刘 龙,张 炜*,陈元涛,刘海彬,张 琪,高中超,雷 蕾
(青海师范大学化学化工学院,青海 西宁 810008)
摘 要:为开发利用苜蓿叶蛋白资源,以紫花苜蓿叶蛋白为原料,利用碱性蛋白酶酶解制备抗氧化肽。在单因素试验基础上,以抗氧化活性为指标,选取酶解时间、碱性蛋白酶用量、酶解温度和pH值为考察因素。采用响应面试验优化,其最佳酶解条件为酶解时间240 min、碱性蛋白酶用量4.80%、酶解温度60 ℃、pH 11.60,在此条件下清除率达到64.25%。用制备色谱纯化并收集抗氧化性最强的抗氧化肽组分,表明纯化后的抗氧化肽具有更强的抗氧化活性。用高效液相色谱测定纯化后抗氧化肽的氨基酸组成,其组成为天冬氨酸(Asp)、甘氨酸(Gly)、组氨酸(His)、酪氨酸(Tyr)、缬氨酸(Val)、亮氨酸(Leu)、苯丙氨酸(Phe)、色氨酸(Trp)和赖氨酸(Lys)。
关键词:苜蓿叶蛋白;酶解条件优化;抗氧化肽纯化;氨基酸组成;清除率;响应面
自由基是生物体新陈代谢过程中产生的一类带有一个或几个不配对电子的分子或原子,其化学性质相当活跃并具有高度的氧化活性[1]。研究发现,氧化作用会引起一系列的生物学反应,导致分子、细胞和组织结构的破坏,造成功能损伤,引起心脏病、癌症和衰老等疾病[2-3]。高活性抗氧化剂的摄入是清除体内过量自由基的一种有效方法。抗氧化剂按其来源不同可分为人工合成抗氧化剂与天然抗氧化剂2 种,但人工合成抗氧化剂因其明显的毒副作用和安全性问题而受到使用限制[4-5],因此寻找高抗氧化活性的天然成分已成为功能食品领域的研究热点,抗氧化肽为其典型代表。
抗氧化肽是生物活性肽的一种,具有抑制、延缓脂质氧化,保护人体组织器官免受自由基侵害的作用。它除自身具有营养功能特性外,还具有高安全性、强抗氧化性和易被吸收等特点[6-7],因此在食品、制药和化妆品等行业中具有极大的潜在利用价值[8]。目前,抗氧化肽主要是通过酶法、发酵法等手段从天然动植物蛋白质中获得,且已从大豆蛋白、小麦胚芽蛋白、玉米蛋白、花生蛋白、菜籽蛋白等[9]原料中制备出了抗氧化肽。
紫花苜蓿(Medicago sativa L.)为豆科苜蓿属多年生草本植物,具有产草量高、抗逆性强等特点,素以“牧草之王”著称[10],我国种植面积居世界第5位。 紫花苜蓿叶含有32%~65%的粗蛋白和40%~40.6%的人体必需氨基酸[11],蛋白质含量丰富、氨基酸种类齐全,营养价值高于大豆、花生饼,非常符合联合国粮农组织/世界卫生组织的规定标准[12-13],更重要的是紫花苜蓿叶蛋白还含有丰富的抗氧化活性成分[14-15],是制取抗氧化肽的理想材料。
目前,国内外对苜蓿叶蛋白的研究与开发主要停留在提取和营养源水平上,对其抗氧化肽制备及纯化分析的研究报道却很少,且谢正军等[16]研究发现碱性蛋白酶更适合紫花苜蓿叶蛋白抗氧化肽的水解制备,因此,本研究以紫花苜蓿叶蛋白为原料,采用碱性蛋白酶酶解紫花苜蓿叶蛋白制备抗氧化肽,以1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为指标,在单因素试验的基础上,通过响应面法对酶解条件进行优化,制备色谱纯化以获得抗氧化活性较高的抗氧化肽,并对抗氧化肽的成分进行分析。为紫花苜蓿叶蛋白资源的开发利用和精深加工提供实验依据和技术参考。
1.1 材料与试剂
紫花苜蓿叶蛋白粉由本实验室泡沫分离提纯制备[17];碱性蛋白酶(100 000 U/g) 江苏锐阳生物科技有限公司;DPPH(分析纯) 上海源叶生物科技有限公司;无水乙醇、氯化钠、氢氧化钠、盐酸、三氯乙酸等(均为分析纯) 天津市凯信化学工业有限公司。
1.2 仪器与设备
PB-10(数显)pH计 赛多利斯科学仪器(北京)有限公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;制备色谱(DAC-HB50动态压缩柱) 江苏汉邦科技有限公司;20AT高效液相色谱仪(配二极管阵列检测器、Inertsustain C18(50 mm×4.6 mm,5 μm)) 日本岛津公司。
1.3 方法
1.3.1 紫花苜蓿叶蛋白抗氧化肽的制备
将紫花苜蓿叶蛋白粉配制成质量分数为20%的反应体系,在温度为50 ℃水浴中预热处理30 min。处理后调节至实验设定的酶解温度和酶解pH值。随着酶解反应的进行,酶解液的pH值逐渐下降,滴加0.5 mol/L NaOH溶液保持pH值不变,到达实验设定酶解时间后,将酶解液放入95 ℃沸水中保持5 min灭酶活性,取出冷却。
1.3.2 DPPH自由基清除率的测定
各取4.0 mL酶解液,依次加入4.0 mL质量分数为16%的三氯乙酸溶液离心分离10 min,各取1.0 mL上清液加蒸馏水定容到100.0 mL,取上述溶液4.0 mL依次与1.0 mL质量浓度为0.025 g/L的DPPH无水乙醇溶液室温避光反应20 min,在517 nm波长处测吸光度。另取5.0 mL待测样品避光反应20 min,在517 nm波长处测吸光度;以1.0 mL 0.025 g/L DPPH无水乙醇溶液和4.0 mL蒸馏水反应作为参比,按式(1)计算待测样品的DPPH自由基清除率[18-19]:
式中:AX为样品加DPPH无水乙醇溶液的吸光度;AX0为样品本底吸光度;A0为蒸馏水加DPPH无水乙醇溶液的吸光度。
1.3.3 紫花苜蓿叶蛋白抗氧化肽制备的单因素试验
以酶解时间240 min、酶解温度55 ℃、酶解pH 12.0、碱性蛋白酶用量4%为基本条件,固定其他条件不变,设置酶解温度35、40、45、50、55、60 ℃;酶解时间20、40、60、90、120、150、180、210、240 min;碱性蛋白酶用量1%、2%、3%、4%、5%、6%;酶解pH 8.0、9.0、10.0、11.0、12.0、13.0。以DPPH自由基清除率为指标进行优选试验。
1.3.4 紫花苜蓿叶蛋白抗氧化肽制备响应面试验
利用响应面软件Design-Expert 8.0.6,根据Box-Behnken试验设计原理,在单因素试验基础上,以DPPH自由基清除率为响应值,选择单因素较优因素及水平进行响应面试验设计,探究紫花苜蓿叶蛋白抗氧化肽制备的最佳工艺条件组合,因素与水平设计如表1所示。
表1 响应面试验因素与水平
Table 1 Factors and their levels used in response surface analysis
1.3.5 多肽含量的测定
在苜蓿叶蛋白酶解液中加入等体积的16%三氯乙酸溶液,在35 ℃的水浴中反应5 min,然后在高速离心机上离心30 min,取上清液作为待测样,取1.00 mL的样品,每个试管中加入碱性铜试剂1.00 mL,混匀,在35 ℃的水浴中反应5 min,冷却至常温,再迅速加入Folin-酚试剂4.00 mL,混匀,在55 ℃水浴中反应10 min,冷却至常温,以1.00 mL蒸馏水+1.00 mL碱性铜试剂+ 4.00 mL Folin-酚试剂的反应液为空白,在762 nm波长处测定吸光度,以此表示多肽含量。
1.3.6 水解度的测定
取待测液1.00 mL,加入5.00 mL的考马斯亮蓝溶液,混匀后,常温放置5 min,然后在595 nm波长处进行吸光度测定,空白组以等体积的蒸馏水替待测液。按式(2)计算苜蓿叶蛋白的水解度[20]:
式中:AX为蛋白质溶液水解前的吸光度;A0为蛋白质溶液水解后的吸光度。
1.3.7 抗氧化肽的纯化[21-22]
将苜蓿叶蛋白酶解液加入等体积16%的三氯乙酸溶液,在35 ℃的水浴中反应5 min,然后在高速离心机上离心30 min,取上清液,用0.45 μm的TPEF滤膜过滤,将过滤液取2.5 mL注入制备色谱中分离纯化。
制备色谱条件:色谱柱:C18(250 nm×12 mm, 10 μm);流动相:V(0.1%三氟乙酸)∶V(乙腈)= 80∶20,等度洗脱;流速10.0 mL/min;柱温25 ℃;进样量2.5 mL;检测波长214 nm。
1.3.8 多肽的水解
取10 mL样品加入到20 mL的酸解液(V(三氟乙酸)∶V(6 mol/L HCl)=1∶2),在酸液中加入0.2%的苯酚)中[20,23],放入水解瓶中,充入氮气,密封,放入160 ℃水解60 min。打开水解瓶,用0.1 mol/L的盐酸定容到10.00 mL。
1.3.9 氨基酸组成分析
氨基酸的柱前衍生:分别准确移取标准品溶液、多肽水解液和水各200 μL,0.1 mol/L的异硫氰酸苯酯的乙腈溶液100 μL,1 mol/L的三乙胺的乙腈溶液100 μL,混匀,室温放置30 min,加入正己烷400 μL,充分振摇混匀后,静置10 min,吸取下层溶液,用0.45 μm滤膜滤过,即得标准品、多肽水解液和空白的衍生化溶液[23]。
分析色谱条件:色谱柱:C18(250 nm×4.6mm, 5 μm);流动相:A相0.1 mol/L的乙酸钠(pH值调至6.5)-乙腈(97∶3,V/V),B相乙腈-水(4∶1,V/V);流速1.0 mL/min;柱温40 ℃;进样量20 μL;检测波长254 nm。进行梯度洗脱[20],梯度洗脱见表2。
表2 液相色谱梯度洗脱
Table 2 Gradient elution program for LC analysis

2.1 水解度、多肽含量与DPPH自由基清除率的关系

图1 清除率与酶解时间的关系图
Fig. 1 Effect of hydrolysis time on DPPH scavenging activity of hydrolysates

图2 多肽含量与酶解时间的关系
Fig. 2 Effect of hydrolysis time on polypeptide content of hydrolysates
从图1可以看出,清除率随酶解时间的延长而增大,在240 min时达到最大值,从图2可以看出,多肽含量也随酶解时间延长而逐渐增大,在120 min时达到最大值,由图1及图2能看出,多肽含量和清除率不完全呈正比,这是因为绝大部分具有生理活性的多肽主要是一些分子质量较小的肽段[24],因此不能以多肽含量的大小来衡量紫花苜蓿叶蛋白多肽的抗氧化性。
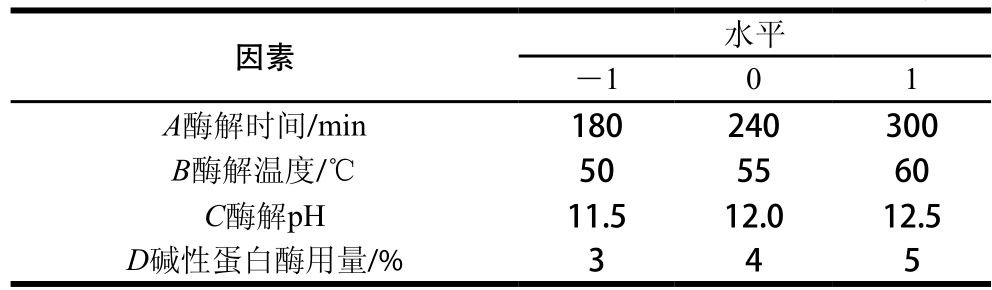
图3显示,水解度随酶解时间延长逐渐增大,在240 min达到最大值后无明显变化。对比图1说明水解度与自由基清除能力之间并不存在线性关系,这是因为制备抗氧化肽的目的是尽可能多地获得功能性多肽,而水解度过大可能会产生过多不具抗氧化性的游离氨基酸和寡肽,抗氧化多肽含量下降[25-26]。
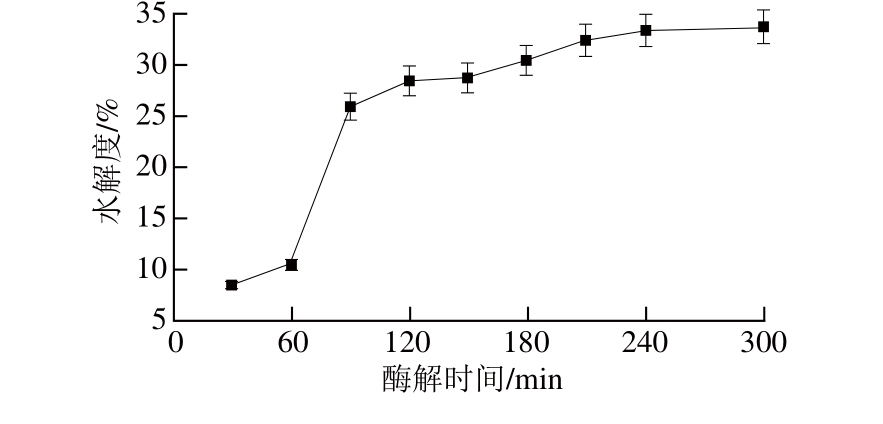
图3 水解度与酶解时间的关系
Fig. 3 Relationship between degree of hydrolysis and hydrolysis time
2.2 单因素试验结果
2.2.1 酶解时间的影响
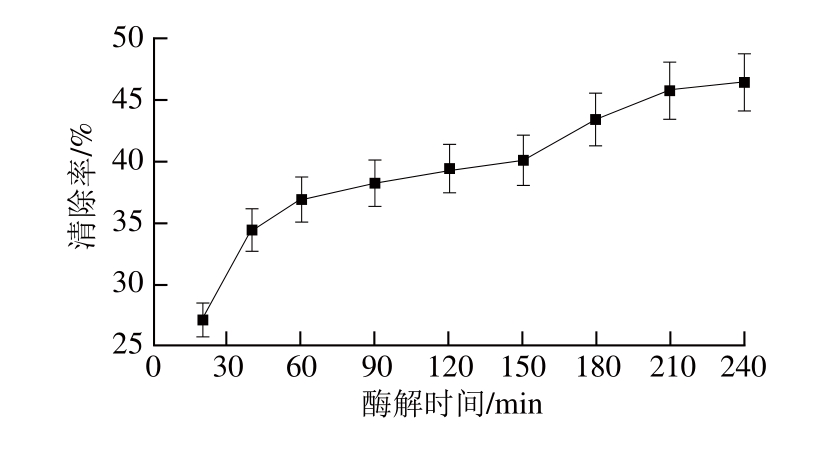
图4 酶解时间对紫花苜蓿叶蛋白抗氧化肽制备的影响
Fig. 4 Effect of hydrolysis time on DPPH scavenging activity of hydrolysates
由图4可以看出,随着酶解时间的延长,清除率逐渐增大,但上升速率逐渐趋缓。这是因为酶解反应之初酶解程度较低肽链过长,具有抗氧化活性的氨基酸残基不能暴露出来,显示不出抗氧化活性。随着反应进行,当酶解到一定程度后,紫花苜蓿叶蛋白大部分已经酶解,氨基酸残基完全暴露[27]。这时抗氧化能力随时间变化趋于稳定,再延长反应时间也不能达到更好的酶解效果,因此选用酶解时间240 min作为下一步研究条件。
2.2.2 酶解温度的影响
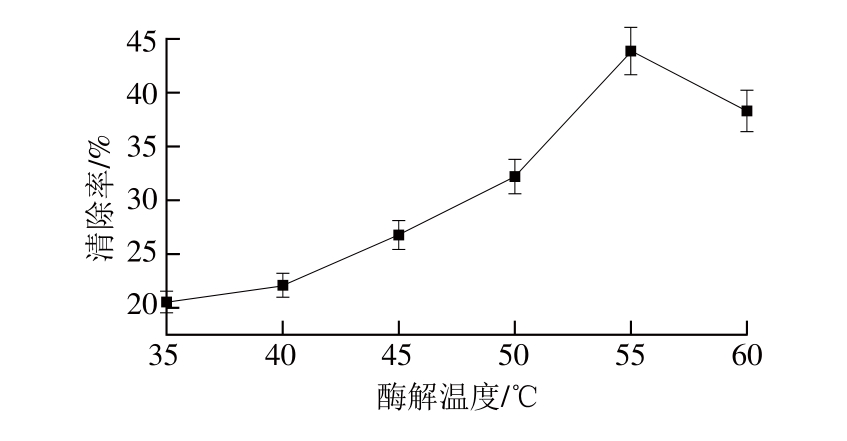
图5 酶解温度对紫花苜蓿叶蛋白抗氧化肽制备的影响
Fig. 5 Effect of hydrolysis temperature on DPPH scavenging activity of hydrolysates
由图5可以看出,清除率先随酶解温度的升高而增大,达到最大值后,清除率随温度的升高而减小。这是因为酶解反应之初温度较低,随着温度的升高,反应速率加快,清除率逐渐增大。但温度升高到一定程度后,酶蛋白会逐渐变性而失活,引起酶反应速率下降,导致清除率下降,因此选用温度55 ℃作为下一步研究条件。
2.2.3 碱性蛋白酶用量的影响

图6 碱性蛋白酶用量对紫花苜蓿叶蛋白抗氧化肽制备的影响
Fig. 6 Effect of alkaline protease concentration on DPPH scavenging activity of hydrolysates
由图6可以看出,清除率随碱性蛋白酶用量的增大而增大,但上升速率逐渐趋缓,这是因为在一定底物用量条件下,酶量较低时,清除率随酶解速率上升明显。随着加酶量的逐渐加大,反应体系中酶的用量升高,碱性蛋白酶可能被饱和,导致尽管酶量成倍增加,清除率却仅有少许的上升[28],因此选用碱性蛋白酶用量4%作为下一步研究条件。
2.2.4 酶解pH值对紫花苜蓿叶蛋白抗氧化肽制备的影响
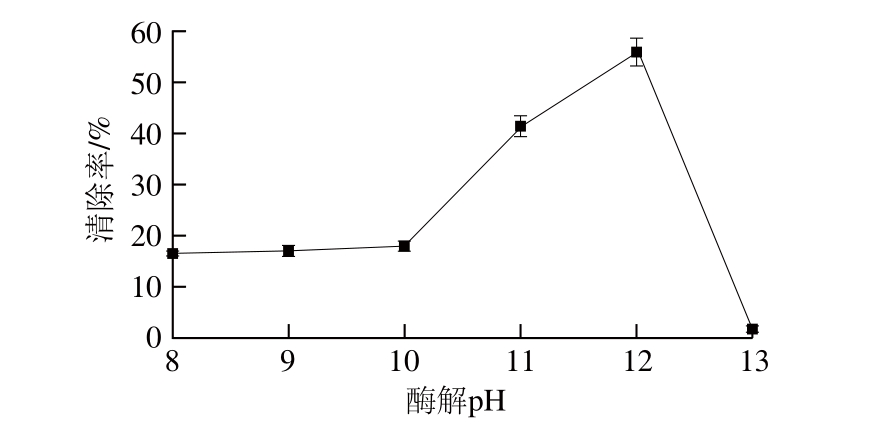
图7 酶解pH值对紫花苜蓿叶蛋白抗氧化肽制备的影响
Fig. 7 Effect of pH on DPPH scavenging activity of hydrolysates
由图7可以看出,清除率随pH值升高而增大,达到最大值后开始减小,这是因为在pH值较小时,酶活性被抑制,清除率小。随着pH值的逐渐增大,逐渐接近酶的最适pH值范围,当反应体系pH值达到12.0时清除率最大,这是因为酶的催化作用只有在特定的pH值条件下,才能保持最大催化活性的酶构象[29],因此选用pH 12.0作为下一步研究条件。
2.3 响应面试验结果
2.3.1 响应面试验设计与结果
进行四因素三水平试验设计,共29 个试验,试验设计及结果如3表所示。
表3 苜蓿叶蛋白水解的响应面试验设计与结果
Table 3 Response surface design with experimental results

运用Design-Expert软件进行拟合,苜蓿叶蛋白酶解液清除率的响应值经回归拟合后,得到的最优方程为:清除率/%=0.51+0.024A+0.10B-0.18C-003D-0.024AB-0.066AC-0.091BC-0.038B2-0.30C2+ 0.023D2。对该回归模型进行差异显著性检验及方差分析,其结果如表4所示。
表4 响应面试验方差分析
Table 4 Analysis of variance of quadratic polynomial equation
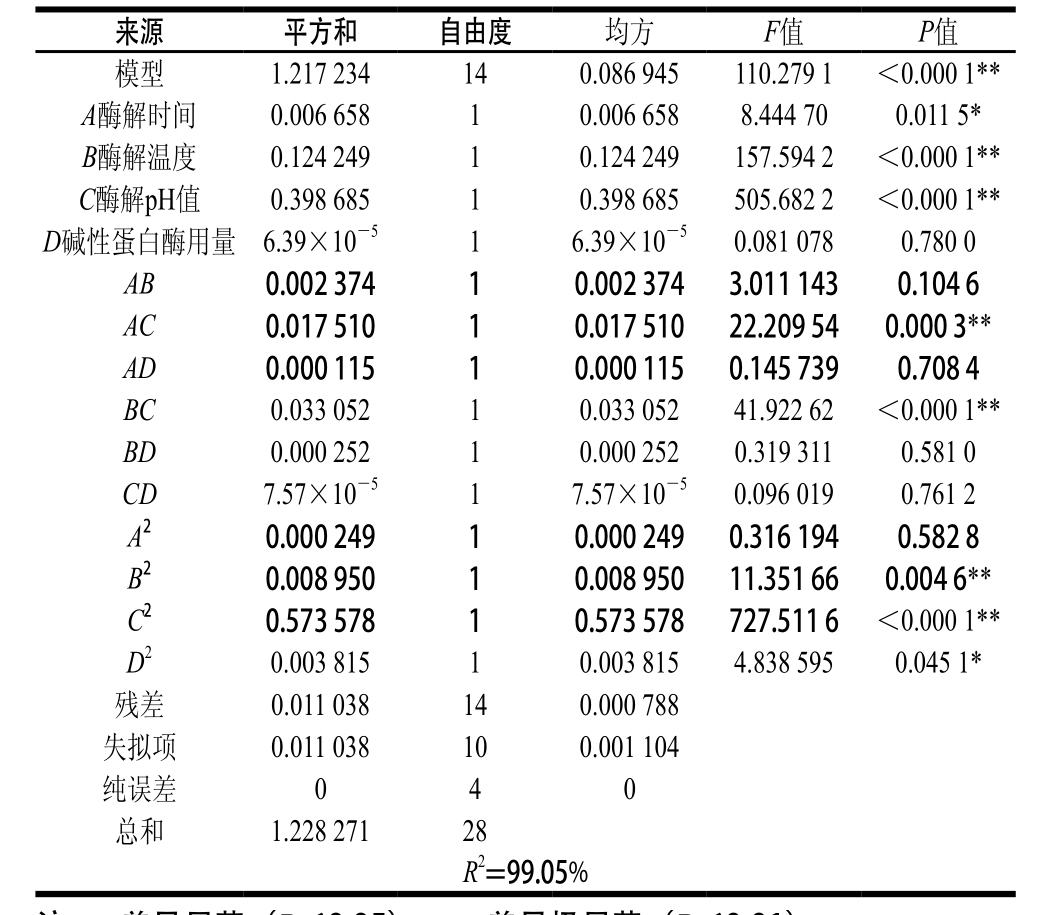
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
由表4可知,模型P值小于0.000 1,说明所建立的模型极显著。其因变量和全体自变量之间的线性关系显著(R2=99.05%),说明响应值的变化有99.05%来源于所选变量,即所选的4 个因素基本上决定了苜蓿蛋白水解效率。因此,该回归方程对试验拟合情况较好,可以较好地描述各因素与响应值之间的真实关系。A、B、C、AC、BC、B2、C2和D2项的影响显著;F值越大,因素对响应值的影响越大,影响因素的顺序:酶解pH值>酶解温度>酶解时间>碱性蛋白酶用量。
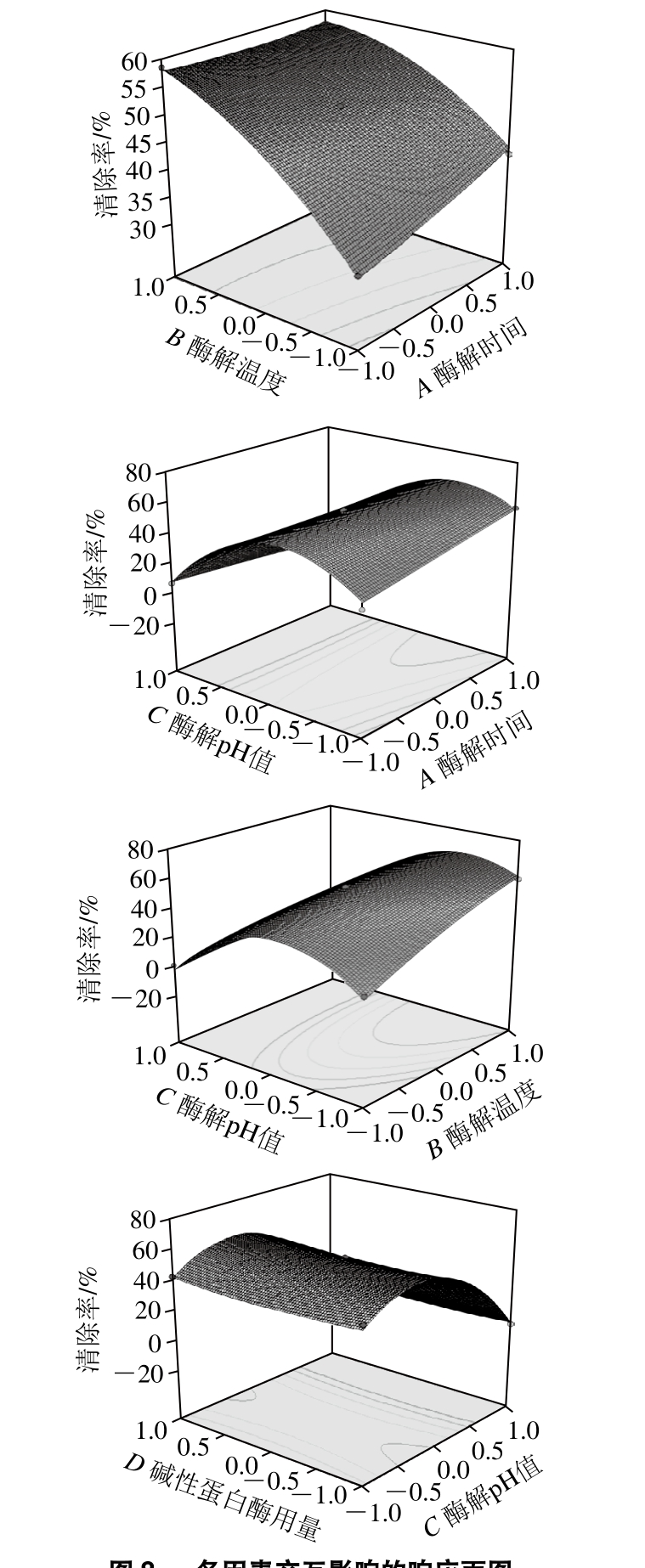
图8 各因素交互影响的响应面图
Fig. 8 Response surface plots showing the effects of various factors on DPPH scavenging activity of hydrolysates
选择4 个交互作用的响应面作为代表,如图8所示,随着酶解温度和酶解时间水平的增加,酶解多肽对DPPH自由基的清除率逐渐增加,且酶解温度的影响明显强于酶解时间的影响;随着酶解pH值水平的增加,酶解多肽对DPPH自由基的清除率先增加后降低;随着碱性蛋白酶用量的增加,酶解多肽对DPPH自由基的清除率基本不变,这是由于酶解温度、酶解时间和酶解pH值对DPPH自由基清除率的影响明显强于碱性蛋白酶用量(3%~5%)的影响[30]。因素影响作用的大小与方差分析的结论一致。
2.3.2 模型验证
为了验证所建立模型的可信度,利用Design-Expert软件,选出紫花苜蓿叶蛋白水解最佳预测优化工艺为酶解时间248 min、酶解温度60 ℃、碱性蛋白酶用量4.85%、酶解pH 11.60,其清除率为65.10%。考虑到实际操作,对选出的优化数据进行相应的调整,其验证工艺为:酶解时间240 min、酶解温度60 ℃、碱性蛋白酶用量4.80%、酶解pH 11.60。在此条件下,清除率为64.25%,与模型预测清除率基本相符,说明模型符合紫花苜蓿叶蛋白的水解工艺。
2.4 抗氧化肽的纯化
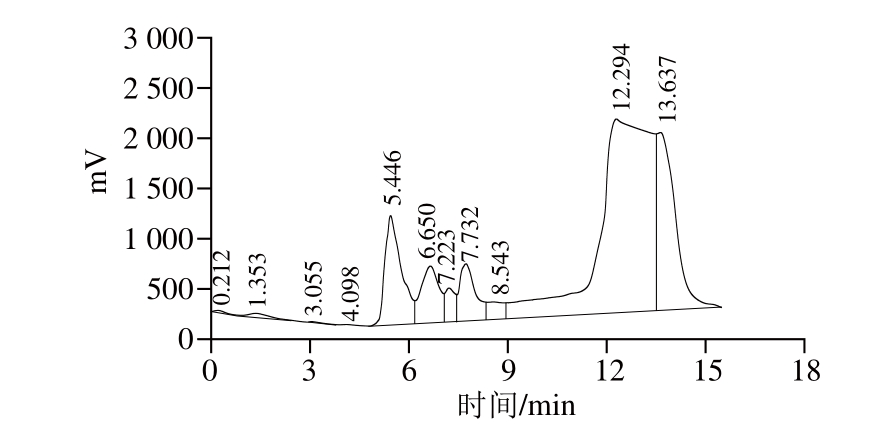
图9 制备色谱纯化高效液相色谱图
Fig. 9 Chromatogram of antioxidant peptide purified by preparative HPLC
将苜蓿叶蛋白酶解液按照1.3.8节中的方法进行分离纯化,如图9所示,收集各个峰的流动相,将各个峰收集的流动相进行多肽含量和对DPPH自由基清除率进行比较,发现最后的一个峰(保留时间12~15 min)的抗氧化性最强。取相同体积最后一个峰收集的流动相和苜蓿蛋白酶解液,然后分别进行多肽含量和DPPH自由基清除率测定,其中流动相多肽的吸光度和苜蓿叶蛋白酶解液的吸光度分别为0.024和0.253,清除率分别为40.43%、43.52%,在清除率基本一样的情况下,流动相多肽的吸光度(即含量)更小,所以制备色谱纯化后的抗氧化肽具有更强的抗氧化能力。
2.5 抗氧化肽氨基酸成分分析
将制备色谱纯化好的抗氧化肽按照1.3.8节方法进行水解。将水解得到的氨基酸和氨基酸标准品分别进行柱前衍生,按照1.3.9节分析色谱条件进行梯度洗脱,用高效液相色谱测定抗氧化肽的氨基酸组成。
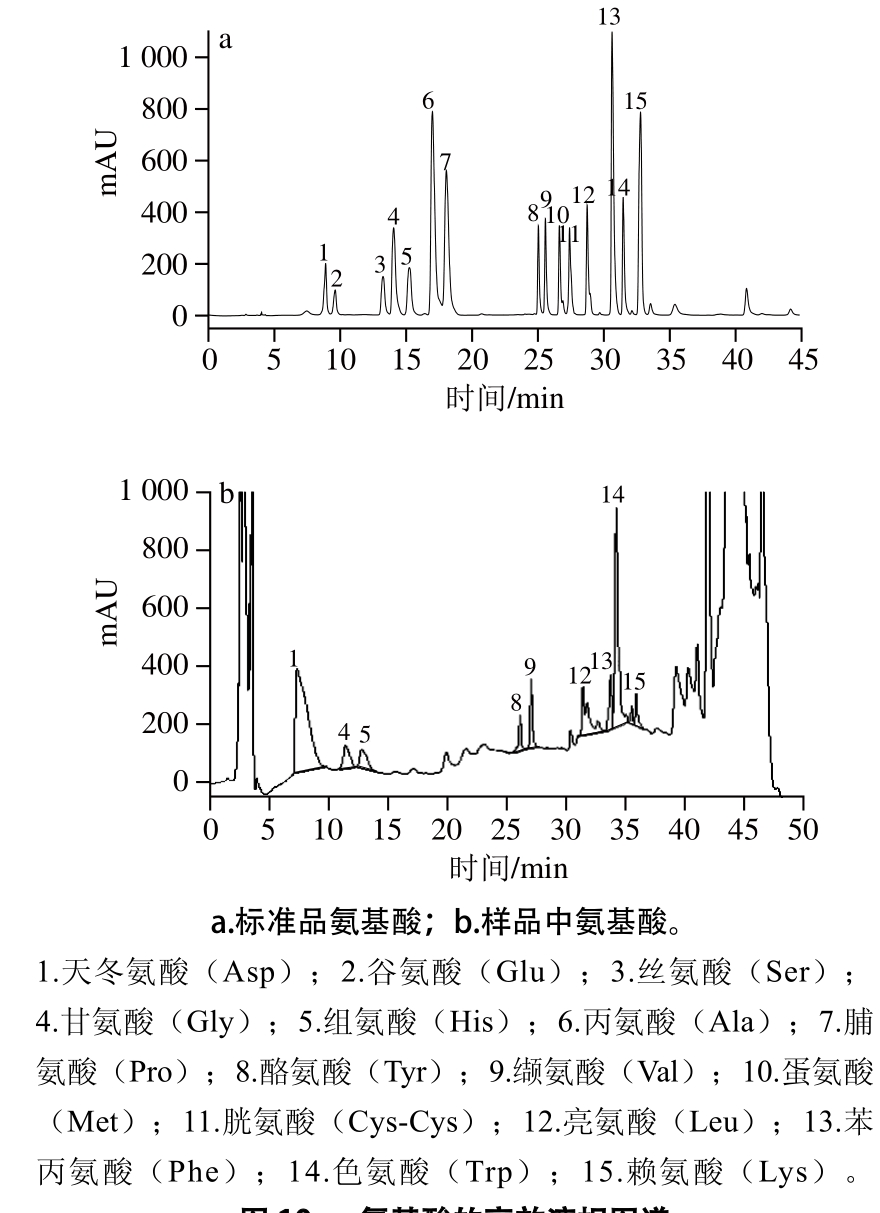
图10 氨基酸的高效液相图谱
Fig. 10 High performance liquid chromatogram of amino acids
由图10可以看出,抗氧化肽组成中含有的氨基酸有天冬氨酸(Asp)、甘氨酸(Gly)、组氨酸(His)、酪氨酸(Tyr)、缬氨酸(Val)、亮氨酸(Leu)、苯丙氨酸(Phe)、色氨酸(Trp)和赖氨酸(Lys)。
通过响应面优化苜蓿叶蛋白水解的工艺,其最优工艺为酶解时间240 min、碱性蛋白酶用量4.80%、酶解温度60 ℃、pH 11.60,在此条件下清除率达到64.25%。对比制备色谱纯化前后的抗氧化肽对DPPH自由基的清除能力,发现纯化后的抗氧化肽具有更强的抗氧化能力。此外,用高效液相色谱测定了纯化后具有高抗氧化活性肽的氨基酸组成,为紫花苜蓿叶蛋白资源的开发利用和精深加工提供实验依据和技术参考。
参考文献:
[1] YING L, HUANG L, TIAN G. An improved method for the quantitative determination of uronic acid[J]. Chinese Traditional & Herbal Drugs, 1999, 30(11): 817-819. DOI:10.7501/ j.issn.0253-2670.1999.11.007.
[2] 张吴, 任发政. 天然抗氧化肽的研究进展[J]. 食品科学, 2008, 29(4): 443-447. DOI:10.3321/j.issn:1002-6630.2008.04.100.
[3] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956. DOI:10.1016/j.peptides.2010.06.020.
[4] ZHANG T, LI Y, MIAO M, et al. Purification and characterisation of a new antioxidant peptide from chickpea (Cicer arietium L.) protein hydrolysates[J]. Food Chemistry, 2011, 128(1): 28-33. DOI:10.1016/ j.foodchem.2011.02.072.
[5] 陈宁, 孙一, 刘淑莹. 核桃蛋白酶解物的制备及抗氧化活性[J]. 高等学校化学学报, 2013, 34(1): 72-76. DOI:10.7503/cjcu20120277.
[6] 李京京, 孙文佳, 闵伟红. 长白山榛子抗氧化肽制备及其活性研究[J]. 食品研究与开发, 2016, 37(10): 1-5. DOI:10.3969/ j.issn.1005-6521.2016.10.001.
[7] 吴定, 孙嘉文, 黄卉卉, 等. 固定化碱性蛋白酶制备麦胚抗氧化肽条件优化[J]. 中国粮油学报, 2016, 31(7): 114-119. DOI:10.3969/ j.issn.1003-0174.2016.07.021.
[8] ANTOLOVICH M, PRENZLER P D, PATSALIDES E, et al. Methods for testing antioxidant activity[J]. Analyst, 2002, 127(1): 183-198. DOI:10.1039/b009171p.
[9] 张海涛, 祝其锋, 莫丽儿, 等. H2O2对HL-60细胞DNA中8-羟基鸟嘌呤含量影响的研究[J]. 癌变·畸变·突变, 2000, 12(1): 12. DOI:10.3969/j.issn.1004-616X.2000.01.004.
[10] 顾有方, 陈会良, 刘德义, 等. 自由基的生理和病理作用[J]. 动物医学进展, 2005, 26(1): 94-97. DOI:10.3969/ j.issn.1007-5038.2005.01.029.
[11] 曲敏, 杨大鹏, 梁金钟, 等. 嗜酸乳杆菌发酵制备苜蓿叶蛋白的研究[J].食品科学, 2011, 32(19): 152-156.
[12] HIRANO R, SASAMOTO W, MATSUMOTO A, et al. Antioxidant ability of various flavonoids against DPPH radicals and LDL oxidation[J]. Journal of Nutritional Science & Vitaminology, 2001, 47(5): 357-362. DOI:10.3177/jnsv.47.357.
[13] FASAKIN E A. Nutrient quality of leaf protein concentrates produced from water fern (Azolla africana, Desv) and duckweed (Spirodela polyrrhiza, L. Schleiden)[J]. Bioresource Technology, 1999, 69(2): 185-187. DOI:10.1016/S0960-8524(98)00123-0.
[14] 唐丽, 鲁燕舞, 崔瑾. 光质对苜蓿芽苗菜营养品质和抗氧化特性的影响[J]. 食品科学, 2014, 35(13): 32-36. DOI:10.7506/spkx1002-6630-201413006.
[15] 王静, 冯娜娜, 王丹, 等. UV-B辐射对紫花苜蓿幼苗品质和抗氧化性的影响[J]. 食品科技, 2016, 41(6): 56-60. DOI:10.13684/j.cnki. spkj.2016.06.014.
[16] 谢正军, 金征宇. 苜蓿叶蛋白抗氧化肽水解用酶的筛选研究[J]. 食品科学, 2007, 28(7): 342-346. DOI:10.3321/j.issn:1002-6630.2007.07.080. g/10.317.7/jnsv.47.357.
[17] LIU H, ZHANG W, CHEN Y, et al. Technology optimization of Medicago sativa leaf protein separation with foam fractionation[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016. DOI:10.11975/j.issn.1002-6819.2016.09.038.
[18] 赵东升, 马晓丽, 李新霞, 等. 柱前衍生-高效液相色谱法同时测定可食药用葱属植物中18 种游离氨基酸含量[J]. 药物分析杂志, 2013(6): 963-968. DOI:10.16155/j.0254-1793.2013.06.006.
[19] 秦垂新, 姚松君, 唐青涛, 等. 抗氧化肽及其化学活性测定方法的研究概述[J]. 食品工业科技, 2014, 35(1): 394-400. DOI:10.13386/ j.issn1002-0306.2014.01.050.
[20] 田洪斌, 赵可意, 孙佳玲. 氨基酸分析法测定复方骨肽注射液中多肽含量[J]. 中国药事, 2011, 25(8): 816-820. DOI:10.16153/j.1002-7777.2011.08.018.
[21] 耿娟, 王艳玲, 陈丽颖, 等. 反相液相色谱在多肽及蛋白质分离分析中的应用[J]. 广东农业科学, 2006(12): 133-135. DOI:10.16768/ j.issn.1004-874x.2006.12.048.
[22] 朱晓囡, 苏志国. 反相液相色谱在蛋白质及多肽分离分析中的应用[J]. 分析化学, 2004, 32(2): 248-254. DOI:10.3321/ j.issn:0253-3820.2004.02.030.
[23] 吕艳, 冯凤琴. 反相高效液相色谱定量分析多肽中的氨基酸组成[J]. 浙江农业科学, 2006(2): 211-214. DOI:10.16178/ j.issn.0528-9017.2006.02.040.
[24] 马井喜, 孙永杰, 冯印, 等. 鲤鱼肽的酶法制备工艺及其抗氧化性[J].食品科学, 2013, 34(1): 225-229.
[25] 黄明, 王璐莎. 动物蛋白源抗氧化肽的研究进展[J]. 中国农业科学, 2013, 46(22): 4763-4773. DOI:10.3864/j.issn.0578-1752.2013.22.014.
[26] 李俐桦, 殷钟意, 郑旭煦. 糯米糠抗氧化肽的制备工艺及自由基清除能力研究[J]. 食品工业科技, 2015, 36(4): 251-254. DOI:10.13386/ j.issn1002-0306.2015.04.046.
[27] 刘英丽, 张慧娟, 王静, 等. 酶解花生粕制备抗氧化肽工艺研究[J].中国食品学报, 2014, 14(8): 62-68. DOI:10.16429/j.1009-7848.2014.08.008.
[28] 范三红, 胡雅喃, 何亚. 响应面法优化菊芋渣酶解制备抗氧化肽工艺[J]. 食品科学, 2015, 36(8): 49-53. DOI:10.7506/spkx1002-6630-201508009.
[29] 付刚, 李诚, 马长中, 等. 猪骨抗氧化肽的酶解制备研究[J].现代食品科技, 2006, 22(3): 136-138. DOI:10.13982/ j.mfst.1673-9078.2006.03.045.
[30] LI X L, WEI Z, CHEN Y T, et al. Optimization of a foam separation process for acid fraction gum from flax seeds by response surface methodology[J]. Separation Science & Technology, 2015, 50(12): 1906-1913. DOI:10.1080/01496395.2015.1014055.
Optimization of Enzymatic Hydrolysis Conditions for the Preparation of Antioxidant Peptides and Amino Acid Composition Analysis from Alfalfa Leaf Protein
LIU Long, ZHANG Wei*, CHEN Yuantao, LIU Haibin, ZHANG Qi, GAO Zhongchao, LEI Lei
(School of Chemistry and Chemical Engineering, Qinghai Normal University, Xining 810008, China)
Abstract:In order to develop and utilize alfalfa leaves as a good resource of protein, antioxidant peptides were prepared from alfalfa leaf protein by alkaline protease hydrolysis. Through one-factors-at-a-time experiments, hydrolysis time, enzyme concentration, hydrolysis temperature and pH were selected as independent variables for further optimization using response surface methodology, and the response variable was antioxidant activity. The optimum conditions that provided the maximum percentage scavenging of DPPH radical of 64.25% were found to be hydrolysis time of 240 minutes, enzyme concentration of 4.80%, hydrolysis temperature of 60 ℃ and pH of 11.60. Then the most potent antioxidant peptide was purified and collected by preparative liquid chromatography, having stronger antioxidant activity than the crude hydrolysate. The amino acid composition of the antioxidant peptide was determined by high performance chromatography (HPLC) to consist of Asp, Gly, His, Tyr, Val, Leu, Phe, Trp and Lys.
Key words:alfalfa leaf protein; optimization of enzymatic hydrolysis conditions; antioxidant peptide purification; amino acid composition; percentage scavenging; response surface methodology
DOI:10.7506/spkx1002-6630-201714041
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)14-0263-07
引文格式:刘龙, 张炜, 陈元涛, 等. 紫花苜蓿叶蛋白制备抗氧化肽酶解条件优化及氨基酸组成分析[J]. 食品科学, 2017, 38(14): 263-269.
DOI:10.7506/spkx1002-6630-201714041. http://www.spkx.net.cn
LIU Long, ZHANG Wei, CHEN Yuantao, et al. Optimization of enzymatic hydrolysis conditions for the preparation of antioxidant peptides and amino acid composition analysis from alfalfa leaf protein[J]. Food Science, 2017, 38(14): 263-269. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714041. http://www.spkx.net.cn
收稿日期:2017-04-14
基金项目:青海省基础研究计划项目(2017-ZJ-712)
作者简介:刘龙(1989—),男,硕士研究生,研究方向为天然产物分离与提取。E-mail:906297945@qq.com
*通信作者:张炜(1972—),女,教授,硕士,研究方向为天然产物分离与提取。E-mail:zhangwei@qhnu.edu.cn