表1 4 种镰刀菌毒素的质谱参数
Table 1 Instrumental settings for analysis of the four Fusarium toxins

注:*.定量离子。
张家宁,丁 轲*,韩 涛,陈湘宁
(北京农学院食品科学与工程学院,食品质量与安全北京实验室,农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206)
摘 要:比较MycoSep☒226多功能净化柱、DZT MS-PREP免疫亲和柱和实验室制备聚苯乙烯-二乙烯苯树脂免疫亲和柱在检测小麦粉中4 种镰刀菌毒素(玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、T-2毒素、HT-2毒素)过程中的前处理效果。选择MycoSep☒226多功能净化柱、DZT MS-PREP免疫亲和柱和实验室制备聚苯乙烯-二乙烯苯树脂免疫亲和柱,通过不同的提取和前处理方法,以及建立高效液相色谱-串联质谱检测法,对小麦粉中的4 种镰刀菌毒素进行测定。DZT MS-PREP免疫亲和柱处理小麦粉样品所得的回收率为88.01%~107.31%,相对标准偏差为1.09%~14.42%;聚苯乙烯-二乙烯苯树脂免疫亲和柱的回收率为70.05%~112.80%,相对标准偏差为3.42%~12.25%;MycoSep☒226多功能净化柱的回收率为69.42%~111.12%,相对标准偏差为1.46%~13.24%。免疫亲和柱具有重复利用,有机溶剂耗用量少、特异性强等显著优势,且聚苯乙烯-二乙烯苯树脂免疫亲和柱为新载体免疫亲和柱的制备提供了依据。
关键词:镰刀菌毒素;高效液相色谱-串联质谱;MycoSep☒226多功能净化柱;聚苯乙烯-二乙烯苯树脂免疫亲和柱;DZT MS-PREP免疫亲和柱
引文格式:张家宁, 丁轲, 韩涛, 等. 不同净化柱处理对小麦粉中4 种镰刀菌毒素的净化效果[J]. 食品科学, 2017, 38(14): 316-322.
DOI:10.7506/spkx1002-6630-201714049. http://www.spkx.net.cn
ZHANG Jianing, DING Ke, HAN Tao, et al. Purification efficiency of four Fusarium toxins from wheat flour with different purification columns[J]. Food Science, 2017, 38(14): 316-322. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714049. http://www.spkx.net.cn
镰刀菌毒素是镰刀菌属真菌产生的多种次级代谢产物的总称[1],广泛存在于各种粮食作物(如小麦、玉米等)及其加工制品中,多见于潮湿环境中储藏的发霉粮食中[2]。其中,脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、玉米赤霉烯酮(zearalenone,ZEN)、T-2毒素和HT-2毒素等[3-7]4 类真菌毒素是造成小麦粉污染的主要真菌毒素。对于镰刀菌毒素的检测方法主要有气相色谱法[8-9]、气相色谱-质谱联用法[10]、高效液相色谱法[11-12]和液相色谱-质谱联用法[13-14]。考虑到小麦粉基质的复杂性及镰刀菌毒素在样品中含量较低的特点,以上这些检测方法[15-16]通常会结合一种前处理方法,如固相萃取(solid phase extraction,SPE)技术[17-25]。
目前国内外研究中,多功能净化柱和免疫亲和柱在粮食及其制品中镰刀菌毒素的前处理过程中的应用较为广泛[26-31]。对于镰刀菌毒素的前处理,多功能净化柱以MycoSep☒226最常见。免疫亲和柱常用的介质载体包括无机载体、多糖和高分子聚合物[27]。无机载体具有粒度均匀、机械强度高等特点,但适用范围比较窄,且表面的非特异性吸附也使得它在生物活性产品分离、分析中的应用受到限制。多糖类载体生物相容性好、亲水性强,是最常用的吸附与分离载体,且市售已有针对以上4 种镰刀菌毒素的多糖类载体的商品免疫亲和柱。但是多糖类载体价格昂贵、机械强度差,用这类载体填装的层析柱不能耐受高压和高流速。合成的高分子聚合物载体具有好的机械强度和良好的化学稳定性,而且价格相对低廉,是很有前景的层析载体,但作为免疫亲和柱填充介质的研究尚少。
本实验选择MycoSep☒226多功能净化柱、DZT MS-PREP免疫亲和柱和实验室制备聚苯乙烯-二乙烯苯树脂免疫亲和柱,建立不同前处理方式,比较其回收率和柱效等,旨在选择出多种镰刀菌毒素前处理的较优方法,拟为解决快速准确检测食品中多种镰刀菌毒素含量的问题提供方法借鉴,也为有关研究的进一步开展提供参考。
1.1 材料与试剂
从北京、天津、河北、河南、山东、辽宁6 个省市的超市、农贸市场,购买7 种不同品牌不同产地的小麦粉定型包装样品。
DON(CAS 51481-10-8)、ZEN(CAS 17924-92-4)、T-2(CAS 21259-20-1)、HT-2(CAS 26934-87-2)毒素标准品(购自新加坡Pribolab公司),均用甲醇溶解并定容至质量浓度100 μg/mL,作为标准储备液,4 ℃条件下避光保存;10 mmol/L乙酸铵溶液(分析纯);0.01 mol/L pH 7.4磷酸盐缓冲液(phosphate buffer saline,PBS);0.1 mol/L NaAc(pH 4.0,含0.5 mol/L NaCl);0.1 mol/L Tris-HCl(pH 8.0,含0.5 mol/L NaCl);0.01 mol/L PBS(pH 7.4,含0.01% NaN3)。
1.2 仪器与设备
1200-ESI6410液相色谱-质谱联用仪 美国Agilent公司;MycoSep☒226多功能净化柱 新加坡Pribolab公司;DZT MS-PREP免疫亲和柱 德国R-Biopharm公司;BF-2000氮气吹干仪 北京八方世纪有限公司;聚苯乙烯-二乙烯苯树脂免疫亲和柱由农产品有害微生物及农残安全检测与控制北京市重点实验室制备;SUPER SERIES超纯水系统 美国Aquapro公司。
1.3 方法
1.3.1 聚苯乙烯-二乙烯苯树脂免疫亲和柱的制备
1.3.1.1 硝基聚苯乙烯-二乙烯苯微球的制备
配制10 g/100 mL的聚苯乙烯-二乙烯苯微球乳液,50 ℃水浴中高速搅拌下,加入比例为3∶2的硫酸与硝酸的混合,反应2 h。将反应混合物注入去离子水中,过滤,去离子水洗涤至滤除产物的pH值呈中性,37 ℃真空干燥24 h,得到淡黄色粉末。
1.3.1.2 氨基聚苯乙烯-二乙烯苯微球的制备
取3.0 g硝基聚苯乙烯-二乙烯苯微球于烧瓶中,75 ℃水浴中高速搅拌,加入2 mol/L KOH溶液180 mL和12 g还原剂Na2S2O4,反应4 h。将反应混合物过滤,去离子水洗涤至中性,37 ℃真空干燥24 h,得到黄色粉末。
1.3.1.3 氨基聚苯乙烯-二乙烯苯微球的活化
取3.0 g氨基化聚苯乙烯-二乙烯苯微球,用8 mL pH 7.0 的 PBS分散,超声30 min。加入32 mL 25%戊二醛溶液,在29 ℃的振荡水浴锅中振荡反应(200 r/min)3 h,停止活化。用pH 5.0 的0.2 mol/L的PBS清洗3 遍,最终将活化后的树脂材料溶解在5 mL,pH 5.0的此PBS中,得到0.3 g/mL的树脂溶液。
1.3.1.4 氨基聚苯乙烯-二乙烯苯微球偶联抗体
取DON抗体1.25 mg,T-2/HT-2抗体0.2 mg,ZEA抗体0.3 mg,将上述抗体加入50% PBS-甘油溶液(PBS、甘油各250 μL),再取上述活化过的树脂材料1 mL(约0.3 g),将两者混合,25 ℃的振荡水浴锅中振荡反应12 h。离心取上清液用考马斯亮蓝法计算偶联率。将混合溶液装入2.5 mL的SPE空柱管,制成免疫亲和柱。
1.3.2 样品前处理
MycoSep☒226多功能净化柱:称取小麦粉样品25.0 g (精确至0.1 g)于500 mL具塞锥形瓶中, 加入100 mL乙腈-水(84∶16,V/V)提取液,浸泡15 min,超声振荡40 min,过滤,取8 mL 滤液,过MycoSep☒226多功能柱,取过柱后液体4 mL,氮气吹干,甲醇溶液定容至1 mL。
DZT MS-PREP免疫亲和柱和聚苯乙烯-二乙烯苯树脂免疫亲和柱:称取小麦粉样品25.0 g(精确至0.1 g)于500 mL具塞锥形瓶中,加入100 mL 70%甲醇溶液(V/V),浸泡15 min,超声振荡40 min,过滤,取16mL 滤液,以2 mL/min的速率过柱,再用16 mL水以5 mL/min的速度洗涤免疫亲和柱;用1 mL 100%甲醇溶液以1 滴/s的速度洗脱柱子,将洗脱液收集于2 mL的样液瓶中,再用1 mL水以5 mL/min的速率洗涤免疫亲和柱,同样收集于上述样液瓶中。
1.3.3 液相色谱-质谱条件
离子源:ESI源(300 ℃),雾化气压力1.03×105Pa。色谱柱:Agilent ZORBAX Bonus-RP柱(50 mm×2.1 mm,3.5 ☒m),柱温20 ℃,进样量20 μL。流动相:乙酸铵溶液(A)-乙腈溶液(B)体系,流速为0.3 mL/min。梯度条件:0~0.1 min,B 10%;0.1~2 min,B 10%~50%;2~10 min,B 50%~80%;10~15 min,B 80%;15~16 min,B 80%~10%;16~20 min,B 10%。电离模式、监测离子对(m/z)和其他参数见表1。
表1 4 种镰刀菌毒素的质谱参数
Table 1 Instrumental settings for analysis of the four Fusarium toxins

注:*.定量离子。
1.3.4 定量分析
将配制的混合系列标准溶液进行测定,以峰面积(Y)对相应真菌毒素质量浓度(X)绘制标准曲线,得到线性回归方程、线性范围及相关系数。
准确称取若干份相同的小麦粉样品各25 g,分别减少加入4 种真菌毒素标准溶液的量,按1.3.1节所述步骤处理后检测。仪器信噪比为3∶1时,单离子检测扫描中选择离子不再有峰出现,此时小麦粉中4 种真菌毒素的质量浓度即为方法的检出限;再根据仪器信噪比为10∶1时计算定量限。
1.3.5 加标回收率
准确称取若干份相同的小麦粉样品各25 g,向小麦粉中加入等量的不同质量浓度的4 种真菌毒素标样,混匀,静置0.5 h。按1.3.1节所述步骤,分别用3 种前处理方式进行净化。同时对空白小麦粉样品进行检测。每个样品做3 份平行。计算加标回收率和相对标准偏差(精密度)。
1.3.6 免疫亲和柱再生性和稳定性
MycoSep☒226多功能净化柱不能重复使用。因此,仅对DZT MS-PREP免疫亲和柱和实验室制备聚苯乙烯-二乙烯苯树脂免疫亲和柱进行再生性处理。分别用0.1 mol/L NaAc(pH 4.0,含0.5 mol/L NaCl)和0.1 mol/L Tris-HCl(pH 8.0,含0.5 mol/L NaCl)交替冲洗柱子至少3 个循环,再用0.01 mol/L PBS(pH 7.4)冲洗,最后,用含0.01% NaN30.01 mol/L PBS(pH 7.4)封闭柱子进行保存。
2.1 定量分析结果

图1 4 种镰刀菌毒素标准溶液的总离子流图
Fig. 1 Total ion current (TIC) chromatogram of mixed standard solution of four Fusarium toxins
如图1所示,4 种真菌毒素HT-2、T-2、DON和ZEN的保留时间分别为5.34、6.11、7.67 min和7.68 min。表2表明:4 种镰刀菌毒素在各自的线性范围内线性关系良好,相关系数在0.995以上,检出限为2~5 ☒g/L。
表2 4 种镰刀菌毒素的线性方程、线性范围、相关系数、检出限与定量限
Table 2 Linear equations, linear ranges, correlation coefficients, detection limits and quantitation limits of four Fusarium toxins
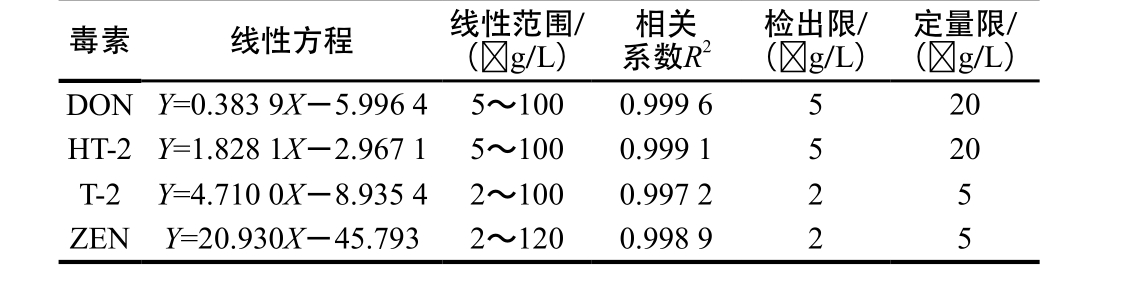
2.2 加标回收实验结果
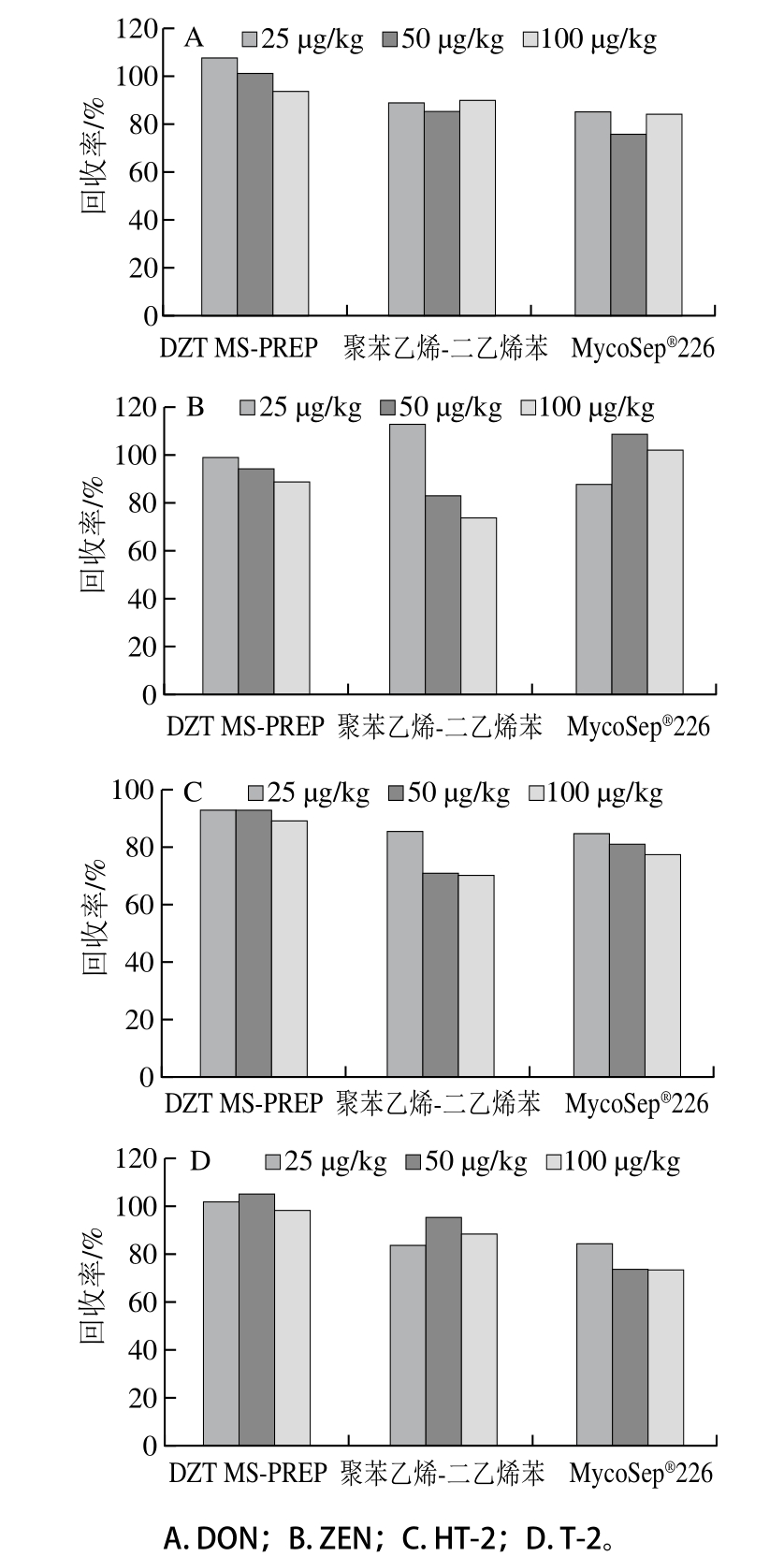
图2 3 种不同前处理柱的添加回收率比较
Fig. 2 Comparison of recoveries from spiked samples with three different columns
DZT MS-PREP免疫亲和柱的回收率为88.01%~107.31%,相对标准偏差为1.09%~14.42%。聚苯乙烯-二乙烯苯树脂免疫亲和柱的回收率为70.05%~112.80%,相对标准偏差为3.42%~12.25%。MycoSep☒226多功能净化柱的回收率为69.42%~111.12%,相对标准偏差为1.46%~13.24%。如图2所示,总体上,DZT MS-PREP免疫亲和柱的回收率接近100%,聚苯乙烯-二乙烯苯树脂免疫亲和柱与MycoSep☒226多功能净化柱与之相比较低。由于抗原抗体反应的高度特异性,免疫亲和柱具有很高的灵敏度和选择性,实验室制备聚苯乙烯-二乙烯苯树脂免疫亲和柱较商品材质免疫亲和柱虽较低,但却整体高于MycoSep☒226多功能净化柱,为新载体免疫亲和柱的制备提供了依据。
2.3 小麦粉样品的检出结果

图3 处理7 种小麦粉样品的结果
Fig. 3 Contents of Fusarium toxins in 7 flour samples separated using
three different columns
如图3所示,用MycoSep☒226多功能净化柱处理的样品,DON、HT-2、T-2的检出率为100%,1、3、4、5号样品ZEN的检出率为100%;而聚苯乙烯-二乙烯苯树脂免疫亲和柱和DZT MS-PREP免疫亲和柱处理的样品,4 种镰刀菌毒素的检出率均为100%。对于3 种前处理柱处理后1~7号小麦粉样品中4 种镰刀菌毒素的检测结果均保持一致,但DZT MS-PREP免疫亲和柱所得检出值相对较高。免疫亲和柱比MycoSep☒226多功能净化柱更能够有效去除基质干扰,因此表现出较高的灵敏度。
GB 2761—2011《食品中真菌毒素限量》中对小麦、玉米、大麦中DON和ZEN限量做了规定,分别为1 000 ☒g/kg和60 ☒g/kg。由检测结果可知,3、4号样品ZEN值均超过国家限量标准。但我国目前未有HT-2、T-2相关限量标准。
2.4 免疫亲和柱的再生性和稳定性

图4 DZT MS-PREP免疫亲和柱使用3 次的回收率
Fig. 4 Recoveries of Fusarium toxins with DZT MS-PREP when it was repeatedly used for three times
如图4、5所示,4 种镰刀菌毒素的回收率均有一定程度的降低,但下降不明显,具有一定的稳定性。免疫亲和柱的再生性和稳定性,大大节约了成本,提高了使用效率,相较于MycoSep☒226多功能净化柱一次性使用具有很大的优势。
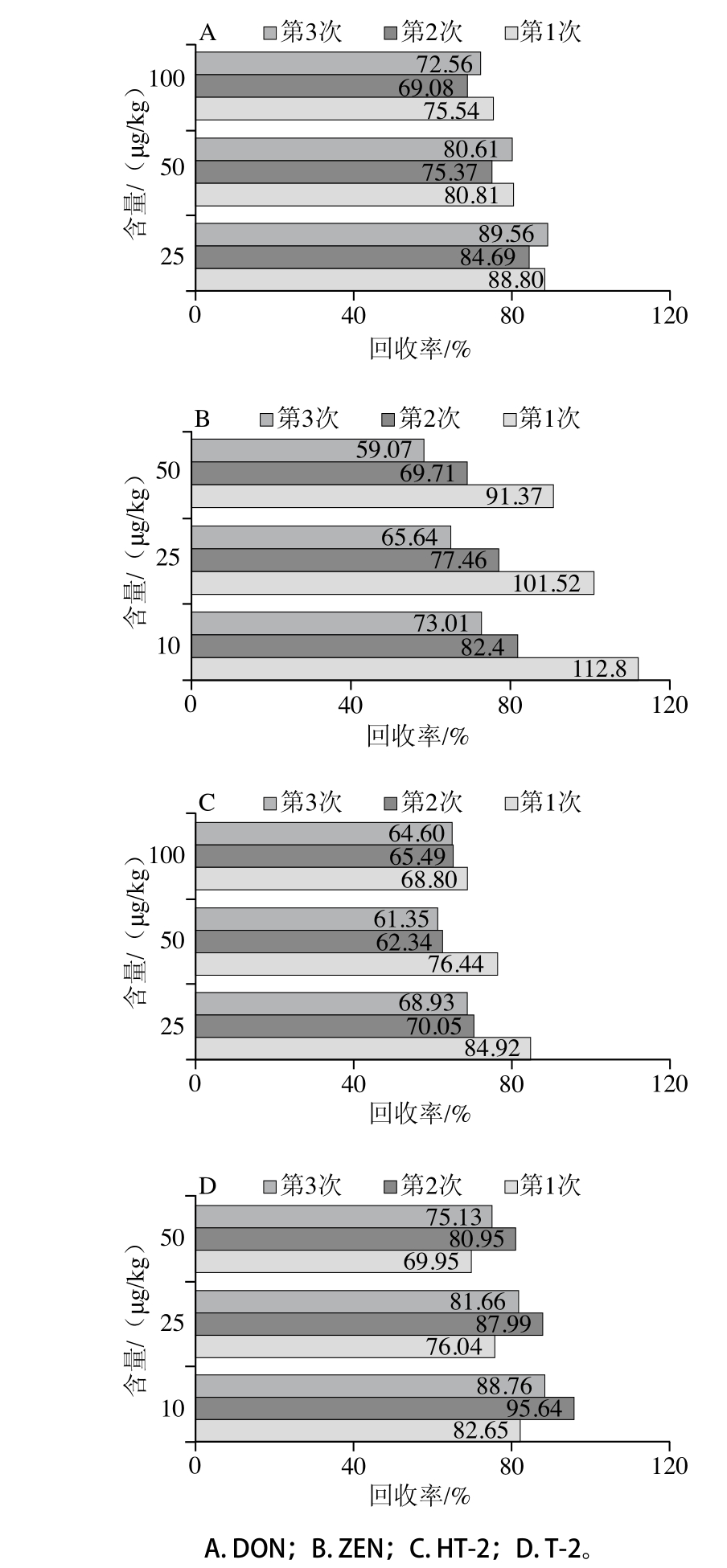
图5 聚苯乙烯-二乙烯苯免疫亲和柱使用3 次的回收率
Fig. 5 Recoveries of Fusarium toxins with PS-DVB when it was repeatedly used for three times
DON引起急性中毒的症状包括恶心、呕吐、头晕头痛和腹泻,其慢性毒性主要表现为实验动物的摄食减少、生长缓慢及血清免疫球蛋白水平改变。联合国粮农组织和世界卫生组织食品添加剂联合专家委员会在其第56次会议制定了暂定最大每日可耐受摄入量为1 000 ng/kg。ZEN具有雌激素作用,主要作用于生殖系统,并具有免疫毒性、细胞毒性和肝毒性,对肿瘤发生也有一定影响。联合国粮农组织和世界卫生组织食品添加剂联合专家委员会在其第53次会议上制定了ZEN的暂定每日最大容许摄入量为500 ng/kg。T-2、HT-2毒素主要作用于细胞分裂旺盛的组织器官,抑制这些器官细胞蛋白质和DNA合成。此外,可引起淋巴细胞中DNA单链的断裂。T-2毒素还可作用于氧化磷酸化的多个部位而引起线粒体呼吸抑制。
国家食品安全风险监测2010—2015年,在全国范围监测了小麦及小麦粉中的DON、ZEN,其中DON超标率为0.47%~20.70%,均值范围148~782 μg/kg ZEN超标率为0.06%~7.65%,均值范围2.60~76.6 μg/kg。与本实验随机采集的7 份小麦粉样本检测结果相符。但是目前尚未监测过小麦及小麦粉中的T-2毒素和HT-2毒素。
本实验提供的检测方法,可以同时检测4 种镰刀菌毒素,简化了操作步骤。DZT MS-PREP免疫亲和柱的回收率为88.01%~107.31%,相对标准偏差为1.09%~14.42%;聚苯乙烯-二乙烯苯树脂免疫亲和柱的回收率为70.05%~112.80%,相对标准偏差为3.42%~12.25%。有较高的灵敏度和特异性,具有重复利用,有机溶剂耗用量少等显著优势。聚苯乙烯-二乙烯苯树脂免疫亲和柱以高分子合成材料为新的载体,突破了传统免疫亲和柱以多糖类为载体、价格昂贵、机械强度差的缺点,具有良好的机械强度和化学稳定性,pH值适用范围宽,以树脂材料为载体的免疫亲和柱为新载体免疫亲和柱的制备提供了依据。
参考文献:
[1] BENNET J W, KLICH M. Mycotoxins[J]. Journal of Clinical Microbiology, 2003, 16(3): 497-516. DOI:10.1128/CMR.16.3.497-516.2003.
[2] VISCONTI A, LATTANZIO V M, PASCALE M, et al. Analysis of T-2 and HT-2 toxins in cereal grains by immunoaffinity clean-up and liquid chromatography with fluorescence detection[J]. Journal of Chromatography A, 2005, 1075(1/2): 151-158. DOI:10.1016/ j.chroma.2005.04.009.
[3] WILD C P, GONG Y Y. Mycotoxins and human disease: alargely ignored global health issue[J]. Carcinogenesis, 2010, 31(1): 71-82. DOI:10.1093/carcin/bgp264.
[4] PESTKA J J, ROTTER B A, PRELUSKY D B, et al. Toxicology of deoxynivalenol (vomitoxin)[J]. Journal of Toxicology Environmental Health, 1996, 48(1): 1-34.
[5] CHANEMOUGASOUNDHARAM A, FIONA M D. Trichothecene toxicity in eukaryotes: cellular and molecular mechanisms in plants and animals[J]. Toxicology Letters, 2013, 217(2): 149-158.
[6] 李丽霞, 尚书凤. T-2毒素的毒性及其作用机制与代谢研究进展[J].湖南农业科学, 2015, 54(21): 5207-5210. DOI:10.14088/j.cnki. issn0439-8114.2015.21.002.
[7] 梁颖. 配合饲料中三种镰刀菌毒素检测方法的研究[D]. 咸阳: 西北农林科技大学, 2006.
[8] 高爽, 邓又天, 张超, 等. 脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮及其联合染毒对小鼠肝脏功能及肝细胞凋亡的影响[J]. 中国兽医学报, 2015, 35(12): 2021-2026. DOI:10.16303/j.cnki.1005-4545.2015.12.25.
[9] KOTAL F, HOLADOV☒ K, HAJ☒LOV☒ J, et al. Determination of trichothecenes in cereals[J]. Journal of Chromatography A, 1999, 830(1): 219-225.
[10] EKE Z, KENDE A, TORKOS K. Simultaneous detection of A and B trichothecenes by gas chromatography with flame ionization or mass selective detection[J]. Microchemical Journal, 2004, 78(2): 211-216.
[11] SOLEIMANY F, JINAP S, RAHMANI A, et al. Simultaneous detection of 12 mycotoxins in cereals using RP-HPLC-PDA-FLD with PHRED and a post-column derivatization system[J]. Food Additives and Contaminants, 2011, 28(4): 494-501.
[12] 孙娟, 李为喜, 张妍, 等. 用超高效液相色谱串联质谱法同时测定谷物中12 种真菌毒素[J]. 作物学报, 2014, 40(4): 691-701.
[13] ULRIKE B, INGA R, SUSANNE K, et al. Diagnosis of intoxications of piglets fed with Fusarium toxin-contaminated maize by the analysis of mycotoxin residues in serum, liquor and urine with LC-MS/MS[J]. Archives of Animal Nutrition. 2014, 68(6): 425-447.
[14] DALL’ASTA C, SFORZA S, GALAVERNA G, et al. Simultaneous detection of type A and type B trichothecenes in cereals by liquid chromatography-electrospray ionization mass spectrometry using NaCl as cationization agent[J]. Journal of Chromatography A, 2004, 1054(1): 389-393.
[15] 吴杰, 刘太国, 高利, 等. 小麦四种镰刀菌毒素的ELISA检测及毒素污染分析[J]. 植物保护学报, 2009, 36(2): 106-112. DOI:10.7666/ d.y1635190.
[16] WANG Q, ZHAO H, XI C X, et al. Determination of chloramphenicol and zeranols in pig muscle by immunoaffinity column clean-up and LC-MS/MS analysis[J]. Food Additives and Contaminants, 2014, 31(7): 1177-1186.
[17] ROMAGNOLI B, FERRARI M, BERGAMINI C. Simultaneous determination of deoxynivalenol, zearalenone, T-2 and HT-2 toxins in breakfast cereals and baby food by high-performance liquid chromatography and tandem mass spectrometry[J]. Journal of Mass Spectrometry, 2010, 45(9): 1075-1080. DOI:10.1002/jms.1802.
[18] RADOV☒ Z, HOLADOV☒ K, HAJSLOV☒ J. Comparison of two clean-up principles for determination of trichothecenes in grain extract[J]. Journal of Chromatography A, 1998, 829(1): 259-267.
[19] TANAKA T, YONEDA A, INOUE S, et al. Simultaneous determination of trichothecene mycotoxins and zenralenone in cereals by gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2000, 882(1): 23-28.
[20] VACLAVIKOVA M, MACMAHON S, ZHANG K, et al. Application of single immunoaffinity clean-up for simultaneous determination of regulated mycotoxins in cereals and nuts[J]. Talanta, 2013, 117(22): 345-351.
[21] LATTANZIO V M T, SOLFRIZZO M, POWERS S, et al. Simultaneous determination of aflatoxins, ochratoxin A and Fusarium toxins in maize by liquid chromatography/tandem mass spectrometry after multitoxin immunoaffinity cleanup[J]. Rapid Communications in Mass Spectrometry, 2007, 21(20): 3253-3261.
[22] 郑翠梅, 张艳, 王松雪, 等. 液相色谱-质谱联用同时检测粮食中多种真菌毒素的应用进展[J]. 粮食科技与经济, 2012, 37(1): 45-49. DOI:10.3969/j.issn.1007-1458.2012.01.022.
[23] FERREIRA I, FERNANDES J O, CUNHA S C. Optimization and validation of a method based in a QuEChERS procedure and gas chromatography-mass spectrometry for the determination of multimycotoxins in popcorn[J]. Food Control, 2012, 27(1): 188-193. DOI:10.1016/j.foodcont.2012.03.014.
[24] DIANA D, MAVUNGU J, MONBALIU S, et al. LC-MS/MS multianalyte method for mycotoxin determination in food supplements[J]. Food Additives and Contaminants, 2009, 26(6): 885-895. DOI:10.1080/02652030902774649.
[25] STECHER G, JARUKAMJORN K, ZABORSKI P, et al. Evaluation of extraction methods for the simultaneous analysis of simple and macrocyclic trichothecenes[J]. Talanta, 2007, 73(2): 251-257. DOI:10.1016/j.talanta.2007.03.028.
[26] MEI L Y, CAO B Y, YANG H, et al. Development of an immunoaffinity chromatography column forselective extraction of a new agonist phenylethylamine A from feed, meat and liver samples[J]. Journal of Chromatography B, 2014, 945/946(2): 178-184.
[27] RAZZAZI F E, B☒HM J, JARUKAMJORN K, et al. Simultaneous determination of major B-trichothecenes and the de-epoxymetabolite of deoxynivalenol in pig urine and maize using highperformance liquid chromatography-mass spectrometry[J]. Journal of Chromatography B, 2003, 796(1): 21-33.
[28] RAZZAZI F E, B☒HM J, LUF W. Determination of nivalenol and deoxynivalenol in wheat using liquid chromatography-mass spectrometry with negative ion atmospheric pressure chemical ionisation[J]. Journal of Chromatography A, 1999, 854(1): 45-55. DOI:10.1016/s0021-9673(99)00616-0.
[29] SCHOTHORST R C, JEKEL A A. Determination of trichothecenes in wheat by capillary gas chromatography with flame ionisation detection[J]. Food Chemistry, 2001, 73(1): 111-117. DOI:10.1016/ s0308-8146(00)00321-6.
[30] 静平, 胥璐, 马志勇, 等. 高效液相色谱法检测粮谷及其制品中六种A,B型单端孢霉烯族真菌毒素[J]. 食品安全质量检测学报, 2012, 3(2): 106-111.
[31] 鲍蕾, 吴振兴, 石媛媛, 等. 多功能柱净化-高效液相色谱法检测粮谷及其制品中的呕吐毒素[J]. 食品安全质量检测学报, 2014, 5(3): 776-781.
Purification Efficiency of Four Fusarium Toxins from Wheat Flour with Different Purification Columns
ZHANG Jianing, DING Ke*, HAN Tao, CHEN Xiangning
(Beijing Key Laboratory of Agricultural Product Detection and Control for Spoilage Organisms and Pesticides, Beijing Laboratory of Food Quality and Safety, Food Science and Engineering College, Beijing University of Agriculture, Beijing 102206, China)
Abstract:A method for the simultaneous determination of four Fusarium toxins in wheat flour including zenralenone, deoxynivalenol, T-2 and HT-2 toxins was established using high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). Samples were cleaned up with a MycoSep☒226 multifunctional column, a DZT MS-PREP immunoaffinity column, which were both commercial products, and a polystyrene-divinylbenzene (PS-DVB) immunoaffinity column which was prepared in our laboratory, respectively. The recoveries of Fusarium toxins purified with MycoSep☒226 ranged from 69.42% to 111.12% with relative standard deviations (RSDs) of 1.46%–13.24%, those obtained with PS-DVB ranged from 70.05% to 112.80% with RSDs of 3.42%–12.25%, and those obtained with DZT MS-PREP ranged from 88.01% to 107.31% with RSDs of 1.09%–14.42%. Immunoaffinity columns had the advantages of repeated use, less organic solvent consumption and high specificity. Moreover, PS-DVB could be a promising new immunoaffinity carrier.
Key words:Fusarium toxins; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); MycoSep☒226 multifunctional column; polystyrene-divinylbenzene (PS-DVB) immunoaffinity column; DZT MS-PREP immunoaffinity column
DOI:10.7506/spkx1002-6630-201714049
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2017)14-0316-07
收稿日期:2016-08-09
基金项目:北京市属高等学校高层次人才引进与培养计划项目(CIT&TCD20154045);
北京市自然科学基金重点项目(KZ201710020014);北京农学院食品质量与安全北京实验室2017年度开放课题;
作者简介:张家宁(1990—),女,硕士研究生,研究方向为食品安全检测技术。E-mail:s631852@163.com
*通信作者:丁轲(1978—),男,副教授,博士,研究方向为食品营养与安全。E-mail:dingk@tom.com