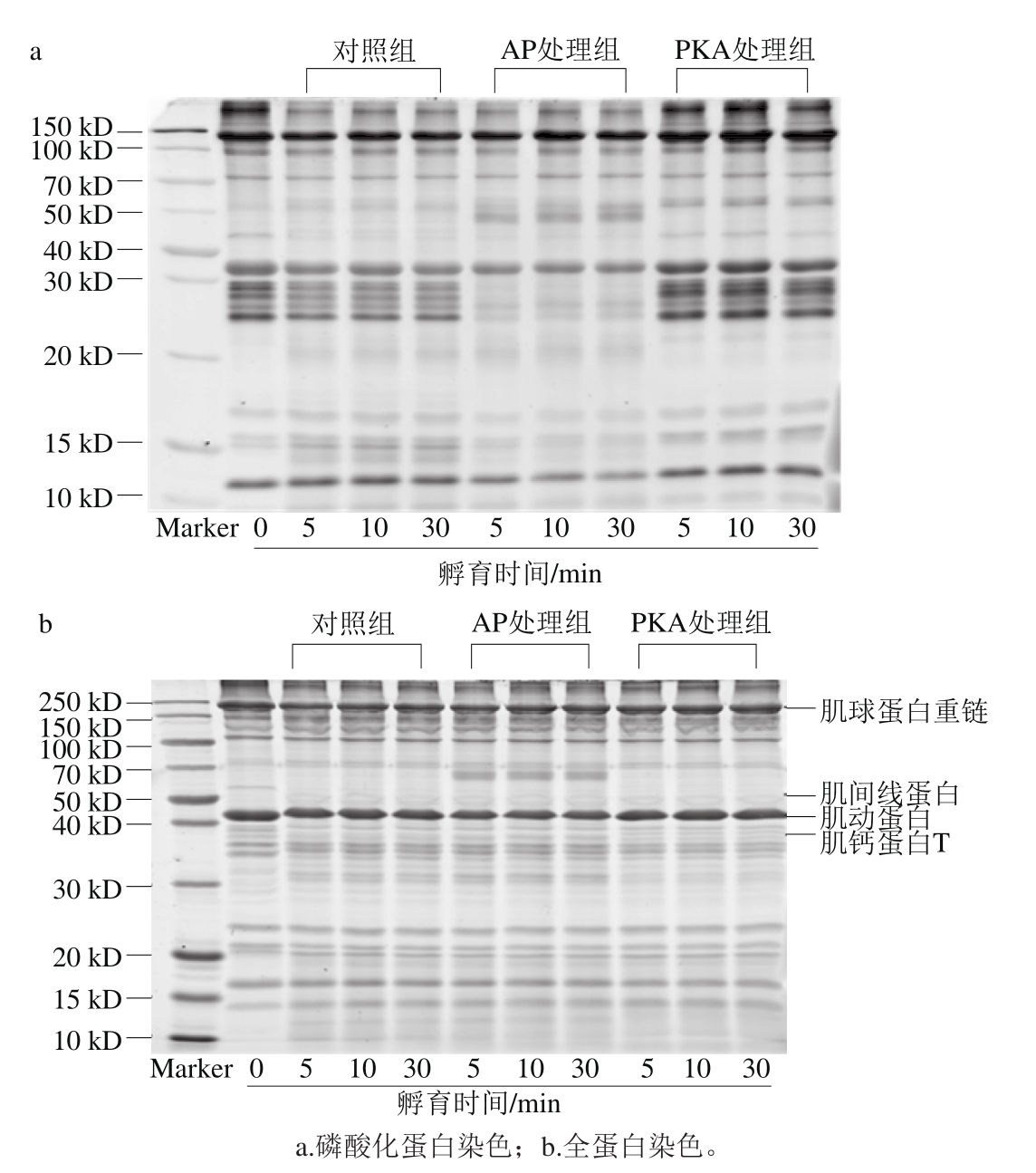
图1 肌原纤维蛋白SDS-PAGE磷酸化蛋白与全蛋白染色图
Fig. 1 Gel images of phosphoproteins and total myof i brillar proteins separated by SDS-PAGE
李 铮,李 欣,杜曼婷,李 蒙,张德权*
(中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
摘 要:目的:研究肌原纤维蛋白磷酸化对其被μ-钙蛋白酶降解的影响。方法:以羊背最长肌肌原纤维蛋白为原料,添加蛋白激酶A和碱性磷酸酶催化磷酸化和去磷酸化反应,反应后加入μ-钙蛋白酶,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和荧光染色、蛋白质免疫印迹测定肌原纤维蛋白的磷酸化水平、蛋白降解程度。结果:蛋白激酶A处理组肌原纤维蛋白磷酸化水平显著高于对照组(P<0.05);碱性磷酸酶处理组肌原纤维蛋白磷酸化水平显著低于对照组(P<0.05);蛋白激酶A处理抑制μ-钙蛋白酶自溶,降低其活性,延长其发挥活性的时间;蛋白激酶A处理促进肌球蛋白重链及肌钙蛋白T降解;碱性磷酸酶处理促进肌动蛋白及肌间线蛋白降解。结论:磷酸化通过作用于μ-钙蛋白酶活性及肌原纤维蛋白进而影响μ-钙蛋白酶降解肌原纤维蛋白。
关键词:磷酸化;肌原纤维蛋白;μ-钙蛋白酶;降解;蛋白激酶A;碱性磷酸酶
我国是畜禽肉生产和消费大国,嫩度是评价肉品品质的一个重要指标,影响肉嫩度的主要因素有肌肉结构蛋白被降解的程度、肌节长度及结缔组织含量。蛋白质降解的主要途径有钙蛋白酶系统、溶酶体系统、线粒体蛋白酶系统、泛素-蛋白酶体途径等,蛋白降解过程中钙蛋白酶参加的肌原纤维蛋白降解是限速步骤,是宰后影响肌肉嫩化的重要因素[1-3]。钙蛋白酶系统是肉品科学领域研究最广泛的酶系统之一,宰后初期μ-钙蛋白酶起主要的降解肌原纤维蛋白的作用,μ-钙蛋白酶在宰后前3 d内被Ca2+激活发生自溶,并发挥水解蛋白活性[4]。钙蛋白酶可以破坏肌肉的超微结构,尤其使Z线弱化并消失,从而促进肌原纤维小片段化和肉的嫩化[5]。肌动蛋白、肌球蛋白重链、肌球蛋白轻链、原肌球蛋白、肌间线蛋白、肌钙蛋白T、肌钙蛋白I等均为μ-钙蛋白酶的降解底物[6-7]。
蛋白质会发生多种转录后修饰现象,如磷酸化、甲基化、乙酰化、糖基化等,转录后修饰可以通过改变蛋白结构构象影响其性质或者调解其功能[8]。蛋白质磷酸化反应是指由蛋白激酶催化的将ATP或GTP上γ位的磷酸基转移到底物蛋白质氨基酸残基上的过程,该反应主要发生在丝氨酸、苏氨酸和酪氨酸等氨基酸残基侧链的羟基上。Chen Lijuan等[8]研究表明嫩度高的肌肉中肌原纤维蛋白磷酸化水平低,嫩度低的肌肉中肌原纤维蛋白磷酸化水平高。D’Alessandro等[9-11]研究表明低嫩度牛肉中Z线相关蛋白(肌收缩蛋白、肌联蛋白、肌钙蛋白T等)磷酸化水平高,且Z线相关蛋白磷酸化水平高可能会导致蛋白之间作用增强以及蛋白酶对蛋白的酶解作用减弱,进而导致肉嫩度低。另外,Huang Honggang等[12-13]研究指出,宰后pH值下降速率影响嫩度,而pH值下降速率差异的肉中存在多种磷酸化水平差异的肌原纤维蛋白。以上研究均说明肌原纤维蛋白磷酸化影响肉的嫩度,宰后肌肉中仍发生磷酸化和去磷酸化反应,磷酸化水平随宰后时间动态变化,但磷酸化对各种肌原纤维蛋白的作用机制还有待进一步研究。
前人的研究将富含脯氨酸、谷氨酸、丝氨酸及苏氨酸的易被μ-钙蛋白酶降解的蛋白区域命名为PEST区[14],一些医学相关研究指出该区域因含有丝氨酸及苏氨酸使其易发生磷酸化修饰,进而降低μ-钙蛋白酶对该区域的灵敏度[15-17]。但在宰后肌肉成熟过程中,磷酸化是否会影响肌原纤维蛋白的降解目前尚不明确,磷酸化是否通过作用于肌原纤维蛋白降解进而调控宰后肌肉嫩度尚不清楚。本研究以羊背最长肌为原料,提取肌原纤维蛋白,通过碱性磷酸酶(alkaline phosphatase,AP)及蛋白激酶A(protein kinase A,PKA)分别催化肌原纤维蛋白的去磷酸化及磷酸化反应,研究μ-钙蛋白酶对不同磷酸化水平的肌原纤维蛋白降解的程度,明确肌原纤维蛋白磷酸化对其被μ-钙蛋白酶降解的影响。
1.1 材料与试剂
选取饲养条件相同的3 只10 月龄的小尾寒羊与大尾寒羊的杂交公羊,平均胴体质量约25 kg,在北京市昌平区商业化的屠宰场屠宰。宰后30 min内取羊背最长肌,在十三肋附近取约100 g肉,剔除可见的结缔组织及筋膜,分装于冻存管中液氮速冻后于-80 ℃保存。
μ-钙蛋白酶(208712) 美国Calbiochem公司;蛋白激酶A(PKA、P2654)、碱性磷酸酶(AP、P0114)、鼠抗-肌球蛋白抗体(M4276) 美国Sigma公司;蛋白浓度测定试剂盒(PL212238) 美国Thermo Fisher Scientific公司;Pro-Q Diamond、SYPRO Ruby染色液 美国Invitrogen公司;三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵(ammonium persulfate,APS)、四甲基乙二胺(tetramethylethylenediamine,TEMED)、氯化钠、碳酸钠、碳酸氢钠(均为分析纯) 北京化学试剂公司。
1.2 仪器与设备
Ultra Turrax Disperser S25分散器 德国IKA公司;Himac CR 22 GII高效冷冻离心机 日本Hitachi公司;恒温振荡金属浴 杭州奥盛仪器有限公司;SpectraMax 190全波长酶标仪 美国Molecular Devices公司;电泳设备(Mini-PROTEAN Tetra System)、半干转膜设备(Trans-Blot TurboTM)、ChemiDocTMMP凝胶成像系统美国Bio-Rad 公司。
1.3 方法
1.3.1 样品制备
肌原纤维蛋白提取参考Smuder等[18]的方法。取1 g肉,加入5 mL肌原纤维蛋白提取溶液(0.039 mol/L四硼酸钠、0.025 mol/L KCl、5 mmol/L乙二醇二乙醚二胺四乙酸,1 片/50 mL蛋白酶抑制剂,pH 7.1),匀浆后于1 500×g离心12 min(4 ℃)。弃去上清液,向沉淀中加入5 mL 0.1 mol/L KCl(含1.0% Triton X-100),匀浆后于1 500×g离心12 min(4 ℃),此步骤重复两次。最后将沉淀溶于0.4 mol/L KCl、0.05 mol/L三羟基氨基甲烷、0.001 mol/L二硫苏糖醇溶液中。用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒测定蛋白质量浓度,将蛋白质量浓度调至4 mg/mL。向蛋白溶液中分别加入溶解好的ATP(0.2 μmol/10 μg pro)、PKA(1 U/10 μg pro)或AP(1 U/4 μg pro)催化磷酸化或去磷酸化反应,对照组不含PKA及AP,在30 ℃振荡孵育30 min。加入μ-钙蛋白酶(1 U/10 μg pro),加入CaCl2使反应体系Ca2+浓度为0.01 mol/L,在37 ℃反应5、10、30 min,加入Laemmli电泳样品缓冲液,沸水浴5 min终止反应,冷却后于10 000×g离心3 min取上清液备用。
1.3.2 蛋白磷酸化水平的分析
采用4 g/100 mL丙烯酰胺浓缩胶和12 g/100 mL丙烯酰胺分离胶进行电泳,浓缩胶电压70 V,分离胶电压110 V。电泳结束后采用Pro-Q Diamond对磷酸化蛋白染色,采用Ruby对全蛋白染色,染色流程参照Chen Lijuan等[8]的方法。采用Quantity One 4.6.2软件对凝胶成像系统拍照的凝胶图片进行光密度值分析,选取磷酸化蛋白条带,分析各条带光密度,再对应分析各条带全带白光密度,以磷酸化蛋白的Pro-Q Diamond染色光密度(P)与全蛋白的SYPRO Ruby染色光密度(T)之比表示蛋白质磷酸化水平(P/T)。
1.3.3 蛋白降解分析
采用免疫印迹方法分析肌球蛋白重链、肌动蛋白、肌间线蛋白、肌钙蛋白T及μ-钙蛋白酶的降解程度,分别使用7.5、12.0、12.0、15.0 g/100 mL及8.0 g/100 mL丙烯酰胺的分离胶及4 g/100 mL丙烯酰胺的分离胶进行电泳,电泳结束后将凝胶中的蛋白转印到聚偏二氟乙烯膜上,采用TBS溶液(0.01 mol/L Tris、0.15 mol/L NaCl,pH 7.5)漂洗(3次,2 min/次),用封闭液(含0.05% Tween 20、3%牛血清白蛋白的TBS溶液)室温摇床振荡封闭2 h。抗体分别采用鼠抗-肌球蛋白抗体(M4276,稀释1 000 倍)、鼠抗-肌动蛋白抗体(A4700,稀释2 500 倍)、鼠抗肌间线蛋白抗体(D1033,稀释1 000 倍)、鼠抗-肌钙蛋白T抗体(ab130003,稀释1 000 倍)及鼠抗-μ-钙蛋白酶抗体(C0355,稀释500 倍),与抗体在4 ℃孵育14 h。采用TBST1溶液(含0.1% Tween 20的TBS溶液)漂洗3 次,然后与羊抗鼠IgG抗体(A9044,用封闭液1∶2 500稀释)室温摇床振荡孵育2 h。采用TBST2溶液(0.05 mol/L Tris、0.15 mol/L NaCl、0.1% Tween 20,pH 7.5)漂洗3 次,用电化学发光(electrochemiluminescence,ECL)显色剂显色,使用凝胶成像仪成像。
1.4 统计分析
实验均3 次重复,每个样品做3 次平行,所得数据采用SPSS 19.0统计软件进行方差分析,通过最小显著差异法(least signif i cant difference,LSD)和邓肯氏总重比较法(Duncans multiple-rang test)进行差异显著性分析。
2.1 肌原纤维蛋白磷酸化水平及降解程度分析
采用PKA催化肌原纤维蛋白发生磷酸化反应,采用AP催化肌原纤维蛋白发生去磷酸化反应,分析反应后肌原纤维蛋白磷酸化水平,结果如图1所示。对图1a所示的磷酸化蛋白(P)及图1b所示的全蛋白(T)进行光密度值分析,以P/T表示磷酸化水平,结果如图2所示。结果表明,AP处理组肌原纤维蛋白的磷酸化水平显著低于对照组(P<0.05),而PKA处理组肌原纤维蛋白的磷酸化水平显著高于对照组(P<0.05),表明AP及PKA起到了催化去磷酸化及磷酸化反应的作用。

图1 肌原纤维蛋白SDS-PAGE磷酸化蛋白与全蛋白染色图
Fig. 1 Gel images of phosphoproteins and total myof i brillar proteins separated by SDS-PAGE

图2 不同处理组孵育不同时间肌原纤维蛋白的磷酸化水平
Fig. 2 Variation in phosphorylation level of myof i brillar proteins with different treatments as a function of incubation time
小写字母不同代表不同处理组相同孵育时间磷酸化水平差异显著(P<0.05)。
向肌原纤维蛋白中加入μ-钙蛋白酶,随着孵育的进行,如图1所示,可以观察到50 kD附近的蛋白条带消失,此条带推测为肌间线蛋白;40 kD附近的蛋白条带在不同处理组之间出现差异,此条带推测为肌钙蛋白T;在30 kD附近产生新的降解条带,此条带推测为肌钙蛋白T的降解条带;另外,在10~15 kD出现新的降解条带。肌间线蛋白及肌钙蛋白T是宰后嫩化开始的标志,肌球蛋白和肌动蛋白是肌原纤维蛋白中含量最高的两种蛋白,因此选择这4 种蛋白进行免疫印迹分析。
2.2 肌球蛋白重链降解分析
肌球蛋白是骨骼肌中含量最高的蛋白,是肌粗丝的主要组成部分。采用免疫印迹法对肌球蛋白重链降解程度进行分析,结果如图3所示。在未处理的肌原纤维蛋白中,肌球蛋白重链抗体可以检测到肌球蛋白重链及4 条蛋白条带,与μ-钙蛋白酶孵育后,可以检测到新条带1,推测此条带为肌球蛋白重链的降解条带。PKA处理组条带1的光密度值明显高于对照组及AP处理组,说明PKA处理组肌球蛋白重链降解程度高,磷酸化反应促进肌球蛋白重链降解。

图3 不同处理组肌球蛋白重链降解分析
Fig. 3 Analysis of myosin heavy chain degradation with different treatments
2.3 肌动蛋白降解分析
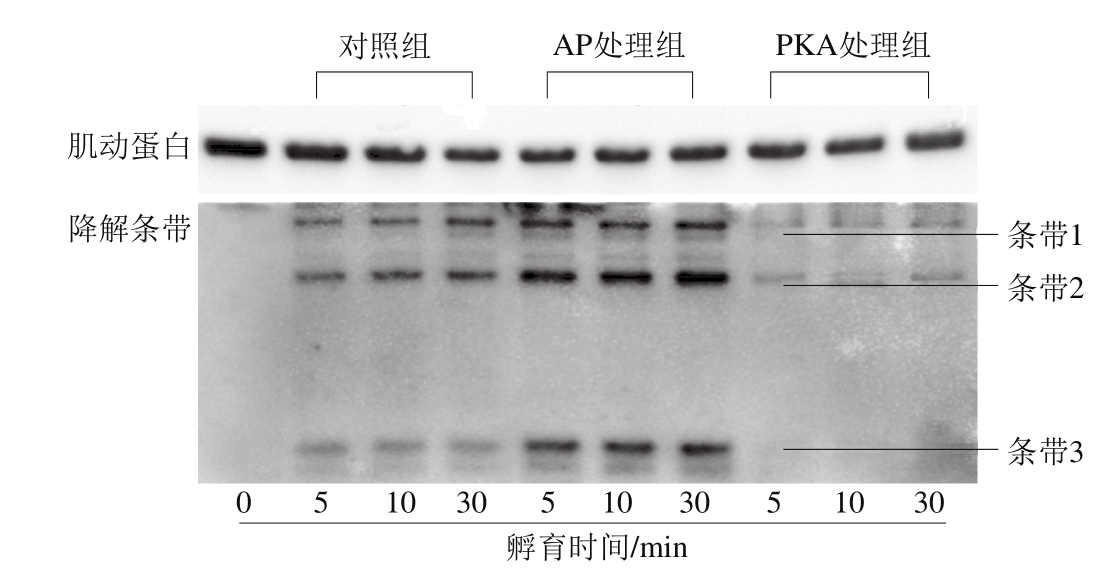
图4 不同处理组肌动蛋白降解分析
Fig. 4 Analysis of actin degradation with different treatments
肌动蛋白是骨骼肌中含量第二的蛋白,仅次于肌球蛋白,是肌细丝的主要组成部分。采用免疫印迹法对肌动蛋白降解程度进行分析,结果如图4所示。本研究中采用ECL显色并采用ChemiDocTMMP凝胶成像系统曝光。在自动曝光条件下,当显色区域有条带达到饱和则停止曝光,此时只能检测到肌动蛋白的条带。在手动曝光条件下,延长曝光时间,膜背景随之加深,能检测到肌动蛋白的降解条带,但肌动蛋白降解条带分子质量和肌动蛋白条带接近,肌动蛋白条带信号干扰降解条带信号,为了避免信号干扰,将肌动蛋白条带剪掉后再对降解条带进行曝光。可以检测到3条降解条带,AP处理组降解条带灰度值高于对照组,PKA处理组降解条带光密度值低于对照组,说明磷酸化抑制肌动蛋白降解,而去磷酸化促进肌动蛋白降解。条带3分子质量和图1中出现在10~15 kD的降解条带的分子质量相似,推测图1中10~15 kD的降解条带为肌动蛋白降解条带。
2.4 肌间线蛋白降解分析
肌间线蛋白是细胞骨架蛋白之一,分子质量约为53 kD,连接于Z线之间,维持肌节间的横向连接,保持肌细胞的有序性和完整性[19]。采用免疫印迹法对肌间线蛋白降解程度进行分析,结果如图5所示。从孵育5 min起,不能检测到肌间线蛋白,说明肌间线蛋白几乎被完全降解。可以检测到2条肌间线蛋白降解条带,且PKA处理组降解条带光密度值高于对照组,AP处理组降解条带光密度值低于对照组,说明磷酸化抑制肌间线蛋白降解,去磷酸化促进肌间线蛋白降解。

图5 不同处理组肌间线蛋白降解分析
Fig. 5 Analysis of desmin degradation with different treatments

图6 不同处理组肌钙蛋白T降解分析
Fig. 6 Analysis of troponin T degradation with different treatments
肌钙蛋白T分子质量约为35 kD,能结合原肌球蛋白,起连接作用,和肌钙蛋白I及肌钙蛋白C一起发挥调解横纹肌的收缩与舒张。采用免疫印迹法对肌钙蛋白T降解程度进行分析,结果如图6所示。孵育过程中,PKA处理组肌钙蛋白T被降解程度最高,且只能检测到1条降解条带,在AP处理组和对照组中,还可以检测到多条肌钙蛋白T的降解条带,且对照组降解程度高于AP处理组。说明磷酸化促进肌钙蛋白T降解,去磷酸化抑制肌钙蛋白T降解。
2.6 μ-钙蛋白酶自溶分析
μ-钙蛋白酶是由一个80 kD的催化亚基和一个28 kD的调节亚基组成,其80 kD的亚基经78 kD自溶至76 kD的过程是其发挥活性的过程,因此通过免疫印迹分析μ-钙蛋白酶自溶进而反映其活性,结果如图7所示,除μ-钙蛋白酶条带,还可以检测到2 条降解条带。3 组中μ-钙蛋白酶条带光密度值低于μ-钙蛋白酶标准品,说明在孵育过程中,μ-钙蛋白酶自溶并发挥水解活性。PKA处理组中μ-钙蛋白酶条带光密度值略高于对照组,AP处理组中μ-钙蛋白酶光密度值略低于对照组,说明肌原纤维蛋白溶液中的PKA及AP对μ-钙蛋白酶产生影响,PKA抑制μ-钙蛋白酶自溶,AP促进μ-钙蛋白酶自溶。PKA处理组中孵育10 min时条带2光密度值低于对照组及AP处理组,同样也证明PKA抑制μ-钙蛋白酶自溶,但可以延长μ-钙蛋白酶发挥活性的时间。
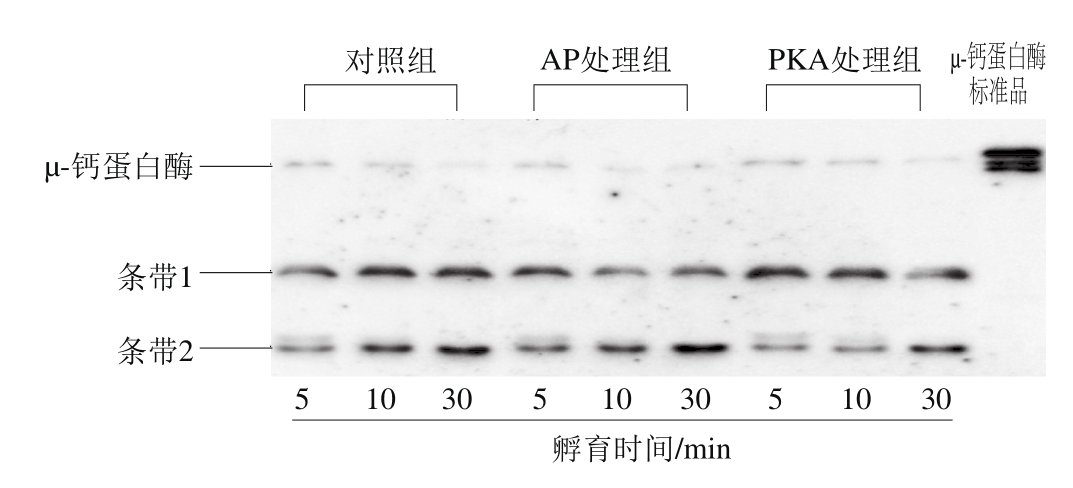
图7 不同处理组μ-钙蛋白酶自溶分析
Fig. 7 Analysis ofμ-autolyse with different treatments
磷酸化是一种常见的蛋白质修饰方式,在活体细胞中对蛋白质功能有重要作用。近些年研究表明,在宰后肌肉中,磷酸化对肌肉品质形成也有重要作用,特别是宰后肌肉嫩化过程,肌原纤维蛋白降解是肌肉嫩化的关键步骤。前人研究结果表明,肌原纤维蛋白磷酸化与宰后肌肉嫩度负相关,磷酸化可能通过影响肌原纤维蛋白降解进而影响嫩度[8-9]。在本研究中,经过AP及PKA处理,肌原纤维蛋白发生去磷酸化及磷酸化反应,磷酸化水平降低或升高,在与μ-钙蛋白酶孵育后,3 个处理组中肌原纤维蛋白降解程度不同。采用免疫印迹方法分析肌原纤维蛋白的降解程度,以肌原纤维蛋白中含量最高的肌球蛋白及肌动蛋白、以及宰后降解程度高的肌间线蛋白及肌钙蛋白T为研究目标。前人的研究已经采用磷酸化蛋白质组的方法鉴定了人肌肉中这些蛋白的磷酸化位点,证明了这些蛋白存在磷酸化修饰现象[20]。
由于肌球蛋白重链及肌动蛋白含量高,在图1中不易观察到这两种蛋白发生降解,但在免疫印迹图中,可以检测到这两种蛋白的降解条带。研究表明,宰后肌肉中肌球蛋白重链及肌动蛋白不易发生降解,但Lametsch等[6]采用蛋白质组方法,检测到这两种蛋白的降解条带。宰后肌间线蛋白发生降解,前人研究发现了50、47及39 kD的肌间线蛋白降解产物[19],且Baron等[21]研究表明,肌间线蛋白易被μ-钙蛋白酶降解,在离体孵育过程中(25 ℃)肌间线蛋白在1 h内被完全降解。肌钙蛋白T是μ-钙蛋白酶的降解底物,且其在宰后易发生降解,前人研究表明,肌钙蛋白T主要降解为一个30 kD的蛋白片段[22],另外,Anderson等[23]研究发现了另一个分子质量低于30 kD的肌钙蛋白T降解片段,这和本研究结果一致。
与μ-钙蛋白酶孵育后,肌球蛋白重链及肌动蛋白发生轻微降解,肌钙蛋白T及肌间线蛋白大部分被降解。其中,磷酸化抑制肌动蛋白及肌间线蛋白的降解,去磷酸化促进肌动蛋白及肌间线蛋白的降解;与之相反,磷酸化促进肌球蛋白重链及肌钙蛋白T的降解,去磷酸化抑制肌球蛋白重链及肌间线蛋白的降解。并且,磷酸化抑制μ-钙蛋白酶自溶,抑制其活性,但延长其发挥活性的时间。前人研究表明,磷酸化对蛋白降解的影响有两个方面。第一,钙蛋白酶降解底物含有PEST区域,该区域中丝氨酸和苏氨酸易发生磷酸化修饰,磷酸化修饰可能会通过对PEST区域的掩蔽作用影响钙蛋白酶对底物的识别能力。Wang Hongmei等[24]研究证明了ezrin蛋白的PEST区域发生磷酸化抑制了μ-钙蛋白酶对其的降解,Gomes等[25]研究表明,低磷酸化水平的肌钙蛋白I更易被钙蛋白酶降解。第二,磷酸化修饰改变蛋白结构,进而改变蛋白稳定性[26-28],Kim等[29]研究表明,C/EBPβ蛋白磷酸化后,促进其二聚体的形成,进而降低其被降解程度。Vizel等[30]研究表明,AKAP3降解受磷酸化修饰调节。在本研究中,磷酸化通过作用于μ-钙蛋白酶活性及肌原纤维蛋白进而影响μ-钙蛋白酶降解肌原纤维蛋白的过程。AP处理组中,μ-钙蛋白酶发挥活性快,其活性高,同时失活快,PKA处理组中,μ-钙蛋白酶发挥活性慢,其活性低,但维持活性时间长。因此,AP处理和PKA处理对于不同的肌原纤维蛋白影响不同,对于肌动蛋白和肌间线蛋白,磷酸化对底物的影响在酶降解底物的过程中占主要作用,因此,低磷酸化水平的肌动蛋白和肌间线蛋白更易被μ-钙蛋白酶降解;对于肌球蛋白重链和肌钙蛋白T,磷酸化对酶的影响在酶降解底物的过程中占主要作用,因此,PKA处理组μ-钙蛋白酶维持活性时间长,其对肌球蛋白重链和肌钙蛋白T的降解作用时间长,进而这两种蛋白降解程度高。
AP和PKA可以有效地催化肌原纤维蛋白发生去磷酸化或磷酸化反应,进而降低或提高肌原纤维蛋白磷酸化水平。AP处理组肌原纤维蛋白磷酸化水平显著低于对照组(P<0.05),PKA处理组肌原纤维蛋白磷酸化水平显著高于对照组(P<0.05)。磷酸化抑制μ-钙蛋白酶自溶,降低其活性,提高其发挥活性时间。磷酸化促进肌球蛋白重链及肌钙蛋白T被μ-钙蛋白酶降解,去磷酸化促进肌动蛋白和肌间线蛋白被μ-钙蛋白酶降解。磷酸化修饰通过作用于μ-钙蛋白酶活性及肌原纤维蛋白进而影响μ-钙蛋白酶降解肌原纤维蛋白的过程。
参考文献:
[1] HUFF L E, ZHANG W, LONERGAN S M. Biochemistry of postmortem muscle-lessons on mechanisms of meat tenderization[J]. Meat Science, 2010, 86(1): 184-195. DOI:10.1016/j.meatsci.2010.05.004.
[2] HOPKINS D, LITTLEFIELD P, THOMPSON M. A research note on factors affecting the determination of myofibrillar fragmentation[J]. Meat Science, 2000, 56(1): 19-22. DOI:10.1016/S0309-1740(00)00012-7.
[3] KEMP C M, SENSKY P L, BARDSLEY R G, et al. Tenderness: an enzymatic view[J]. Meat Science, 2010, 84(2): 248-256. DOI:10.1016/ j.meatsci.2009.06.008.
[4] STORR S J, CARRAGHER N O, FRAME M C, et al. The calpain system and cancer[J]. Nature Reviews Cancer, 2011, 11(5): 364-374. DOI:10.1038/nrc3050.
[5] GOLL D E, THOMPSON V F, LI H, et al. The calpain system[J]. Physiological Reviews, 2003, 83(3): 731-801. DOI:10.1152/physrev.00029.2002.
[6] LAMETSCH R, ROEPSTORFF P, MOLLER H S, et al. Identif i cation of myof i brillar substrates for μ-calpain[J]. Meat Science, 2004, 68(4): 515-521. DOI:10.1016/j.meatsci.2004.03.018.
[7] HUFF L E, MITSUHASHI T, BEEKMAN D D, et al. Proteolysis of specific muscle structural proteins by μ-calpain at low pH and temperature is similar to degradation in postmortem bovine muscle[J]. Journal of Animal Science, 1996, 74(5): 993-1008. DOI:10.2527/1996.745993x.
[8] CHEN Lijuan, LI Xin, NI Na, et al. Phosphorylation of myof i brillar proteins in post-mortem ovine muscle with different tenderness[J]. Journal of the Science of Food and Agriculture, 2015, 96(5): 1474-1483. DOI:10.1002/jsfa.7244.
[9] D’ALESSANDRO A, MARROCCO C, RINALDUCCI S, et al. Chianina beef tenderness investigated through integrated Omics[J]. Journal of Proteomics, 2012, 75(14): 4381-4398. DOI:10.1016/ j.jprot.2012.03.052.
[10] D’ALESSANDRO A, ZOLLA L. Meat science: from proteomics to integrated omics towards system biology[J]. Jounal of Proteomics, 2013, 78: 558-577. DOI:10.1016/j.jprot.2012.10.023.
[11] D’ALESSANDRO A, RINALDUCCI S, MARROCCO C, et al. Love me tender: an Omics window on the bovine meat tenderness network[J]. Journal of Proteomics, 2012, 75(14): 4360-4380.
[12] HUANG Honggang, LARSEN M R, LAMETSCH R. Changes in phosphorylation of myofibrillar proteins during postmortem development of porcine muscle[J]. Food Chemistry, 2012, 134(4): 1999-2006. DOI:10.1016/j.foodchem.2012.03.132.
[13] HUANG Honggang, LARSEN M R, PALMISANO G, et al. Quantitative phosphoproteomic analysis of porcine muscle within 24 h postmortem[J]. Journal of Proteomics, 2014, 106: 125-139. DOI:10.1016/j.jprot.2014.04.020.
[14] RECHSTEINER M. Regulation of enzyme levels by proteolysis: the role of pest regions[J]. Advances in Enzyme Regulation, 1988, 27: 121-131. DOI:10.1016/0065-2571(88)90014-3.
[15] KOOIJ V, SAES M, JAQUET K, et al. Effect of troponin I Ser23/24 phosphorylation on Ca2+-sensitivity in human myocardium depends on the phosphorylation background[J]. Journal of Molecular and Cellular Cardiology, 2010, 48(5): 954-963. DOI:10.1016/j.yjmcc.2010.01.002.
[16] PEDERSON T M, KRAMER D L, RONDINONE C M. Serine/ threonine phosphorylation of IRS-1 triggers its degradation: possible regulation by tyrosine phosphorylation[J]. Diabetes, 2001, 50(1): 24-31. DOI:10.2337/diabetes.50.1.24.
[17] HARRINGTON E O, SMEGLIN A, NEWTON J, et al. Protein tyrosine phosphatase-dependent proteolysis of focal adhesion complexes in endothelial cell apoptosis[J]. American Journal of Physiology-Lung Cellular and Molecular Physiology, 2001, 280(2): L342-L353.
[18] SMUDER A J, KAVAZIS A N, HUDSON M B, et al. Oxidation enhances myof i brillar protein degradation via calpain and caspase-3[J]. Free Radical Biology and Medicine, 2010, 49(7): 1152-1160. DOI:10.1016/j.freeradbiomed.2010.06.025.
[19] MUROYA S, ERTBJERG P, POMPONIO L, et al. Desmin and troponin T are degraded faster in type IIb muscle fi bers than in type I fi bers during postmortem aging of porcine muscle[J]. Meat Science, 2010, 86(3): 764-769. DOI:10.1016/j.meatsci.2010.06.019.
[20] HOJLUND K, BOWEN B P, HWANG H, et al. In vivo phosphoproteome of human skeletal muscle revealed by phosphopeptide enrichment and HPLC-ESI-MS/MS[J]. Journal of Proteome Research, 2009, 8(11): 4954-4965. DOI:10.1021/pr9007267.
[21] BARON C P, JACOBSEN S, PURSLOW P P. Cleavage of desmin by cysteine proteases: calpains and cathepsin B[J]. Meat Science, 2004, 68(3): 447-456. DOI:10.1016/j.meatsci.2004.03.019.
[22] HO C Y, STROMER M H, ROBSON R M. Identif i cation of the 30 kDa polypeptide in post mortem skeletal muscle as a degradation product of troponin-T[J]. Biochimie, 1994, 76(5): 369-375. DOI:10.1016/0300-9084(94)90110-4.
[23] ANDERSON M J, LONERGAN S M, FEDLER C A, et al. Profile of biochemical traits influencing tenderness of muscles from the beef round[J]. Meat Science, 2012, 91(3): 247-254. DOI:10.1016/ j.meatsci.2012.01.022.
[24] WANG Hongmei, GUO Zhen, WU Fang, et al. PKA-mediated protein phosphorylation protects ezrin from calpain I cleavage[J]. Biochemical and Biophysical Research Communications, 2005, 333(2): 496-501. DOI:10.1016/j.bbrc.2005.05.143.
[25] GOMES A V, HARADA K, POTTER J D. A mutation in the N-terminus of Troponin I that is associated with hypertrophic cardiomyopathy affects the Ca2+-sensitivity, phosphorylation kinetics and proteolytic susceptibility of troponin[J]. Journal of Molecular and Cellular Cardiology, 2005, 39(5): 754-765. DOI:10.1016/ j.yjmcc.2005.05.013.
[26] TORNAVACA O, SARRO E, PASCUAL G, et al. KAP degradation by calpain is associated with CK2 phosphorylation and provides a novel mechanism for cyclosporine A-induced proximal tubule injury[J]. PloS ONE, 2011, 6(9): e25746. DOI:10.1371/journal. pone.0025746. Epub2011 Sep28.
[27] LIN C H, LIN S Y, CHANG H W, et al. CDK2 phosphorylation regulates the protein stability of KLF10 by interfering with binding of the E3 ligase SIAH1[J]. Biochimica et Biophysica Acta, 2015, 1853(5): 1174-1181. DOI:10.1016/j.bbamcr.2015.02.018.
[28] BAKTHISARAN R, AKULA K K, TANGIRALA R, et al. Phosphorylation of αB-crystallin: role in stress, aging and pathophysiological conditions[J]. Biochimica et Biophysica Acta, 2016, 1860(1 Pt B): 167-182. DOI:10.1016/j.bbagen.2015.09.017.
[29] KIM J, TANG Q, LI X, et al. Effect of phosphorylation and S–S bondinduced dimerization on DNA binding and transcriptional activation by C/EBPβ[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(6): 1800-1804. DOI:10.1073/ pnas.0611137104.
[30] VIZEL R, HILLMAN P, ICKOWICZ D, et al. AKAP3 degradation in sperm capacitation is regulated by its tyrosine phosphorylation[J]. Biochimica et Biophysica Acta, 2015, 1850(9): 1912-1920. DOI:10.1016/j.bbagen.2015.06.005.
Effect of Phosphorylation on the Degradation of Myof i brillar Proteins by μ-Calpain
LI Zheng, LI Xin, DU Manting, LI Meng, ZHANG Dequan*
(Key Laboratory of Agro-Products Processing, Ministry of Agriculture, Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract:Objective: The objective of this study was to investigate the effect of phosphorylation on the degradation of myof i brillar proteins by μ-calpain. Methods: Protein kinase A (PKA) and alkaline phosphatase (AP) were used to catalyze the phosphorylation and dephosphorylation of myof i brillar proteins of mutton longissimus dorsi muscle, followed by hydrolysis by μ-calpain. The levels of protein phosphorylation and degradation were measured by SDS-PAGE, Pro-Q Diamond fl uorescent staining, and Western blotting, respectively. Results: The phosphorylation level of myof i brillar proteins in the PKA group was signif i cantly higher than that of the control group (P < 0.05), while the phosphorylation level of myof i brillar proteins in the AP group was signif i cantly lower than that of the control group (P < 0.05). The autolysis and activity of μ-calpain were suppressed by PKA treatment, thereby leading to prolonged hydrolysis of myof i brillar proteins by μ-calpain. Phosphorylation enhanced the degradation of myosin heavy chain and troponin T, while dephosphorylation enhanced the degradation of actin and desmin. Conclusion: Phosphorylation affected both myof i brillar proteins and μ-calpain activity and therefore the degradation of myof i brillar proteins by μ-calpain.
Key words:phosphorylation; myof i brillar proteins; μ-calpain; degradation; protein kinase A; alkaline phosphatase
DOI:10.7506/spkx1002-6630-201715001
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2017)15-0001-06
引文格式:
李铮, 李欣, 杜曼婷, 等. 肌原纤维蛋白磷酸化对其被μ-钙蛋白酶降解的影响[J]. 食品科学, 2017, 38(15): 1-6.
DOI:10.7506/spkx1002-6630-201715001. http://www.spkx.net.cn
LI Zheng, LI Xin, DU Manting, et al. Effect of phosphorylation on the degradation of myo fi brillar proteins by μ-calpain[J]. Food Science, 2017, 38(15): 1-6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715001. http://www.spkx.net.cn
收稿日期:2016-07-25
基金项目:国家自然科学基金面上项目(31471604);中国博士后科学基金面上项目(2015M571176);国家现代农业(肉羊)产业技术体系建设专项(CARS-39)
作者简介:李铮(1986—),女,博士,研究方向为肉品科学与技术。E-mail:lizheng2014w@163.com
*通信作者:张德权(1972—),男,研究员,博士,研究方向为肉品科学与技术。E-mail:dequan_zhang0118@126.com