刘 丹,贾 娜*,杨 磊,苗 壮,刘登勇,李儒仁
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
摘 要:将迷迭香、丁香、肉桂3 种香辛料提取物添加到猪肉肌原纤维蛋白中(0.005、0.010、0.020 g/g pro),研究其对蛋白质巯基、表面疏水性、溶解度及凝胶特性的影响。结果表明,3 种香辛料提取物均降低了蛋白质的总巯基含量和溶解性,表面疏水性随添加量的增加先升高后降低。3个添加量在加热最终阶段弹性模量(G’)均高于对照组,低、中添加量提取物使凝胶强度增加,有利于蛋白凝胶的形成,而高添加量提取物对凝胶形成有破坏作用。因此,香辛料提取物与肌原纤维蛋白发生相互作用,从而对蛋白质的结构和凝胶特性产生影响。
关键词:香辛料提取物;猪肉;肌原纤维蛋白;功能特性
蛋白质是肉及肉制品中主要的营养成分之一。在加工和贮藏过程中蛋白质会发生氧化,其构象及功能性质都会有所改变,从而引起肉及肉制品品质劣变、营养价值下降[1]。因此,蛋白质氧化和脂肪氧化同样重要,都被认为是降低肉品品质的重要因素。所以寻找减少蛋白质和脂肪氧化的方法尤为重要,向肉及肉制品中添加抗氧化剂来防止蛋白质和脂肪氧化目前已有报道,有研究发现合成抗氧化剂对人体有一定的副作用,与合成抗氧化剂相比,植物来源的天然抗氧化剂(如:香辛料提取物、绿茶提取物等)以其安全、健康的优势受到广泛研究。其中,香辛料提取物中富含酚类物质,如迷迭香提取物中的酚类主要是二萜类的鼠尾草酸和鼠尾草酚;通过气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)分析出丁香的主要成分为丁香酚、丁香酚烯、石竹烯[2-3],这些酚类物质的存在使得香辛料提取物具有很好的抗氧化活性,如将迷迭香、丁香、桂皮提取物添加到速冻肉丸中,可有效延缓其脂肪氧化[4],迷迭香提取物还可以减少博洛尼亚香肠中蛋白质羰基氧化产物的生成[5]。将丁香花蕾提取物作为天然抗氧化剂应用到白鲢鱼片中,发现其具有抑制蛋白质氧化的效果[6]。
多酚类物质对蛋白质有亲和作用,二者相互作用可以改变蛋白质的功能基团、键合作用、空间结构和聚合形式,从而对蛋白质的功能特性产生重大影响,其作用程度取决于多酚和蛋白质的结构以及温度、pH值等因素[7]。通常,植物多酚能够以氢键、疏水相互作用、共价键等方式与蛋白质作用,进而对蛋白质的性质产生影响。如茶多酚可以通过疏水和亲水作用与α-酪蛋白、β-酪蛋白结合,其中以疏水作用为主,而β-酪蛋白由于疏水性强而更易于与多酚结合,并且多酚改变了酪蛋白的二级结构,主要使α-螺旋和β-折叠含量下降,随机卷曲程度增加,蛋白结构展开[8]。茶多酚还可以通过疏水和亲水作用与β-乳球蛋白结合,使得β-乳球蛋白的α-螺旋和β-折叠含量增加,蛋白结构更稳定[9]。此外,低浓度多酚能够提高肌原纤维蛋白的凝胶强度[10],提高蛋清蛋白的发泡能力和泡沫稳定性[11]。但是,目前关于香辛料提取物对猪肉肌原纤维蛋白结构特性及凝胶特性有何影响的研究较少。
因此,本实验通过添加肉制品中常用的3 种香辛料(迷迭香、丁香、肉桂)提取物于猪肉肌原纤维蛋白中,并测定肌原纤维蛋白的溶解度、表面疏水性、总巯基含量和凝胶特性等指标,以研究香辛料提取物对猪肉肌原纤维蛋白结构和凝胶特性的影响,从而为香辛料在肉及肉制品中的应用提供一定的理论参考。
1.1 材料与试剂
新鲜猪肉背最长肌 锦州大润发超市。
丁香、肉桂、迷迭香 锦州同治大药房;磷酸二氢钠、磷酸氢二钠、乙二胺四乙酸二钠、氢氧化钠、溴酚蓝、甘氨酸、三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、尿素、5,5-二硫代二硝基苯甲醇、酒石酸钾钠、硫酸铜、盐酸等试剂均为国产分析纯。
1.2 仪器与设备
Allegra 64R冷冻离心机 美国Beckman公司;FE20 pH计、JB/7534 电子天平 梅特勒-托利多仪器(上海)有限公司;T25数显型均质机 德国IKA集团;UV-2550紫外-可见光分光光度计 日本Shimadzu公司;FW-200高速万能粉碎机 北京中兴伟业仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;TA-XT2i质构仪 英国Stable Micro Systems公司;Discovery DHR-1流变仪 美国TA公司;DHG-9055A电热鼓风干燥箱 上海一恒科学仪器有限公司;HHS电热恒温水浴锅 山西省文水医疗器械厂。
1.3 方法
1.3.1 香辛料提取物的制备
香辛料提取按照张慧芸等[12]的方法并稍作修改。将香辛料洗净并放置于45 ℃鼓风干燥箱中烘干,FW-200高速万能粉碎机粉碎后,准确称取50 g于1 000 mL带盖的三角烧瓶中,并加入400 mL 95%的乙醇置于55 ℃恒温培养摇床(110 r/min)提取12 h,用滤纸过滤,残渣再用200 mL 95%乙醇重提12 h后过滤,合并滤液用旋转蒸发仪55 ℃、0.08 MPa真空浓缩后进行冷冻干燥,得到提取物进行提取率的计算并保存于4 ℃冰箱中备用。最终迷迭香、丁香和肉桂等香辛料的提取率分别为21.28%、14.38%和14.7%。
1.3.2 肌原纤维蛋白提取及样品的制备
肌原纤维蛋白提取按照Park等[13]的方法进行。蛋白质质量浓度用双缩脲法测定[14],并利用牛血清白蛋白作为标准蛋白。
配制肌原纤维蛋白溶液,使其终质量浓度为40 mg/mL。随后分别添加3 组不同添加量的丁香、桂皮和迷迭香(0.005、0.010、0.020 g/g pro),以未加香辛料的肌原纤维蛋白作为对照组。样品均在4 ℃条件下反应12 h。
1.3.3 蛋白质总巯基含量的测定
取1 mL 10 mg/mL的蛋白质溶液加入8 mL的Tris-甘氨酸,均质,10 000 r/min离心15 min除去不溶性蛋白。取上清液4.5 mL与0.5 mL 10 mmol的Ellman试剂反应,对照组为4.5 mL的Tris-甘氨酸代替上清液,混合均匀后静置30 min,在412 nm波长处测定吸光度。总巯基含量的计算如式(1)所示。
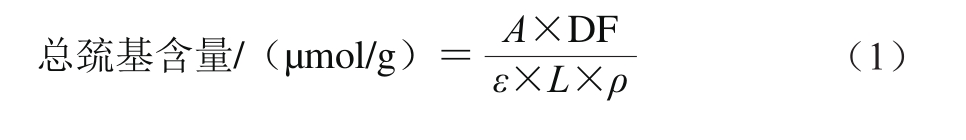
式中:A为样品412 nm波长处吸光度;DF为稀释倍数;ε为摩尔吸光系数(13 600 mol−1·cm−1);L为光程/cm;ρ为蛋白质量浓度/(mg/mL)。
1.3.4 蛋白质表面疏水性的测定
参照Chelh等[15]的方法,将肌纤维蛋白溶于pH 7.0磷酸盐缓冲溶液,制备质量浓度为5 mg/mL的蛋白质溶液,取1 mL蛋白溶液加入200 μL的1 mg/mL溴酚蓝,用涡流漩涡混合器充分混合,然后在6 000 r/min条件下离心15 min,取上清液稀释10 倍,在595 nm波长处测定吸光度,以未加蛋白溶液的磷酸盐缓冲溶液作为对照组。溴酚蓝结合量按照式(2)计算,以溴酚蓝结合量表征表面疏水性。
1.3.5 蛋白质溶解性的测定
参照Joo等[16]的方法并略加修改。用pH 7.0的磷酸盐缓冲溶液配制10 mg/mL的蛋白质溶液,取3 mL于10 mL离心管中,于4 ℃的冰箱放置2 h后,在10 000 r/min 、4 ℃条件下冷冻离心20 min。取上清液1 mL,对照取1 mL蒸馏水,采用双缩脲法测定蛋白质的质量浓度。溶解性计算如式(3)所示。
式中:ρ1为上清液蛋白质量浓度/(mg/mL);ρ2为离心前蛋白质量浓度/(mg/mL)。
1.3.6 蛋白质热诱导凝胶的制备
将40 mg/mL的蛋白质溶液装入密闭的玻璃瓶中(25 mm×40 mm),每个玻璃瓶中加入10 g(高度约5 cm)蛋白质溶液,每组3 个平行,放入恒温水浴锅内从25 ℃加热到80 ℃后保持30 min,制备好的凝胶在室温条件下放置1 h后,放入2~4 ℃的冰箱中备用。在进行凝胶特性分析之前,要从冰箱中取出放在室温条件下(25~27 ℃)静置30 min。
1.3.7 凝胶强度的测定
肌原纤维蛋白凝胶质构特性的测定采用TA-XT Plus型质构分析仪。质构分析仪采用的参数如下:测定模式选择下压距离,测试前速率为5 mm/s,测试速率为2 mm/s,测试后速率为2 mm/s,下压距离为凝胶高度4 mm,引发力为5 g,探头型号选择P/0.5。将待测样品置于测定平台上固定好,在室温条件下进行测定。
1.3.8 动态流变学测定
用Discovery DHR-1流变仪测定样品的动态学特性。首先将制备好的蛋白质溶液均匀涂布于测试平台,赶走气泡。测试参数为:频率0.1 Hz,应变力为2%,上下夹缝为1 mm,起始温度30 ℃,升温速率为1 ℃/min,终止温度80 ℃。测定过程中,平板外蛋白与空气接触,使用保护盖进行密封。每组3 个重复。测定指标为流变的弹性模量G’。1.4 统计分析
每个指标测3 次平行,实验重复3 次,结果表示为 ±s。数据统计分析采用SPSS 19.0软件中的Linear Models程序进行处理,差异显著性(P<0.05)分析采用LSD程序。作图使用Sigmaplot 12.0软件。
±s。数据统计分析采用SPSS 19.0软件中的Linear Models程序进行处理,差异显著性(P<0.05)分析采用LSD程序。作图使用Sigmaplot 12.0软件。
2.1 香辛料提取物对肌原纤维蛋白总巯基含量的影响
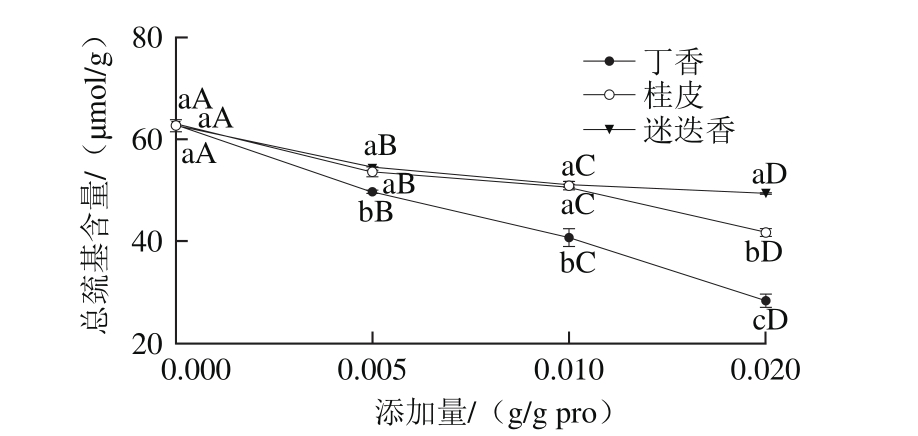
图1 香辛料提取物对肌原纤维蛋白总巯基含量的影响
Fig. 1 Effect of spice extracts on total thiols content of myof i brillar protein
小写字母不同表示同一添加量不同香辛料之间差异显著(P<0.05);大写字母不同表示同一香辛料不同添加量之间差异显著((P<0.05)。下同。
蛋白质氨基酸侧链上的巯基反应活性很高,可转化为分子内或分子间二硫键,因此,有必要研究香辛料提取物是否会与巯基发生作用。由图1可知,与不添加提取物的对照组相比,总巯基含量随着3 种香辛料提取物添加量的增加而显著降低(P<0.05),且不同香辛料使总巯基含量降低的速率也不相同,其中丁香处理组的总巯基含量下降得最快,添加量为0.005、0.010、0.020 g/g pro时,均显著低于桂皮和迷迭香处理组(P<0.05),而桂皮和迷迭香两处理组只有在添加量为0.02 g/g pro时差异显著(P<0.05),桂皮处理组的总巯基含量较低。
有研究表明,酚类化合物可以与肌原纤维蛋白中的巯基发生作用,如咖啡酸、儿茶素、阿魏酸和单宁酸中的酚羟基能与鱼肉肌原纤维蛋白中的巯基相互作用,从而导致总巯基含量降低[17],这与本研究的结果相似。高浓度的绿茶提取物能与猪肉肌原纤维蛋白中的巯基发生共价交联,生成巯基-醌加成物,从而阻止了蛋白质之间交联形成二硫键[18]。绿茶提取物和迷迭香提取物均导致蛋白质巯基含量降低,其中绿茶提取物的效果更明显,是由于儿茶素是绿茶提取物的主要成分,儿茶素中邻苯二酚结构中含有多个酚羟基,酚羟基可以与蛋白质巯基相互作用,从而促进蛋白质交联,而迷迭香提取物中主要成分为鼠尾草酚和鼠尾草酸,二者均只含一个能与巯基结合的位点[5],这可能也是本研究中迷迭香处理组的总巯基含量降低较少的原因。
2.2 香辛料提取物对肌原纤维蛋白表面疏水性的影响

图2 香辛料提取物对肌原纤维蛋白表面疏水性的影响
Fig. 2 Effect of spice extracts on surface hydrophobicity of myof i brillar protein
表面疏水性是影响蛋白质乳化凝胶特性的另一个重要因素,能够反映蛋白质分子表面疏水性氨基酸的相对含量,而极性和非极性氨基酸达到较好的平衡有利于蛋白质具有更好的乳化凝胶性质[19]。由图2可以看出,随着添加量的增加,3 种香辛料提取物处理组的表面疏水性都呈现先升高后降低的趋势。低添加量时,表面疏水性升高,说明香辛料提取物导致蛋白质结构展开,埋藏在蛋白质分子内部的疏水性氨基酸残基暴露[20],并且疏水性的增加还说明蛋白质的稳定性降低,蛋白质分子之间更容易发生聚集[21]。当添加量增加至0.020 g/g pro时,各香辛料处理组的表面疏水性均最低,且各组之间差异不显著(P>0.05),可能是因为高添加量的提取物促进了蛋白质之间的交联使其分子内发生聚集,蛋白质结构折叠,掩盖了一些非极性氨基酸,因此导致了其疏水性的下降[22]。此外,一般认为多酚-蛋白质复合物是通过氨基酸侧链和多酚芳香环之间各种弱作用力维系的,其中主要是疏水作用,这说明多酚和蛋白质的结合主要发生在暴露的疏水性表面,并且氢键结合能够起到补充的作用,使复合物的结构更加稳定[23]。因此,本研究中,高添加量香辛料提取物使肌原纤维蛋白的疏水基团充分暴露,有利于提取物与蛋白质发生疏水相互作用,从而导致蛋白可结合的溴酚蓝含量减少,表面疏水性降低。在研究乌饭树叶色素与大米蛋白相互作用时,也发现蛋白质的表面疏水性降低,说明色素多酚能够与蛋白质的疏水性氨基酸残基结合形成新复合物[24]。同样,与未添加茶多酚的大黄鱼肌原纤维蛋白相比,添加茶多酚掩盖了蛋白质表面的疏水位点,从而使大黄鱼肌原纤维蛋白表面疏水性降低[5,25]。并且不同香辛料提取物对疏水性影响的效果也不相同,主要是由于不同提取物的主要成分不同。丁香和迷迭香处理组的表面疏水性在添加量为0.020 g/g pro时开始降低,而桂皮处理组在添加量为0.010 g/g pro时就已降低,可能是由于桂皮提取物使蛋白质疏水基团暴露的过快,暴露的疏水基团之间发生作用,蛋白质折叠,从而使疏水性较早降低。
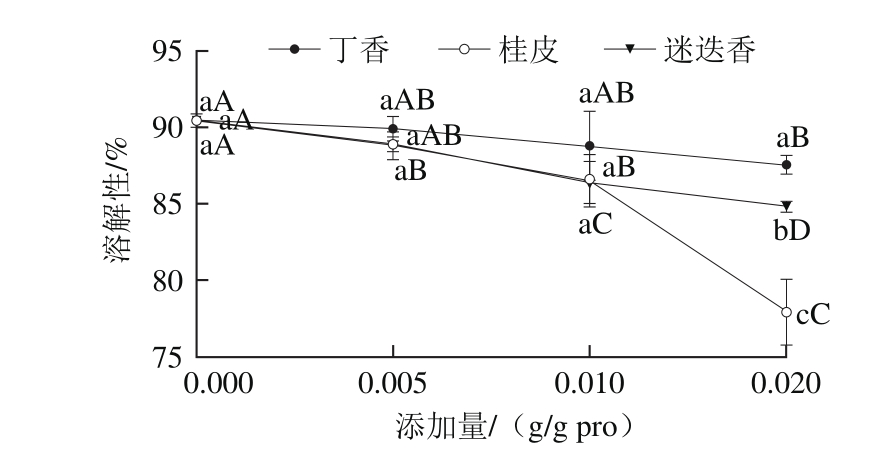
图3 香辛料提取物对肌原纤维蛋白溶解性的影响
Fig. 3 Effect of spice extracts on solubility of myof i brillar protein
2.3 香辛料提取物对肌原纤维蛋白溶解性的影响蛋白质的大多数功能性质与其溶解性相关,只有在高度溶解状态时其功能性质才能表现出来,如凝胶性质等[26],因此,研究了香辛料提取物对蛋白质溶解性的影响。由图3可知,3 种香辛料处理组与对照组相比,溶解性均有不同程度的降低。溶解性降低可能是由于蛋白质有序的三维结构受到破坏,蛋白质的水合能力下降。有研究发现,二硫键的形成导致了肌球蛋白重链的聚合[27],
而本研究证实肌原纤维蛋白的巯基能够与香辛料提取物发生相互作用,因此,这可能也是导致溶解度降低的原因。此外,不同提取物对溶解性的影响程度也不相同。丁香处理组的溶解性与其他两种香辛料相比,下降得较为缓慢,但在添加量为0.005 g/g pro和0.010 g/g pro时,3 种香辛料处理组之间差异不显著(P>0.05)。在添加量为
0.020 g/g pro时,桂皮处理组溶解性最低,其次是迷迭香处理组,最后是丁香处理组,各组之间差异显著(P<0.05)。总的来看,添加3 种香辛料提取物后,并没有提高蛋白质的溶解性,反而溶解性不同程度地降低,因此添加这3 种香辛料并没有起到改善其溶解性的效果。
2.4 香辛料提取物对肌原纤维蛋白凝胶强度的影响

图4 香辛料提取物对肌原纤维蛋白凝胶强度的影响
Fig. 4 Effect of spice extracts on gel strength of myof i brillar protein
凝胶特性是肉及肉制品加工中最重要的功能特性,在动物蛋白质中,肌原纤维蛋白的热诱导凝胶能力最强[28]。肌原纤维蛋白诱导凝胶的三维立体网状结构对脂肪和水可以起到稳定效果,从而改善肉及肉制品的品质。由图4可知,随着添加量的增加,3 种香辛料处理组的凝胶强度均表现为先上升后下降的趋势。当添加量为0.005 g/g pro和0.010 g/g pro时,丁香和桂皮处理组的凝胶强度差异不显著(P>0.05),但都显著低于迷迭香处理组(P<0.05),添加量为0.020 g/g pro时,迷迭香、桂皮、丁香处理组的凝胶强度依次显著降低(P<0.05)。形成和维持蛋白质凝胶的作用力通常是非共价键交联,如疏水相互作用、氢键、静电相互作用,除此之外,也有如二硫键这种共价键的相互作用力,说明凝胶强度降低也可能是由于维持和形成凝胶的作用力发生了变化,但是也可能是由于香辛料的添加量过高,破坏了蛋白质分子之间的交联作用。Cao Yungang等[10]研究发现低浓度的绿原酸使蛋白质进一步展开,更多地参与聚集和凝胶化,从而利于凝胶网络结构的形成,而高浓度的绿原酸添加下,蛋白形成的凝胶较弱。添加0.5%的多酚能提高乳清浓缩蛋白WPC35凝胶的硬度和黏着性,而多酚浓度继续增加,硬度和黏着性反而下降,这是由于乳清蛋白表面覆盖较多多酚,导致蛋白之间发生聚集形成凝胶的能力变弱[23]。这与本实验的结果一致。
对于迷迭香提取物的3 组不同添加量,其凝胶强度均显著高于对照组(P<0.05),说明迷迭香提取物与肌原纤维蛋白交联,更有利于凝胶网络结构的形成。von Staszewski等[29]发现茶多酚可以加速β-乳球蛋白凝胶的形成,其原因可能是由于蛋白质聚合作用加快或者蛋白质热稳定性的降低引起的。而桂皮提取物在添加量为0.010 g/g pro时,凝胶强度与对照组相比显著增加(P<0.05),说明在此添加量下,桂皮可以较好地发挥作用,而高添加量的桂皮导致凝胶强度下降,说明过多的桂皮提取物阻碍了蛋白质凝胶网络结构的形成。而丁香在0.005 g/g pro和0.010 g/g pro时,凝胶强度与对照组相比差异均不显著(P>0.05),且在高添加量下显著低于对照组(P<0.05),说明丁香对蛋白质凝胶强度的改善作用没有桂皮和迷迭香的效果好。
2.5 香辛料提取物对肌原纤维蛋白流变性质的影响
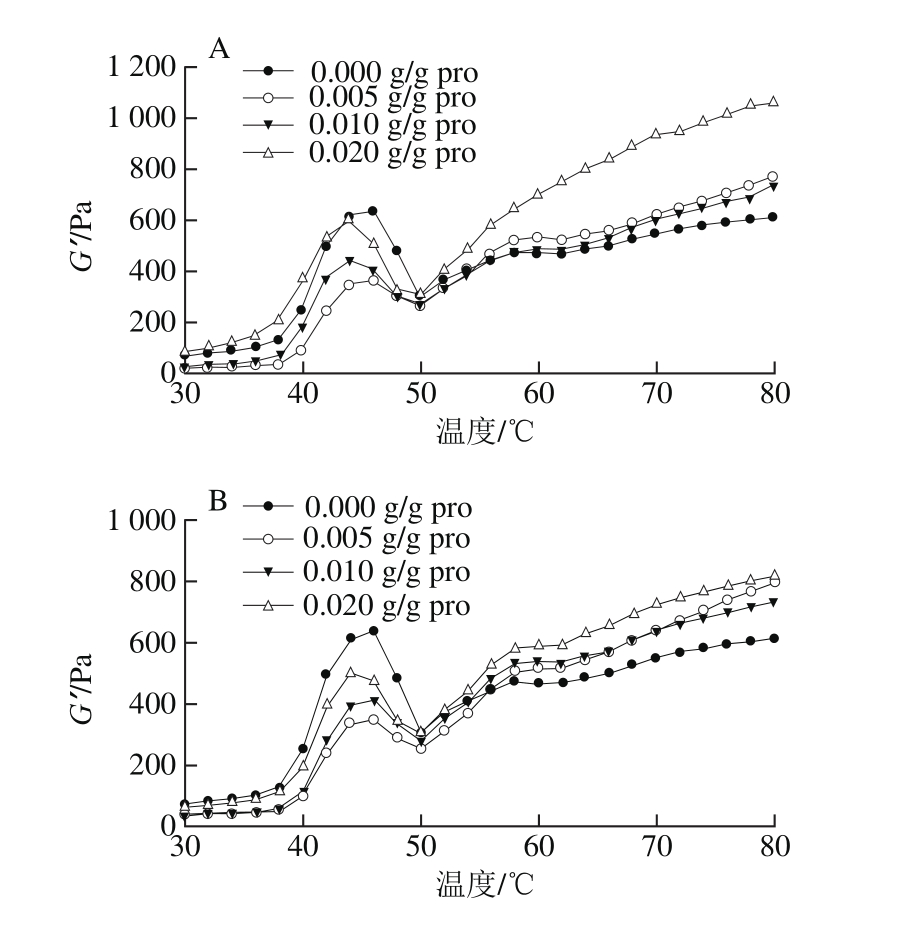
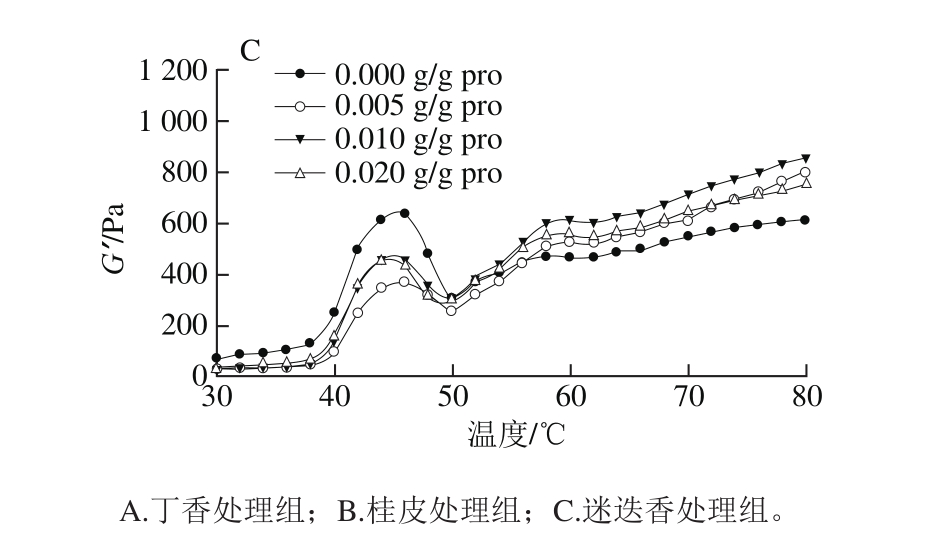
图5 香辛料提取物对肌原纤维蛋白流变特性的影响
Fig. 5 Effect of spice extracts on rheological properties of heat-induced myof i brillar protein gels
热处理导致蛋白质发生物理和化学变化,进一步引起内部结构的变化,蛋白质最终形成有黏弹性的热诱导凝胶[30]。同时,蛋白质的凝胶行为及其流变性质是形成食品独特质构、感官和风味的决定性因素。由图5可以看出,对照组的肌原纤维蛋白加热后G’缓慢增加,直到46 ℃,此时G’发生了第一阶段的变化,达到峰值温度,被称为“凝胶形成”,这一阶段的变化是由肌球蛋白头部S1亚基变性引起的。46~50 ℃范围内,G’急剧下降,被称为“凝胶弱化”,由于肌球蛋白尾部从螺旋变卷曲,这一变化可能会破坏某些已经形成蛋白质网络。随后G’一直上升,直至60 ℃第二次达到峰值,G’开始了第二阶段的变化,被称为“凝胶加强”,主要是因为大多数肌球蛋白分子可能已经展开,成为随机线圈结构,增强了蛋白质之间的交联,从而产生一个坚固且不可逆的凝胶结构[31-32]。
由图5可知,3 种香辛料处理组的流变曲线均呈现典型的“几”字形状。在“凝胶形成”阶段(40~46 ℃),丁香、桂皮和迷迭香处理组的G’均逐渐增加,蛋白凝胶网络开始形成,但是均小于对照组,说明蛋白之间作用力减弱。当达到50 ℃以后,3 种香辛料处理组的G’均高于对照组,说明在凝胶加强阶段,香辛料促进了蛋白质形成凝胶的能力。有研究表明,向乳清浓缩蛋白WPC35中添加不同浓度茶多酚制备凝胶(pH 6.0),随着茶多酚添加量的增加,凝胶形成的起始温度降低,G’增加,说明多酚能促进蛋白凝胶形成[23],这与本实验的结果相一致。对于不同添加量的提取物来说,0.020 g/g pro迷迭香处理的G’相对降低,这与前面凝胶强度的结果相符,而丁香处理组和桂皮处理组的G’随着添加量的增加而增加,但高添加量时的凝胶强度却降低。有研究发现,加入中、低浓度的绿原酸后,肌原纤维蛋白凝胶的G’显著增加,但是相应的凝胶强度变化却并不大[10],这也与本研究的结果相类似,其原因可能是由于不同提取物的主要成分不尽相同,因此与肌原纤维蛋白的作用力和作用方式不同,对流变特性产生的影响也不同。
不同香辛料提取物对猪肉肌原纤维蛋白结构性质及凝胶特性具有不同影响。3 种香辛料提取物均降低了总巯基含量;表面疏水性先增加后降低;溶解性逐渐降低;低、中添加量提取物有利于凝胶强度提高,而高添加量提取物降低了凝胶强度;不同添加量的提取物均不同程度地提高了蛋白的流变特性。今后,还需进一步研究不同香辛料提取物对蛋白结构和功能特性具有不同影响的原因,分析其主要成分与蛋白的其他作用力(如二硫键、氢键等)、作用位点等,明确二者相互作用的方式。
参考文献:
[1] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-543. DOI:10.1016/ j.meatsci.2006.02.005.
[2] BABUSKIN S, BABU P A S, SASIKALA M, et al. Antimicrobial and antioxidant effects of spice extracts on the shelf life extension of raw chicken meat[J]. International Journal of Food Microbiology, 2014, 171: 32-40. DOI:10.1016/j.ijfoodmicro.2013.11.011.
[3] SEBAALY C, JRAIJ A, FESSI H, et al. Preparation and characterization of clove essential oil-loaded liposomes[J]. Food Chemistry, 2015, 178: 52-62. DOI:10.1016/j.foodchem.2015.01.067.
[4] 陈璐. 香辛料提取物在肉糜制品中抗氧化效果的研究[D]. 哈尔滨:东北农业大学, 2012: 11-12.
[5] JONGBERG S, TØRNGREN M A, GUNVIG A, et al. Effect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science, 2013, 93(3): 538-546. DOI:10.1016/j.meatsci.2012.11.005.
[6] SHI C, CUI J Y, YIN X F, et al. Grape seed and clove bud extracts as natural antioxidants in silver carp (Hypophthalmichthys molitrix) fi llets during chilled storage: effect on lipid and protein oxidation[J]. Food Control, 2014, 40: 134-139. DOI:10.1016/j.foodcont.2013.12.001.
[7] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International, 2013, 51(2): 954-970. DOI:10.1016/j.foodres.2013.02.009.
[8] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk αand β-caseins with tea polyphenols[J]. Food Chemistry, 2011, 126(2): 630-639. DOI:10.1016/j.foodchem.2010.11.087.
[9] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3): 1046-1055. DOI:10.1016/j.foodchem.2011.01.079.
[10] CAO Yungang, XIONG Youling L.. Chlorogenic acidmediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243. DOI:10.1016/ j.foodchem.2015.02.036.
[11] WU W G, CLIFFERD M, HOWELL N K. The effect of instant green tea on the foaming and theological properties of egg albumen proteins[J]. Science of Food and Agriculture, 2007, 87(10): 1810-1819. DOI:10.1002/jsfa.2809.
[12] 张慧芸, 孔保华, 孙旭. 香辛料提取物抗氧化活性及其作用模式的研究[J]. 食品科学, 2010, 31(5): 111-115.
[13] PARK D, XIONG Youling L., ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myof i brillar protein[J]. Food Chemistry, 2007, 101(3): 1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[14] 张龙翔, 张庭芳, 李令媛, 等. 生物化学实验方法和技术[M]. 2版.北京: 高等教育出版社, 1997: 136-137.
[15] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/ j.meatsci.2006.05.019.
[16] JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myof i brillar protein solubility to colour and waterholding capacity in porcine longissimus muscle[J]. Meat Science, 1999, 52(3): 291-297. DOI:10.1016/j.meatsci.2006.05.019.
[17] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/ j.ijbiomac.2012.07.010.
[18] JONGBERG S, TERKELSEN L S, MIKLOS R, et al. Green tea extract impairs meat emulsion properties by disturbing protein disulf i de cross-linking[J]. Meat Science, 2015, 100: 2-9. DOI:10.1016/ j.meatsci.2014.09.003.
[19] MOHAN M, RAMACHANDRAN D, SANKAR T V, et al. Physicochemical characterization of muscle proteins from different regions of mackerel (Rastrelliger kanagurta)[J]. Food Chemistry, 2008, 106(2): 451-457. DOI:10.1016/j.foodchem.2007.05.024.
[20] PACIFICI R E, KONO Y, DAVIES K J. Hydrophobicity as the signal for selective degradation of hydroxyl radical-modified hemoglobin by the multicatalytic proteinase complex, proteasome[J]. Journal of Biological Chemistry, 1993, 268(21): 15405-15411.
[21] XIA X F, KONG B H, XIONG Youling L., et al. Decreased gelling and emulsifying properties of myof i brillar protein from repeatedly frozenthawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science, 2010, 85(3): 481-486. DOI:10.1016/j.meatsci.2010.02.019.
[22] SHI Y, LI R Y, TU Z C, et al. Effect of γ-irradiation on the physicochemical properties and structure of fi sh myof i brillar proteins[J]. Radiation Physics and Chemistry, 2015, 109: 70-72. DOI:10.1016/j.radphyschem.2014.12.016.
[23] VON STASZEWSKI M, JAGUS R J, PILOSOF A M R. Influence of green tea polyphenols on the colloidal stability and gelation of WPC[J]. Food Hydrocolloids, 2011, 25(5): 1077-1084. DOI:10.1016/ j.foodhyd.2010.10.004.
[24] WANG L, XU Y, ZHOU S M, et al. Interaction between Vaccinium bracteatum Thunb. leaf pigment and rice proteins[J]. Food Chemistry, 2016, 194: 272-278. DOI:10.1016/j.foodchem.2015.08.006.
[25] ZHAO J, LÜ W J, WANG J L, et al. Effects of tea polyphenols on the post-mortem integrity of large yellow croaker (Pseudosciaena crocea) fi llet proteins[J]. Food Chemistry, 2013, 141(3): 2666-2674. DOI:10.1016/j.foodchem.2013.04.126.
[26] RINCÓN F, MARTÍNEZ B, PÉREZ-OLMOS R, et al. The roles of pH extraction and colloidal protein solubility in the optimization of spectrophotometric nitrite determination in meat products via response surface methodology[J]. Meat Science, 2008, 80(3): 744-752. DOI:10.1016/j.meatsci.2008.03.016.
[27] VISSCHERS R W, DE JONGH H H J. Disulphide bond formation in food protein aggregation and gelation[J]. Biotechnology Advances, 2005, 23(1): 75-80. DOI:10.1016/j.biotechadv.2004.09.005.
[28] LEFEVRE F, FAUCONNEAU B, OUALI A, et al. Thermal gelation of brown trout myofibrils from white and red muscles: effect of pH and ionic strength[J]. Journal of the Science of Food and Agriculture, 2002, 82(4): 452-463. DOI:10.1002/jsfa.1057.
[29] VON STASZEWSKI M, JARA F L, RUIZ A L T G, et al. Nanocomplex formation between β-lactoglobulin or caseinomacropeptide and green tea polyphenols: impact on protein gelation and polyphenols antiproliferative activity[J]. Journal of Functional Foods, 2012, 4(4): 800-809. DOI:10.1016/j.jff.2012.05.008.
[30] 陈文博. 肌原纤维蛋白热诱导凝胶形成机制研究[D]. 南京: 南京农业大学, 2010: 16-18.
[31] XIONG Youling L., SRINIVASAN S, LIU G. Modif i cation of muscle protein functionality by antioxidants[M]// COHEN I R, LAJTHA A, LAMBRIS J D, et al. Advances in Experimental Medicine and Biology. 1997, 415: 95-108. DOI:10.1007/978-1-4899-1792-8_7.
[32] WU M G, XIONG Youling L., CHEN J, et al. Rheological and microstructural properties of porcine myofibrillar protein-lipid emulsion composite gels[J]. Journal of Food Science, 2009, 74(4): E207-E217. DOI:10.1111/j.1750-3841.2009.01140.x.
Inf l uence of Three Different Spice Extracts on Functional Characteristics of Pork Myof i brillar Protein
LIU Dan, JIA Na*, YANG Lei, MIAO Zhuang, LIU Dengyong, LI Ruren
(National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, College of Food Science and Technology, Bohai University, Jinzhou 121013, China)
Abstract:This paper reports the effect of rosemary, clove and cinnamon extracts (0.005, 0.010 and 0.020 g/g protein) added to pork myof i brillar protein, respectively on total thiols content, surface hydrophobicity, solubility, gel strength and rheological properties. The results showed that all spice extracts reduced the total thiols content and solubility of pork myof i brillar protein. The surface hydrophobicity increased fi rst and then decreased with increasing addition of the spice extracts. At the fi nal stage of heating, the elasticity modulus (G’) of all of the three additions was higher when compared with the control. Low and medium concentrations of the spice extracts were benef i cial for gel strength enhancement and gel formation. However, the addition of high concentration of the spice extracts was detrimental for the gelation of myof i brillar protein. Therefore, the interactions between spice extracts and myof i brillar protein have an impact on protein structure and gel properties.
Key words:spice extracts; pork; myof i brillar proteins; functional characteristics
DOI:10.7506/spkx1002-6630-201715003
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2017)15-0014-06
引文格式:
刘丹, 贾娜, 杨磊, 等. 3 种不同香辛料提取物对猪肉肌原纤维蛋白功能特性的影响[J]. 食品科学, 2017, 38(15): 14-19.
DOI:10.7506/spkx1002-6630-201715003. http://www.spkx.net.cn
LIU Dan, JIA Na, YANG Lei, et al. Influence of three different spice extracts on functional characteristics of pork myof i brillar protein[J]. Food Science, 2017, 38(15): 14-19. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715003. http://www.spkx.net.cn
收稿日期:2016-06-23
基金项目:国家自然科学基金青年科学基金项目(31301509)
作者简介:刘丹(1992—),女,硕士研究生,研究方向为肉品加工及质量控制。E-mail:ld625120847@163.com
*通信作者:贾娜(1982—),女,副教授,博士,研究方向为肉品加工及质量控制。E-mail:jiana_2010@163.com