陈 婵,黄 茜*,李珊珊,马美湖
(华中农业大学食品科学技术学院,湖北 武汉 430070)
摘 要:通过化学共沉法和表面功能化修饰得到硫酸软骨素钠和Fe3+负载的磁性纳米粒子Fe3O4-CS@Fe3+(CMNP@Fe3+),并对该粒子的形貌等特性进行分析。透射电子显微镜观察显示CMNP@Fe3+呈尺寸为20 nm的圆球形,分散性较好;磁滞回线结果表明该粒子具有超顺磁性;傅里叶变换红外光谱测定证明硫酸软骨素钠和Fe3+已成功修饰在Fe3O4表面。利用磁性纳米粒子表面Fe3+与卵黄高磷蛋白的强结合力,建立从蛋黄中磁性分离卵黄高磷蛋白的新方法,并对吸附过程的影响因素进行研究。结果发现当溶液pH 4.0、底物初始质量浓度10 mg/mL、吸附时间180 min时,磁性纳米粒子的吸附能力最强。利用动力学模型和等温吸附模型进行拟合,确定CMNP@Fe3+吸附卵黄高磷蛋白的过程符合伪二级动力学模型和Freundlich等温吸附模型,并通过模型计算得到吸附平衡时卵黄高磷蛋白的理论吸附量为625.00 mg/g。该研究结果为鸡蛋中蛋白质实现磁性分离提供了依据。
关键词:卵黄高磷蛋白;磁性纳米粒子;磁性分离;硫酸软骨素;铁离子
鸡蛋蛋黄分为蛋黄浆质和蛋黄颗粒两个部分,卵黄高磷蛋白(phosvitin,PV)是蛋黄中主要的磷蛋白,通过磷酸钙桥与卵黄脂磷蛋白结合,以复合物的形式存在于蛋黄颗粒中。含量占卵黄蛋白质的4%,氨基酸残基含量217 个,其中丝氨酸124 个,占总氨基酸的56%[1-2]。PV 80%以上的丝氨酸被磷酸化,带大量负电荷,因此对金属离子有很强的亲和力,能够螯合Fe3+、清除自由基产生抗氧化的效果[3-4],同时在生物矿化中起到调控作用,具有多种生物学功能[5-6]。
从蛋黄中分离PV,首先需要利用高盐溶液将磷酸钙桥打断[7]。因此,PV的分离提取方法主要由盐析法联合其他方法组成。盐析法联合离子交换色谱法是利用10% NaCl溶液对蛋黄颗粒进行盐析后,再用阴离子交换柱纯化,此时PV的回收率达到82.7%[8]。若经过低浓度盐溶液和高浓度盐溶液两步盐析后,采用聚乙二醇6000(PEG 6000)沉淀蛋白,再用阴离子交换柱纯化,此时得到的PV纯度达到99%[9]。这种方法能获得高纯度的蛋白,但反复盐析、透析的过程十分费时,不利于大规模的工业化生产。由于PV具有良好的热稳定性,有研究利用高浓度盐溶液盐析和90 ℃热辅助提取PV。这种方法环保健康,也能获得较大的蛋白提取量,只是蛋白的纯度都在90%以下[10-11]。盐析联合超滤法提取则是使用10% NaCl溶液对蛋黄颗粒进行处理后,经过10 kD和30 kD的超滤膜浓缩、脱盐,收集得到的PV经过变性凝胶电泳——十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测,除了目标蛋白条带外,还有其他蛋白条带[12]。此外还可以利用乙醇溶液两次处理蛋黄颗粒,再使用盐溶液盐析提取PV[13]。这种方法能够在盐析前除去大部分脂蛋白。
PV含有大量磷酸化的丝氨酸,使分子携带负电荷,对金属阳离子有很强的亲和力,结合后非常稳定[14],其中以Fe3+与PV的结合能力最强,即使在110 ℃条件下加热20~40 min,螯合的Fe3+也不会释放出来。这种螯合金属离子能力超过了柠檬酸、转铁蛋白,只有利用乙二胺四乙酸才能使PV螯合的Fe3+释放[15-16]。由于PV在食品加工、化妆品、生物材料等领域有很大的市场潜力,因此,利用Fe3+与PV的强结合力,建立一种PV的提取方法很有意义。
采用磁性纳米粒子(magnetic nanoparticles,MNPs)为辅助,进行分离纯化的方法,近年来也有较多的研究。银杏酸、黄岑中黄酮类、环三萜类化合物等都是具有邻位酚羟基和羧基结构的天然成分。这种结构的化合物能够被Fe3O4纳米粒子进行特异性吸附,再利用不同的洗脱液进行洗脱,就能得到不同的目标成分[17-18]。Fe3O4@SiO2@MIP纳米粒子磁性分离紫衫中的4 种紫杉烷化合物并进行洗脱收集,能够为紫杉烷类抗肿瘤、抗癌药物生产提供大量原料,降低了原料提取的时间成本和经济成本[19]。磁性分离还能够应用于蛋白质组学研究中低丰度蛋白质或多肽的提取,解决低含量物质难以提取的问题,Ti4+-NTA-PEG@Fe3O4能高效富集酪蛋白水解磷酸肽[20]。其中利用磁性微球进行分离提取磷酸肽已有报道[21],但是磁性微球对PV的分离鲜有报道。本实验利用PV与Fe3+的强结合特性,应用表面修饰Fe3+的MNPs联合盐析进行前处理,构建一种PV磁性分离的新方法。
1.1 材料与试剂
鸡蛋原料:品种为白来航,以产蛋48 h以内的新鲜鸡蛋为原料提取实验所需的蛋白质。
七水硫酸亚铁、六水氯化铁、氯化钠、PEG 6000、乙酸钠、冰醋酸、无水乙醇、氨水、咪唑(均为分析纯)国药集团化学试剂有限公司;硫酸软骨素钠(sodium chondroitin sulfate,CS) 日本TCI公司;SDS-PAGE凝胶制备试剂盒 谷歌生物公司;PV纯品按照实验室的方法自制[7]。
1.2 仪器与设备
ALPHA 1-4真空冷冻干燥机 德国Christ公司;3-30K高速冷冻离心机 德国Sigma公司;NanoDrop 2000紫外分光光度计 美国Thermo公司;RF-5301荧光分光光度计 日本岛津公司; D8 Advance X-射线衍射仪德国Bruker公司;Nexus 470傅里叶变换红外光谱仪美国梅特勒-托利多公司;ZHWY-2102C恒温培养振荡器上海智城分析仪器有限公司;BKT-4500振动样品磁强计北京泽天伟业科技有限公司;7000FA 100kV生物透射电子显微镜 日本日立公司。
1.3 方法
1.3.1 功能化磁性纳米粒子的制备
参考张婧[22]的方法利用化学共沉法制备Fe3O4磁性纳米粒子,控制Fe2+与Fe3+的物质的量比为2∶3,加入体积分数1%的PEG 6000。即将FeSO4•7H2O和FeCl3•6H2O2溶解于水和无水乙醇体积比5∶1的水溶液,并于60 ℃恒温搅拌均匀,通氮气除氧30 min。加入体积分数30%的氨水后产生黑色颗粒沉淀,此时溶液pH>10,溶液剧烈搅拌10 min。随后迅速将温度升至80 ℃,恒温搅拌1 h。磁性分离出沉淀,多次水洗并冻干得到Fe3O4粉末。
重复上述步骤至加氨水产生黑色颗粒沉淀后,加入3% CS溶液并保持80 ℃搅拌1 h。利用强磁铁将黑色沉淀从溶液中分离出来,蒸馏水多次清洗沉淀至pH值中性,冻干得到表面修饰CS的Fe3O4-CS(CMNP)。将Fe3O4-CS分散于pH值为5.0的5 mg/mL的FeCl3溶液中,在恒温摇床作用下达到吸附平衡,多次清洗除去表面多余的溶液,真空干燥得到Fe3O4-CS@Fe3+(CMNP@Fe3+)。
1.3.2 前处理样品粗PV的制备
人工打蛋,采用分离器分离蛋清和蛋黄,将蛋黄置于滤纸上,小心滚动翻转,去除蛋黄表面残留的蛋清液及系带,用牙签刺破蛋黄膜,流出的蛋黄液收集到烧杯中。加入2 倍质量的蒸馏水稀释待用。将稀释溶液在4 ℃中磁力搅拌1 h。15 000×g冷冻离心20 min,去除上层清液,收集沉淀得到蛋黄颗粒[10]。将蛋黄颗粒悬浮于100 g/L NaCl溶液(蛋黄颗粒与NaCl溶液质量比为1∶10,pH 7.25),在4 ℃中搅拌过夜。溶液加热至85 ℃并保持20 min,随后用双蒸水透析24 h,在15 000×g冷冻离心15 min,收集上层清液,调节pH值至8.0,4 ℃搅拌1 h并再次离心收集上层清液冻干后保藏[14]。
1.3.3 磁性纳米粒子表面吸附PV
称取适量上述前处理样品,利用醋酸-醋酸钠缓冲溶液配成10 mg/mL的样品溶液(pH 4.0),取5 mL样品溶液并加入20 mg 的CMNP@Fe3+,利用涡旋振荡器混合,在30 ℃的恒温摇床中吸附120 min。用荧光分光光度计测量吸附前后样品溶液中PV的含量。
建立荧光光谱法检测溶液中的PV含量:用PV标准品配制梯度质量浓度(0.00、6.25、12.50、25.00、50.00、100.00 μg/mL)的溶液,以350 nm波长处荧光强度为基准,绘制标准曲线。CMNP@Fe3+吸附能力计算见式(1)[23]。
式中:qe为平衡吸附量/(mg/g);V为样品溶液体积/mL;ρ0为溶液初始PV质量浓度/(mg/mL);ρe为吸附平衡时溶液PV的质量浓度/(mg/mL);m为CMNP@Fe3+的质量/g。
1.3.4 功能化磁性纳米粒子表征及特性分析
1.3.4.1 透射电子显微镜观察
称取微量CMNP、Fe3O4、CMNP@Fe3+、CMNP@ Fe3+-PV,分别超声分散于乙醇中,取一滴混合液滴在铜网上,待乙醇完全挥发后,将铜网置于透射电子显微镜中观察并拍摄结果。
1.3.4.2 磁学特性分析
称取30 mg 的样品粉末(CMNP和Fe3O4),利用振动样品磁强计得到磁滞回线并计算磁化强度,施加磁场范围为-6 000~6 000 Oe。
1.3.4.3 X射线衍射分析
利用X射线衍射仪对粉末样品进行物相分析。将粉末平铺,在D8 Advance X射线衍射仪上进行衍射分析。测试条件为:Bragg-Brentano衍射几何,LynxEye阵列探测器,Ni滤波片,Cu Kα(λ=0.154 18 nm),管压40 kV,管流40 mA,步进扫描,步长0.02°,扫描速率10 °/min。
1.3.4.4 傅里叶变换红外光谱分析
将干燥样品和KBr粉末以1∶100(质量比)的比例混合,压片。红外测定Fe3O4、CS、CMNP和CMNP@Fe3+磁性纳米粒子的化学官能团,波数范围为4 000~400 cm-1。
1.3.5 溶液pH值对PV吸附量的影响
称取适量前处理样品,利用不同pH值的醋酸-醋酸钠缓冲溶液(pH值为3.0、3.5、4.0、4.5、5.0)配成质量浓度为10 mg/mL样品溶液,取5 mL样品溶液并加入20 mg的CMNP@Fe3+,利用涡旋振荡器混合,在30 ℃的恒温摇床中吸附120 min。用荧光分光光度计测量吸附前后样品溶液中PV的含量,CMNP@Fe3+的吸附能力参照式(1)计算。
1.3.6 吸附时间对PV吸附量的影响
探讨吸附时间的影响。配制pH 4.0的10 mg/mL醋酸-醋酸钠样品溶液,取5 mL样品溶液并加入20 mg的CMNP@Fe3+,利用涡旋振荡器混合,在30 ℃的恒温摇床中吸附不同时间(30、60、90、120、150、180、300 min)。用荧光分光光度计测量吸附前后样品溶液中PV的含量,CMNP@Fe3+的吸附能力参照式(1)计算。
采用吸附动力学的伪一级动力学模型和伪二级动力学模型对上述吸附过程进行分析。这两种模型的公式如下,伪一级动力学模型线性表达式为式(2)。
式中:qe为平衡吸附量/(mg/g);qt为时间t时吸附量/(mg/g);k1为伪一级动力学模型吸附速率常数。以lg(qe-qt)对t作图,通过直线的斜率和截距可以求出k1和理论平衡吸附量qe,cal。
伪二级动力学模型线性表达式见式(3)[24]。

式中:qe和qt同式(2);k2为Pseudo second-order模型吸附速率常数。以t/qt对t作图,通过直线的斜率和截距可以求出k2和理论平衡吸附量qe,cal。
1.3.7 底物初始添加质量浓度对PV吸附量的影响
设置前处理样品添加质量浓度为2、4、6、8、10、15、20 mg/mL,其他操作及反应条件同上,探讨初始底物质量浓度对PV吸附量的影响。并采用吸附等温模型Langmuir模型和Freundlich模型对吸附过程进行分析。Langmuir等温模型的线性表达见式(4)[23]。
式中:qe为平衡吸附量/(mg/g);qmax为吸附剂单分子层最大吸附量/(mg/g);ρe为吸附平衡时溶液质量浓度/(mg/L);KL为Langmuir等温吸附平衡常数/(L/mg)。以ρe/qe对ρe作图,通过直线的斜率和截距可以求出qmax和KL值。
Freundlich等温模型的线性表达见式(5)[23]。
式中:qe和ρe同式(4);KF为Freundlich等温吸附常数;1/n为吸附强度,n是常数,与吸附体系的性质有关,反映吸附剂的吸附性能。以ln qe对ln ρe作图,若得到一条直线,说明这个吸附符合Freundlich等温吸附模型,根据直线的斜率和截距求出1/n和KF。
1.3.8 吸附温度对PV吸附量的影响
其他操作及反应条件同上,探究吸附温度为20、25、30、35、40 ℃时,CMNP@Fe3+对PV的吸附量的影响。
1.3.9 磁性分离的PV凝胶电泳测定
在外加磁场的作用下将吸附了PV的CMNP@Fe3+磁性纳米粒子从溶液中分离,用纯净水清洗数次后,加入3 mL的咪唑-NaCl溶液(咪唑、NaCl浓度均为2 mol/L,pH 8.0),在37 ℃恒温摇床上进行洗脱2 h。然后在外加磁场的作用下将CMNP@Fe3+分离出来,而洗脱液经过透析后冷冻干燥,得到磁性分离的样品PV。
利用电泳的方法对磁性分离得到的PV进行鉴定。其中非变性凝胶电泳(Native-PAGE)的具体操作参考张晓维[7]的方法。
1.4 数据统计
每组实验进行3 次平行测定取平均值。
2.1 功能化磁性纳米粒子的微观形貌表征
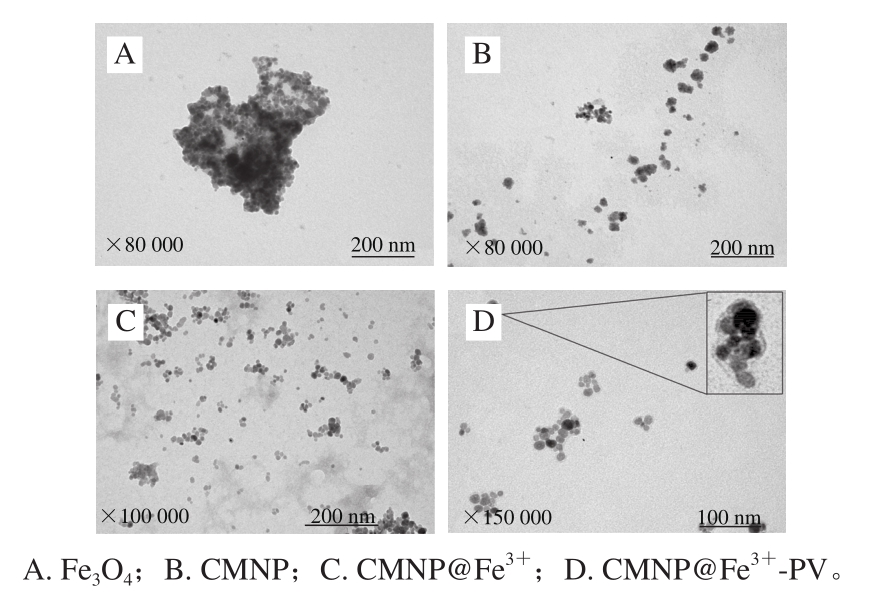
图1 磁性纳米粒子的透射电子显微镜图
Fig. 1 Transmission electron photomicrographs of magnetic nanoparticles
从图1A、B可以看到,这些磁性纳米粒子都是球形,且表面光滑。未修饰的Fe3O4粒子大量的聚集在一起,而表面修饰CS的粒子相比于Fe3O4而言分散性提高,基本为单层分散。这是由于磁性纳米粒子间存在4 种力:范德华力、磁性引力、静电排斥力和空间位阻[25]。范德华力和磁性引力是磁性纳米粒子发生团聚的作用力,而静电排斥力和空间位阻是粒子稳定存在的作用力。在纳米粒子表面进行功能性修饰能够有效地增强静电排斥力和空间位阻作用来分散、稳定磁性纳米粒子。
从图1C可以看见,经过表面功能化修饰上Fe3+后,磁性纳米粒子大部分均为规则圆形,大小较为均一,粒径一般为20 nm,表面比较光滑,分散性比起未进行修饰的裸Fe3O4粒子有了很大的改善,团聚现象大大减少。图1D为表面吸附PV后的CMNP@Fe3+透射电子显微镜图,图中显示CMNP@Fe3+以两个至十几个磁性纳米粒子相互团聚后,在表面吸附了一层物质。由于PV的高负电性,使得分子内部相互排斥,只能呈现细长分子形状,而不能形成空间球形的结构[10],因此推测图中CMNP@ Fe3+的表面覆盖的一层物质为PV分子。
2.2 功能性磁性纳米粒子的磁学性能分析

图2磁性纳米粒子的磁滞回线
Fig. 2 Hysteresis loops of magnetic nanoparticles
图2 为各种磁性纳米粒子的磁滞回线,可以看出4 条磁性纳米粒子的磁化曲线和退磁曲线重合,且4 条闭合曲线都经过原点,当磁场强度H为0 Oe时,磁感应强度为0 emu/g,即测试的样品在外加磁场存在时被磁化,当外加磁场撤去后,样品不具有磁性,说明样品具有超顺磁性[26]。未修饰的Fe3O4与表面功能化修饰CS、CMNP@Fe3+、CMNP@Fe3+-PV的饱和磁化强度略有差异,其中未修饰的Fe3O4饱和磁感应强度为83.34 emu/g,CS修饰3%的CMNP饱和磁感应强度为80.84 emu/g,CMNP@Fe3+的饱和磁感应强度为75.00 emu/g以及吸附PV的CMNP@Fe3+的饱和磁感应强度为71.80 emu/g。从上述结果中看出,未修饰的Fe3O4的饱和磁感应强度是最高的,当在裸Fe3O4表面进行一层一层的修饰包裹后,饱和磁感应强度逐渐减小,说明Fe3O4表面进行功能化修饰一定程度降低了纳米粒子的磁矩,从而降低磁化性能,使磁感应强度小。
2.3 磁性纳米粒子的晶体结构分析
采用X射线衍射对裸Fe3O4和表面修饰CS的CMNP进行晶体结构分析,结果如图3所示。在0~80°范围内能看到Fe3O4的6 个特征峰(2θ=30.2°、35.6°、43.2°、53.4°、57.1°、62.5°),分别对应Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)晶面[27]。而表面修饰CS的CMNP的谱线2θ在相同的位置(2θ=30.2°、35.6°、43.2°、57.1°、62.5°)也能观察到对应特征峰的衍射,说明表面修饰CS对磁性纳米粒子的晶型没有影响。与Fe3O4的图谱相比,CS修饰后的纳米粒子衍射强度有所降低,衍射峰宽稍微变大,这是由于在制备粒子的过程中在Fe3O4表面修饰CS,能够一定程度地阻止晶粒的进一步生长,所以生成较小粒径的颗粒[28]。
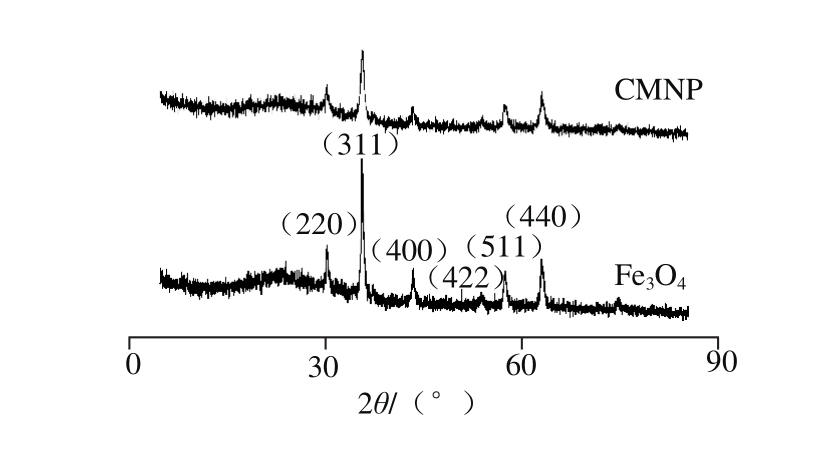
图3 磁性纳米粒子的X射线衍射光谱
Fig. 3 X-ray diffraction spectra of magnetic nanoparticles
2.4 磁性纳米粒子的傅里叶变换红外光谱分析
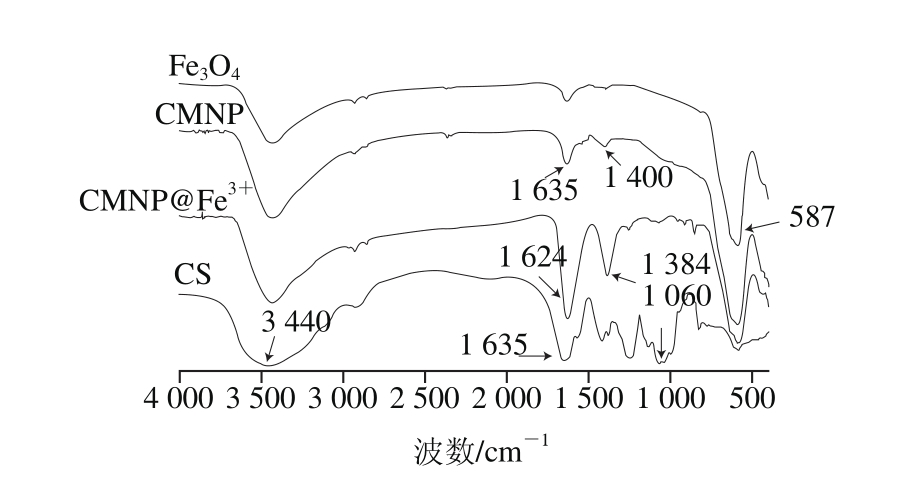
图4 磁性纳米粒子的傅里叶变换红外光谱图
Fig. 4 Infrared spectra of magnetic nanoparticles
CS中主要含有—OH、—COOH、—NH2官能基团,从图4可以看到,3 440 cm-1处为O—H和N—H的伸缩振动峰,1 635 cm-1处为C=O的反对称伸缩振动峰,1 400 cm-1处为酰胺的C—N伸缩振动峰,1 060 cm-1处为C—O的伸缩振动峰,而Fe—O的主要特征吸收峰在587 cm-1处。进行CS表面修饰修饰后的CMNP傅里叶变换红外光谱图在3 440、1 635、1 400、1 060 cm-1处都有吸收峰,说明CS已经成功修饰在Fe3O4表面。
而CMNP表面修饰Fe3+后的傅里叶变换红外光谱图在3 440、1 624、1 384、1 060、587 cm-1处有CS与Fe—O的特征峰吸收。与之前未修饰Fe3+的CMNP红外图进行比较,纳米粒子修饰Fe3+后,其中C=O对应的伸缩振动峰位置从1 635cm-1位移到1 624 cm-1,而C—N的吸收峰位置也从1 400 cm-1位移到1 384 cm-1,并且吸收增强,说明C=O和C—N参与了Fe3+的偶联[29]。
2.5 溶液pH值对PV吸附量的影响
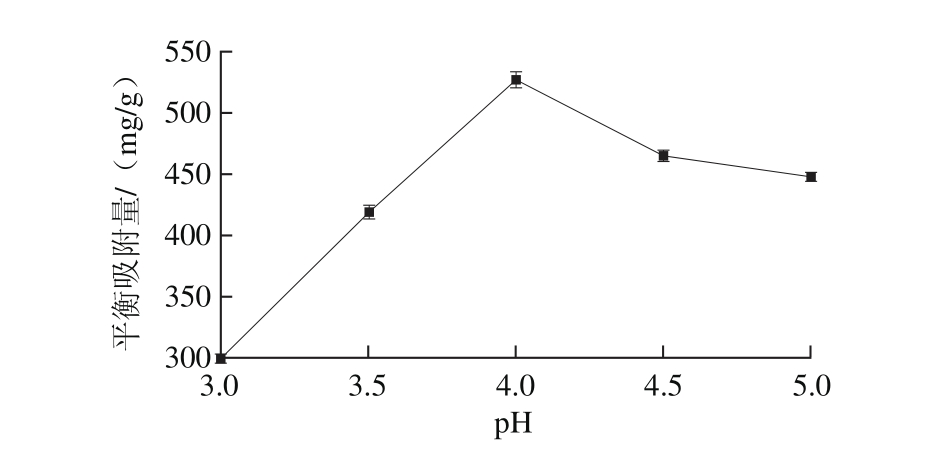
图5溶液pH值对磁性纳米粒子吸附能力的影响
Fig. 5 Effect of pH on the adsorption capacity of magnetic nanoparticles
图5 反映了溶液的pH值对CMNP@Fe3+吸附PV的能力影响比较大。PV的平衡吸附量随着pH值的增大呈现先增加后减少的趋势。当pH值为4.0时,CMNP@Fe3+对PV的平衡吸附量达到最大。在pH<4.0时,PV分子表面的负电荷减少,导致PV平衡吸附量减少;当pH>4.0时,虽然PV表面的负电荷较多,但CMNP@Fe3+表面的Fe3+基团处于较高pH值环境中时,Fe3+发生水解,掠夺弱酸或水中的OH-,而与OH-结合后,所在位点就不能与PV结合,所以PV的平衡吸附量随着pH值升高而减少。有研究表明,在酸性条件下,若PV与Fe3+反应时间延长,PV螯合Fe3+的能力不断增加。由于两者有更长的接触时间,部分质子化的磷酸酯基团被附近的Fe3+诱导,质子解离,而PV的磷酸基团与Fe3+形成更稳定的复合物[16]。因此,CMNP@Fe3+对PV进行等电点吸附时,粒子的吸附能力最强,此时吸附量达到最大[30]。
2.6 吸附温度对PV吸附量的影响
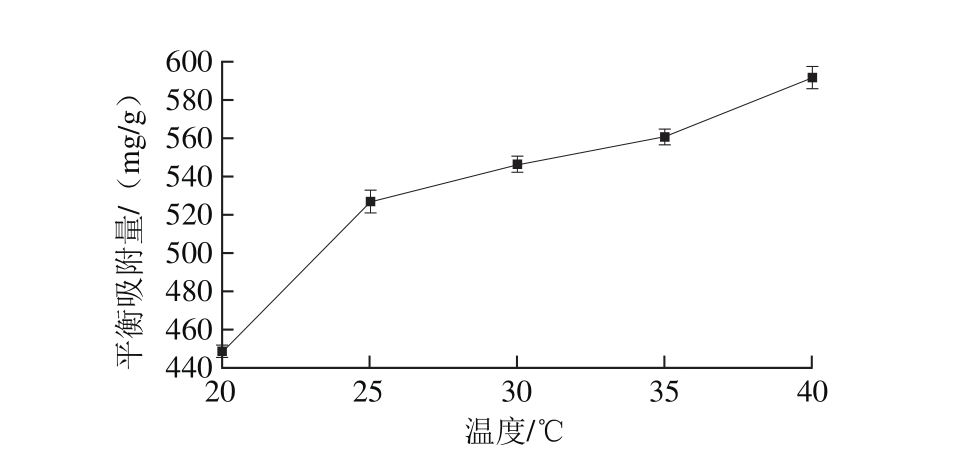
图6 吸附温度对磁性纳米粒子吸附能力的影响
Fig. 6 Effect of temperature on the adsorption capacity of magnetic nanoparticles
不同的吸附温度对PV吸附量影响的结果如图6所示,CMNP@Fe3+对PV的平衡吸附量与吸附温度呈正相关。吸附温度为20 ℃时,PV平衡吸附量最小448.90 mg/g,随着温度的上升,PV平衡吸附量也不断增加,在实验温度范围中,PV平衡吸附量在吸附温度为40 ℃时达到最高。吸附行为发生在CMNP@Fe3+粒子的表面,温度越高分子运动速度越快,能够与CMNP@Fe3+有效接触的PV分子数量增多,有利于结合的发生,说明温度升高对吸附过程有利。但是为了保持PV的生物活性,提取的过程需要避免长时间维持过高的温度,因此选择30 ℃作为吸附过程的温度。
2.7 吸附时间对PV吸附量的影响

图7吸附时间对磁性纳米粒子吸附能力的影响
Fig. 7 Effect of adsorption time on the adsorption capacity of magnetic nanoparticles
图7 显示了吸附时间对PV平衡吸附量的影响,随着吸附时间的延长,溶液中的PV含量不断减少,至趋于平稳。可以将CMNP@Fe3+与PV的结合过程分为3 个阶段,分别为快速吸附阶段、缓慢吸附阶段和吸附平衡阶段[31]。在0~30 min阶段,CMNP@Fe3+表面存在大量的可结合位点,CMNP@Fe3+与PV的结合比较容易,因此PV平衡吸附量快速提高,这属于快速吸附阶段。30~180 min过程中,PV平衡吸附量显现缓慢增加的趋势,这是由于CMNP@Fe3+表面结合了大量的PV,表面形成空间位阻,使得可结合位点与PV的结合变得较为困难,进入缓慢吸附阶段。当吸附时间到达180 min后,表面的空间位阻让PV的平衡吸附量不再随时间延长而继续增加,此时达到吸附平衡的阶段。
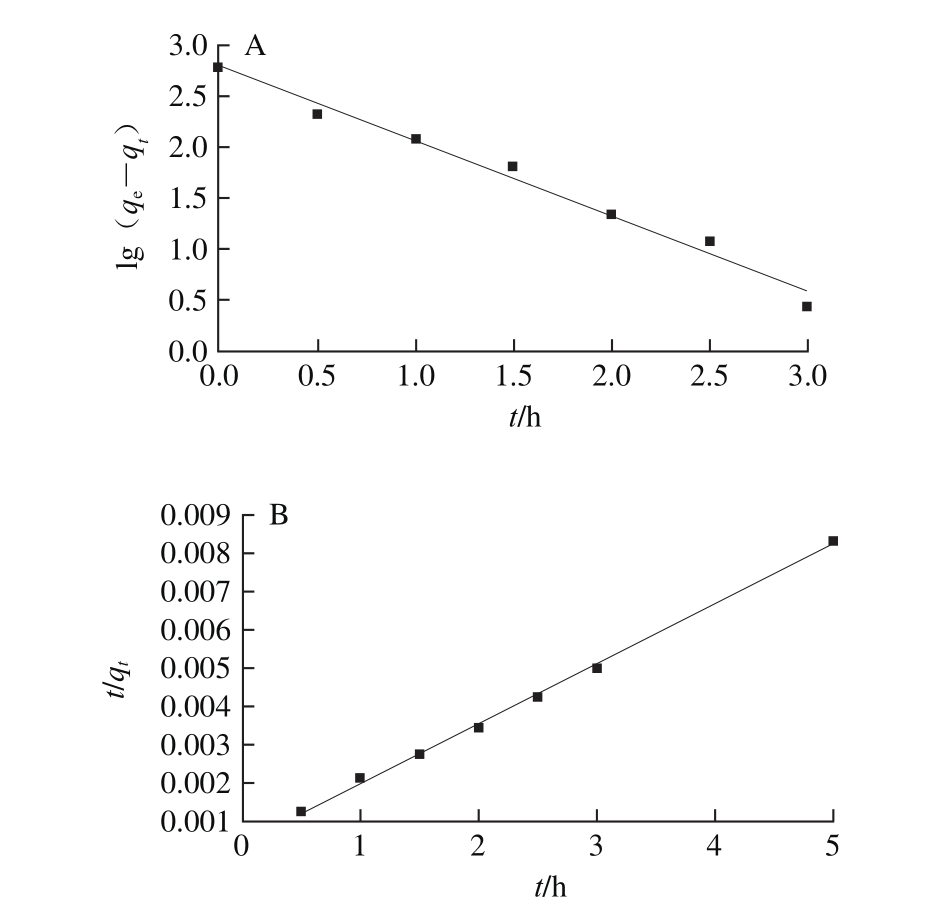
图8 动力学伪一级(A)和伪二级(B)模型的拟合曲线
Fig. 8 Fitted curves of pseudo fi rst-order kinetics (A) and pseudo second-order kinetics (B)
表1 吸附PV过程伪一级模型和伪二级模型相关参数
Table 1 Kinetic parameters for pseudo fi rst-order and pseudo second-order models
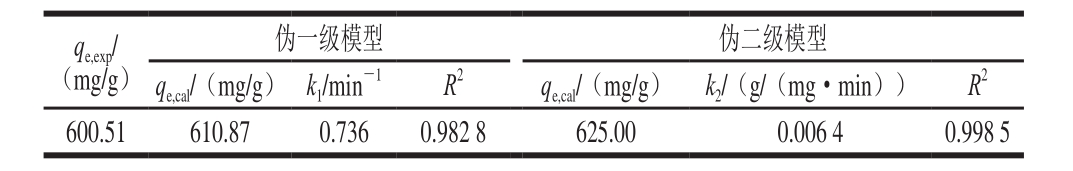
注:qe,exp为实际测量平衡吸附量。
用动力学伪一级模型和伪二级模型拟合0~180 min阶段吸附时间对PV吸附量影响的数据,得到的拟合曲线如图8所示,得到相应的动力学模型参数如表1所示。从计算得到的动力学参数可知,伪一级动力学模型计算得到的吸附平衡时PV理论吸附量为610.87 mg/g,伪二级动力学模型计算得到的吸附平衡时PV理论吸附量为625.00 mg/g,这两个值与实际测量的吸附平衡的PV吸附量600.51 mg/g相差不大。而伪二级模型的相关系数(R2)比伪一级模型的相关系数大,说明CMNP@Fe3+对PV的吸附行为更符合伪二级动力学模型。较小的k2值说明CMNP@Fe3+对PV的吸附速率较快。本实验的k2值为0.006 4 g/(mg·min),而Kamran等[30]利用IL-Fe3O4吸附溶菌酶、牛血清白蛋白、肌红蛋白的动力学过程计算的k2值分别为0.007、0.027、0.011 g/(mg·min),说明本实验的吸附体系更容易进行。
2.8 底物初始添加质量浓度对PV吸附量的影响
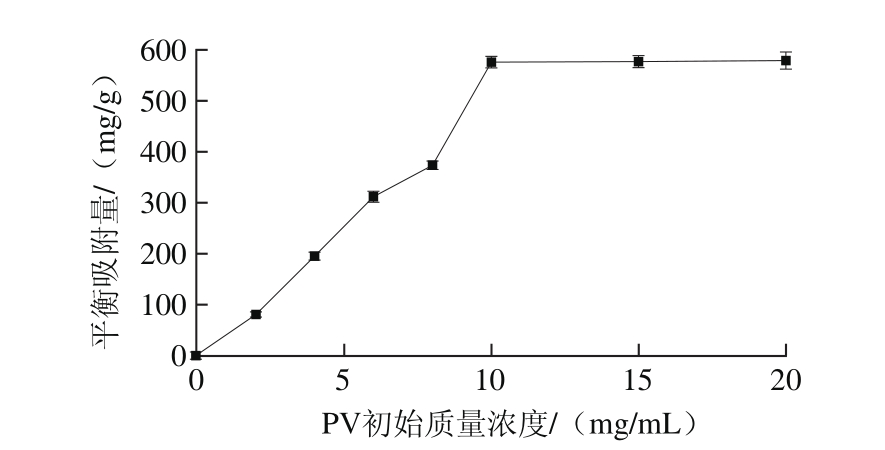
图9 底物初始质量浓度对磁性纳米粒子吸附能力的影响
Fig. 9 Effect of initial substrate concentrationon adsorption capacity of magnetic nanoparticles
由图9可知,随着底物初始质量浓度的增大,CMNP@ Fe3+对PV的吸附量也随之增加。在底物PV添加量小于10 mg/mL时,PV平衡吸附量随着底物初始质量浓度的增加而迅速增大;但当底物初始质量浓度到达10 mg/mL后,CMNP@Fe3+对PV的平衡吸附量不再随底物质量浓度的增加而变化,此时达到最大平衡吸附量,为597.88 mg/g。
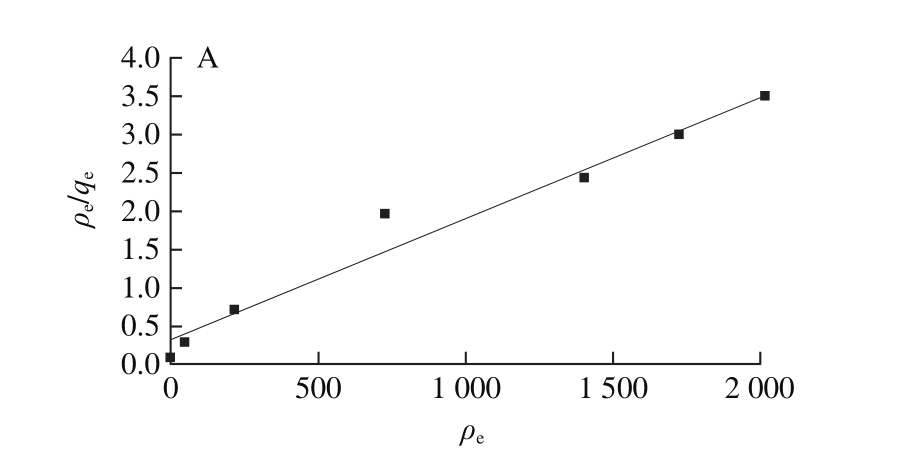
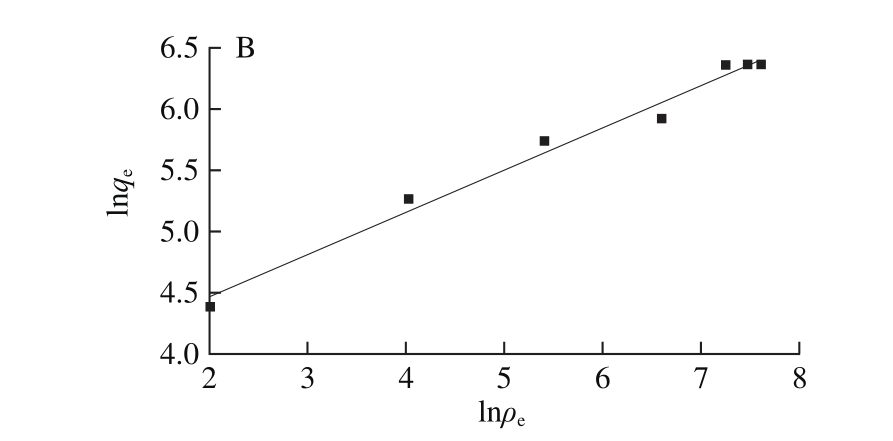
图10 吸附等温模型Langmuir模型(A)和Freundlich模型(B)
Fig. 10 Fitted curves of Langmuir model (A) and Freundlich model (B)
表2 吸附等温模型Langmuir模型和Freundlich模型的相关参数
Table 2 Parameters for Langmuir and Freundlich isotherm models
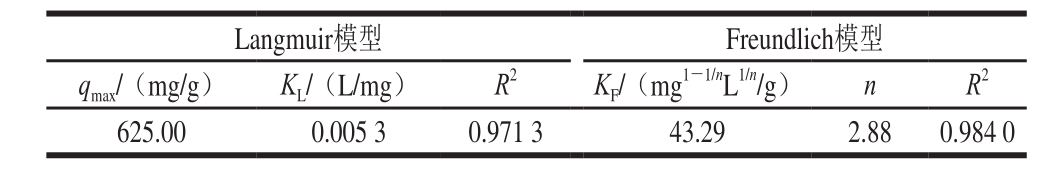
根据图9数据进行吸附等温模型(Langmuir模型和Freundlich模型)的拟合,如图10所示。并计算出相关参数,结果见表2。利用Langmuir模型计算得到的PV理论最大平衡吸附量为625.00 mg/g,这个结果与伪二级动力学模型计算得到的平衡吸附量相同,与实际检测的平衡吸附量(600.51 mg/g)接近,说明这个理论值是可信的。Langmuir模型是一个表面单分子层吸附模型,每个吸附位点对被吸附物质有相同的吸附亲和力;而Freundlich模型的吸附位点则是能量不相等的,随着底物初始质量浓度的增加,吸附剂表面的吸附物质的量也随之增加[30]。通过R2值的比较,Freundlich模型的R2值大于Langmuir模型的R2值,表明CMNP@Fe3+吸附PV的行为比较符合Freundlich等温吸附模型。Freundlich模型中的KF值反映了吸附剂CMNP@Fe3+的吸附能力,数值越高则吸附能力越强。当0.1<1/n<0.5时,体系被认为易于吸附,通过计算本实验的1/n值为0.35,说明在体系中CMNP@Fe3+对PV的吸附是容易发生的。
2.9 磁性分离的PV的电泳结果
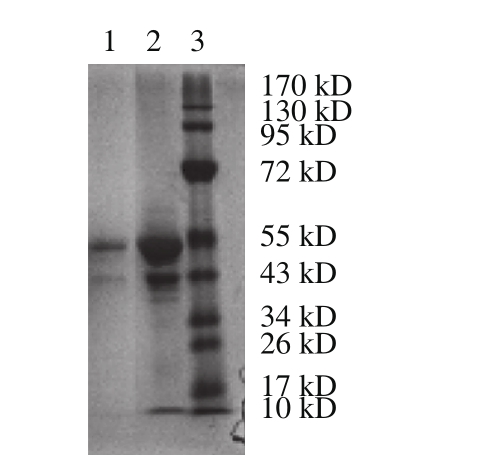
图11 PV的Native-PAGE图
Fig. 11 Native-PAGE of PV
泳道1.磁性分离的PV;泳道2. PV纯品;泳道3.分子质量为170 kD的Marker。
图11为磁性分离的PV和PV纯品的Native-PAGE结果。可以看到,泳道2的PV纯品电泳图有两个条带,一条为PV的条带,而另一个为PV亚基的条带;泳道1中的磁性分离PV电泳图,在相同的位置也存在两个条带,且没有其他的杂条带,说明CMNP@Fe3+提取得到的蛋白PV的确是PV分子,而且蛋白纯度高。
本实验以表面功能化修饰Fe3+的磁性纳米粒子为吸附材料,构建盐析联合磁性分离PV的方法。透射电子显微镜观察看到裸Fe3O4粒子发生团聚,形成多层粒子堆叠的大颗粒,而表面修饰CS的CMNP分散性大大提高,粒子以单层分散。X射线衍射结果表明Fe3O4进行表面修饰后不会改变粒子的晶型,而磁滞回线结果证明制备的CMNP、CMNP@Fe3+都具有超顺磁性,能应用于后续磁性分离蛋白质。通过红外光谱的检测,证明CS、Fe3+已经成功修饰在Fe3O4表面,得到了目标的功能化磁性纳米粒子。
实验对CMNP@Fe3+吸附PV过程的影响因素进行了探究,并获得最佳的条件为:称取适量的前处理样品,配制成pH 4.0、初始底物质量浓度10 mg/mL的溶液,放入磁性纳米粒子CMNP@Fe3+,混匀后放入30 ℃的恒温摇床中吸附180 min,此时CMNP@Fe3+能达到最大平衡吸附PV能力约600.51 mg/g。通过对实验数据进行分析确定CMNP@Fe3+吸附PV的过程符合伪二级动力学模型和Freundlich等温吸附模型。本实验建立的磁性分离PV的方法操作比较快速、简便、绿色环保,为后续磁性纳米粒子材料分离PV方法的完善提供了理论依据。但是磁性纳米粒子的重复利用性还有待改善,如何在减少磁性纳米粒子表面功能基团损耗的同时,维持较高的PV吸附能力,在后续的研究中可以进一步探讨。
参考文献:
[1] 程晓燕, 吴子健, 王亮, 等. 卵黄高磷蛋白及其磷酸肽的研究进展[J]. 食品科学, 2013, 34(21): 43-47. DOI:10.13386/ j.issn1002-0306.2010.09.078.
[2] 宋儒坤, 李斌, 许沙沙, 等. 卵黄高磷蛋白的功能与应用研究[J]. 中国家禽, 2011, 33(16): 40-42. DOI:10.16372/ j.issn.1004-6364.2011.16.004.
[3] ISHIKAWA S, OHTSUKI S, TOMITA K, et al. Protective effect of egg yolk phosvitin against ultraviolet-light-induced lipid peroxidation in the presence of iron ions[J]. Biological Trace Element Research, 2005, 105: 249-256. DOI:10.1385/BTER:105:1-3:249.
[4] XU X, KATAYAMA S, MINE Y. Antioxidant activity of tryptic digests of hen egg yolk phosvitin[J]. Journal of the Science of Food and Agriculture, 2007, 87(14): 2604-2608. DOI:10.1002/jsfa.3015.
[5] ABDELKEBIR K, MORIN G S, LADAM G. Biomimetic layer-bylayer templates for calcium phosphate biomineralization[J]. Acta Biomater, 2012, 8: 3419-3428. DOI:10.1016/j.actbio.2012.05.035.
[6] WILLIAM J Z, CHEN I-W, SHASTRI V P. Influence of surface change and protein intermediary layer on the formation of biomimetic calcium phosphate on silica nanoparticles[J]. Journal of Materials Chemistry, 2012, 22: 19562-19569. DOI:10.1039/C2JM31733H.
[7] 张晓维. 卵黄高磷蛋白的分离纯化、结构表征及功能特性研究[D].武汉: 华中农业大学, 2014: 3-25.
[8] REN J, WU J. Preparation of high purity egg phosvitin using anion exchange chromatography[J]. Food Chemistry, 2014, 158: 186-191. DOI:10.1016/j.foodchem.2014.02.120.
[9] ZHANG X W, QIU N, GENG F, et al. Simply and effectively preparing high-purity phosvitin using polyethylene glycol and anionexchange chromatography[J]. Journal of Separation Science, 2011, 34: 3295-3301. DOI:10.1002/jssc.201100601.
[10] JUNG S, AHN D U, NAM K C, et al. Separation of phosvitin from egg yolk without using organic solvents[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26: 1622. DOI:10.5713/ajas.2013.13263.
[11] REN J, WU J. Thermal-aided phosvitin extraction from egg yolk[J]. Journal of the Science of Food and Agriculture, 2015, 95(13): 2595-2600. DOI:10.1002/jsfa.7073.
[12] TING C P, BERTRAND P, POULIOT Y, et al. On the use of ultrafiltration for the concentration and desalting of phosvitin from egg yolk protein concentrate[J]. International Journal of Food Science & Technology, 2010, 45: 1633-1640. DOI:10.1111/j.1365-2621.2010.02311.x.
[13] KO K, NAM K, JO C, et al. A simple and eff i cient method for preparing partially purified phosvitin from egg yolk using ethanol and salts[J]. Poultry Science, 2011, 90: 1096-1104. DOI:10.3382/ps.2010-01138.
[14] SAMARAWEERA H, ZHANG W G, LEE E J, et al. Egg yolk phosvitin and functional phosphopeptides: review[J]. Journal of Food Science, 2011, 76: 143-150. DOI:10.1111/j.1750-3841.2011.02291.x.
[15] 陈婵, 黄茜, 马美湖. 鸡蛋中抗氧化活性蛋白质研究进展[J]. 中国家禽, 2015, 37(21): 43-47. DOI:10.16372/j.issn.1004-6364.2015.21.009.
[16] CASTELLANI O, GUÉRIN-DUBIARD C, DAVID-BRIAND E, et al. Inf l uence of physicochemical conditions and technological treatments on the iron binding capacity of egg yolk phosvitin[J]. Food Chemistry, 2004, 85: 569-577. DOI:10.1016/j.foodchem.2003.08.002.
[17] LI R, SHEN Y, ZHANG X, et al. Efficient purification of ginkgolic acids from Ginkgo biloba leaves by selective adsorption on Fe3O4magnetic nanoparticles[J]. Journal of Natural Products, 2014, 77: 571-575. DOI:10.1021/np400821r.
[18] 张松. Fe3O4磁性纳米粒子对黄酮类化合物的选择性吸附研究[D].长沙: 湖南师范大学, 2012: 1-8.
[19] FAN J P, XU X K, XU R, et al. Preparation and characterization of molecular imprinted polymer functionalized with core/shell magnetic particles (Fe3O4@SiO2@MIP) for the simultaneous recognition and enrichment of four taxoids in Taxus × media[J]. Chemical Engineering Journal, 2015, 279: 567-577. DOI:10.1016/j.cej.2015.05.045.
[20] WU H T, HSU C C, TSAI C F, et al. Nanoprobe-based immobilized metal affinity chromatography for sensitive and complementary enrichment of multiply phosphorylated peptides[J]. Proteomics, 2011, 11: 2639-2653. DOI:10.1002/pmic.201000768.
[21] SUN J, LIU Y, SU Y, et al. Highly efficient enrichment of phosvitin phosphopeptides by novel magnetic carboxymethyl chitosan nanoparticles decorated with Fe (III) ions[J]. Journal of Chromatography B, 2013, 915: 33-38. DOI:10.1016/ j.jchromb.2012.12.013.
[22] 张婧. 卵黄高磷蛋白磷酸肽的分离纯化及功能性质研究[D]. 无锡:江南大学, 2012: 9-10.
[23] PIROUZ M J, BEYKI M H, SHEMIRANI F. Anhydride functionalised calcium ferrite nanoparticles a new selective magnetic material for enrichment of lead ions from water and food samples[J]. Food Chemistry, 2015, 170: 131-137. DOI:10.1016/j.foodchem.2014.08.046.
[24] 王文娟, 张海鹏, 韩玉香, 等. 磁性Fe3O4@SiO2@ZrO2对水中磷酸盐的吸附研究[J]. 无机化学学报, 2014, 30(12): 2726-2732.
[25] 张燚. Fe3O4磁性纳米粒子-氧化石墨烯复合材料的可控制备与应用[D].西安: 陕西师范大学, 2011: 1-6.
[26] CHEN T T, YANG W J, GUO R J, et al. Enhancing catalytic performance of β-glucosidase via immobilization on metal ions chelated magnetic nanoparticles[J]. Enzyme and Microbial Technology, 2014, 63: 50-57. DOI:10.1016/j.enzmictec.2014.05.008.
[27] CHEN Z M, GENG Z R, ZHANG Z Y, et al. Synthesis of magnetic Fe3O4@C nanoparticles modif i ed with -SO3H and -COOH groups for fast removal of Pb2+, Hg2+, and Cd2+ions[J]. European Journal of Inorganic Chemistry, 2014, 20: 3172-3177. DOI:10.1002/ejic.201301500.
[28] 孙海平. 磁性纳米粒子的表面修饰及功能化[D]. 扬州: 扬州大学, 2008: 32-46.
[29] ZHANG J, SUN J, LIU Y, et al. Separation and purification of phosvitin phosphopeptides using immobilized metal affinity nanoparticles[J]. Journal of Chromatography B, 2012, 893: 121-126. DOI:10.1016/j.jchromb.2012.02.046.
[30] KAMRAN S, ASADI M, ABSALAN G. Adsorption of acidic, basic, and neutral proteins from aqueous samples using Fe3O4magnetic nanoparticles modified with an ionic liquid[J]. Microchimica Acta, 2013, 180: 41-48. DOI:10.1007/s00604-012-0901-7.
[31] ZHOU L X, PAN S D, CHEN X H, et al. Kinetics and thermodynamics studies of pentachlorophenol adsorption on covalently functionalized Fe3O4@SiO2-MWCNTs core–shell magnetic microspheres[J]. Chemical Engineering Journal, 2014, 257: 10-19. DOI:10.1016/ j.cej.2014.07.060.
Synthesis and Characterization of Surface-Modif i ed Magnetic Nanoparticles for Phosvitin Adsorption
CHEN Chan, HUANG Xi*, LI Shanshan, MA Meihu
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Abstract:Functional magnetic nanoparticles Fe3O4-CS@Fe3+(CMNP@Fe3+for short) were prepared by chemical co-precipitation and functional modif i cation with sodium chondroitin sulfate and ferric ion, and their surface morphology was analyzed. CMNP@Fe3+showed a spherical shape with a small diameter of about 20 nm, and they could be well dispersed in aqueous solution as proved by transmission electron microscope. It was found that the nanoparticles had superparamagnetic properties as indicated by the hysteresis loop. Fourier transform infrared spectrum revealed that sodium chondroitin sulfate and Fe3+coated the surface of Fe3O4successfully. This study established a new method to extract phosvitin from hen egg yolk by taking advantage of the strong binding of Fe3+on the surface of magnetic nanoparticles to phosvitin, and we also investigated the factors inf l uencing the adsorption process. The magnetic nanoparticles had maximum adsorption capacity under the following conditions: solution pH 4.0, initial substrate concentration 10 mg/mL, and adsorption time 180 min. The adsorption kinetics of CMNP@Fe3+for phosvitin was better described by a pseudo second-order kinetic model, and the theoretical adsorption capacity at the equilibrium state computed from the model was 625.00 mg/g. The adsorption data were fi t to well the Freundlich isotherm model. This research may provide a reference for protein separation from eggs using magnetic particles.
Key words:phosvitin; magnetic nanopaticles; magnetic separation; sodium chondroitin sulfate; ferric ion
DOI:10.7506/spkx1002-6630-201715008
中图分类号:TS253.1
文献标志码:A
文章编号:1002-6630(2017)15-0043-08
引文格式:
陈婵, 黄茜, 李珊珊, 等. Fe3+修饰磁性纳米粒子的制备与表征及对卵黄高磷蛋白的吸附作用[J]. 食品科学, 2017, 38(15): 43-50. DOI:10.7506/spkx1002-6630-201715008. http://www.spkx.net.cn
CHEN Chan, HUANG Xi, LI Shanshan, et al. Synthesis and characterization of surface-modif i ed magnetic nanoparticles for phosvitin adsorption[J]. Food Science, 2017, 38(15): 43-50. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201715008. http://www.spkx.net.cn
收稿日期:2016-06-27
基金项目:国家自然科学基金面上项目(31471602);公益性行业(农业)科研专项(201303084)
作者简介:陈婵(1991—),女,硕士研究生,研究方向为蛋品科学与技术。E-mail:295434276@qq.com
*通信作者:黄茜(1984—),女,副教授,博士,研究方向为畜产食品科学与技术。E-mail:huangxi@mail.hzau.edu.cn