李 可1,赵颖颖1,康壮丽2,*,王虎虎3,马汉军2,徐幸莲3
(1.郑州轻工业学院食品与生物工程学院,食品生产与安全河南省协同创新中心,河南 郑州 450001;2.河南科技学院食品学院,食品生产与安全河南省协同创新中心,河南 新乡 453003;3.南京农业大学,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095)
摘 要:NaCl是猪肉糜制品加工过程中必不可少的辅料,为进一步探明NaCl在猪肉糜加工过程中的作用,通过低场核磁共振和拉曼光谱等方法,研究了NaCl对猪肉糜的蒸煮得率、硬度、水分迁移和蛋白质二级结构的影响。结果表明:蒸煮得率和硬度随着NaCl添加量的增加而显著提高(P<0.05),特征峰T2b和T22的自旋-自旋弛豫时间逐渐缩短,T21(不易流动水)的峰面积比例逐渐增加;NaCl添加量从1%增加到2%,对蛋白质二级结构含量影响显著,β-折叠含量提高,从2%增加到3%,二级结构相对含量差异不显著(P>0.05);随着NaCl添加量的增加,—OH基团伸缩振动波峰向高波数方向移动(3 226 cm-1和3 227 cm-1),水分子内氢键增多。因此,在猪肉糜加工中适量添加NaCl能够改变猪肉糜蛋白质二级结构,增强蛋白质的水合作用,有助于提高猪肉糜的加工特性。
关键词:拉曼光谱;低场核磁共振;保水性;二级结构;水分子结构
猪肉糜制品品种丰富,能够给消费者在营养、质构和风味等方面提供较多选择。在猪肉糜制品加工制作过程中,NaCl对猪肉糜的加工特性起着关键作用。NaCl能够提取肌肉中的盐溶性肌原纤维蛋白,促使肌原纤维蛋白发生溶解和溶胀,增加肉糜的保水保油性,影响产品的出品率、质构和货架期[1-2];作为咸味剂,NaCl有助于提高肉制品的风味[3]。因而降低或提高NaCl的添加量都会影响产品品质。目前,猪肉糜制品的消费量逐年增加,但传统猪肉糜制品中NaCl含量都较高,摄入过量NaCl会增加患高血压和心血管疾病的风险[4]。因此,如何选择合适的NaCl添加量是猪肉糜制品加工过程中一个研究难点[5],需要进一步研究NaCl对猪肉糜加工特性和蛋白质二级结构的影响。
蒸煮得率是衡量肉糜制品保水性的常用指标,也能反映肉糜凝胶结构的优劣。NaCl影响肉糜蛋白质功能特性,特别是凝胶的保水性,但对于NaCl影响肉糜保水性的机理,如水分分布状态的变化与蛋白质二级结构及水分子氢键变化的关系研究报道较少。低场核磁共振(low field nuclear magnetic resonance,LF-NMR)是一种无损的、非侵入式的测量高含水量样品水分分布状态和移动性的技术[6],拉曼光谱也是一种快速、无损的提供蛋白质肽链变化信息的技术,如通过拉曼光谱可以测定肌肉蛋白质二级和三级结构的变化及对共价键和非共价键的影响,且因水对散射光谱影响较小,其能够直接用于水相系统[7-8]。因此,本实验应用拉曼光谱和LF-NMR技术研究不同NaCl添加量猪肉糜中蛋白质二级结构和水分子及水分分布状态的变化,探究NaCl对猪肉糜保水性和硬度影响的机理,为猪肉糜制品在加工过程中添加适量的NaCl提供理论依据。
1.1 材料与试剂
冷却24~48 h的猪后腿肉(水分含量为70.58%、蛋白质含量为21.25%、脂肪含量为6.98%、pH值为5.78)购于众品集团。剔除猪肉中的结缔组织和多余的脂肪,使用绞肉机绞碎(6 mm),每份1 000 g分装于双层真空包装袋(PE/尼龙)中,真空包装后贮存于-20 ℃冷库中,2 周内用完。使用前在0~4 ℃冷库中解冻约12 h至中心温度为0 ℃左右。NaCl、白胡椒粉等均为食品级。
1.2 仪器与设备
JY Labram HR 800显微激光拉曼光谱仪 法国Jobin-Yvon公司;PQOOl台式NMR分析仪 上海纽迈电子有限公司;UMC-5C斩拌机 德国Stephan公司;质构仪英国StableMicroSystem公司;绞肉机 山东嘉信食品机械有限公司;HH-42水浴锅 常州国华电器有限公司;CR-40色差计 日本美能达公司;AUY120电子天平 日本岛津公司;L-80-XP高速离心机 美国Beckman公司。
1.3 方法
1.3.1 肉糜的制备
冻肉解冻到中心温度为0 ℃左右。猪肉糜配方:取猪后腿肉1 000 g,冰水200 g,NaCl添加量分别为1%(12 g,T1)、2%(24 g,T2)、3%(36 g,T3),白胡椒粉2 g。使用Kang Zhuangli等[9]的加工工艺并作修改:将解冻好的猪肉、NaCl放入真空斩拌机,1 500 r/min斩拌30 s,并缓慢加入1/3体积的冰水;加入白胡椒粉,1 500 r/min斩拌30 s,并缓慢地加入1/3体积的冰水;3 000 r/min斩拌60 s,并缓慢地加入1/3体积的冰水(中心温度低于10 ℃)。将35 g肉糜装入50 mL的离心管中,500×g离心3 min完全除去肉糜中的气泡,然后放入80 ℃水浴锅中煮制20 min(中心温度72 ℃),冷却后放入0~4 ℃冷库中待用。
1.3.2 蒸煮得率测定
2 ℃过夜冷却后,从离心管中取出,用吸水纸将猪肉糜外部的渗出液吸取干净,分别对猪肉糜的质量进行测定,蒸煮得率按照以下公式计算。
式中:m1为蒸煮前肉糜质量/g;m2为蒸煮后肉糜质量/g。
1.3.3 质构分析
将过夜冷却的猪肉糜放置在室温条件下回温2 h,使猪肉糜内外温度一致。在室温条件下使用质构仪对猪肉糜(直径20 mm、高度20 mm的圆柱体)进行质构测定。参数设置如下:测试前速率为2.0 mm/s,测试速率为2.0 mm/s,测试后速率为3.0 mm/s;压缩比50%;时间5 s。使用P/50测试探头进行测定,得到猪肉糜的硬度/N[10]。每组样品测定5 次。
1.3.4 LF-NMR自旋-自旋弛豫时间测定
应用台式脉冲NMR分析仪PQ001进行NMR自旋-自旋弛豫时间(T2)的测量。称取质量为2 g左右的猪肉糜放入直径为15 mm的核磁管后放入分析仪中。测量温度为32 ℃,质子共振频率为22.6 MHz。参数设置如下:τ-值为(90°脉冲和180°脉冲之间的时间)为200 μs。重复扫描32 次,重复间隔时间为6.5 s,得到12 000 个回波,每组样品测试4 次。
1.3.5 拉曼光谱测定
取适量猪肉糜均匀涂抹在载玻片中央,使用显微拉曼光谱仪进行测定。用单晶硅对拉曼光谱仪进行频率校正,再用50 倍长焦距镜头将激光聚焦到样品上,功率100 mW左右,获取的拉曼光谱波数在400~3 600 cm-1范围内。每个肉样测定3 次。具体测定条件如下:600 g/mm光栅,狭缝200 μm,3 次扫描数据,获取速率为120 cm-1•min-1,分辨率为2 cm-1,积分时间为60 s。因苯丙氨酸环在1 001 cm-1伸缩振动强度不随蛋白质结构变化而变化,可将其作为内标对拉曼光谱数据进行归一化。根据文献[11-12]已报道的蛋白质和多肽拉曼光谱,对氨基酸侧链和肽键骨架振动光谱条带进行指认和分析。蛋白质二级结构(α-螺旋、β-折叠、β-转角、无规卷曲)的相对含量使用Alix等[12]的方法计算得到。
1.4 数据统计分析
实验结果均以 ±s表示。应用软件SPSS v.18.0进行统计分析,使用单因素方差分析(ANOVA)对数据进行分析,当P<0.05时判定组间存在显著差异。
±s表示。应用软件SPSS v.18.0进行统计分析,使用单因素方差分析(ANOVA)对数据进行分析,当P<0.05时判定组间存在显著差异。
2.1 蒸煮得率
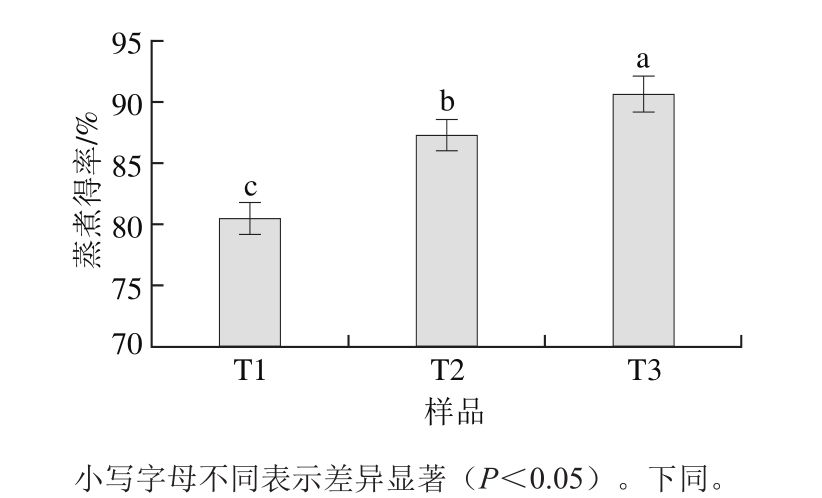
图1 不同NaCl添加量猪肉糜的蒸煮得率
Fig. 1 Cooking yield of pork meat batters with various amounts of NaCl
由图1可知,NaCl添加量对猪肉糜的蒸煮得率影响显著(P<0.05)。蒸煮得率随着NaCl添加量的增加而提高,T3有最高的蒸煮得率,T2次之,T1最低(P<0.05)。提高猪肉糜中NaCl的添加量,有利于肌原纤维蛋白的溶解和溶出。Totosaus等[13]报道了通过增加猪肉糜和牛肉糜中NaCl的添加量,使肌原纤维蛋白的提取量和溶解度提高。Kang Zhuangli等[9]也发现猪肉糜中肌原纤维蛋白溶解度随着NaCl添加量的增加而显著提高(P<0.05)。肌原纤维蛋白的溶出量显著影响猪肉糜的蒸煮得率[14],因为提取较多的肌原纤维蛋白能够形成稳定的肉糜体系,在加热过程中能利用充足的肌原纤维蛋白与不溶性肌肉组织形成良好的蛋白质基质。Tobin等[15]报道了与高盐法兰克福香肠(2.0%、2.5%和3.0% NaCl)相比,低盐(1%和1.5% NaCl)香肠有较高的蒸煮损失。
2.2 硬度
图2显示NaCl添加量对猪肉糜的硬度影响显著(P<0.05)。随着NaCl添加量的增加,猪肉糜的硬度增大。这是由于NaCl添加量的增加提高了肌原纤维蛋白的溶解和溶胀性,从而提高盐溶性蛋白的提取量。Tobin等[15]发现减少NaCl添加量,法兰克福香肠的硬度降低。另外,不同NaCl添加量的肉糜中,溶出的肌原纤维蛋白不同,也影响凝胶的形成。如减少NaCl添加量导致肌原纤维蛋白,特别是肌球蛋白和肌动蛋白提取量和溶解量的减少,影响肌原纤维蛋白的功能特性[16]。因此,增加NaCl添加量能够提高猪肉糜凝胶的硬度[17]。
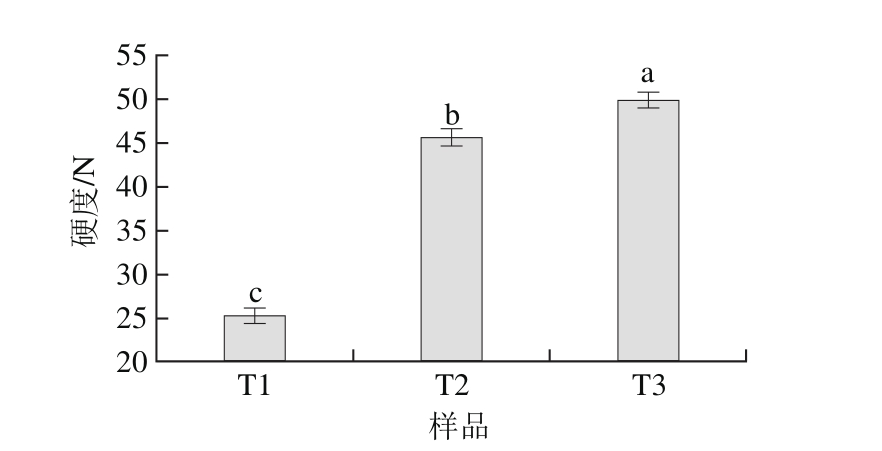
图2 不同NaCl添加量猪肉糜的硬度
Fig. 2 Hardness of pork meat batters with various amounts of NaCl
2.3 LF-NMR质子T2分析
表1 NaCl添加量对猪肉糜弛豫时间的影响
Table 1 Effect of NaCl addition on relaxation times of pork meat batters ms
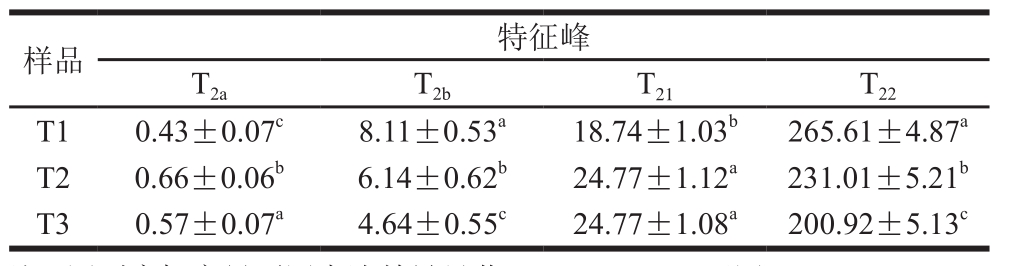
注:同列肩标字母不同表述差异显著(P<0.05)。下同。
猪肉糜凝胶体系中水的分布和移动性能够通过质子T2来反映[18]。本研究中猪肉糜凝胶体系共出现4 个特征峰,分别为T2a、T2b、T21和T22(表1)。T2越短表明水与底物结合越紧密,越长表明水分越自由[19-20]。结合水T2在0~10 ms之间,表示猪肉糜凝胶中蛋白质等大分子结合的水和部分脂肪中的水分,分别用T2a和T2b表示;T21和T22的T2分别在20~100 ms和250~400 ms之间,分别代表不易流动水和自由水[6]。随着NaCl添加量的增加,猪肉糜中T2b和T22起始T2较短,说明增加NaCl有利于形成良好的凝胶结构,限制了水的移动,而水的可移动性降低造成了T2下降。T21随着NaCl从1%增加到2%,T2延长,表明凝胶具有均匀和细致的孔状结构,有利于毛细管力的形成和保持较多的水分[21-23]。而添加2%和3% NaCl的猪肉糜中,T21的T2差异不显著(P>0.05),表明添加2% NaCl对可移动水的影响与3% NaCl一致。
表2 NaCl添加量对猪肉糜峰面积比例的影响
Table 2 Effect of NaCl addition on peak ratio of pork meat batters %
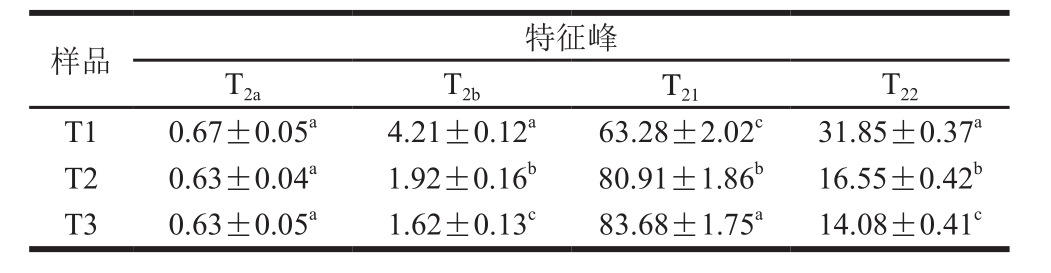
由表2可知,NaCl添加量对不同状态水所对应的峰面积比例影响显著(P<0.05)。增加NaCl添加量能够降低结合水(T2b)和自由水(T22)的峰面积比例,增加不易流动水(T21)的峰面积比例,表明提高NaCl有利于三维网状凝胶结构的形成,并将水分束缚于凝胶中,减少水分的损失[24]。NMR测量T2结果表明,提高NaCl添加量能够增加猪肉肉糜蛋白质与水的交互作用,提高凝胶的保水性。
2.4 拉曼光谱分析
2.4.1 二级结构
猪肉糜蛋白酰胺Ⅰ带位于拉曼光谱的1 665 cm-1附近[8,25],主要通过肽键C=O的伸缩振动,也包含Cα—C—N的弯曲振动、C—N的伸缩振动、N—H的面内弯曲振动提供蛋白质二级结构的信息[11]。由于酰胺Ⅰ带对肽键上氢键的变化比较敏感,α-螺旋、β-折叠、β-转角和无规卷曲含量的变化分别交错有序地通过1 650~1 660、1665~1680、1680 cm-1和1660~1665 cm-1条带上的变化来反映[26-27]。
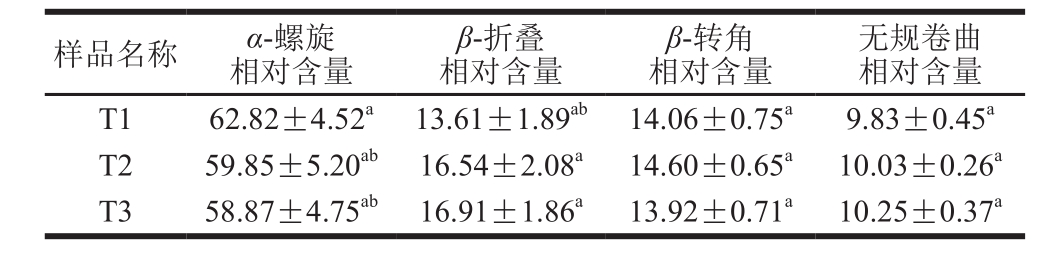
由表3可知,NaCl添加量从1%增加到2%,α-螺旋含量降低(P>0.05),β-折叠含量增加,而β-转角和无规卷曲的相对含量差异不显著(P>0.05)。NaCl从2%升高到3%,α-螺旋、β-折叠、β-转角和无规卷曲的相对含量差异不显著(P>0.05)。Kang Zhuangli等[9]发现提高猪肉糜中NaCl添加量,β-折叠相对含量有升高的趋势。NaCl增加促进α-螺旋结构解折叠,形成β-折叠结构。而β-折叠结构是蛋白质集聚和形成良好凝胶的基础结构,增加肉糜体系中β-折叠的含量,有助于改善肉制品的质构特性和保水性[28-29]。
表3 不同NaCl添加量猪肉糜蛋白质二级结构相对含量的变化
Table 3 Effect of NaCl addition on the secondary structure contents of proteins in pork meat batters
%
2.4.2 水分子结构
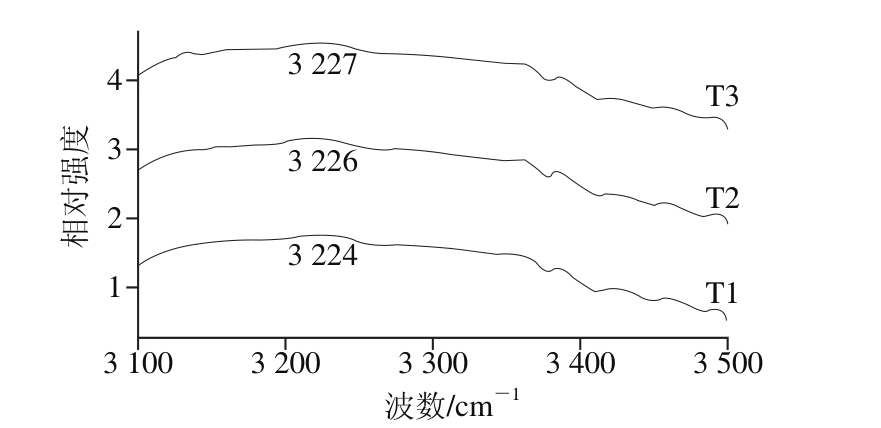
图3 不同NaCl添加量猪肉糜的拉曼光谱(3 100~3 500 cm-1)
Fig. 3 Raman spectra of pork meat batters with various amounts of NaCl in the region of 3 100–3 500 cm-1
拉曼光谱能提供肉糜体系中水分子变化的信息。拉曼光谱中3 100~3 500 cm-1之间的条带被指认为—OH基团的伸缩振动,能够反映水分子内氢键的振动[23]。如图3所示,与添加1% NaCl的猪肉糜相比,随着NaCl添加量的增加,峰值逐步向高波数方向移动,T1、T2和T3的峰值分别位于3 224、3 226 cm-1和3 227 cm-1。峰值向高波数方向移动,表明水分子内形成更多的氢键,氢键作用力更大[30]。增加NaCl,促使蛋白质中氨基酸侧链的亲水基团暴露并与水分子结合,加强蛋白质与水分子间的交联,使这部分水分的T2延长(表1)。另外,由于形成较多的氢键能够诱导蛋白二级结构中的β-折叠相对含量增加,因此,提高NaCl添加量,也能促使α-螺旋结构的解折叠,形成β-折叠结构(表3),在加热过程中形成良好的凝胶结构,提高猪肉糜的蒸煮得率和硬度(图1和表2)。
随着NaCl添加量的增加,猪肉糜蒸煮得率和硬度显著提高。LF-NMR结果表明高NaCl添加量的猪肉糜中不易流动水含量较高,有较好的保水性。拉曼光谱结果表明NaCl从1%提高到2%,α-螺旋结构相对含量降低,β-折叠相对含量增加,而NaCl添加量从2%提高到3%,二级结构含量变化不明显。NaCl添加量从1%增加至3%,3 100~3 500 cm-1之间的波峰向高波数方向移动,水分子内氢键增多,蛋白质和水分子之间的相互作用增强,诱导α-螺旋结构解折叠,形成β-折叠结构。
参考文献:
[1] XIONG Youling L.. Structure/function relationship of muscle proteins[M]// DAMODARAN S, PARAF A. Food proteins and their applications. New York: Marcel Dekker, 1997: 175-196.
[2] SIKES A L, TOBIN A B, TUME R K. Use of high pressure to reduce cook loss and improve texture of low-salt beef sausage batters[J]. Innovative Food Science and Emerging Technologies, 2009, 10: 405-412. DOI:10.1016/j.ifset.2009.02.007.
[3] TOBIN B D, O’SULLIVAN M G, HAMILL R M, et al. The impact of salt and fat level variation on the physiochemical properties and sensory quality of pork breakfast sausages[J]. Meat Science, 2013, 93: 145-152. DOI:10.1016/j.meatsci.2012.08.00.
[4] HE F J, MACGREGOR G A. Effect of modest salt reduction on blood pressure: a meta-analysis of randomized trial[J]. Journal of Human Hypertension, 2002, 16: 761-770. DOI:10.1038/sj.jhh.1001459.
[5] OMANA D A, PLASTOW G, BETTI M. Effect of different ingredients on color and oxidative characteristics of high pressure processed chicken breast meat with special emphasis on use of β-glucan as a partial salt replacer[J]. Innovative Food Science and Emerging Technologies, 2011, 12: 244-254. DOI:10.1016/j.ifset.2011.04.007.
[6] TORNBERG E, WAHLGREN M, BRØNDUM J, et al. Pre-rigor conditions in beef under varying temperature and pH falls studied with rigometer, NMR and NIR[J]. Food Chemistry, 2000, 69(4): 407-418. DOI:10.1016/S0308-8146(00)00053-4.
[7] ALLAIS I, VIAUD C, PIERRE A, et al. A rapid method based on front-face fl uorescence spectroscopy for the monitoring of the texture of meat emulsions and frankfurters[J]. Meat Science, 2004, 67: 219-229. DOI:10.1016/j.meatsci.2003.10.009.
[8] LI-CHAN C Y, NAKAI S, HIROTSUKA M. Raman spectroscopy as a probe of protein structure in food systems[M]// YADA R Y, JACKMAN R L, SMITH J L. Protein structure-function relationships in foods. New York: Chapman and Hall Inc., 1994: 163-197. DOI:10.1007/978-1-4615-2670-4_8.
[9] KANG Zhuangli, ZOU Yufeng, XU Xinglian, et al. Effect of a beating process, as a means of reducing salt content in Chinese-style meatballs (kung-wan): a physico-chemical and textural study[J]. Meat Science, 2014, 96: 147-152. DOI:10.1016/j.meatsci.2013.06.019.
[10] BOURNE M C. Texture prof i le analysis[J]. Food Technology, 1978, 33: 62-66.
[11] LI-CHAN E C Y. The applications of Raman spectroscopy in food science[J]. Trends in Food Science and Technology, 1996, 7: 361-370. DOI:10.1016/S0924-2244(96)10037-6.
[12] ALIX A J P, PEDANOU G, BERJOT M. Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide Ⅰ band[J]. Journal of Molecular Structure, 1988, 174: 159-164. DOI:10.1016/0022-2860(88)80151-0.
[13] TOTOSAUS A, PÉREZ-CHABELA M L. Textural properties and microstructure of low-fat and sodium-reduced meat batters formulated with gellan gum and dicationic salts[J]. LWT-Food Science and Technology, 2009, 42: 563-569. DOI:10.1016/j.lwt.2008.07.016.
[14] LAN Y H, NOVAKOFSKI J, MCCUSKER R H, et al. Thermal gelation of pork, beef, fi sh, chicken and turkey muscles as affected by heating rate and pH[J]. Journal of Food Science, 1995, 60: 936-940. DOI:10.1111/j.1365-2621.1995.tb06265.x.
[15] TOBIN B D, O’SULLIVAN M G, HAMILL R M, et al. Effect of varying salt and fat levels on the sensory and physiochemical quality of frankfurters[J]. Meat Science, 2012, 92: 659-666. DOI:10.1016/ j.meatsci.2012.06.017.
[16] PIETRASIK Z, LI-CHAN E C Y. Response surface methodology study on the effects of salt, microbial transglutaminase and heating temperature on pork batter gel properties[J]. Food Research International, 2002, 35: 387-396. DOI:10.1016/S0963-9969(01)00133-8.
[17] HORITA C N, MORGANO M A, CELEGHINI R M S, et al. Physicochemical and sensory properties of reduced-fat mortadella prepared with blends of calcium, magnesium and potassium chloride as partial substitutes for sodium chloride[J]. Meat Science, 2011, 89: 426-433. DOI:10.1016/j.meatsci.2011.05.010.
[18] LI C B, LIU D Y, ZHOU G H, et al. Meat quality and cooking attributes of thawed pork with different low fi eld NMR T21[J]. Meat Science, 2012, 92: 79-83. DOI:10.1016/j.meatsci.2011.11.015.
[19] 韩敏义, 费英, 徐幸莲, 等. 低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学, 2009, 42(6): 2098-2104. DOI:10.3864/j.issn.0578-1752.2009.06.028.
[20] 林婉瑜, 林晶晶, 林向阳, 等. 利用核磁共振技术研究食盐对鱼糜加工的影响[J]. 食品科学, 2013, 34(5): 105-109.
[21] PITOMBO R N M, LIMA G A M R. Nuclear magnetic resonance and water activity in measuring the water mobility in Pintado (Pseudoplatystoma corrldscas) fi sh[J]. Journal of Food Engineering, 2003, 58(1): 59-66. DOI:10.1016/S0260-8774(02)00334-5.
[22] CHEN P L, LONG Z, RUAN R, et al. Nuclear magnetic resonance studies of water mobility in bread during storage[J]. LWT-Food Science and Technology, 1997, 30(2): 178-183. DOI:10.1006/ fstl.1996.0163.
[23] CURTI E, BUBICI S, CARINI E, et al. Water molecular dynamics during bread staling by Nuclear Magnetic Resonance[J]. LWTFood Science and Technology, 2011, 44(4): 854-859. DOI:10.1016/ j.lwt.2010.11.021.
[24] KANG Z L, LI B, MA H J, et al. Effect of different processing methods and salt content on the physicochemical and rheological properties of meat batters[J]. International Journal of Food Properties, 2016, 19(7): 1604-1615. DOI:10.1080/10942912.2015.1105819.
[25] KRIMM S, BANDEKAR J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins[J]. Advances in Protein Chemistry, 1986, 38: 181-364. DOI:10.1016/S0065-3233(08)60528-8.
[26] TU A T. Raman spectroscopy in biology[M]. New York: John Wiley, 1982: 95-102. DOI:10.1016/B978-0-12-170850-4.50004-3.
[27] HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems[J]. Critical Reviews in Food Science and Nutrition, 2008, 48(6): 512-523. DOI:10.1080/10408390701537385.
[28] LIU R, ZHAO S M, LIU Y M, et al. Effect of pH on the gel properties and secondary structure off i sh myosin[J]. Food Chemistry, 2010, 121: 196-202. DOI:10.1016/j.foodchem.2009.12.030.
[29] HERRERO A M. Raman spectroscopy a promising technique for quality assessment of meat and fish: a review[J]. Food Chemistry, 2008, 107: 1642-1651. DOI:10.1016/j.foodchem.2007.10.014.
[30] MATULIS R J, MCKEITH F K, SUTHERLAND J W, et al. Sensory characteristics of frankfurters as affected by salt, fat, soy protein, and carrageenan[J]. Journal of Food Science, 1995, 60: 48-54. DOI:10.1111/j.1365-2621.1995.tb05604.x.
Effect of NaCl on Processing Characteristics and Protein Secondary Structures in Pork Meat Batters
LI Ke1, ZHAO Yingying1, KANG Zhuangli2,*, WANG Huhu3, MA Hanjun2, XU Xinglian3
(1. Henan Province Collaborative Innovation Center for Food Production and Safety, College of Food and Bioengineering, Zhengzhou University of Light Industry, Zhengzhou 450001, China; 2. Henan Province Collaborative Innovation Center for Food Production and Safety, School of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China; 3. National Center of Meat Quality and Safety Control, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:NaCl is an essential auxiliary material for processing of minced pork products. In this paper, in order to further conf i rm the role of NaCl in this regard, low fi eld nuclear magnetic resonance and Raman spectroscopy were used to explore the effect of NaCl on cooking yield, hardness, water migration and protein secondary structures in pork batters. The results showed that cooking yield and hardness were signif i cantly (P < 0.05) improved, T2band T22relaxation times became shorter, and the peak ratio of T21(bound water) was increased with the increase in NaCl concentration. Raman spectroscopy indicated that β-sheet content was increased with increasing NaCl concentration from 1% to 2%, while the secondary structure composition was not signif i cantly changed (P > 0.05) with further increase in NaCl concentration up to 3%. With the increase in NaCl concentration, the—OH stretching vibration was shifted to high wavenumbers (3 226 and 3 227 cm-1), and the number of hydrogen bonds in a water molecule was increased. Overall, the addition of a proper amount of NaCl could change the secondary structure of pork proteins and enhance protein hydration, thereby helping improve processing properties of pork batter.
Key words:Raman spectroscopy; low field nuclear magnetic resonance (LF-NMR); water holding capacity; secondary structure; water structure
DOI:10.7506/spkx1002-6630-201715013
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2017)15-0077-05
引文格式:
李可, 赵颖颖, 康壮丽, 等. NaCl对猪肉糜加工特性和蛋白质二级结构的影响[J]. 食品科学, 2017, 38(15): 77-81. DOI:10.7506/spkx1002-6630-201715013. http://www.spkx.net.cn
LI Ke, ZHAO Yingying, KANG Zhuangli, et al. Effect of NaCl on processing characteristics and protein secondary structures in pork meat batters[J]. Food Science, 2017, 38(15): 77-81. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201715013. http://www.spkx.net.cn
收稿日期:2016-06-24
基金项目:国家自然科学基金青年科学基金项目(31501508;31601492);河南省高校科技创新团队支持计划项目(13IRTSTHN006);河南省高等学校重点科研项目(16A550006)
作者简介:李可(1986—),男,讲师,博士,研究方向为肉品加工与质量安全控制。E-mail:xc_like@163.com
*通信作者:康壮丽(1980—),男,讲师,博士,研究方向为肉品加工与质量安全控制。E-mail:kzlnj1988@163.com