于国萍,齐微微,藏小丹,郭佩佩,王艳菲,陈 超,孙 琪
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:为探究胰凝乳蛋白酶与谷氨酰胺转氨酶(transglutaminase,TGase)复合酶法改性制备乳清分离蛋白(whey protein isolate,WPI)可溶性聚合物的性质,本实验利用电泳、荧光分光光度计和旋转流变仪等对可溶性聚合物的性质进行对比分析。结果表明:复合酶改性制得的聚合物与单一TGase改性相比,黏度增大,游离巯基含量显著降低,但表面疏水性和ζ-电位无显著变化。复合酶改性聚合物平均粒径是(153.66±9.15) μm,而TGase改性聚合物平均粒径是(157.92±10.91) μm,没有显著差异。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和非变性聚丙烯酰胺凝胶电泳对比分析得出,单独的TGase改性聚合物分子质量较大,被截留在凝胶加样口,而复合酶改性聚合物分子质量更多的集中在65 kD附近,即聚合物分子大小适中,这与粒径的结果相呼应。胰凝乳蛋白酶和TGase复合改性聚合物表面呈波纹片状,结构均一紧致。与未改性的WPI相比,复合酶改性WPI聚合物pH值溶解性曲线在pH 2.0~7.0范围变化较平缓,且在pH 4.0~5.0时溶解性提高。此研究结果为复合酶法改性WPI在酸乳或酸性乳饮料方面的应用提供了理论依据与技术参考。
关键词:乳清分离蛋白;可溶性聚合物;胰凝乳蛋白酶;谷氨酰胺转氨酶
乳清蛋白可溶性聚合物[1]为介于蛋白单体与不可溶性凝胶网络结构或沉淀的一种中间状态,也称为溶胶或可流动的凝胶。乳清蛋白经过改性制得可溶性聚合物(soluble aggregates,SA),改善并拓展了乳清蛋白在起泡[2]、乳化[3]、凝胶[4]、成膜和包埋[5]等方面的应用。正因为SA具有多样的结构和理化的性质,其在食品中的应用相当广泛。
酶法改性制备可溶性聚合物主要涉及两类酶:蛋白水解酶和交联酶。蛋白水解酶通过类蛋白反应,改变蛋白的二级和三级结构,由此改变表面暴露的活性氨基酸,这些活性基团可以促进分子间的相互作用,有助于蛋白聚合[6],生成沉淀、触变胶体或具有良好流变学性质黏稠的可溶性聚合物[7-8]。交联酶主要为微生物谷氨酰胺转氨酶(transglutaminase,TGase),TGase催化蛋白质分子间或分子内的肽段之间形成ε-(γ-谷氨酰)赖氨酸共价键[9]。近年来,关于蛋白酶和TGase复合改性蛋白的研究较多[10-11],王凯强等[11]先利用胰蛋白酶水解小麦面筋蛋白,能暴露出更多谷氨酰胺残基供与TGase,致水化小麦面筋蛋白形成更为多孔且致密的小麦面筋蛋白网络结构,但是过度的酶解将不利于TGase的交联反应。所以可以利用蛋白水解酶和交联酶同时作用于乳清蛋白,用以进一步形成高黏度稳定型的聚合物。
本实验以乳清分离蛋白(whey protein isolate,WPI)为研究对象,在已有的对多种酶筛选的基础上,确定将胰凝乳蛋白酶与TGase复合酶法改性WPI制备可溶性聚合物,以获得高凝胶稳定型酶法复合改性WPI聚合物,产品可作为具有增稠、稳定、凝固作用的蛋白源的食品添加剂,以替代价格昂贵的果胶或其他非蛋白源食用胶,应用于酸乳与乳酸饮料中,既可以提高WPI的使用价值,拓宽酶的应用,也为酶法改性WPI提供新的理论依据,为可溶性聚合物的形成提高新思路。
1.1 材料与试剂
WPI(蛋白质含量90.90%) 新西兰Fonterra公司;TGase(酶活力为100 U/g) 泰兴市一鸣生物制品有限公司;胰凝乳蛋白酶(chymotrypsin type Ⅱ,酶活力为5.65×105U/g) 北京博奥拓达科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
pHS-3C型精密pH计 上海雷磁仪器厂;NDJ-5S旋转黏度计 上海精密科学仪器有限公司;TA-XT2 Plus物性测定仪 英国Stable Micro System公司;Mastersizer-2000型激光粒度分析仪、ζ-电位分析仪英国Malvern公司;S-3400N扫描电子显微镜、F-4500荧光分光光度计 日本日立公司;Mini-PROTEAN Tetra Cell电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 酶法改性WPI
以未改性WPI为对照组(记为未改性组),进行以下5 种改性处理:pH 8碱改性条件下进行(记为碱改性组);pH 8、85 ℃、5 min条件下热改性(记为热改性组);pH 8、85 ℃、5 min条件下预热,5 U/g TGase,50 ℃加热60 min,再85 ℃、5 min酶灭活(记为TGase改性组);pH 8条件下胰凝乳蛋白酶添加量为0.01%,再85 ℃、5 min酶灭活(记为水解改性组);pH 8条件下5 U/g TGase、0.01%胰凝乳蛋白酶双酶复合改性(记为复合酶改性组)。
1.3.2 指标测定
1.3.2.1 可溶性聚合物黏度的测定
可溶性聚合物的制备参照前期实验齐微微[12]的方法,将可溶性聚合物冷却至室温,利用旋转黏度计测定其黏度。
1.3.2.2 可溶性聚合物浊度的测定
样品测定完黏度之后,立即测定其浊度值,根据David等[13]的方法,略有改动。样品原液测定,不用稀释,通过紫外分光光度计,在420 nm波长处测定吸光度A420nm。
1.3.2.3 可溶性聚合物游离巯基含量的测定
样品中游离巯基含量的测定方法参照Beveridge等[14],并有所改动。取5 mL Tris-Gly缓冲溶液加入到0.06 mL的WPI聚合物溶液中,然后在向其中加入20 μL的5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)试剂,振荡混匀,在室温条件下静止15 min,利用紫外分光光度计在412 nm波长处测定吸光度,将0.06 mL去离子水替换样品溶液,再加5 mL的缓冲液和20 μL的DTNB试剂做空白调零。以下式计算游离巯基含量。
式中:A412nm为在412 nm波长处的吸光度,计算时取其平均值;ρ为固形物含量/(mg/mL);D为稀释系数。
1.3.2.4 可溶性聚合物表面疏水性的测定
参照Hayakawa等[15]的测定方法,并加以改进,用0.01 mol/L的磷酸盐缓冲液(pH 6.7)将样品溶液稀释,稀释5 个质量浓度从0.002 g/100 mL到0.010 g/100 mL。取样5 mL,然后加入20 μL的ANS荧光探针,测得的荧光强度对蛋白溶液质量浓度作图,线性关系良好的回归线的斜率作为蛋白质表面的疏水性指数。测定的条件:样品混匀后在室温条件下避光15 min,激发波长390 nm,发射波长470 nm,狭缝5 nm。
1.3.2.5 可溶性聚合物pH值溶解性的测定
pH值溶解性的测定根据Zhu Haiming等[16]的方法。用0.5 mol/L的HCl或NaOH溶液调节pH值,pH值的变化范围为2.0~7.0,利用紫外分光光度计在500 nm的波长下测定样品不同pH值条件的吸光度。
1.3.2.6 可溶性聚合物粒径大小及分布的测定
利用Mastersizer-2000激光粒度仪进行粒径分布的测定。
1.3.2.7 可溶性聚合物ζ-电位的测定
采用ζ-电位分析仪测定不同处理样品的ζ-电位。
1.3.3 可溶性聚合物十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)按照Laemmli[17]实验方法加以改进,分离胶质量浓度为12 g/100 mL、浓缩胶质量浓度为5 g/100 mL。样品缓冲液(含有5%巯基乙醇和2% SDS)和样品溶液直接混合(体积比为1∶1)电泳前煮沸3 min。取5 μL该混合液上样,浓缩胶电压为60 V,分离胶电压为90 V。之后用0.1%的考马斯亮蓝染色。最后脱色,分析组分的差异。非变性聚丙烯酰胺凝胶(Native-PAGE)制胶时不加SDS,样品缓冲液中也不加入巯基乙醇和SDS,其他操作与SDS-PAGE相同。
1.3.4 可溶性聚合物扫描电子显微镜观察
电子显微镜扫描分析参考Helen等[18]方法。
1.4 数据统计分析
实验数据均使用SPSS 18.0软件进行统计分析,所用数据均为3 次的平均数,单因素方差分析(ANOVA)中采用Duncan检验。作图采用Sigma Plot 9.0软件。
2.1 不同改性条件制得WPI聚合物的黏度和浊度

图1 不同改性条件下WPI聚合物的黏度和浊度
Fig. 1 Viscosity and turbidity of differently modif i ed aggregates
由图1可知,与未改性的WPI相比(柱1),85 ℃、5 min热改性(柱2)聚合物与胰凝乳蛋白酶限制性水解改性(柱4)聚合物黏度变化不显著,即表明单一的水解WPI改性与85 ℃、5 min热改性不能提高WPI的黏度。而在热改性的基础上添加5 U/g的TGase,50 ℃加热60 min聚合物的黏度显著提高(柱3)。胰凝乳蛋白酶和TGase复合改性WPI制得聚合物黏度(柱5)与单一TGase改性相比,显著提高。
从图1可以看出,WPI通过不同条件的处理,所得产物的浊度显著降低,但不同改性方法对浊度的影响无显著变化,未改性的WPI浊度最大。这与David等[13]利用枯草杆菌蛋白酶(subtilisin)和碱性蛋白酶(alcalase)等酶水解WPI研究其聚合行为,浊度的变化一致。本研究发现,黏度与浊度并未呈正相关的关系。
2.2 不同改性条件制得可溶性聚合物电泳分析

图2不同改性条件制得可溶性聚合物PAGE图谱
Fig. 2 PAGE prof i les of soluble aggregates with different modif i cations
图2 a泳道1表明WPI的3 条主要条带为α-乳清蛋白、β-乳球蛋白和牛血清白蛋白,分子质量分别约为14、18 kD和67 kD。图2a除了未改性的WPI,其余4 条泳道在加样口均有高分子聚合物,不能进入分离胶,说明热改性、TGase改性、水解改性和复合酶改性WPI都发生了聚合反应,这是由于每一种改性都有85 ℃、5 min的热变性,也说明热处理对WPI聚合的影响非常显著。泳道3和5的BSA条带变淡或消失,同时产生了新的亚基,说明TGase改性蛋白交联聚合,而且复合改性新产生的条带更多。α-乳清蛋白条带变浅,部分α-乳清蛋白参与聚合,而β-乳球蛋白条带变淡不明显,说明与β-乳球蛋白相比,α-乳清蛋白更利于TGase交联,这与Srinivasan等[19]的研究是一致的。
图2b更清晰地显示了各种改性条件对WPI聚合的影响。SDS-PAGE和Native-PAGE对比表明聚合时分子间二硫键的作用的重要性。泳道3和5中β-乳球蛋白和α-乳清蛋白条带均变浅,且泳道3条带更浅一些,说明单独的TGase改性导致更多的β-乳球蛋白和α-乳清蛋白聚合。分子质量在65 kD左右胰凝乳蛋白酶和TGase复合改性产生条带颜色更深一些,即产生分子质量适中的聚合物较多。通过两者对比分析得出,单独的TGase改性聚合物分子质量较大,分子质量较大的被截留在加样口,而复合酶改性聚合物分子质量更多地集中在65 kD附近。
2.3 不同改性处理制得可溶性聚合物粒径分析
未改性WPI平均粒径(27.05±0.89) μm,胰凝乳蛋白酶水解改性平均粒径减小到(19.14±0.51) μm,TGase改性聚合物为(157.92±10.91) μm,酶复合改性聚合物粒径为(153.66±9.15) μm,小于TGase改性,这与电泳图谱的结果一致。利用TGase改性和酶复合改性的粒径大小与Nicolai等[20]研究β-乳球蛋白的聚合模型,形成的可溶性聚合物的大小在15~150 nm类似。
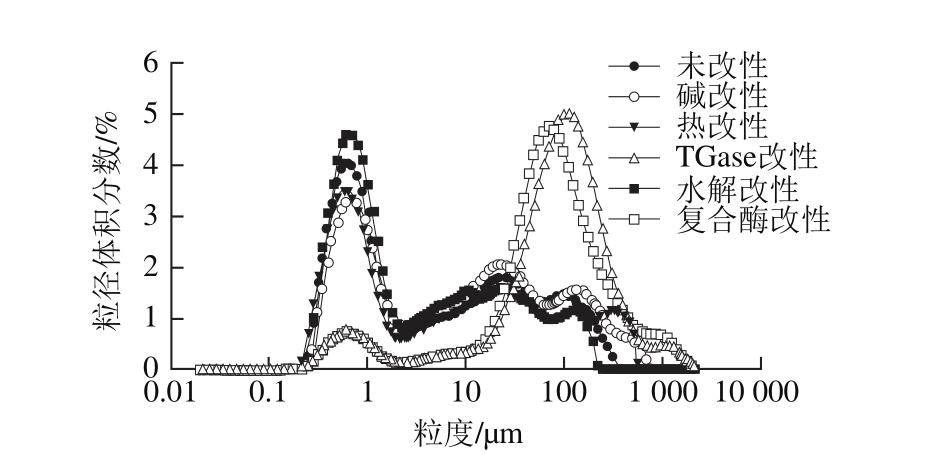
图3 不同改性条件制得可溶性聚合物的粒度分布比较
Fig. 3 Particle size distribution of soluble aggregates with different modif i cations
从图3可以看出,未改性WPI、碱改性、热改性和胰凝乳蛋白酶水解改性的聚合物粒径分布曲线相似,而TGase改性和复合酶改性的粒径分布曲线相似,在1 μm处体积分数减小,在100 μm处增大。
2.4 不同改性处理制得可溶性聚合物在不同pH值条件下溶解性的变化
图4表明了不同的改性条件对产物在pH 2.0~7.0范围内溶解性的影响。吸光度越小,表明聚合物的溶解性越好。Cheison等[21]研究了pH值对β-乳球蛋白结构的影响,当pH值大于7.5或小于2.0时,β-乳球蛋白以单聚体形式存在;当pH值在2.0~3.7和5.1~7.5时,β-乳球蛋白为二聚体;而pH值在3.7~5.1之间时,β-乳球蛋白形成八聚体。β-乳球蛋白为WPI的主要组成成分,因此本实验未改性的WPI的溶解度的变化可以用Cheison等[21]的研究解释,在pH 2.0~3.2和5.1~7.0,聚合物主要以二聚体形式存在,溶解性高,而在pH 3.7~5.1时,八聚体存在,溶解度低。
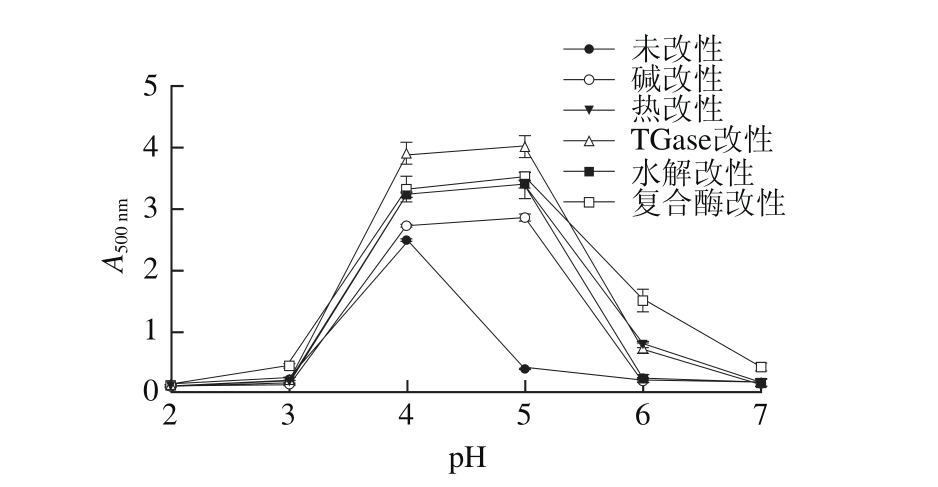
图4 不同改性条件对聚合物在不同pH值条件下溶解性的影响
Fig. 4 pH solubility profiles of aggregates with different modifications
当pH值调节到4.0时,聚合物的颜色由透明变成不透明的纯白色,此时的吸光度最大,溶解性最差。TGase改性的WPI在pH 4.0~5.0有最大吸光度,这可能是交联反应导致赖氨酸残基的ε-氨基酸减少,改变了蛋白表面的疏水亲水比率,导致在等电点处的大量沉淀。复合改性的WPI在pH 2.0~7.0范围为吸光度变化较平缓,且在pH 4.0~5.0时,吸光度低于TGase改性的WPI聚合物,即溶解性提高,溶解性越高,在体系中不易沉淀。说明在偏酸环境溶解性较高,更适于应用酸乳或酸性乳饮料中。
2.5 不同改性处理制得可溶性聚合物游离巯基含量的变化

图5 不同改性条件制得可溶性聚合物游离巯基含量的变化
Fig. 5 Free sulfhydrylcontents of aggregates with different modifications
由图5可知,自然状态下的WPI游离巯基含量最高,WPI经过一定温度的热处理,其游离巯基含量显著的降低,这可能是由于蛋白质在热处理过程中,蛋白质结构打开,游离巯基暴露并形成分子间二硫键或分子内二硫键所致[22]。Vardhanabhuti等[23]用8 mol/L的尿素或DTT作用于初级聚合物,佐证二硫键的确在这一阶段聚合物的形成起作用。所以热处理WPI的游离巯基降低。
与热改性相比,胰凝乳蛋白酶改性的聚合物游离巯基含量提高,这可能是由于极低限制性酶解改变了蛋白的二级结构,限制了游离巯基向二硫键转变亦或打开部分二硫键。与单独TGase改性相比,胰凝乳蛋白酶和TGase复合改性的游离巯基含量降低,这可能由于胰凝乳蛋白酶的作用,促进了TGase对WPI的交联,进而降低了游离巯基的含量。
2.6 不同改性处理制得可溶性聚合物表面疏水性的变化

图6 不同改性条件对可溶性聚合物表面疏水性的影响
Fig. 6 Effect of different modif i cation conditions on surface hydrophobicity of soluble aggregates
分子间的疏水相互作用是促进聚合的主要非共价作用力之一。加热促进蛋白粒子展开,大量疏水基团暴露,如图6所示,85 ℃、5 min热改性显著提高了WPI的表面疏水性。而TGase改性制得聚合物的表面疏水性降低,这是由于TGase改性,制得聚合物结构更紧密,使部分疏水性的区域被掩埋导致的。所以,胰凝乳蛋白酶作用使聚集的蛋白结构打开,与热改性相比,表面疏水性增大。酶复合改性的聚合物的表面疏水性介于TGase改性和胰凝乳蛋白酶改性,但变化差异不显著。
2.7 不同改性处理制得可溶性聚合物ζ-电位的变化

图7 不同改性条件制得可溶性聚合物的电位的变化
Fig. 7 Change inζ-of soluble aggregates with different modif i cations
ζ-电位是揭示胶体分散体系是否稳定的重要指标[24]。ζ-电位测定的是分子表面的所有电荷,不论是正电荷还是负电荷,ζ-电位越大,表明分子间静电排斥力越强越有利于聚合,尽管没有确切的数据说明,但推测出较低的表面疏水性和较高的负ζ-电位有利于胶体的稳定[25]。从图7可以看出,未改性的WPI溶液带负电荷,在各个改性条件下,蛋白带有的负电荷有所增加,但改变pH值和加热改性对ζ-电位的变化影响不显著。Ladan等[26]研究了胰凝乳蛋白酶对WPI水解过程ζ-电位的变化,研究表明未水解的WPI和热处理组的WPI的ζ-电位无显著变化,与本实验结果相符。TGase参与改性显著提高了聚合物的ζ-电位,未改性WPI的ζ-电位为-(13.00±1.74)mV,TGase参与改性后WPI聚合物ζ-电位降低到-(22.26±1.74) mV和-(19.27±3.22) mV,且单独的TGase改性高于复合酶改性的ζ-电位,但是变化不显著。这可能是由于蛋白酶的初步改性,使底物的结构变得松散,隐藏在内部的带电基团有所暴露,ζ-电位有所增加,同时依据谷氨酰胺转胺酶作用机理,它催化(γ-谷氨酰)赖氨酸共价键形成,使底物中的赖氨酸的ε-氨基参与反应,正电性减少,进一步导致负电性增加。Donato等[27]的研究表明,可溶性聚合物的ζ-电位约在-45~-25 mV范围内。通过对比分析,胰凝乳蛋白酶限制性水解改性提高了聚合物的ζ-电位,但变化不显著。
2.8 不同改性处理制得可溶性聚合物微观结构分析

图8 不同改性条件制得聚合物的扫描电子显微镜结果
Fig. 8 Scanning electron micrographs of aggregates with different modif i cations
未改性的WPI和pH 8的WPI冷藏24 h后仍为液体,未形成凝胶没有测定其微观结构。热改性及胰凝乳蛋白酶改性制得聚合物形成淡棕色,透明的半固体凝胶;TGase改性和复合酶改性制得聚合物形成淡棕色、透明、有弹性的固体凝胶。有研究表明凝胶形成的不透明性与凝胶的微观结构有较大关系,即不透光凝胶为颗粒结构,而半透明凝胶为丝状结构。85 ℃、5 min热改性的聚合物表面呈波浪状(图8A1),放大倍数到4 000 倍时观察,结构致密,表面粗糙,有大小不一的颗粒浮于表面(图8B1)。TGase改性的聚合物呈片状长线型不规则性,表面光滑,这有利于黏度的增大。胰凝乳蛋白酶水解改性制得聚合物结构较松散,表面不光滑,图8A3、B3与B1相比较,颗粒变小,表面较平整,这是由于酶解作用,裂解了蛋白肽链,蛋白分子质量变小,聚合度降低,所以结构较松散。胰凝乳蛋白酶和TGase复合改性聚合物表面呈波纹片状,与单独的TGase改性相比,通过复合酶改性产生更多分子质量适中的聚合物,所以聚合物结构边缘更圆润、宽厚,表面圆滑,放大4 000 倍时观察,结构均一紧致。较厚和较光滑的结构表明蛋白间的相互作用提高,结构更稳定[28]。
酶复合改性制得的聚合物与单一TGase改性相比,黏度增大,游离巯基含量显著降低,但表面疏水性和ζ-电位无显著变化。通过SDS-PAGE和Native-PAGE对比分析得出,单独的TGase改性聚合物分子质量较大,分子质量较大的被截留在加样口,而复合酶改性聚合物分子质量更多地集中在65 kD附近,即聚合物分子大小适中,这与粒径的结果相呼应。胰凝乳蛋白酶和TGase复合改性聚合物表面呈波纹片状,结构均一紧致。与未改性的WPI相比,改性制得的WPI聚合物浊度显著降低,pH值溶解性曲线在pH 2.0~7.0范围为变化较平缓,且在pH 4.0~5.0时,溶解性提高。为酶法复合改性WPI聚合物在酸乳或酸性乳饮料方面的应用提供理论依据与技术参考。
参考文献:
[1] RYAN K, ZHONG Q X , EDWARD A. Use of whey protein soluble aggregates for thermal stability: a hypothesis paper[J]. Journal of Food Science, 2013, 78(8): 1105-1115. DOI:10.1046/j.1365-2621.1999.00310.x.
[2] SCHMITT C, BOVAY C, ROUVET M, et al. Whey protein soluble aggregates from heating with NaCl: physicochemical, interfacial, and foaming properties[J]. Langmuir, 2007, 23(8): 4155-4166. DOI:10.1021/la0632575.
[3] MORO A, BAEZ G D, BUSTI P A, et al. Effects of heat-treated beta-lactoglobulin and its aggregates on foaming properties[J]. Food Hydrocolloids, 2011, 25(5): 1009-1015. DOI:10.1016/ j.foodhyd.2010.09.021.
[4] MCSWINEY M, SINGH H, CAMPANELLA O H. Thermal aggregation and gelation of bovine beta-lactoglobulin[J]. Food Hydrocolloids, 1994, 8(5): 441-453. DOI:10.1016/S0268-005X(09)80087-8.
[5] BENGOECHEA C, JONES O G, GUERRERO A M. Formation and characterization of lactofer-rin/pectin electrostatic complexes: impact of composition, pH and thermal treatment[J]. Food Hydrocolloids, 2011, 25(5): 1227-1232. DOI:10.1016/j.foodhyd.2010.11.010.
[6] EALLEN F, JACKP D. Food protein functionality: a comprehensive approach[J]. Food Hydrocolloids, 2011, 25(8): 1853-1864. DOI:10.1016/j.foodhyd.2011.05.008.
[7] 赵晶, 张睿. 微生物谷氨酰胺转胺酶对乳清蛋白的改性[J]. 中国乳品工业, 2004, 32(2): 36-39. DOI:10.3969/j.issn.1001-2230.2004.02.010.
[8] 姚玉静, 崔春, 邱礼平, 等. 类蛋白反应条件及其机理探讨[J]. 中国调味品, 2009, 34(2): 45-48. DOI:10.3969/j.issn.1000-9973.2009.02.007.
[9] 姜燕. 酶法改性食物蛋白质成膜及其机理[D]. 广东: 华南理工大学, 2006: 17-21.
[10] WANG K Q, LUO S Z, CAI J, et al. Effects of partial hydrolysis and subsequent cross-linking on wheat gluten physicochemical properties and structure[J]. Food Chemistry, 2016, 197: 168-174. DOI:10.1016/ j.foodchem.2015.10.123.
[11] 王凯强, 黎敏, 罗水忠, 等. 酶法复合改性对小麦面筋蛋白性质和结构的影响[J]. 现代食品科技, 2016, 32(3): 177-182. DOI:10.13982/ j.mfst.1673-9078.2016.3.029.
[12] 齐微微. 酶法复合改性乳清蛋白制备可溶性聚合物及其性质研究[D].哈尔滨: 东北农业大学, 2016: 16-19.
[13] DAVID S, PATRICIA K, GERARDO C, et al. Aggregation properties of whey protein hydrolysates generated withbacillus licheniformis proteinase activities[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 1258-1265. DOI:10.1021/jf048754a.
[14] BEVERIDGE T, TOMA, NAKAI S. Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science, 2006, 39(1): 49-51. DOI:10.1111/j.1365-2621.1974.tb00984.x.
[15] HAYAKAWA S, NAKAI S. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J]. Journal of Food Science, 1985, 50(2): 486-491. DOI:10.1111/j.1365-2621.1985.tb13433.x. [16] ZHU Haiming, DAMODARAN S. Heat-induced conformational changes in whey protein isolate and its relationship to foaming properties[J]. Journal of Agricultural and Food Chemistry, 2002, 42(4): 846-855. DOI:10.1021/jf00040a002.
[17] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[18] HELEN W, JANE R, GREGORY H, et al. Physico-chemical properties, probiotic survivability, microstructure, and acceptability of a yogurt-like symbiotic oats-based product using pre-polymerized whey protein as a gelation agent[J]. Journal of Food Science, 2010, 75(5): 327-337. DOI:10.1111/j.1750-3841.2010.01637.x.
[19] SRINIVASAN D, KINGSELY K. Effect of microbial transglutaminase treatment on thermal stability and pH-solubility of heat-shocked whey protein isolate[J]. Food Hydrocolloids, 2013, 30(1): 12-18. DOI:10.1016/j.foodhyd.2012.04.012.
[20] NICOLAI T, BRITTEN M, SCHIMITT C. β-Lactoglobulin and WPI aggregates: formation, structure and applications[J]. Food Hydrocolloids, 2011, 25(8): 1945-1962. DOI:10.1016/ j.foodhyd.2011.02.006.
[21] CHEISON S, LAI M, LEEB E, et al. Hydrolysis of β-lactoglobulin by trypsin under acidic pH and analysis of the hydrolysates with MALDI-TOF-MS/MS[J]. Food Chemistry, 2011, 125(4): 1241-1248. DOI:10.1016/j.foodchem.2010.10.042.
[22] GULZAR M, CROGUENNEC T, JARDIN J, et al. Copper modulates the heat-induced sulfhydryl/disulf i de interchange reactions of β-lactoglobulin[J]. Food Chemistry, 2009 116(4): 884-891. DOI:10.1016/j.foodchem.2009.03.043.
[23] VARDHANABHUTI B, FOEGEDING E A. Rheological properties and characterization of polymerized whey protein isolates[J]. Journal of Agricultural and Food Chemistry, 1999, 47(9): 3649-3655. DOI:10.1021/jf981376n·Source:PubMed.
[24] 赵正涛, 李全阳, 王秀菊, 等. 不同酸度条件下牛乳乳清蛋白的稳定性[J]. 食品与发酵工业, 2009, 35(8): 156-159. DOI:10.13995/ j.cnki.11-1802/ts.2009.08.028.
[25] NICOLA T, DURAND D. Controlled food protein aggregation for new functionality[J]. Current Opinion in Colloid & Interface Science, 2013, 18(4): 249-256. DOI:10.1016/j.cocis.2013.03.001.
[26] LADAN R, MICHEL B. Effect of whey protein enzymatic hydrolysis on the rheological properties of acid-induced gels[J]. Food Hydrocolloids, 2009, 23: 2302-2308. DOI:10.1016/ j.foodhyd.2009.06.011.
[27] DONATO L, SCHMITT C, BOVETTO L, et al. Mechanism of formation of stable heat-induced β-lactoglobulin microgels[J]. International Dairy Journal, 2009, 19(5): 295-306. DOI:10.1016/ j.idairyj.2008.11.005.
[28] PINTERITS A, ARNTFIELD S D. Improvement of canola protein gelation properties through enzymaticmodification with transglutaminase[J]. LWT-Food Science and Technology, 2008, 41(1): 128-138. DOI:10.1016/j.lwt.2007.01.011.
Properties of Soluble Aggregates Prepared from Whey Protein Isolate Modif i ed by Mixed Enzymes
YU Guoping, QI Weiwei, ZANG Xiaodan, GUO Peipei, WANG Yanfei, CHEN Chao, SUN Qi
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:This study was aimed to explore the properties of soluble aggregates from whey protein isolate (WPI) modif i ed with mixed chymotrypsin and transglutaminase (TGase) using electrophoresis, a fluorescence spectrophotometer and a rotational rheometer. The results showed that the viscosity of protein aggregates modif i ed by mixed enzymes was higher, and the content of free sulfhydryl groups was signif i cantly decreased; however, the surface hydrophobicity and ζ-potential did not change signif i cantly when compared with single TGase modif i cation. The average particle size of mixed enzymemodif i ed aggregates was (153.66 ± 9.15) μm, while that of TGase-modif i ed aggregates was (157.92 ± 10.91) μm, suggesting no signif i cant difference. Comparative analysis using SDS-PAGE and Native-PAGE showed that single TGase-modif i ed aggregates had higher molecular weight, and was trapped at the injection port; in contrast, the molecular weight of aggregates modif i ed by mixed enzymes was moderate, mostly distributed around 65 kD, which was coincided with the particle size distribution. The surface of aggregates modified by both enzymes showed a corrugated shape with structural uniformity. The solubility curve of mixed enzyme-modified WPI aggregates in the range of pH 2.0–7.0 was gentle, while the solubility was increased at pH 4.0–5.0 when compared with the unmodif i ed whey protein. The results in this study may provide a theoretical basis and technical reference for applying enzymatically modif i ed WPI in yogurt and fermented dairy beverage.
Key words:whey protein; soluble aggregates; chymotrypsin; transglutaminase(TGase)
DOI:10.7506/spkx1002-6630-201715015
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)15-0089-06
引文格式:
于国萍, 齐微微, 藏小丹, 等. 复合酶法改性制备乳清分离蛋白可溶性聚合物的性质[J]. 食品科学, 2017, 38(15): 89-94.
DOI:10.7506/spkx1002-6630-201715015. http://www.spkx.net.cn
YU Guoping, QI Weiwei, ZANG Xiaodan, et al. Properties of soluble aggregates prepared from whey protein isolate modified by mixed enzymes[J]. Food Science, 2017, 38(15): 89-94. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201715015. http://www.spkx.net.cn
收稿日期:2016-06-29
基金项目:“十二五”国家科技支撑计划项目(2013BAD18B07-03)
作者简介:于国萍(1963—),女,教授,博士,研究方向为农产品精深加工。E-mail:yuguopingneau@hotmail.com