葛双双,张雯雯,李 坤,徐 涓,刘兰香,郑 华,张 弘*
(中国林业科学研究院资源昆虫研究所,国家林业局特色森林资源工程技术研究中心,云南 昆明 650224)
摘 要:本研究旨在研究余甘子核仁油的体外抗氧化作用,并探索多不饱串联和脂肪酸的抗氧化机理。以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazl,DPPH)自由基与2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphoate) radical,ABTS+·)为实验对象,通过余甘子核仁油对2种自由基的清除作用,评估其体外抗氧化能力。结果表明:余甘子核仁油对DPPH自由基清除作用的半抑制浓度(half maximal inhibitory concentration,IC50)为5.08 mg/mL,最大清除率为95.91%;对ABTS+·清除作用的IC50为9.84 mg/mL,最大清除率为98.58%。α-亚麻酸的清除自由基实验表明,余甘子核仁油中起抗氧化作用的主要物质为α-亚麻酸等多不饱和脂肪酸。通过抗氧化前后混合脂肪酸的紫外光谱扫描、红外光谱吸收,检测到了氧化后混合脂肪酸中共轭脂肪酸和羟基脂肪酸的生成,并在DPPH自由基过量条件下,利用气相色谱-质谱联用仪检测到了单羟基脂肪酸的存在,从而证明多不饱和脂肪酸清除自由基反应机理基至少包括多不饱和脂肪酸的共轭化、单分子加成、碳碳双键α-H氧化及环氧化。
关键词:余甘子核仁油;体外抗氧化能力;多不饱和脂肪酸;α-亚麻酸;抗氧化作用机理
余甘子(Phyllanthus emblica L.)属大戟科叶下珠属植物,广泛分布于中国、印度、印度尼西亚、马来半岛的热带和亚热带地区[1],余甘子在中国与印度的传统药物体系中已经使用了1 000多年,也是世界卫生组织指定广泛种植的3 种保健植物之一[2]。余甘子中富含多酚类、生物碱类、类黄酮、糖类、VC等成分[3-4]。丰富的营养成分使得余甘子具有抗衰老[5-7]、降血脂[8]、抑菌[9]、抗动脉粥样硬化[10]、抗癌[11]等多种保健和药用功效。因此,针对余甘子果肉、叶子及其根茎的相关研究较多[12-14],而对余甘子核仁的研究甚少。近年来,出现了少量有关余甘子核仁的研究,主要集中在余甘子核仁油的提取方法[15]及其脂肪酸组成的分析等方面[16-18]。从其脂肪酸组成来看,余甘子核仁油的不饱和度较高,α-亚麻酸更是超过50%[19]。事实上,围绕不饱和脂肪酸的研究已涵盖了诸多方面[20-23],抗氧化无疑是研究热点之一。然而,绝大多数抗氧化研究关注的是试材自身对不同自由基的清除活性,对试材中发挥抗氧化作用的物质种类却多不明确,对试材中活性物的抗氧化机理研究更是鲜有报道。就油脂与不饱和脂肪酸而言,有关其自氧化的报道较多[24-27],然而,对其抗氧化的相关报道较少。少量有关油脂与不饱和脂肪酸抗氧化的报道,亦偏重于抗氧化活性研究[28-29]。本实验以余甘子核仁油为研究对象,在验证了余甘子核仁油抗氧化活性的基础上,揭示了油脂中抗氧化活性物质的类别,并进一步对不饱和脂肪酸的抗氧化机理进行了探索,为油脂抗氧化的深入研究提供了参考。
1.1 材料与试剂
余甘子核仁由昆明酷特利生物科技有限公司提供。
氢氧化钾、过硫酸钾(均为分析纯) 天津市风船化学试剂有限公司;正己烷、无水乙醇、乙醚、甲醇、苯、石油醚(60~90 ℃)(均为分析纯)广东光华科技股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazl,DPPH)自由基 美国Sigma公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphoate),ABTS)(纯度100%) EMD生物科技有限公司;抗坏血酸(分析纯) 国药集团化学试剂有限公司;亚麻酸甲酯(纯度≥99.5%,色谱纯)阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
AB204-S精密型电子天平 瑞士梅特勒-托利多(中国)有限公司;116型摇摆式六两装高速中药粉碎机 浙江瑞安市永历制药机械有限公司;TY742X2A纯水机 美国Barnstead公司;DSX-90数显搅拌机杭州仪表电机有限公司;VOS-3000VD型真空干燥箱、N1000 Rotavapor R11型旋转蒸发仪 日本东京理化器械株式会社;DU 800紫外分光光度计 美国贝克曼库尔特有限公司;Tensor-27傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪 德国布鲁克公司;Xevo TQ-S超高压液相色谱三重四极杆串联质谱联用仪 美国Waters公司;ITQ 900气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 余甘子核仁油的提取
取适量余甘子核仁粉碎,参照GB/T 14488.1—2008《植物油料含油量测定》[30],以正己烷为溶剂进行提取,提取液经旋蒸浓缩后得到余甘子核仁油。
1.3.2 余甘子核仁油对DPPH自由基清除率的测定
以无水乙醇为溶剂,分别配制浓度为2×10-4mol/L的DPPH自由基溶液,配制质量浓度为2.0、5.0、10.0、15.0、20.0、30.0 mg/mL的余甘子核仁油溶液和质量浓度为0.01、0.02、0.03、0.04、0.05 mg/mL抗坏血酸溶液。精确吸取4 mL不同质量浓度余甘子核仁油溶液和抗坏血酸溶液,加入4 mL DPPH自由基溶液,摇匀后在暗室下放置30 min,在517 nm波长处测定上述溶液的吸光度[31]。按照式(1)计算DPPH自由基清除率。
式中:A为样品(不同质量浓度的样品溶液)与DPPH混合溶液的吸光度;A0为样品(同上)与无水乙醇混合溶液的吸光度;A1为无水乙醇与DPPH混合溶液的吸光度。
1.3.3 余甘子核仁油对ABTS+·清除率的测定
将ABTS及过硫酸钾用少量水溶解,再以无水乙醇为溶剂配制浓度为7×10-3mol/L 的ABTS+·溶液与浓度为2.5×10-3mol/L 的过硫酸钾溶液,并将二者等体积混合,在暗处放置12 h后取混合溶液稀释50 倍待用。配制质量浓度为5.0、10.0、15.0、20.0、30.0 mg/mL的余甘子核仁油溶液和质量浓度为0.01、0.02、0.03、0.04、0.05、1.00 mg/mL的抗坏血酸溶液。精确吸取1 mL不同质量浓度的余甘子核仁油样品溶液或抗坏血酸样品溶液,分别加入5 mL ABTS+·和过硫酸钾混合溶液,摇匀后于室温条件下避光30 min。以无水乙醇作为对照,在734 nm波长处分别测定上述溶液的吸光度[32]。按照式(2)计算其清除率。
式中:A为样品(不同质量浓度的样品溶液)与ABTS+·和过硫酸钾混合溶液的吸光度;A0为样品(同上)与无水乙醇混合溶液的吸光度;A1为无水乙醇与ABTS+·和过硫酸钾混合溶液的吸光度。
1.3.4 亚麻酸甲酯对DPPH自由基清除率的测定
配制质量浓度为1.0、2.0、4.0、6.0、8.0、10.0 mg/mL的亚麻酸甲酯样品溶液,采用1.3.2节中的方法,按式(1)计算亚麻酸甲酯对DPPH自由基的清除率。
1.3.5 余甘子核仁油混合脂肪酸的制备方法
称取30 g余甘子核仁油加入装有300 mL浓度为1 mol/L KOH-乙醇溶液的烧瓶中,在80 ℃的水浴中加热回流1 h,回流期间不断摇动烧瓶,皂化完全冷却至室温,得到皂化液,加入100 mL蒸馏水,将其混合均匀,转移至分液漏斗,分别用300 mL正己烷萃取非皂化物3 次,取下层水相,用体积分数为10%的HCl调pH值至2~3,加入适量的正己烷进行萃取,留正己烷相,并加入无水硫酸钠脱水,经溶剂回收得到混合脂肪酸。称取上述混合脂肪酸200 mg,定容至100 mL,配制质量浓度为2 mg/mL混合脂肪酸溶液后保存备用。
1.3.6 余甘子核仁油的抗氧化作用机理研究
1.3.6.1 氧化前后余甘子核仁油的组分分析
余甘子核仁油与混合脂肪酸的甲酯化方法参照GB/T 17376—2008《动植物油脂脂肪酸甲酯制备》[33]中三氟化硼法。
气相色谱条件:色谱柱:C P 7 4 2 0毛细管柱(100 m×0.25 mm,0.25 µm);升温程序:初始温度100 ℃,保持20 min,以20 ℃/min的速率升至190 ℃,保持20 min,然后以1 ℃/min的速率升温到210 ℃,保持10 min,再以4 ℃/min的速率升温至250 ℃,最后保持10 min;进样口温度:250 ℃;载气:高纯氦气,流速1.0 mL/min;分流比:20∶1;进样量:1 μL。
质谱条件:电离方式:电子轰击离子源,电子能量70 eV;离子源温度:250 ℃;传输线温度:250 ℃;质量扫描范围:40~400 u。
1.3.6.2 多不饱和脂肪酸抗氧化作用的结果验证
以α-亚麻酸甲酯代替余甘子核仁油,按照1.3.2节中的方法进行DPPH自由基清除实验,再按照1.3.6.1节的方法采用GC-MS仪检测。
1.3.6.3 多不饱和脂肪酸抗氧化作用机理研究
氧化前后样品的紫外-分光光度计分析:扫描条件:采样间隔为1 nm,扫描速率为中速,光谱宽带为1 nm,波长范围为200~800 nm,每个样品平行扫描3 次。
氧化前后样品的FT-IR分析条件:扫描范围为4 000~400 cm-1,分辨率为4 cm-1,固体样品经KBr压片后进行测试,液体样品直接滴加在KBr片上进行测试。
氧化前后样品的GC-MS分析:取DPPH溶液200 mL,与1 mL混合脂肪酸贮备液混合,按照1.3.2节方法进行DPPH自由基清除反应后,浓缩上述反应液至3~5 mL,参照文献[34]向反应浓缩液中加入2 mL体积分数为5%的氢氧化三甲基(间-三氟甲基)苯基铵(3-(tri fl uoromethyl)phenyltrimethylammonium hydroxide,TMTFTH)的甲醇溶液后,常温反应24 h,进行GC-MS检测。检测条件为:DB-5MS色谱柱(100 m×0.25 mm,0.25 µm),进样口温度300 ℃,接口温度300 ℃;升温程序:起始温度50 ℃,保持2 min,以10 ℃/min升至310 ℃,保持22 min;进样量5 μL;分流比50∶1;离子源温度250 ℃;四极杆温度180 ℃。
氧化前后样品的电喷雾质谱(electrospray ionization mass spectrometry,ESI源质谱)分析:取α-亚麻酸甲酯及1.3.5节中制备所得混合脂肪酸样品,按照1.3.2节的方法进行DPPH自由基清除实验后,采用ESI源质谱进样检测。质谱检测条件为:α-亚麻酸甲酯标准品为正离子模式ESI+,混合脂肪酸为负离子模式ESI-;锥孔电压5 V;射频透镜电压为0.5 V;源温120 ℃;脱溶剂气温度为350 ℃;脱溶剂气流为600 L/h;锥孔气流为50 L/h;采集模式为四通道选择性离子采集模式。
2.1 余甘子核仁油对DPPH自由基的清除能力
DPPH自由基溶液呈紫罗兰色且在517 nm波长处有特征吸收峰,当具有抗氧化成分的物质与自由基作用后,紫罗兰颜色褪去,通过溶液吸光度变化来计算自由基清除程度[35]。因此,可以通过对DPPH自由基的清除能力来评价某些组分的抗氧化活性。该法被广泛应用于物质清除自由基能力的研究中。不同质量浓度的余甘子核仁油溶液及抗坏血酸溶液对DPPH自由基的清除效果如图1所示。


图1 余甘子核仁油(a)和抗坏血酸(b)对DPPH自由基的清除作用
Fig. 1 DPPH radical scavenging capacity of Phyllanthus emblica L. seed oil (a) and ascorbic acid (b)
由图1可知,随着余甘子核仁油质量浓度的升高,对DPPH自由基清除率也逐渐增大。在2~20 mg/mL范围内,余甘子核仁油溶液对DPPH自由基的清除效果由26.28%迅速增加到95.70%;随着余甘子核仁油溶液质量浓度的进一步升高,清除率增加缓慢直至趋于平缓,当质量浓度在30 mg/mL时,清除率达到95.91%。抗坏血酸在质量浓度为0.02 mg/mL时,对DPPH自由基的清除率已经达到89.50%,最大清除率为93.03%,其半抑制浓度(half maximal inhibitory concentration,IC50)为0.015 mg/mL。根据文献[36]报道,抗坏血酸在低浓度时就有一定的清除作用,主要因为DPPH自由基溶液中有DPPH自由基和正离子态的DPPH+两种形态平衡存在,抗坏血酸对两种形态都具有清除作用,而油脂清除DPPH自由基的作用机理还未明确,本研究选择抗坏血酸作为余甘子核仁油体外抗氧化研究的一个阳性对照。由图1可知,余甘子核仁油对DPPH自由基的最大清除率与抗坏血酸相当,余甘子核仁油对DPPH自由基清除作用的IC50=5.08 mg/mL,文献[37]中葡萄籽油质量浓度为25 mg/mL时,对DPPH自由基的清除率在80%左右,燕麦粗油[38]的IC50=5.15 mg/mL,最大清除率在80%左右,与其他油脂相比,余甘子核仁油具有较强的抗氧化作用。
2.2 余甘子核仁油对ABTS+·的清除能力
检测一种物质抗氧化的能力时,由于其抗氧化原理不同,在一种检测方法中其抗氧化效果较好,而在另一种检测方法中可能是促氧化剂[39]。因此,实验选取ABTS+·作为另一种抗氧化活性检测方法。ABTS+·溶液呈蓝绿色,具有抗氧化活性的物质与其反应后导致溶液褪色,通过其在734 nm波长处吸光度的变化评价物质的抗氧化能力。余甘子核仁油样品溶液及抗坏血酸溶液对ABTS+·的清除效果如图2所示。
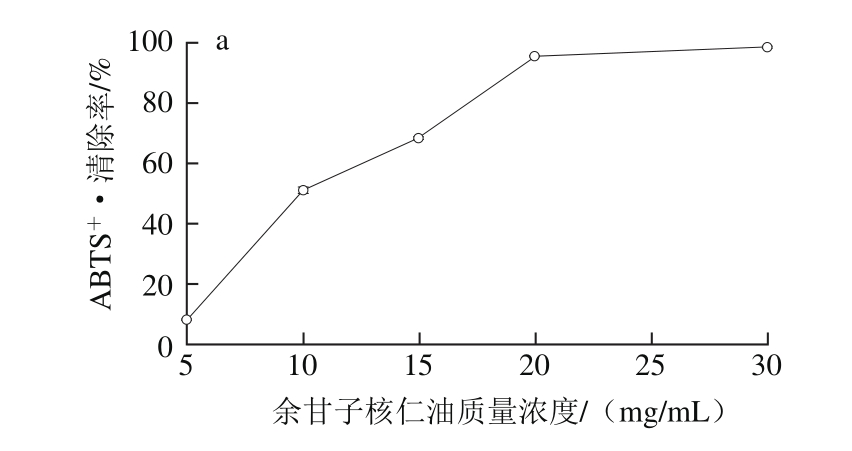

·的清除作用
Fig. 2 ABTS+· radical scavenging capacity of Phyllanthus emblica L. seed oil (a) and ascorbic acid (b)
图2余甘子核仁油(a)和抗坏血酸(b)对ABTS +
由图2可以看出,不同质量浓度的余甘子核仁油溶液与抗坏血酸溶液对ABTS+·均有清除作用,且随着质量浓度的提高,ABTS+·的清除率也逐渐升高。余甘子核仁油溶液在5~20 mg/mL范围内,对ABTS+·的清除率由8.41%迅速增加到95.70%,之后趋于平缓;对于ABTS+·,抗坏血酸溶液仍有较强的清除能力,在质量浓度为0.05 mg/mL时,对ABTS+·的清除率已经达到90.51%。余甘子核仁油对ABTS+·清除作用的IC50=9.84 mg/mL,抗坏血酸对ABTS+·清除作用的IC50=0.035 mg/mL,二者差异较大,不过余甘子核仁油对ABTS+·的最大清除率(98.58%)与抗坏血酸(90.51%)相近,表明余甘子核仁油具有一定的ABTS+·清除能力。
2.3 余甘子核仁油体外抗氧化作用机理研究
2.3.1 氧化前后余甘子核仁油的组分对比
由2.1和2.2节可知,余甘子核仁油对DPPH自由基和ABTS+·均显示出了一定的清除能力。从化学反应本质上看,清除自由基为氧化还原反应,自由基为氧化剂,作为还原剂的余甘子核仁油清除自由基后的氧化产物是分析其抗氧化机理的直接有力证据。因此,以DPPH自由基为例,采用三氟化硼甲酯化方法,对氧化前后余甘子核仁油的脂肪酸组成进行GC-MS检测,结果如表1所示。
表1 DPPH自由基处理前后余甘子核仁油中的脂肪酸组成及相对含量
Table 1 Fatty acid composition of Phyllanthus emblica L. seed oil before and after DPPH radical scavenging
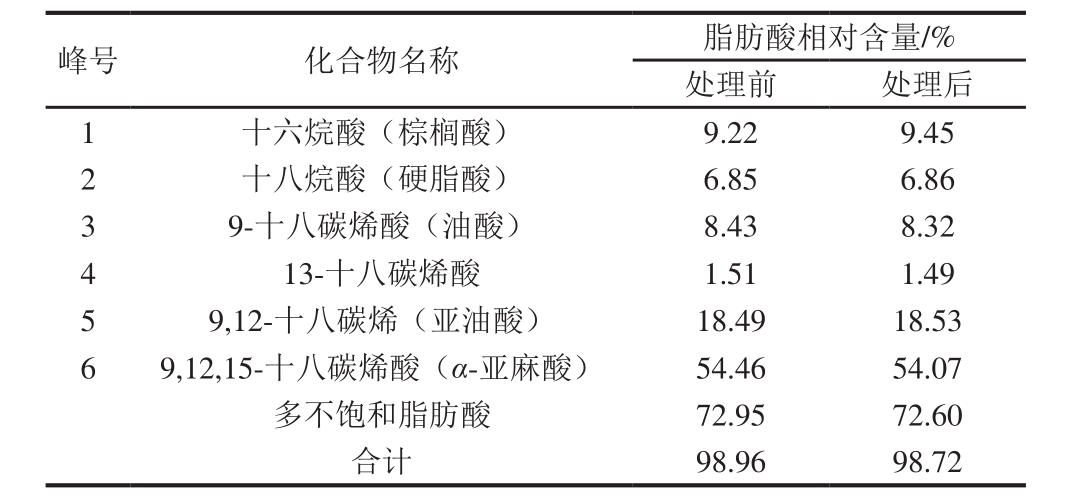
注:表中显示相对含量大于1%的脂肪酸。
由表1可知,DPPH自由基氧化前后余甘子核仁油的脂肪酸含量发生变化。氧化前,余甘子核仁油中主要有6 种脂肪酸,总含量占所检测出总成分的98.96%,其中多不饱和脂肪酸含量占72.95%,9,12,15-十八碳烯酸(α-亚麻酸)占检出化合物的54.46%。而氧化后,多不饱和脂肪酸和α-亚麻酸相对含量分别下降至72.60%和54.07%。尽管DPPH自由基氧化前后多不饱和脂肪酸的含量降低幅度不大,但必须指出的是,在该抗氧化实验中,DPPH自由基的用量仅为混合脂肪酸用量的1/375~1/25。依据余甘子核仁油的组成,并结合相关报道[40-41]可推测,余甘子核仁油中体外抗氧化作用的主要物质为多不饱和脂肪酸,而余甘子核仁油中多不饱和脂肪酸主要是α-亚麻酸。可见,α-亚麻酸可能就是余甘子核仁油中抗氧化的活性物质。为进一步验证该推论,以α-亚麻酸甲酯为还原剂的验证实验很有必要。
2.3.2 多不饱和脂肪酸的抗氧化作用验证

图3 α-亚麻酸甲酯对DPPH自由基的清除作用
Fig. 3 DPPH radical scavenging capacity of
由图3可以看出,α-亚麻酸甲酯对DPPH自由基有较好的清除作用,其作用效果及趋势与余甘子核仁油高度一致。主要区别在于相同质量浓度条件下,α-亚麻酸甲酯的DPPH自由基清除率明显高于余甘子核仁油,这初步说明α-亚麻酸在余甘子核仁油清除自由基中的主体作用。此外,以半数抑制率IC50为例,α-亚麻酸甲酯对DPPH自由基清除作用的IC50为2.81 mg/mL,2.1节中余甘子核仁油对DPPH自由基清除作用的IC50为5.08 mg/mL,其占比为55.3%,与余甘子核仁油中α-亚麻酸的相对含量为54.46%高度接近,可推断余甘子核仁油对DPPH自由基有清除作用的成分可能正是α-亚麻酸。
2.3.3 α-亚麻酸的抗氧化作用机理探索
为进一步探索α-亚麻酸对DPPH自由基的作用机理,以混合脂肪酸为样品,经DPPH自由基氧化前后的相关表征结果及分析如下。
2.3.3.1 紫外光谱扫描分析
如图4所示,DPPH自由基样品分别在326、515 nm波长处存在特征吸收峰,这与文献[42]报道的323 nm和 517 nm波长处存在吸收峰基本一致;混合脂肪酸样品在200~800 nm波长范围内并无特征吸收峰,而经DPPH自由基氧化后的混合脂肪酸在240、245、251、257 nm波长处分别有明显的特征吸收峰,这与相关报道共轭脂肪酸在230~240 nm波长范围内有特征吸收峰的结果吻合[43],且随着共轭结构的不同和共轭双键数目的增多,特征吸收峰发生红移[44]。

图4 DPPH自由基氧化混合脂肪酸后的全波长扫描
Fig. 4 Full wavelength scanning spectra of mixed fatty acids after DPPH radical scavenging
2.3.3.2 FT-IR分析
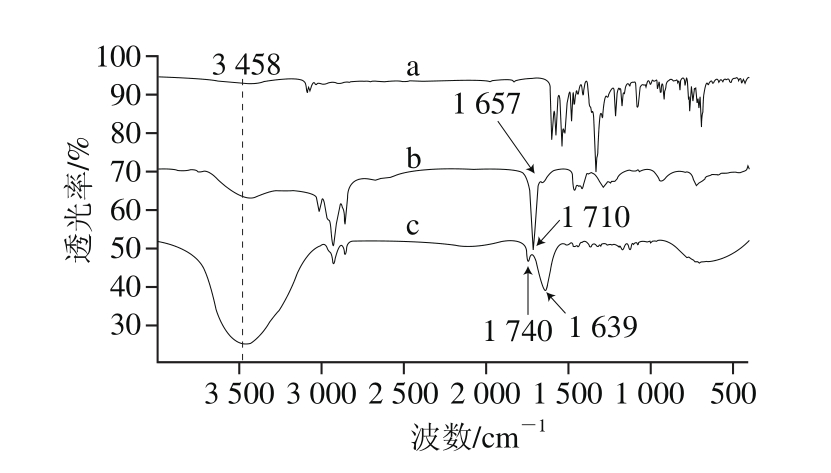
图5 DPPH自由基氧化前后混合脂肪酸的FT-IR对比
Fig. 5 FTIR spectra of mixed fatty acids after DPPH radical scavenging
a.固体DPPH自由基;b.混合脂肪酸;c. DPPH自由基氧化后的混合脂肪酸。
对比图5中DPPH自由基、混合脂肪酸、DPPH自由基氧化后的混合脂肪酸的FT-IR图可发现:1)氧化后的混合脂肪酸在3 458 cm-1处的羟基吸收峰相对前两者明显变宽变强,这说明氧化后的混合脂肪酸中的羟基数量明显增多;2)混合脂肪酸的1 710 cm-1处的羰基吸收峰,在氧化后平移至1 740 cm-1,且原1 657 cm-1处的非共轭—C=C—的伸缩振动吸收峰,平移至1 639 cm-1处的共轭— C=C—C=C—的伸缩振动吸收峰[45],这充分说明氧化后的混合脂肪酸样品中有新的共轭结构生成。
2.3.3.3 GC-MS分析
在2.3.1节中,通过GC-MS分析了经DPPH自由基氧化前后余甘子核仁油的脂肪酸组成差异,除质谱数据外,其他检测方法并未发现相关氧化产物的存在,原因在于以余甘子核仁油清除DPPH自由基时,核仁油过量(相同浓度条件下,DPPH自由基溶液与核仁油的加入体积比例为1∶1),即核仁油为DPPH自由基用量的25~375 倍,因此,即使反应转化率为100%条件下,氧化产物的占比也极小,仅为0.26%~3.80%,加之羟基脂肪酸仅为自由基氧化的中间产物,在其生成的同时,还必然伴随有深度氧化反应的消耗,因此存在于反应体系中的羟基脂肪酸的量极少,在GC-MS谱图中极易被掩盖。而在过量DPPH自由基氧化时,DPPH自由基与核仁油的加入体积比例为200∶1(如图5中c所示),即DPPH自由基的用量为混合脂肪酸的7.88 倍。以DPPH自由基过量的方式,通过GC-MS检测氧化前后混合脂肪酸成分的差异,结果如图6所示。
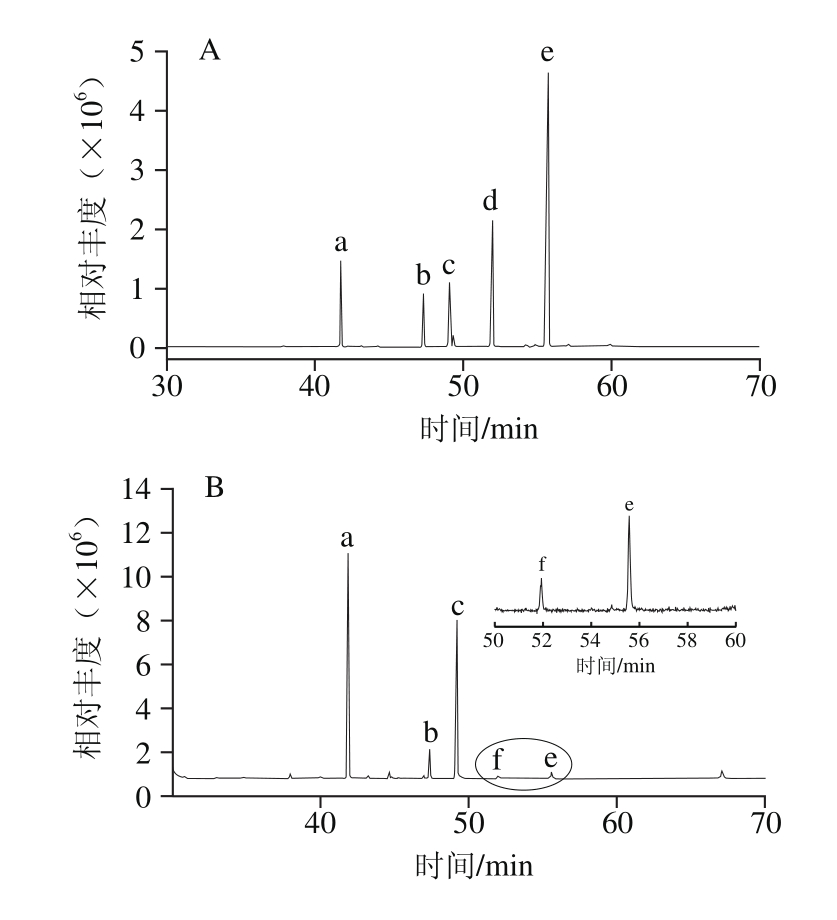
图6 过量DPPH自由基氧化前后混合脂肪酸的GC-MS谱图对比
Fig. 6 GC-MS prof i les of fatty acid mixture before and after oxidization by excessive DPPH radical
A.混合脂肪酸;B.混合脂肪酸+DPPH自由基。a.棕榈酸甲酯;b.硬脂酸甲酯;c.油酸甲酯;d.亚油酸甲酯;e. α-亚麻酸甲酯;f. 2-羟基亚麻酸甲酯。
由图6可知,氧化前后混合脂肪酸的组成在DPPH自由基过量的条件下表现出了明显的差异,氧化前混合脂肪酸中分别为棕榈酸、硬脂酸、油酸、亚油酸和α-亚麻酸,而经DPPH自由基氧化后,亚油酸(峰d)消失,α-亚麻酸(峰e)急剧降低,且在氧化后的气质检测图中产生了2-羟基亚麻酸。这再次说明余甘子核仁油中抗氧化的主要物质为α-亚麻酸和亚油酸等多不饱和脂肪酸,且抗氧化产物中确有羟基脂肪酸生成,而2号位羟基的存在则可能是部分双键发生转移的结果[46]。此外,这里必须指出的是,为降低多羟基脂肪酸的沸点,使得其在GC-MS中能够顺利汽化,本实验参照文献[34]中所采用的TMTFTH完全甲氧基化方法,但实际操作中发现TMTFTH与DPPH自由基间会优先发生反应,使得DPPH自由基溶液产生明显的褪色现象,这使得TMTFTH的甲氧基化效力降低,故而也仅检测到了单羟基脂肪酸的甲酯化产物(峰f)。
2.3.3.4 ESI源质谱分析
为全面地得到氧化产物信息以印证上述分析结果,氧化前后混合脂肪酸和α-亚麻酸甲酯的ESI源质谱检测结果图7所示。

图7 DPPH自由基氧化前后α-亚麻酸甲酯及混合脂肪样品的MS图
Fig. 7 Mass spectra of α-methyl linolenate and mixed fatty acids after DPPH radical scavenging
A. α-亚麻酸甲酯;B. DPPH自由基氧化后的α-亚麻酸甲酯;C.混合脂肪酸;D. DPPH自由基氧化后的混合脂肪酸。
由图7可知,氧化后α-亚麻酸甲酯及混合脂肪酸样品的MS图中分子离子峰明显增多,现以α-亚麻酸甲酯(M=292)和混合脂肪酸中的α-亚麻酸(M=278)为目标物,分析样品m/z的变化规律如表2所示。
表2 氧化后α-亚麻酸甲酯和α-亚麻酸的m/z变化
Table 2 Molecular weight variations of α- linolenic acid methyl ester and α- linolenic acid after oxidation

由表2可知,氧化后的α-亚麻酸及α-亚麻酸甲酯的m/z出现了较为明显的规律性变化,以α-亚麻酸甲酯为例,MS图中存在M+16及M+16+18的相对分子质量交替增长的变化规律,依据此规律,α-亚麻酸中m/z 395处的分子离子峰亦能较好吻合;而除个别相对分子质量有偏差外,α-亚麻酸甲酯的m/z与上述相对分子质量变化规律几乎完全吻合。可见,该体外抗氧化实验在DPPH自由基氧化α-亚麻酸的过程中,必然伴随着羟基脂肪酸的生成,且由相对分子质量M+16和M+18的交替增长方式来看,α-亚麻酸的氧化首先以非共轭双键的共轭化反应开始,这与Buege等[47]的研究报道相符,但与油脂自氧化不同的是,该氧化过程由于DPPH自由基的存在而更加迅速,因此,1 次氧化后的稳定终产物为α-亚麻酸的单羟基脂肪酸。随后的2 次氧化,则是由自由基进攻共轭双键开始的,抛开反应历程,单从反应产物来看,2 次氧化与1 分子H2O对—C=C—的加成反应类似,生成H—C—C—OH结构的羟基脂肪酸,第3次氧化与第1次氧化类似,继续发生的是剩余2 个非共轭双键重排为共轭双键[48],同时生成三羟基脂肪酸的过程,以此类推,直至双键消耗完全。然而,按照上述反应机理,最多只能产生五羟基脂肪酸,无法解释质谱中八羟基脂肪酸的存在,因此,在α-亚麻酸生成共轭脂肪酸的过程中,还应伴随有α-H氧化及环氧化反应的存在[26,49-50],使得部分双键环氧化后水解为双羟基脂肪酸。该反应机理示意图如图8。


图8 以α-亚麻酸为代表的体外抗氧化机理推测示意图
Fig. 8 Schematic diagram of putative antioxidant mechanism in vitro of α-linolenic acid
A.共轭化与单分子加成机理推测示意图;B.共轭化与环氧化反应机理推测示意图。
图8仅为以α-亚麻酸为还原剂清除DPPH自由基的反应中,α-亚麻酸的氧化机理示意图,并不意味着羟基脂肪酸即为氧化终产物。事实上,所生成的多羟基脂肪酸仅可视为α-亚麻酸抗氧化的中间产物,只是该中间产物能在一定时间内稳定存在,而随着反应时间的延长,该中间产物将继续氧化使得脂肪酸碳链断裂而生成小分子的醛、酮、酸类物质。
余甘子核仁油对DPPH自由基的最大清除率为95.91%,其IC50为5.08 mg/mL,对ABTS+·的最大清除率为98.58%,IC50为9.84 mg/mL。与葡萄籽油、核桃油等不饱和脂肪酸含量较高的油脂相比,余甘子核仁油具有较强的抗氧化活性。
余甘子核仁油中,抗氧化活性物质为多不饱和脂肪酸,即α-亚麻酸和亚油酸,其总含量占余甘子核仁油脂肪酸含量的72.95%,其中α-亚麻酸含量达54.46%。
以α-亚麻酸为目标物,通过对比氧化前后混合脂肪酸样品的紫外光谱扫描、FT-IR分析检测到氧化后混合脂肪酸样品中共轭脂肪酸和羟基脂肪酸的生成,并在DPPH自由基过量条件下以GC-MS检测到了单羟基脂肪酸的存在,并依据ESI源质谱的检测结果提出多不饱和脂肪酸清除自由基的过程是一个复杂反应,反应机理至少包括了多不饱和脂肪酸的共轭化、单分子加成、碳碳双键α-H氧化及环氧化。
参考文献:
[1] PERIANAYAGAM J B, SHARMA S K, JOSEPH A, et al. Evaluation of anti-pyretic and analgesic activity of Emblica off i cinalis Gaertn[J]. Journal of Ethnopharmacology, 2004, 95(1): 83-85. DOI:10.1016/ j.jep.2004.06.020.
[2] 李秀丽, 叶峰, 俞腾飞. 余甘子的药理研究进展[J]. 时珍国医国药, 2006, 17(2): 266-267. DOI:10.3969/j.issn.1008-0805.2006.02.083.
[3] LIU Xiaoli, ZHAO Mouming, WU Kegang, et al. Immunomodulatory and anticancer activities of phenolics from emblica fruit (Phyllanthus emblica L.)[J]. Food Chemistry, 2012, 131(2): 685-690. DOI:10.1016/ j. foodchem.2011.09.063.
[4] El-DESOUKY S K, RYU S Y, KIM Y K. A new cytotoxic acylated apigenin glucoside from Phyllanthus emblica L.[J]. Natural Product Research, 2008, 22(1): 91-95. DOI:10.1080/14786410701590236.
[5] 崔炳权, 林元藻. 余甘子的抗衰老作用研究[J]. 时珍国医国药, 2007, 18(9): 2100-2102.
[6] LIU Xiaoli, ZHAO Mouming, WANG Jinshui, et al. Antioxidant activity of methanolic extract of emblica fruit (Phyllanthus emblica L.) from six regions in China[J]. Journal of Food Composition and Analysis, 2008, 21(3): 219-228. DOI:10.1016/j.jfca.2007.10.001.
[7] POLTANOV E A, SHIKOV A N, DORMAN H J D, et al. Chemical and antioxidant evaluation of Indian gooseberry (Emblica off i cinalis Gaertn., syn. Phyllanthus emblica L.) supplements[J]. Phytotherapy Research, 2009, 23(9): 1309-1315. DOI:10.1002/ptr.2775.
[8] 高路, 张公信, 高云涛. 余甘子多糖提取物抗氧化活性研究[J]. 中国农学通报, 2011, 27(20): 133-136.
[9] SINGH B, SHARMA R A. Antioxidant and antimicrobial activities of callus culture and fruits of Phyllanthus emblica L.[J]. Journal of Herbs, Spices and Medicinal Plants, 2015, 21(3): 230-242. DOI:10.1080/1049 6475.2014.949998.
[10] LUO Wei, ZHAO Mouming, YANG Bao, et al. Antioxidant and antiproliferative capacities of phenolics purified from Phyllanthus emblica L. fruit[J]. Food Chemistry, 2011, 126(1): 277-282. DOI:10.1016/j.foodchem.2010.11.018.
[11] NGAMKITIDECHAKUL C, JAIJOY K, HANSAKUL P, et al. Antitumour effects of Phyllanthus emblica L.: induction of cancer cell apoptosis and inhibition of in vivo tumour promotion and in vitro invasion of human cancer cells[J]. Phytotherapy Research, 2010, 24(9): 1405-1413. DOI:10.1002/ptr.3127.
[12] 余小林, 徐步前, 曾贤强. 余甘子: 椪柑复合果汁饮料加工工艺研究[J]. 食品工业科技, 2006, 27(2): 139-141. DOI:10.13386/ j.issn1002-0306.2006.02.040.
[13] 刘冬. 余甘子清汁饮料加工工艺研究[J]. 食品与机械, 2007, 23(4): 136-139. DOI:10.13652/j.issn.1003-5788.2007.04.034.
[14] 罗维. 余甘子干果活性成分的分离鉴定与生理活性研究[D]. 广州:华南理工大学, 2010: 10-20.
[15] 宋佳, 朱岳麟, 熊常健, 等. 余甘子果核油的提取及成分分析[J]. 山东化工, 2012, 41(6): 48-50. DOI:10.3969/j.issn.1008-021X.2012.06.016.
[16] 张雯雯, 张弘, 郑华, 等. 余甘子核仁油的微波辅助萃取工艺优化及脂肪酸组成分析[J]. 食品科学, 2013, 34(20): 13-18. DOI:10.7506/ spkx1002-6630-201320003.
[17] 吴国欣, 李永星, 陈密玉, 等. 余甘籽油脂肪酸组成的GC-MS分析[J]. 中医药学报, 2003, 31(6): 21-23. DOI:10.3969/ j.issn.1002-2392.2003.06.009.
[18] 胡国庆, 熊常健, 朱岳麟, 等. 余甘子果核油组分性质及介电精制研究[J]. 天津理工大学学报, 2012, 28(4): 41-45. DOI:10.3969/ j.issn.1673-095X.2012.04-05.010.
[19] 赵谋明, 刘晓丽, 罗维, 等. 超临界CO2萃取余甘子籽油及其成分研究[J]. 林产化学与工业, 2007, 27(5): 107-112. DOI:10.3321/ j.issn:0253-2417.2007.05.022.
[20] 鲍建民. 多不饱和脂肪酸的生理功能及安全性[J]. 中国食物与营养, 2006(1): 45-46. DOI:10.3969/j.issn.1006-9577.2006.01.014.
[21] 王海燕, 李睿. 功能性不饱和脂肪酸研究进展[J]. 肉类研究, 2010(12): 14-17. DOI:10.3969/j.issn.1001-8123.2010.12.003.
[22] 黄宝玺, 王大为, 王金凤. 多不饱和脂肪酸的研究进展[J]. 农业工程技术, 2009(8): 26-30. DOI:10.3969/j.issn.1673-5404.2009.08.010.
[23] 孙翔宇, 高贵田, 段爱莉, 等. 多不饱和脂肪酸的研究进展[J]. 食品工业科技, 2012, 33(7): 418-423. DOI:10.13386/ j.issn1002-0306.2012.07.030.
[24] 王挺, 朱振中, 闵欣, 等. 石墨烯修饰电极电化学阻抗法测量油脂的氧化诱导时间[J]. 分析科学学报, 2015, 31(4): 489-493. DOI:10.13526/j.issn.1006-6144.2015.04.010.
[25] 葛林梅, 郝海燕, 陈杭君, 等. 加工工艺对香榧油脂氧化和抗氧化活性的影响[J]. 中国粮油学报, 2011, 26(5): 42-45.
[26] 周华龙, 张新申, 陈家丽, 等. 不饱和油脂氧化机理的研究与技术开发(Ⅰ): 氧化机理研究中的几个重要问题[J]. 中国皮革, 2003, 32(13): 4-8.
[27] 周华龙, 张新申, 蒋小平, 等. 不饱和油脂氧化机理的研究与技术开发(Ⅱ): 油脂游离基的反应特点与技术开发[J]. 中国皮革, 2003, 32(11): 26-30.
[28] 何文兵, 韩舜愈, 祝霞, 等. 燕麦麸油及其混合脂肪酸的抗氧化性评价[J]. 食品工业科技, 2007, 28(4): 97-99. DOI:10.13386/ j.issn1002-0306.2007.04.019.
[29] 敬思群, 蔡远强. 皂化水解及尿素包合工艺对马齿苋油脂肪酸组成及抗氧化性影响[J]. 食品科技, 2015, 40(2): 82-85.
[30] 湖北国家粮食质量监测中心. 植物油料含油量测定: GB/T 14488.1—2008[S]. 北京: 中国标准出版社, 2008: 1-6.
[31] BURITS M, BUCAR F. Antioxidant activity of Nigella sativa essential oil[J]. Phytotherapy Research, 2000, 14(5): 323-328. DOI:10.1002/1099-1573(200008)14:5<323::AID-PTR621>3.0.CO;2-Q.
[32] LEE Chiapu, YEN Gowchin. Antioxidant activity and bioactive compounds of tea seed (Camellia oleifera Abel.) oil[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 779-784.
[33] 国家质量监督检验检疫总局. 动植物油脂脂肪酸甲酯制备: GB/T 17376—2008[S]. 北京: 中国标准出版社, 2008: 1-3.
[34] SUTHERLAND K, DEL RÍO J C. Characterisation and discrimination of various types of lac resin using gas chromatography mass spectrometry techniques with quaternary ammonium reagents[J]. Journal of Chromatography A, 2014, 1338: 149-163. DOI:10.1016/ j.chroma.2014.02.063.
[35] 郭元亨, 马李一, 郑华, 等. 胭脂红酸清除自由基的作用[J]. 食品科学, 2010, 31(17): 73-76.
[36] 李铉军, 崔胜云. 抗坏血酸清除DPPH自由基的作用机理[J]. 食品科学, 2011, 32(1): 86-90.
[37] 王媛, 王定颖, 岳田利. 超声波提取葡萄籽油的工艺优化及其抗氧化性研究[J]. 食品科学, 2012, 33(10): 136-140.
[38] 蔡红艳. 燕麦油的提取、抗氧化活性及应用研究[D]. 武汉: 武汉工业学院, 2012: 12-25.
[39] 于占洋, 金哲雄. 鞣质抗氧化作用研究进展[J]. 黑龙江医药, 2014(1): 43-46.
[40] 孟阿会. 核桃油成分及抗氧化性质研究[D]. 北京: 北京林业大学, 2012: 20-30.
[41] 赵小云, 管中华, 李齐激, 等. 瓜蒌籽中脂肪酸组成型态及抗氧化活性[J]. 食品工业科技, 2014, 35(10): 178-181.
[42] 金春英, 崔京兰, 崔胜云. 氧化型谷胱甘肽对还原性谷胱甘肽清除自由基的协同作用[J]. 分析化学, 2009, 37(9): 1349-1353.
[43] 薛刚, 王莹, 冯建波. 乙醇和正己烷溶解不饱和脂肪酸的紫外吸收比较[J]. 南阳理工学院学报, 2009, 1(1): 63-65. DOI:10.3969/ j.issn.1674-5132.2009.01.017.
[44] 高红丽, 曹莹, 陈振宇, 等. 共轭亚麻酸的制备、表征和生物活性研究进展[J]. 化学通报, 2007, 70(2): 96-105. DOI:10.3969/ j.issn.0441-3776.2007.02.003.
[45] 周梅村. 仪器分析[M]. 武汉: 华中科技大学出版社, 2008: 112-114.
[46] 于华东, 邹永鹏, 周华龙, 等. 不饱和天然油脂在氧化与环氧化反应历程中的差异[J]. 中国皮革, 2010, 39(17): 26-30.
[47] BUEGE J A, AUST S D. Microsomal lipid peroxidation[J]. Methods in Enzymology, 1978, 52: 302-310. DOI:10.1016/S0076-6879(78)52032-6.
[48] BARCLAY L R C, INGOLD K U. Autoxidation of biological molecules. 2. autoxidation of a model membrane. comparison of the autoxidation of egg lecithin phosphatidylcholine in water and in chlorobenzene[J]. Journal of American Chemical Society, 1981, 103(21): 6478-6485. DOI:10.1021/ja00411a036.
[49] 邢存章, 武玉民, 徐新国. 环氧化植物油的制备[J]. 应用化学, 1994, 11(4): 85-87.
[50] 施赛泉, 蒋平平, 史润萍, 等. 无硫酸环氧化大豆油合成条件优化[J].化工进展, 2008, 27(5): 753-756.
Antioxidant Activity and Mechanism in Vitro of Phyllanthus emblica L. Seed Oil
GE Shuangshuang, ZHANG Wenwen, LI Kun, XU Juan, LIU Lanxiang, ZHENG Hua, ZHANG Hong*
(Research Center of Engineering and Technology on Forest Resources with Characteristics, State Forestry Administration, Research Institute of Resources Insects, Chinese Academy of Forestry, Kunming 650224, China)
Abstract:The purpose of this study was to reveal the antioxidant activity in vitro of Phyllanthus emblica L. seed oil and to explore the role of the polyunsaturated fatty acids presented in the seed oil in its antioxidant mechanism. 1,1-diphenyl-2-picrylhydrazl (DPPH) radical and 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphoate) radical (ABTS+·) scavenging assays were employed to evaluate the antioxidant activity. The results indicated that the scavenging capacity of Phyllanthus emblica L. seed oil against DPPH radical and ABTS+· were 95.91% and 98.58%, with half maximal inhibitory concentration (IC50) of 5.08 and 9.84 mg/mL respectively. The main antioxidants in Phyllanthus emblica L. seed oil were polyunsaturated fatty acids including α-linolenic acid. Conjugated fatty acid and hydroxyl fatty acid were detected in mixed fatty acids after oxidation characterized by ultraviolet (UV) spectroscopy and Fourier transform infrared spectroscopy (FT-IR). Moreover, monohydroxyl fatty acid was detected by gas chromatography-mass spectrometry (GC-MS) under the condition of excessive DPPH radical. All the above data indicated that the free radicals scavenging mechanism of polyunsaturated fatty acids included polyunsaturated fatty acid conjugation, singlemolecule addition, α-H oxidation of C=C double bond and epoxidation reaction at least.
Key words:Phyllanthus emblica L. seed oil; antioxidant activity in vitro; polyunsaturated fatty acids; α-linolenic acid; antioxidant mechanism
DOI:10.7506/spkx1002-6630-201715021
中图分类号:TS201.2;TS225.1
文献标志码:A
文章编号:1002-6630(2017)15-0127-08
引文格式:
葛双双, 张雯雯, 李坤, 等. 余甘子核仁油的体外抗氧化活性及其作用机理[J]. 食品科学, 2017, 38(15): 127-134. DOI:10.7506/spkx1002-6630-201715021. http://www.spkx.net.cn
GE Shuangshuang, ZHANG Wenwen, LI Kun, et al. Antioxidant activity and mechanism in vitro of Phyllanthus emblica L. seed oil[J]. Food Science, 2017, 38(15): 127-134. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201715021. http://www.spkx.net.cn
收稿日期:2016-07-13
基金项目:中央级公益性科研院所基本科研业务费专项(RIRICAF2015003M);“十三五”国家重点研发计划重点专项(2016YFD0600806)
作者简介:葛双双(1990—),女,硕士研究生,研究方向为天然产物开发与利用。E-mail:geshuangshuang0407@163.com
*通信作者:张弘(1963—),男,研究员,博士,研究方向为林业生物资源化学与工程。E-mail:kmzhhong@163.com