表1 PCR扩增用引物
Table 1 Primers used for PCR amplif i cation

王嘉炜1,肖英平2,3,杨 华2,3,曹晨阳1,杨保伟1,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.浙江省农业科学院农产品质量标准研究所,浙江 杭州 310021;3.浙江省农业科学院 浙江省植物有害生物防控重点实验室,浙江 杭州 310021)
摘 要:目的:研究432 株分离于陕西省杨凌及周边城市零售鸡肉中沙门氏菌的血清型分布、药敏性及其与(氟)喹诺酮类抗菌药物抗性相关耐药基因的流行状况。方法:按照玻片凝集法鉴定血清型,使用临床和实验室标准协会推荐的琼脂稀释法测定沙门氏菌的药敏性,聚合酶链式反应(polymerase chain reaction,PCR)方法确定沙门氏菌中与(氟)喹诺酮类抗生素耐药相关基因。结果:432 株沙门氏菌中除36 株血清型未定外,其余396 株沙门氏菌共涵盖37 个血清型,其中鼠伤寒沙门氏菌(Salmonella typhimurium,检出率17.93%)、汤普森沙门氏菌(Salmonella thompsons,检出率12.88%)、埃森沙门氏菌(Salmonella essen,检出率8.84%)和婴儿沙门氏菌(Salmonella
infants,检出率6.57%)等血清型比较常见。沙门氏菌对磺胺异噁唑(耐药率89.81%)耐药最为普遍,对磺胺甲噁唑、萘啶酮酸、四环素、氨苄西林、氯霉素和阿莫西林-克拉维酸等抗生素的耐药率均在50%以上。aac(6’)-Ib-cr基因检出率(16.67%)最高,qnrB、qnrS和qnrA的检出率分别为10.19%、6.71%和1.62%,且该4 种基因在不同血清型菌株中分布不同。菌株携带qnr和aac(6’)-Ib-cr基因越多,对(氟)喹诺酮类和氨基糖苷类协同耐药性越强。结论:陕西省杨凌及周边城市零售鸡肉源沙门氏菌的血清型种类繁多,耐药比较普遍。
关键词:沙门氏菌;血清型;(氟)喹诺酮类抗生素;耐药基因
沙门氏菌(Salmonella)在自然界分布极为广泛,对人和动物健康造成严重危害,是世界上常见的食源性致病菌之一。早在20世纪80年代,沙门氏菌引发的食品污染及对人们身体健康带来的危害已在国内外受到广泛关注[1]。据报道,我国每年约3亿人因感染沙门氏菌而患病,达病原菌食源性疾病总数的70%~80%[2]。
沙门氏菌血清型种类繁多、菌株复杂,自1885年被发现以来,迄今已有2 610 种沙门氏菌血清型被确认。食源性致病菌监测结果显示,在我国主要流行的沙门氏菌与相邻的东南亚国家和欧美国家有所不同,具有很强的地域性[1-3]。
目前,抗生素被广泛应用于畜牧业生产,在预防和控制畜禽沙门氏菌病方面发挥了巨大作用[3]。但由于抗生素的广泛使用及滥用,沙门氏菌对抗菌药物的耐药性趋势逐年上升,耐药性问题已引起国内外广泛重视,在全球得到高度关注[4-6]。相对而言,食源性沙门氏菌耐药性在国外研究较为深入,对其耐药的分子机理及耐药基因研究较多[7-8]。在陕西省,除张芳等[9]研究了该省食源性沙门氏菌的流行状况,郝宏珊[10]、杨保伟[11]等研究了该省鸡肉源沙门氏菌对(氟)喹诺酮类抗生素的耐药状况及相关基因外,鲜见其他报道。由于(氟)喹诺酮类抗生素是沙门氏菌预防和临床治疗的最主要药物之一,而qnrA、qnrB、qnrS和aac(6’)-Ib-cr等基因的编码产物导致沙门氏菌对喹诺酮和氟喹诺酮类抗生素产生抗性[10-13]。本实验旨在获得陕西省杨凌及周边地区零售鸡肉源沙门氏菌的血清型分布、耐药性状况及部分与喹诺酮和(氟)喹诺酮类抗生素耐药相关基因,为保障食品安全提供部分参考依据。
1.1 材料
1.1.1 菌株
432 株沙门氏菌分离于2011—2012年间采集于陕西省杨凌及周边城市农贸市场和超市的零售鸡肉样品。菌株的分离和鉴定按照Cui Shenghui等[14]所述方法进行。用400 mL无菌的蛋白胨缓冲液充分洗涤鸡肉样品后,将淋洗液置于37 ℃摇床中100 r/min条件下培养6~8 h后,分别取10 mL和1 mL增菌液加入到100 mL四硫磺酸钠亮绿培养基(tetrathionate broth base,TTB)和Rappaport-Vassiliadis(RV)增菌液中,于42 ℃摇床中100 r/min条件下培养18~20 h。用无菌接种环取适量TTB增菌液划线到XLT4培养基表面,取RV增菌液划线到木糖赖氨酸脱氧胆酸钠培养基(xylose lysine desoxycholate medium,XLD)培养基表面后,于37 ℃条件下培养18~24 h,挑取沙门氏菌疑似菌落,再XLT4平板上纯化后,使用invA引物(invA-F:5’-TATCGCCACGTTCGGGCAATCTT-3’;invA-R:5’-TCGCACCGTCAAAGGAACCACT-3’)和聚合酶链式反应(polymerase chain reaction,PCR)方法鉴定沙门氏菌后,再使用沙门氏菌诊断血清确认。药敏性测定用标准质控菌株Esherichia coli ATCC 25922和ATCC 35218,Enterococcus faecalis ATCC 29212均为中国药品生物制品检定研究院崔生辉博士惠赠。
1.1.2 培养基
蛋白胨缓冲水、四硫磺酸钠亮绿培养基及相应的添加剂、Luria-Bertani(LB)营养琼脂、Rappaport-Vassiliadis培养基 北京陆桥技术有限责任公司;Mueller Hinton(MH)琼脂 北京奥博星生物技术有限责任公司;XLD培养基、XLT4培养基及其补充液美国BD公司。
1.1.3 抗生素
磺胺异噁唑(sulfisoxazole,SUL)、磺胺甲噁唑/甲氧苄啶(sulfamethoxazole/trimethoprim,SXT)、萘啶酮酸(nalidixic acid,NAL)、环丙沙星(ciprofloxacin,CIP)、氨苄西林(ampicillin,AMP)、阿莫西林/克拉维酸(amoxicillin/clavulanate potassium,AMC)、头孢噻呋(ceftiofur,CTX)、头孢曲松(ceftriaxone,CRO)、头孢西丁(cefoxitin,FOX)、卡那霉素(kanamycin,KAN)、链霉素(streptomycin,STR)、庆大霉素(gentamycin,GEN)、阿米卡星(amikacin,AMK)、氯霉素(chloramphenicol,CHL)、四环素(tetracycline,TCY)(均为分析纯) 美国Sigma公司。
1.1.4 引物
qnrA、qnrB、qnrS和aac(6’)-Ib-cr扩增用引物使用Premier5软件设计,均由上海捷锐生物工程有限公司合成(表1)。aac(6’)-Ib-cr基因扩增后将其DNA序列在低温条件下送至上海桑尼生物科技有限公司测序。
表1 PCR扩增用引物
Table 1 Primers used for PCR amplif i cation

1.2 试剂与仪器
Taq DNA聚合酶、ExTaq DNA聚合酶、dNTPmix、10×PCR Buffer、DL2000DNA Ladder 宝生物工程(大连)有限公司。
超净工作台 苏州苏洁净化设备有限公司;高压灭菌锅 日本Tomy公司;超纯水处理器 美国Millipore公司;-40 ℃低温冰箱、-80 ℃低温冰箱 日本Sanyo公司;恒温摇床 上海智成分析仪器制造有限公司;Mycycler PCR仪、DNA电泳、凝胶成像系统 美国Bio-Rad公司;移液器、高速离心机 德国Eppendorf公司;恒温水浴 宁波赛福实验仪器厂。
1.3 方法
1.3.1 沙门氏菌血清型鉴定
沙门氏菌血清分型研究在河南省疾病预防控制中心进行。使用泰国S&A公司生产的沙门氏菌诊断血清,采用玻片凝集法按照操作说明书分别确定供试菌的O抗原和H抗原类型,得到抗原式后查阅White-Kauffmann抗原表,确定沙门氏菌的血清型。
1.3.2 药物敏感性测定
采用美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)[15]推荐的琼脂稀释法测定供试抗生素对沙门氏菌的最小抑制浓度(minimum inhibitory concentrations,MICs),按照CLSI标准判读药敏结果并确定耐药表型。供试抗生素的使用浓度范围及相应的耐药折点检表2。药敏测定中使用Escherichia coli ATCC 25922和ATCC 35218,Enterococcus faecalis ATCC 29212作为标准质控菌株。
表2 抗生素种类、使用范围和耐药折点
Table 2 Concentration ranges of various antibiotics where they are used and resistance breakpoints

注:CLSI未规定链霉素的耐药折点,判定是参考美国国家抗生素检测体系中使用的适用于链霉素的耐药折点浓度。
1.3.3 PCR扩增
使用煮沸法制备PCR用DNA模板[16]。PCR反应条件为94 ℃、10 min;94 ℃、1 min、相应引物退火温度条件下1 min、72 ℃、1 min,35 个循环;72 ℃、10 min。电泳结束后,用5 μL PCR产物与5 μL Loading buffer均匀混合,在0.5×TBE缓冲液中于100 V电泳30 min,使用凝胶成像系统照相。
2.1 沙门氏菌的血清型分析
432 株沙门氏菌中有36 株血清型未定,其余396 株菌中共鉴定出37 种血清型。以鼠伤寒沙门氏菌(S. typhimurium,检出率(下同)17.93%)、汤普森沙门氏菌(S. thompsons,12.88%)、埃森沙门氏菌(S. essen,8.84%)、婴儿沙门氏菌(S. infants,6.57%)、肠炎沙门氏菌(S. entertidis,5.30%)和里森沙门氏菌(S. rissen,5.05%)等比较常见。阿富拉沙门氏菌(S. afula,4.55%)和阿贡纳沙门氏菌(S. agona,4.29%)等13 种血清型的沙门氏菌检出率在1%~5%之间。契斯特沙门氏菌(S. chester,0.76%)和德尔卑沙门氏菌(S. derby,0.76%)等11 种血清型的沙门氏菌检出率在0.5%~1.0%之间。不常见血清型有阿尔伯特沙门氏菌(S. albert,0.25%)和巴西沙门氏菌(S. brazil,0.25%)等7 种(表3)。
表3 沙门氏菌血清型分析(n=396)
Table 3 Distribution of Salmonella serovars (n= 396)

2.2 鸡肉源沙门氏菌的耐药分析
沙门氏菌对磺胺异噁唑耐药最为普遍,耐药率达89.81%,对磺胺甲噁唑/甲氧苄啶和萘啶酮酸等6 种抗生素的耐药率均在50%以上。相对而言,对头孢噻呋、卡那霉素、链霉素、庆大霉素和环丙沙星等耐药率较低,对阿米卡星、头孢曲松和头孢西丁比较敏感(表4)。
432 株沙门氏菌中,耐萘啶酮酸但环丙沙星敏感(NAL+CIP-)型菌株检出率最高(48.84%),其次分别为对萘啶酮酸和环丙沙星同时敏感(NAL-CIP-)型菌株(27.78%)以及对萘啶酮酸和环丙沙星同时耐药(NAL+CIP+)的菌株(23.38%)(图1)。
在NAL+CIP-型菌株(n=211)中共检出21 种血清型,结合图1和表3可计算得到:鼠伤寒沙门氏菌(21.80%)、埃森沙门氏菌(14.22%)和婴儿沙门氏菌(12.80%)比较常见。在NAL-CIP-型菌株(n=120)中共检出18 种血清型,结合图1、表3计算得到:阿富拉沙门氏菌(13.33%)、阿贡纳沙门氏菌(11.82%)、恩吉利沙门氏菌(11.82%)、汤普森沙门氏菌(11.82%)和布拉登卢普沙门氏菌(10.00%)比较常见。在NAL+CIP+型菌株(n=101)中共检出19 种血清型,结合图1、表3计算得到:鼠伤寒沙门氏菌(23.76%)、汤普森沙门氏菌(18.81%)和印第安纳沙门氏菌(9.90%)比较常见。
表4 沙门氏菌对15 种抗生素的耐药率(n=432)
Table 4 Resistance rates of Salmonella to 15 kinds of antibiotics (n= 432)
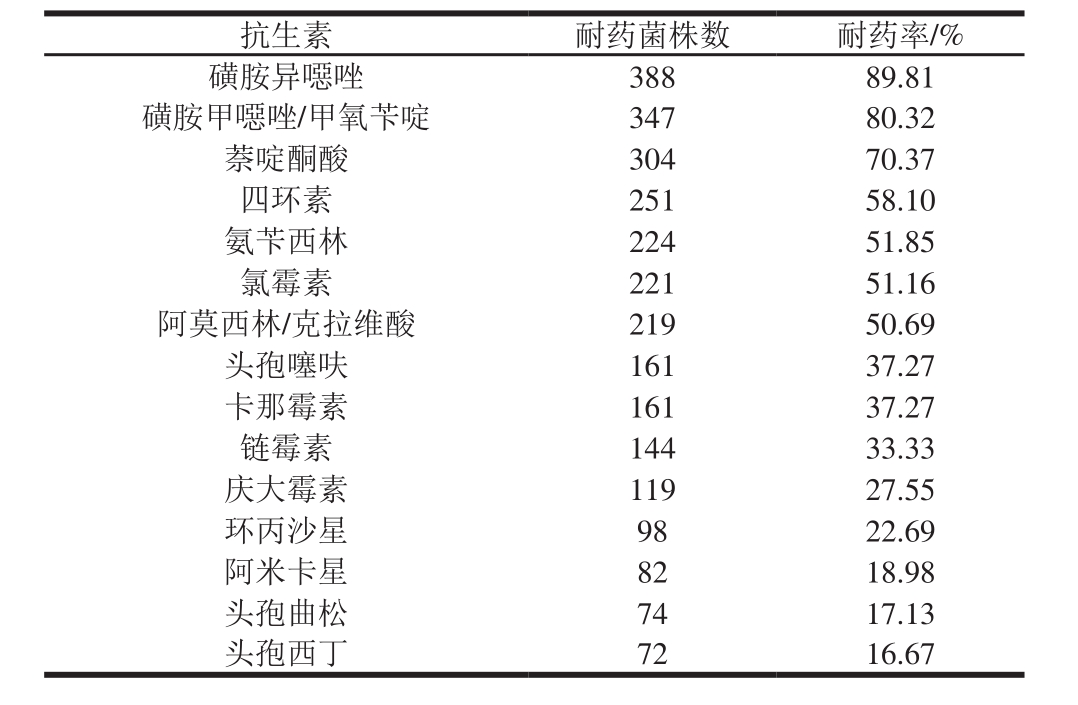

图1 鸡源性耐(氟)喹诺酮类抗生素沙门氏菌检出率(n=432)
Fig. 1 Detection rates of fl uoroquinolones resistant Salmonella in retail chicken (n = 432)
2.3 沙门氏菌中与(氟)喹诺酮类抗生素耐药相关质粒携带的基因
432 株沙门氏菌中,aac(6’)-Ib-cr检出率(16.67%)最高,其次分别为qnrB(10.19%)、qnrS(6.71%)和qnrA(1.62%)。101 株NAL+CIP+沙门氏菌中,aac(6’)-Ib-cr、qnrB、qnrS和qnrA的检出率分别为34.65%、13.86%、2.97%和0.00%。211 株NAL+CIP-沙门氏菌中,qnrS、aac(6′)-Ib-cr、qnrB和qnrA的检出率分别为11.85%、9.95%、7.58%和1.42%。120 株NAL-CIP-沙门氏菌中,aac(6’)-Ib-cr、qnrB、qnrA和qnrS的检出率分别为13.33%、11.67%、3.33%和0.83%(图2)。
432 株沙门氏菌中,88 株菌种(20.37%)携带1 种基因,32 株菌(7.41%)同时携带2 种基因,未检测到同时携带3 种或4 种基因的菌株。

图2 零售鸡肉源沙门氏菌中相关耐药基因的检出率(n=432)
Fig. 2 Detection rates of antibiotic resistance-related genes in chickenborne Salmonella (n = 432)
表 5qnr和aac(6’)-Ib-cr 基因检出与菌株耐药状况间的关系(n=432)
Table 5 Relationship between qnrandaac(6’)-Ib-cr genes and antibiotic resistance phenotype (n= 432)
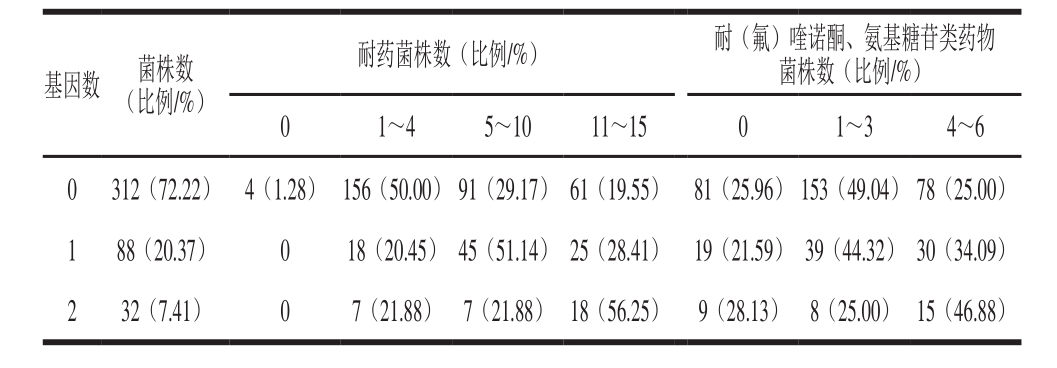
由表5可知,未检出耐药基因的菌株(n=312)总体上对抗生素比较敏感,约51%的菌株可耐供试抗生素的数量不超过4 种,约75%的菌株可耐受供试氨基糖胺类和(氟)喹诺酮类抗生素的数量不超过3 种。检测出1 种基因的菌株(n=88)中,可耐5~10 种供试抗生素的菌株比例为51.14%,28.41%的菌株可耐11~15 种抗生素,78.41%的菌株至少可耐受1 种供试氨基糖胺类和(氟)喹诺酮类抗生素。检测出2 种基因的菌株(n=32)中,耐11~15 种药物的菌株比例为56.25%,46.88%的菌株可耐4~6 种供试氨基糖胺类和(氟)喹诺酮类抗生素。随着qnr和aac(6’)-Ib-cr基因检出数的增加,菌株对(氟)喹诺酮和氨基糖苷类抗生素的耐药数也随之增加。
2.4 耐药基因在不同血清型沙门氏菌中的分布
120 株携带qnrA、qnrB、qnrS和aac(6’)-Ib-cr基因的沙门氏菌共涵盖28 种血清型。4 种基因在汤普森沙门氏菌和鼠伤寒沙门氏菌中均有检出,其他血清型沙门氏菌携带该4 种基因的情况不同。除汤普森沙门氏菌和鼠伤寒沙门氏菌外,只在阿贡纳沙门氏菌中检出qnrA,分别在安尼达尔沙门氏菌、布拉登鲁普沙门氏菌和巴西沙门氏菌等共14 个血清型的菌株中检出qnrB,分别在阿贡纳沙门氏菌、病牛沙门氏菌和肠炎沙门氏菌等共9 个血清型的菌株中检出qnrS,分别在埃森沙门氏菌、鼠伤寒沙门氏菌和印第安纳沙门氏菌等共25 个血清型的菌株中检出aac(6’)-Ib-cr(表6)。
表7 耐药基因在不同血清型沙门氏菌中的分布
Table 6 Distribution of antibiotic resistance genes in different Salmonella serovars

沙门氏菌是一种寄生于人和动物肠道,能引起沙门氏菌病,对人畜健康产生威胁的主要食源性和人畜共患病致病菌之一[17]。在各类食源性病原菌污染事件中,30%食源性细菌污染由沙门氏菌引起[18]。沙门氏菌能在人与动物间交叉传播,导致食物中毒,对公共卫生安全造成威胁[19]。
沙门氏菌血清型种类繁多、菌株复杂,且其菌型分布具有很强的区域特点。世界各国流行的沙门氏菌虽有所差异,但大多以肠炎沙门氏菌、鼠伤寒沙门氏菌、印第安纳沙门氏菌和德尔卑沙门氏菌等为主[20-21]。
本研究从陕西省杨凌及周边城市农贸市场和超市零售鸡肉中分离出的沙门氏菌的主要为鼠伤寒沙门氏菌(共71 株,检出率17.93%),与施开创[3]、张茂棠[22]、张秀丽[23]等分别对广西、深圳市和河南省鸡源、生鸡肉源和生肉中沙门氏菌血清分型研究结果一致,也与赵玉林等[24]对陕西省西安、宝鸡和杨凌3 个地区鸡肉、猪肉、牛肉和羊肉中沙门氏菌的血清型分布状况相似。表明鼠伤寒沙门氏菌作为引起食物中毒的主要血清型在我国肉类食品中流行相当广泛,要严格预防控制[25]。除鼠伤寒沙门氏菌外,本研究中汤普森沙门氏菌的检出率(12.88%)也较高,与现有报道有所不同[26]。此外,虽然本研究调查的范围不是很大,但可以定型的396 株沙门氏菌却涵盖了37 个血清型,有2 种血清型,即Salmonella koessen和Salmonella every Ⅲb目前尚未查到中文名称的报道,表明杨凌及周边地区零售鸡肉源沙门氏菌的血清型具有非常高的多样性。
世界卫生组织2001年统计数据,每年约有12 000 t和900 t抗生素分别作为饲料添加剂和食品性动物治疗,仅有1 300 t抗生素用于人类治疗[27]。随着抗生素在人和动物上的广泛使用、甚至滥用,沙门氏菌耐药性正在逐年增强,尤其是多重耐药现象的出现,给食品安全及公共卫生问题带来了极大的威胁[28]。刘渠等[29]对69 株分离于720 份生肉类样品沙门氏菌耐药性测定发现,88.6%、34.77%和5.80%的分离株分别对1、5 种和11 种以上抗生素产生抗性。吴云凤等[30]对分离于204 份肉鸡胴体的71 株沙门氏菌的药敏性检测结果表明沙门氏菌至少对3 种以上抗生素耐药,耐3~7 种药物的菌株达33.8%,耐8~12 种药物的达26.8%,耐13~16 种药物的达36.6%。本研究结果与上述结果以及与潘志明[31]、代娟娟[32]、谢一俊[33]等的研究比较相似,表明食源性特别是鸡肉源沙门氏菌耐药谱不断增宽、多重耐药现象已经比较普遍,已成为当前食品安全和公共安全卫生领域的核心问题之一。
郝宏姗等[10]研究表明,63.59%和21.28%的鸡肉源沙门氏菌分别对萘啶酮酸和环丙沙星产生抗性。戴建华等[34]研究表明72.73%的禽源沙门氏菌对萘啶酮酸产生抗性,9.09%对环丙沙星产生抗性。本研究分离到的432 株沙门氏菌中,70.37%的菌株对萘啶酮酸产生抗性,耐环丙沙星的菌株占22.69%,与上述报道结果基本一致。由于(氟)喹诺酮类抗生素是人畜沙门氏菌病预防和治疗的主要药物之一,本研究中沙门氏菌对(氟)喹诺酮类抗生素产生抗性使食品安全形势处于比较严峻的局面。
质粒介导的(氟)喹诺酮耐药是沙门氏菌耐药性产生的一个重要机制[35]。质粒携带的与(氟)喹诺酮类药物耐药相关的基因既可纵向传播,也可横向传播(主要通过接合转移方式传给其他细菌)。除携带(氟)喹诺酮类抗生素耐药基因外,这些质粒通常还携带可引起其他类抗生素耐药的附加基因[36]。国内外对沙门氏菌质粒介导(氟)喹诺酮类耐药相关基因检测结果显示,aac(6’)-Ib-cr检出率为0.05‰~37.1%[12,37]、qnrA检出率为0.05‰~2.77%[12,38-39]、qnrB检出率为0.026‰~11.34%[12-13,38-39]、qnrS检出率为0.57‰~10.29%[12-13,38-39]。本研究中,aac(6’)-Ib-cr的检出率(16.67%)明显高于其他3 种qnr(qnrA、qnrB和qnrS的检出率分别为1.62%、10.19%和6.71%)基因,与现有研究结果比较一致。
本研究在涵盖29 种血清型的沙门氏菌中检出qnrA、qnrB、qnrS和aac(6’)-Ib-cr基因,这4 种基因在汤普森和鼠伤寒沙门氏菌中均有检出,在婴儿沙门氏菌、肠炎沙门氏菌和埃森沙门氏菌中均未检出qnrA。邹明等[40]研究发现沙门氏菌血清型、耐药表型和耐药基因携带率之间有着复杂关系,表明沙门氏菌耐药性的产生是一个复杂过程,可能是多种途径共同作用的结果。
综上,杨凌及周边地区鸡肉源沙门氏菌血清型种类丰富,多数菌株对常用于沙门氏菌病预防和治疗的(氟)喹诺酮类药物产生抗性,多重耐药现象比较普遍。检测出qnrA、qnrB、qnrS和aac(6’)-Ib-cr等与(氟)喹诺酮类抗生素耐药相关基因,可能为沙门氏菌对(氟)喹诺酮类抗生素产生耐药性的原因之一。
参考文献:
[1] 张文宇, 杜雄伟, 岳威威. 大连地区食源性沙门氏菌耐药性检测[J]. 畜牧兽医科技信息, 2014(2): 35-36. DOI:10.3969/J.ISSN.1671-6027.2014.02.017.
[2] World Health Organization. Overcoming antimicrobial resistance: World Health Organization report on infectious diseases[R]. Canberra: WHO. 2000.
[3] 施开创, 李凤梅, 邹联斌, 等. 鸡源致病性沙门氏菌的分离鉴定及血清型和药物敏感性分析[J]. 中国畜牧兽医, 2015, 42(8): 2160-2168. DOI:10.16431/2fj.cnki.1671-7236.2015.08.034.
[4] SU L H, CHIU C H, CHU C, et al. Antimicrobial resistance in nontyphoid Salmonella serotypes: a global challenge[J]. Clinical Infectious Diseases, 2004, 39(4): 546-551. DOI:10.1086/422726.
[5] HUR J, JAWALE C, LEE J H. Antimicrobial resistance of Salmonella isolated from food animals: a review[J]. Food Research International, 2012, 45(2): 819-830. DOI:10.1016/j.foodres.2011.05.014.
[6] HAO Haihong, CHENG Guyue, IQBAL Z, et al. Benefits and risks of antimicrobial use in food producing animals[J]. Frontiers in Microbiology, 2014, 5: 288. DOI:10.3389/fmicb.2014.00288.
[7] FONSECA E L, MYKYTCZUK O L, ASENSI M D, et al. Clonality and antimicrobial resistance gene profiles of multidrug-resistant Salmonella enteric serovar infantis isolates from four public hospitals in Rio de Janeiro, Brazil[J]. Journal of Clinical Microbiology, 2006, 44(8): 2767-2772. DOI:10.1128/JCM.01916-05.
[8] LYNNE A M, RHODES-CLARK B S, BLIVEN K, et al. Antimicrobial resistance genes associated with Salmonella enteric serovar Newport isolates from food animals[J]. Antimicrobial Agents and Chemotherapy, 2008, 52(1): 353-356. DOI:10.1128/AAC.00842-07.
[9] 张芳, 马国柱, 潘立, 等. 陕西省2002—2006年食源性致病菌污染状况[J]. 中国公共卫生, 2008, 24(2): 222-224. DOI:10.3321/ j.issn:1001-0580.2008.02.047.
[10] 郝宏珊, 杨保伟, 师俊玲, 等. 鸡肉源沙门氏菌对喹诺酮和氟喹诺酮类抗生素耐药状况及相关基因[J]. 微生物学报, 2011, 51(10): 1413-1420. DOI:10.13343/j.cnki.wsxb.2011.10.012.
[11] 杨保伟, 曲东, 申进玲, 等. 陕西食源性沙门氏菌耐药及相关基因[J]. 微生物学报, 2010, 50(6): 788-796. DOI:10.13343/j.cnki.wsxb.2010.06.017.
[12] SJÖLUND-KARLSSON M, FOLSTER J P, PECIC G, et al. Emergence of plasmid-mediated quinolone resistance among non-typhi Salmonella enterica isolates from humans in the United States[J]. Antimicrobial Agents and Chemotherapy, 2009, 53(5): 2142-2144. DOI:10.1128/AAC.01288-08.
[13] VELDMAN K, CAVACO LM, MEVIUS D, et al. International collaborative study on the occurrence of plasmid-mediated quinolone resistance in Salmonella enterica and Escherichia coli isolated from animals, humans, food and the environment in 13 European countries[J]. Journal of Antimicrobial Chemotherapy, 2011, 66(6): 1278-1286. DOI:10.1093/jac/dkr084.
[14] CUI Shenghui, ZHENG Jie, MENG Jianghong. An improved method for rapid isolation of Salmonella against Proteus in chicken carcasses[J]. Journal of Food Safety, 2006, 26(1): 49-61. DOI:10.1111/ j.1745-4565.2005.00032.x
[15] Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically Approved standard[S]. 2nd ed. Wayne, PA, USA: Clinical and Laboratory Standards Institute, 2003.
[16] JOSEPH S, RUSSELL D W. 分子克隆实验指南[M]. 3版. 黄培堂,王恒墚, 周晓巍. 译. 北京: 科学出版社, 2002: 36-42. DOI:10.1016/ j.ygcen.2010.01.018.
[17] 杨德胜, 张险朋, 黄炳炽, 等. 动物产品沙门氏菌污染情况调查[J].中国畜牧兽医, 2010, 37(10): 202-203.
[18] 张莉, 曾艳兵, 尹德风, 等. 畜禽沙门氏菌药敏性研究及两种测定方法比较[J]. 江西农业学报, 2013, 25(5): 114-116; 119. DOI:10.3969/ j.issn.1001-8581.2013.05.034.
[19] FRANCOIS X W, FRANCOISE G. Multidrug resistance in Salmonella enterica serotype Typhimurium from humans in France[J]. Journal of Clinical Microbiology, 2006, 44(3): 700-708. DOI:10.1128/ JCM.44.3.700-708.2006.
[20] BATISTA D F, FREITASNETO O C, BARROW P A, et a1. Identification and characterization of regions of difference between the Salmonella Gallinarum biovar Gallinarum and the Salmonella Gallinarum biovar Pullorum genomes[J]. Infection Genetics and Evolution, 2015, 30: 74-81. DOI:10.1016/j.meegid.2014.12.007.
[21] 徐桂云, 樊世杰. 家禽沙门氏菌感染现状及不同国家的防治策略[J]. 中国家禽, 2012, 34(9): 7-12. DOI:10.3969/ j.issn.1004-6364.2012.09.002.
[22] 张茂棠, 林琳, 刘渠, 等. 深圳市生鸡肉中沙门菌的耐药性研究[J]. 现代预防医学. 2005, 32(7): 732-733. DOI:10.3969/ j.issn.1003-8507.2005.07.011.
[23] 张秀丽, 廖兴广, 郝宗宇, 等. 2006—2007年河南省生肉食品中沙门菌的主动监测及其DNA指纹图谱库的建立[J]. 中国卫生检验杂志, 2009, 19(7): 1545-1548.
[24] 赵玉林, 刘芳萍, 李昌文, 等. 鸡源性多重耐药沙门氏菌Ⅰ类整合子与耐药基因研究[J].中国家禽, 2012, 34(4): 29-32. DOI:10.3969/ j.issn.1004-6364.2012.04.008.
[25] 孟昭赫. 食品卫生检验方法注解(微生物学部分)[M]. 北京: 人民卫生出版社, 1986: 209-219.
[26] 杨保伟, 张秀丽, 曲东, 等. 2007—2008陕西部分零售畜禽肉沙门氏菌血清型和基因型[J]. 微生物学报, 2010(5): 654-660. DOI:10.13343/j.cnki.wsxb.2010.05.018.
[27] 金少鸿, 马越. 国内细菌耐药性监测研究的回顾与展望[J]. 中国抗生素杂志, 2005, 30(5): 257-259. DOI:10.3969/j.issn.1001-8689.2005.05.001.
[28] YANG Hanchun, CHEN Sheng, WHITE D G, et al. Characterized on of multiple antimicrobial resistant Escherichia coli isolates from diseased chickens and swine in China[J]. Journal of Clinical Microbiology, 2004, 42(8): 3483-3489. DOI:10.1128/JCM.42.8.3483-3489.2004.
[29] 刘渠, 刘衡川, 李灶平, 等. 食品中沙门氏菌的耐药性研究[J]. 现代预防医学, 2004, 31(3): 330-332. DOI:10.3969/j.issn.1003-8507.2004.03.007.
[30] 吴云凤, 袁宝君, 乔昕, 等. 肉鸡胴体中沙门氏菌的分离鉴定及多重耐药谱研究[J]. 南京医科大学学报(自然科学版), 2012, 32(1): 125-128.
[31] 潘志明, 焦新安. 鸡白痢沙门氏菌耐药性的变化趋势[J]. 中国预防兽医学报, 1999, 21(4): 305-307.
[32] 代娟娟, 孙金华, 常维山. 鸡白痢沙门氏菌耐药性分析[J]. 山东畜牧兽医, 2008, 29(11): 56-57. DOI:10.3969/j.issn.1007-1733.2008.11.039.
[33] 谢一俊, 陈亢川. 福建省鼠伤寒沙门氏菌的耐药性变迁趋势的监测[J].中国人兽共患病杂志, 1993, 9(3): 13-16.
[34] 戴建华, 吴植, 袁维峰. 禽源致病性沙门氏菌耐药表型与耐药基因的分析[J]. 中国畜牧兽医, 2014, 41(4): 245-248.
[35] 王明贵. 喹诺酮类抗菌药的耐药性及质粒介导耐药机制[J].中华医学杂志, 2006, 86(9): 645-647. DOI:10.3760/ j:issn:0376-2491.2006.09.020
[36] 李宵宁, 柴芸. 喹诺酮类抗菌药的作用机制及耐药机制研究进展[J]. 国外医药: 抗生素分册, 2015, 36(3): 97-103. DOI:10.3969/ j.issn.1001-8751.2015.03.001.
[37] YU Fangyou, CHEN Qiang, YU Xiaojun, et al. High prevalence of plasmid-mediated quinolone resistance determinant aac(6′)-Ib-cr amongst Salmonella enterica serotype Typhimurium isolates from hospital isedpaediatric patients with diarrhoea in China[J]. International Journal of Antimicrobial Agents, 2011, 37(2): 152-155. DOI:10.1016/j.ijantimicag.2010.10.021.
[38] GUNELL M, WEBBER M A, KOTILAINEN P, et al. Mechanisms of resistance in nontyphoidal Salmonella enterica strains exhibiting a nonclassical quinolone resistance phenotype[J]. Antimicrobial Agents and Chemotherapy, 2009, 53(9): 3832-3836. DOI:10.1128/ AAC.00121-09.
[39] CUI Shenghui, LI Jingyun, SUN Ziyong, et al. Characterization of Salmonella enterica isolates from infants and toddlers in Wuhan, China[J]. Journal of Antimicrobial Chemotherapy, 2009, 63(1): 87-94. DOI:10.1093/jac/dkn452.
[40] 邹明, 魏蕊蕊, 张纯萍, 等. 鸡源沙门氏菌的血清型、耐药性和耐药机制调查[J]. 农业生物技术学报, 2013, 21(7): 855-862. DOI:10.3969/j.issn.1674-7968.2013.07.012.
Serotyping, Antibiotic Susceptibility and Some Genes Associated with Quinolones and Fluoroquinolines Resistance of Chicken-Borne Salmonella
WANG Jiawei1, XIAO Yingping2,3, YANG Hua2,3, CAO Chenyang1, YANG Baowei1,*
(1. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China;
2. Institute of Quality and Standard for Agro-Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China; 3. State Key Laboratory Breeding Base for Zhejiang Sustainable Pest and Disease Control, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China)
Abstract:Objective: In this study, the serotyping, antibiotic susceptibility and some genes associated with quinolone and fluoroquinolones resistance of 432 chicken-borne Salmonella isolates in and around Yangling, Shaanxi province were studied for better understanding the epidemiological characteristics of Salmonella serovars. Methods: Salmonella serovars were determined using slide agglutination method. Antibiotic susceptibility was tested by the agar dilution method recommended by the Clinical and Laboratory Standards Institute (CLSI). The resistant genes of qnrA, qnrB, qnrS and aac(6’) -Ib-cr, commonly carried by plasmid and associated with resistance to quinolone and fl uoroquinolones, were identif i ed using PCR and DNA sequencing. Results: Totally 37 serotypes were identif i ed among 396 Salmonella isolates, and the other 36 isolates were unidentif i ed. The most prevalent serotype was Salmonella typhimurium (17.93%), followed by S. thompson (12.88%), S. essen (8.84%) and S. infantis (6.57%). Among 432 Salmonellae isolates, antibiotic resistance was commonly found to sulfafurazole (89.81%), and approximately 50% of the isolates were resistant to sulfamethoxazole, naladixic acid, tetracycline, ampicillin, chloramphenicol, and amoxicillin/clavulanate potassium. aac(6’)-Ib-cr (16.67%) was most frequently detected, and the detection rates of qnrB, qnrS and qnrA were 10.19%, 6.71% and 1.62%, respectively. The distribution of these four genes differed in different serotypes of isolates. More qnr and aac(6’)-Ib-cr genes were detectedin the isolates found to be more resistant to both fluoroquinolones and aminoglycosides. Conclusion: The serotype of Salmonella isolates from retail chicken in Yangling and its surrounding areas was diverse, and qnr and aac(6’)-Ib-cr genes were commonly found in these isolates that were resistant to many antibiotics.
Key words:Salmonella; serotype; fl uoroquinolones; antibiotic resistant genes
收稿日期:2016-07-08
基金项目:浙江省农业科学院“农产品质量安全”中美国际合作项目;国家自然科学基金面上项目(31171682)
作者简介:王嘉炜(1995—),女,硕士研究生,研究方向为食源性致病菌检测。E-mail:1271208221@qq.com
*通信作者:杨保伟(1974—),男,教授,博士,研究方向为食源性致病菌快速检测和多重耐药机理。E-mail:ybw090925@163.com
DOI:10.7506/spkx1002-6630-201715023
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)15-0140-07
引文格式:
王嘉炜, 肖英平, 杨华, 等. 鸡肉源沙门氏菌血清型、药敏性及部分耐药基因研究[J]. 食品科学, 2017, 38(15): 140-146. DOI:10.7506/spkx1002-6630-201715023. http://www.spkx.net.cn
WANG Jiawei, XIAO Yingping, YANG Hua, et al. Serotyping, antibiotic susceptibility and some genes associated with quinolones and fluoroquinolines resistance of chicken-borne Salmonella[J]. Food Science, 2017, 38(15): 140-146. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201715023. http://www.spkx.net.cn