白周亚,阚丽娇,李 昌,殷军艺,聂少平*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:为深入了解豇豆的营养价值,以11 个不同品种的豇豆样品为原料,对其总酚含量、总黄酮含量及抗氧化活性(总还原能力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、•OH清除能力)进行分析,并讨论酚类物质含量及抗氧化活性的相关性。结果表明,不同品种的豇豆酚类物质含量和抗氧化活性差异显著。在测定的样品中,新杂1号表现出最高的总酚含量(5.59 mg GAE/g)、总黄酮含量(4.12 mg CAE/g)及抗氧化活性(总还原能力和DPPH自由基清除能力);豇豆中总酚含量、总黄酮含量与总还原能力、DPPH自由基清除能力之间有极显著相关性(P<0.01),与•OH清除能力之间没有显著相关性。
关键词:豇豆;总酚;总黄酮;总还原能力;DPPH自由基清除能力;•OH清除能力
豇豆是人体蛋白质和其他营养物质的重要来源,在我国分布较为广泛,豇豆(Vigna unguiculata)俗称带豆、角豆、饭豆、长豆和腰豆,豇豆由于其较高的营养价值被广泛食用[1]。豇豆主要产于我国的山西、陕西、东北、山东、四川、江西等地,具有多个优良品种,如新杂1号、新杂红、南昌扬子洲黑子和红子、铁线青、安徽月月红。流行病学研究表明,长期食用豇豆对预防癌症、人体老化、心血管疾病等慢性疾病具有较为有效的作用,研究表明这些作用主要归功于其含有的酚类物质[2]。
酚类物质是一种天然的抗氧化剂,作为食物中重要的生物活性成分,对于癌症、动脉粥硬化等疾病具有很好的防护作用,同时通过抗氧化、抗突变作用保护人类身体健康[3]。目前,国内外对豆类中酚类物质的研究较多,Siddhuraju等[4]研究了经过处理的豇豆提取液的抗氧化性和自由基清除活力,结果表明,未经加工的浅棕色豇豆比深棕色豇豆含有更高的酚类物质,干的深棕和浅棕色豇豆具有最高的自由基清除活力。张昊琳等[5]通过研究5 种食用豆及其配比组合来比较其抗氧化性,结果表明,以0.050%的京农8号、0.050%的冀绿9号、0.432%的食荚大菜碗1号、0.050%的龙芸豆4号和0.418%的中豇1号配比组合的总抗氧化能力测定值高达0.589 U/mg。张兵[6]对小扁豆中的酚类物质及抗氧化活性进行检测,小扁豆总多酚含量与总还原能力(ferric reducing antioxidant power,FRAP)之间存在很强的相关性,其皮尔逊相关系数(R2)达0.936 6。为进一步研究豇豆中的酚类物质及建立酚类物质与抗氧化活性之间的关系,本研究以11 种不同品种的豇豆为原料,研究酚类物质含量与FRAP、自由基清除活性相关性,为豇豆酚类物质的开发利用提供理论参考。
1.1 材料与试剂
山西豇豆(未知品种)购于山西省朔州市朔城区贾庄乡西辛庄村四区;吉林豇豆购于吉林省长岭县前七号;铁线青购于陕西榆林米脂;新杂1号、新杂2号、新杂3号、新杂5号、新杂6号、新杂7号、新杂红、新杂9号购于江西农望高科技有限公司。东北、山西、陕西是国内豇豆的主要生产地,并有大面积的种植基地,于江西取材是为更全面地研究同一产地不同品种的豇豆。
没食子酸(色谱纯)、Folin-Ciocalteu试剂 北京百灵威科技有限公司;儿茶素、三吡啶三吖嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、奎诺二甲基丙烯酸酯(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(均为色谱纯) 美国Sigma公司;抗坏血酸(VC)、无水甲醇、无水乙醇、浓盐酸、亚硝酸钠、氢氧化钠、碳酸钠、FeSO4•7H2O、硫酸亚铁、水杨酸均为国产分析纯。
1.2 仪器与设备
AL104电子天平 瑞士梅特勒-托利多仪器有限公司;DFY-500 500克摇摆式高速万能粉碎机 温岭市林大机械有限公司;HH-4数显恒温水浴锅 国华电器有限公司;KQ5200E型超声波清洗器 昆山市超声仪器有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;Varioshan Flash多功能酶标仪 美国热电公司。
1.3 方法
1.3.1 豇豆提取液的制备
豇豆提取液的制备参照文献[7-8],准确称取2.00 g研磨好的豇豆粉末置于50 mL的塑料离心管中,按1∶20的料液比(m/V),加入40 mL的提取液,提取液为含0.1%盐酸的70%甲醇-水混合液,超声提取30 min后4 800 r/min离心10 min,收集上清液。在沉淀中再加入40 mL提取试剂,重复上述步骤。合并两次提取液定容至100 mL,每个样品做3 个平行。最后,样品放在-20 ℃冰箱保存备用。
1.3.2 豇豆中总酚含量的测定
豇豆中总酚含量的测定参照文献[9],采用Folin-Ciocalteu法测定豇豆中总酚的含量。以没食子酸为标准,精确称取5 mg的没食子酸标准样品,用蒸馏水溶解定容至50 mL,该标准液质量浓度为0.1 mg/mL,准确取母液1、2、3、4、5 mL于10 mL容量瓶中。配制质量浓度为0.01、0.02、0.03、0.04、0.05 mg/mL的系列标准溶液。准确量取标准液和豇豆提取液0.5 mL于10 mL具塞试管(EP)中,加入Folin-Ciocalteu试剂0.5 mL,摇匀,静置30 s后加入10 g/100 mL Na2CO3溶液3 mL,摇匀,用超纯水定容至5 mL,在25 ℃条件下避光放置30 min,分别吸取100 µL反应后的溶液于96微孔板中,在750 nm波长处测定吸光度。以没食子酸质量浓度ρ为横坐标,吸光度A为纵坐标,制作标准曲线,计算总酚含量,总酚含量以每克豇豆粉中毫克没食子酸当量(mg GAE/g)计。
1.3.3 豇豆中总黄酮含量的测定
豇豆中总黄酮含量的测定参照文献[10-11],称取5 mg的儿茶素于10 mL容量瓶,用甲醇定容,分别吸取0.125、0.250、0.500、1.000、2.000 mL于5 mL容量瓶,配制成0.012 5~0.200 0 mg/mL的标准液。取0.5 mL的豇豆提取液及儿茶素标准液于10 mL EP管,加入0.1 mL 5 g/100 mL NaNO2和4 mL水,摇匀,放置5 min后,加入0.1 mL 1 g/mL的AlCl3•6H2O,放置6 min,加入3 mL 1 mol/L NaOH,混匀,15 min后,分别吸取200 µL反应后的溶液于96微孔板中,在510 nm波长处测定吸光度。以儿茶素质量浓度ρ为横坐标,吸光度A为纵坐标,制作标准曲线,计算总黄酮含量,总酚含量以每克豇豆粉中毫克儿茶素当量(mg CAE/g)计。
1.3.4 总还原能力的测定
FRAP测定参照文献[12-13]。FeSO4标准曲线的绘制:准确称取13.9 mg FeSO4•7H2O溶于适量的水中,加入18 mol/L的浓硫酸0.25 mL,再加水稀释定容至50 mL,即为1 mmol/L标准溶液。吸取上述溶液5 mL定容至10 mL,则为0.5 mmol/L FeSO4标准溶液。按此方法依次进行,配制得到0.250 0、0.125 0、0.062 5 mmol/L标准溶液,绘制标准曲线,得回归方程。取100 µL样品,加1.8 mL预热至37 ℃的FRAP工作液,摇匀后置于37 ℃条件下反应10 min,分别吸取100 µL反应后的溶液于96微孔板中,于593 nm波长处测定其吸光度(A)。以FeSO4为标准,样品抗氧化活性以达到同样吸光度所需的FeSO4的物质的量(µmol/g)表示。
1.3.5 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参照文献[14-15]。Trolox标准溶液的配制:称取2.5 mg的Trolox置于棕色容量瓶,用70%甲醇-水溶解后,用甲醇定容至100 mL,分别取0.125、0.250、0.500、1.000、2.000 mL于10 mL容量瓶,用甲醇定容。测定各样品的吸光度:A2:1 mL标准液或样品溶液+1 mL DPPH溶液;A1:1 mL标准液或样品溶液+1mL无水乙醇;A0:1 mL DPPH溶液+1 mL纯水。各组样品在25 mL的比色管中摇匀后,在暗室中反应30 min,最后点200 µL样品于96微孔板,用酶标仪在517 nm波长处测定其吸光度,以Trolox为标准,样品抗氧化活性以达到同样清除率所需Trolox的毫克数表示,清除率的计算如式(1)所示。
1.3.6 •OH清除能力的测定
•OH清除能力的测定参照文献[16-17],称50 mg的VC溶于70%甲醇-水(V/V)中,用水定容至100 mL,分别吸取3.0、4.0、5.0、6.0、7.0 mL于100 mL容量瓶,配制成0.15~0.35 mg/mL的标准液。在10 mL EP管中加入2 mmol/L FeSO4溶液、6 mmol/L水杨酸溶液各0.5 mL,样品溶液或VC标准液0.2 mL,摇匀;接着加入1 mmol/L H2O2溶液0.5 mL,摇匀,启动反应;于37 ℃水浴保温60 min后取出,分别吸取200 µL于96微孔板中,用多功能酶标仪在510 nm波长处测定其吸光度。每个处理均做3 个平行。以VC为标准,样品抗氧化活性以达到同样清除率所需的VC的毫克数表示,•OH清除率计算如式(2)所示。
式中:Y为•OH清除率;AX为一定质量浓度样品溶液的吸光度;AX0为不加H2O2溶液而用水代替的样品溶液自身吸光度;A0为模型对照组,即不加待测样品的吸光度。
1.4 数据处理
采用SPSS 17.0统计软件进行数据分析,应用方差分析(ANOVA)进行显著性分析,以P<0.05为差异具有统计学意义。
2.1 豇豆中总酚及总黄酮含量
不同品种豇豆的总酚及总黄酮含量见表1。不同品种豇豆间总酚含量有显著性差异(P<0.05),总酚含量在1.44~5.59 mg GAE/g之间,不同品种豇豆间总黄酮含量有显著性差异(P<0.05),总黄酮含量在0.89~4.12 mg CAE/g之间。11 种不同品种的豇豆中,新杂1号总酚和总黄酮含量最高,新杂7号总酚含量最低,铁线青总黄酮含量最低。Sowndhararajan等[18]的研究表明,未经加工的干豇豆总酚含量为6.8 mg GAE/g干豆粉,与本研究结果基本一致。赵艳[11]以建红4号、定西小扁豆、深红芸豆、蚕豆常规种1、鹰嘴豆134等11 个杂豆品种为实验材料,研究分析多酚类物质含量与抗氧化之间的相关性,结果表明,豇豆属中的建红4号和冀红9218的总酚含量分别为14.2、10.1 mg GAE/g干豆粉,总黄酮含量分别为13.9、11.4 mg RE/g干豆粉(RE即芦丁当量),均高于本研究结果,主要原因可能为豇豆的产地和品种不一样。由表1可知,4 个不同地区的豇豆中,江西的新杂1号总酚、总黄酮含量最高,吉林豇豆次之;同一产地,不同品种的豇豆中,新杂1号总酚、总黄酮含量最高,这对于豇豆产品的开发提供了数据支持。
表1 不同豇豆提取物总酚、总黄酮含量
Table 1 Total phenolic and total fl avonoid contents of extracts from different cowpea varieties
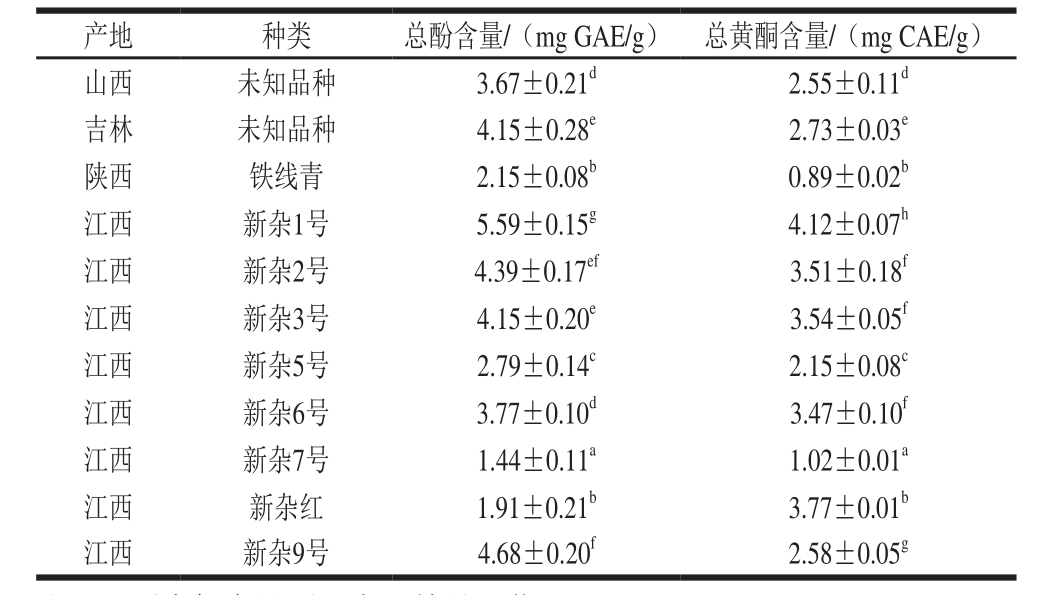
注:同列肩标字母不同表示差异显著(P<0.05)。下同。
2.2 豇豆提取物的FRAP
FRAP测定的原理主要是通过抗氧化活性物质在酸性条件下将Fe3+-TPTZ还原,产生蓝色的Fe2+-TPTZ,它在593 nm波长处有最大吸收,吸光度越大则样品的总抗氧化能力越强[19]。
从表2可以得到豇豆的FRAP测定结果。不同品种豇豆的FRAP值主要分布在12.61~87.35 μmol/g之间,不同品种的豇豆FRAP之间有显著性差异(P<0.05),11 种不同品种豇豆FRAP的大小排序为:新杂1号>新杂2号>新杂6号>新杂9号>新杂3号>吉林豇豆(未知品种)>新杂5号>山西豇豆(未知品种)>铁线青>新杂红>新杂7号,与总酚含量的结果基本一致,这说明总酚含量对于豇豆提取液的FRAP有很重要的影响。Marathe等[20]研究白色、深棕、浅棕的鹰嘴豆、白色、红色、棕色的豇豆、白色、黑色和绿色的豌豆等豆类的抗氧化活性,结果表明红色豇豆、白色豇豆和棕色豇豆的FRAP值分别是22.79、14.25、68.03 µmol/g,与本研究结果相接近。
表2 不同豇豆提取物的FRAP、DPPH自由基和•OH的清除能力
Table 2 Ferric reducing antioxidant power and DPPH and hydroxyl radical scavenging activity of extracts from different cowpea varieties

注:TE即Trolox当量;VCE即VC当量。
2.3 豇豆提取物对DPPH自由基的清除能力
DPPH在乙醇中溶解呈深紫色,抗氧化活性物质能与DPPH的单电子配对,从而使其颜色变浅,在593 nm最大吸收波长处的吸光度减小,根据吸光度的降低水平来衡量样品对于DPPH自由基清除能力[21]。
如表2所示,豇豆提取液对DPPH自由基有较强的清除能力,11 种不同品种的豇豆,新杂1号豇豆的DPPH自由基清除能力最强,为10.60 mg TE/g,显著高于其他豇豆(P<0.05),不同品种豇豆的DPPH自由基清除能力之间有显著差异(P<0.05)。11 种不同品种的豇豆中,新杂7号的DPPH自由基清除能力最弱(0.72 mg TE/g)。任顺成等[22]研究常见豆类提取液的抗氧化性,结果表明,相对于赤豆、芸豆、黑大豆、绿豆和豌豆,花豇豆表现出较强的DPPH自由基清除能力。Gujral等[23]研究鹰嘴豆、红芸豆、乌头叶豇豆等6 种不同种豆子的抗氧化能力,结果表明,乌头叶豇豆全豆的原液对于DPPH自由基清除能力为13.9%。
2.4 豇豆提取物对•OH的清除能力
•OH通过Fenton反应产生,当有•OH清除剂存在时,•OH与水杨酸结合生成的2,3-二羟基苯甲酸能够被消除,2,3-二羟基苯甲酸的最大吸收波长为510 nm,所以可以根据吸光度来衡量样品的自由基清除能力[24]。
11 种豇豆的提取液对•OH的清除能力如表2所示,不同品种的豇豆对•OH的清除能力在9.17~11.67 mg VCE/g之间,铁线青的FRAP和DPPH自由基清除能力较弱,然而其•OH清除能力明显高于其他品种的豇豆(P<0.05),新杂1号具有最强的FRAP及DPPH自由基清除能力,但•OH清除能力最弱,这可能与豇豆中水溶性抗氧化提取物的结构和种类有关。赵艳等[25]对小扁豆、小红豆、建红四号等不同品种杂豆的体外抗氧化活性进行研究,结果表明,豇豆属的杂豆的•OH清除能力较弱,建红四号和冀红9218提取原液的•OH清除能力分别为59.74%和66.33%。
2.5 不同豇豆的总酚、总黄酮含量与体外抗氧化活性相关性研究
目前有很多研究表明,植物化学物质的含量与抗氧化活性之间存在良好的相关性,徐金瑞等[26]研究了127 份黑大豆种质的总酚和花色苷与抗氧化活性之间的相关性,结果表明,FRAP与总酚含量之间呈极显著正相关性。杜双奎等[27]研究可食用杂豆乙醇提取物的体外抗氧化活性,结果表明,不同杂豆的总抗氧能力、DPPH自由基清除能力与总酚含量呈极显著正相关性。周威等[28]研究小粒黑大豆和红小豆提取物的体外抗氧化活性,结果表明提取液中多酚与抗氧化活性呈正相关。本实验对不同品种豇豆的总酚、总黄酮含量与体外抗氧化活性之间的相关性进行研究(表3)。结果表明总酚、总黄酮含量与FRAP、DPPH自由基清除能力有极显著相关性(P<0.01),总酚含量高的豇豆具有较强的FRAP和DPPH自由基清除能力。•OH清除率与豇豆中总酚含量、总黄酮含量之间没有显著相关性(P>0.05),这与巩蔼等[29]的研究结果相一致。总酚含量与FRAP之间有极显著正相关性,皮尔逊相关系数(R2)为0.942;FRAP与DPPH自由基清除能力之间有极显著正相关性(P<0.05),皮尔逊相关系数(R2)为0.954。•OH清除能力与豇豆总酚含量之间没有显著相关性(P>0.05),这些相关性分析能够更加准确地体现豇豆中酚类物质的抗氧化活性,同时也说明酚类可能不是豇豆中唯一的抗氧化活性物质,但是还有待进一步研究。
表3 不同豇豆的总酚、总黄酮含量与体外抗氧化活性相关性分析
Table 3 Correlations between phenolic contents and antioxidant activities of different cowpea varieties
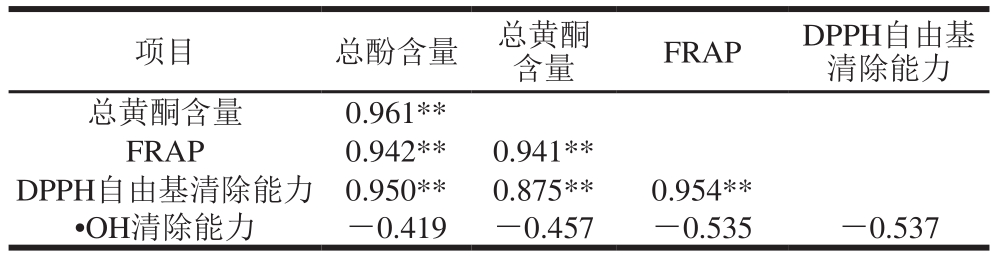
注:**.极显著相关(P<0.01)。
中国豇豆资源丰富,豇豆含有丰富的大量营养素、微量营养素,同时含有黄酮类及酚类物质等植物化学素[4],黄酮类及酚类两种物质均对自由基有清除能力[30],因此,豇豆作为天然的抗氧化物质,其抗氧化活性具有巨大的开发前景。
本研究取材于山西、陕西、东北、江西,并对同一产地(江西)8 种不同品种的豇豆为研究对象,全面研究不同产地及不同品种豇豆的总酚及总黄酮含量,并对其总酚、总黄酮含量与抗氧化活性相关性进行分析,结果表明,11 种不同品种的豇豆中,总酚及总黄酮含量分别为1.44~5.59 mg GAE/g、0.89~4.12 mg CAE/g,FRAP、DPPH自由基清除能力、•OH清除能力分别为12.61~87.35 µmol/g、0.72~10.60 mg TE/g、9.17~11.67 mg VCE/g,新杂1号的总酚含量最高,FRAP最强,这对进一步研究新杂1号育种提供数据支持。豇豆的不同产地对于其总酚含量、总黄酮含量有一定的影响,江西新杂1号、吉林豇豆总酚和总黄酮含量较高。同一产地不同品种的豇豆中,新杂1号总酚和总黄酮含量最高,FRAP最强,新杂2号次之,这可为豇豆品种的选育以及消费者的消费趋向提供一定的科学依据。总酚、总黄酮含量与FRAP、DPPH自由基清除能力极显著正相关。总酚、总黄酮含量与•OH清除能力之间没有显著相关性,这些相关性分析能够更加准确地体现豇豆中酚类物质的抗氧化活性。上述研究结果可为豇豆产品深加工提供数据支持。
参考文献:
[1] PRINYAWIWATKUL W, MCWATTERS K H, BEUCHAT L R, et al. Cowpea flour: a potential ingredient in food products[J]. Critical Reviews in Food Science and Nutrition, 1996, 36(5): 413-436. DOI:10.1080/10408399609527734.
[2] GUTIÉRREZ-URIBE J A, ROMO-LOPEZ I, SERNA-SALDÍVAR S O. Phenolic composition and mammary cancer cell inhibition of extracts of whole cowpeas (Vigna unguiculata) and its anatomical parts[J]. Journal of Functional Foods, 2011, 3(4): 290-297. DOI:10.1016/j.jff.2011.05.004.
[3] DUENAS M, FERNANDEZ D, HERNANDEZ T, et al. Bioactive phenolic compounds of cowpeas (Vigna sinensis L.) modif i cations by fermentation with natural microf l ora and with Lactobacillus plantarum ATCC 14917[J]. Journal of the Science of Food and Agriculture, 2005, 85(2): 297-304. DOI:10.1002/jsfa.1924.
[4] SIDDHURAJU P, BECKE R K. The antioxidant and free radical scavenging activities of processed cowpea (Vigna unguiculata (L.) Walp.) seed extracts[J]. Food Chemistry, 2007, 101(1): 10-19. DOI:10.1016/j.foodchem.2006.01.004.
[5] 张昊琳, 邓媛媛, 雷广军, 等. 5 种食用豆及其配比组合抗氧化性研究[J]. 北京农学院学报, 2014, 29(3): 21-25; 41. DOI:10.13473/cnki. issn.1002-3186.2014.0053.
[6] 张兵. 小扁豆植物化学物组成及其抗氧化、抗炎活性研究[D]. 南昌:南昌大学, 2015: 12.
[7] XU B J, CHANG S K. A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents[J]. Food Science, 2007, 72(2): 159-166. DOI:10.1111/j.1750-3841.2006.00260.x.
[8] 苟体忠, 唐文华, 任永权, 等. 石吊兰总多酚体外抗氧化活性研究[J]. 食品工业科技, 2015, 5(36): 73-77. DOI:10.13386/ j.issn1002-0306.2015.05.006.
[9] HUNG C Y, YEN G C. Antioxidant activity of phenolic compounds isolated from Mesona procumbens Hemsl[J]. Agricultural and Food Chemistry, 2002, 50(10): 2993-2997. DOI:10.1021/jf011454y.
[10] HEIMLER D, VIGNOLINI P, DINI M G, et al. Rapid tests to assess the antioxidant activity of Phaseolus vulgaris L. dry beans[J]. Journal of Agricultural and Food Chemistry, 2005, 53(8): 3053-3056. DOI:10.1021/jf049001r.
[11] 赵艳. 杂豆体外抗氧化活性研究[D]. 杨凌: 西北农林科技大学, 2015: 5.
[12] ZHANG B, DENG Z Y, RAMDATH D D, et al. Phenolic profiles of 20 Canadian lentil cultivars and their contribution to antioxidant activity and inhibitory effects on α-glucosidase and pancreatic lipase[J]. Food Chemistry, 2015, 172: 862-872. DOI:10.1016/ j.foodchem.2014.09.144.
[13] LI H Y, DENG Z Y, ZHU H H, et al. Highly pigmented vegetables: anthocyanin compositions and their role in antioxidant activities[J]. Food Chemistry, 2012, 46(1): 250-259. DOI:10.1016/ j.foodchem.2008.08.008.
[14] 祝子坪, 李娜. 桑黄菌多糖体外抗氧化作用[J]. 食品科学, 2011, 32(19): 92-95.
[15] SHARMA O P, BHAT T K. Analytical methods DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113: 1202-1205. DOI:10.1016/j.foodchem.2008.08.008.
[16] 王玉婷, 陈奕, 李雨波. 干燥方式对香蕉片总多酚含量及其抗氧化性的影响[J]. 食品科学, 2012, 34(23): 113-117. DOI:10.7506/ spkx1002-6630-201323024.
[17] ZHONG K, LIN W J, WANG Q, et al. Extraction and radicals scavenging activity of polysaccharides with microwave extraction from mung bean hulls[J]. International Journal of Biological Macromolecules, 2012, 51(4): 612-617.
[18] SOWNDHARARAJAN K, SIDDHURAJU P, MANIAN S. Antioxidant and free radical scavenging capacity of the underutilized legume, Vigna vexillata (L.) A. Rich[J]. Journal of Food Composition and Analysis, 2011, 24(2): 160-165. DOI:10.1016/j.jfca.2010.09.016.
[19] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[20] MARATHE S A, RAJALAKSHMI V, JAMDAR S N, et al. Comparative study on antioxidant activity of different varieties of commonly consumed legumes in India[J]. Food and Chemical Toxicology, 2011, 49(9): 2005-2012. DOI:10.1016/j.fct.2011.04.039.
[21] 许申鸿, 杭瑚. 用DPPH分析法研究野生植物的抗氧化活性[J]. 青岛大学学报, 1999, 12(3): 75-78.
[22] 任顺成, 王鹏, 马宇翔, 等. 常见食用豆类提取液抗氧化特性研究[J].大豆科学, 2009, 28(6): 1081-1084.
[23] GUJRAL H S, SHARMA P, GUPTA N, et al. Antioxidant properties of legumes and their morphological fractions as affected by cooking[J]. Food Science and Biotechnology, 2013, 22(1): 187-194. DOI:10.1007/ s10068-013-0026-8.
[24] XIONG S L, LI A L, HUANG N, et al. Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of Ophiopogon japonicas[J]. Carbohydrate Polymers, 2011, 86(3): 1273-1280. DOI:10.1016/j.carbpol.2011.06.025.
[25] 赵艳, 杜双奎, 王晗欣, 等. 5 种杂豆体外抗氧化性研究[J]. 中国粮油学报, 2015, 30(10): 6-10.
[26] 徐金瑞, 张名位, 刘兴华, 等. 黑大豆种质抗氧化能力及其与总酚和花色苷含量的关系[J]. 中国农业科学, 2006, 39(8): 1545-1552.
[27] 杜双奎, 于修烛, 李志西. 食用杂豆乙醇提取物的体外抗氧化活性研究[J]. 中国食品学报, 2012, 12(11): 14-19. DOI:10.16429/j.1009-7848.2012.11.003.
[28] 周威, 王璐, 范志红. 小粒黑大豆和红小豆提取物的体外抗氧化活性研究[J]. 食品科技, 2008, 33(9): 145-148. DOI:10.13684/j.cnki. spkj.2008.09.072.
[29] 巩蔼, 任顺成, 常云彩, 等. 云南特色豆类的酚类含量及其抗氧化活性[J]. 中国粮油学报, 2015, 30(4): 1-5.
[30] NITHIYANANTHAM S, SELVAKUMAR S, SIDDHURAJU P. Total phenolic content and antioxidant activity of two different solvent extracts from raw and processed legumes, Cicer arietinum L. and Pisum sativum L.[J]. Journal of Food Composition and Analysis, 2012, 27: 52-60.
Antioxidant Activity and Phenolic Content of Different Varieties of Cowpea
BAI Zhouya, KAN Lijiao, LI Chang, YIN Junyi, NIE Shaoping*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:A total of 11 different varieties of cowpea were collected in this study to investigate their nutritional value. Total phenolic contents and total flavonoid contents were measured and correlated with antioxidant activities (ferric reducing antioxidant power, 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity, and hydroxyl radical scavenging activity). Signif i cant differences in phenolic contents and antioxidant activities among different varieties of cowpea were observed. The Xinza No.1 cultivar exhibited the highest levels of total phenolic content (5.59 mg GAE/g), total fl avonoid content (4.12 mg CAE/g) and antioxidant activity (ferric reducing antioxidant power and DPPH radical scavenging activity). Total phenolic and total flavonoid contents showed highly significant correlations with ferric reducing antioxidant power and DPPH radical scavenging activity (P < 0.01), while weak correlation was observed with hydroxyl radical scavenging activity.
Key words:cowpea; total phenolic; total fl avonoid; ferric reducing antioxidant power; 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity; hydroxyl radical scavenging activity
DOI:10.7506/spkx1002-6630-201715025
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)15-0153-05
引文格式:
白周亚, 阚丽娇, 李昌, 等. 不同豇豆中酚类含量与抗氧化活性[J]. 食品科学, 2017, 38(15): 153-157. DOI:10.7506/
spkx1002-6630-201715025. http://www.spkx.net.cn
BAI Zhouya, KAN Lijiao, LI Chang, et al. Antioxidant activity and phenolic content of different varieties of cowpea[J]. Food Science, 2017, 38(15): 153-157. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201715025. http://www.spkx.net.cn
收稿日期:2016-06-28
基金项目:食品科学与技术国家重点实验室目标导向项目(SKLF-ZZA-201611)
作者简介:白周亚(1991—),女,硕士研究生,研究方向为食品化学与分析。E-mail:15797768916@sina.cn
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品营养与安全、食品复杂碳水化合物。E-mail:spnie@ncu.edu.cn