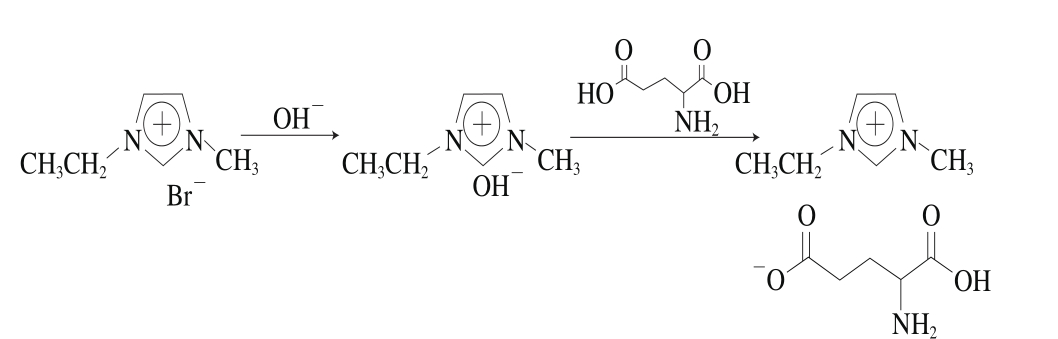
图1 [C2mim][Glu]的合成步骤
Fig. 1 Synthetic pathway of [C2mim][Glu]
贾娜尔·吐尔逊1,王晓娅2,谭瑞康1,李德强1
(1.新疆农业大学化学工程学院,新疆 乌鲁木齐 830052;2.新疆蓝山屯河能源有限公司质管部,新疆 昌吉 831800)
摘 要:以溴化1-乙基-3-甲基咪唑(1-ethyl-3-methylimidazolium bromide,[C2mim]Br)为原料,采用中和法合成氨基酸离子液体1-乙基-3-甲基咪唑-2-氨基-1,3-戊二酸盐(1-ethyl-3-methylimidazolium 1-aminopropane-1,3-dicarboxylic acid salt,[C2mim][Glu])。分别采用亲和毛细管电泳法和荧光猝灭法考察α-乳白蛋白与[C2mim] [Glu]、α-乳白蛋白与[C2mim]Br的相互作用。结果得到二者结合常数均在106L/mol量级,且α-乳白蛋白-[C2mim] [Glu]的结合常数大于α-乳白蛋白-[C2mim]Br,结合比约为1∶1。实验结果为进一步研究α-乳白蛋白与离子液体相互作用机理、开发高效环境友好的α-乳白蛋白萃取体系具有一定的参考意义。
关键词:α-乳白蛋白;氨基酸离子液体;亲和毛细管电泳;结合常数;荧光猝灭法
α-乳白蛋白(α-lactalbumin,α-LAB)是必需氨基酸和支链氨基酸的极好来源,并且也是唯一一种能结合钙的乳清蛋白成分。由于从牛乳分离出来的α-LAB在很多方面与人乳都非常相似,使得牛乳α-LAB在婴儿配方食品、保健品和药品等领域得到广泛应用。故从牛乳中分离α-LAB的研究备受人们的关注。
离子液体(ionic liquid,IL)的优良理化性质使其成为蛋白质萃取分离领域一种备受关注的萃取媒介。引入IL不仅可以有效减少或避免有机溶剂的使用,实现绿色分离,同时还可以提高蛋白质的稳定性,有利于保持目标组分的生物活性[1]。IL在动物血清、乳清中蛋白质的分离领域已受到人们的关注。Quental等[2]用胆碱类IL-无机盐双水相体系萃取牛血清样品中的牛血清白蛋白,萃取效率比聚丙二醇的双水相体系高。Michel等[3]用咪唑类IL-无机盐双水相萃取法提高了乳清中α-LAB、β-乳白蛋白和转铁蛋白的萃取效率。Hasan等[4]以溴化N-烷基-4-甲基吡啶作缓冲溶液添加剂,采用凝胶电泳法实现了α-LAB、转铁蛋白等5 种蛋白质的高效分离,并用荧光猝灭法得知蛋白质与IL产生的疏水性相互作用是影响蛋白质分离的主要因素。除了蛋白质的萃取分离,IL还用于蛋白质的溶解、稳定和再生[5]、蛋白质的色谱分析[6]、电化学分析[7]和空间构型研究[8],IL作为生物催化反应的溶剂、共溶剂或催化剂载体[9-10]还可以实现高效生物催化等,在蛋白质研究领域具有很广泛的应用前景。
蛋白质研究领域常用IL的阴离子有卤素离子、BF4—、PF6—、CH3COO—、NO3—、H2PO4—、HSO4—等。以氨基酸根为阴离子的IL称为氨基酸离子液体(amino acid ionic liquid,AAIL)。氨基酸根是很强的氢键接受体,它的氢键碱性比以上常见阴离子(除CH3COO—)高[11],即AAIL的极性比普通IL的极性强,易与蛋白质产生较强的相互作用[11],是潜在的食品蛋白质萃取介质。
IL在蛋白质研究领域的应用与二者的相互作用密切相关,只有得知二者之间的相互作用机理,才能很好地实现IL在蛋白质研究领域的应用。蛋白质与IL相互作用机理的研究才刚刚起步,二者结合常数的测定是相互作用机理研究的重要组成部分。本实验采用亲和毛细管电泳(affinity capillary electrophoresis,ACE)法研究牛α-LAB与IL的相互作用,通过Scatchard方程测得结合常数。同时又采用经典的荧光猝灭法研究了相同缓冲溶液条件下α-LAB与IL的相互作用,用Stern-Volmer方程和Lineweaver-Burk方程对猝灭类型、结合常数和结合比等进行了测定,考察ACE法在蛋白质与IL结合常数测定中的实用性,并结合文献对α-LAB-IL相互作用进行探讨。旨在为蛋白质与IL相互作用机理的进一步研究理论基础,合理指导IL和AAIL在食品蛋白质分离领域的利用。
1.1 材料与试剂
溴化1-乙基-3-甲基咪唑(1-e t h y l-3-methylimidazolium bromide,[C2mim]Br) 上海笛柏化学品技术有限公司;牛α-LAB 上海蓝季科技发展有限公司;谷氨酸(glutamic acid,Glu) 上海蓝季科技发展有限公司。以上试剂均为分析纯,-20 ℃条件下保存。强碱型阴离子交换树脂 天津市光复精细化工研究所。
1.2 仪器与设备
高效毛细管电泳仪 贝克曼库尔特商贸有限公司;LS-55型荧光分光光度计 美国Perkin Elmer公司;石英毛细管 凯里奥拉色谱分析有限责任公司;单道可调移液器(10~1 000、10~100 μL) 白傅实验仪器苏州有限公司;0.4 µm滤膜 北京九鼎高科公司。
1.3 方法
1.3.1 [C2mim][Glu]的合成
以[C2mim]Br为原料,用中和法合成[C2mim][Glu][12],合成反应方程式如图1所示,合成分两步进行。第一步:将[C2mim]Br通过离子交换树脂,将Br—置换成OH—,得到碱性IL氢氧化1-乙基-3-甲基咪唑(1-ethyl-3-methylimidazolium hydroxide,[C2mim]OH),因[C2mim] OH较不稳定,需要在水溶液中保存,无需对样品进行干燥。第二步:[C2mim]OH与稍过量的Glu低温搅拌反应12 h,反应完加入适量的乙腈和甲醇混合溶液(体积比9∶1),强烈搅拌后过滤,以除去多余的Glu。滤液在55 ℃蒸发除去甲醇、乙腈和溶剂水。用真空干燥箱对产品进行干燥,产品在-20 ℃条件下保存。核磁共振(nuclear magnetic resonance,NMR)法对产品进行表征。

图1 [C2mim][Glu]的合成步骤
Fig. 1 Synthetic pathway of [C2mim][Glu]
1.3.2 α-LAB、IL标准储备溶液的制备
用高纯水配制714.3 μmol/L α-LAB、100 μmol/L [C2mim]Br、100 μmol/L [C2mim][Glu]标准溶液。实验中用超纯水逐级稀释。高浓度储备液于-20 ℃条件下保存,待测溶液和低浓度储备液于-4 ℃条件下保存。
1.3.3 ACE条件
毛细管处理:新毛细管(内径75 μm,总长55 cm,有效长度40 cm)依次用以下试剂(冲洗时间)冲洗,0.5 mol/L NaOH(30 min)、 蒸馏水(10 min)、0.5 mol/L HCl(30 min)、蒸馏水(5 min)、甲醇(5 min)、蒸馏水(3 min)。为保证实验的重现性,每次电泳实验之间依次用以下试剂(冲洗时间)冲洗,0.1 mol/L NaOH(2 min)、蒸馏水(1.5 min)和运行缓冲溶液(2 min);冲洗压力均为10 psi(1 psi相当于0.068 bar)。
电泳条件:进样压差1 psi;进样时间5 s;进样和电泳温度25 ℃。紫外检测波长214 nm;毛细管电泳分析用所有溶液和水均用0.4 μm滤膜过滤。
1.3.4 荧光猝灭法分析条件
测试溶液的制备:取一定量的α-LAB、IL低浓度标准溶液,用磷酸盐缓冲溶液稀释至所需浓度(待测液缓冲溶液组成为10 mmol/L NaH2PO4-10 mmol/L Na2HPO4)。待测液在室温(25 ℃)条件下恒温0.5 h后装入1 cm的石英比色池中测定。
荧光实验条件:扫描速率1 200 nm/min;激发波长280 nm,室温(25 ℃)条件下扫描282~418 nm的发射光谱;激发和发射狭缝宽度均为5 nm,记录331.2 nm波长处的荧光强度。
2.1 [C2mim][Glu]的合成与表征
由9.6 g(50 mmol/L)[C2mim]Br和9.1 g(62 mmol/L)Glu获得10.03 g [C2mim][Glu],产率为78%。[C2mim] [Glu]的1H NMR分析结果:1H NMR(400 MHz,DMSO,δ相对于TMS,ppm)8.96(s, 1H)、7.67(t, 1H)、7.59(t, 1H)、4.18(q, 2H)、3.30(q, 1H)、2.22 (m, 2H)、1.91(m, 1H)、1.85~1.73(m, 1H)、1.43(s, 3H)。与文献[12]值相符。
2.2 ACE法测定α-LAB与IL的结合常数
2.2.1 ACE实验条件的选择
丙酮和N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)是ACE实验中常用的中性内标。分别将二者作为样品,用10 mmol/L NaH2PO4-10 mmol/L Na2HPO4的缓冲溶液进行毛细管区带电泳分析。丙酮在20 min内未出峰,DMF出来一个尖峰(未给出电泳谱图)。因此,选用DMF作中性内标。
ACE测定结合常数的方法有淌度移动法[13]、空亲和毛细管电泳法[14]、空位峰法[15]、Hummel-Dreyer法[16]和前沿分析方法[17]。ACE淌度移动法的具体实验方法如下:蛋白质或IL作为配体直接加入运行缓冲溶液中,另一个作ACE分析物,固定分析物浓度,改变配体浓度,根据样品淌度的变化计算出结合常数[18]。先以[C2mim]Br作为配体加到运行缓冲溶液中,以α-LAB作分析物进行ACE分析。在10 mmol/L NaH2PO4-10 mmol/L Na2HPO4的缓冲溶液中分别加入0、10、20、30、50、100、150、500、1 000、2 000 μmol/L [C2mim]Br进行ACE分析,以[C2mim][Glu]代替[C2mim]Br重复以上实验。结果显示,随着IL浓度的增加,蛋白质的峰形、迁移时间和有效淌度均无发生明显变化,可能的原因是配体浓度低于形成复合物所需浓度[18]。因此,IL不适合作为配体加入到运行缓冲液进行ACE分析。以α-LAB作为配体加到运行缓冲溶液中,以IL作分析物进行ACE分析,如图2、3所示,随着α-LAB浓度的增加,IL迁移时间和有效淌度有显著变化。故以α-LAB作配体加入运行缓冲溶液中进行后续ACE分析。

图 2α-LAB与[C2mim]Br相互作用的ACE电泳图
Fig. 2 Electrophoregrams of α-LAB-[C2mim]Br interactions based on ACE
样品为38.5 mmol/L [C2mim]Br与0.005% DMF的混合溶液;缓冲溶液分别为含有0、1、2、3、4、5、6、10 μmol/L α-LAB的10 mmol/L NaH2PO4-10 mmol/L Na2HPO4溶液;分离电压20 kV。
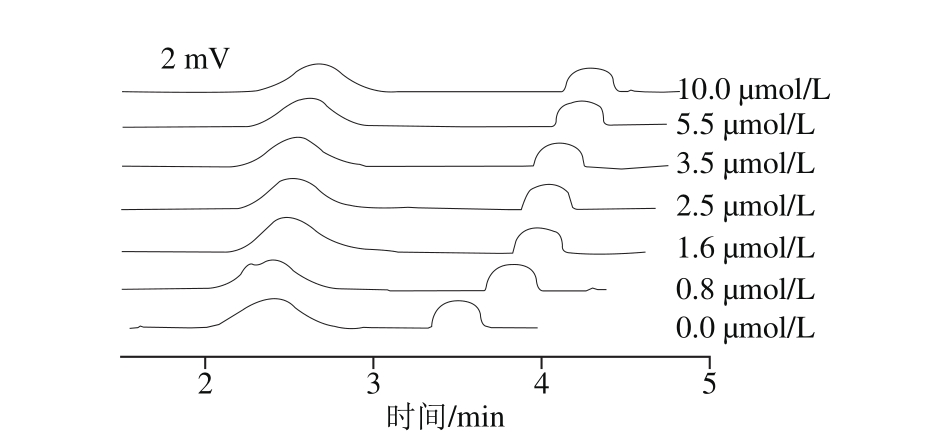
图 3α-LAB与[C2mim][Glu]相互作用的ACE电泳图
Fig. 3 Electrophoregrams of α-LAB-[C2mim][Glu] interactions based on ACE
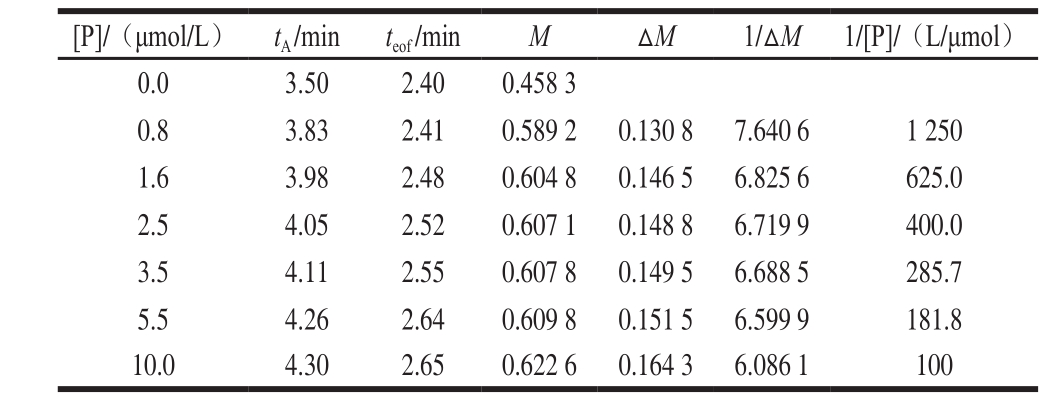
样品为40 mmol/L [C2mim][Glu]与0.005% DMF的混合溶液;缓冲溶液为分别含有0.0、0.8、1.6、2.5、3.5、5.5、10.0 μmol/L α-LAB的10 mmol/L NaH2PO4-10 mmol/L Na2HPO4溶液;分离电压21.7 kV。
ACE分析中配体与中性内标的峰高需要保持基本一致,因此,先对分析物和中性内标的含量进行优化,确定后续ACE实验的样品分别为38.5 mmol/L [C2mim]Br与质量分数0.005%DMF的混合溶液和40 mmol/L [C2mim][Glu]与质量分数0.005% DMF的混合溶液。
2.2.2 α-LAB与IL的结合常数
当IL与蛋白质结合时,结合反应及其结合常数Kb为:

式(1)中:AP为IL与蛋白质的结合物。式(2)中:[AP]、[Af]、[Pf]分别为溶液中IL与蛋白质结合物、游离IL和游离蛋白质的浓度/(μmol/L)。
刘春叶等[19]证明可用淌度比(M)作为电泳中分析物迁移更可靠的定量指标。其定义如下:
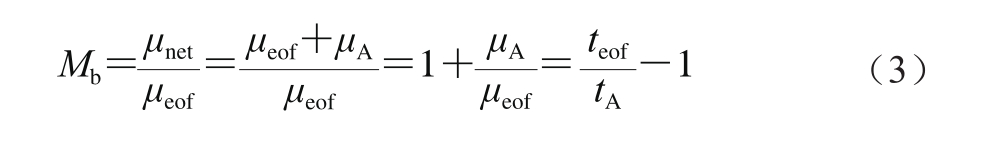
式(3)中:μeof、μnet和μA分别为电渗淌度、分析物有效淌度和分析物表观淌度;teof和tA分别为中性内标和分析物的迁移时间/min。经推导得到Scatchard方程式[18]:
式中:ΔM=M[P]-M[P]=0,ΔMmax=MAP-M[P]=0,M[P]=0为运行缓冲溶液中未添加蛋白质时的淌度比;M[P]是运行缓冲溶液中加入的蛋白质浓度为[P]时的淌度比。根据式(4)![]() 作图可得一直线,该直线的截距与斜率之比即为蛋白质与IL与的结合常数Kb。
作图可得一直线,该直线的截距与斜率之比即为蛋白质与IL与的结合常数Kb。
以α-LAB作配体加入运行缓冲溶液中,分别以[C2mim]Br和DMF的混合溶液、[C2mim][Glu]和DMF的混合溶液作分析物,考察α-LAB与[C2mim]Br、α-LAB与[C2mim][Glu]之间的相互作用。如图2、3所示,随着α-LAB浓度的增加,DMF和IL的迁移时间都延长,IL对DMF的相对迁移时间也延长,说明α-LAB与IL产生了相互作用。表1、2给出了相关电泳分析数据,tA和teof分别代表IL和DMF的迁移时间。由式(4)得到α-LAB-[C2mim]Br和α-LAB-[C2mim][Glu]的结合常数。Scatchard线性方程分别为y=3.288x+13.39和y=1.184x+6.172,线性相关系数分别为0.920 0和0.933 3,Kb分别为4.072×106L/mol和5.211×106L/mol。Scatchard线性方程线性良好,说明ACE淌度移动法非常适合于蛋白质与IL相互作用的测定。
表 1α-LAB 与[C2mim]Br相互作用的Scatchard线性回归方程相关数据
Table 1 Data from Scatchard linear regression equation for binding between α-LAB and [C2mim]Br
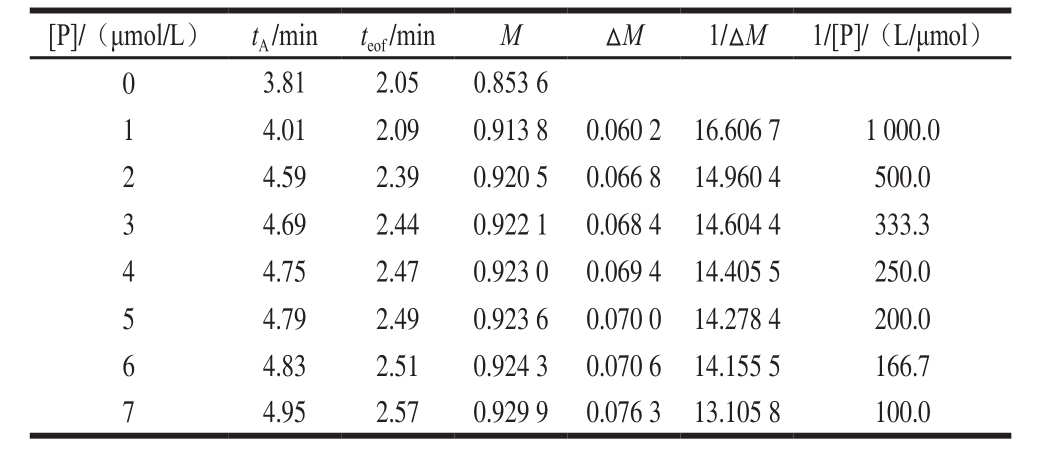
表 2α-LAB与[C2mim][Glu]相互作用的Scatchard线性回归方程相关数据
Table 2 Data from Scatchard linear regression equation for binding between α-LAB and [C2mim][Glu]
2.3 荧光猝灭法测定α-LAB与IL的结合常数
蛋白质的内源荧光主要来源于色氨酸残基,牛α-LAB由123 个氨基酸残基组成,相对分子质量为14 000,分子中有4 个色氨酸残基,因而在280 nm激发光下能发射较强的内源荧光[20]。实验确认激发波长为280 nm时,α-LAB的最大发射波长为331.2 nm,此处[C2mim]Br和[C2mim][Glu]无干扰。如图4、5所示,固定α-LAB浓度的条件下,[C2mim]Br和[C2mim][Glu]的加入对α-LAB的荧光产生了规律性的猝灭,同时α-LAB的最大吸收波长也发生了明显的红移,说明位于α-LAB色氨酸处的疏水环境和蛋白构象发生了变化,IL与α-LAB在此位置结合[21]。

图4 [C2mim]Br对α-LAB荧光猝灭光谱图
Fig. 4 Fluorescence quenching of α-LAB by [C2mim]Br
α-LAB的浓度为1 μmol/L;1~7. [C2mim]Br浓度依次为0.0、0.7、1.5、2.4、3.2、4.0、5.2 μmol/L。

图5 [C2mim][Glu]对α-LAB荧光猝灭光谱图
Fig. 5 Fluorescence quenching of α-LAB by [C2mim][Glu]
α-LAB的浓度为1 μmol/L;1~7. [C2mim][Glu]浓度依次为0.0、0.8、1.7、2.5、3.2、4.0、4.5 μmol/L。
先将此过程按动态猝灭处理,Stern-Volmer方程为[22]:
式中:F0和F分别为未加入和加入猝灭剂时体系荧光强度;[Q]为猝灭剂的浓度/(mol/L);KSV为动态猝灭常数;KQ为双分子猝灭过程的速率常数/(L/(mol·s));τ0为无猝灭剂存在时分子的平均寿命,生物大分子的荧光寿命通常为10-8s[23]。根据式(5)以F0/F对[Q]作图可得一直线,由该直线的斜率和截距可确定KSV和KQ。[C2mim]Br和[C2mim][Glu]对α-LAB的猝灭速率常数KQ分别为9.362×1012L/(mol·s)和1.086× 1013L/(mol·s)。而各类猝灭剂对生物大分子扩散控制的最大猝灭速率常数为2.0×1010L/(mol·s)[23]。显然IL对α-LAB的猝灭速率常数远大于扩散控制的最大猝灭速率常数,说明α-LAB与[C2mim]Br、α-LAB与[C2mim][Glu]之间的猝灭类型属于静态猝灭,而不是动态猝灭,二者形成了复合物。
静态猝灭可以用Lineweaver-Burk方程来描述[22]:
式中:Kb和n分别为结合常数/(L/mol)和结合位点数;F0和F分别表示未加入和加入猝灭剂时体系荧光强度。固定α-LAB的浓度,改变IL的浓度[Q],以![]() 对lg[Q]作图得一直线,由该直线的斜率和截距可确定Kb和n。如表4所示,α-LAB与IL约以1∶1的比例形成复合物。α-LAB-[C2mim]Br的Kb为1.244×106L/mol,α-LAB-[C2mim][Glu]的Kb为1.538×106L/mol。
对lg[Q]作图得一直线,由该直线的斜率和截距可确定Kb和n。如表4所示,α-LAB与IL约以1∶1的比例形成复合物。α-LAB-[C2mim]Br的Kb为1.244×106L/mol,α-LAB-[C2mim][Glu]的Kb为1.538×106L/mol。
表3 加入不同浓度IL时α-LAB的荧光强度
Table 3 Fluorescent intensity of α-LAB in the presence of different concentrations of ILs
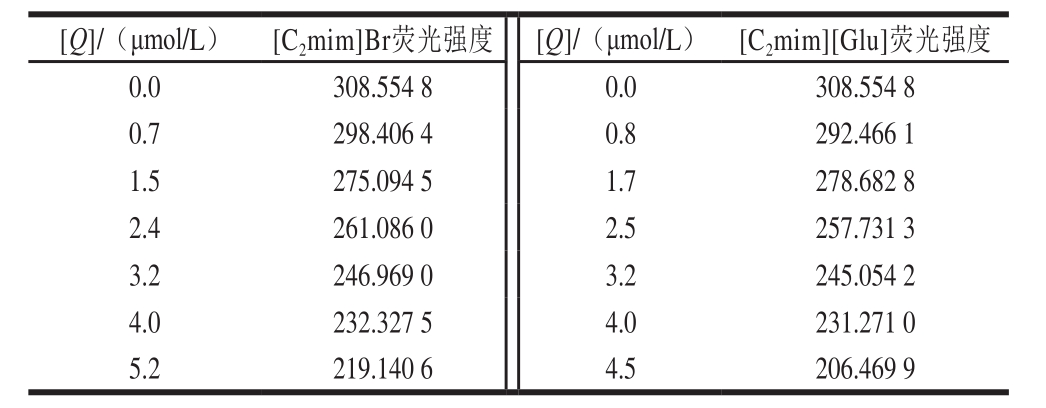
表4 α-LAB与IL结合常数
Table 4 Binding constants between α-LAB and IL

ACE法和荧光猝灭法测得的Kb均在106L/mol量级,属于强结合作用(105~107L/mol量级),一方面,咪唑阳离子是较强的共价配体,它的配位作用比α-LAB所含组氨酸中的中性咪唑基团强,可改变蛋白质的分子构象,促进蛋白质氨基酸链的伸展,从而促进IL与α-LAB的结合[24];此外,Br—和谷氨酸根离子都是氢键接受体,都能够与蛋白质分子中的氨基酸形成氢键,破坏蛋白质分子间原有的氢键,使蛋白质分子空间构象发生变化,从而增强IL与α-LAB的相互作用[25]。
两种方法所得到的Kb有差别,主要原因如下:1)两种方法的实验原理不同,实验条件并不完全相同;2)两种方法基于不同的计算方法,进行线性回归时所选用的物理量不同,引进的误差必然不同。但两种方法获得的Kb值在同一个数量级上,基本吻合,佐证了ACE方法应用于实际相互作用体系的可行性。
α-LAB-[C2mim][Glu]的Kb大于α-LAB-[C2mim]Br的Kb,ACE法测得前者为后者的1.3 倍,荧光猝灭法测得前者为后者的1.2倍。一方面,由于谷氨酸根离子的氢键碱性比Br-的氢键碱性大[11]。与[C2mim]Br比,[C2mim] [Glu]更容易与α-LAB形成氢键[25],使得α-LAB-[C2mim] [Glu]的Kb大于α-LAB-[C2mim]Br的Kb。另一方面,IL阴离子的疏水性也可间接地影响与蛋白质的作用。咪唑类IL阴、阳离子之间通过氢键缔合[26],本实验在水溶液体系中进行测定,IL阴离子的疏水性越强,水的存在更容易破坏IL阴、阳离子间的氢键缔合,导致更多的阳离子从IL中解离,增加IL阳离子与蛋白质作用的机会[27]。由于谷氨酸根离子的疏水性比Br-的疏水性大,在相同的条件下,α-LAB-[C2mim][Glu]体系中与α-LAB作用的[C2mim+]数量比α-LAB-[C2mim]Br体系中与α-LAB相互作用的[C2mim+]数量多,使得α-LAB-[C2mim][Glu]的Kb大于α-LAB-[C2mim]Br的Kb。
毛细管电泳法不仅是蛋白质分离的主要方法,也是研究蛋白质性能必不可少的手段,在食品科学领域中应用越来越广泛。ACE法用于实际相互作用体系具有操作和计算方法简单、允许在生理条件下进行等优势[13]。IL与蛋白质的相互作用与IL的阴、阳离子组成有关,通过调整IL的阴、阳离子组成可以改变IL与蛋白质的相互作用模式和强度,从而影响蛋白质在IL中的溶解性和稳定性,因此可通过具有特定功能团的IL有望实现目标蛋白质的溶解、稳定与分离纯化,以及提高生物催化反应效率。AAIL因具有更好的生物兼容性在食品工业领域有非常广泛的应用前景。
参考文献:
[1] 胡小玲, 郭小青, 管萍, 等. 在离子液体中蛋白质溶解性和稳定性的研究进展[J]. 功能材料, 2013, 44(12): 1679-1689. DOI:10.3969/ j.issn.1001-9731.2013.12.002.
[2] QUENTAL M V, CABAN M, PEREIRA M M, et al. Enhanced extraction of proteins using cholinium-based ionic liquids as phaseforming components of aqueous biphasic systems[J]. Biotechnology Journal, 2015, 10(9): 1457-1466. DOI:10.1002/biot.201500003.
[3] MICHEL B, NEVES M T, DE SOUSA R D S, et al. Partitioning of whey proteins using aqueous two-phase systems with ionic liquids[J]. Quimica Nova, 2015, 38(9): 1148-1152. DOI:10.5935/0100-4042.20150123
[4] HASAN F, VIDANAPATHIRANA P, DAS S, et al. Ionic liquids as buffer additives in ionic liquid-polyacrylamide gel electrophoresis separation of mixtures of low and high molecular weight proteins[J]. RSC Advances, 2015, 5(85): 69229-69237. DOI:10.1039/c5ra11559k.
[5] MILLER M C, HANNA S L, DE FRATES K G, et al. Kinetics and mass spectrometric measurements of myoglobin unfolding in aqueous ionic liquid solutions[J]. International Journal of Biological Macromolecules, 2016, 85: 200-207. DOI:10.1016/ j.ijbiomac.2015.12.067.
[6] WANG Y X, ZHAO K L, YANG F, et al. Protein separation using a novel silica-based RPLC/IEC stationary phase modified with N-methylimidazolium ionic liquid[J]. Chinese Chemical Letters, 2015, 26(8): 988-992. DOI:10.1016/j.cclet.2015.05.001.
[7] XIA J F, CAO X Y, WANG Z H, et al. Molecularly imprinted electrochemical biosensor based on chitosan/ionic liquid-graphene composites modified electrode for determination of bovine serum albumin[J]. Sensors and Actuators B: Chemical, 2015, 225(5): 908-914. DOI:10.1016/j.snb.2015.11.060.
[8] JHA I, VENKATESU P. Endeavour to simplify the frustrated concept of protein-ammonium family ionic liquid interactions[J]. Physical Chemistry Chemical Physics, 2015, 17(32): 20466-20484. DOI:10.1039/c5cp01735a.
[9] RONGE P, SPARRMAN T, ANUGWOM I, et al. Realtime (PNMR)-P-31 investigation on the catalytic behavior of the enzyme adenylate kinase in the matrix of a switchable ionic liquid[J]. Chemsuschem, 2015, 8(22): 3764-3768. DOI:10.1002/cssc.201501104.
[10] GAUCHOT V, BRANCA M, SCHMITZER A. Encapsulation of a catalytic imidazolium salt into avidin: towards the development of a biohybrid catalyst active in ionic liquids[J]. Chemistry, 2014, 20(6): 1530-1538. DOI:10.1002/chem.201303865.
[11] TAMURA K N N, OHNO H. Cytochome C dissolved in 1-alkyl-3-methylimidazolium chloride type ionic liquid undergoes a quasireversible redox reaction up to 140 ℃[J]. Biotechnology and Bioengineering, 2012, 109(3): 729-735. DOI:10.1002/bit.24357.
[12] FUKUMOTO K, YOSHIZAWA M, OHNO H. Room temperature ionic liquids from 20 natural amino acids[J]. Journal of the American Chemical Society, 2005, 127(8): 2398-2399. DOI:10.1021/ja043451i.
[13] ANGELO Z, SALVATORE S, BASTIANINA S, et al. Evaluation of non-covalent interactions between serum albumin andgreen tea catechins by affinity capillary electrophoresis[J]. Journal of Chromatography A, 2014, 1367: 167-171. DOI:10.1016/ j.chroma.2014.09.053.
[14] DVORAK M, SVOBODOVA J, BENES M, et al. Applicability and limitations of affinity capillary electrophoresis and vacancy affinity capillary electrophoresis methods for determination of complexation constants[J]. Electrophoresis, 2013, 34(5): 761-767. DOI:10.1002/ elps.201200581.
[15] TEPANOVA S, KASICKA V. Capillary electrophoretic methods applied to the investigation of peptide complexes[J]. Journal of Separation Science, 2015, 38(15): 2708-2721. DOI:10.1002/ jssc.201500399.
[16] MICHALCOVA L, GLATZ Z. Comparison of various capillary electrophoretic approaches for the study of drug-protein interaction with emphasis on minimal consumption of protein sample and possibility of automation[J]. Journal of Separation Science, 2015, 38(2): 325-331. DOI:10.1002/jssc.201400914.
[17] GONCIARZ A, KUS K, SZAFARZ M, et al. Capillary electrophoresis/ frontal analysis versus equilibrium dialysis in dexamethasone sodium phosphate-serum albumin binding studies[J]. Electrophoresis, 2012, 33(22): 3323-3330. DOI:10.1002/elps.201200166.
[18] 赵新颖, 郭淑元, 陈凡, 等. 毛细管电泳法表征离子液体与蛋白质的相互作用[J]. 分析化学, 2013, 41(8): 1204-1208. DOI:10.3724/ SP.J.1096.2013.20721.
[19] 刘春叶, 张雪娇, 苗延青, 等. 毛细管电泳法研究牛血清白蛋白与盐酸异丙肾上腺素的相互作用[J]. 分析科学学报, 2015, 32(3): 313-317. DOI:10.13526/j.issn.1006-6144.2015.03.004.
[20] BI H N, TANG L, GAO X, et al. Spectroscopic analysis on the binding interaction between tetracycline hydrochloride and bovine proteins β-casein, α-lactalbumin[J]. Journal of Luminenescence, 2016, 178: 72-83. DOI:10.1016/j.jlumin.2016.05.048.
[21] 张黎伟, 张新祥. 亲和毛细管电泳法和荧光法研究氟喹诺酮类药物与牛血清白蛋白的相互作用[J]. 高等学校化学学报, 2008, 29(4): 694-699. DOI:10.3321/j.issn:0251-0790.2008.04.008.
[22] HUANG R N, ZHANG S X, PAN L L, et al. Spectroscopic studies on the interactions between imidazolium chloride ionic liquids and bovine serum albumin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 104(3): 377-382. DOI:10.1016/ j.saa.2012.11.087.
[23] SHU Y, LIU M L, CHEN S, et al. New insight into molecular interactions of imidazolium ionic liquids with bovine serum albumin[J]. Journal of Physical Chemistry B, 2011, 115(38): 12306-12314. DOI:10.1021/jp2071925.
[24] 张涛, 陈凡, 盖青青, 等. 离子液与蛋白质和核酸相互作用的研究[J].化学进展, 2011, 23(10): 2132-2139.
[25] PAGE T A, KRAUT N D, PAGE P M, et al. Dynamics of loop 1 of domain I in human serum albumin when dissolved in ionic liquids[J]. Journal of Physical Chemistry B, 2009, 113(38): 12825-12830. DOI:10.1021/jp904475v.
[26] VARFOLOMEEV M A, KHACHATRIAN A A, AKHMADEEV B S, et al. Thermodynamics of hydrogen bonding and van der Waals interactions of organic solutes in solutions of imidazolium based ionic liquids: “Structure-property” relationships[J]. Thermochimica Acta, 2016, 633: 12-23. DOI:10.1016/j.tca.2016.03.036.
[27] PEI Y C, WANG J J, WU K, et al. Ionic liquid-based aqueous twophase extraction of selected proteins[J]. Separation and Purification Technology, 2009, 64(3): 288-295. DOI:10.1016/j.seppur.2008.10.010.
Interactions of α-Lactalbumin with Ionic Liquids Analyzed by Aff i nity Capillary Electrophoresis and Fluorescence Quenching Method
TUERXUN Jianaer1, WANG Xiaoya2, TAN Ruikang1, LI Deqiang1
(1. College of Chemical Engineering, Xinjiang Agricultural University, Ürümqi 830052, China; 2. Quality Control Department, Xinjiang Blue Ridge Tunhe Chemical Industry Joint Stock Co. Ltd., Changji 831800, China)
Abstract:An amino acid ionic liquid (AAIL), 1-ethyl-3-methylimidazolium 1-aminopropane-1,3-dicarboxylic acid salt ([C2mim][Glu]), was synthesized by the neutralization method from 1-ethyl-3-methylimidazolium bromide ([C2mim]Br). The binding behavior of α-lactalbumin (α-LAB) with [C2mim][Glu] and [C2mim]Br was evaluated by affinity capillary electrophoresis and fluorescence quenching method. The binding constants of both α-LAB-[C2mim][Glu] and α-LAB-[C2mim]Br were in the order of magnitude of 106L/mol, with the former being higher than the latter, and the binding ratios were approximately 1:1. This research may provide some references for further studies aimed to understand the mechanism behind α-LAB-ionic liquid interaction and develop an eff i cient and environment-friendly extraction system for α-LAB.
Key words:α-lactalbumin (α-LAB); amino acid ionic liquids (AAIL); affinity capillary electrophoresis (ACE); binding constant; fl uorescence quenching method
DOI:10.7506/spkx1002-6630-201715030
中图分类号:O657.8
文献标志码:A
文章编号:1002-6630(2017)15-0183-06
引文格式:
贾娜尔·吐尔逊, 王晓娅, 谭瑞康, 等. 亲和毛细管电泳法和荧光猝灭法分析α-乳白蛋白与离子液体相互作用[J]. 食品科学, 2017, 38(15): 183-188. DOI:10.7506/spkx1002-6630-201715030. http://www.spkx.net.cn TUERXUN Jianaer, WANG Xiaoya, TAN Ruikang, et al. Interactions of α-lactalbumin with ionic liquids analyzed by aff i nity capillary electrophoresis and fl uorescence quenching method[J]. Food Science, 2017, 38(15): 183-188. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715030. http://www.spkx.net.cn
收稿日期:2016-07-24
基金项目:新疆农业大学校前期资助课题(XJAU201204)
作者简介:贾娜尔·吐尔逊(1983—),女,讲师,硕士,研究方向为无机物、有机物小分子、生物大分子的色谱分析法。E-mail:hozejanar@163.com