 表示,P<0.05为差异有统计学意义。
表示,P<0.05为差异有统计学意义。王 泳,龚建苗,贾 彦,阎亚丽,庞广昌,赵 培*,陈庆森*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:为进一步阐释乳源酪蛋白糖巨肽(casein glycomacropeptide,CGMP)的抗炎及修复肠道炎症的功效,本研究在确定了乳源CGMP对脂多糖(lipopolysaccharides,LPS)诱导的结肠癌细胞HT-29NF-κB亚单位p65蛋白的影响和乳源CGMP调控核转录因子(nuclear factor,NF)-κB信号通路的基础上,通过构建表达乳源CGMP和NF-κB必需调节蛋白(NF-κB essential modulator,NEMO)的质粒,共转HT-29细胞,免疫共沉淀测定两个蛋白的相互作用。最后采用线粒体膜电位法测定乳源CGMP对HT-29细胞的促凋亡作用。结果表明,乳源CGMP与NEMO(NF-κB essential modulator)30 h共转HT-29细胞中,乳源CGMP与NEMO蛋白均表达,且表现出二者的相互作用。乳源CGMP可与NEMO相互作用影响NF-κB信号通路;同时乳源CGMP还促进HT-29细胞凋亡,呈时间依赖性,其中0.1 μg/mL的CGMP作用效果最好。乳源CGMP与NEMO相互作用是间接作用于IκB激酶(IκB kinase,IKK)而作用于 IκB,进而影响NF-κB信号通路。研究揭示了乳源CGMP调控NF-κB信号通路的另一种途径,也充分说明乳源CGMP可通过作用多种抗炎途径发挥其调控作用。
关键词:酪蛋白糖巨肽;结肠癌细胞HT-29;NF-κB信号途径;NF-κB必需调节蛋白;细胞凋亡
引文格式:
王泳, 龚建苗, 贾彦, 等. 乳源酪蛋白糖巨肽作用人结肠癌细胞HT-29调控炎症活力研究[J]. 食品科学, 2017, 38(15): 201-207. DOI:10.7506/spkx1002-6630-201715033. http://www.spkx.net.cn
WANG Yong, GONG Jianmiao, JIA Yan, et al. Milk-derived casein glycomacropeptide (CGMP) regulates in fl ammation in human colon carcinoma cells HT-29[J]. Food Science, 2017, 38(15): 201-207. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715033. http://www.spkx.net.cn
食品通过调节细胞因子网络来调节免疫网络、信息传递网络和代谢网络,从而控制机体的健康和生命活动[1-2]。乳源酪蛋白糖巨肽(casein glycomacropeptide,CGMP)是一种非常重要的乳源生物活性肽[3-4],到目前为止,人们已经从不同角度探讨了乳源CGMP对机体健康的生物学功效,但对功能特性和作用机制进行论证与探讨的报道不多。本课题组围绕乳源CGMP的分离纯化[5]和生物学活性评价以及相关信号通路等方面开展了研究[6-25],包括从调控和恢复肠道溃疡性结肠炎(ulcerative colitis,UC)的角度,全面地研究并阐述了乳源CGMP对肠黏膜细胞因子及其网络的影响[7,11,14,19]、与保护肠黏膜完整性有关的黏膜屏障因子的表达水平[9-10,21]、对肠黏膜细胞的免疫调节作用[17-18]、对UC小鼠抗凋亡的作用机制[12,20]、对相关信号通路途径[15,22-23]和对肠道黏膜以及粪便微生物菌群多样性的作用[24-25];同时还从表观遗传学的角度阐述了乳源CGMP对早期结肠癌细胞发生发展的抑制作用[16]。本课题组研究成果与Groux等[26]报道的研究结果一致。前期研究结果提示,乳源CGMP作为生物活性物质通过参与肠黏膜免疫应答,促进肠黏膜屏障因子的适时表达,调节免疫细胞亚群的平衡,表现出明显的抵御肠道炎症的能力,作为一种营养治疗方案有可能成为缓解、修复和治疗炎症性肠病(inflammatory bowel disease,IBD)的一种新功能性成分。
各种免疫调节和效应细胞所表达的与炎症介导物相关的信号转导问题也一直是免疫学领域关注和研究的热点。外界刺激分子可以特异性地与免疫细胞表面的各种受体相结合,随后诱导细胞产生应激反应的过程,包括受体识别、信号转导和细胞内效应3 个过程。信号传导会引起细胞内蛋白质活性、细胞膜通透性、基因表达状况、细胞形态和功能等各方面的变化。Requena等[27]研究发现,牛乳糖巨肽(bovine glycomacropeptide,BGMP)可通过激活核转录因子(nuclear factor,NF)-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导途径,上调人单核细胞肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素(interleukin,IL)-1β和IL-8的分泌,并认为BGMP在肠道中可能起到抗炎的作用。本课题组前期从分子生物学角度开展了口服乳源CGMP干预UC模型小鼠,研究探讨NF-κB p65的表达水平与UC的发展状况的相关性,表明NF-κB p65表达水平在UC发生发展中起关键作用[23]。推测作为乳源糖肽的乳源CGMP可能与NF-κB p65分子结合,阻止了p65上的转录激活区(transactivation domain,TAD)与DNA的结合,从而减弱其活性。说明乳源CGMP可能作为NF-κB活性的负调控因子[22],即可用它的活性状况作为一个有效治疗靶点,为治疗炎症性肠病提供了更有力的理论支撑。
NF-κB必需调节蛋白(NF-κB essential modulator,NEMO)是NF-κB信号通路中的小泛素相关修饰物(small ubiquitin-related modifier,SUMO)修饰蛋白,是细胞质IκB激酶(IκB kinase,IKK)复合物的一部分,又叫NF-κB基本调节器(NF-κB essential modulator,NEMO),其是NF-κB信号通路中的小泛素相关修饰物(small ubiquitin-related modifier,SUMO)修饰蛋白,是细胞质IκB激酶(IκB kinase,IKK)复合物的一部分,又叫IκB激酶γ(IκB kinase-gamma,IKKγ),IKKγ对细胞的DNA损伤起反应。本课题组前期研究表明,乳源CGMP可显著降低NF-κB信号通路关键蛋白IκBα的降解,其机制是抑制了IκBα的磷酸化和泛素化,使p-IκBα和泛素化关键蛋白E3RSIκB和UBC5的表达均有所下降,进而减少了IκBα的降解,增加了IκBα-p65-p50蛋白三聚体的数量,使NF-κB p65蛋白核移位效应降低,进而减少下游基因的表达,阐释了乳源CGMP是通过调控NF-κB信号通路以发挥抗炎的作用。
基于以上分析,据本课题组前期研究结果得知,乳源CGMP作为生物活性物质在改善、修复和治疗IBD方面具有潜在的功效和优势,本研究采用结肠癌细胞HT-29,经脂多糖(lipopolysaccharides,LPS)刺激干预后分别用免疫共沉淀法和线粒体膜电位法测定乳源CGMP对人结肠癌HT-29细胞NF-κB信号通路关键蛋白的影响,确定相应的作用靶点,更进一步地探讨并阐述乳源CGMP调控NF-κB信号途径,为确定乳源CGMP的抗炎分子机制以及维护相关肠黏膜内环境生物学活性功能提供科学依据,使乳源CGMP作为功能性食品用于炎症性肠病的生物免疫治疗奠定基础。
1.1 材料与试剂
CGMP 新西兰Tatua公司;人类结肠癌细胞HT-29江苏齐氏生物科技有限公司。
1.2 仪器与设备
倒置显微镜 日本Nikon公司;CO2培养箱 美国Thermo公司;多功能读板机 美国Molecular Devices公司;迷你双垂直电泳槽、迷你转印电泳槽、电泳仪 北京六一仪器厂;高速冷冻离心机 德国Sigma公司。
1.3 方法
1.3.1 HT-29细胞培养
参考文献:[21-22],HT-29细胞在含有10%胎牛血清、青霉素(100 U/mL)和链霉素(100 U/mL)的DMEM培养基中,置于37 ℃、5% CO2培养箱内进行培养。待细胞对数期时进行实验。
1.3.2 乳源CGMP对HT-29细胞NF-κB信号途径中调节蛋白NEMO的影响
1.3.2.1 表达载体的构建、表达和测序
通过http://www.ncbi.nih.gov/、http://www.hprd.org/网站查找出目的蛋白编码基因的序列及结构,由美国复能基因公司合成序列,并将乳源CGMP全长cDNA构建在pCMV-Myc载体上,将NEMO/IKKγ开放阅读框序列构建到pCMV-Flag载体上。测序由生工生物工程股份有限公司完成。
1.3.2.2 质粒瞬时转染HT-29细胞
接种细胞:转染前1 d,用胰酶消化细胞并计数。调整细胞浓度,将细胞以106个/孔铺入6 孔板中,每孔加入2 mL完全培养液。
准备DNA-EndoFectinTM复合物:将DNA、EndoFectinTM试剂和稀释剂(无血清DMEM高糖培养液)升至室温。6孔板每孔加入DNA 0.4~6.0 μg,稀释到50~200 μL,每1 μg DNA需用 3.0 μL EndoFectinTM试剂,EndoFectinTM试剂与DNA稀释体积一致。一边轻轻涡旋装有DNA溶液的试管,一边将稀释的 EndoFectinTM试剂滴加至试管中(勿颠倒添加顺序)。充分混匀后,室温静置10~25 min以形成DNA-EndoFectinTM复合物。
转染HT-29细胞:待细胞汇合度达到70%~80%时,直接向每个孔中加入DNA-EndoFectinTM复合物并轻轻涡旋培养板/培养皿。在无血清条件下转染时,去除生长培养基,替换成无血清培养基,然后滴加DNA-EndoFectinTM复合物。转染3 h后,添加1/2体积的含30%血清的生长培养基。
孵育细胞和分析结果:在CO2培养箱中37 ℃条件下下分别孵育细胞0、20、28、36 h,提取蛋白进行检测。
1.3.2.3 非变性裂解液提取细胞总蛋白
去除培养液,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗一遍,洗去血清中的IgG。每孔加入添加蛋白酶抑制剂的裂解液200 μL,混匀,使裂解液和细胞充分接触,冰上孵育5~10 min,为促进细胞裂解,可用枪头轻轻吹打。4 ℃、12 000×g离心5 min。尽快将上清液转入一支预冷的洁净无菌的微量离心管,即得细胞总蛋白。
1.3.2.4 转染HT-29细胞的Western blotting检测
NEMO转染总蛋白含量测定参照文献[22],乳源CGMP分子质量约为7 kD,采用小分子Tricine-PAGE电泳,具体操作如下:1)Tricine-PAGE凝胶制备(双面):将玻璃板用蒸馏水清洗干净,再用75%的酒精去脂,干燥后固定在灌胶支架上;按配方4.522 mL分离胶贮存液、3.333 mL分离胶缓冲液、1.067 mL甘油、2.233 mL双蒸水、34 μL 10%过硫酸铵(ammonium persulfate,AP)和4 μL四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)制备分离胶,加入TEMED后轻轻振荡混匀,迅速注入安装好的玻璃板的间隙中,留出足够的空间(分离胶厚度约4 cm、堆积胶厚度约1.5 cm、空间胶厚度约2 cm)。在丙烯酰胺溶液上覆盖一层水饱和的正丁醇,以防止空气扩散到凝胶中抑制聚合作用;在室温条件下,凝胶应在60 min左右聚合完成。倒掉覆盖层并用蒸馏水清洗凝胶顶部数次,并用滤纸条吸净残留的蒸馏水。按配方0.6 mL分离胶贮存液、0.667 mL分离胶缓冲液、1.38 mL双蒸水、43 μL10% AP和3 μL TEMED制备空间胶,加入TEMED后轻轻振荡混匀,迅速注入分离胶上方,在丙烯酰胺溶液上覆盖一层水饱和的正丁醇;在室温条件下,凝胶应在40 min左右聚合完成。倒掉覆盖层并用蒸馏水清洗凝胶顶部数次,并用滤纸条吸净残留的蒸馏水。按配方0.741 mL堆积贮存液、0.542 mL堆积胶缓冲液、2.94 mL双蒸水、43 μL 10% AP和3 μL TEMED制备堆积胶,加入TEMED后轻轻振荡混匀,迅速注入空间胶上方,立即插入干净的梳子,不要混入气泡,以免影响凝胶的聚合;在室温条件下,凝胶应在30 min左右聚合完成。堆积胶聚合后小心移去梳子,避免破坏加样孔,用蒸馏水小心清洗加样孔,以除去未聚合的丙烯酰胺。2)加样:将凝胶固定在电泳装置上,电泳上槽内加入阴极缓冲液没过加样孔,并确保没有阴极缓冲液从电泳上槽漏出;电泳下槽内加入阳极缓冲液,倾斜整个装置以赶走凝胶下面可能留有的气泡。按预定顺序加样,每孔加入20 μL。3)电泳:将电泳装置与电源连接进行电泳,样品在堆积胶和空间胶阶段电压为70 V,而在分离胶阶段电压调整为120 V。直到溴酚蓝到达分离胶的底部后,关闭电源,这个过程大约需要3 h。4)湿法转膜:取出玻璃板并撬开,留取所需分离胶置于转膜缓冲液中,预先裁好与胶条大小相同的滤纸和PVDF膜,将PVDF膜于甲醇中活化1 min后,将其与滤纸一起放入转膜缓冲液中平衡15 min。转膜装置从下至上依次按阳极板、2 层滤纸、PVDF膜、凝胶、2 层滤纸、阴极板的顺序放好,滤纸、凝胶与PVDF膜精确对齐,每一步必须确保除去气泡,然后用迷你湿式转印电泳槽200 mA恒流转移1 h,将蛋白转移至PVDF膜。5)后续Western blotting操作参见文献[22]。
蛋白条带的灰度积分值分析:将得到的胶片进行拍照,利用QuantityOne凝胶成像分析软件得到各个目的条带和内参条带的灰度积分值,确定转染效果,进行后续操作。
1.3.2.5 免疫共沉淀法测定乳源CGMP与NEMO的相互作用
将含有Flag、Myc标签的融合蛋白表达载体共转HT-29细胞,转染30 h后用预冷的PBS冲洗3 次,收集细胞(离心后的细胞沉淀于-80 ℃保存)。蛋白提取和蛋白含量测定参照文献[22]。采用c-Myc Taq IP试剂盒,取Handee™离心柱管,将底部的塞子塞上,加上适量的细胞裂解液到离心管。用150 μL TBS稀释50 μL c-Myc标签作为阳性对照。在分配之前迅速翻转小瓶几次达到完全重悬抗c-Myc标签琼脂糖(不要涡旋),用宽口枪头将10 μL抗c-Myc标签琼脂糖悬浊液(5 μg抗c-Myc标签抗体)分配到每个标记的离心管中,拧紧盖子。在4 ℃条件下上下翻转孵育混合至少1 h,最佳的孵育时间从2 h至过夜。松开离心管的上盖,拔掉底部的塞子,将收集管放在离心管的底部,离心10 s,丢掉液体(或者收集后用于将来的分析)。加入0.5 mL TBST到每个管中。轻轻拧紧盖子并轻柔的翻转带收集管的离心管2~3 次,离心10 s。去掉洗脱液(或者收集后用于将来的分析),重复该步骤两次。将离心管放到新的收集管中。加入25 μL 2×非还原性样本缓冲液到抗c-Myc标签琼脂糖,轻轻拧上盖子,并轻轻敲打管子以混匀。95~100 ℃加热装配的离心柱/收集管5 min,离心10 s。准备Western blotting,用Myc沉淀,检测Flag标签的NEMO蛋白,方法参照文献[22]。
1.3.3 乳源CGMP对HT-29细胞凋亡影响的研究
细胞分组培养:细胞以5 000 个/孔传代于96 孔黑色底透微孔板,每孔100 μL,用含10%的胎牛血清的DMEM高糖培养液培养细胞至60%~70%时,用无血清培养基同步化6 h,吸除培养液,用PBS洗涤1 次。研究分8 组:空白组(N组)、LPS组(L组)、CGMP组(C1组:0.001 μg/mL、C2组:0.010 μg/mL、C3组:0.100 μg/mL、C4组:1.000 μg/mL、C5组:10.000 μg/mL、C6组:100.000 μg/mL),每组6 个复孔。37 ℃、5% CO2条件下孵育6、12、24、48 h和72h。
罗丹明123(Rhodamine 123,Rh123)孵育细胞:到相应时间点时,用预热到37 ℃的PBS洗2~3次,吸弃PBS后,每孔加入5 μg/mL的罗丹明123 100 μL,37 ℃、5% CO2条件下孵育1 h。
洗涤:用预热到37 ℃的PBS洗3 次,每次尽量吸弃液体又保持细胞表面湿润,最后一次吸尽液体。
多功能读板机测定:每孔加入100 μL PBS,测定激发光波长507 nm,发射光波长529 nm条件下的荧光强度。
1.4 统计学分析
使用SPSS 17.0统计软件对实验数据进行分析处理,进行单因素方差分析,处理结果以 表示,P<0.05为差异有统计学意义。
表示,P<0.05为差异有统计学意义。
2.1 乳源CGMP对HT-29细胞NF-κB信号途径中调节蛋白NEMO的影响
2.1.1 表达载体的构建、表达和测序
通过测定260 nm波长处吸光度测定DNA的质量浓度分别为pCMV-Myc 401 ng/μL、pCMV-Flag 466 ng/μL,琼脂糖凝胶电泳检测其完整性,结果如图1所示,生工生物工程股份有限公司测序,结果经过比对为正确序列。
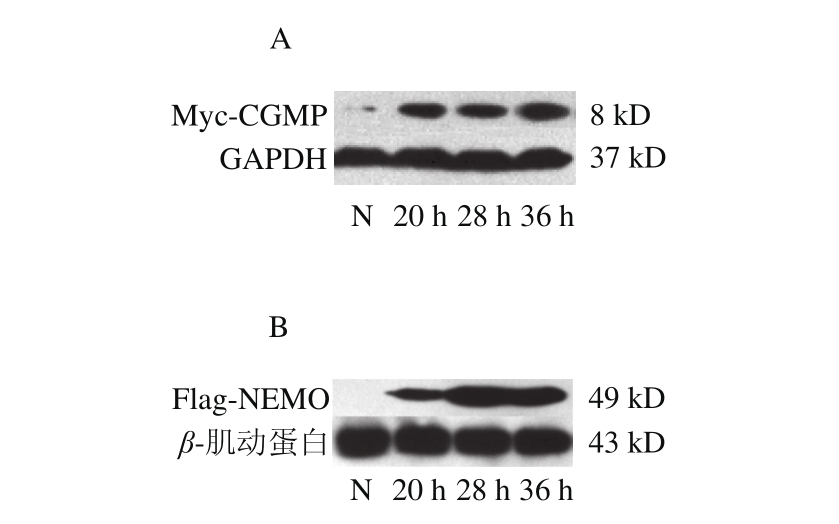
图1 pCMV-Myc-CGMP(A)、pCMV-Flag-NEMO(B)转染细胞后Western blotting检测
Fig. 1 pCMV-Myc-CGMP (A) and pCMV-Flag-NEMO (B) expression in HT-29 cells after transfection detected by Western blotting
2.1.2 质粒瞬时转染HT-29细胞
将插入目的片段的pCMV-Myc-CGMP、pCMVFlag-NEMO分别转染到HT-29细胞中,表达标签蛋白质,其中转染0 h为空白组(N)。细胞裂解液样品用Western blotting法检测,得到分子质量正确的蛋白质条带(图1)。其中Myc-CGMP在20 h就有较高的表达量,而Flag-NEMO在20 h时表达量还比较少,随时间延长,Flag-NEMO表达量增大,28 h时表达量已经很高。
2.1.3 乳源CGMP与NEMO的相互作用
NEMO/IKKγ作为NF-κB通路机制研究中一个靶点,用免疫共沉淀技术证实乳源CGMP和NEMO/IKKγ的相互作用。
免疫共沉淀是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。为了确证乳源CGMP与NEMO/ IKKγ的相互作用,用pCMV-Myc-CGMP载体和pCMVFlag-NEMO载体共转染于HT-29细胞,以Myc作为IP抗体,每组设立相应的阴性对照组,Western blotting法检测每组Flag-NEMO的表达(图2)。

图2 CGMP与NEMO免疫共沉淀结果
Fig. 2 Verif i cation of CGMP and NEMO/IKKγ interaction by Co-IP
由图2中WB:Myc、WB:Flag可以看到pCMV-Myc-CGMP质粒和pCMV-Flag-NEMO质粒共转HT-29后,乳源CGMP与NEMO/IKKγ蛋白均表达,通过IP:Myc可以看到在过表达条件下乳源CGMP与NEMO/IKKγ有明显的相互作用,只是因为两者分子质量相差1 kD条带分开不明显,但可明显看到在lgG(L)表达量相差不大的情况下,两者共转后IP经Western blotting检测条带明显宽于其中任何一个单独转染,证明两者存在明显的相互作用。
2.2 乳源CGMP对HT-29细胞凋亡的影响
本研究对于加入LPS、乳源CGMP后是否对HT-29细胞的存活有影响,而发生不科学的研究数据,本实验选择Rh123试剂通过荧光信号的强弱来检测线粒体膜电位的变化和凋亡的发生。不同剂量乳源CGMP作用下线粒体膜电位的变化见图3。

图3 线粒体膜电位测定HT-29细胞凋亡
Fig. 3 Verif i cation of HT-29 cell apoptosis by mitochondrial transmembrane potential
*.相同时间时,与N组差相比异显著(P<0.05);**.相同时间时,与N组相比差异极显著(P<0.01);#.相同时间时,与L组相比差异显著(P<0.05);##.相同时间时,与L组相比差异极显著(P<0.01)。
由图3可知,随着作用时间延长,各组线粒体膜电位均呈增加趋势;L组与N组相比线粒体膜电位均略低;相同孵育时间时,CGMP组随质量浓度的增加,线粒体膜电位均先增加后降低,在0.1 μg/mL时膜电位最大。研究发现CGMP作用6 h时,与N组相比,C2和C3组显著促进了LPS刺激下线粒体膜电位的增加(P<0.05),其中C3具有极显著性(P<0.01),其他各组作用不显著;与L组相比,C2、C3和C4组显著促进了线粒体膜电位的增加(P<0.05),C1、C5和 C6组也使线粒体膜电位有所增加,且高于N组,但不具有显著性。另外CGMP作用12 h时,与N组相比,C2、C3、C4和C5组显著促进了LPS刺激下线粒体膜电位的增加(P<0.05),其中C3和C4具有极显著性(P<0.01);与L组相比,C2、C3、C4和C5组显著促进了线粒体膜电位的增加(P<0.05,P<0.01),C1和C6组也使线粒体膜电位有所增加且高于N组,但不具有显著性。当CGMP作用24 h时,与N组相比,C2、C3、C4和C5组显著促进了LPS刺激下线粒体膜电位的增加(P<0.05),其中C3和C4具有极显著性(P<0.01);与L组相比,C2、C3、C4和C5组显著促进了线粒体膜电位的增加(P<0.05),C1和C6组也使线粒体膜电位有所增加且高于N组,但不具有显著性。当CGMP作用48 h时,与N组相比,C1、C2、C3、C4和C5组显著促进了LPS刺激下线粒体膜电位的增加(P<0.05),其中C3和C4组具有极显著性(P<0.01);与L组相比,C1、C2、C3、C4和C5组显著促进了线粒体膜电位的增加(P<0.05),其中C3具有极显著性(P<0.01)。当CGMP作用72 h时,与N组相比,C3和C4组显著促进了LPS刺激下线粒体膜电位的增加(P<0.05),其他各组作用不显著;与L组相比,C1、C2、C3、C4和C5组显著促进了线粒体膜电位的增加(P<0.05),其中C3组具有极显著性(P<0.01),C6组虽略高于N组,但不具有显著性(P>0.05)。
研究显示基因毒性应力导致NEMO通过位点特异性SUMO-1 结合于NLS[15,30]。IκB的激活降解依赖IKK,所以,NEMO的SUMO化可以影响NF-κB信号途径的转录激活。基因剔除实验表明,NEMO的完整是IKK活性和NF-κB的激活的前提[31]。DNA损伤反应引发RIP1(death receptor-interacting protein 1)、PIDD(P53-induced death domain protein 1)等活化,导致NEMO的SUMO化并向核内迁移促进NF-κB活化,在DNA损伤诱导NF-κB激活过程中起关键作用[32]。DNA损伤还激活激酶ATM(DNA损伤感应器分子),导致NEMO磷酸化和泛素化,并迁回细胞质调节IKK的活化。在氧化应激作用下,DNA损伤致DNA双链断裂,导致连接于NEMO和促进S85磷酸化的ATM激活,然后使NEMO泛素化,NEMO和ATM转出细胞核,转出的NEMO和ATM促进IKK的激活,导致IκBα降解而使NF-κB激活[33]。NEMO在NF-κB激活中如此重要,乳源CGMP是否与其相互作用呢?我们用免疫共沉淀技术探讨NEMO/IKKγ和乳源CGMP是否发生相互作用。分析结果显示,分别将插入目的片段的pCMVMyc-CGMP、pCMV-Flag-NEMO转染到HT-29细胞中,在20 h时Myc-CGMP就有较高的表达量,Flag-NEMO在20 h时表达量还比较少,28 h时表达量已经很高,随转染时间增加,转染质粒目的蛋白表达的量增加,故选取30 h为转染时间共转HT-29细胞中。由图2可以看出,存在两个条带,其原因可能是抗体、目的蛋白、Protein A/G beads三者之间是以非共价健结合在一起,只有Protein A/G与琼脂糖珠是共价结合在一起的。因此,最后经过添加含巯基乙醇的加样缓冲液以及煮沸变性并离心出去Protein A/G beads后,离心管只有抗体和目的蛋白以及少量非特异性吸附蛋白。这样十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中就含有目的蛋白和抗体二种蛋白,由于加样缓冲液中含有巯基乙醇从而导致抗体的重链与轻链之间的二硫键被破坏从而使得抗体分子变成重链分子(50 kD)和轻链分子(20 kD)。因此,Western blotting显色反应中除了能检测到目的蛋白外,由于本实验使用的二抗与用于免疫沉淀实验的抗体分子属于同一种属,故还能检测到重链和轻链分子。由图1还可以看到,质粒共转HT-29细胞后,乳源CGMP与NEMO/IKKγ蛋白均表达,通过IP:Myc可以看到在过表达条件下乳源CGMP与NEMO/IKKγ有明显的相互作用,有不少的Flag-NEMO蛋白被沉降下来,只是因为lgG(L)与Flag-NEMO两者分子质量仅相差1 kD,条带不好分开,但可明显看到在lgG(L)表达量相差不大的情况下,两者共转后IP经WB条带(IP:Myc)第三列第一行条带明显宽于其中任何一个单独转染的条带,证明两者存在明显的相互作用,进入细胞内部的乳源CGMP可以通过一定的作用力与NEMO结合,进而影响其激活NF-κB,但其具体结合到NEMO的哪个结合域上还有待进一步研究。
研究已经证实,当细胞发生凋亡时,线粒体会发生一系列的变化:线粒体通透性增加,大量可溶性蛋白释放到胞浆(大多数可溶性蛋白带负电荷),使膜间隙的正离子不断进入基质,导致内膜两侧的离子梯度消失,从而使膜电位下降[34],因此用Rh123线粒体膜电位检测细胞凋亡。细胞色素c从线粒体释放,并与细胞凋亡激活因子1(apoptotic protease activating factor 1,Apaf-1)结合,从而活化caspase-9前体,进而激活caspase-3,引发Caspases级联反应,最终导致细胞凋亡。图3表明,各个质量浓度的CGMP促进了LPS刺激下HT-29细胞的凋亡,与N组相较,L组细胞凋亡程度均有所下降,即LPS抑制结肠癌细胞HT-29凋亡,但不具有显著性。随作用时间增加,CGMP促进细胞凋亡程度逐渐增大,呈时间依赖性,随CGMP质量浓度增加,各个时间点的细胞凋亡程度均先增加后降低,其中0.1 μg/mL的CGMP作用效果最好,每个作用时间较N组和L组均具有差异显著性,此外,0.01 μg/mL和1 μg/mL的CGMP作用效果也较好,除6 h和72 h外,较N组和L组均具有显著性提高,质量浓度最高的100 μg/mL CGMP作用效果最不好,无论与N组还是L组相较均不具有显著性,说明并非质量浓度越高作用效果越好。
本实验利用免疫共沉淀技术验证了乳源CGMP可与NEMO相互作用,说明乳源CGMP可间接作用于IKK而作用于IκB,实现调控NF-κB信号途径的激活。研究阐述了乳源CGMP表现促进HT-29细胞凋亡的能力,而NF-κB信号途径抗细胞凋亡,这可能是乳源CGMP调控NF-κB信号途径的另一方式。进一步研究确定乳源CGMP具有显著的调节NF-κB信号途径,改善炎症性肠病引发的结直肠癌的作用。
参考文献:
[1] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅰ)[J]. 食品科学, 2006, 27(5): 258-264. DOI:10.3321/ j.issn:1002-6630.2006.05.058.
[2] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅱ)[J]. 食品科学, 2006, 27(6): 260-270.
[3] FIAT A M, JOLLÈS P. Caseins of various origins and biologically active casein peptides and oligosaccharides: structural and physiological aspects[J]. Molecular and Cellular Biochemistry, 1989, 87(1): 5-30. DOI:10.1007/BF00421079.
[4] BRODY E P. Biological activities of bovine glycomacropeptide[J]. British Journal of Nutrition, 2000, 84 (Suppl 1): 39-46.
[5] 李博智, 陈庆森. 利用TGase结合微滤技术从乳清粉中分离纯化GMP的研究[J]. 食品科学, 2009, 30(20): 97-103.
[6] 贾玉臣, 陈庆森. 生物活性肽对肠粘膜免疫调节作用的研究进展[J]. 食品科学, 2009, 30(21): 415-422. DOI:10.3321/j.issn:1002-6630.2009.21.096. [7] 贾玉臣, 陈庆森. 乳源糖巨肽对小鼠IFN-γ和IL-4的调节作用[J]. 中国乳品工业, 2010, 38(11): 11-14. DOI:10.3969/j.issn.100 1-2230.2010.11.003.
[8] 李伟, 陈庆森. 酪蛋白糖巨肽对小鼠肠道免疫系统的影响[J]. 食品科学, 2010, 31(15): 240-243.
[9] 贾玉臣, 陈庆森. 乳源酪蛋白糖巨肽改善小鼠溃疡性结肠炎的研究[J].食品科学, 2010, 31(21): 365-368.
[10] 贾玉臣, 陈庆森. 乳源酪蛋白糖巨肽对溃疡性结肠炎小鼠MUC2表达的影响[J]. 食品科学, 2011, 32(15): 230-233.
[11] 李荣华, 庞广昌, 陈庆森. 酪蛋白糖巨肽通过树突状细胞发挥免疫调节作用的初步研究[J]. 食品科学, 2011, 32(21): 233-242.
[12] 王华, 陈庆森. 乳源酪蛋白糖巨肽抗细胞凋亡干预小鼠溃疡性结肠炎效应研究[J]. 食品科学, 2012, 33(1): 230-234.
[13] 朱晨晨, 陈庆森. 乳源酪蛋白糖巨肽改善炎症性肠病的研究进展[J].食品科学, 2012, 33(1): 262-266.
[14] 王金凤, 陈庆森, 阎亚丽. 酪蛋白糖巨肽对大鼠肠黏膜屏障的保护作用[J]. 食品科学, 2013, 34(7): 254-257. DOI:10.7506/spkx1002-6630-201307053.
[15] 龚建苗, 陈庆森, 阎亚丽, 等. 生物活性肽调节NF-κB信号通路的研究进展[J]. 食品科学, 2013, 34(21): 379-388. DOI:10.7506/sp kx1002-6630-201321075.
[16] GUAN F Y, YAN L, HONG L I, et al. Effects of casein glycomacropeptide on the early development of primary colorectal cancer in rats[J]. Food Science and Human Wellness, 2013, 2(3/4): 113-118. DOI:10.1016/j.fshw.2013.09.001.
[17] 叶雷, 陈庆森, 李伟, 等. 酪蛋白糖巨肽对小鼠腹腔吞噬细胞及肠粘膜免疫细胞的影响[J]. 食品科学, 2014, 35(9): 234-240. DOI:10.7506/spkx1002-6630-201409046.
[18] 叶雷, 陈庆森, 李伟, 等. 乳源CGMP对小鼠外周血T淋巴细胞亚群的影响研究[J]. 食品科学, 2014, 35(11): 209-214. DOI:10.7506/ spkx1002-6630-201411042.
[19] 王金凤, 陈庆森. 酪蛋白糖巨肽对二甲肼干预的大鼠细胞因子网络变化的研究[J]. 食品科学, 2014, 35(13): 74-80. DOI:10.7506/ spkx1002-6630-201413037.
[20] CHEN Q S, WANG H, ZHU C C, et al. Anti-apoptotic effects of milkderived casein glycomacropeptide on mice with ulcerative colitis[J]. Food and Agricultural Immunology, 2014, 25(4): 453-466. DOI:10. 1080/09540105.2013.823912.
[21] 曹江鸣, 陈庆森. 乳源酪蛋白糖巨肽对结肠癌HT-29细胞中COX-2、iNOS、GST-π表达的影响[J]. 食品科学, 2014, 35(13): 213-217. DOI:10.7506/spkx1002-6630-201413041.
[22] GONG J M, CHEN Q S. Effect of casein glycomacropeptide on subunit p65 of nuclear transcriptionfactor-κB in lipopolysaccharidestimulated human colorectal tumor HT-29 cells[J]. Food Science and Human Wellness, 2014, 3(2): 51-55. DOI:10.1016/j.fshw.2014.04.001. [23] MING Z, JIA Y, CHEN Q S, et al. Amelioration effect of bovine casein glycomacropeptide on ulcerative colitis in mice[J]. Food and Agricultural Immunology, 2015, 26(5): 717-728. DOI:10.1080/095401 05.2015.1018874.
[24] 江岩, 陈庆森, 阎亚丽, 等. 酪蛋白糖巨肽对小鼠肠道双歧杆菌增殖水平的影响[J]. 食品科学, 2015, 36(17): 219-224. DOI:10.7506/ spkx1002-6630-201517041.
[25] 明珠, 刘雪姬, 陈庆森. 乳源酪蛋白糖巨肽对溃疡性结肠炎小鼠粪便菌群多样性的影响[J]. 食品科学, 2016, 37(5): 154-161. DOI:10.7506/spkx1002-6630-201605028.
[26] GROUX H, POWRIE F. Regulatory T cells and inf l ammatory bowel disease[J]. Immunology Today, 1999, 20(10): 442-445. DOI:10.1016/ S0167-5699(99)01510-8.
[27] REQUENA P, DADDAOUS A, GUADIX E, et al. Bovine glycomacropeptide induces cytokine production in human monocytes through the stimulation of the MAPK and the NF-κB signal transduction pathways[J]. British Journal of Pharmacology, 2009, 157(7): 1232-1240. DOI:10.1111/j.1476-5381.2009.00195.x.
[28] YAMAOKA S, COURTOIS G, BESSIA C, et al. Complementation cloning of NEMO, a component of the IκB kinase complex essential for NF-κB activation[J]. Cell, 1998, 93(7): 1231-1240. DOI:10.1016/ S0092-8674(00)81466-X.
[29] ROTHWARF D M, ZANDI E, NATOLI G, et al. IKK-γ is an essential regulatory subunit of the IκB kinase complex[J]. Nature, 1998, 395: 297-300. DOI:10.1038/26261.
[30] JANSSENS S, TINEL A, LIPPENS S, et al. PIDD mediates NF-kappaB activation in response to DNA damage[J]. Cell, 2005, 123(6): 1079-1092. DOI:10.1016/j.cell.2005.09.036.
[31] HUANG T T, ZH W D S, MIYAMOTO S. Sequential modif i cation of NEMO/IKKgamma by SUMO-1 and ubiquitin mediates NF-kappaB activation by genotoxic stress[J]. Cell, 2003, 115(5): 565-576. DOI:10.1016/S0092-8674(03)00895-X.
[32] DAVÉ S H, TILSTRA J S, MATSUOKA K, et al. Amelioration of chronic murine colitis by peptide-mediated transduction of the IkappaB kinase inhibitor NEMO binding domain peptide[J]. Journal of Immunology, 2007, 179(11): 7852-7859. DOI:10.4049/jimm unol.179.11.7852.
[33] MABB A M, MIYAMOTO S. SUMO and NF-κB ties[J]. Cellular and Molecular Life Sciences, 2007, 64(15): 1979-1996. DOI:10.1007/ s00018-007-7005-2.
[34] 石静, 卿晨. 线粒体膜电位改变与细胞凋亡[J]. 中国民族民间医药, 2011, 20(7): 20-21. DOI:10.3969/j.issn.1007-8517.2011. 07.015.
Milk-Derived Casein Glycomacropeptide (CGMP) Regulates Inf l ammation in Human Colon Carcinoma Cells HT-29
WANG Yong, GONG Jianmiao, JIA Yan, YAN Yali, PANG Guangchang, ZHAO Pei*, CHEN Qingsen*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:To further elucidate the anti-inflammatory activity of casein glycomacropeptide (CGMP) and its efficacy in enhancing recovery from intestinal inf l ammation, the effect of CGMP on the NF-κB p65 subunit in colon carcinoma cells HT-29 treated with lipopolysaccharide (LPS) and its role in regulating the NF-κB signaling pathway were determined. Furthermore, plasmids were constructed to express CGMP and NF-κB essential modulator (NEMO) and then used to co-transfect HT-29 cells. Co-immunoprecipitation was used to identify the interaction between the expressed proteins. Finally, we detected the pro-apoptotic effect of CGMP on HT-29 cells by measuring the change in mitochondrial transmembrane potential. The experimental results indicated that after 30 h transfection of HT-29 cells, the co-expression and interaction of CGMP and NEMO were conf i rmed. CGMP affected the NF-κB signaling pathway through its interaction with NEMO with a concomitant increase in apoptosis of HT-29 cells in a time-dependent manner. This effect of CGMP was maximum at 0.1 μg/mL. In conclusion, the interaction of CGMP and NEMO can indirectly affect IKK (IκB kinase) and therefore the NF-κB signaling pathway through IκB. The study revealed another way CGMP could regulate the NF-κB signaling pathway, and fully indicated that there are multiple ways CGMP could execute anti-inf l ammatory effect.
Key words:casein glycomacropeptide (CGMP); colon carcinoma cells HT-29; NF-κB signaling pathway; NF-κB essential modulator (NEMO); apoptosis
DOI:10.7506/spkx1002-6630-201715033
中图分类号:TS252
文献标志码:A
文章编号:1002-6630(2017)15-0201-07
收稿日期:2016-09-29
基金项目:国家自然科学基金面上项目(31071522);天津商业大学国家基金培育项目(160120)
作者简介:王泳(1993—),女,硕士研究生,研究方向为发酵生物技术、食源性生物活性物质与肠道健康。E-mail:15620616749@163.com
*通信作者:赵培(1978—),女,硕士,研究方向为食源性生物活性物质与肠道健康。E-mail:zhaopei@tjcu.edu.cn陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、食源性生物活性物质与肠道健康。E-mail:chqsen@tjcu.edu.cn