
图1 异牛肝菌素化学结构式
Fig. 1 Chemical structure of iso-suillin
吕 品1,范素芳2,宋 楠1,王璐琪1,孙 勇3,赵俊霞1,*,张 岩1,2,*
(1.河北医科大学基础医学院,河北 石家庄 050017;2. 河北省食品检验研究院 河北省食品安全重点实验室,河北 石家庄 050071;3.北京食品科学研究院,中国肉类食品综合研究中心,北京 100068)
摘 要:从黄乳粘盖牛肝菌(Suillus flavus)中分离得到的异牛肝菌素(iso-suillin)具有显著的抗肿瘤活性,但其在心血管系统的功效尚不明确。本研究用不同浓度的异牛肝菌素预处理原代血管平滑肌细胞(vascular smooth muscle cell,VSMC)24 h或48 h后,再采用血小板源性生长因子(platelet-derived growth factor,PDGF)-BB处理细胞,细胞计数法检测VSMC增殖活性;流式细胞术检测细胞周期分布;Western blot分析检测蛋白表达情况;免疫沉淀检测平滑肌22 alpha(smooth muscle 22 alpha,SM22α)磷酸化和泛素化水平。结果显示,异牛肝菌素显著抑制PDGF-BB引发的VSMC增殖;上调分化标志蛋白SM22α表达,下调增殖相关蛋白PCNA表达;抑制SM22α磷酸化及其泛素化降解,且该过程可能与其阻断蛋白激酶C(protein kinase C,PKC)δ的活性有关。通过以上结果推测,异牛肝菌素通过抑制PKCδ的活性,降低SM22α磷酸化水平,阻止SM22α泛素化降解,进而抑制VSMC表型转化,发挥血管保护的功能。
关键词:异牛肝菌素;血管平滑肌细胞;表型转化;平滑肌22α(SM22α)
引文格式:
吕品, 范素芳, 宋楠, 等. 异牛肝菌素通过阻断SM22α泛素化降解抑制血管平滑肌细胞表型转化[J]. 食品科学, 2017, 38(15): 208-214. DOI:10.7506/spkx1002-6630-201715034. http://www.spkx.net.cn
LÜ Pin, FAN Sufang, SONG Nan, et al. Iso-suillin inhibits VSMC phenotypic modulation via repressing ubiquitinationmediated SM22α degradation[J]. Food Science, 2017, 38(15): 208-214. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201715034. http://www.spkx.net.cn
血管平滑肌细胞(vascular smooth muscle cell,VSMC)的表型转化是高血压、动脉粥样硬化、血管成形术后再狭窄等血管重构性疾病共同的病理生理学基础。在血管损伤等因素刺激下,VSMC可从收缩(分化)表型转化为合成(去分化)表型,丧失收缩功能并获得增殖、迁移和分泌细胞外基质的能力,该过程是血管重构的根本原因和血管损伤病变复杂性的重要因素[1-3]。因此,抑制VSMC表型转化对预防血管损伤性疾病具有重要的意义。
真菌可以产生多种次生代谢产物,其中聚异戊二烯酚类化合物表现出了很高的生物活性,如抗氧化、抗肿瘤、抗感染和消炎止痛等[4-6]。本课题组于2014年从一种食药兼用的大型真菌-黄乳粘盖牛肝菌的石油醚相中纯化出一种代谢产物,相对分子质量为440.29,化学名称为3,6-二羟基-2-(2Z,6E,10E)-3,7,11,15-六甲基十六碳-2,6,10,14-四烯苯乙酯,与之前研究发现的牛肝菌素是同分异构体,命名为异牛肝菌素(iso-suillin)(图1)。经过研究发现,异牛肝菌素具有较强的抗肿瘤活性,能够有效抑制SMMC-7721、BGC、K562、A549等肿瘤细胞系的生长,与顺铂和5-氟尿嘧啶比较,异牛肝菌素表现出较强的抑瘤作用,且对正常人的淋巴细胞几乎没有毒性[7-9]。然而,异牛肝菌素在心血管系统中的作用尚不明确。

图1 异牛肝菌素化学结构式
Fig. 1 Chemical structure of iso-suillin
肌动蛋白(actin)相关蛋白平滑肌22 alpha(smooth muscle 22 alpha,SM22α),又称转凝(transgelin)蛋白,属于calponin家族,主要表达于成体平滑肌组织。虽然SM22α缺失不影响生理条件下血管组织的正常发育和功能,但病理状态下,它的功能是不可替代的。SM22α在损伤诱导的血管重塑性疾病中,如动脉粥样硬化斑块[10-11]、血管新生内膜[12-13]、血管钙化[14-15]、主动脉夹层动脉瘤[16-17]等,表达急剧下调,且下调水平与血管损伤程度呈正相关,因此,SM22α表达降低已成为VSMC去分化的一种特异性标志物[12,18-20]。本课题组前期的研究结果显示,血管紧张素(angiotensin,Ang)Ⅱ和血小板源性生长因子(platelet-derived growth factor,PDGF)-BB等刺激因素可抑制VSMC分化标志物SM22α、SM α-actin、calponin、caldesmon等表达,进而诱导VSMC表型转化[12,21-22]。各种刺激因素引起的SM22α表达降低,除了与SM22α的表达受抑有关外,其泛素化降解加快也是一个重要因素[21,23],但影响其泛素化水平的药物研究较少。本研究观察异牛肝菌素对VSMC表型转化的调节以及与SM22α泛素化降解的关联,并对其分子机制进行初步探讨,为该药物在血管重塑性疾病的防治提供实验参考。
1.1 动物、材料与试剂
雄性SD大鼠(清洁级)由河北医科大学实验动物中心提供。
异牛肝菌素由本课题组提取,经高效液相色谱法检验纯度为99.0%。
低糖DMEM培养基、胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;PDGF-BB 美国R&D公司;MG132 美国Sigma公司;兔抗SM22α抗体 英国Abcam公司;ProteinA/G-琼脂糖、小鼠抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、小鼠抗β-actin抗体、兔抗Ub抗体、小鼠抗p-Ser单克隆抗体美国Santa Cruz公司;兔抗蛋白激酶C(protein kinase C,PKC)δ抗体、兔抗磷酸化(p)-PKCδ抗体 美国Cell Signaling公司。
1.2 仪器与设备
电泳槽、电泳仪、半干快速转膜仪 美国Bio-Rad公司;凝胶成像系统 美国GE公司;流式细胞仪 美国BD公司;自动细胞计数仪 美国Life Technologies公司;CO2培养箱 美国Thermo公司。
1.3 方法
1.3.1 VSMC培养
选取80~100 g雄性SD大鼠(清洁级),用贴块法分离培养胸腹主动脉中膜VSMC,置于含体积分数10% FBS的DMEM培养基中。待细胞生长至100%汇合后,用0.25 g/100 mL胰蛋白酶溶液消化传代,取3~5 代细胞进行实验。
1.3.2 VSMC增殖活性测定
采用细胞计数法,将细胞接种于96 孔板中,每孔100 μL,待细胞生长至50%汇合时,换用含体积分数1% FBS的DMEM培养基培养24 h(对照:0 μmol/L异牛肝菌素、0 μmol/L PDGF-BB),分别用0.0(单独PDGF-BB处理为阴性对照)、1.5、3.0、6.0、12.0、24.0 μmol/L异牛肝菌素预处理细胞24 h 或48 h,然后给予PDGF-BB(20 ng/mL)刺激24 h。用细胞计数仪进行细胞计数,计算相对细胞数量。
1.3.3 流式细胞术分析
将细胞接种于细胞瓶中,待细胞生长至50%汇合时,换用含体积分数1% FBS的DMEM培养基培养24 h(对照组),用0(阴性对照组)、6、12、24 μmol/L异牛肝菌素预处理细胞24 h,然后给予PDGF-BB(20 ng/mL)刺激24 h。消化并收集细胞,生理盐水洗涤3 次,70%乙醇固定。加入50 mg/L的碘化丙啶(propidium iodide,PI)DNA荧光染色,避光孵育30 min,流式细胞仪检测细胞周期分布。
1.3.4 VSMC总蛋白提取与Western blot分析
按文献[21]常规方法收集和裂解细胞,取上清液体,用改良Lowry法进行蛋白定量。取等量的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis, SDS-PAGE),半干法将分离胶上的蛋白转移至PVDF膜上,5 g/100 mL脱脂奶粉37 ℃封闭2 h,一抗4 ℃孵育过夜,TBST洗膜后以远红外标记的荧光二抗室温封闭1 h,洗膜后Odyssey远红外荧光成像系统扫描成像。
1.3.5 免疫沉淀分析
取200 μg细胞总蛋白与相应的抗体混合,4 ℃摇动混合过夜后加入20 μL ProteinA/G-agarose,4 ℃摇动混合2~4 h后,4 ℃、12 000 r/min离心1 min,洗涤后收集Protein A/G-抗原-抗体复合物进行Western blot分析。按文献[21]常规方法,用兔抗SM22α抗体检测SM22α的磷酸化水平;用兔抗Ub抗体检测SM22α的泛素化水平。
1.4 数据统计分析
数据均采用SPSS 16.0统计软件进行处理,以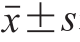 表示,多样本均数两两比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
表示,多样本均数两两比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
2.1 异牛肝菌素对VSMC表型转化的影响
如图2所示,与对照相比,PDGF-BB显著促进细胞增殖。不同浓度异牛肝菌素预处理VSMC 24 h后,与阴性对照相比,1.5 μmol/L和3.0 μmol/L异牛肝菌素对VSMC增殖无显著影响(P>0.05),而6~24 μmol/L异牛肝菌素可极显著抑制细胞增殖活性(P<0.01);不同浓度异牛肝菌素预处理VSMC 48 h后,1.5~24 μmol/L均可显著抑制细胞增殖活性(P<0.05、P<0.01、P<0.001)。上述结果表明,异牛肝菌素以时间和浓度依赖性方式抑制VSMC增殖。

图2 异牛肝菌素对VSMC增殖的影响(n=3)
Fig. 2 Effect of iso-suillin on the proliferation of VSMCs (n = 3)
**.与对照组比较差异极显著(P<0.01);***.与对照组比较差异高度显著(P<0.001)。#、##、###.与阴性对照组比较分别为差异显著(P<0.05)、极显著(P<0.01)、高度显著(P<0.001)。下同。
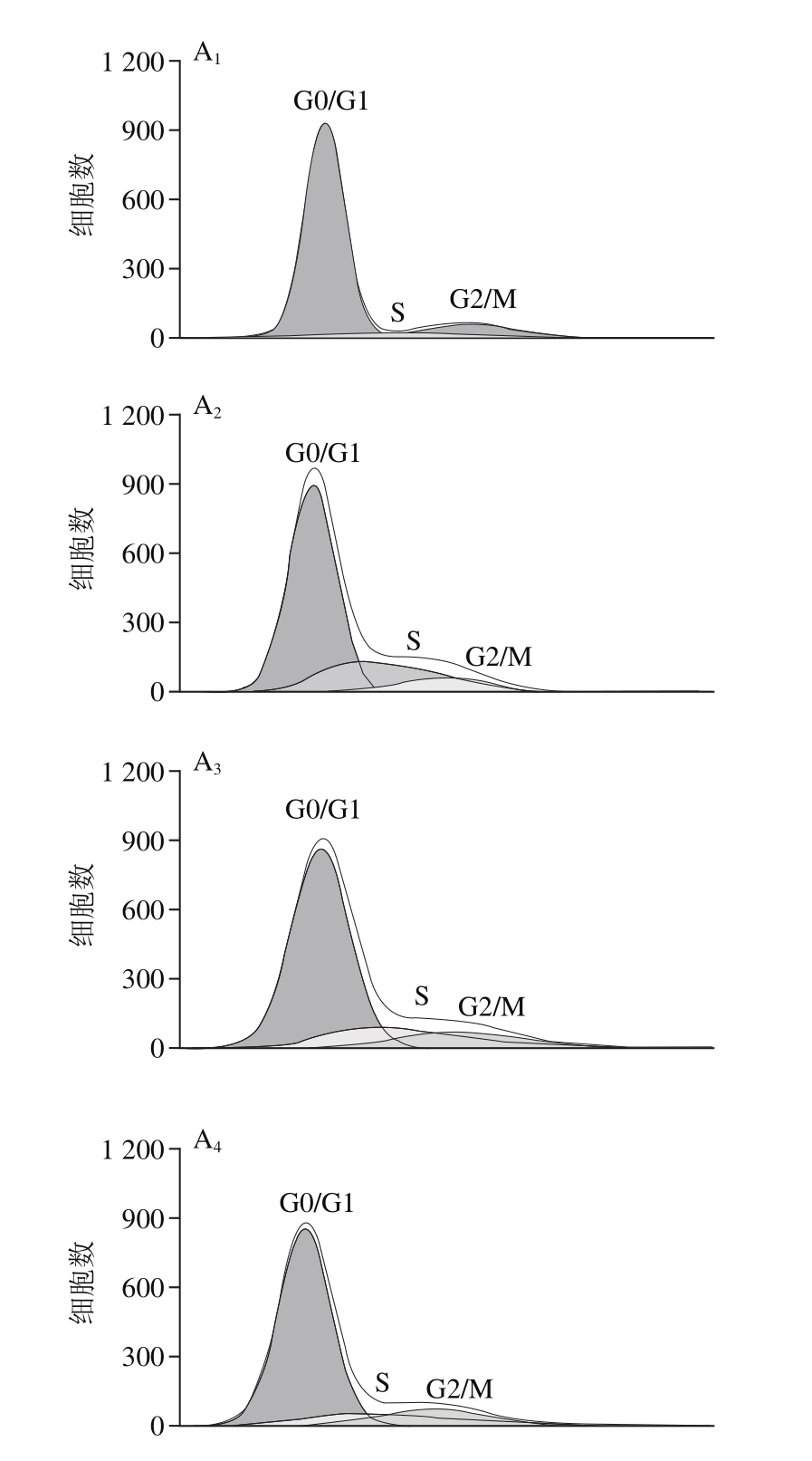
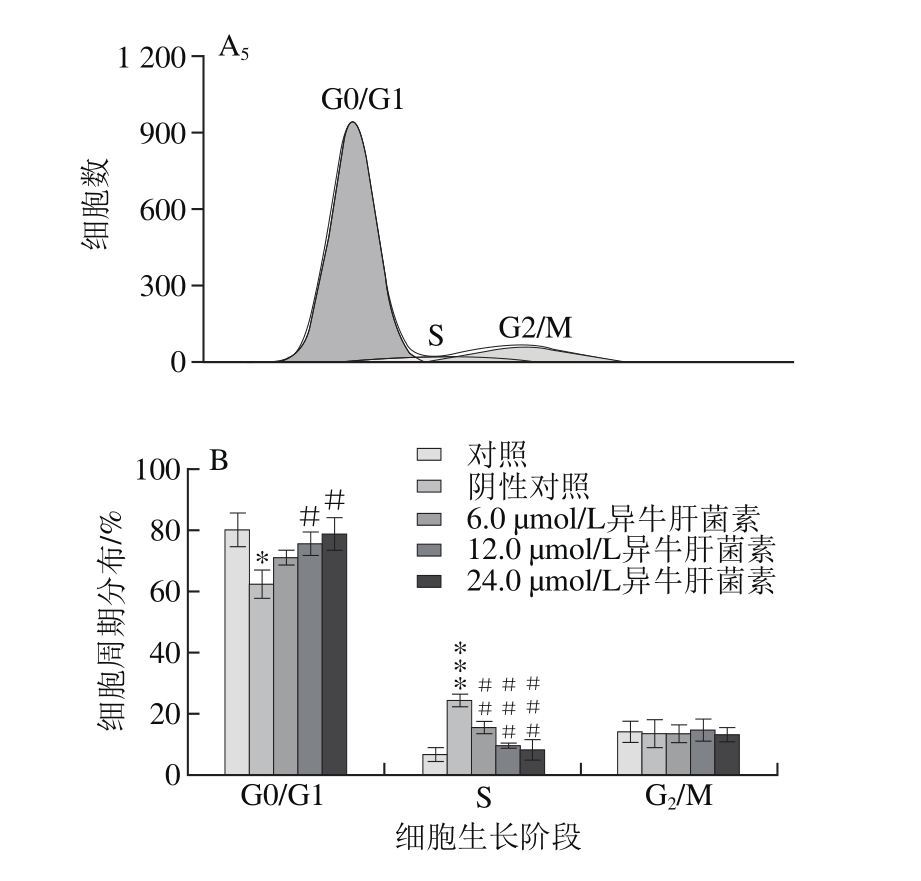
图3 流式细胞检测异牛肝菌素对VSMC细胞周期分布的影响(n=3)
Fig. 3 Effect of iso-suillin on cell cycle distribution of VSMC (n = 3)
A.流式细胞检测图;B.细胞周期分布图;下标1~5. 分别为对照、阴性对照、6.0、12.0、24.0 μmol/L异牛肝菌素预处理(经20 ng/mL PDGF-BB刺激)样品。
由图3可知,PDGF-BB处理24 h后,与对照相比,VSMC S期细胞数目增加,G0/G1期细胞数目减少;与阴性对照相比,随异牛肝菌素浓度升高,G0/G1期细胞数量逐渐增加,而S期细胞数目显著减少。该结果表明,异牛肝菌素可能通过诱导VSMC G0/G1期阻滞从而抑制细胞增殖活性。
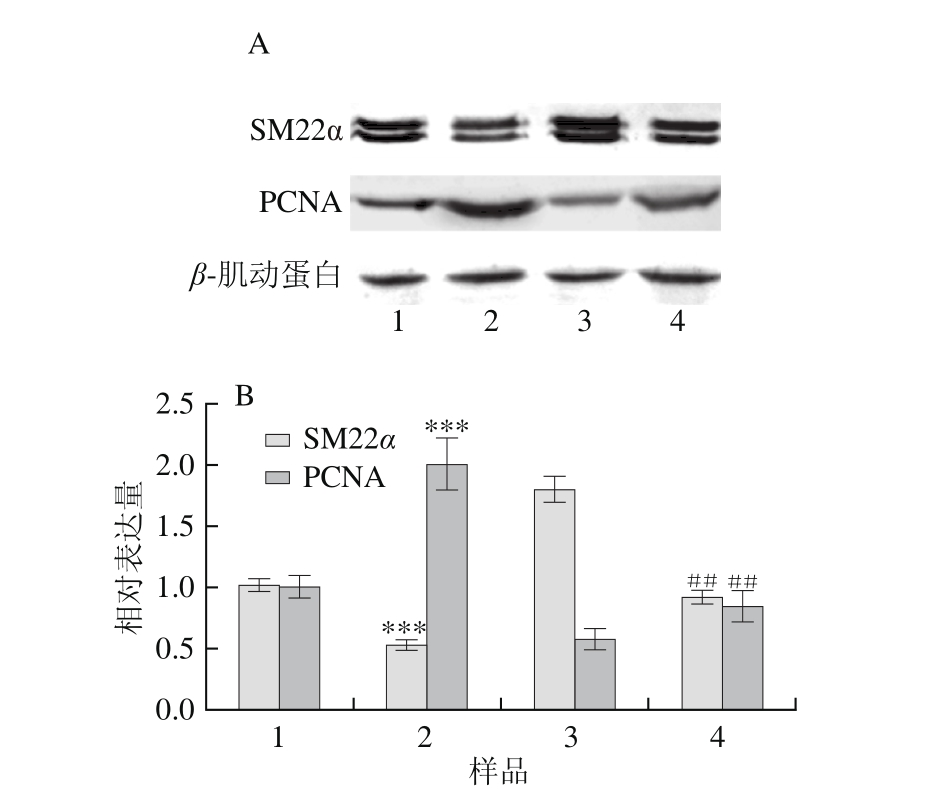
图4 Western blot检测牛肝菌素对VSMC表型转化的影响(n=3)
Fig. 4 Effect of iso-suillin on VSMC phenotypic modulation (n=3)
A. Western blot检测结果;B.蛋白相对表达量结果。1.对照;2.仅PDGF-BB处理VSMC样品;3.仅6 μmol/L异牛肝菌素预处理VSMC 24 h样品;4. 6 μmol/L异牛肝菌素预处理VSMC 24 h,PDGF-BB处理VSMC样品,图5~7同。
从细胞计数中选取了一个浓度和一个时间点进行实验(6 μmol/L异牛肝菌素预处理VSMC 24 h,PDGF-BB处理VSMC 24 h),Western blot分析结果如图4所示,PDGF-BB处理VSMC 24 h显著促进增殖相关蛋白PCNA表达,抑制分化相关蛋白SM22α表达,标志VSMC发生表型转化;而6 μmol/L异牛肝菌素预处理VSMC 24 h后,PDGF-BB引发的PCNA表达上调和SM22α表达下调明显受抑。提示,异牛肝菌素可抑制VSMC表型转化。
2.2 异牛肝菌素上调SM22α表达的作用机制
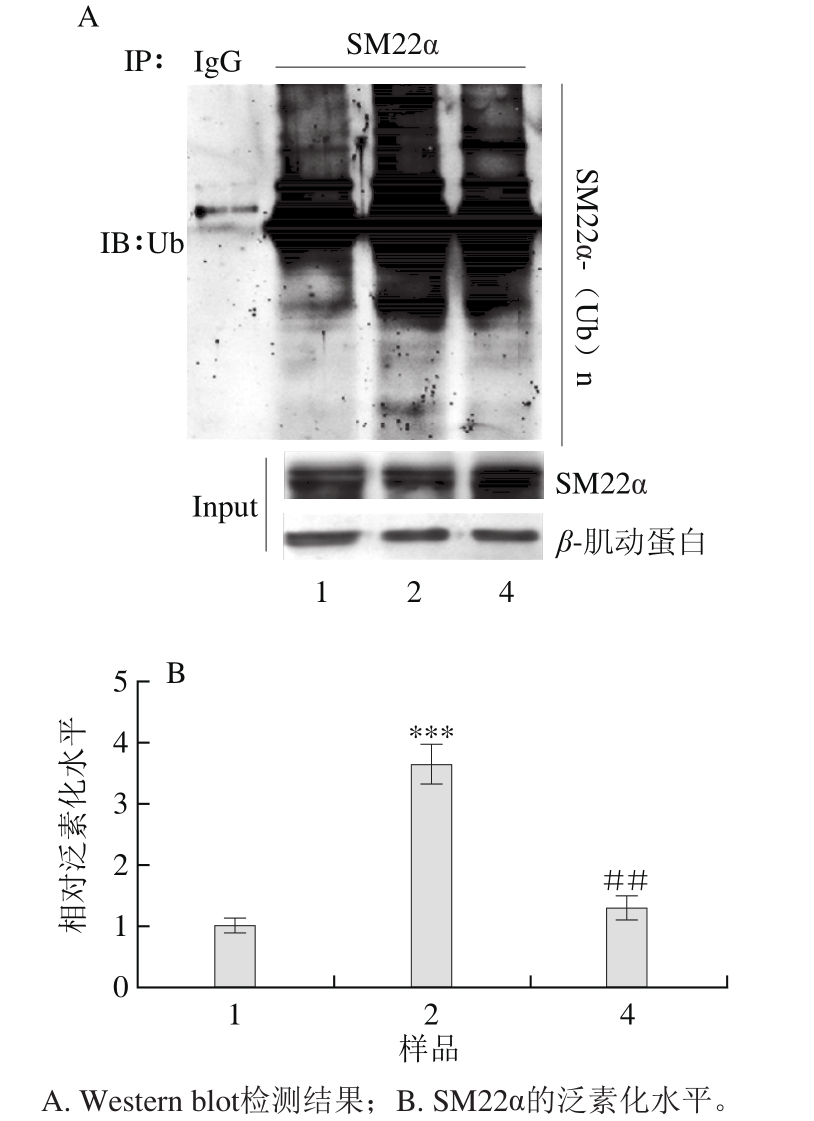
图5 异牛肝菌素对SM22α泛素化的影响(n=3)
Fig. 5 Effect of iso-suillin on ubiquitination of SM22α (n = 3)
为进一步探究异牛肝菌素上调SM22α表达的可能机制,VSMC裂解液用抗SM22α抗体进行免疫沉淀(IP)后,用抗泛素化(ubiquitination,Ub)的抗体检测泛素化SM22α水平(IB)。由图5可知,VSMC经蛋白酶体抑制剂MG132(10 μmol/L)预处理2 h后,PDGF-BB处理VSMC 4 h,SM22α泛素化水平升高,而6 μmol/L异牛肝菌素预处理VSMC 24 h后,随SM22α表达升高,PDGF-BB引发的SM22α泛素化水平显著降低。上述结果表明,SM22α泛素化降解受到抑制可能是异牛肝菌素上调SM22α表达的机制之一。
2.3 异牛肝菌素抑制SM22α泛素化降解的作用机制
为明确异牛肝菌素抑制SM22α泛素化降解的上游机制,细胞裂解液用抗p-Ser抗体进行免疫沉淀(IP),用抗SM22α的抗体检测磷酸化SM22α水平(IB)。由图6可知,PDGF-BB作用于VSMC 30 min,SM22α磷酸化水平明显升高,而6 μmol/L异牛肝菌素预处理VSMC 24 h后,PDGF-BB引发的SM22α磷酸化水平显著降低。

图6 异牛肝菌素对SM22α磷酸化的影响(n=3)
Fig. 6 Effect of iso-suillin on phosphorylation of SM22α (n = 3)
2.4 异牛肝菌素抑制SM22α磷酸化的作用机制

图7 异牛肝菌素对PKCδ磷酸化的影响(n=3)
Fig. 7 Effect of iso-suillin on phosphorylation of PKCδ (n = 3)
本课题组前期实验证实PKCδ信号通路是SM22α磷酸化所必需的[21]。由图7可知,PDGF-BB作用于VSMC 10 min,PKCδ磷酸化水平升高,而6 μmol/L异牛肝菌素预处理VSMC 24 h后,PDGF-BB诱导的PKCδ磷酸化水平明显降低。表明,异牛肝菌素可能通过阻断PKCδ活化抑制SM22α磷酸化。
VSMC表型转化是动脉粥样硬化和血管再狭窄等血管损伤性疾病发生发展的关键环节,研究和开发抗细胞增殖和迁移的药物,对动脉粥样硬化的防治具有重要意义。异戊二烯基酚类化合物(prenylphenols)是一类相对分子质量较低的有机化合物,主要从植物和真菌的代谢产物中分离提取或人工半合成。其基本结构含有聚合异戊二烯分子和苯酚,具有多种潜在的生物活性和药用价值,包括抗氧化、抗肿瘤、镇痛、减少炎症损害、降血压、降血脂、降低胆固醇含量、改善人体微循环、防止心脑血管疾病的发生、抗衰老、提高机体耐受力、增强免疫功能等效果。异牛肝菌素作为一种从黄乳粘盖牛肝菌中提取的聚异戊二烯酚类化合物,能抑制多种肿瘤细胞增殖,促进细胞凋亡[7-9],但其在脉管系统中的功能尚不明确。本研究发现,异牛肝菌素能够明显改变VSMC细胞周期分布,诱导细胞周期阻滞在G0/G1期,抑制细胞增殖活性,降低增殖相关蛋白表达,促进分化标志蛋白SM22α表达,表明异牛肝菌素可抑制VSMC表型转化,提示异牛肝菌素对于血管重塑性疾病的治疗有着巨大的潜力。
SM22α主要表达于收缩型VSMC,我们和国内外实验室大量的研究表明,当遭受损伤刺激或体外培养时,VSMC发生表型转化而快速去分化,该过程的一个重要标志就是SM22α表达急剧下调[12,24]。Feil等[10]证实,高脂饲喂的Sm22α基因敲除(Sm22α-/-型)小鼠的动脉粥样硬化斑块的面积和VSMC增殖活性都大大高于野生型小鼠,该过程可能与SM22α影响了其他类型的细胞在血管病变部位的募集和增殖有关,表明在动脉粥样硬化发生过程中SM22α可通过调节VSMC表型转化及增殖活性影响动脉粥样硬化病变的发生与发展。本课题组前期的研究证实,过表达SM22α显著抑制PDGF-BB诱导的VSMC Raf-1-MEK1/2-ERK1/2信号级联;而敲低SM22α后,该信号通路被激活。进一步研究显示,高水平的SM22α通过与Ras相互作用抑制Ras的募集和Raf-1的活化,进而阻断MAPK信号通路。体内研究显示,过表达SM22α通过阻断MAPK信号通路削弱球囊损伤诱导的颈总动脉新生内膜形成[13]。与野生型相比,Sm22α-/-型小鼠颈动脉内皮剥脱后软骨形成标志基因,包括Ⅱ型胶原、蛋白聚糖、骨桥蛋白等,表达明显升高,与VSMC分化标志基因表达下调相一致,表明SM22α缺失可通过促进VSMC向成骨细胞转化,诱发血管钙化[14-15]。Sm22α基因敲除后,颈总动脉炎性因子表达升高,并且通过促进ROS生成激活NF-κB(nuclear factor,NF)-κB信号通路,导致血管组织对炎性反应异常敏感而丧失抗炎能力,这可能与SM22α缺失导致的细胞骨架重塑有关[25];我们实验室前期的研究揭示了SM22α下调激活NF-κB的可能机制,过表达SM22α通过与NF-κB的阻遏物(inhibitor of NF-κB,IκB)形成复合物,抑制IκB的磷酸化和降解,使IκB和NF-κB紧密结合阻止NF-κB向核内转位,从而阻断NF-κB活化导致的血管炎症反应,抑制结扎诱导的新生内膜形成[11,26]。上述发现阐明了VSMC以SM22α依赖的方式保持其收缩表型的机制,揭示了SM22α调制VSMC表型转化的生物学功能。研究表明,生长因子等刺激因素不仅诱导SM22α等分化标志基因表达下调,而且还与它们的泛素化降解加快直接相关[27]。我们近年来的研究显示,AngⅡ和PDGF-BB可诱导SM22α泛素化水平升高和降解加速[21,23],但影响其泛素化水平的药物研究较少。本研究发现,异牛肝菌素可显著降低PDGF-BB诱导的SM22α泛素化水平升高,表明异牛肝菌素上调SM22α表达可能与其降低SM22α泛素化降解有关。
蛋白的翻译后修饰作为高度灵活的开关,调控着蛋白的活性、表达及其亚细胞定位。磷酸化和泛素化修饰是真核细胞蛋白质重要的翻译后修饰方式,磷酸化是调节细胞信号转导的主要机制,而泛素化在蛋白质降解中发挥重要作用,二者存在交互应答[28]。通常情况下,蛋白质泛素化修饰有赖于其磷酸化。E3泛素连接酶比较容易识别磷酸化的蛋白质,进而对磷酸化的底物进行泛素化标记,启动蛋白质经由蛋白酶体途径进行降解;另外,蛋白质的磷酸化还能直接调控各种泛素连接酶的活性,从而影响酶和底物的亲和力,改变泛素连接酶的催化能力[29-30]。因此,蛋白质磷酸化修饰是其泛素化降解的关键环节。本课题组前期的结果已证实,AngⅡ经由PKCδ-SM22α磷酸化-SM22α泛素化轴加速SM22α降解[21]。本实验发现,异牛肝菌素预处理VSMC后,随PKCδ的活性降低,PDGF-BB诱导的SM22α磷酸化水平亦明显下降。推测,异牛肝菌素可能通过阻断PKCδ信号通路,抑制SM22α磷酸化,以及由此导致的SM22α泛素化降解,进而稳定平滑肌细胞的收缩表型。
综上所述,异牛肝菌素通过削弱PKCδ活性,降低SM22α磷酸化水平,进而阻断SM22α的泛素化降解,发挥抑制VSMC表型转化的功能,证实SM22α泛素化降解介导的VSMC表型转化可能是异牛肝菌素发挥血管保护作用的重要靶点。
参考文献:
[1] GOMEZ D, OWENS G K. Smooth muscle cell phenotypic switching in atherosclerosis[J]. Cardiovascular Research, 2012, 95(2): 156-164. DOI:10.1093/cvr/cvs115.
[2] RAINES E W. PDGF and cardiovascular disease[J]. Cytokine & Growth Factor Reviews, 2004, 15(4): 237-254. DOI:10.1016/ j.cytogfr.2004.03.004.
[3] LACOLLEY P, REGNAULT V, NICOLETTI A, et al. The vascular smooth muscle cell in arterial pathology: a cell that can take on multiple roles[J]. Cardiovascular Research, 2012, 95(2): 194-204. DOI:10.1093/cvr/cvs135.
[4] LIU F Y, LUO K W, YU Z M, et al. Suillin from the mushroom Suillus placidus as potent apoptosis inducer in human hepatoma HepG2 cells[J]. Chemico-Biological Interactions, 2009, 181(2): 168-174. DOI:10.1016/j.cbi.2009.07.008.
[5] YE M, LIU J K, LU Z X, et al. Grifolin, a potential antitumor natural product from the mushroom Albatrellus conf l uens, inhibits tumor cell growth by inducing apoptosis in vitro[J]. FEBS Letters, 2005, 579(16): 3437-3443. DOI:10.1016/j.febslet.2005.05.013.
[6] QUANG D N, HASHIMOTO T, ARAKAWA Y, et al. Grifolin derivatives from Albatrellus caeruleoporus, new inhibitors of nitric oxide production in RAW 264.7 cells[J]. Bioorganic & Medicinal Chemistry, 2006, 14(1): 164-168. DOI:10.1016/j.bmc.2005.08.005.
[7] WANG Y, ZHANG Q, ZHAO J, et al. Iso-suillin from the mushroom Suillus fl avus induces cell cycle arrest and apoptosis in K562 cell line[J]. Food and Chemical Toxicology, 2014, 67: 17-25. DOI:10.1016/j.fct. 2014.02.007.
[8] ZHAO J X, ZHANG Q S, CHEN Y, et al. Iso-suillin from Suillus flavus induces apoptosis in human small cell lung cancer H446 cell line[J]. Chinese Medical Journal, 2016, 129(10): 1215-1223. DOI:10.4103/0366-6999.181961.
[9] JIA Z Q, CHEN Y, YAN Y X, et al. Iso-suillin isolated from Suillus luteus, induces G1 phase arrest and apoptosis in human hepatoma SMMC-7721 cells[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(3): 1423-1428.
[10] FEIL S, HOFMANN F, FEIL R, et al. SM22alpha modulates vascular smooth muscle cell phenotype during atherogenesis[J]. Circulation Research, 2004, 94(7): 863-865. DOI:10.1161/01. RES.0000126417.38728.F6.
[11] SHU Y N, ZHANG F, BI W, et al. SM22alpha inhibits vascular inflammation via stabilization of IkappaBalpha in vascular smooth muscle cells[J]. Journal of Molecular and Cellular Cardiology, 2015, 84: 191-199. DOI:10.1016/j.yjmcc.2015.04.020.
[12] DONG L H, LÜ P, HAN M. Roles of SM22alpha in cellular plasticity and vascular diseases[J]. Cardiovascular & Hematological Disorders Drug Targets, 2012, 12(2): 119-125.
[13] DONG L H, WEN J K, LIU G, et al. Blockade of the ras-extracellular signal-regulated kinase 1/2 pathway is involved in smooth muscle 22 alpha-mediated suppression of vascular smooth muscle cell proliferation and neointima hyperplasia[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2010, 30(4): 683-691. DOI:10.1161/ATVBAHA.109.200501.
[14] SHEN J, YANG M, JIANG H, et al. Arterial injury promotes medial chondrogenesis in Sm22 knockout mice[J]. Cardiovascular Research, 2011, 90(1): 28-37. DOI:10.1093/cvr/cvq378.
[15] KAPUSTIN A N, CHATROU M L L, DROZDOV I, et al. Vascular smooth muscle cell calcification is mediated by regulated exosome secretion[J]. Circulation Research, 2015, 116(8): 1312-1323. DOI:10.1161/Circresaha.116.305012.
[16] SUN Y, ZHAO Z, HOU L, et al. The regulatory role of smooth muscle 22 on the proliferation of aortic smooth muscle cells participates in the development of aortic dissection[J]. Journal of Vascular Surgery, 2016. DOI:10.1016/j.jvs.2016.02.063.
[17] AILAWADI G, MOEHLE C W, PEI H, et al. Smooth muscle phenotypic modulation is an early event in aortic aneurysms[J]. The Journal of Thoracic and Cardiovascular Surgery, 2009,138(6): 1392-1399. DOI:10.1016/j.jtcvs.2009.07.075.
[18] SALMON M, GOMEZ D, GREENE E, et al. Cooperative binding of KLF4, pELK-1, and HDAC2 to a G/C repressor element in the SM22alpha promoter mediates transcriptional silencing during SMC phenotypic switching in vivo[J]. Circulation Research, 2012, 111(6): 685-696. DOI:10.1161/CIRCRESAHA.112.269811.
[19] WAMHOFF B R, HOOFNAGLE M H, BURNS A, et al. A G/C element mediates repression of the SM22alpha promoter within phenotypically modulated smooth muscle cells in experimental atherosclerosis[J]. Circulation Research, 2004, 95(10): 981-988. DOI:10.1161/01.RES. 0000147961. 09840.fb.
[20] ZHAO L L, ZHANG F, CHEN P, et al. Insulin-independent GLUT4 translocation in proliferative vascular smooth muscle cells involves SM22alpha[J]. Journal of Molecular Medicine, 2017, 95(2): 181-192. DOI:10.1007/s00109-016-1468-2.
[21] LÜ P, MIAO S B, SHU Y N, et al. Phosphorylation of smooth muscle 22alpha facilitates angiotensin II-induced ROS production via activation of the PKCdelta-P47phox axis through release of PKCdelta and actin dynamics and is associated with hypertrophy and hyperplasia of vascular smooth muscle cells in vitro and in vivo[J]. Circulation Research, 2012, 111(6): 697-707. DOI:10.1161/CIRCRESAHA.112.272013.
[22] LÜ P, ZHANG F, YIN Y J, et al. SM22alpha inhibits lamellipodium formation and migration via Ras-Arp2/3 signaling in synthetic VSMCs[J]. American Journal of Physiology-Cell Physiology, 2016, 311(5): 758-767. DOI:10.1152/ajpcell.00033.2016.
[23] DONG L H, LI L, SONG Y, et al. TRAF6-mediated SM22alpha K21 ubiquitination promotes G6PD activation and NADPH production, contributing to GSH homeostasis and VSMC survival in vitro and in vivo[J]. Circulation Research, 2015, 117(8): 684-694. DOI:10.1161/ CIRCRESAHA.115.306233.
[24] 吕品, 韩梅. 血管损伤的新靶点: 平滑肌22 alpha[J]. 中国生物化学与分子生物学报, 2013, 29(4): 311-315. DOI:10.13865/j.cnki. cjbmb.2013.04.003.
[25] SHEN J, YANG M, JU D, et al. Disruption of SM22 promotes inf l ammation after artery injury via nuclear factor kappaB activation[J]. Circulation Research, 2010, 106(8): 1351-1362. DOI:10.1161/ CIRCRESAHA.109.213900.
[26] CHEN R, ZHANG F, SONG L, et al. Transcriptome prof i ling reveals that the SM22alpha-regulated molecular pathways contribute to vascular pathology[J]. Journal of Molecular and Cellular Cardiology, 2014, 72: 263-272. DOI:10.1016/j.yjmcc.2014.04.003.
[27] OWENS G K, KUMAR M S, WAMHOFF B R, et al. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiological Reviews, 2004, 84(3): 767-801. DOI:10.1152/physrev.00041.2003.
[28] YANG W L, WANG J, CHAN C H, et al. The E3 ligase TRAF6 regulates Akt ubiquitination and activation[J]. Science, 2009, 325: 1134-1138. DOI:10.1126/science.1175065.
[29] LIN H K, WANG G, CHEN Z, et al. Phosphorylation-dependent regulation of cytosolic localization and oncogenic function of Skp2 by Akt/PKB[J]. Nature Cell Biology, 2009, 11(4): 420-432. DOI:10.1038/ ncb1849.
[30] SWANEY D L, BELTRAO P, STARITA L, et al. Global analysis of phosphorylation and ubiquitylation cross-talk in protein degradation[J]. Nature Methods, 2013, 10(7): 676-682. DOI:10.1038/nmeth.2519.
Iso-Suillin Inhibits VSMC Phenotypic Modulation via Repressing Ubiquitination-Mediated SM22α Degradation
LÜ Pin1, FAN Sufang2, SONG Nan1, WANG Luqi1, SUN Yong3, ZHAO Junxia1,*, ZHANG Yan1,2,* (1. College of Basic Medicine, Hebei Medical University, Shijiazhuang 050017, China;
2. Hebei Food Safety Key Laboratory, Hebei Food Inspection and Research Institute, Shijiazhuang 050071, China; 3. China Meat Research Center, Beijing Academy of Food Sciences, Beijing 100068, China)
Abstract:Iso-suillin, a phenolic compound isolated from Suillus flavus, has significant anti-tumor activity. However, the role of iso-suillin in cardiovascular system remains unclear. Herein, primary vascular smooth muscle cells (VSMCs) were pretreated with iso-suillin for 24 or 48 h, and then stimulated by platelet-derived growth factor (PDGF)-BB. The cell proliferation was evaluated by cell counting. VSMC cell cycle distribution was analyzed by flow cytometry. In addition, Western blot was used to examine protein expression, and immuneprecipitation analysis was used to identify the phosphorylation and ubiquitination of smooth muscle 22 alpha (SM22α). The results showed that iso-suillin inhibited PDGF-BB-induced VSMC proliferation. Iso-suillin increased the expression of SM22α (a marker of cell differentiation), and reduced the level of PCNA. Furthermore, iso-suillin decreased the levels of phosphorylated and ubiquitinated SM22α upon PDGF-BB treatment, which may be associated with iso-suillin-decreased protein kinase C (PKC) δ activity. Collectively, these data demonstrated that iso-suillin prevented VSMC phenotype transformation through decreasing PKCδ-mediated SM22α degradation via the ubiquitin-proteasome pathway in VSMCs.
Key words:iso-suillin; vascular smooth muscle cells; phenotypic modulation; smooth muscle 22α (SM22α)
DOI:10.7506/spkx1002-6630-201715034
中图分类号:R285
文献标志码:A
文章编号:1002-6630(2017)15-0208-07
收稿日期:2017-04-08
基金项目:“十三五”国家重点研发计划重点专项(2016YFF0202300);科技部质检行业公益专项(201510208-08);国家自然科学基金青年科学基金项目(81300225);河北省自然科学基金资助项目(H2015206467);河北省高等学校优秀青年基金项目(YQ2013018)
作者简介:吕品(1979—),女,副教授,博士,研究方向为血管重塑性疾病的发病机制。E-mail:lvpinzy@163.com
*通信作者:赵俊霞(1966—),女,教授,博士,研究方向为天然药物活性物质与功能。E-mail:zhaojunxia@hebmu.edu.cn张岩(1979—),男,正高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com