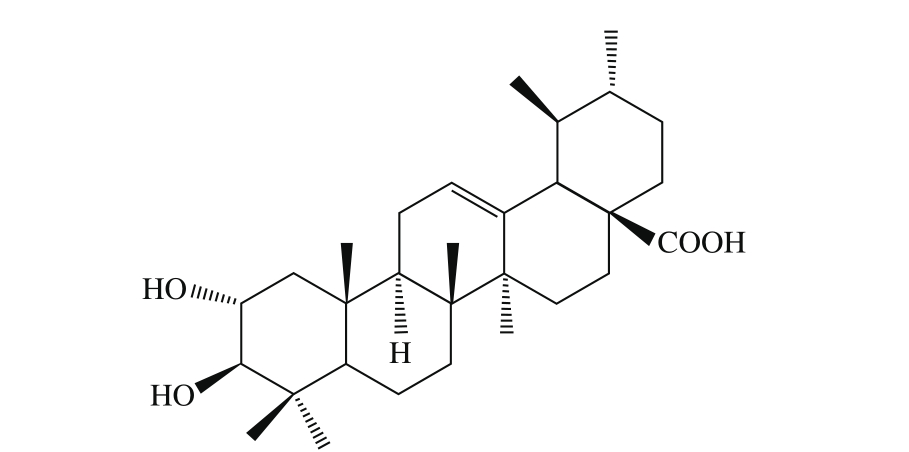
图1 科罗索酸结构图
Fig. 1 Structure of corosolic acid
李 锋1,2,李义嘉2,李清仙2,郭养浩2,石贤爱2,*
(1.福州大学化学学院,福建 福州 350116;2.福州大学生物科学与工程学院,福建 福州 350116)
摘 要:从枇杷叶中提取分离制备科罗索酸,采用体外Cu2+诱导低密度脂蛋白(low density lipoprotein,LDL)氧化损伤的体外化学反应模型及2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis-2-methyl-propanimidamide dihydrochloride,AAPH)诱导人主动脉内皮细胞(human aortic endothelial cells,HAECs)氧化损伤的细胞模型,考察枇杷叶科罗索酸对LDL氧化过程的抑制作用及对动脉血管内皮细胞氧化损伤的保护作用。体外实验结果表明,枇杷叶科罗索酸在体外10~100 μmol/L剂量范围内能有效延长LDL氧化过程中的迟滞期,降低反应动力学曲线的曲线下面积以及降低脂质过氧化物的生成,表明科罗索酸在体外能有效抑制Cu2+诱导的LDL氧化。细胞实验结果表明,在2~10 μmol/L剂量范围内能有效降低AAPH所致HAECs的乳酸盐脱氢酶漏出量,维护细胞结构的完整性;提高受损细胞的超氧化物歧化酶、谷胱甘肽过氧化物酶活性,从而提升内皮细胞抵抗氧化应激的能力;降低细胞处于sub-G1/G0状态的比例,减少AAPH所致细胞的坏死或凋亡。表明枇杷叶科罗索酸能在细胞水平有效保护HAECs免受AAPH氧化应激损伤。
关键词:枇杷叶;科罗索酸;低密度脂蛋白;血管内皮细胞;脂质过氧化
枇杷叶(Folium Eriobotryae)作为一种传统药材,在我国民间使用历史悠久,收载于典籍[1-2]。目前枇杷叶作为一种常见中药,在临床仍然广泛使用,主要用于止咳平喘。研究表明枇杷叶中含有挥发油、三萜类、黄酮类、倍半萜类、氨基酸、糖类、酚苷类及其他有机酸类等化学成分[3-4],其中三萜酸含量最高,是其最主要的生物活性贡献成分[5]。枇杷中最为典型的几种三萜酸为熊果酸(ursolic acid)、齐墩果酸(oleanic acid)、科罗索酸(corosolic acid)、山楂酸(maslinic acid)、蔷薇酸(euscaphic acid)和委陵菜酸(tormentic acid)等[5-8],其中熊果酸和科罗索酸的含量较高,其他几种含量较少。科罗索酸作为熊果酸衍生物,又名2α-羟基熊果酸,属于熊果烷型五环三萜酸(图1)。近年来,科罗索酸的生物活性得到了深入的研究,研究表明具有抗氧化[9-11]、抗肿瘤[12-14]、降血糖[15-18]、抑制肥胖[19-21]以及抗炎[10,19,22]等药理活性,引起了人们的广泛的重视。

图1 科罗索酸结构图
Fig. 1 Structure of corosolic acid
低密度脂蛋白(low density lipoprotein,LDL)是主要的血胆固醇运载工具,主要负责从肝向外周输送胆固醇。LDL在体内易经活性氧(reactive oxygen species,ROS)自由基氧化损伤作用而转变为氧化型低密度脂蛋白(oxidative low density lipoprotein,ox-LDL),而ox-LDL是致动脉粥样硬化(atherosclerosis,AS)危险因素,故LDL的氧化损伤在AS的形成和发展中扮演着重要角色[23-24]。目前对科罗索酸抑制LDL氧化及AS形成的研究报道较少,本实验拟采用体外Cu2+诱导人源LDL氧化损伤模型及2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis-2-methyl-propanimidamide, dihydrochloride,AAPH)诱导人动脉内皮细胞(human aortic endothelial cells,HAECs)氧化损伤细胞模型,考察枇杷叶科罗索酸对LDL氧化过程的抑制作用及对动脉血管内皮细胞氧化损伤的保护作用。
1.1 材料与试剂
枇杷叶药材 福州市中药饮片厂。
HAECs细胞株 鼎国生物技术公司;人LDL 上海经科化学科技公司;细胞培养相关试剂(血清、培养基、抗生素及胰酶等) 美国HyClone公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,7-二氯二氢荧光素二乙酸酯(2’,7’-dichlorod ihydrofluorescein diacetate,DCFH-DA) 阿拉丁试剂有限公司;四乙氧基丙烷(1,1,3,3-tetraethoxypropane,TEP)、硫代巴比妥酸(2-thiobarbituric acid,TBA)、2,6-二叔丁基对甲酚(2,6-di-tert-butyl-4-methylphenol,BHT) 上海源叶生物科技公司;碘化丙啶(propidium iodide,PI)单染试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)测定试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
COULTER EPICS XL型流式细胞仪 美国Beckman公司;二氧化碳培养箱 美国Thermo公司;倒置显微镜重庆光电仪器公司;50i型荧光显微镜 日本Nikon公司;SpectraMax i3x型荧光酶标仪、U410型超低温冰箱 美国NBS公司;Z 323K型冷冻离心机 德国Hermle公司。
1.3 方法
1.3.1 枇杷叶科罗索酸的制备
枇杷叶烘干粉碎,按料液比1∶10(m/V)用90%乙醇于45 ℃提取3 次,每次2 h。过滤合并提取液,碱性条件下用活性碳吸附过滤去除叶绿素等非极性色素。脱色液减压浓缩至浸膏,浸膏用少量乙酸乙酯溶解,上硅胶柱,采用乙酸乙酯/甲醇洗脱体系,收集富含科罗索酸组分。此组分再经C18半制备高效液相色谱(high performance liquid chromatography,HPLC)进一步分离纯化,得到较纯的枇杷叶科罗索酸样品,经HPLC测定纯度。
1.3.2 LDL的制备
为了避免商品LDL中的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)对后续实验造成干扰,需通过透析法去除。采用磷酸盐缓冲液(10 mmol/L、pH 7.4)4 ℃透析24 h,每隔6 h更换一次透析液。二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,过滤除菌,4 ℃保存备用。
1.3.3 Cu2+诱导LDL氧化
LDL氧化反应体系为:LDL终质量浓度100 μg pro/mL,CuSO4终浓度10 μmol/L,混合均匀,于37 ℃避光反应,结束时加入等体积含1 mmol/L EDTA和1 mmol/L BHT的混合液终止氧化反应[25]。本实验中,反应体系中加入不同浓度(10、20、50、100 μmol/L)的枇杷叶科罗索酸考察对LDL氧化过程的抑制效果;体系中不加CuSO4和科罗索酸作为空白对照组,只加CuSO4作为模型诱导组。反应进行中实时测定共轭二烯键的形成情况。反应结束后,测定共轭二烯键的生产,取样采用硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)法分析LDL氧化物水平。
1.3.4 共轭二烯键的测定
共轭二烯键是LDL氧化的早期产物,采用Xu等[26]方法稍作改动。1 mL LDL溶液(100 μg/mL)与不同浓度枇杷叶科罗索酸样品混合,对照组同样条件但不加科罗索酸。体系中加入CuSO4使终浓度为10 μmol/L的启动氧化反应,分光光度计每10 min测定234 nm波长处吸光度(A),持续4 h,记录共轭二烯键的生产动力学曲线,并计算0~4 h的曲线下面积(area under the curve,AUC0~4h)。
1.3.5 TBARS分析
采用分析TBARS方法测定LDL氧化物[27]。1 mL的LDL溶液(100 mg/mL)与终浓度为10 μmol/L的CuSO4混合均匀,在加入或不加入(对照组)20 μL的不同浓度(10、20、50、100 μmol/L)枇杷叶科罗索酸样品的情况下进行氧化,37 ℃避光反应4 h。反应体系加入EDTA(终浓度1 mmol/L)终止氧化,分别加入1 mL 20%乙酸和1 mL 0.67% TBA溶液,混合均匀,加热至95 ℃反应30 min,冷却至室温。1 500 r/min离心10 min去除沉淀,取上清液测定532 nm波长处吸光度。10 μmol/L四乙氧基丙烷(1,1,3,3-tetraethoxypropane,TEP)作为标准品,与测定样品同样处理。按式(1)计算各组的TBARS值。
1.3.6 细胞培养及处理
HAECs用DMEM培养基(含15% FBS、20 U/mL bFGF、100 U/mL链霉素、100 U/mL青霉素),置于5% CO2、37 ℃培养箱中培养,每48 h换液一次。取对数生长期的细胞用0.25%胰酶消化,制备细胞悬液,密度调整至1×105个/mL,每孔100 μL接种于12 孔板,继续培养24 h,随后转换无血清培养基培养4 h。随机将培养孔分成3 组:空白对照组:不加任何药物;模型刺激组:用含2 mmol/L AAPH无血清培养基氧化刺激;药物组:分别用含1、2、5、10 μmol/L科罗索酸和2 mmol/L AAPH无血清培养基处理。每组设3 个复孔,用0.25%胰酶消耗制备细胞悬液用于后续实验。
1.3.7 MTT法分析细胞存活率
培养板吸去培养基,加入含5 mg/mL MTT的无血清无酚红培养基,于37 ℃、5% CO2条件继续培养4 h,吸取MTT溶液,加入DMSO溶解所形成的甲簪晶体,570 nm波长处测定吸光度(A)。按式(2)计算细胞存活率。
1.3.8 细胞ROS水平、LDH漏出量及SOD、GPx活性的测定
细胞ROS含量测定:采用黑壁底透96 孔板培养细胞,药物处理方法同1.3.6节。弃上清液,磷酸盐缓冲液(phosphate buffer,PBS)清洗,每孔加入100 μL 10 μmol/L的DCFH-DA荧光染液,37 ℃避光染色30 min。PBS清洗2次,用SpectraMax i3x型荧光酶标仪测定荧光强度,其激发光波长为480 nm,发射光波长为520 nm;以最高组荧光强度为100%,计算其他各组的相对荧光强度。LDH漏出量测定:取细胞培养上清液,按照LDH试剂盒说明书操作,测定LDH活性,表示为U/mL。SOD、GPx活性测定:收集6 孔培养板中细胞,冰浴超声波破碎,收集蛋白,BCA法测定蛋白浓度,样品采用SOD和GPx试剂盒测定酶活力。
1.3.9 PI染色流式细胞术检测细胞周期分布
将处于对数生长期的细胞接种于6 孔培养板中,接种密度为每孔5×105个细胞,组别设置及药物处理同1.3.6节,培养24 h。吸除培养基,胰蛋白酶消化贴壁细胞,收集106个细胞,PBS洗涤1 次,3 000 r/min离心2 min,弃上清液。按照PI单染试剂盒说明书操作制备染色悬浮细胞,用于FCM分析。200 目尼龙网过滤,流式细胞仪检测。激发波长488 nm,检查收集104个细胞。
1.4 数据处理
采用Origin软件进行单因素方差分析,P<0.05表明差异有显著性,P<0.01表明差异极显著。结果用 ±s表示。
±s表示。
2.1 枇杷叶科罗索酸的制备
枇杷叶含有多种五环三萜酸,其中科罗索酸的含量仅次于熊果酸,可达原料干质量的0.8%,但由于和山楂酸互为同分异构体,往往采用常规分离手段很难制备高纯度样品。本实验采用常压柱层析结合半制备HPLC方法,得到了较高纯度的枇杷叶科罗索酸样品,经HPLC分析其纯度为93.4%(图2)。
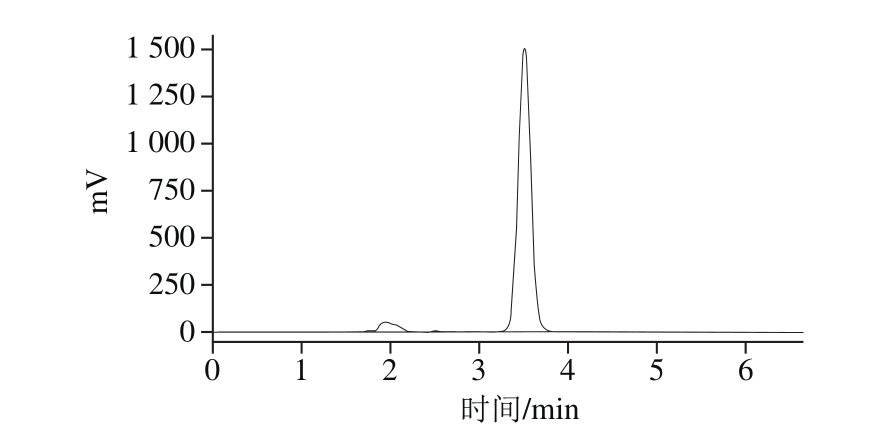
图2 枇杷叶科罗索酸HPLC图谱
Fig. 2 HPLC prof i le of corosolic acid from Folium Eriobotryae
2.2 枇杷叶科罗索酸对Cu2+诱导LDL氧化的体外抑制作用
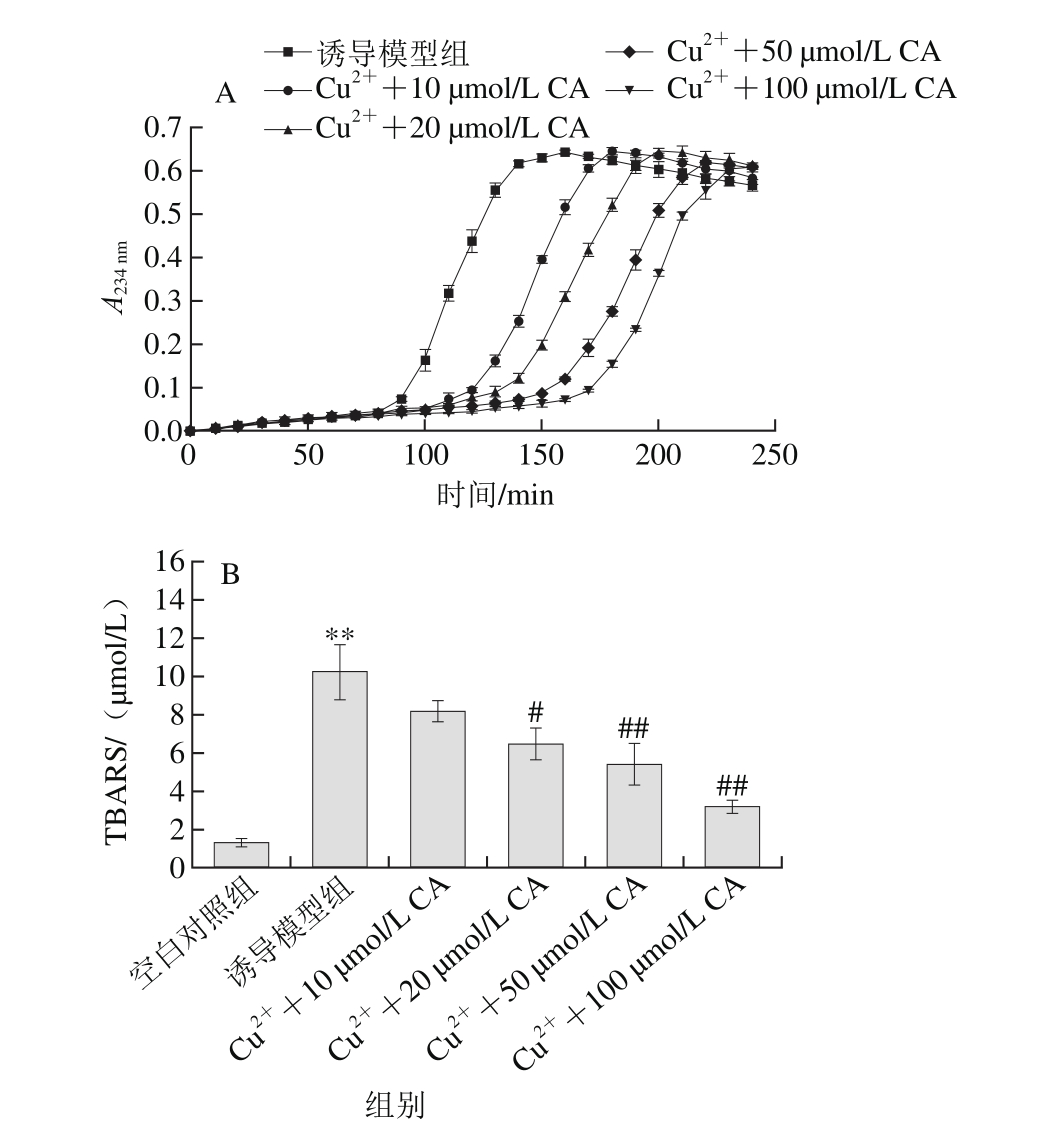
图3 枇杷叶科罗索酸对Cu2+诱导LDL氧化的抑制作用
Fig. 3 Inhibitory effect of corosolic acid on LDL oxidation induced by Cu2+ in vitro
A.科罗索酸抑制Cu2+诱导LDL氧化过程动力学曲线;B.科罗索酸抑制Cu2+诱导LDL氧化的脂质过氧化物水平。**.与空白对照组相比差异极显著(P<0.01);#.与诱导模型组相比差异显著(P<0.05);##.与诱导模型组相比差异极显著(P<0.01)。CA.科罗索酸。
共轭二烯键的形成是反映LDL早期氧化阶段的标志,而TBARS法分析的是晚期氧化阶段的产物,因此本研究分别测定了这两项指标。如图3A所示,Cu2+诱导LDL氧化的动力学曲线可明显分为三阶段:延滞期、快速反应期和减速期。Cu2+氧化LDL模型诱导组的延滞期平均为89.3 min,经枇杷叶科罗索酸处理可显著延长延滞期时间,呈剂量依赖性(表1),10 μmol/L处理延长到117.5 min(P<0.05),而100 μmol/L水平时迟滞期进一步延长(P<0.01);同时科罗索酸也能有效降低Cu2+氧化LDL动力学曲线的AUC(表1),50 μmol/L和100 μmol/L水平时,从诱导模型组的81.0分别降低到42.38和33.89(P<0.01),而在10 μmol/L和20 μmol/L水平时,AUC降低也具有显著性(P<0.05)。图3B表明,科罗索酸能显著降低Cu2+氧化LDL过程中脂质过氧化物的水平,呈剂量依赖性。经过Cu2+氧化诱导后,LDL反应体系中TBARS值显著增加到约10.3 μmol/L水平,而20 μmol/L科罗索酸能将TBARS值降低到约6.5 μmol/L(P<0.05),100 μmol/L能更进一步降低到3.1 μmol/L水平(P<0.01)。
表1 Cu2+诱导氧化LDL动力学曲线延滞期时间及AUC0-4h比较
Table 1 Lag time and AUC0‒4hof kinetic curve of LDL oxidation induced by Cu2+

注:#.与诱导模型组相比差异显著(P<0.05);##.与诱导模型组相比差异极显著(P<0.01)。
2.3 枇杷叶科罗索酸对细胞活性的影响及对AAPH氧化损伤细胞的保护作用

图4 枇杷叶科罗索酸对正常HAECs的影响(A)及对AAPH所致损伤细胞的保护作用(B)
Fig. 4 Corosolic acid effects on normal HAECs (A) and its protective effects on AAPH-induced cell damage (B)
已有研究表明科罗索酸具有一定的抗肿瘤作用,有明显的细胞毒性作用,本研究在药物本身不对HAECs产生损伤的前提条件下,考察其对细胞氧化损伤的保护作用,故需要先确定药物的安全剂量。图4A表明,随着剂量的增加,科罗索酸会显著抑制HAECs的活性。在50 μmol/L及以上浓度时,相对细胞存活率低于40%,抑制作用明显;而在10 μmol/L及以下浓度时,相对细胞存活率接近100%,无明显的抑制。故本实验所设定的科罗索酸的细胞安全剂量上限为10 μmol/L,确定了1、2、5、10 μmol/L 4 个浓度梯度,在此剂量下考察药物对细胞的保护作用。图4B表明,与模型刺激组相比,科罗索酸在1 μmol/L剂量下对细胞活性无显著提高,而在2、5和10 μmol/L剂量下能显著提高细胞的活性(P<0.05,P<0.01),说明枇杷叶科罗索酸在一定的剂量范围能有效保护HAECs内皮细胞免受AAPH的氧化损伤作用。
2.4 枇杷叶科罗索酸对AAPH氧化细胞的LDH漏出量、ROS水平及SOD、GPx活性影响
表2 枇杷叶科罗索酸对细胞LDH漏出量、ROS、SOD和GPx水平的影响
Table 2 Effects of CA on LDH, ROS, SOD and GPx level in cells suffering from AAPH-induced damage

注:**.与空白对照组相比差异极显著(P<0.01);#.与模型刺激组相比差异显著(P<0.05);##.与模型刺激组相比差异极显著(P<0.01)。下同。
通过分析培养基中LDH活性来测定细胞LDH的漏出量,从而间接反映出细胞膜所受氧化损伤程度,结果如表2所示。与空白对照组细胞相比,模型刺激组的LDH活性显著增加,漏出量剧增到85.37 U/L,说明细胞膜受损伤严重,而枇杷叶科罗索酸能有效保护细胞膜而降低细胞LDH的漏出量,呈剂量依赖性。细胞ROS水平反映了细胞氧化应激的程度,科罗索酸也能显著抑制AAPH所致细胞的ROS水平的增加,在2 μmol/L剂量时ROS水平降至87.6%,随着剂量增加,能进一步降低至62.3%,表明科罗索酸能有效减轻损伤细胞的胞内氧化应激水平。SOD和GPx是机体重要的抗氧化酶,反映了细胞的抗氧化应激状态,结果表明枇杷叶科罗索酸同样能提高AAPH所致损伤细胞的SOD、GPx活性,提升细胞的抵抗氧化应激能力。
2.5 枇杷叶科罗索酸对AAPH所致损伤细胞周期分布的影响
表3 枇杷叶科罗索酸对AAPH所致损伤细胞周期的影响(n=3)
Table 3 Effect of corosolic acid on cell cycle (n=3)

PI为着色于核酸的荧光染料,无法通过完整的细胞膜,可以用来反映细胞的受损伤的程度。当细胞坏死或者处于凋亡晚期时,膜通透性变大,PI染料就可以进入膜内与DNA结合将核染成红色。细胞各个时期DNA含量不同结合荧光染料的量也不同,对于正常细胞,具有完整细胞膜会阻挡PI进入细胞内部,细胞核不着色。
从表3可以看出,AAPH氧化诱导的细胞,sub-G0/G1所占比例平均为85.4%,远高于空白对照细胞的平均值0.9%(P<0.01),说明细胞受损严重,几乎都处于凋亡或坏死状态;而经过枇杷叶科罗索酸的处理,能明显降低sub-G0/G1细胞的比例,1 μmol/L的科罗索酸平均可降低至67.2%,而10 μmol/L时能平均降低至16.8%,说明科罗索酸抑制AAPH所致细胞损伤作用明显,有效地保护了细胞结构的完整性。
机体ROS所致的LDL氧化损伤过程是致血管内皮细胞损伤的关键因素之一[28],其产物ox-LDL能促进内皮细胞及单核细胞分泌黏附分子,易于形成泡沫细胞[29]。LDL在体外易受过渡态金属离子的诱导作用而被氧化,故本实验采用体外Cu2+诱导LDL氧化来模拟体内的氧化过程。AAPH是常见的水溶性自由基诱导剂,能在生理条件下分解产生的自由基,从而对细胞产生氧化损伤,且产生自由基的速度可控,因而被认为是研究体内抗氧化的理想模型[30]。故本实验采用体外Cu2+诱导人源LDL氧化损伤模型及AAPH诱导人动脉内皮细胞HAECs氧化损伤细胞模型,考察枇杷叶科罗索酸对LDL氧化过程的抑制作用及对动脉血管内皮细胞氧化损伤的保护作用。科罗索酸作为一种熊果烷型三萜酸,具有抗氧化及清除自由基的作用[31]。本实验结果也表明,枇杷叶科罗索酸在体外较低的剂量条件下(10~100 μmol/L)即能有效延长LDL氧化过程中的迟滞期时间,降低反应动力学曲线的AUC以及TBARS值,表明枇杷叶科罗索酸在体外能有效抑制Cu2+诱导的LDL氧化。
细胞正常条件下处于一种氧化/抗氧化平衡状态,当受外界氧化因子过度刺激时,会打破这种均衡状态,导致氧化应激增强,抗氧化系统严重受损。SOD、GPx是机体重要的抗氧化酶,对维持细胞氧化还原平衡具有重要作用。LDH是较为稳定的蛋白质,存在于绝大多数正常细胞的胞质中,不能分泌到胞外,而一旦细胞膜受损,LDH即被释放到细胞外;通过检测细胞培养液中的LDH活性(即LDH的漏出量),可判断细胞受损的程度[32]。本研究结果表明,在一定的剂量范围内(2~10 μmol/L),枇杷叶科罗索酸能有效降低AAPH所致HAECs细胞的LDH漏出量,维护细胞膜的完整性;增加受损细胞的SOD、GPx活性,从而提升内皮细胞的抵抗氧化应激的能力;降低处于sub-G0/G1状态的比例,减少AAPH所致细胞的坏死或凋亡。
综上所述,枇杷叶科罗索酸在体外能有效抑制Cu2+诱导的人LDL氧化;保护HAECs免受AAPH所致的自由基氧化损伤,维护细胞结构的完整性。其机制有可能是通过增加细胞中诸如SOD、GPx等抗氧化酶而实现,具体的分子机理还需进一步深入研究。本研究表明,枇杷叶科罗索酸有望应用于抗动脉粥样硬化领域,为枇杷叶的有效利用提供科学依据。
参考文献:
[1] 林玉霖, 林文津, 林力强. 枇杷叶的研究现状与开发前景[J]. 中药材, 2006, 29(10): 1111-1114. DOI:10.13863/j.issn1001-4454.2006.10.045.
[2] 曾美怡, 楼之岑, 周梦白. 国产枇杷叶的生药学研究[J]. 药学学报, 1955, 3(2): 189-194. DOI:10.16438/j.0513-4870.1955.02.004.
[3] 陈剑, 李维林, 吴菊兰, 等. 枇杷叶的化学成分研究(Ⅰ)[J]. 中草药, 2006, 37(11): 1632-1634. DOI:10.3321/j.issn:0253 -2670.2006.11.012.
[4] 吕寒, 于盱, 陈剑, 等. 枇杷叶黄酮类化学成分研究[J]. 中成药, 2014, 36(2): 329-332. DOI:10.3969/j.issn.1001-1528.2014.02.025.
[5] 陈欢, 陈光, 任红梅, 等. 枇杷叶中三萜类成分的研究[J]. 北京化工大学学报(自然科学版), 2012, 39(3): 40-45. DOI:10.3969/ j.issn.1671-4628.2012.03.008.
[6] 吕寒, 陈剑, 李维林, 等. 枇杷叶中三萜类化学成分的研究[J]. 中药材, 2008, 31(9): 1351-1354. DOI:10.3321/j.issn:1001-4454.2008.09.020.
[7] 陈龙胜, 忻旸, 许舒雯. RP-HPLC同时测定枇杷叶中4 种三萜酸[J].中草药, 2008, 39(9): 1411-1413.
[8] 吕寒, 习超鹏, 陈剑, 等. 不同生长季节枇杷叶中三萜酸成分的含量变化[J]. 中国中药杂志, 2009, 34(18): 2353-2355.
[9] ALADEDUNYE F A, OKORIE D A, IGHODARO O M. Antiinflammatory and antioxidant activities and constituents of Platostoma africanum P. Beauv.[J]. Natural Product Research, 2008, 22(12): 1067-1073. DOI:10.1080/14786410802264004.
[10] YAMAGUCHI Y, YAMADA K, YOSHIKAWA N, et al. Corosolic acid prevents oxidative stress, inf l ammation and hypertension in SHR/ NDmcr-cp rats, a model of metabolic syndrome[J]. Life Sciences, 2006, 79(26): 2474-2479. DOI:10.1016/j.lfs.2006.08.007.
[11] MIURA T, TAKAGI S, ISHIDA T. Management of diabetes and its complications with banaba (Lagerstroemia speciosa L.) and corosolic acid[J]. Evidence-based Complementary and Alternative Medicine: ECAM, 2012, 2012(2012): 871495. DOI:10.1155/2012/871495.
[12] FUJIWARA Y, TAKAISHI K, NAKAO J, et al. Corosolic acid enhances the antitumor effects of chemotherapy on epithelial ovarian cancer by inhibiting signal transducer and activator of transcription 3 signaling[J]. Oncology Letters, 2013, 6(6): 1619-1623. DOI:10.3892/ ol.2013.1591.
[13] LEE M S, CHA E Y, THUONG P T, et al. Down-regulation of human epidermal growth factor receptor 2/neu oncogene by corosolic acid induces cell cycle arrest and apoptosis in NCI-N87 human gastric cancer cells[J]. Biological and Pharmaceutical Bulletin, 2010, 33(6): 931-937. DOI:10.1248/bpb.33.931.
[14] FUJIWARA Y, KOMOHARA Y, IKEDA T, et al. Corosolic acid inhibits glioblastoma cell proliferation by suppressing the activation of signal transducer and activator of transcription-3 and nuclear factor-kappa B in tumor cells and tumor-associated macrophages[J]. Cancer Science, 2011, 102(1): 206-211. DOI:10.1111/j.1349-7006.2010.01772.x.
[15] FUKUSHIMA M, MATSUYAMA F, UEDA N, et al. Effect of corosolic acid on postchallenge plasma glucose levels[J]. Diabetes Research and Clinical Practice, 2006, 73(2): 174-177. DOI:10.1016/ j.diabres.2006.01.010.
[16] STOHS S J, MILLER H, KAATS G R. A review of the eff i cacy and safety of banaba (Lagerstroemia speciosa L.) and corosolic acid[J]. Phytotherapy Research, 2012, 26(3): 317-324. DOI:10.1002/ptr.3664.
[17] YANG J, LENG J, LI J J, et al. Corosolic acid inhibits adipose tissue inf l ammation and ameliorates insulin resistance via AMPK activation in high-fat fed mice[J]. Phytomedicine, 2016, 23(2): 181-190. DOI:10.1016/j.phymed.2015.12.018.
[18] SIVAKUMAR G, VAIL D R, NAIR V, et al. Plant-based corosolic acid: future anti-diabetic drug?[J]. Biotechnology Journal, 2009, 4(12): 1704-1711. DOI:10.1002/biot.200900207.
[19] YAMADA K, HOSOKAWA M, YAMADA C, et al. Dietary corosolic acid ameliorates obesity and hepatic steatosis in KK-Ay mice[J]. Biological and Pharmaceutical Bulletin, 2008, 31(4): 651-655. DOI:10.1248/bpb.31.651.
[20] AGUIRRE M C, DELPORTE C, BACKHOUSE N, et al. Topical antiinf l ammatory activity of 2α-hydroxy pentacyclic triterpene acids from the leaves of Ugni molinae[J]. Bioorganic & Medicinal Chemistry, 2006, 14(16): 5673-5677. DOI:10.1016/j.bmc.2006.04.021.
[21] SHIH C C, CIOU J L, LIN C H, et al. Cell suspension culture of Eriobotrya japonica regulates the diabetic and hyperlipidemic signs of high-fat-fed mice[J]. Molecules, 2013, 18(3): 2726-2753. DOI:10.3390/molecules18032726.
[22] BANNO N, AKIHISA T, TOKUDA H, et al. Triterpene acids from the leaves of and their anti-inflammatory and antitumor-promoting effects[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(1): 85-90. DOI:10.1271/bbb.68.85.
[23] XU X H, SHAH P K, FAURE E, et al. Toll-like receptor-4 is expressed by macrophages in murine and human lipid-rich atherosclerotic plaques and upregulated by oxidized LDL[J]. Circulation, 2001, 104(25): 3103-3108. DOI:10.1161/hc5001.100631.
[24] JOVINGE S, ARES M P, KALLIN B, et al. Human monocytes/ macrophages release TNF-α in response to ox-LDL[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 1996, 16(12): 1573-1579. DOI:10.1161/01.ATV.16.12.1573.
[25] THILAKARATHNA S H, RUPASINGHE H V, NEEDS P W. Apple peel bioactive rich extracts effectively inhibit in vitro human LDL cholesterol oxidation[J]. Food Chemistry, 2013, 138(1): 463-470. DOI:10.1016/j.foodchem.2012.09.121.
[26] XU B J, YUAN S H, CHANG S K. Comparative studies on the antioxidant activities of nine common food legumes against copperinduced human low-density lipoprotein oxidation in vitro[J]. Journal of Food Science, 2007, 72(Suppl 7): 522-527. DOI:10.1111/j.1750-3841.2007.00464.x.
[27] LIU F, NG T. Antioxidative and free radical scavenging activities of selected medicinal herbs[J]. Life Sciences, 2000, 66(8): 725-735. DOI:10.1016/S0024-3205(99)00643-8.
[28] 潘玉婷, 郭春雨, 马晓娟, 等. 人参皂苷Rb3对ox-LDL诱导内皮细胞氧化应激与功能障碍的类雌激素样保护作用[J]. 药学学报, 2014, 49(10): 1406-1412. DOI:10.16438/j.0513-4870.2014.10.003.
[29] 刘颖琳, 刘耕陶. 丹酚酸-A体外对人血清低密度脂蛋白氧化修饰的抑制作用[J]. 药学学报, 2002, 37(2): 81-85. DOI:10.3321/ j.issn:0513-4870.2002.02.001.
[30] 陈建平, 李琳, 苏健裕. 姜黄素的抗氧化及抗肿瘤活性研究[J]. 现代食品科技, 2014, 30(12): 11-15. DOI:10.13982/ j.mfst.1673-9078.2014.12.003.
[31] LIU X, ZHU L, TAN J, et al. Glucosidase inhibitory activity and antioxidant activity of flavonoid compound and triterpenoid compound from Agrimonia Pilosa Ledeb[J]. BMC Complementary and Alternative Medicine, 2014, 14(1): 12. DOI:10.1186/1472-6882-14-12.
[32] FOTAKIS G, TIMBRELL J A. In vitro cytotoxicity assays: comparison of LDH, neutral red, MTT and protein assay in hepatoma cell lines following exposure to cadmium chloride[J]. Toxicology Letters, 2006, 160(2): 171-177. DOI:10.1016/j.toxlet.2005.07.001.
Corosolic Acid from Folium Eriobotryae Inhibits LDL Oxidation and Protects HAECs against Oxidative Damage
LI Feng1,2, LI Yijia2, LI Qingxian2, GUO Yanghao2, SHI Xian’ai2,*
(1. College of Chemistry, Fuzhou University, Fuzhou 350116, China; 2. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350116, China)
Abstract:In the present study, corosolic acid (CA) was extracted and separated from Folium Eriobotryae. A Cu2+-induced low density lipoprotein (LDL) oxidation model was employed to evaluate the inhibitory effect of CA on LDL oxidation in vitro, and a human aortic endothelial cell (HAEC) model of oxidative damage induced by (2,2’-azobis-2-methylpropanimidamide dihydrochloride, AAPH) was employed to evaluate the protective effect of CA on oxidative damage. In the dose range of 10-100 μmol/L, CA effectively extended the lag time of the Cu2+-induced LDL oxidation process, reduced the area under the oxidation kinetic curve (AUC) and inhibited the generation of lipid peroxide indicating that CA could effectively inhibit LDL oxidation induced by Cu2+. In the cellular experiment at the dose range of 2-10 μmol/L, CA effectively reduced LDH leakage induced by AAPH, maintained the integrity of cell structure, enhanced the activities of antioxidant enzymes such as superoxide dismutase (SOD) and glutathione peroxidase (GPx) and therefore oxidative stress resistance, reduced the proportion of sub-G1/G0 cells and necrosis or apoptosis induced by AAPH. These results demonstrated that CA could elevate cellular antioxidant capacity, maintain the integrity of cellular structure, and ultimately protect HAECs against oxidative stress damage induced by AAPH.
Key words:Folium Eriobotryae; corosolic acid; low density lipoprotein(LDL); vascular endothelial cells; lipid peroxidation
DOI:10.7506/spkx1002-6630-201715035
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)15-0215-06
引文格式:
李锋, 李义嘉, 李清仙, 等. 枇杷叶科罗索酸抑制人低密度脂蛋白氧化修饰及保护血管内皮细胞氧化损伤作用[J]. 食品科学, 2017, 38(15): 215-220. DOI:10.7506/spkx1002-6630-201715035. http://www.spkx.net.cn
LI Feng, LI Yijia, LI Qingxian, et al. Corosolic acid from Folium Eriobotryae inhibits LDL oxidation and protects HAECs against oxidative damage[J]. Food Science, 2017, 38(15): 215-220. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201715035. http://www.spkx.net.cn
收稿日期:2016-06-14
基金项目:国家海洋公益性行业科研专项(201205022)
作者简介:李锋(1976—),男,助理研究员,硕士,主要从事天然成分生物活性研究。E-mail:lifeng9676@aliyun.com
*通信作者:石贤爱(1971—),男,教授,博士,主要从事海洋生物工程研究。E-mail:shixa@fzu.edu.cn