户帅锋1,于 洁1,赵碧洁2,王 喆3,李 立1,*
(1.上海海洋大学食品学院,上海 201306;2.吉林大学珠海学院,广东 珠海 519041;3.中国科学院深圳先进技术研究院,生物医用材料与界面研究中心,广东 深圳 518055)
摘 要:分别以质量分数3%山梨酸(sorbic acid,S)、3%壳聚糖(chitosan,CS)、3%山梨酸-壳聚糖微囊粉末(sorbic acid-chitosan microcapsules,S-MP)为抗菌物质,以乙烯-聚乙烯醇共聚物(ethylene-vinyl alcohol,EVOH)为基材树脂,通过共混造粒、挤出吹塑等工艺,制备山梨酸-EVOH(S-EVOH)、壳聚糖-EVOH(CSEVOH)、山梨酸-壳聚糖微囊-EVOH(S-MP-EVOH)3 种抗菌薄膜,并以对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)薄膜为外层薄膜进行复合,制备出S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET复合薄膜以及纯EVOH/PET,在(4±1) ℃对黑鱼鱼块进行冷藏保鲜,通过菌落总数、挥发性盐基氮含量、硫代巴比妥酸值、pH值、汁液流失率、K值和感官评定对抗菌薄膜的保鲜效果进行评价。结果表明,若以菌落总数小于6 (lg(CFU/g))为可食用的标准,在(4±1) ℃贮藏环境下,相对于EVOH/PET薄膜,CS-EVOH/PET薄膜能有效延长黑鱼货架期2 d,S-EVOH/PET、S-MP-EVOH/PET两种复合薄膜均能有效延长黑鱼货架期4 d。
关键词:山梨酸;壳聚糖;山梨酸-壳聚糖微囊;乙烯-聚乙烯醇共聚物;黑鱼;货架期
黑鱼在中国是一种常见的食用鱼,骨刺少,含肉率高,营养丰富,受到消费者喜爱。但黑鱼体表体内黏附大量细菌、体内酶活性强等因素,导致鱼肉极易腐败变质,导致其经济效益不高[1-2]。随着生鲜电商行业快速发展,如何解决生鲜食品配送“最后一公里”的难题成为广大社会群体和相关行业的关注焦点。而抗菌包装薄膜能够有效地抑制生鲜食品表面微生物生长,延长生鲜食品的货架期,有助于解决生鲜食品配送这一难点。
山梨酸(sorbic acid,S)是一种高效无毒的防腐保鲜剂,对酵母、霉菌和许多真菌均具有抑制作用。但山梨酸的水溶性较差,其在食品保鲜中的应用受到限制[3]。壳聚糖(chitosan,CS)是由甲壳素脱乙酰制得的一种直链多糖,具有良好的抗菌活性,对食源性丝状真菌、细菌具有抑制作用,是食品工业中常用的保鲜剂[4-6]。壳聚糖无毒无味、具有良好的生物组织相容性和生物可降解性,能够与聚阴离子通过离子交联法制备载药微囊[7],能够起到缓释的作用,并减少外界环境对被包埋药物的影响[8-9]。
将山梨酸、壳聚糖、山梨酸-壳聚糖微囊粉末(sorbic acid-chitosan microcapsules,S-MP)分别以质量分数3%添加到乙烯-聚乙烯醇共聚物(ethylene-vinyl alcohol,EVOH)树脂颗粒中,通过挤出吹塑法,制备出纯EVOH、山梨酸-EVOH(S-EVOH)、壳聚糖-EVOH(CS-EVOH)、山梨酸-壳聚糖微囊-EVOH(S-MP-EVOH) 4 种不同的薄膜。因EVOH树脂的分子结构中存在着羟基,EVOH树脂具有亲水性和吸湿性。当吸附水蒸气后,气体的阻隔性能会受到影响[10]。以对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)预涂膜为外层薄膜,对4 种单层EVOH薄膜进行复合,制得EVOH/PET、S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET复合薄膜,减少吸湿作用对EVOH薄膜的气体阻隔性的影响。
本实验以EVOH/PET、S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET复合薄膜制备成包装袋,用于4 ℃环境下黑鱼鱼肉的冷藏保鲜,并以菌落总数(total viable counts,TVC)、挥发性盐基氮(total volatile base nitrogen,TVB-N)含量、pH值、硫代巴比妥酸(2-thiobarbituric acid,TBA)值、汁液流失率、K值等作为鲜度指标,同时进行感官评定,评价抗菌薄膜的保鲜效果。
1.1 材料与试剂
黑鱼购于上海农工商超市,每条黑鱼质量约1 000 g。
EVOH(H171B) 日本可乐丽公司;PET预涂膜(总厚度:25 μm,PET基材厚度:12 μm、EVA胶层厚度:13 μm) 伊路顺软包装材料有限公司。
山梨酸、三氯乙酸、硼酸、TBA、高氯酸(分析纯)、溴甲酚绿(试剂纯)、磷酸二氢钾、磷酸氢二钾、甲醇(色谱纯) 国药集团化学试剂有限公司;壳聚糖(脱乙酰度≥95%,黏度100~200 MPa•s) 上海阿拉丁生化科技股份有限公司;腺苷三磷酸(adenosine triphosphate,ATP)、腺苷二磷酸(adenosine diphosphate,ADP)(HPLC纯度≥95%) 美国Sigma公司;腺苷一磷酸(adenosine monophosphate,AMP)、肌苷一磷酸(inosine monophosphate,IMP)(HPLC纯度≥99%) 北京曼哈格生物科技有限公司;次黄嘌呤(hypoxanthine,Hx)、次黄嘌呤核苷酸(hypoxanthine nucleotide,HxR)(HPLC纯度≥98%)美国Chromadex公司。
单增李斯特菌ATCC19114(Listeria monocytogenes)、鼠伤寒沙门氏菌ATCC 13076(Mouse enterica)和大肠杆菌ATCC 25922(Escherichia coli)由农业部水产品贮藏保鲜质量安全风险评估实验室(上海)提供。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器 河南省予华仪器有限公司;UV2100分光光度计 上海尤尼柯仪器有限公司;KJELTEC2300凯氏定氮仪 丹麦FOSS有限公司;PHS-3C pH计 上海精科雷磁有限公司;拍打式匀浆器 法国Interscience公司;2695高效液相色谱仪美国Waters公司;H2050R-1高速冷冻离心机 湘仪离心机仪器有限公司。
1.3 方法
1.3.1 抗菌薄膜的制备
山梨酸、壳聚糖、S-MP以质量分数3%的比例分别添加到EVOH树脂颗粒中,经充分搅拌均匀后,通过双螺杆挤出机进行共混改性,造粒机剪切,制得S-EVOH、CS-EVOH、S-MP-EVOH 3 种改性树脂。双螺杆挤出机的1~7区温度分别为150、185、190、190、190、180 ℃和165 ℃;双螺杆转速为60 r/min。纯EVOH颗粒及3 种改性母粒分别通过挤出吹塑法制备得到纯EVOH、S-EVOH、CS-EVOH、S-MP-EVOH 4 种薄膜。单螺杆挤出机各区温度分别为154、190、185、170 ℃,单螺杆转速为35 r/min。
1.3.2 抗菌薄膜的抑菌测定
参考Muriel-Galet等[11]的抗菌薄膜的抑菌性能测试方法,具体修改如下:金黄色葡萄球菌ATCC 6538、大肠杆菌ATCC 25922和单增李斯特菌ATCC 19114菌种分别用营养肉汤10 mL在37 ℃条件下培养活化24 h,连续培养活化2 次后,用生理盐水溶液依次做10 倍递增稀释液,选择菌液浓度为5.0×105CFU/mL的稀释液作为实验用菌浓度的细菌悬浮液。取5 种薄膜各0.40 g分别放置于含有10 mL营养肉汤的试管中,在室温条件下放置2 d。然后向试管中接入100 μL实验用菌悬浮液,在37 ℃条件下摇床培养 24 h。根据0.5麦氏浊度标准,以生理盐水为稀释液对各试管进行连续梯度稀释。取200 μL不同梯度的稀释液,在含有15 mL营养琼脂的培养皿中涂布,然后放置在(37±1)℃条件下培养48 h后,按GB 4789.2—2010《食品微生物学检验 菌落总数测定》[12]的方法测定活菌数。
1.3.3 黑鱼样品的处理
以PET预涂膜为外层薄膜,对纯EVOH、S-EVOH、CS-EVOH、S-MP-EVOH 4 种薄膜进行复合,制备出EVOH/PET、S-EVOH/PET、CS-EVOH/PET、S-MPEVOH/PET 4 种复合薄膜。并以这4 种薄膜为包装材料制袋,进行黑鱼鱼肉保鲜实验。
对黑鱼进行击晕、去头、去腮、去内脏、去骨、剥皮处理,用1~4 ℃的去离子水冲洗,然后置于冰中待处理。将处理好的黑鱼鱼肉切成大约30 g的鱼块。鱼块被随机分成4 组,分别装于EVOH/PET、S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET 4 种不同复合薄膜制成的包装袋内。鱼肉样品处理方案设计为:鱼肉样品包装后,置于(4±1) ℃环境中贮藏。在第0、2、4、6、8、10天,每次取出16 个样品(每组4 个样品,共4 组),进行微生物、理化指标的检测,并进行感官评定,共计取样144 个鱼肉样品。
1.3.4 指标测定
1.3.4.1 菌落总数的测定
根据GB 4789.2—2010进行菌落总数测定。
1.3.4.2 TVB-N含量的测定
根据半微量凯氏定氮的原理,利用Kjeltee2300自动凯氏定氮仪对鱼肉的TVB-N含量进行[13]测定。
1.3.4.3 TBA值的测定
参考顾海宁等[14]的实验方法进行TBA值的测定,实验结果以每千克鱼肉中所含丙二醛的量表示:
式中:A532nm为样液在532 nm波长处吸光度;A600nm为样液在600 nm波长处吸光度。
1.3.4.4 pH值的测定
将样品鱼肉绞碎后称取10.0 g于烧杯中,加入新鲜冷却煮沸的蒸馏水100 mL,用高速匀浆机匀浆1 min,匀浆结束后,静置30 min,用PHS-3C型pH计进行测定[15]。
1.3.4.5 汁液流失率的测定
参考Özogul等[16]的方法,测定汁液流失率,略作修改:各组样品分别称质量,记录为m1,然后封装于包装袋内。测试指标前,剪开包装袋,用滤纸将样品表面的汁液吸干后,称质量,记录为m2。计算公式如式(2)所示。
1.3.4.6 K值的测定
ATP及其降解产物的提取和测定参照奚春蕊等[17]的方法。K值计算公式如式(3)所示。
式中:MATP为样品中腺苷三磷酸的含量/(μmol/g);MADP为样品中腺苷二磷酸的含量/(μmol/g);MAMP为样品中腺苷酸的含量/(μmol/g);MIMP为样品中肌苷酸的含量/(μmol/g);MHxR为样品中次黄嘌呤核苷的含量/(μmol/g);MHx为样品中次黄嘌呤的含量/(μmol/g)。1.3.5 感官评定
根据Chamanara等[18]的方法,略作修改。鱼肉样品由一个6 人(3 男3 女)感官评定小组进行感官评价。所有样品2 d评价一次。鱼肉样品随机的独立放置在白色塑料托盘中,所有托盘均独立编号。感官评定小组成员按照9 分嗜好程度(1 分,极端不喜欢;2 分,非常不喜欢;3 分,一般不喜欢;4 分,稍微不喜欢;5 分,最低可接受值;6 分,稍微喜欢;7 分,一般喜欢;8 分,非常喜欢;9 分,极端喜欢)对样品的气味、质构、色泽以及总体可接受度进行感官评价。
1.4 数据处理
所有分析均重复3 次,每重复3 个平行(n=3×3),所有数据均通过SPSS 20.0软件进行单因素方差分析,采用最小显著差数法(LSD)(P<0.05)进行显著性分析。
2.1 薄膜的抑菌效果

图1 薄膜对沙门氏菌、单增李斯特菌、大肠杆菌的抑菌效果
Fig. 1 Inhibitory effect of antimicrobial fi lms on tested bacteria
图1显示S-EVOH、S-MP-EVOH、CS-EVOH这3种薄膜对单增李斯特菌、沙门氏菌和大肠杆菌均具有不同程度的抑菌作用。在接种培养24 h后,相对于纯EVOH薄膜,S-EVOH、S-MP- EVOH、CS-EVOH薄膜使单增李斯特菌菌落总数分别减少2.32、2.23、2.01(lg(CFU/g)),使沙门氏菌的菌落总数分别减少5.00、4.54、4.08(lg(CFU/g)),使大肠杆菌的菌落总数分别减少3.30、2.59、2.32(lg(CFU/g))。结果显示,S-MP-EVOH薄膜的抗菌效果较S-EVOH薄膜弱,这可能是因为EVOH在溶液中结构疏松,导致薄膜中山梨酸的释放速率较S-MP-EVOH薄膜快,且释放含量高,发挥抑菌效果更好。S-MP-EVOH、CS-EVOH薄膜的抑菌效果依赖于从薄膜中溶出的和薄膜表面的CS、S-MP。EVOH在溶液中结构疏松,使CS、S-MP更容易从EVOH薄膜中溶出。S-MP-EVOH薄膜的抗菌效果强于CS-EVOH薄膜,是因为在溶液中S-MP的山梨酸更易释放到溶液中和溶于溶液中的部分壳聚糖发挥协同抑菌作用。
抑菌结果显示S-EVOH、S-MP-EVOH、CS-EVOH薄膜均对革兰氏阴性菌(沙门氏菌和大肠杆菌)的抑菌效果要优于革兰氏阳性菌(单增李斯特菌)。Hauser等[19]的研究表明含有0.7%或更高含量CS的聚乙烯薄膜对沙门氏菌和大肠杆菌等革兰氏阴性菌的抑菌效果要好于革兰氏阳性菌(单增李斯特菌)。Park等[20]的研究同样表明,将山梨酸溶于聚乙烯醇溶液中,涂膜于聚乙烯薄膜表面,对大肠杆菌、沙门氏菌、单增李斯特菌均具良好的抑菌效果,与本实验的研究结果相似。
2.2 冷藏过程中菌落总数的变化

图2 冷藏过程中鱼肉样品菌落总数的变化
Fig. 2 Changes in total viable counts of fi sh samples during cold storage
鱼肉的腐败与细菌的生长繁殖密切相关。细菌总数是评价黑鱼货架期长短的重要鲜度指标。如图2所示,所有鱼肉样品组的细菌菌落总数都随着贮藏时间的延长而逐渐升高。4 组黑鱼样品的初始菌落总数为2.99 (lg(CFU/g))。在整个实验期间,EVOH/PET组的菌落总数都要高于其他实验组。Huang等[21]研究指出鱼肉中细菌总数的最大可接受限值为6 (lg(CFU/g))。在第6天,EVOH/PET组的菌落总数为6.02 (lg(CFU/g)),超过最大可见接受限值,且与3 个实验组的差异显著(P<0.05);S-EVOH/PET、CS-EVOH/PET、 S-MP-EVOH/PET组的菌落总数分别为4.31、4.85、4.56(lg(CFU/g)。EVOH/PET组在第8天的菌落总数为6.89 (lg(CFU/g)),而S-EVOH/PET与S-MP-EVOH/PET组的菌落总数分别为5.21、5.5 (lg(CFU/g)),且差异不显著(P>0.05)。第10天,S-EVOH/PET与S-MP-EVOH/PET两组的菌落总数均超过最大可接受限值。结果证明,相对于EVOH/PET复合薄膜,CS-EVOH/PET复合薄膜能够延长黑鱼的货架期2 d,而S-EVOH/PET、S-MP-EVOH/PET两种复合薄膜能够延长黑鱼的货架期4 d。
EVOH树脂具有亲水性和吸湿性,直接在EVOH中添加山梨酸,使得山梨酸能够较快从薄膜中迁移至鱼肉的表面,而在冷藏2~4 d时鱼肉的pH值相对较低,所以S-EVOH/PET复合薄膜能有效抑制鱼肉表面的细菌生长。S-MP-EVOH/PET复合薄膜由于将山梨酸包埋在壳聚糖微球中,山梨酸释放较S-EVOH/PET复合薄膜缓慢但抑菌时间更长[22-23],而且能够协同壳聚糖发挥抗菌作用,所以也能够有效抑制鱼肉表面细菌的生长繁殖。
2.3 冷藏过程中TVB-N含量的变化
TVB-N指动物性食品在酶和细菌的作用下,蛋白质分解产生氨以及胺类等碱性含氮物质。GB 2733—2015《鲜、冻动物性水产品卫生标准》[24]要求淡水鱼虾的TVB-N值不大于20 mg/100 g。

图3 冷藏过程中鱼肉样品TVB-N含量的变化
Fig. 3 Changes in TVB-N value of fi sh samples during cold storage
4 种复合薄膜对(4±1) ℃条件下贮藏黑鱼TVB-N含量的影响见图3。黑鱼样品的初始TVB-N含量为9.93 mg/100 g,在不同复合薄膜的处理下,黑鱼样品的TVB-N含量随着贮藏时间的延长逐渐增加。在第6天,EVOH/PET、S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET组的TVB-N含量分别为19.38、14.96、17.92、16.04 mg/100 g,EVOH/PET组的TVB-N含量显著高于其他各组(P<0.05),而S-EVOH/PET组最低。在第8天,EVOH/PET、CS-EVOH/PET两组的TVB-N含量均高于最大可接受20 mg/100 g,已经腐败;S-EVOH/PET、S-MP-EVOH/PET组的TVB-N含量分别为18.34、19.42 mg/100 g,未腐败。在第10天,S-EVOH/PET、S-MP-EVOH/PET组的TVB-N含量大于20 mg/100 g,腐败变质,说明相对于其他两组,这两组均能延长黑鱼货架期2 d。可以看出在2~10 d,EVOH/PET组的TVB-N含量增长速率明显高于其他各组,S-EVOH/PET组的TVB-N含量上升趋势低于S-MP-EVOH/PET组,说明S-EVOH/PET薄膜的保鲜效果优于S-MP-EVOH/PET薄膜。
2.4 TBA值的变化

图4 冷藏过程中鱼肉样品TBA值的变化
Fig. 4 Changes in TBA value of fi sh samples during cold storage
TBA可以用来反映肉中脂肪的最终氧化程度,TBA值越大,说明脂肪氧化程度越高,鱼肉的腐败程度越高。冷藏期间,4 种复合薄膜对鱼肉TBA值变化的影响如图4所示。黑鱼样品的初始TBA值为0.22 mg/kg,在不同薄膜的处理下,黑鱼样品的TBA值随着贮藏时间的延长逐渐增加。在冷藏期间,3 个实验组的TBA值显著低于对照组EVOH/PET组(P<0.05)。在第6天,S-EVOH/PET和S-M P-E V O H/P E T两组的T B A值差异不显著(P>0.05),分别为0.46、0.45 mg/kg;CS-EVOH/PET组的TBA值为0.56 mg/kg。在第8天,S-EVOH/PET组的TBA值最低,但与S-MP-EVOH/PET组差异不显著。4 种复合薄膜内层均以EVOH为基材,对氧气的阻隔性很好,优于外层PET薄膜。在初期外界氧气极少能进入包装袋内,所以初期的脂肪氧化是由包装袋内的氧气引起[25]。随着冷藏时间的延长,鱼肉产生的水分增多,EVOH的吸湿性和亲水性导致以EVOH为基材的内层薄膜对氧气的阻隔性降低,所以在后期,4 种复合薄膜对氧气的阻隔性依赖于外层PET薄膜,脂肪的氧化程度加剧。EVOH/PET组的TBA值高于3 个实验组,可能是由细菌的生长繁殖引起。
2.5 冷藏过程中pH值的变化

图5 冷藏过程中鱼肉样品pH值的变化
Fig. 5 Changes in pH value of fi sh samples during cold storage
黑鱼冷藏过程中pH值的变化如图5所示。在冷藏期间,所有鱼肉样品组的pH值都呈现出先下降后上升的趋势。鱼体在宰杀以后,鱼肉中CO2的溶解,糖原经无氧降解产生的乳酸,ATP和磷酸肌酸分解产生的磷酸,都会造成pH值的下降。随着冷藏时间的延长,鱼体内蛋白质逐渐被微生物分解,以及酶类代谢造成的氨基酸脱氨基、核苷降解、胺类物质氧化为碱性含氮小分子物质,致使pH值不断上升[26]。由图5可以看出,黑鱼样品的初始pH值为6.67。在冷藏期间,3 个实验组的pH值都显著低于EVOH/PET组(P<0.05)。在第6天,S-EVOH/PET组样品的pH值为6.51,显著低于CS-EVOH/PET组(P<0.05),与S-MP-EVOH/PET组差异不显著(P>0.05)。在第8天,S-EVOH/PET组样品的pH值为6.8,与CS-EVOH/PET、S-MP-EVOH/PET两组差异均不显著(P>0.05)。由图2、5可知,黑鱼样品pH值的变化和样品菌落总数的变化具有一定的相关性,S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET 3 种抗菌复合薄膜均能在一定程度上抑制鱼肉表面微生物的生长繁殖,延缓其pH值的变化。在0~6 d,4 组黑鱼样品的pH值上升较为缓慢,是因为4 组样品的菌落总数较低导致;在6~10 d,4 组样品的细菌生长繁殖快,碱性含氮小分子物质积累导致pH值上升速率加快。
2.6 冷藏过程中持水率的变化

图6 冷藏过程中鱼肉样品汁液流失率的变化
Fig. 6 Changes in drip loss of fi sh samples during cold storage
如图6所示,在冷藏条件下,EVOH/PET、S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET 4 组黑鱼样品的汁液流失率都呈逐渐上升趋势。在整个冷藏过程中EVOH/PET组的汁液流失率明显高于3 个实验组。在第6天,S-EVOH/PET组的汁液流失率为3.17%,与CS-EVOH/PET、S-MP-EVOH/PET两组无显著差异(P>0.05)。在第8天,S-EVOH/PET组的汁液流失率3.93%,与CS-EVOH/PET、S-MP-EVOH/PET两组差异显著(P<0.05)。4 组样品汁液流失率的变化与使用的薄膜的抑菌性能相关,可见汁液的流失是因为细菌的生长繁殖,使黑鱼组织分解,细胞破裂,营养物质被细菌分解、氧化和水解导致的[27]。
2.7 冷藏过程中K值的变化
K值是评估鱼肉质量的一个重要鲜度指标。鱼死后肌肉中的ATP在内源酶作用下发生降解,降解中间产物依次为ADP、AMP、IMP、HxR和Hx。它能反映鱼宰杀后从僵直到自溶不同阶段的不同新鲜度。一般来讲,活鱼的K值在10%以下,可生食鱼肉的K值在20%以下,超过60%即开始腐败[28]。

图7 冷藏过程中鱼肉样品K值的变化
Fig. 7 Changes in K value of fi sh samples during cold storage
(4±1)℃条件下贮藏黑鱼样品的K值变化趋势如图7所示。随着冷藏时间的延长, EVOH/PET、S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET 4个实验组的K值逐渐上升,从初始的9.43%分别上升到第10天的75.13%、60.31%、63.76%、67.07%。初始K值低于10%主要是由于鱼肉组织中的内源酶促降解,而菌落的生长繁殖导致K值在贮藏期间快速上升。在第2天EVOH/PET组和CS-EVOH/PET组的K值分别为27.38%、21.62%,超过20%,不宜生食,实验组S-EVOH/PET、S-MP-EVOH/PET的K值分别为15.3%、15.91%,未超过20%。在第8天EVOH/PET组的K值为68.49%,超过60%,进入腐败期,S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET 3 个实验组的K值分别为52.22%、59.15%、56.18%,均未达到60%。壳聚糖虽然能够抑制5-核苷酸酶的活性,但是在EVOH中难以迁移,难以有效抑制ATP的降解。Matsumato等[29]的研究同样发现Hx含量的增加是微生物生长的结果。因此K值的变化很可能与壳聚糖及山梨酸的抑菌效果有关,S-EVOH和S-MP-EVOH中的山梨酸能够迁移至鱼肉表面,能更有效地抑制细菌的生长繁殖,因此K值得增加较CS-EVOH/PET组更为缓慢。
2.8 感官评分结果
感官评定是通过视觉、听觉、嗅觉、味觉、触觉这5 个方面对食品的各项指标及可接受程度的评价,在食品评定中占有很大地位。本实验通过对气味、质构、色泽、总体可接受度4 个方面对黑鱼鱼肉进行评价。从表1可以看出,在4 ℃冷藏条件下贮藏,黑鱼鱼肉样品的感官评分随时间延长逐渐下降,S-EVOH/PET、CS-EVOH/PET、S-MP-EVOH/PET 3 组的感官评分的下降速率较EVOH/PET组慢。在冷藏第2天,S-EVOH/PET和S-MP-EVOH/PET两组的感官品质保持在第0天的初始水平,而EVOH/PET组和CS-EVOH/PET组的感官品质出现一定程度的降低,肉质坚韧有弹性、无汁液析出、颜色呈鲜红色,但鱼肉表面较为黏稠,稍有鱼腥味。在第6天,S-EVOH/PET组的感官评分最高,样品袋内有少量汁液,无异味,颜色变化不明显,肉质有弹性;而EVOH/PET组样品的肉质松软,表面黏稠,带有黄色,包装袋内出现大量黄红色汁液,其气味、质构、颜色和总体可接受度均低于最低可接受值5 分。在第8天,CS-EVOH/PET组的感官评分低于5 分。在第10天,S-EVOH/PET和S-MP-EVOH/PET两组的感官评分低于5 分,而EVOH/PET组样品表面颜色黄青,肉质极其松软,袋中有大量黄色浑浊汁液,异味刺激强烈,不适宜进行感官评定。
表1 冷藏过程中鱼肉样品感官评分的变化
Table 1 Changes in sensory scores of fi sh samples during cold storage
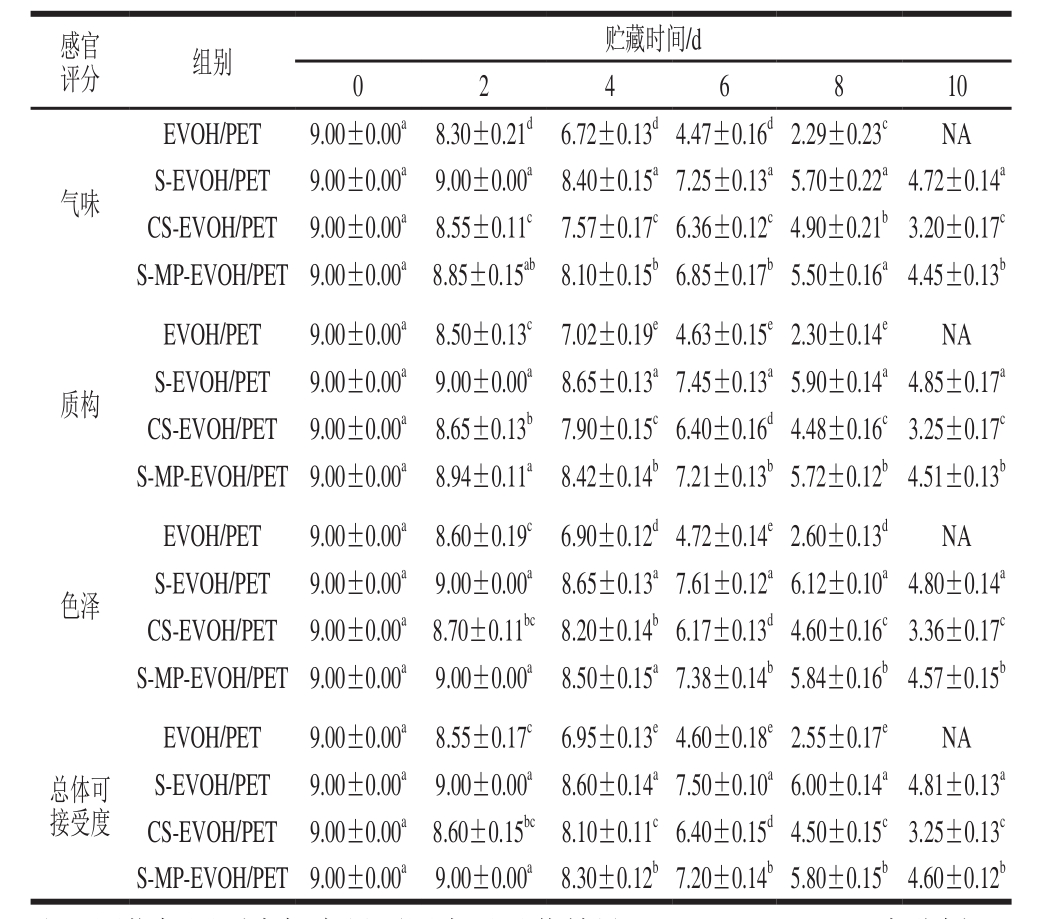
注:同指标同列肩标字母不同表示显著差异(P<0.05);NA.未分析。
蛋白质的分解产生NH3、三甲胺、硫化氢、组胺、尸胺等物质,脂肪氧化酸败产生丙二醛等物质,这些化学变化产生的物质均具有刺激气味,使样品的气味评分下降[30]。蛋白质的分解导致鱼肉的组织结构被破坏使鱼肉肉质变软、疏松,鱼肉的黏弹性和硬度均发生变化。微生物的代谢产物,脂肪氧化导致的色素分解均能导致鱼肉样品颜色变化,S-EVOH/PET、S-MP-EVOH/PET、CS-EVOH/PET 3 种复合薄膜的抑菌效果以及对氧气的高阻隔性[31],导致4 组样品颜色的评分变化比气味、质构及总体可接受度的评分变化慢。
所有鲜度指标及感官评定结果均反映S-EVOH/PET、S-MP-EVOH/PET复合薄膜对黑鱼鱼肉的保鲜效果最好。若以菌落总数小于6 (lg(CFU/g))为可食用的标准,在4 ℃环境中CS-EVOH/PET复合薄膜能使黑鱼鱼肉的货架期延长至8 d;S-EVOH/PET、S-MP-EVOH/PET复合薄膜则能使黑鱼鱼肉的货架期延长至10 d。相对于EVOH/PET复合薄膜,CS-EVOH薄膜能有效延长黑鱼货架期2 d,S-EVOH/PET、S-MP-EVOH/PET两种复合薄膜均能有效延长黑鱼货架期4 d。S-EVOH/PET、S-MP-EVOH/PET抗菌薄膜均具有良好的抗菌保鲜效果,而S-MP-EVOH/PET抗菌复合薄膜相对于S-EVOH/PET抗菌复合薄膜具有山梨酸使用量少、易于熔融加工、在薄膜贮藏过程中不易氧化变色等优点,在生鲜食品保鲜中具有广阔的应用前景。
参考文献:
[1] GRAM L, HUSS H H. Microbiological spoilage of fish and fish products[J]. International Journal of Food Microbiology, 1996, 33(1): 121-137. DOI:10.1016/0168-1605(96)01134-8.
[2] 吕飞, 丁玉庭, 叶兴乾. 含肉桂油和Nisin的海藻酸钠薄膜保鲜黑鱼性能分析[J]. 农业机械学报, 2011, 42(5): 146-150. DOI:10.3969/ j.issn.1000-1298.
[3] 丁文慧, 陆利霞, 熊晓辉. 提高山梨酸及钾盐防腐效果的研究进展[J]. 食品工业科技, 2012, 33(3): 410-412; 416. DOI:10.13386/ j.issn1002-0306.2012.03.102.
[4] HELANDER I M, NURMIAHO-LASSILA E L, AHVENAINEN R, et al. Chitosan disrupts the barrier properties of the outer membrane of gram-negative bacteria[J]. International Journal of Food Microbiology, 2001, 71: 235-244. DOI:10.1016/S0168-1605(01)00609-2.
[5] 冯小强, 李小芳, 杨声, 等. 壳聚糖对细菌细胞膜及膜蛋白的作用[J].食品科学, 2009, 30(13): 84-88.
[6] TOKURA S, UENO K, MIYAZAKI S, et al. Molecular weight dependent antimicrobial activity by chitosan[M]// New macromolecular architecture and functions. Berlin Heidelberg: Springer, 1996: 199-207.
[7] BOWMAN K, LEONG K W. Chitosan nanoparticles for oral drug and gene delivery[J]. International Journal of Nanomedicine, 2006, 1(2): 117-128. DOI:10.2147/nano.2006.1.2.117.
[8] ESTEVINHO B N, ROCHA F, SANTOS L, et al. Microencapsulation with chitosan by spray drying for industry applications: a review[J]. Trends in Food Science & Technology, 2013, 31(2): 138-155. DOI:10.1016/j.tifs.2013.04.001.
[9] 武陶, 丁武. 山梨酸纳米防腐颗粒的制备, 表征及其缓释性能[J]. 食品科学, 2014, 35(10): 57-61. DOI:10.7506/spkx1002-6630-201410011.
[10] DHAWAN S, VARNEY C, BARBOSA-CÁNOVAS G V, et al. Pressure-assisted thermal sterilization effects on gas barrier, morphological, and free volume properties of multilayer EVOH fi lms[J]. Journal of Food Engineering, 2014, 128: 40-45. DOI:10.1016/ j.jfoodeng.2013.12.012.
[11] MURIEL-GALET V, LÓPEZ-CARBALLO G, GAVARA R, et al. Antimicrobial food packaging fi lm based on the release of LAE from EVOH[J]. International Journal of Food Microbiology, 2012, 157(2): 239-244. DOI:10.1016/j.ijfoodmicro.2012.05.009.
[12] 食品微生物学检验: 菌落总数测定: GB T 4789.2—2010[S].
[13] 姬勇. KJELTEC2300全自动定氮仪测定羊肉中的挥发性盐基氮[J].石河子大学学报(自然科学版), 2005, 23(5): 538-540.
[14] 顾海宁, 李强, 李文钊, 等. 冷却猪肉贮存中的品质变化及货架期预测[J]. 现代食品科技, 2013, 29(11): 2621-2626. DOI:10.13982/ j.mfst.1673-9078.2013.11.023.
[15] 刘骁, 谢晶, 林永艳. 复合生物保鲜剂对猪肉保鲜的研究[J].食品与机械, 2011, 27(6): 199-203. DOI:10.3969j.issn.1003-5788.2011.06.054.
[16] ÖZOGUL Y, ÖZYURT G, ÖZOGUL F, et al. Freshness assessment of European eel (Anguilla anguilla) by sensory, chemical and microbiological methods[J]. Food Chemistry, 2005, 92(4): 745-751. DOI:10.1016/j.foodchem.2004.08.035.
[17] 奚春蕊, 包海蓉, 刘琴, 等. 基于金枪鱼K值变化的MTT快速传感器的研究及响应面设计[J]. 食品工业科技, 2013, 34(12): 131-136. DOI:10.13386/j.issn1002-0306.2013.12.081.
[18] CHAMANARA V, SHABANPOUR B, GORGIN S, et al. An investigation on characteristics of rainbow trout coated using chitosan assisted with thyme essential oil[J]. International Journal of Biological Macromolecules, 2012, 50(3): 540-544. DOI:10.1016/ j.ijbiomac.2012.01.016.
[19] HAUSER C, WUNDERLICH J. Antimicrobial packaging fi lms with a sorbic acid based coating[J]. Procedia Food Science, 2011, 1: 197-202. DOI:10.1016/j.profoo.2011.09.031.
[20] PARK S, MARSH K S, DAWSON P. Application of chitosanincorporated LDPE film to sliced fresh red meats for shelf life extension[J]. Meat Science, 2010, 85(3): 493-499. DOI:10.1016/ j.meatsci.2010.02.022.
[21] HUANG Y R, SHIAU C Y, HUNG Y C, et al. Change of hygienic quality and freshness in tuna treated with electrolyzed water and carbon monoxide gas during refrigerated and frozen storage[J]. Journal of Food Science, 2006, 71(4): M127-M133. DOI:10.1111/j.1750-3841.2006.00023.x.
[22] WORANUCH S, YOKSAN R. Eugenol-loaded chitosan nanoparticles: II. application in bio-based plastics for active packaging[J]. Carbohydrate Polymers, 2013, 96(2): 586-592. DOI:10.1016/ j.carbpol.2012.09.099.
[23] DE MOURA M R, AOUADA F A, AVENA-BUSTILLOS R J, et al. Improved barrier and mechanical properties of novel hydroxypropyl methylcellulose edible films with chitosan/tripolyphosphate nanoparticles[J]. Journal of Food Engineering, 2009, 92(4): 448-453. DOI:10.1016/j.jfoodeng.2008.12.015.
[24] 鲜、冻动物性水产品卫生标准: GB 2733—2015[S].
[25] LÓPEZ-DE-DICASTILLO C, GÓMEZ-ESTACA J, CATALÁ R, et al. Active antioxidant packaging films: development and effect on lipid stability of brined sardines[J]. Food Chemistry, 2012, 131(4): 1376-1384. DOI:10.1016/j.foodchem.2011.10.002.
[26] WULF D M, EMNETT R S, LEHESKA J M, et al. Relationships among glycolytic potential, dark cutting (dark, fi rm, and dry) beef, and cooked beef palatability[J]. Journal of Animal Science, 2002, 80(7): 1895-1903. DOI:10.2527/2002.8071895x.
[27] HEBARD C E, FLICK G J, MARTIN R E. Occurrence and significance of trimethylamine oxide and its derivatives in fish and shellfish[C]// Abstracts of Papers of the American Chemical Society. Washington, DC: Amer Chemical Soc., 1979: 22.
[28] LI Tingting, LI Jianrong, HU Wenzhong et al. Quality enhancement in refrigerated red drum (Sciaenops ocellatus) fillets using chitosan coatings containing natural preservatives[J]. Food Chemistry, 2013, 138(2): 821-826. DOI:10.1016/J.FOODCHEM.2012.11.092.
[29] MATSUMATO M, YAMANAKA H. Post-morten biochemical changes in the muscle of kuruma prawn during storage and evaluation of the freshness[J]. Nippon Suisan Gakkaishi, 1990, 56(7): 1145-1149. DOI:10.2331/suisan.56.1145.
[30] GOULAS A E, KONTOMINAS M G. Combined effect of light salting, modif i ed atmosphere packaging and oregano essential oil on the shelf-life of sea bream (Sparus aurata): biochemical and sensory attributes[J]. Food Chemistry, 2007, 100(1): 287-296. DOI:10.1016/ j.foodchem.2005.09.045.
[31] YANG Hui, WANG Jing, YANG Fuxin, et al. Active packaging fi lms from ethylene vinyl alcohol copolymer and clove essential oil as shelf life extenders for grass carp slice[J]. Packaging Technology and Science, 2016, 29(7): 383-396. DOI:10.1002/pts.2215.
Effect of Antimicrobial Ethylene-Vinyl Alcohol (EVOH) Copolymer Film Based on Sorbic Acid-Loaded Chitosan Microcapsules on the Preservation of Snakehead
HU Shuaifeng1, YU Jie1, ZHAO Bijie2, WANG Zhe3, LI Li1,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Zhuhai College of Jilin University, Zhuhai 519041, China; 3. Center for Biomedical Materials and Interfaces, Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China)
Abstract:Using three different antimicrobials: sorbic acid, chitosan (CS) and sorbic acid-chitosan microcapsules (S-MP), each added at a level of 3%, antimicrobial ethylene-vinyl alcohol (EVOH) copolymer fi lms, sorbic acid-EVOH (S-EVOH), chitosan-EVOH (CS-EVOH) and sorbic acid-chitosan microcapsules-EVOH (S-MP-EVOH), were prepared by sequential blending, granulation, extrusion and blow molding. Using polyethylene terephthalate (PET) pre-coated fi lm as outer fi lm, EVOH/PET, S-EVOH/PET, CS-EVOH/PET and S-MP-EVOH/PET composite films were prepared and applied to the preservation of snakehead fi llets at (4 ± 1) ℃. The total viable count (TVC), total volatile basic nitrogen (TVB-N), pH, thiobarbituric acid (TBA), drip loss, K value and sensory evaluation were analyzed periodically during cold storage. The results indicated that CS-EVOH/PET fi lm could extend the shelf-life of snakehead fi llet by 2 days, and S-EVOH/PET and S-MP-EVOH/PET fi lms could extend the shelf-life by 4 days compared to EVOH/PET fi lm.
Key words:sorbic acid; chitosan; sorbic acid-chitosan microcapsules (S-MP); ethylene-vinyl alcohol (EVOH); snakehead; shelf-life
DOI:10.7506/spkx1002-6630-201715038
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2017)15-0237-07
引文格式:
户帅锋, 于洁, 赵碧洁, 等. 负载山梨酸的壳聚糖微囊-EVOH抗菌薄膜对黑鱼鱼肉保鲜的影响[J]. 食品科学, 2017, 38(15): 237-243. DOI:10.7506/spkx1002-6630-201715038. http://www.spkx.net.cn
HU Shuaifeng, YU Jie, ZHAO Bijie, et al. Effect of antimicrobial ethylene-vinyl alcohol (EVOH) copolymer fi lm based on sorbic acid-loaded chitosan microcapsules on the preservation of snakehead[J]. Food Science, 2017, 38(15): 237-243. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201715038. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:上海市教育委员会科研创新项目(14YZ120);国家高技术研究发展计划(863计划)项目(2012AA0992301)
作者简介:户帅锋(1989—),男,硕士,研究方向为水产品贮藏加工及食品包装技术。E-mail:hu983179529@163.com
*通信作者:李立(1977—),男,副教授,博士,研究方向为食品包装材料与工艺。E-mail:l-li@shou.edu.cn