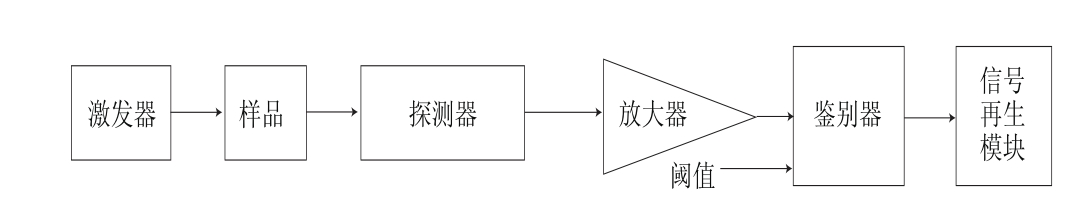
图1 时间分辨计光谱仪架构
Fig. 1 Schematic of time-resolved fl uorescence technique
陈 晖1,祁兴普1,2,郭 丽1,李 峰3,陆道礼1,陈 斌1,*
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.江苏农牧科技职业学院,江苏 泰州 225300;3.江苏大学附属医院,江苏 镇江 212001)
摘 要:时间分辨荧光技术是一种较新的检测技术,在食品品质检测领域有诸多应用。本文简述了时间分辨荧光技术的基本原理及特点,指出该技术进行的是荧光发射的动态性测量,可以获得荧光发射过程的细节信息。在此基础上综述了时间分辨荧光技术在食品品质分析中的应用,并提出其在食用植物油品质分析中的应用方案,最后展望了时间分辨荧光技术在食品品质检测领域的应用前景。
关键词:时间分辨荧光;动态测量;品质分析;植物油
时间分辨光谱的方法原理[1]是英国化学家、诺贝尔化学奖获得者George Porter勋爵在1951年发展的“闪光光解”技术上建立的,该技术是通过记录光谱随时间的变化了解瞬时过程中被检测体系的信息[2]。时间分辨荧光技术(time-resolved fl uorescence technique,TRF)是时间分辨光谱技术中的一种,是基于跟踪监测激发态分子进行辐射弛豫所发射的荧光随时间的变化,研究分子状态、结构的微观动态学的一种常用方法,其主要特点是在时间尺度下考察荧光发射的各种特性参数的变化及其影响因素,检测的不是叠加在高强度探测光背景上的吸收强度微小变化,而是将分子体系在某一瞬间所发射的荧光信号在“零背景”的条件下进行监测[2]。随着仪器技术的进步,TRF已实现飞秒级的时间分辨检测。无论是食品中有毒有害物质检测,还是食品成分因子分析,或者是食品种类的鉴别,TRF都是一种灵敏度高、快速准确、识别率高的检测方法[3]。
本文对TRF的基本原理和特点进行了综合分析,综述了TRF在食品品质检测中的应用情况,以此为基础提出了该技术在食用植物油品质分析中的应用方案,最后对该技术在食品品质检测领域的应用进行了展望。
1.1 时间分辨荧光技术原理
TRF是在传统荧光技术上结合光脉冲技术和微弱、瞬变光信号检测技术发展起来的一项新兴技术[2]。该技术的基本原理是:以一个持续时间Δtp(远小于某一分子荧光过程的脉冲光)激发该分子,在经过一定时间延迟后,用光信号检测器检测该荧光信号在不同波长处的分布Iti(λ1,λ2,…,λn),即可获得该激发态分子在此瞬间的结构、形态信息;经过不同的时间延迟后,逐步监测这一激发态分子在特定波长λi处光谱信号在不同时间的强度变化Iλi(Δt1,Δt2,…,Δtn),获得有关激发态分子随时间演变的微观步骤信息[2]。
1.2 时间分辨荧光仪的关键模块和光子分布直方图
荧光测量技术可以粗分为稳态荧光测量和时间分辨(瞬态)荧光测量,时间分辨荧光的时间尺度和稳态荧光空间尺度是二者的本质区别。为实现时间尺度下的荧光测量,时间分辨荧光仪架构中引入了很多复杂模块,时间分辨荧光仪的架构如图1所示。

图1 时间分辨计光谱仪架构
Fig. 1 Schematic of time-resolved fl uorescence technique
相较于稳态荧光仪的连续高压激发,时间分辨荧光仪的激发模块在激发上采用低压脉冲激发以获得低噪声背景的荧光,且脉冲频率对时间分辨率影响较大[2]。光电探测器模块中,条纹摄像管的应用使时间分辨荧光仪可以同时记录荧光信号在不同波长、不同时间的分布,实现了空间尺度和时间尺度下荧光信号模式的表征。信号再生模块用于从光电探测器中传出的含有大量噪声的光电子信号中提取出微弱的目标信号,并通过统计整理,还原出目标分子的荧光发射分布,其中光子计数技术应用较多[2]。其启发思想源于1905年爱因斯坦的一篇划时代学术论文[4],其核心思想为:光的测量,无论信号的形式如何,测量结果所代表的都是在给定时间内检测到的光子数[5]。因此时间分辨测量中,通过光子计数技术可以得到时间微元中的光子数,经过多次脉冲激发和统计整理形成光子分布直方图,该直方图经模型拟合得到荧光衰减曲线,从拟合模型中可获得荧光寿命等参数。
光子分布直方图是概率统计谱,每个时间通道中的光子数代表的是在该时刻时光子的发射概率而并非光强,但可理解为该时刻下的概率光强,是时间尺度下发射概率的度量,与常规光谱区别很大。激发器以脉冲形式激发荧光分子产生荧光,荧光到达光电探测器后转换为光电子,光电子经过鉴别器筛选出目标单光子脉冲光信号,单光子脉冲信号根据其发射延迟时间被相应的时间通道记录,该通道检测到的光子数加1,即光子在该延迟时刻上的发射概率增加。经过多个脉冲周期后,以每个通道中光子数为纵坐标,时间为横坐标统计整理形成光子计数直方图[6-14],直方图经拟合形成荧光衰变谱。荧光衰变谱的形成如图2所示[5]。

图2 荧光衰变谱形成原理
Fig. 2 Formation mechanism of fl uorescence-decay spectrum
1.3 荧光发射的动态性测量
激发态荧光分子可以通过辐射跃迁和无辐射跃迁返回基态,包括荧光发射在内,这两类能量转移方式有7 种具体途径[15-17],其能量转移关系如图3所示。
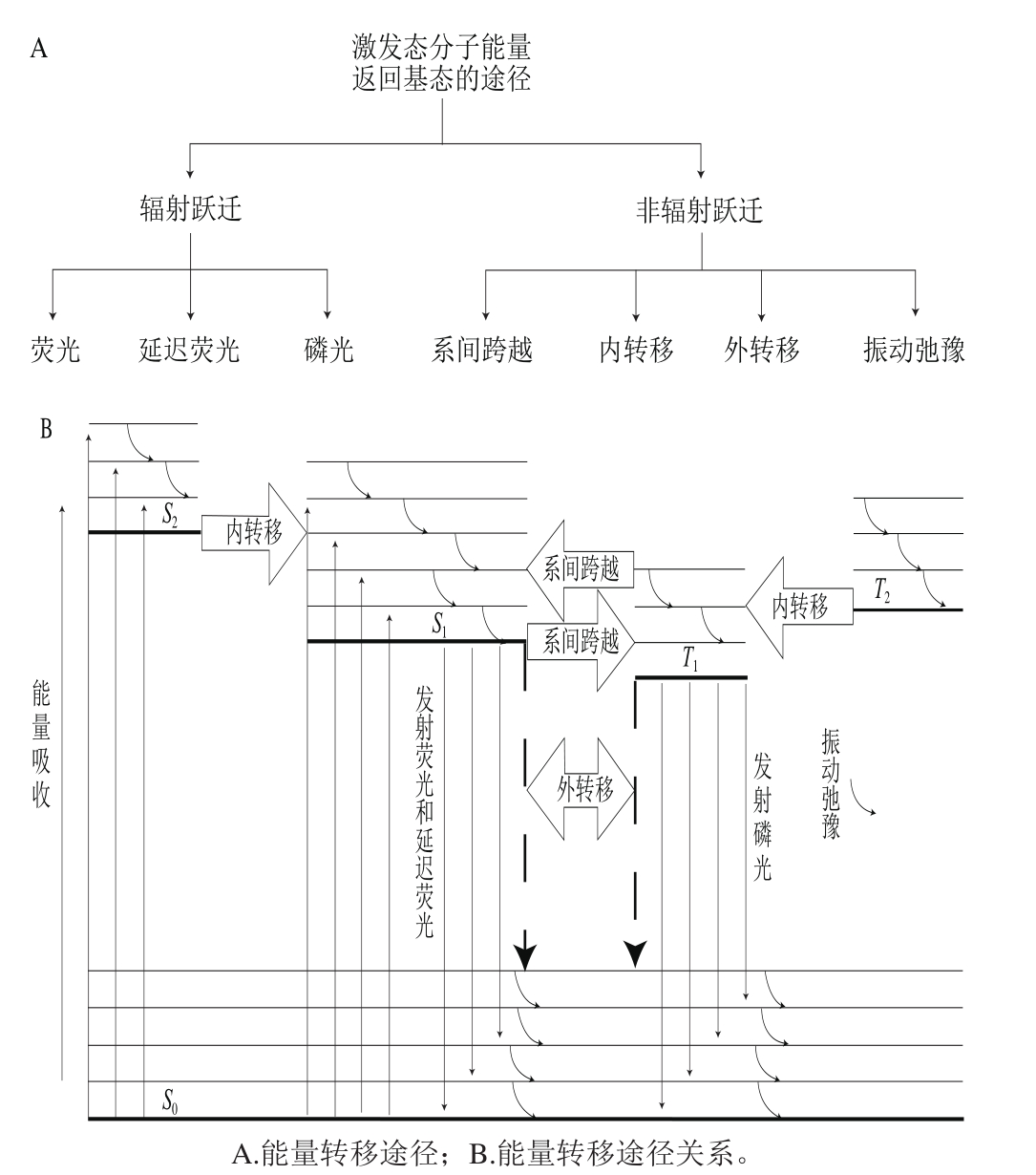
图3 激发态分子能量转移途径及关系
Fig. 3 Pathways and relationships of excited-state molecular energy transformation
分子被激发后,能量通过上述途径转移使得分子返回基态。TRF利用时间微元将荧光发射过程在时间尺度上“切分”后进行分析,而稳态荧光反映的是荧光发射过程的最终结果,因此TRF分析的是荧光能量的动态变化。
1.4 荧光寿命和时间分辨荧光的检测优势
1.4.1 荧光寿命
荧光寿命是TRF的主要测量参数之一,反映分子荧光概率发射的中值位置,是指分子被激发后,荧光强度降到激发时最大强度的1/e所需的时间,是分子的本征性质之一[18]。如果激发态荧光分子本身没有发生变化且没有与环境发生相互作用,它将从S1激发态返回到基态并发射光子,此时测得的荧光寿命为本征荧光寿命τn;如果分子本身发生变化或者与环境发生相互作用则会导致荧光寿命发生改变,其他因素对荧光寿命的影响也应该计算在内,而这些因素因为增加激发态分子以其他途径转移能量的几率,所以通常会降低表观荧光寿命,因此实际的荧光寿命测量通常指在特定的环境条件下的表观荧光寿命,且表观荧光寿命τ比本征荧光寿命τn要短[5]。
简单荧光分子的表观荧光寿命受辐射衰减常数和非辐射衰减常数的影响,计算公式如式(1)[18]。
式中:τ为表观荧光寿命/s;kr和knr分别为辐射衰减常数和非辐射衰减常数/s-1[18]。辐射衰减常数kr表明了分子的本征荧光发射性质,非辐射衰减常数knr则可以代表所有其他因素对荧光寿命造成的影响。
分子的荧光寿命是该分子的本征性质之一,但是其荧光寿命数值的确定却是通过仪器检测然后通过数学计算获得的。在某种荧光素荧光寿命数值的确定中,该荧光素单分子的荧光寿命是通过检测该分子集团总体的荧光寿命,然后通过数学计算获得。荧光寿命的数学推导过程也可以证实这一点[18]。假设有N0个荧光素分子到达了激发态,那么该分子基团荧光强度随时间t的衰减速率可用方程(2)表示[18]。
式中:Nt为某一时刻处于激发态的分子数[18]。在t=0时,N=N0,lg N=lg N0,通过计算可得到式(3)。
因为表观荧光寿命定义式为1/τ=kr+knr,且在t=τ时,N=N0/e,因此荧光寿命可以理解为激发态荧光分子基团浓度下降到1/e时所需要的时间[18]。虽然荧光寿命是分子的本征性质,但是结合荧光寿命的数学推导式和仪器的检测限等实际因素考虑,有如下推断:如果单位体积荧光素分子数远小于激发脉冲所能激发的最大荧光分子数,那么测量时间将大大增长,更极端的情况就是无法获得荧光寿命。因此虽然认为荧光寿命几乎不受分子浓度影响,但是实际测量时却必须考虑分子浓度。
由1.3节可知,荧光发射、延迟荧光发射、磷光、系间跨越和振动弛豫与荧光分子的能级状态有关,而环境热力学性质的改变对已激发分子能级状态的改变会造成影响,从而影响分子的荧光寿命;外转移是荧光分子与环境分子相互作用产生的效应,因此溶剂分子的理化性质和其对环境性质产生的影响也必然会传递到分子的荧光寿命上。
综上所述,在分子构造不发生改变的情况下,荧光分子所处的特定环境性质会对荧光分子构象、荧光分子之间或之内的电子分布、荧光分子与其他溶剂分子之间的相互作用造成影响,从而改变非辐射衰减常数knr,因而会造成计算出的表观荧光寿命τ的不同,利用这一点可以进行某种荧光分子在特定环境条件下的荧光寿命研究,从而反映该分子的所处环境的性质。以荧光寿命为参数,通过能量变化敏感的时间分辨荧光测量研究体系的性质变化,是当下研究的热点,也是食品有关检测应用中值得研究的方向。
1.4.2 时间分辨荧光的检测优势
稳态荧光测量和瞬态荧光测量之间要区分一个重要关系,即一个稳态荧光强度观测是一系列瞬态荧光发射在一定时间内的叠加,叠加后瞬态发射细节被平均。一个简单的公式可以帮助理解稳态荧光强度和瞬态荧光强度之间的关系。假设某分子的荧光瞬态光强度可以用单指数模型表示(It=I0e-t/τ),则其稳态荧光强度和瞬态光强度的关系如式(4)所示[19]。
式中:ISS为稳态荧光强度;I0为分子被激发后的瞬态荧光强度,与荧光分子浓度和仪器参数有关;τ为衰减时间;t为时间变量[19]。
式(4)表明稳态荧光强度是各个瞬态荧光强度的积分,从而体现稳态荧光测量无法实现对荧光发射的瞬态监测,这会导致时间平均效应的产生[19]。因时间尺度的缺乏,稳态荧光测量中分子荧光的发射模式细节信息因时间平均效应丢失。
时间平均效应造成的稳态荧光测量信息损失可以通过2 个例子理解。例一:荧光探针的表观荧光寿命和其绑定的分子构象有关。通过时间分辨荧光测量可以区分出因分子构象不同造成的表观寿命差异,进而确定分子不同构象的存在,而通过稳态荧光测量只能得到一段时间内荧光发射强度的积分值,因此无法确定分子是否存在不同构象。例二:假设肽链上有2 个色氨酸残基,其中一个处于肽链的伸展结构中,另一个处于肽链的折叠结构中,因为二者所处的微环境不同会造成表观荧光寿命的不同,因此通过时间分辨荧光测量可以体现出这种区别,而2 个色氨酸残基结构一致,经过时间平均效应作用后,二者的稳态荧光测量中荧光强度和峰形并没有明显区别[20-23]。这2 个例子说明瞬态荧光测量可以获得微时间尺度上荧光分子本身和微环境的信息,而稳态荧光测量则因时间平均效应丢失了发射的细节信息。
另外,基于强度的稳态荧光测量由于荧光分子的不均一性、光漂白作用或者光电子漂移等作用,会导致分析物浓度和其他因素(如温度和pH值)造成稳态荧光测量不准确。荧光寿命受荧光分子浓度的影响较小,因此以荧光寿命替换荧光强度作为检测指标获得了广泛的关注[24],而TRF正是这种替换实现的方法。
荧光现象多发生在纳秒级,这正好是分子运动所发生的时间尺度。因此利用分辨率为纳秒级的TRF可以监测到许多复杂的分子间作用过程,例如超分子体系中分子间的簇集、固液界面上吸附态高分子的构象重排、蛋白质高级结构的变化等。目前,TRF非常成熟,时间分辨率从纳秒级到皮秒级的时间分辨荧光仪都有较成熟的产品,这些不同级别的时间分辨荧光仪为不同程度研究食品分子的动态过程、互作机制和生产加工中的检测应用研究等领域提供了技术保障。综上分析表明,TRF在食品分子的检测研究中必将得到广泛应用。
TRF在食品检测领域有很多应用,例如食品成分分析、真菌及其毒素、农药残留的检测等。作为一种检测技术,TRF还通过和其他技术联用以提高检测灵敏度、检测限等指标,例如TRF结合荧光探针技术检测蛋白质构象的转变,TRF与聚合酶链式反应(polymerase chain reaction,PCR)技术相结合用于检测食品中特异的靶DNA序列[25]。
2.1 时间分辨荧光技术在食品成分分析中的应用
Apperson等[26]运用时间分辨各项异性荧光光谱技术对啤酒中亲水性蛋白的构象进行了研究,结果表明亲水性蛋白的半径约为3.5 nm,指出啤酒中的荧光胺可作为啤酒中蛋白含量的标志,并说明荧光寿命可以表征不同工艺阶段啤酒的特性。Lemos等[27]对4 种加工工艺下的紫薯活性物质进行时间分辨荧光分析,结果表明紫薯加工工艺影响荧光发射性质,并且长波发射段的变化反映了其中花青素的变化。
Ding Fei等[28]用稳态荧光和TRF证实了人血清蛋白-黄酮苷复合物的形成是由于色氨酸的减少造成的,并通过荧光寿命的研究指出该复合物的形成属于静态机制。Qi等[29]应用TRF研究了果胶对乳球蛋白的结构和热稳定性的影响。结果表明,荧光寿命参数可以很好地体现乳球蛋白结构的变化。Ma Ji等[30]通过TRF研究了3,7-二羟黄酮对人血清白蛋白的影响,结果表明随着3,7-二羟黄酮浓度的上升,人血清白蛋白的平均荧光寿命从5.68 ns降低到了4.35 ns,说明“环境分子”对荧光素荧光寿命影响较大。Basu等[31]研究了食品着色剂酒石黄对人体血红蛋白的毒理作用,指出人体血红蛋白在酒石黄作用下存在着色不足的情况,酒石黄的存在改变了血红蛋白中色氨酸的微环境,而TRF检测到了色氨酸微环境的改变。
Takahashi等[32]用时间分辨荧光各向异性技术证实了苦瓜胰蛋白酶中色氨酸残基摆动的自由度受到了抑制剂的影响。Faria等[33]运用时间分辨荧光发射谱进行了单线态氧对微胶囊中类胡萝卜素和生育酚衍生物的荧光猝灭效应的研究,表明激发态分子形成是瞬时的,并且其荧光衰减速率比单体分子快很多。
上述研究范围涉及食品加工领域检测、食品生物分子互作机制研究和外界刺激对食品生物分子作用的研究。这些TRF的研究应用,表明其是一种颇有前途的技术方法。某些研究仅停留在荧光现象-分子现象的关联阶段,其中的作用机制仍需要进一步分析,TRF的潜力有待发挥。目前,越来越多的学者应用TRF对食品生物分子进行研究,TRF必将在这一领域得到充分发展。
2.2 时间分辨荧光技术在食品污染检测中的应用
2.2.1 时间分辨荧光技术在食品中真菌及其毒素检测中的应用
Tu Shui等[34]应用时间分辨免疫荧光技术对鸡蛋中的沙门氏菌进行了检测,检测灵敏度达到了1 CFU/50 g,检测时间由原来的20 h缩短到了5 h。Majdinasab等[35]应用时间分辨荧光结合免疫层析技术对食品中的赭曲霉素A进行了检测,表明该方法的灵敏度比免疫层析法高。Rasch等[36]对谷物中黄曲霉毒素进行TRF应用研究,结果表明TRF可以去除高强度的背景光,提高毒素检测灵敏度。Cohen等[37]应用时间分辨福斯特共振能量转移免疫荧光技术建立了一种一步检测鼠疫杆菌、炭疽杆菌、肉毒杆菌毒素的方法,该方法比酶联免疫技术简便、耗时少,实现了食品中3 种污染菌的高效快速检测。Huang Yunkun等[38]建立了一种基于竞争性猝灭原理的TRF检测食品中蓖麻毒素的方法,该方法和酶联免疫技术相比相关性更好,并且被认为是一个灵敏度高、可靠和方便的检测技术,在其他检测上也能够实现很好的应用。
2.2.2 时间分辨荧光技术在食品农药残留检测中的应用
Leivo等[39]应用TRF结合荧光免疫法对牛奶中氟喹诺酮检测,其线性范围为0.2~68.0 μg/L,并指出这种检测方法可以进一步优化以实现各种牛奶样品中氟喹诺酮的检测。Zhou Bin[40]应用时间分辨荧光免疫技术建立了检测食品中恩诺沙星污染的方法,其灵敏度很高,检测限为0.01 ng/mL;该方法在鳗鱼、猪肉和鸡肉中的检测限为1 μg/kg,在蜂蜜中的检测限为1 μg/L。该方法和酶联免疫技术在鳗鱼恩诺沙星的检测中一致性很高,是可信度很高的技术,并指出该技术是一个简便、灵敏度高、经济的技术,适用于大批样品的氟喹诺酮类污染的检测。Shi Haiyan等[41]建立了双标签时间分辨免疫荧光技术在食品中同时检测对硫磷和吡虫啉的应用。通过荧光标签标记以上两种农残,可以实现这两种农残的高灵敏度检测,并在大米、西红柿、大白菜上实现了成功应用。Ma Zhihong等[42]建立了一种非直接竞争性时间分辨荧光免疫分析方法,该法在谷物食品中玉米烯酮类毒素的检测中得到了良好应用,检测限达到了0.2 ng/mL,且该方法的效果在10 个玉米和6 个小麦样本中得到了验证。
以上研究表明,TRF对食品中污染分子的检测大多采用和荧光标记技术联用的形式。通过标记,提高了检测针对性,通过高灵敏度的TRF应用,提高了检测限,这一研究思路仍可为后续的研究提供借鉴。通过TRF和分离、纯化、标记等技术联用后,可以扩展TRF在食品污染检测中应用范围,研究深度也将大大提高。
食用植物油中含有荧光物质,这些荧光物质有内源和外源之分。内源荧光物质主要有叶绿素、类胡萝卜素、酚类等,外源荧光物质有苯并芘等氧化产物,黄曲霉毒素等毒素,油脂贮运、制取过程中的农药等残留物[43]。食用油中这些外源和内源荧光物质的存在为TRF的应用奠定了物质基础。
根据目标分析物的来源,TRF对食用植物油的检测有2 种应用方案。方案一:荧光来自外源荧光素,检测时植物油中会出现新的荧光寿命值,借此可分析食用植物油是否遭到了污染。方案二:荧光来自内源荧光素,检测其荧光寿命可以反映食用植物油的品质信息;也可通过时间分辨荧光发射测量,获得食用植物油的“指纹”谱,并借此区分不同种类的食用植物油。
Mu Taotao等[44]运用时间分辨荧光强度衰变谱结合等高线图对9 种食用植物油进行了种类鉴别。结果表明,这9 种食用植物油可以被100%区分。同时该研究指出时间分辨荧光强度衰变谱结合等高线图对食用油进行种类鉴别是一种辨识率高、辨识速率快的技术,辨识结果可靠准确方法。
Navarra等[45]运用TRF对特级初榨橄榄油的抗氧化性进行了研究。结果表明,橄榄油中叶绿素的荧光寿命随热氧化过程成中黏度的上升而上升。由此可知,通过内源荧光分子叶绿素荧光寿命的测量,可以一定程度上反映植物油热氧化情况。
综上所述,TRF在食用植物油品种识别和反映食用植物油品质信息方面的应用是可行的,但是因为食用植物油是混合体系,其中荧光素种类多、荧光素存在状态不明晰等原因,其识别和反映状态信息的机理、具体的分析方法尚待研究。笔者相信,通过食用植物油的时间分辨荧光测量,可以从一种新的角度对食用植物油进行解析,获得对食用植物油性质的深刻理解,从而为处理食用植物油掺假和品质评价等问题提供强有力的技术支持和理论解释。
TRF在食品检测中的应用方兴未艾。应用TRF可从分子水平获取食品的状态信息,为食品成分分析、食品污染检测和食品掺杂确定提供有力的技术支持。随着仪器技术的发展和检测理论研究的深入,TRF在食品品质检测领域将会得到广泛应用。
参考文献:
[1] POTER G. Flash photolysis and some of its applications[J]. Science, 1968, 160: 1299-1307. DOI:10.1126/science.160.3834.1299.
[2] 郭础. 时间分辨光谱基础[M]. 北京: 高等教育出版社, 2012: 2-3; 86; 155-189; 284.
[3] 金晶, 赖卫华, 涂祖新, 等. 时间分辨荧光免疫分析技术的研究进展及在食品安全领域中的应用[J]. 食品科学, 2006, 27(12): 886-889.
[4] EINSTEIN A. Über einen die erzeugung und verwandlung des lichtes betreffenden heuristischen gesichtspunkt[J]. Annalen der Physik, 1905, 322(6): 132-148. DOI:10.1002/andp.19053220607.
[5] 贝克尔. 高级时间相关单光子计数技术[M]. 屈军乐, 译. 北京: 科学出版社, 2009: 10-19; 57-59; 286-287.
[6] KRIEGER U K, CORTI T, VIDEEN G. Using photon-counting histograms to characterize levitated liquid aerosol particles with a single, solid inclusion[J]. Journal of Quantitative Spectroscopy and Radiative Transfer, 2004, 89(1/2/3/4): 191-200. DOI:10.1016/ j.jqsrt.2004.05.022.
[7] CHIRICO G, OLIVINI F, BERETTA S. Fluorescence excitation volume in two-photon microscopy by autocorrelation spectroscopy and photon counting histogram[J]. Applied Spectroscopy, 2000, 54(7): 1084-1090. DOI:10.1366/0003702001950607.
[8] GOPICH I V, SZABO A. Photon counting histograms for diffusing fluorophores[J]. Journal of Physical Chemistry B, 2005, 109(37): 17683-17688. DOI:10.1021/jp052345f.
[9] ANIKOVSKY M, WILTSHIRE Z D, WEISSHART K, et al. Photon counting histogram analysis for two-dimensional systems[J]. Chemphyschem: a European Journal of Chemical Physics and Physical Chemistry, 2011, 12(13): 2439-2448. DOI:10.1002/cphc.201100414.
[10] PERROUD T D, HUANG Bo, ZARE R N. Effect of bin time on the photon counting histogram for one-photon excitation[J]. Chemphyschem, 2005, 6(5): 905-912. DOI:10.1002/cphc.200400547.
[11] HUANG Bo, PERROUD T D, ZARE R N. Photon counting histogram: one-photon excitation[J]. Chemphyschem: a European Journal of Chemical Physics and Physical Chemistry, 2004, 5(10): 1523-1531. DOI:10.1002/cphc.200400176.
[12] KRICHEL N J, MCCARTHY A M, RECH I, et al. Cumulative data acquisition in comparative photon-counting three-dimensional imaging[J]. Journal of Modern Optics, 2010, 58(3/4): 244-256. DOI:10.1080/09500340.2010.519445.
[13] VINOGRADOV S, VINOGRADOVA T, FUTLIK L, et al. Characterization of single photon detection in solid state photomultipliers using multi-photon transit time histograms[J]. Journal of Instrumentation, 2011, 6(2): 105-108. DOI:10.1088/1748-0221/6/02/P02013.
[14] LI Hua, FANG Xueen, CAO Hongmei, et al. Paper-based fl uorescence resonance energy transfer assay for directly detecting nucleic acids and proteins[J]. Biosensors and Bioelectronics, 2016, 80: 79-83. DOI:10.1016/j.bios.2015.12.065.
[15] GENG Linhua, YANG Xiaofeng, ZHONG Yaogang, et al. “Quinonephenol” transduction activated excited-state intramolecular proton transfer: a new strategy toward ratiometric fluorescent probe for sulfite in living cells[J]. Dyes and Pigments, 2015, 120: 213-219. DOI:10.1016/j.dyepig.2015.04.016.
[16] FALKLOF O, BO D. Red-light absorption and fluorescence of phytochrome chromophores: acomparative theoretical study[J]. Chemical Physics, 2013, 425: 19-28. DOI:10.1016/ j.chemphys.2013.07.018.
[17] ROCHAT S, SWAGER T M. Conjugated amplifying polymers for optical sensing applications[J]. ACS Applied Materials & Interfaces, 2013, 5(11): 4488-4502. DOI:10.1021/am400939w.
[18] DESHPANDE S S. Principles and applications of luminescence spectroscopy[J]. Critical Reviews in Food Science and Nutrition, 2001, 41(3): 155-224. DOI:10.1080/20014091091797.
[19] LAKOWICZ J R. Principles of fl uorescence spectroscopy[M]. 3rd ed. New York: Springer, 2006: 9-15. DOI:10.1007/978-0-387-46312-4.
[20] ALBANI J R. Origin of tryptophan fluorescence lifetimes. part 1: fl uorescence lifetimes origin of tryptophan free in solution[J]. Journal of Fluorescence, 2013, 24(1): 93-104. DOI:10.1007/s10895-013-1277-8.
[21] ALBANI J R. Origin of tryptophan fluorescence lifetimes. part 2: fluorescence lifetimes origin of tryptophan in proteins[J]. Journal of Fluorescence, 2014, 24(1): 105-117. DOI:10.1007/s10895-013-1274-y.
[22] WANG Xin, CUI Jin, LI Wei, et al. γ-Secretase modulators and inhibitors induce different conformational changes of presenilin 1 revealed by FLIM and FRET[J]. Journal of Alzheimer’s Disease, 2015, 47(4): 927-937. DOI:10.3233/JAD-150313.
[23] SHI Xiangguo, PARKS J H. Fluorescence lifetime probe of biomolecular conformations[J]. Journal of the American Society for Mass Spectrometry, 2010, 21(5): 707-718. DOI:10.1016/ j.jasms.2010.01.009.
[24] COLLIER B B, MCSHANE M J. Time-resolved measurements of luminescence[J]. Journal of Luminescence, 2013, 144(12): 180-190. DOI:10.1016/j.jlumin.2013.06.034.
[25] 游冬青, 陈杞. TRF检测法在核酸分析中的应用[J]. 国外医学(放射医学核医学分册), 1996(4): 161-164.
[26] APPERSON K, LEIPER K A, MCKEOWN I P, et al. Beer fl uorescence and the isolation, characterisation and silica adsorption of haze-active beer proteins[J]. Journal of the Institute of Brewing, 2002, 108(2): 193-199. DOI:10.1002/j.2050-0416.2002.tb00540.x.
[27] LEMOS M A, ALIYU M M, HUNGERFORD G. Inf l uence of cooking on the levels of bioactive compounds in Purple Majesty potato observed via chemical and spectroscopic means[J]. Food Chemistry, 2015, 173: 462-467. DOI:10.1016/j.foodchem.2014.10.064.
[28] DING Fei, DIAO Jianxiong, SUN Ye, et al. Bioevaluation of human serum albumin-hesperidin bioconjugate: insight into protein vector function and conformation[J]. Journal of Agricultural and Food Chemistry, 2012, 60(29): 7218-7228. DOI:10.1021/jf300424w.
[29] QI P X, WICKHAM E D, GARCIA R A. Structural and thermal stability of beta-lactoglobulin as a result of interacting with sugar beet pectin[J]. Journal of Agricultural and Food Chemistry, 2014, 62(30): 7567-7576. DOI:10.1021/jf502699g.
[30] MA Ji, LIU Yuan, CHEN Luan, et al. Spectroscopic investigation on the interaction of 3,7-dihydroxyf l avone with different isomers of human serum albumin[J]. Food Chemistry, 2012, 132(1): 663-670. DOI:10.1016/j.foodchem.2011.11.023.
[31] BASU A, KUMAR G S. Multispectroscopic and calorimetric studies on the binding of the food colorant tartrazine with human hemoglobin[J]. Journal of Hazardous Materials, 2016, 318: 468-476. DOI:10.1016/j.jhazmat.2016.07.023.
[32] TAKAHASHI D, MATSUMOTO S, NISHIMOTO E, et al. Heterogeneous packing in the folding/unfolding intermediate state of bitter gourd trypsin inhibitor[J]. Bioscience Biotechnology and Biochemistry, 2008, 72(6): 1498-1505. DOI:10.1271/bbb.80009.
[33] FARIA A F, MIGNONE R A, MONTENEGRO M A, et al. Characterization and singlet oxygen quenching capacity of spraydried microcapsules of edible biopolymers containing antioxidant molecules[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 8004-8011. DOI:10.1021/jf100925j.
[34] TU Shui, GEHRING A, PAOLI G C. Detection of Salmonella enteritidis in shell egg contents by immunomagnetic capture and timeresolved fl uorescence[J]. Journal of Rapid Methods and Automation in Microbiology, 2007, 15(1): 107-119. DOI:10.1111/j.1745-4581.2007.00081.x.
[35] MAJDINASAB M, SHEIKH Z M, SOLEIMANIAN Z S, et al. A reliable and sensitive time-resolved fluorescent immunochromatographic assay (TRFICA) for ochratoxin A in agro-products[J]. Food Control, 2015, 47: 126-134. DOI:10.1016/j.foodcont.2014.06.044.
[36] RASCH C, KUMKE M, LOHMANNSROBEN H G. Sensing of mycotoxin producing fungi in the processing of grains[J]. Food and Bioprocess Technology, 2010, 3(6): 908-916. DOI:10.1007/s11947-010-0364-y.
[37] COHEN N, ZAHAVY E, ZICHEL R, et al. An internal standard approach for homogeneous TR-FRET immunoassays facilitates the detection of bacteria, biomarkers, and toxins in complex matrices[J]. Analytical and Bioanalytical Chemistry, 2016, 408(19): 5179-5188. DOI:10.1007/s00216-016-9602-0.
[38] HUANG Yunkun, CHEN Xiujuan, WU Shijia, et al. Homogeneous time-resolved fluorescence assay for the detection of ricin using an aptamer immobilized on europium-doped KGdF4 nanoparticles and graphene oxide as a quencher[J]. Microchimica Acta, 2014, 182(5): 1035-1043. DOI:10.1007/s00604-014-1422-3.
[39] LEIVO J, LAMMINMAKI U, LOVGREN T, et al. Multiresidue detection of fl uoroquinolones: specif i city engineering of a recombinant antibody with oligonucleotide-directed mutagenesis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(49): 11981-11985. DOI:10.1021/jf403715n.
[40] ZHOU Bin, ZHANG Kai, ZHANG Jue, et al. A novel and sensitive method for the detection of enrof l oxacin in food using time-resolved fl uoroimmunoassay[J]. Toxicology Mechanisms and Methods, 2013, 23(5): 323-328. DOI:10.3109/15376516.2012.757685.
[41] SHI Haiyan, SHENG Enze, LU Feng, et al. Simultaneous detection of imidacloprid and parathion by the dual-labeled time-resolved fl uoroimmunoassay[J]. Environmental Science and Pollution Research, 2015, 22(19): 14882-14890. DOI:10.1007/s11356-015-4697-y.
[42] MA Zhihong, HUANG Biao, ZHANG Jue, et al. Time-resolved fluoroimmunoassay of zearalenone in cereals with a europium chelate as label[J]. Journal of Rare Earths, 2009, 27(6): 1088-1091. DOI:10.1016/S1002-0721(08)60393-2.
[43] 王兴国. 油料科学原理[M]. 北京: 中国轻工业出版社, 2011: 286-287.
[44] MU Taotao, CHEN Siying, ZHANG Yinchao, et al. Characterization of edible oils using time-resolved fl uorescence[J]. Analytical Methods, 2013, 6(3): 940-943. DOI:10.1039/c3ay41552j.
[45] NAVARRA G, CANNAS M, D’AMICO M, et al. Thermal oxidative process in extra-virgin olive oils studied by FTIR, rheology and timeresolved luminescence[J]. Food Chemistry, 2011, 126(3): 1226-1231. DOI:10.1016/j.foodchem.2010.12.010.
Time-Resolved Fluorescence Technique and Its Application in Food Quality Detection
CHEN Hui1, QI Xingpu1,2, GUO Li1, LI Feng3, LU Daoli1, CHEN Bin1,*
(1. School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China; 2. Jiangsu Agri-Animal Husbandry Vocational College, Taizhou 225300, China; 3. Aff i liated Hospital of Jiangsu University, Zhenjiang 212001, China)
Abstract:Time-resolved fluorescence technique is a relatively new technique that has many applications in the field of food quality detection. This review outlines the principle and features of time-resolved fluorescence technique, and pointed out that this technique allows dynamic measurement of fluorescence emission to obtain detailed information. Moreover, its applications in food quality analysis are also summarized and some strategies for its application are put forward for quality analysis of vegetable oil. At last, we conclude with some perspectives on the future application of time-resolved fl uorescence technique in the fi eld of food quality detection.
Key words:time-resolved fl uorescence technique; dynamic measurement; quality analysis; vegetable oil
DOI:10.7506/spkx1002-6630-201715040
中图分类号:TS207.7
文献标志码:A
文章编号:1002-6630(2017)15-0250-06
引文格式:
陈晖, 祁兴普, 郭丽, 等. 时间分辨荧光技术在食品品质检测中的应用[J]. 食品科学, 2017, 38(15): 250-255.
DOI:10.7506/spkx1002-6630-201715040. http://www.spkx.net.cn
CHEN Hui, QI Xingpu, GUO Li, et al. Time-resolved fl uorescence technique and its application in food quality detection[J]. Food Science, 2017, 38(15): 250-255. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715040. http://www.spkx.net.cn
收稿日期:2016-08-08
基金项目:国家自然科学基金面上项目(31271874)
作者简介:陈晖(1988—),男,博士,研究方向为食品品质光学检测。E-mail:greatlodge@hotmail.com
*通信作者:陈斌(1960—),男,教授,博士,研究方向为食品品质无损检测。E-mail:ncp@ujs.edu.cn