
图1 通过水热法处理黄瓜汁合成N/S/P-CDs的示意图[17]
Fig. 1 Schematic illustration of the formation of N/S/P-CDs from hydrothermal treatment of cucumber juice[17]
魏 伟1,2,石星波1,2,3,*,邓放明1,2
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南农业大学东方科技学院,湖南 长沙 410128;3.湖南大学 化学生物传感与计量学国家重点实验室,湖南 长沙 410082)
摘 要:碳量子点(carbon dots,CDs)作为一类新型的荧光纳米材料,具备很多优良的光学特性。相比于半导体量子点,其毒性低、生物相容性好、稳定性与抗光漂白性更高,这些优良的性质使其在检测食品中重金属、抗生素、病原菌、农药残留与违禁添加剂以及营养功能成分等方面有很好的发展前景。近年来,有关CDs的文献综述着重于总结其合成与光学性质,鲜有关于CDs在食品检测中的应用。本文介绍CDs的光学性质与合成方法,重点综述CDs在食品检测中的应用,并提出未来CDs的发展趋势。
关键词:碳量子点;光学性质;重金属;抗生素;病原菌
2004年,Xu Xiaoyou等[1]通过电弧放电的方法合成了单壁碳纳米管,在将其悬浮液进行分离纯化时,发现了新型荧光纳米材料碳量子点(carbon dots,CDs),进而引发一系列关于CDs荧光性质、合成方法和应用方面的研究。研究表明,CDs具有上转换荧光特性、激发波长和发射波长的可调控性、较高的稳定性与抗光漂白性等优良性质[2-4]。相比于半导体量子点,CDs较低的毒性和较高的生物相容性,使其在生物成像和化学生物传感等方面成为半导体量子点的有力竞争者,实际应用有望更为广泛。近几年,有关CDs的荧光性质与合成方法等方面的综述较多[5],而鲜有关于CDs应用于食品检测等方面的文献总结。本文基于近年来关于CDs的最新研究,介绍了CDs的荧光性质与合成方法,重点综述CDs在食品检测中的应用。
1.1 荧光产生机理
一般认为,纳米颗粒的尺寸与其激子的波尔半径相近时,电子-空穴对的运动被限制在小尺寸的势阱中,进而分成准分立的类分子能级。而发光的过程则是电子-空穴对的复合过程,CDs的发光也就是这种电子-空穴对的复合发光。CDs尺寸越大,其发射波长越长[4],即量子尺寸效应。然而,最近Ding Hui等[6]合成了平均尺寸大小一致,但发射波长不同的CDs,他们认为这是CDs表面的氧化程度不一致导致的。研究表明,表面氧化产生的表面缺陷,可作为激子的俘获中心,产生与表面缺陷态相关的荧光。氧化程度越大,π-电子系统的范围越大,CDs表面态的能级降低就越多,故荧光发射峰的红移程度越大[6-7],他们将这种发光机理表述为表面缺陷态荧光发射理论。这些机理可以各自解释一部分荧光现象,而有些现象则需要几种机理共同解释[7-8]。更为准确地阐述,还需对CDs及其荧光性质做更为深入的研究。
1.2 上转换荧光性质
上转换荧光是一种荧光发射波长比激发波长短的反斯托克斯位移型的荧光发射现象[9]。通常,CDs与生物组织经紫外光照射均发蓝色荧光,从而干扰了CDs在生物体内的荧光分析。而具有上转换荧光特性的CDs能够吸收近红外区的可见光,发射出蓝光。因不需要紫外光照射,降低了生物组织自发荧光的背景,提高了组织的穿透深度和信噪比,使得CDs在生物成像方面具备更多优势[4]。相比掺有镧系元素的稀土纳米颗粒等传统材料,CDs合成简单,省略了复杂的修饰步骤,其上转换性质应用将更为广泛。
1.3 依赖于激发光的荧光性质
CDs普遍具有随着激发波长不同而荧光最大发射波长变化的性质。Zheng Baozhan等[10]对以十六烷基氯化吡啶为底物合成的CDs的研究表明,当激发波长在400 nm以上时,荧光发射峰随着激发波长增大而红移。他们认为这种现象可能与CDs中芳香族的C=C键和来自于C—OH、C=O基团的表面缺陷有关。与此同时,利用柠檬酸铵和乙二胺合成的CDs也具有这种性质。实验证明,其表面缺陷和较窄的大小分布可能与此现象相关[11]。这种荧光现象的发现,佐证了表面缺陷态有关的荧光产生机理。
1.4 依赖于pH值的荧光性质
研究表明,依赖于pH值的荧光性质与CDs表面功能基团的质子化与去质子化有关。CDs中存在石墨型和吡啶型氮原子,只有吡啶型氮才可接受质子。随着pH值减小,CDs的吡啶型氮逐渐被质子化,电子可从质子化的氮转移到与之相邻的共轭结构的碳原子上,从而提高荧光强度[12]。Qian Zhaosheng等[12]研究表明,随着pH值增大,荧光发射峰发生蓝移,且荧光强度随pH值而变化。当pH≤5 时,CDs荧光强度基本不变,他们认为可能是在pH 5时,CDs中氮位点的质子处于饱和状态,导致多余的质子不能结合到氮原子上。进一步说明作为荧光发射活性位点的氮,对CDs的荧光有很大影响。同时,利用pH值与荧光强度间的关系,可以开发酸碱传感器[13]。其中,Wang Chuanxi等[14]发现从pH 3~9的变化过程中,CDs的溶液颜色由淡黄色变为深黄色,且可以往复循环多次,荧光强度几乎不变。
1.5 稳定性与抗光漂白性
较高的稳定性和抗光漂白性是CDs又一重要的光学特性。不管使用何种原材料还是采用不同方法合成的CDs,其荧光强度在6 个月[15]甚至1 年[16]内都能保持基本不变。同时,有关CDs的抗光漂白特性得到了多个课题组的验证。如,Wang Chunfeng等[17]利用紫外光照射合成的CDs 3 h,其荧光强度保持不变;而有的课题组进一步延长照射时间至12 h,发现CDs的荧光强度为初始荧光强度的70%[18];甚至用紫外光照射CDs 24 h,其荧光强度还能保持基本不变[19]。
CDs的合成方法可以归为两类:自上而下法和自下而上法,其中自上而下法是利用物理、化学方法将较大的碳结构破碎为纳米尺寸的碳结构而产生CDs,如弧放电法、激光销蚀法、电化学氧化法等。相比自上而下法,通过加热、微波处理等方式,利用一些富含碳的分子前体合成CDs的自下而上法,步骤较简单、成本较低、应用更为广泛。基于此,下面将重点介绍自下而上合成法,其中包括水热法、溶剂热法、微波消解法和超声振荡法。
2.1 水热法
水热法是目前CDs合成与研究较为热门的一种方法,它是直接加热有机分子前体的水溶液而获得CDs的方法。水热法合成原材料来源广泛且成本低廉,如氨基酸[15]、柠檬酸[9]、柠檬酸铵[4]、乙二胺[11]等化学物质都可作为合成CDs的前体物质。近年来,科研工作者更偏向于寻求自然可持续的有机生物原材料,如以黄瓜汁为原材料,加热可合成含氮、硫、磷的CDs(图1)[17]。另外,选用天然蚕丝[20]、土豆[21]、荔枝[22]、椰奶[23]、燕麦片[24]等原材料,也同样获得了高品质的CDs。然而,以上方法需要较高的温度和较长的时间,量子产率一般在50%以下,故选取合适的原材料、低温、短时间合成高量子产率CDs的方法将有更好的前景。如,Zheng Baozhan等[10]以氯化十六烷基吡啶和氢氧化钠为原材料,在室温条件下即可合成量子产率为16.7%的CDs。这些在室温条件下的水热法,再进一步优化量子产率后,有望广泛应用于CDs的合成。

图1 通过水热法处理黄瓜汁合成N/S/P-CDs的示意图[17]
Fig. 1 Schematic illustration of the formation of N/S/P-CDs from hydrothermal treatment of cucumber juice[17]
2.2 溶剂热法
溶剂热法是在通过加热含有机分子前体的有机溶剂而合成CDs的方法。如,Wu Hongyan等[25]以VC为碳源,乙二醇和蒸馏水为溶剂,加热合成了发绿色荧光的CDs。Zhang Yanqing等[26]通过加热CCl4和不同浓度的NaNH2,合成了可发射蓝色、蓝绿色、黄绿色和黄色荧光的CDs。同时,这种掺有氮且被氨基功能化的CDs的量子产率达到22%,高于被胺类化合物钝化的CDs的量子产率。他们进一步研究表明,作为掺入到CDs中的杂原子,其含量的变化实质是改变了CDs表面缺陷发生的概率,这种现象符合表面缺陷效应的荧光产生机理。这种加热有机溶剂来合成CDs的方法,操作相对简单,由于有机溶剂的毒性,在应用方面不及水热合成法。
2.3 微波消解法
微波消解法是利用微波消解含碳的前体分子而合成CDs的方法,因其操作简单、合成时间短而受到科研工作者的青睐。比如以蔗糖为碳前体、磷酸为氧化剂,混合后于微波炉中100 W加热3 min 40 s,可以合成发绿色荧光的CDs[27]。同样也可在微波炉中750 W加热丙三醇和磷酸盐溶液14 min来合成CDs,且不需要额外的表面钝化剂[28]。此外,Liu Changjun等[29]以4,7,10-三氧-1,13-十三烷二胺为钝化剂,因在微波消解丙三醇的过程中完成了对CDs的表面钝化,使CDs的量子产率从4.63%提高到了12.02% ,并证明了表面钝化可改善CDs荧光性质。但这种方法的量子产率普遍不高,需要继续优化合成原材料与合成条件。
2.4 超声波振荡法
超声波振荡法是通过提高溶液混合和反应的速率,促进原料聚合、碳化而形成CDs的一种方法。Ma Zheng等[30]于室温条件下,超声处理葡萄糖和氨水的混合液24 h,得到了掺有氮的CDs。这种方法合成的CDs,其发射光谱宽(从可见区扩展到近红外区),同时还存在上转换荧光现象。相比传统的紫外-可见区的荧光性质,近红外区的荧光有背景干扰少、在生物体组织中的穿透力更大等优势,但该合成方法反应时间较长,量子产率较低。
总体而言,这些自下而上的合成方法各有优缺点。寻找绿色、廉价的原材料,使CDs表面容易钝化、功能化,且易于掺入杂原子来改善CDs光学性质的快速、绿色合成方法一直为科研工作者们所热衷。在诸多考虑因素中,寻找绿色的原材料和CDs表面易钝化的特点尤为重要。因在合成过程中,绿色原材料的碳化可完成对CDs表面的钝化,不仅可以提高CDs的量子产率,还能在其表面引入羧基、羟基等功能基团,从而提高其水溶性。同时原材料中存在的杂元素可在合成过程中掺入到CDs,进一步改善荧光性质,扩展其应用领域[22,31]。
独特的光学、理化性质,使纳米材料受到越来越多研究者的关注,其中基于纳米材料的化学生物传感器尤为简单、灵敏、快速。近年来,半导体量子点以其高量子产率和优异的荧光发射性质,在光学传感方面具有很强的竞争力[32-34]。但半导体量子点具有的生物毒性限制了其在多领域的应用。而CDs制备更简单、成本更低,特别是较好的生物相容性、稳定性与抗光漂白性使其应用更广泛。下面将简述CDs在重金属离子、抗生素、病原菌、农药残留与违禁添加剂、食品中营养与功能成分及其他生物分子等方面的检测应用,旨在为科研工作者开展食品检测的相关工作提拱思路。
3.1 重金属离子检测
传统检测重金属离子的方法包括络合滴定法、化学发光法、原子光谱法等,但这些方法灵敏度不高、操作复杂、成本较高。近年来,基于CDs开发的化学传感器已广泛应用于多种重金属离子的高灵敏、快速检测。
考查重金属离子对CDs荧光强度的影响,进而制定利用CDs高灵敏检测重金属离子的策略,是检测重金属离子较为普遍的一种方法。目前,利用这种策略已实现了对Hg2+、Fe3+、Cu2+等离子的检测。Zhou Li等[35]研究表明,Hg2+与羧酸盐或羟基基团相互作用使得CDs之间相互靠近,通过电子转移途径促进激子的无辐射再结合,导致CDs荧光强度降低。而加入的生物巯基化合物与CDs表面的Hg2+的结合力更大,导致Hg2+与CDs分离,CDs荧光恢复(图2)。基于Hg2+对CDs的荧光猝灭效应,他们对Hg2+实现了线性范围为0.0~3.0 μmol/L、检出限为4.2 nmol/L的高灵敏检测,并根据荧光恢复的荧光强度与生物巯基化合物(半胱氨酸、同型半胱氨酸和谷胱甘肽)浓度间的线性关系,实现了对生物巯基化合物(半胱氨酸、同型半胱氨酸和谷胱甘肽)的检测,其检测限分别为4.9、6.1、8.5 nmol/L。目前诸多课题组已开展了与检测Hg2+相关的工作,主要在降低检测限与拓宽线性范围两方面[11,17,23]。
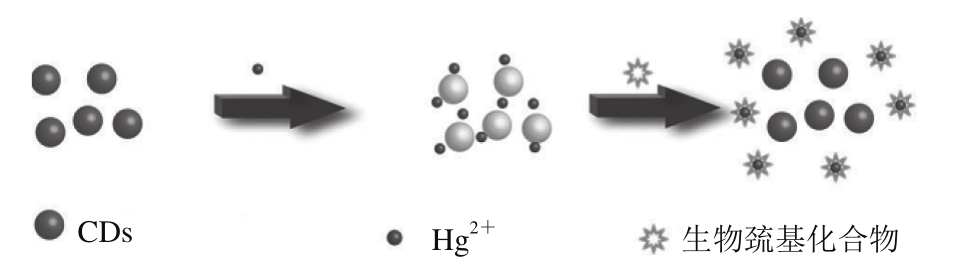
图2 利用CDs检测Hg2+与生物巯基化合物的原理示意图[35]
Fig. 2 Schematic illustration of the detection of Hg2+and biothiols using CDs[35]
Fe3+对CDs的猝灭作用体现在Fe3+与CDs可以形成稳定的化合物,即Fe3+与CDs表面的酚羟基相互作用,进而发生无辐射电子转移或能量转移[3,21,36]。根据此原理,Wen Xiangping等[37]通过不断提高Fe3+的浓度,使混合液中CDs荧光强度逐渐下降,实现了高灵敏检测Fe3+。其线性范围为50 nmol/L~10 μmol/L、检出限为27 nmol/L。而Qian Zhaosheng等[12]发现Fe2+对CDs的荧光强度影响不大,但在检测体系中加入过氧化氢,将Fe2+转化为Fe3+,则可使CDs荧光强度下降,进而开发出检测过氧化氢的方法。值得注意的是,他们基于Ag+对氮原子有亲和力,使CDs带正电,且不同CDs之间的动态碰撞导致正电子数目减少,还首次发现了Ag+对荧光强度有增强作用,其检测Ag+的线性范围为1.00~100.00 μmol/L。
此外,由于Cu2+能与CDs的氮、氧原子结合,而使不同CDs相互靠近,通过电子或能量转移导致CDs荧光猝灭,不同课题组均实现了灵敏检测Cu2+[38-39]。其中Liu Sen等[40]对Cu2+实现了线性范围为0~50 nmol/L、检测限为1 nmol/L的高灵敏检测,且在实际水样中的检出限均远远低于美国环境保护局的检出限(20 μmol/L)。
综合检测不同重金属离子的多种CDs,不难发现不同原材料合成的CDs对检测的离子类型、检测线性范围与检测限都有所不同,这可能是不同原材料合成的CDs的表面功能基团不同所致。对于不同CDs和不同重金属离子的关联性,以及如何影响荧光强度的原理,还需要系统深入地研究。同时不难发现,CDs对检测一些重金属离子的选择性不高,共存离子对检测的干扰较大,因此,未来仍需进一步改善其响应的特异性。
3.2 抗生素的检测
近年来,抗生素在养殖行业的滥用,导致了其在动物源性食品中的高残留,对人类的健康产生很大威胁。由于传统的检测方法不能满足食品中抗生素分析的要求,许多科研工作者基于CDs的荧光性质对多种抗生素的高灵敏、快速检测进行了广泛地探索,研究较多的有四环素及其衍生物、氨苄青霉素、盐酸土霉素。
Yang Xiaoming等[41]根据加入不同浓度的四环素对CDs荧光的不同猝灭效果,实现了高灵敏检测四环素,相应的检出限为7.5 nmol/L。同时对氧四环素、氯四环素和脱氧四环素也进行了定量分析,检出限分别为6.9、4.2、4.8 nmol/L。随后,类似的研究实现了对另一种四环素衍生物——多四环素的检测,其线性检测范围为0.080~60.000 μmol/L、检出限为20 nmol/L[39]。相比其他方法,这种荧光分析方法的线性检测范围更宽、检出限更低和检测更灵敏。
根据特殊的合成原材料,可实现对CDs合成原材料本身的灵敏检测。Mishra等[42]利用葡萄糖和不同量的氨苄青霉素合成了荧光性质不同的CDs,发现CDs在340 nm波长处的吸收值与氨苄青霉素的含量(18.9~572.0 μmol/L)存在线性关系,其检出限为16.5 μmol/L。同时,CDs的荧光强度也随氨苄青霉素的含量(0.0~190.0 μmol/L)呈线性变化,因此,也可以用于检测氨苄青霉素。
另外,利用Fe3+猝灭CDs荧光的机理及竞争络合作用,根据加入盐酸土霉素的量与CDs荧光恢复的关系,可实现高灵敏检测盐酸土霉素,其线性范围为0.10~2.70 μmol/L、检出限为22.8 nmol/L,且在牛乳样品中的回收率为92.5%~103.0%[43]。
3.3 病原菌的检测
由于沙门氏菌、金黄色葡萄球菌、大肠杆菌等病原菌易通过饮食途径而感染人体,引发疾病,病原菌的检测和定量技术在食品相关领域变得越来越重要。检测病原菌的传统方法由于耗时、步骤繁多等因素越来越不能满足对快速灵敏的检测要求。基于CDs的荧光分析法尤以灵敏度高、选择性高、操作简单、检测快速等而成为诸多科研工作者研究的热点。
Wang Renjie等[44]基于CDs的较高生物相容性与稳定性,通过设计的生物传感器可实现快速灵敏检测鼠伤寒沙门氏菌。他们以表面带有羧基的CDs与连有氨基的适配体为荧光探针,通过适配体与细菌膜蛋白的特异性结合,使荧光探针与细菌相连。根据细菌上可识别位点,在优化荧光探针的最佳体积和最佳细菌培养时间后,可得到不同浓度CDs标记的鼠伤寒沙门氏菌与总体荧光强度之间的线性关系,进而开发出检出限为50 CFU/mL的荧光分析法。
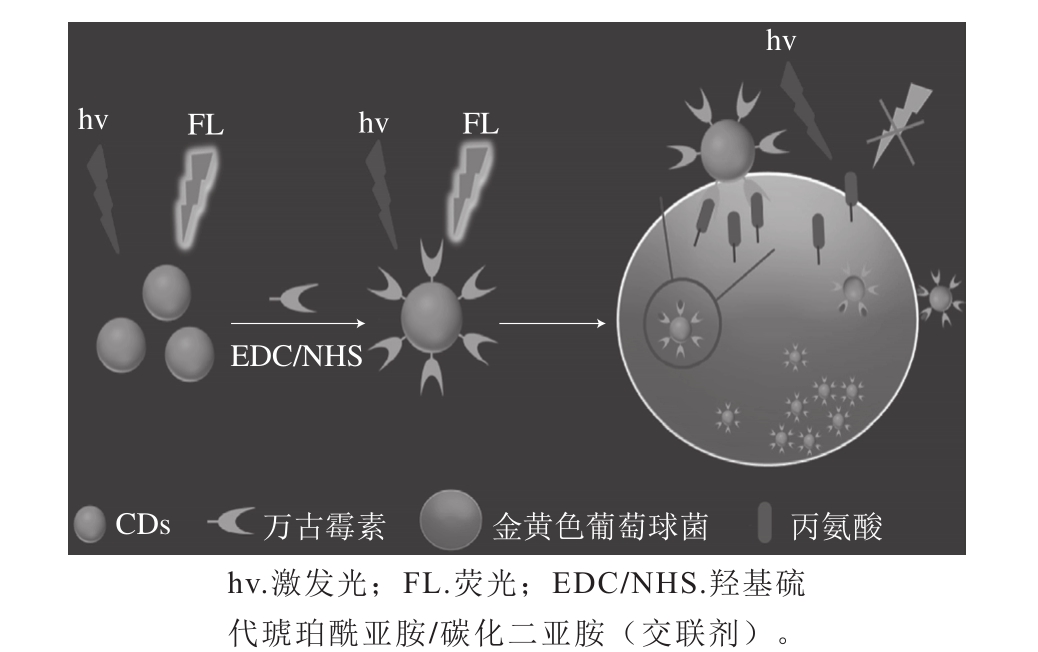
图3 利用CDs检测金黄色葡萄球菌的方法示意图[45]
Fig. 3 Schematic illustration of the detection of Staphylococcus aureus by using CDs[45]
针对牛乳、肉制品等在不清洁环境中易滋生金黄色葡萄球菌,Zhong Dan等[45]利用万古霉素和细胞壁间存在配体-受体相互作用、万古霉素修饰的CDs与革兰氏阳性菌有较强亲和力,通过万古霉素修饰的CDs在细菌表面团聚,导致CDs荧光强度降低的方法提高了检测金黄色葡萄球菌的灵敏度(图3)。他们发现,随着金黄色葡萄球菌浓度不断增大,在3.18×105~1.59×108CFU/mL范围内,CDs的荧光强度逐渐降低,其检出限为9.40×104CFU/mL,并在橘汁中成功实践。该方法也适用于枯草芽孢杆菌(检出限为1.03×105CFU/mL)和单核细胞增多性李斯特氏菌(检出限为9.84×104CFU/mL)等其他革兰氏阳性菌的检测。与此同时,Bhaisare等[46]成功合成出氨基修饰的磁性CDs(magnetic carbon dots,Mag-CDs),利用其荧光特性与磁性分离效应,并基于随金黄色葡萄球菌数量增加,CDs荧光强度增大的现象,实现了对金黄色葡萄球菌的检测,检出限低至3×102CFU/mL。此外,他们利用Mag-CDs表面的氨基可吸附表面带负电的大肠杆菌的特点,实现了对大肠杆菌的灵敏检测,其检出限为3.5×102CFU/mL。
值得注意的是,Lai等[47]借助甘露糖,将饮用水、苹果汁、人体尿液等实际样品的大肠杆菌检出限降至1×102CFU/mL。他们利用甘露糖与大肠杆菌菌毛上的蛋白质的多价结合,可使被甘露糖修饰的CDs特异性标记大肠杆菌,在一定范围内,大肠杆菌浓度和CDs荧光强度的呈线性变化,进而成功应用于样品检测。
3.4 农药残留及违禁添加物的检测
当前,有机磷农药广泛应用于现代农业,残留于食品中的有机磷农药可对人体和环境造成潜在的危害。而传统色谱分析方法对有机磷农药的分析存在一定的局限性,不同课题组热衷于开发以CDs为荧光探针检测有机磷农药的新型荧光分析法。
Hou Juying等[48]基于CDs荧光猝灭、恢复与再猝灭的特性,对有机磷农药敌敌畏实现了灵敏检测,其检出限达到了3.8 nmol/L。实验中,首先利用Cu2+猝灭CDs荧光,而乙酰胆碱酯酶(acetyl cholinesterase,AChE)催化氯代乙酰硫代胆碱(acetylthiocholine chloride,ATChCl)生成硫代胆碱(thiocholine,TCh),TCh可与Cu2+反应使CDs荧光恢复。加入敌敌畏可抑制乙酰胆碱酯酶的活性,从而再猝灭CDs荧光(图4)。根据抑制速率与敌敌畏的浓度对数在6.0~60.0 nmol/L范围内呈线性关系,该方法成功应用于白菜和果汁样品的检测。同时该方法也成功应用于马拉硫磷(检出限为3.4 nmol/L)和乙硫磷 (检出限为4.2 nmol/L)的检测。Hou Juying等[49]还利用AChE可催化硫代乙酰胆碱生成TCh,TCh与5,5-二硫双(2-硝基苯甲酸)生成5-硫-2-氮苯甲酸(5-thio-2-nitrobenzoic acid,TNB);TNB(受体)可与CDs(供体)构成荧光共振能量转移系统,使CDs荧光猝灭;加入有机磷化合物抑制AChE的活性,进而恢复CDs的荧光。依据抑制速率与敌敌畏的浓度对数呈线性关系,得到了线性范围为0.050 0~100.000 0 nmol/L、检出限为0.019 nmol/L的检测效果。该方法同样适用于马拉硫磷和对氧磷的高灵敏检测,其检出限分别为0.048 nmol/L和0.003 5 nmol/L。该检测系统具有抗干扰能力、高稳定性与高选择性。
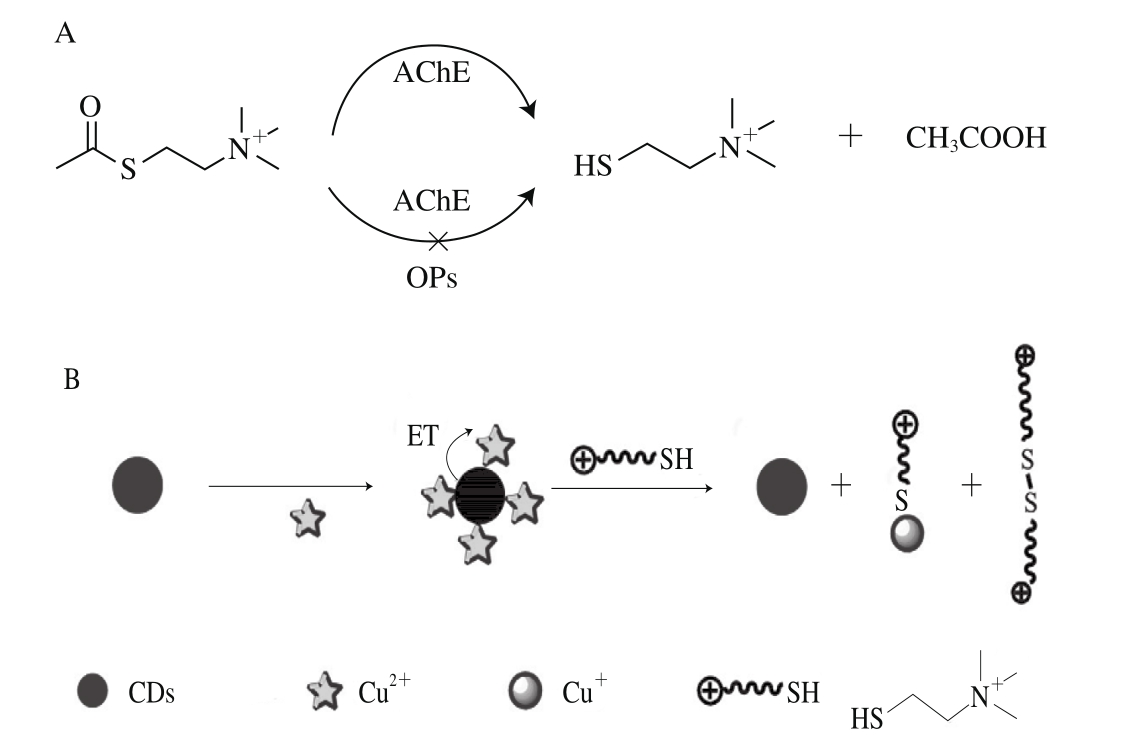
图4 检测有机磷农药的传感器示意图[48]
Fig. 4 Schematic illustration of the working principle of organophosphorus pesticides (Ops) sensor[48]
A. Ops通过抑制AChE活性而影响TCh的生成;B.受Cu2+和TCh的影响,CDs荧光猝灭与恢复;AChE.乙酰胆碱酯酶;CH3COOH.乙酸;Ops.有机磷化合物;ET.电子转移。
除敌敌畏之外,Hou Juying等[50]通过酪氨酸甲酯功能化的CDs对另外一种有机磷杀虫剂——甲基对硫磷,进行了灵敏检测。实验利用酪氨酸酶催化CDs表面的酪氨酸甲酯产生的醌产物(一种电子的受体)可猝灭CDs荧光,再加入有机磷农药,来抑制酪氨酸酶的活性和减轻荧光猝灭的方法,得到抑制率与甲基对硫磷的对数浓度(1.0×10-10~1.0×10-4mol/L)间的线性关系,样品中的检出限为4.8×10-11mol/L,也成功实践于白菜、牛奶和果汁样品。
除草剂也是一类重要的农药残留物。Tao Huilin等[51]以CDs为供体、碲化镉量子点为受体构成的荧光共振能量转移系统,实现了高灵敏检测除草剂绿麦隆。由于能量从CDs转移到CdTe,CdTe荧光强度增大。而后加入的绿麦隆与CdTe通过形成绿麦隆-CdTe基态物质,导致CdTe荧光猝灭,而CDs的荧光基本保持不变。他们以荧光猝灭的程度来衡量绿麦隆的残留量,得出线性范围为2.4×10-10~8.5×10-8mol/L,检出限为7.8×10-11mol/L。相比高效液相色谱法等方法,该方法检出限低、灵敏度高,且在灌溉用水的应用实验中有较高的回收率(98.50%~102.50%)。
作为违禁添加到日常食品和动物饲料来提高含氮量的三聚氰胺,可造成肾结石等危害。Lei Cuihua等[52]基于CDs、三聚氰胺两种物质与汞离子的竞争作用,实现了高灵敏检测三聚氰胺。当汞离子猝灭CDs荧光后,加入的三聚氰胺可通过多氮杂环与汞离子结合,减弱汞离子与CDs间的作用,而使CDs荧光逐步恢复。该方法的检出限(0.300 μmol/L)远低于美国食品药品管理局的标准(20.0 μmol/L)。此外,也可通过以CDs为供体,金纳米颗粒(gold nanoparticle,AuNPs)为受体组成的能量转移系统来检测三聚氰胺[53]。当荧光被AuNPs猝灭后,加入的三聚氰胺凭借氨基键合到AuNPs表面,从而防止CDs与AuNPs作用,使荧光强度增大。根据荧光强度恢复程度与三聚氰胺浓度(50.0~500.0 nmol/L)间的线性关系,可将检出限降至36.0 nmol/L。加之分析快速、成本低、灵敏度高、选择性高,可广泛应用于牛乳制品中三聚氰胺的超灵敏检测[53]。
3.5 食品中营养与功能成分的检测
3.5.1 葡萄糖的检测
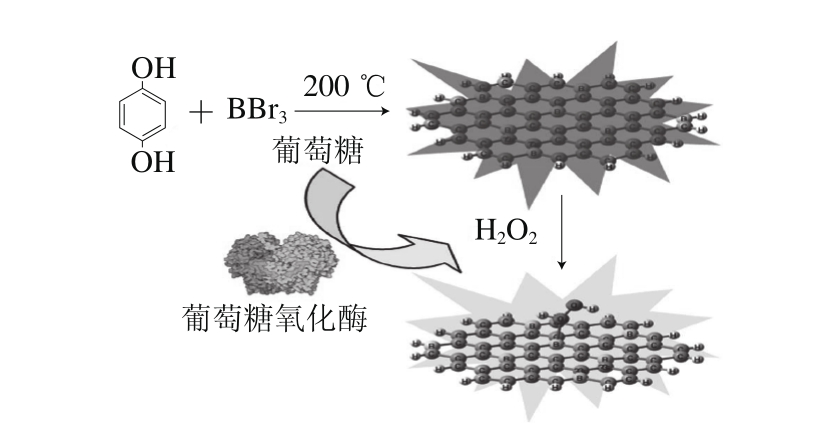
图5 含硼的CDs合成示意图和基于CDs、过氧化氢的葡萄糖检测机理[54]
Fig. 5 Schematic representation of the synthesis of B-doped CDs and the glucose-sensing mechanisms based on B-doped CDs and H2O2[54]
Shan Xiaoyue等[54]发现含硼CDs的荧光可被过氧化氢猝灭,为此,他们基于葡萄糖氧化酶可催化葡萄糖产生葡萄糖酸和过氧化氢,实现了快速高灵敏检测葡萄糖。当葡萄糖氧化酶和葡萄糖同时存在时,CDs荧光的猝灭程度与葡萄糖浓度线性相关,其线性范围为8.00~80.00 μmol/L、检出限为8.00 μmol/L(图5)。
3.5.2 柠檬黄的检测
在研究食品中一些成分对CDs荧光的影响时,有科研工作者根据柠檬黄能猝灭CDs的荧光,实现了对柠檬黄高灵敏的检测,其线性范围为0.250~32.500 μmol/L、检出限为73.0 nmol/L[55]。值得注意的是,该方法在馒头、蜂蜜、冰糖3 种食品中有较好的回收率(24 h内为88.60%~103.40%、48 h内为87.30%~106.60%),表明该方法可广泛应用于食品中柠檬黄的检测。
3.5.3 VB12、VB2、VB9的检测
基于VB12的紫外吸收光谱和CDs的荧光光谱存在明显的光谱重叠,Wang Jilong等[56]设计了以CDs为供体,VB12为受体的荧光共振能量转移体系,当向体系中加入VB12的质量浓度不断增大时,CDs的荧光强度不断降低。根据CDs荧光强度与VB12质量浓度间存在的线性关系,实现了VB12的高灵敏检测。实验中,相对于甘氨酸、酪氨酸、三聚氰胺,CDs对VB12有很好的选择性,同时检出限低至0.1μg/mL。此外,还可对VB2、VB9实现检出限均为1.2 nmol/L的高灵敏检测[57-58]。
3.5.4 植酸的检测
植酸是植物组织(谷类食品、水果和蔬菜等)中磷的主要存在形式。为了给饮食摄入量和新陈代谢提供更有价值的信息,Gao Zhao等[59]利用Fe3+可猝灭CDs荧光,而植酸与Fe3+有更强亲和力的原理,实现了高灵敏检测植酸。具体而言,当CDs荧光被Fe3+猝灭后,加入的植酸可与Fe3+形成复合物,减轻Fe3+对CDs荧光的猝灭效应,使得荧光逐渐恢复。这种分析方法操作简单、成本低、灵敏高(线性范围为0.68~18.69 μmol/L、检出限为0.36 μmol/L),同时在标样和实际样品中具有高选择性、稳定性和回收比例。
3.6 其他生物分子的检测
除了在重金属离子、抗生素、病原菌、农药残留与违禁添加剂、食品中营养与功能成分的检测中发挥了重要的作用外,CDs还可用于检测透明质酸[60]、DNA[61]、凝血酶[62]与ATP[63]等其他生物分子。
Liu Siyu等[60]根据CDs的荧光发射光谱和透明质酸盐-AuNPs的吸收光谱大部分重叠,使带正电的氨基功能化的CDs和带负电的透明质酸盐-AuNPs形成了表面能量转移系统,并以此来定量检测在生理学过程中重要的透明质酸酶。当透明质酸盐-AuNPs猝灭CDs荧光后,加入透明质酸酶,因其能降解透明质酸盐成小分子,导致AuNPs团聚,并从表面能量转移系统脱离,从而使CDs荧光恢复。其线性检测范围为0.1~80.0 U/mL、检出限为0.068 U/mL。同样利用荧光共振能量转移、CDs荧光先猝灭后恢复的原理及DNA碱基互补配对的原理,可广泛应用于食品安全、遗传识别中的DNA检测,该方法更加快速灵敏,线性范围可增至0.04~400.00 nmol/L、检出限可低至17.4 nmol/L[61]。
而尺寸较大的碳纳米颗粒表现出很强的荧光猝灭作用,故可将其用于以能量转移为基础的生物传感中。如Liu Jinhua等[62]利用碳纳米颗粒吸附标有荧光素的凝血酶适配体,从而猝灭荧光素的荧光,当加入凝血酶后,适配体与凝血酶形成的混合物脱离碳纳米颗粒表面,使荧光恢复。基于凝血酶的浓度与荧光恢复的程度,开发了检测凝血酶的生物传感方法。同时利用类似的方法也可灵敏快速检测ATP[63]。
自2004年首次合成CDs以来,多个课题组就合成方法及其应用开展了大量探索工作。相对于自上而下法,利用自下而上法合成CDs的方法由于成本低廉、操作简单、荧光性质多样化,尤其能选用廉价绿色原材料而倍受青睐。未来的CDs的合成方法将朝着利用廉价绿色原材料,一步完成表面钝化和功能化,快速合成的自下而上法方向发展,以期进一步提高CDs量子产率、抗光漂白性及生物相容性。
然而,目前通过不同方法、利用不同原材料合成CDs,致使CDs的组成、结构及表面钝化程度不一致,进而导致其光学理化性质各异,对酸碱度、重金属离子、生物分子等响应的敏感度也不尽相同。复杂的食品基质,进一步了增加CDs在食品检测中的难度,这也正是现今利用CDs分析食品样品的最大阻力。未来基于CDs开发食品中有毒有害物质及营养成分的分析方法时,将着重研究如何提高生物传感方面的响应特异性。
参考文献:
[1] XU Xiaoyou, RAY R, GU Yunlong, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotude fragments[J]. Journal of the American Chemical Society, 2004, 126(40): 12736-12737. DOI:10.1021/ja040082h.
[2] SUN Dong, BAN Rui, ZHANG Penghui, et al. Hair fiber as a precursor for synthesizing of sulfur- and nitrogen-co-doped carbon dots with tunable luminescence properties[J]. Carbon, 2013, 64: 424-434. DOI:10.1016/j.carbon.2013.07.095 .
[3] ZHU Shoujun, MENG Qingnan, WANG Lei, et al. Highly photoluminescent carbon dots for multicolor patterning, sensors, and bioimaging[J]. Angewandte Chemie International Edition, 2013, 52(14): 3953-3957. DOI:10.1002/anie.201300519.
[4] CUI Yanyan, HU Zhongbo, ZHANG Chunfang, et al. Simultaneously enhancing up-conversion fluorescence and red-shifting downconversion luminescence of carbon dots by a simple hydrothermal process[J]. Journal of Materials Chemistry B, 2014, 2(40): 6947-6952. DOI:10.1039/c4tb01085j.
[5] LIM Shiying, SHEN Wei, GAO Zhiqiang. Carbon quantum dots and their applications[J]. Chemical Society Reviews, 2015, 44(1): 362-381. DOI:10.1039/c4cs00269e.
[6] DING Hui, YU Shangbo, WEI Jishi, et al. Full-color lightemitting carbon dots with a surface-state-controlled luminescence mechanism[J]. American Chemical Society Nano, 2016, 10(1): 484-491. DOI:10.1021/acsnano.5b05406.
[7] BAO Lei, LIU Cui, ZHANG Zhiling, et al. Photoluminescencetunable carbon nanodots: surface-state energy-gap tuning[J]. Advanced Materials, 2015, 27(10): 1663-1667. DOI:10.1002/adma.201405070.
[8] BAO Lei, ZHANG Zhiling, TIAN Zhiquan, et al. Electrochemical tuning of luminescent carbon nanodots: from preparation to luminescence mechanism[J]. Advanced Materials, 2011, 23(48): 5801-5806. DOI:10.1002/adma.201102866.
[9] ZHANG Yue, HE Junhui. Facile synthesis of S, N co-doped carbon dots and investigation of their photoluminescence properties[J]. Physical Chemistry Chemical Physics, 2015, 17(31): 20154-20159. DOI:10.1039/c5cp03498a.
[10] ZHENG Baozhan, LIU Tao, PAAU M C, et al. One pot selective synthesis of water and organic soluble carbon dots with green fl uorescent emission[J]. American Chemical Society Advances, 2015, 5(15): 11667-11675. DOI:10.1039/C4RA16529B.
[11] LI Zi, YU Huijun, BIAN Tong, et al. Highly luminescent nitrogendoped carbon quantum dots as effective fluorescent probes for mercuric and iodide ions[J]. Journal of Materials Chemistry C, 2015, 3(9): 1922-1928. DOI:10.1039/c4tc02756f.
[12] QIAN Zhaosheng, MA Juanjuan, SHAN Xiaoyue, et al. Highly luminescent N-doped carbon quantum dots as an effective multifunctional fluorescence sensing platform[J]. Chemistry, 2014, 20(8): 2254-2263. DOI:10.1002/chem.201304374.
[13] JIN Xiaozhe, SUN Xiaobo, CHEN Guo, et al. pH-sensitive carbon dots for the visualization of regulation of intracellular pH inside living pathogenic fungal cells[J]. Carbon, 2015, 81: 388-395. DOI:10.1016/ j.Carbon.2014.09.071.
[14] WANG Chuanxi, XU Zhenzhu, CHENG Hao, et al. A hydrothermal route to water-stable luminescent carbon dots as nanosensors for pH and temperature[J]. Carbon, 2015, 82: 87-95. DOI:10.1016/ j.carbon.2014.10.035.
[15] ZENG Yawen, MA Dekun, WANG Wei, et al. N,S co-doped carbon dots with orange luminescence synthesized through polymerization and carbonization reaction of amino acids[J]. Applied Surface Science, 2015, 342: 136-143. DOI:10.1016/j.apsusc.2015.03.029.
[16] PEI Supeng, ZHANG Jing, GAO Mengping, et al. A facile hydrothermal approach towards photoluminescent carbon dots from amino acids[J]. Journal of Colloid and Interface Science, 2015, 439: 129-133. DOI:10.1016/j.jcis.2014.10.030.
[17] WANG Chunfeng, SUN Dong, ZHUO Kelei, et al. Simple and green synthesis of nitrogen-, sulfur-, and phosphorus-co-doped carbon dots with tunable luminescence properties and sensing application[J]. RSC Advances, 2014, 4(96): 54060-54065. DOI:10.1039/c4ra10885j.
[18] WANG Baogang, TANG Weiwei, LU Hongsheng, et al. Hydrothermal synthesis of ionic liquid-capped carbon quantum dots with high thermal stability and anion responsiveness[J]. Journal of Materials Science, 2015, 50(16): 5411-5418. DOI:10.1007/s10853-015-9085-y.
[19] ZHUO Yan, MIAO Hong, ZHONG Dan, et al. One-step synthesis of high quantum-yield and excitation-independent emission carbon dots for cell imaging[J]. Materials Letters, 2015, 139: 197-200. DOI:10.1016/j.matlet.2014.10.048.
[20] WU Zhulian, ZHANG Pu, GAO Mingxuan, et al. One-pot hydrothermal synthesis of highly luminescent nitrogen-doped amphoteric carbon dots for bioimaging from Bombyx mori silk-natural proteins[J]. Journal of Materials Chemistry B, 2013, 1(22): 2868-2873. DOI:10.1039/c3tb20418a.
[21] XU Jingyi, ZHOU Ying, CHENG Guifang, et al. Carbon dots as a luminescence sensor for ultrasensitive detection of phosphate and their bioimaging properties[J]. Luminescence, 2015, 30(4): 411-415. DOI:10.1002/bio.2752.
[22] CHAUDHARY V, BHOWMICK A K. Green synthesis of fl uorescent carbon nanoparticles from lychee (Litchi chinensis) plant[J]. Korean Journal of Chemical Engineering, 2015, 32(8): 1707-1711. DOI:10.1007/s11814-014-0381-z.
[23] ROSHNI V, OTTOOR D. Synthesis of carbon nanoparticles using one step green approach and their application as mercuric ion sensor[J]. Journal of Luminescence, 2015, 161: 117-122. DOI:10.1016/ j.jlumin.2014.12.048.
[24] YU Caiyan, XUAN Tongtong, CHEN Yiwei, et al. A facile, green synthesis of highly fl uorescent carbon nanoparticles from oatmeal for cell imaging[J]. Journal of Materials Chemistry C, 2015, 3(37): 9514-9518. DOI:10.1039/c5tc02057c.
[25] WU Hongyan, MI Congcong, HUANG Huaiqing, et al. Solvothermal synthesis of green-fluorescent carbon nanoparticles and their application[J]. Journal of Luminescence, 2012, 132(6): 1603-1607. DOI:10.1016/j.jlumin.2011.12.077.
[26] ZHANG Yanqing, MA Dekun, ZHANG Yan, et al. One-pot synthesis of N-doped carbon dots with tunable luminescence properties[J]. Journal of Materials Chemistry, 2012, 22(33): 16714-16718. DOI:10.1039/c2jm32973e.
[27] CHANDRA S, DAS P, BAG S, et al. Synthesis, functionalization and bioimaging applications of highly fl uorescent carbon nanoparticles[J]. Nanoscale, 2011, 3(4): 1533-1540. DOI:10.1039/c0nr00735h.
[28] WANG Xiaohui, QU Konggang, XU Bailu, et al. Microwave assisted one-step green synthesis of cell-permeable multicolor photoluminescent carbon dots without surface passivation reagents[J]. Journal of Materials Chemistry, 2011, 21(8): 2445-2450. DOI:10.1039/ c0jm02963g.
[29] LIU Changjun, ZHANG Peng, TIAN Feng, et al. One-step synthesis of surface passivated carbon nanodots by microwave assisted pyrolysis for enhanced multicolor photoluminescence and bioimaging[J]. Journal of Materials Chemistry, 2011, 21(35): 13163-13167. DOI:10.1039/ c1jm12744f.
[30] MA Zheng, MING Hai, HUANG Hui, et al. One-step ultrasonic synthesis of fluorescent N-doped carbon dots from glucose and their visible-light sensitive photocatalytic ability[J]. New Journal of Chemistry, 2012, 36(4): 861-864. DOI:10.1039/c2nj20942j.
[31] FENG Ji, WANG Wenjing, HAI Xin, et al. Green preparation of nitrogen-doped carbon dots derived from silkworm chrysalis for cell imaging[J]. Journal of Materials Chemistry B, 2016, 4(3): 387-393. DOI:10.1039/C5TB01999K.
[32] 文学方, 杨安树, 陈红兵. 量子点标记技术在食品安全检测中的应用[J]. 食品科学, 2009, 30(21): 399-402. DOI:1002-6630(2009)21-0399-04.
[33] 马良, 贺亚萍, 张宇昊. 量子点荧光分析法在食品污染物分析中的应用[J].食品科学, 2013, 34(21): 389-393. DOI:10026630(2013)21-0389-05.
[34] 雷鹏, 何灿霞, 刘晓东, 等. 硒化镉量子点的安全性及在食品领域的应用[J]. 食品科学, 2015, 36(11): 240-244. DOI:1002-6630(2015)11-0240-05.
[35] ZHOU Li, LIN Youhui, HUANG Zhenzhen, et al. Carbon nanodots as fl uorescence probes for rapid, sensitive, and label-free detection of Hg2+and biothiols in complex matrices[J]. Chemical Communications, 2012, 48(8): 1147-1149. DOI:10.1039/c2cc16791c.
[36] ZHOU Jin, WANG Chen, QIAN Zhaosheng, et al. Highly efficient fluorescent multi-walled carbon nanotubes functionalized with diamines and amides[J]. Journal of Materials Chemistry, 2012, 22(24): 11912-11914. DOI:10.1039/c2jm31192e.
[37] WEN Xiangping, SHI Lihong, WEN Guangming, et al. Green synthesis of carbon nanodots from cotton for multicolor imaging, patterning, and sensing[J]. Sensors and Actuators B: Chemical, 2015, 221: 769-776. DOI:10.1016/j.snb.2015.07.019.
[38] SHI Lihong, LI Yanyan, LI Xiaofeng, et al. Controllable synthesis of green and blue fl uorescent carbon nanodots for pH and Cu(2+) sensing in living cells[J]. Biosensors and Bioelectronics, 2016, 77: 598-602. DOI:10.1016/j.bios.2015.10.031.
[39] WANG Yue, WU Wenting, WU Mingbo, et al. Yellow-visual fluorescent carbon quantum dots from petroleum coke for the efficient detection of Cu2+ions[J]. New Carbon Materials, 2015, 30(6): 550-559. DOI:10.1016/s1872-5805(15)60204-9.
[40] LIU Sen, TIAN Jingqi, WANG Lei, et al. Hydrothermal treatment of grass: a low-cost, green route to nitrogen-doped, carbon-rich, photoluminescent polymer nanodots as an effective fl uorescent sensing platform for label-free detection of Cu(II) ions[J]. Advanced Materials, 2012, 24(15): 2037-2041. DOI:10.1002/adma.201200164.
[41] YANG Xiaoming, LUO Yawen, ZHU Shanshan, et al. One-pot synthesis of high fluorescent carbon nanoparticles and their applications as probes for detection of tetracyclines[J]. Biosensors and Bioelectronics, 2014, 56: 6-11. DOI:10.1016/j.bios.2013.12.064.
[42] MISHRA R K, PULIDINDI I N, KABHA E, et al. In situ formation of carbon dots aids ampicillin sensing[J]. Analytical Methods, 2016, 8(11): 2441-2447. DOI:10.1039/c6ay00413j.
[43] AN Xuting, ZHUO Shujuan, ZHANG Ping, et al. Carbon dots based turn-on fluorescent probes for oxytetracycline hydrochloride sensing[J]. RSC Advances, 2015, 5(26): 19853-19858. DOI:10.1039/ c4ra16456c.
[44] WANG Renjie, XU Yi, ZHANG,Tao, et al. Rapid and sensitive detection of Salmonella typhimurium using aptamer conjugated carbon dots as fluorescence probe[J]. Analytical Methods, 2015, 7(5): 1701-1706. DOI:10.1039/C4AY02880E.
[45] ZHONG Dan, ZHUO Yan, FENG Yuanjiao, et al. Employing carbon dots modif i ed with vancomycin for assaying Gram-positive bacteria like Staphylococcus aureus[J]. Biosensors and Bioelectronics, 2015, 74: 546-553. DOI:10.1016/j.bios.2015.07.015.
[46] BHAISARE M L, GEDDA G, KHAN M S. Fluorimetric detection of pathogenic bacteria using magnetic carbon dots[J]. Analytica Chimica Acta, 2016, 920: 63-71. DOI:10.1016/j.aca.2016.02.025.
[47] LAI I P J, HARROUN S G, CHEN S Y, et al. Solid-state synthesis of self-functional carbon quantum dots for detection of bacteria and tumor cells[J]. Sensors and Actuators B: Chemical, 2016, 228: 465-470. DOI:10.1016/j.snb.2016.01.062.
[48] HOU Juying, DONG Guangjuan, TIAN Zhengbin, et al. A sensitive fluorescent for selective determination of dichlorvos based on the recovered fluorescence of carbon dots-Cu(II) system[J]. Food Chemistry, 2016, 202: 81-87. DOI:10.1016/ j.foodchem.2015.11.134.
[49] HOU Juying, TIAN Zhengbin, XIE Huizhi, et al. A fluorescence resonance energy transfer sensor based on quaternized carbon dots and Ellman’s test for ultrasensitive detection of dichlorvos[J]. Sensors and Actuators B: Chemical, 2016, 232: 477-483. DOI:10.1016/ j.snb.2016.03.092.
[50] HOU Juying, DONG Jing, ZHU Haishuang, et al. A simple and sensitive fl uorescent sensor for methyl parathion based on L-tyrosine methyl ester functionalized carbon dots[J]. Biosensors and Biolectronics, 2015, 68: 20-26. DOI:10.1016/j.bios.2014.12.037.
[51] TAO Huilin, LIAO Xiufen, SUN Chao, et al. A carbon dots-CdTE quantum dots fluorescence resonance energy transfer system for the analysis of ultra-trace chlotoluron in water[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 136: 1328-1334. DOI:10.1016/j.saa.2014.10.020.
[52] LEI Cuihua, ZHAO Xianen, JIAO Shulin, et al. A turn-on fl uorescent sensor for the detection of melamine based on the anti-quenching ability of Hg2+to carbon nanodots[J]. Analytical Methods, 2016, 8(22): 4438-4444. DOI:10.1039/c6ay01063f.
[53] DAIA H C, SHI Yan, WANG Yilin, et al. A carbon dot based biosensor for melamine detection by fl uorescence resonance energy transfer[J]. Sensors and Actuators B: Chemical, 2014, 202: 201-208. DOI:10.1016/ j.snb.2014.05.058.
[54] SHAN Xiaoyue, CHAI Lujing, MA Juanjuan, et al. B-doped carbon quantum dots as a sensitive fl uorescence probe for hydrogen peroxide and glucose detection[J]. Analyst, 2014, 139(10): 2322-2325. DOI:10.1039/c3an02222f.
[55] XU Hua, YANG Xiupei, LI Gu, et al. Green synthesis of fl uorescent carbon dots for selective detection of tartrazine in food samples[J]. Journal of Agricultural and Food Chemistry, 2015, 63(30): 6707-6014. DOI:10.1021/acs.jafc.5b02319.
[56] WANG Jilong, WEI Junhua, SU Siheng, et al. Novel fluorescence resonance energy transfer optical sensors for vitamin B12detection using thermally reduced carbon dots[J]. New Journal of Chemistry, 2015, 39(1): 501-507. DOI:10.1039/c4nj00538d.
[57] KUNDU A, NANDI S, DAS P, et al. Facile and green approach to prepare fluorescent carbon dots: emergent nanomaterial for cell imaging and detection of vitamin B2[J]. Journal of Colloid and Interface Science, 2016, 468: 276-283. DOI:10.1016/ j.jcis.2016.01.070.
[58] CHEN Zhangbao, WANG Jing, MIAO Hong, et al. Fluorescent carbon dots derived from lactose for assaying folic acid[J]. Science China Chemistry, 2015, 59(4): 487-492. DOI:10.1007/s11426-015-5536-1.
[59] GAO Zhao, WANG Libing, SU Rongxin, et al. A carbon dot-based“off-on” fl uorescent probe for highly selective and sensitive detection of phytic acid[J]. Biosensors and Bioelectronics, 2015, 70: 232-238. DOI:10.1016/j.bios.2015.03.043.
[60] LIU Siyu, ZHAO Ning, CHENG Zhen, et al. Amino-functionalized green fl uorescent carbon dots as surface energy transfer biosensors for hyaluronidase[J]. Nanoscale, 2015, 7(15): 6836-6842. DOI:10.1039/ c5nr00070j.
[61] LOO A H, SFOER Z, BOUSA D, et al. Carboxylic carbon quantum dots as a fluorescent sensing platform for DNA detection[J]. American Chemical Society Applied Materials and Interfaces, 2016, 8(3): 1951-1957. DOI:10.1021/acsami.5b10160.
[62] LIU Jinhua, LI Jishan, JIANG Ying, et al. Combination of π-π stacking and electrostatic repulsion between carboxylic carbon nanoparticles and fl uorescent oligonucleotides for rapid and sensitive detection of thrombin[J]. Chemical Communications, 2011, 47(40): 11321-11323. DOI:10.1039/c1cc14445f.
[63] LIU Jinhua, YU Jing, CHEN Jianrong, et al. Noncovalent assembly of carbon nanoparticles and aptamer for sensitive detection of ATP[J]. RSC Advances, 2014, 4(72): 38199-38205. DOI:10.1039/c4ra05631k.
Synthesis of Carbon Dots and Its Applications in Food Detection
WEI Wei1,2, SHI Xingbo1,2,3,*, DENG Fangming1,2
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2. Orient Science & Technology College, Hunan Agricultural University, Changsha 410128, China; 3. State Key Laboratory of Chemo/Biosensing and Chemometrics, Hunan University, Changsha 410082, China)
Abstract:As a new type of fl uorescent nanomaterial, carbon dots (CDs) possess a number of unique optical properties. Compared with semiconductor quantum dots, some advantages of CDs, including lower toxicity, higher biocompatibility, higher photostability and stronger anti-photobleaching effect, are attractive in various fields. Interestingly, increasing attention is attracted to the detection of heavy metals, antibiotics, pathogenic bacteria, pesticide residues and banned additives, and nutritional and functional components in foods by using CDs nowadays. Recently, the synthesis and optical properties of CDs have been reviewed by many researchers, but there are few reviews that focus on the application of CDs in food detection. This article brief l y reviews the optical properties and synthesis of CDs, with emphasis on its applications in food detection. Meanwhile, the future trend of carbon dots is also discussed.
Key words:carbon dots; optical properties; heavy metals; antibiotics; pathogenic bacteria
DOI:10.7506/spkx1002-6630-201715041
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)15-0256-09
引文格式:
魏伟, 石星波, 邓放明. 碳量子点合成及其在食品检测中的应用[J]. 食品科学, 2017, 38(15): 256-264. DOI:10.7506/ spkx1002-6630-201715041. http://www.spkx.net.cn
WEI Wei, SHI Xingbo, DENG Fangming. Synthesis of carbon dots and its applications in food detection[J]. Food Science, 2017, 38(15): 256-264. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201715041. http://www.spkx.net.cn
收稿日期:2016-07-04
基金项目:国家自然科学基金青年科学基金项目(31301484);湖南省自然科学基金青年基金项目(2015JJ3082);湖南农业大学青年项目(14QN11;14QNZ14);化学生物传感与计量学国家重点实验室(湖南大学)开放项目(Z2015025);湖南省高校青年骨干教师培养对象资助项目
作者简介:魏伟(1994—),男,本科,研究方向为碳量子点的合成与应用和食品质量与安全分析。E-mail:1213691488@qq.com
*通信作者:石星波(1984—),男,副教授,博士,研究方向为食品化学与分析、纳米生物传感和单分子成像。
E-mail:shixingbo123@aliyun.com