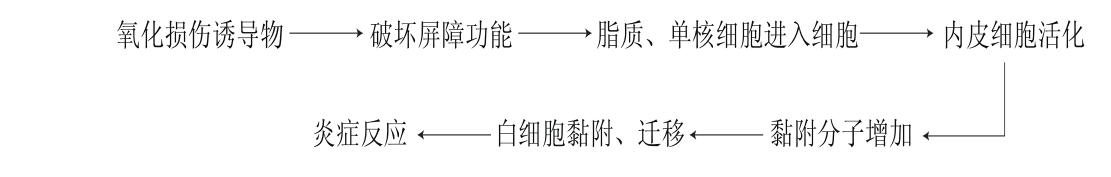
图1 内皮细胞损伤后引发炎症反应的机制
Fig. 1 Mechanisms of inf l ammatory response to damage in endothelial cells
梁 盈,李佳佳,黄 萍,马酉初,刘一超,林亲录*
(中南林业科技大学 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
摘 要:高血压、动脉粥样硬化等心脑血管疾病的发病率逐年增加,这是严重危害人类健康生活的一类疾病,而内皮细胞氧化损伤往往是这些疾病早期的共同反应。不仅如此,一些治疗如物理治疗、心脏手术等会遗留一些影响内皮细胞功能的问题。因此,该领域研究者们对内皮细胞氧化损伤的机制研究越来越重视,并以此寻找合适的效应物如食品中的活性成分来抑制内皮细胞的氧化,减少和防治相关疾病的发生。本文综述了内皮细胞氧化损伤研究中几种常用诱导物如过氧化氢、氧化低密度脂蛋白、高糖、辐射等对内皮细胞氧化损伤的作用和特点,供研究人员根据研究方向选择合适的诱导物来建立内皮细胞氧化损伤模型,以此更有针对性地进行效应物的筛选及作用机制的研究。
关键词:内皮细胞;氧化损伤;诱导物
内皮细胞在人体中起着重要作用。受到外界因素的长期刺激或不健康的饮食会引起内皮细胞氧化损伤,进而导致多种相关心血管疾病,且衰老与内皮的氧化也有着紧密的联系。因此,明确不同诱导物对内皮细胞的作用特点,以此来建立正确、适用的损伤模型对于分析食品中的活性成分,研究其分子水平上的作用机理是重要的前提。
1.1 屏障功能
内皮细胞是血流和血管壁之间的屏障结构和物质转运通道,具有选择通透性[1]。当血管内皮细胞的屏障功能受到破坏时,血液中的脂质、单核细胞等进入血管壁,使血管内皮活化,活化后的内皮细胞黏附分子增加,进而促进白细胞对内皮细胞的黏附和迁移,诱导血管内皮细胞的相关炎症反应(图1)[2]。

图1 内皮细胞损伤后引发炎症反应的机制
Fig. 1 Mechanisms of inf l ammatory response to damage in endothelial cells
1.2 凝血与抗凝血作用
内皮细胞通过分泌一些抗凝促凝物质来保持血液正常流动和凝血。正常情况下,血管内皮能够阻止白细胞和血小板黏附。在血管损伤或应激状态下,血管内皮细胞分泌一系列血管活性物质,协调促凝与抗凝的平衡,防止血栓形成[3],否则血小板会黏附聚集,形成血栓,导致急性心脑血管疾病的发生[4]。一些诱导物可以通过损伤细胞使内皮细胞的凝血通路发生障碍。
1.3 参与炎症和免疫反应
血管内皮细胞通过表达多种免疫相关分子主动参与或影响免疫过程。当血管内皮细胞受到脂多糖[5]等因素氧化损伤后,内皮细胞介导炎症细胞如单核细胞、中性粒细胞向损伤和感染的组织部位聚集,并释放借以与白细胞交流的细胞因子如白细胞介素(interleukin,IL)-8、单核细胞趋化因子(monocyte chemoattractant protein,MCP)-1、内皮黏附因子如血管黏附分子(vascular cell adhesion molecule,VCAM)-1和细胞间黏附因子(intercellular adhesion molecule,ICAM)-1。在内皮细胞表达的多种黏附分子作用下,白细胞从血管内迁移至炎症损伤部位,经活化后发挥致炎效应。其免疫相关分子可以产生多种细胞因子,参与机体的炎症反应及免疫应答[1,6]。
1.4 调控血管张力
内皮细胞通过分泌血管舒张调控因子如NO、前列环素(prostaglandin,PG)I2和收缩因子内皮素(endothelin,ET)、血管紧张素(angiotensin,Ang)Ⅱ、PGE2等来调节血管张力。
NO具有强烈的舒张血管和细胞保护作用,能够抑制血小板在血管内皮黏附和聚集,抑制平滑肌细胞增殖,同时NO可抑制单核细胞对内皮细胞的黏附[7]。一些因素如氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)[8]通过使NO合成减少引起内皮细胞功能障碍。ET-1具有强大的收缩血管作用。AngⅡ不仅具有收缩血管、升高血压的作用,亦具有促炎和促氧化应激作用,可以导致糖尿病血管并发症的发生[9]。
2.1 过氧化氢
H2O2作为一种活性氧(reactive oxygen species,ROS),低剂量时可作为信号分子调节基因表达和信号传导,过量的H2O2则会引起氧化损伤[10]。H2O2易获得,高浓度H2O2对离体的内皮细胞损伤效果明显[11],但在细胞培养中浓度不稳定,造模效果可控性较差。研究表明,H2O2单独处理人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)导致超氧阴离子产生,并呈浓度和时间依赖性;H2O2使得细胞存活率下降,其通过介导外源性蛋白级联反应引起细胞凋亡[12]。高蒙蒙等[13]发现经H2O2处理的内皮细胞的乳酸脱氢酶(lactate dehydrogenase,LDH)漏出量和丙二醛(methane dicarboxylic aldehyde,MDA)含量显著增加,而抗氧化酶的活性显著降低,导致细胞内ROS显著增加,凋亡执行蛋白酶caspase-3活性升高,线粒体膜电位降低,细胞凋亡比例显著升高。H2O2处理后的细胞在形态上也表现出凋亡特征,如细胞肿胀变圆,细胞明显脱落,甚至有的损伤破裂等[14]。李霞等[15]用H2O2处理HUVECs,产生大量MDA并在使细胞膜通透性增加的同时,细胞外分泌的LDH含量增多,细胞活力下降,引起细胞损伤。此外,细胞内过量的自由基可能会抑制抗氧化酶活性,使得自由基的清除能力大幅减弱,氧化损伤程度进一步加重。
2.2 氧化低密度脂蛋白
机体内产生的氧自由基使LDL氧化为ox-LDL。巨噬细胞通过清道夫受体摄入ox-LDL,形成载脂泡沫细胞,这是早期粥样硬化病变的病理学特征。ox-LDL等被修饰的低密度脂蛋白通过使NO减少等反应加速细胞衰老,进而引发动脉粥样化(图2)[16]。Hung等[17]证明ox-LDL可以通过激活核转录因子(nuclear factor,NF)-κB引起氧化应激,使ROS堆积,增加促炎因子IL-8,导致单核细胞对内皮细胞的黏附,进而引起内皮细胞功能紊乱。ox-LDL在动脉粥样硬化早期和斑块破裂晚期起重要作用,其诱导的内皮细胞损伤可以作为从分子水平上研究动脉粥样硬化时内皮氧化损伤的模型。
已有研究证明,ox-LDL处理促进ROS、活性氮(reactivenitrogen species,RNS)等活性组分(reactive species,RS)增加,导致细胞内的谷胱甘肽(glutathione,GSH)、血红素氧合酶(hemeoxygenase,HO)-1[18]等抗氧化酶减少,进而破坏线粒体膜电位,造成线粒体功能障碍,产生影响线粒体的RS循环,减少细胞的最大呼吸容量[19]。ox-LDL导致HUVECs核染色质凋亡,形态学改变和染色质凝聚等细胞凋亡现象,通过调节凋亡相关的基因如Bcl-2,caspase-3和促凋亡激酶基因GSK3β等反应,引起细胞凋亡(图2)[20],减少活细胞数。
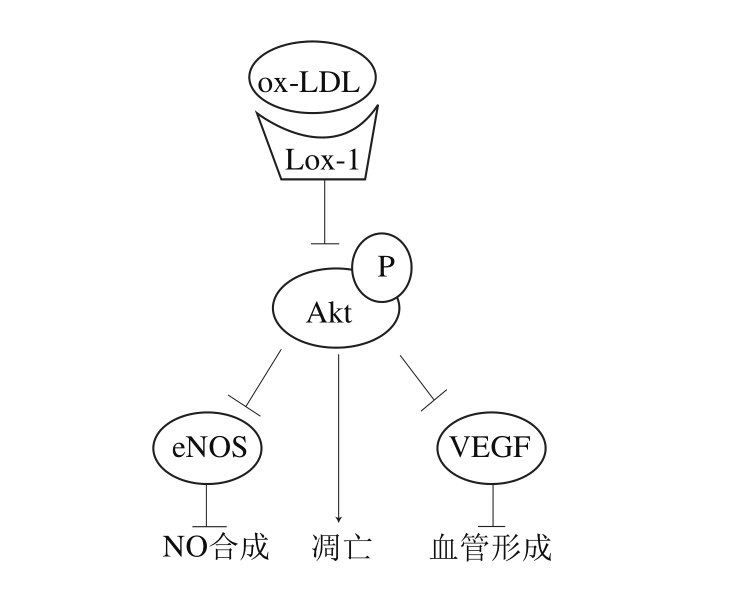
图2 氧化低密度脂蛋白诱导内皮细胞氧化损伤的可能机制[8]
Fig. 2 Possible mechanisms of oxidative stress induced by oxidized low-density lipoprotein in endothelialcells[8]
Lox-1.植物血凝素样氧化低密度脂蛋白受体-1(lectin-like oxidized low density lipoprotein receptor-1);Akt/PKB.蛋白激酶B(protein kinase B);P.磷酸化(phosphorylation)VEGF.血管内皮生长因子(vascular endothelial growth factor);eNOS.内皮型一氧化氮合酶(endothelial nitric oxide synthase)。
2.3 高糖
高糖处理内皮细胞可以模拟高糖血症和糖尿病的病理状态,以此为模型进行实验,便捷特异地为这些疾病寻找合适的药物和作用靶点。
研究表明,随着葡萄糖浓度的增加,细胞逐渐丧失原有的细胞形态。高糖降低血管内皮细胞的增殖[21],导致细胞氧化损伤[22]。高糖处理使牛主动脉内皮细胞内产生ROS,且主要为超氧化物。超氧化物上调Nrf2/HO-1轴,通过增加转录因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)细胞核积累物和细胞核蛋白对抗氧化反应元件(anti-oxidative response element,ARE)基因序列的结合,使c-Jun氨基末端激酶(c-jun N-terminal kinase,JNK)磷酸化,并显著增加起抗氧化防御作用的HO-1的mRNA和蛋白质的表达[23]。
高浓度葡萄糖处理严重影响HUVECs线粒体膜的能量代谢,使ROS形成有显著提升,高糖激活NOX(NADPH激酶)参与到ROS的形成中,而不是影响线粒体呼吸链[24]。la Sala等[25]第一次报道了不论是持续的还是振荡的高糖作用,都上调了内皮细胞中内皮糖蛋白(endoglin,Eng)的表达和可溶的内皮糖蛋白(soluble endoglin,sEng)的释放,而Eng与内皮细胞在损伤后的增殖及对炎症的反应有关,sEng的增加与糖尿病并发症有关。高糖亦会引起细胞内抗氧化剂依赖还原型辅酶Ⅱ/醌氧化还原酶1(NADPH quinone oxidoreductase 1,NQO-1)和HO-1调节紊乱,导致基因双链断裂。
高糖通过诱导黏附分子的表达来增加白细胞[26]、单核细胞对HUVECs的黏附。高糖及其所产生的糖基化终产物可以增加内皮的通透性,使单核巨噬细胞的浸润增加,致使血管肿瘤坏死因子(tumor necrosis factor,TNF)-α的浓度上升[27]。
2.4 晚期糖基化终末产物
晚期糖基化终末产物(advanced glycationend products,AGEs)引发的以ROS增高为特征的氧化应激是心脏微血管内皮细胞eNOS脱偶联的主要原因,并且氮氧化物NOX在其中发挥了重要作用。氧化应激和eNOS脱偶联导致了NO生物利用度的减少,从而发生内皮依赖性舒张功能紊乱,可能导致糖尿病性心肌病的发生,并成为其重要发病机制[28]。AGEs加强内皮细胞中ROS的产生及MCP-1和ICAM-1的表达,显著增加了细胞中蛋白酶活化受体(protease activated receptor,PAR)-1蛋白质水平。AGEs通过上调PAR-1来加强单核细胞对内皮细胞的黏附等炎症反应,通过加强PAR-1的表达来加强血浆导致的凝血酶信号通路[29]。
2.5 辐射
在许多癌症、肿瘤的治疗中都会用到辐射治疗,而辐射治疗会引起相应器官的内皮细胞氧化损伤。辐射具有细胞毒性,导致ROS的大量产生。线粒体是辐射的主要靶器官,辐射通过降低线粒体膜电位来损伤线粒体从而引起氧化应激。γ射线辐照增加了细胞中过氧化物的产量并降低超氧化物歧化酶(superoxide dismutase,SOD)活性和GSH的水平,进一步加重细胞损伤[30]。γ射线辐照显著增加了脑微血管内皮细胞(cerebromicrovascular endothelial cells,CMVECs)的死亡,最初通过诱导细胞凋亡来引起CMVECs的死亡。γ辐照引起DNA损伤,而且辐照后,CMVECs的DNA修复能力降低。在CMVECs中增强的基因组损伤可能会加剧细胞凋亡,并且促进继续存活的细胞早衰。γ射线辐照处理显著抑制血管生成的主要步骤,阻止微血管再生。CMVECs在γ射线处理后提升了衰老相关性分泌表型(senescence-associated secretory phenotype,SASP)的获得,引起细胞早衰[31]。
紫外照射具有潜在的致癌性,而致癌的早期反应是引起皮肤内皮细胞的氧化损伤。紫外线B(ultraviolet B,UVB)处理显著增加ROS的产生,导致脂质过氧化作用增强,谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)活力增强,增加了还原型谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)的比例,导致细胞内氧化和抗氧化平衡的变动,进而增加细胞的死亡。UVB增加NF-κB和pNF-κB的水平,增加了caspase-3的活力,减少细胞活力,对HUVEC有强大的促凋亡作用。UVB引起γ-H2AX增加,DNA双链断裂,诱导DNA损伤[32]。
2.6 血管紧张素Ⅱ
AngⅡ作用于HUVECs后,细胞内ROS的产生显著增加,通过抑制PI3K/AkteNOS通路进而抑制了eNOS磷酸化,减少NO的产生,同时降低了总抗氧化能力(total antioxidant capacity,T-AOC)[33],引起内皮细胞损伤。NOX化是细胞内氧化应激的主要来源,当用AngⅡ处理HAECs时,HAECs也增强了NOX的p47phox亚基向质膜中的转移,而这是NOX活化的关键一步。处理后的小鼠收缩压增加[34]。AngⅡ浓度依赖性地增加ROS含量和线粒体膜电位的去极化,说明引起了氧化应激,诱导HUVEC的衰老和凋亡[35]。
2.7 低氧
低氧引起HUVECs内ROS产量的增加,具有显著的细胞毒性,ROS过度产生扰乱了抗氧化和助氧化之间的平衡,增加氧化应激并导致整体抗氧化能力的缺乏。低氧条件与低氧诱导因子(hypoxia inducible factor,HIF)的上调有关,ROS过度产生导致HIF-1α蛋白质积累和半衰期的增加。HIF-1α引起低氧诱导金属蛋白酶2(mental matrix proteinase-2,MMP-2)和MMP-2的激活,导致细胞程序性死亡[36]。鲁诗史等[37]研究表明,一定时程内大鼠心肌缺氧/再灌注(hypoxia/reoxygenation,H/R)可造成心脏微血管内皮细胞ROS生成进行性增加,氧化应激损伤进行性加重。H/R导致内皮细胞内ROS生成增加,而ROS非特异性直接氧化损伤DNA、蛋白质和脂类。细胞膜主要成分磷脂双分子层被ROS氧化损伤后生成MDA,造成氧化应激损伤,细胞膜完整性遭到破坏。
2.8 局部缺血
一些疾病相关的局部缺血条件也会造成内皮细胞氧化损伤。Gabryel等[38]用剥夺氧和葡萄糖(combined oxygen and glucose deprivation,OGD)形成局部缺血条件,经OGD处理后,细胞形态发生巨大变化,刺激了ROS产生,ROS水平是局部性缺血诱导的血管内皮损伤的关键致病因素,ROS介导的脂质过氧化是引起细胞膜破坏,进而引起细胞死亡的重要原因。局部性缺血条件也导致了抗氧化酶的mRNA表达水平和酶含量的降低,降低了其活性。OGD处理后降低了eNOS的mRNA的表达,增加了eNOS的苏氨酸-495的磷酸化,导致eNOS解偶联,进而减少NO的合成。
不同诱导物对内皮细胞的损伤作用及特点汇总如表1所示。
表1 几种不同诱导物对内皮细胞的损伤作用及特点
Table 1 Mechanisms of action of several different inducers in causing oxidative damage in endothelial cells

现代人们的生活环境日益恶化,如大量的废气排放、纳米材料的使用、装修中产生的甲醛等,相应因素引起的疾病也应得到人们的重视,下面是几种存在于环境中的潜在诱导物。1)废气:废气中含有汽车尾气、工业生产产生的废气等。这些废气与人们患心肺疾病相关。研究发现,柴油燃烧产生的废气和炭黑中的颗粒物会引起ROS产量增加,激活ICAM-1和VCAM-1等细胞黏附因子在质膜中的表达等内皮细胞氧化应激反应[39]。2)纳米材料:银纳米材料可以引起HUVECs中的ROS产生增加,抑制细胞的增殖,损伤细胞膜,严重引起细胞凋亡。同时,导致大量的单细胞对内皮细胞的黏附。银纳米材料可能是早期粥样动脉硬化的潜在危险因子[40]。单壁碳纳米管可以改变纤维蛋白溶解相关的基因表达和蛋白质,引起内皮障碍,进而具有促血栓生成的作用[41]。因此,我们也应针对这些潜在诱导因素建立损伤模型来寻找治疗的药物。
此外,许多人喜欢吃高盐食物,而高盐正是饮食中潜在的诱导物。高盐可以使内皮细胞中ROS增加,抑制NO活性。张玉婕等[42]证明高盐诱发的细胞氧化应激通过调控p38-HSP27信号转导通路引起主动脉内皮细胞骨架蛋白的重组,导致P-eNOS表达减少,NO释放受抑等内皮细胞的损伤反应。
心血管疾病严重影响着人们的身体健康,寻找预防及治疗药物势在必行,在此过程中,建立合适的内皮细胞损伤模型又是关键步骤,而建立合适的模型时,必须了解不同诱导物的机制和特点,才能选择准确有效的诱导物。现在已有不少对不同诱导物的诱导机制研究,但仍有许多方面还不清楚,因此仍应致力于各种诱导物对于内皮细胞的损伤机制研究,为相关研究选择合适的效应物提供科学依据。
参考文献:
[1] 米宁, 高允生. 血管内皮细胞的功能与损伤机制的研究进展[J].泰山医学院学报, 2011, 32(10): 790-792. DOI:10.3969/ j.issn.1004-7115.2011.10.027.
[2] 孙敏慧, 张媛媛, 许少华, 等. 皂苷类成分对血管内皮细胞功能的调节作用研究进展[J]. 药学进展, 2014, 38(6): 409-418.
[3] 张霞, 金惠敏. 慢性肾脏病与血管内皮细胞功能的研究进展[J].上海交通大学学报(医学版), 2012, 32(4): 528-532. DOI:10.3969/ j.issn.1674-8115.2012.04.033.
[4] 严春琳, 杨静, 韩际宏, 等. 中药抗动脉粥样硬化机制研究进展[J].中国药理学与毒理学杂志, 2014, 28(6): 904-913. DOI:10.3867/ j.issn.1000-3002.2014.06.014.
[5] DUARTE S, ARANGO D, PARIHAR A, et al. Apigenin protects endothelial cells from lipopolysaccharide (LPS)-induced inf l ammation by decreasing caspase-3 activation and modulating mitochondrial function[J]. International Journal of Molecular Sciences, 2013, 14(9): 17664-17679. DOI:10.3390/ijms140917664.
[6] JIA Z Q, NALLASAMY P, LIU D M, et al. Luteolin protects against vascular inflammation in mice and TNF-alpha-induced monocyte adhesion to endothelial cells via suppressing IKBα/NF-κB signaling pathway[J]. Journal of Nutritional Biochemistry, 2014, 26(3): 293-302. DOI:10.1016/j.jnutbio.2014.11.008.
[7] 李丹, 李玉洁, 杨庆, 等. 血管内皮功能障碍与动脉粥样硬化研究进展[J]. 中国实验方剂学杂志, 2012, 18(8): 272-276. DOI:10.3969/ j.issn.1005-9903.2012.08.081.
[8] XU L, WANG S J, LI B Y, et al. A protective role of ciglitazone in ox-LDL-induced ratmicrovascular endothelial cells via modulating PPARγ-dependent AMPK/eNOS pathway[J]. Journal of Cellular and Molecular Medicine, 2015, 19(1): 92-102. DOI:10.1111/jcmm.12463.
[9] 荀光, 汪晓霞. 肾素血管紧张素系统对糖尿病内皮细胞损伤机制的研究[J]. 现代生物医学进展, 2014, 14(12): 2360-2363.
[10] JEON B K, KWON K, KANG J L, et al. Csk-induced phosphorylation of Src at tyrosine 530 is essential for H2O2-mediated suppression of ERK1/2 in human umbilical vein endothelial cells[J]. Scientific Reports, 2015, 5: 1-15. DOI:10.1038/srep12725.
[11] 李应东, 刘凯, 赵信科. 当归补血汤超滤物抗H2O2致人脐静脉内皮细胞(ECV-304)氧化损伤的影响[J]. 时珍国医国药, 2012, 23(1): 71-74. DOI:10.3969/j.issn.1008-0805.2012.01.032.
[12] POLIDORO L, PROPERZI G, MARAMPON F, et al. Vitamin D protects human endothelial cells from H2O2oxidant injury through the Mek/Erk-Sirt1 axis activation[J]. Journal of Cardiovascular Translational Research, 2013, 6(2): 221-231. DOI:10.1007/s12265-012-9436-x.
[13] 高蒙蒙, 孙桂波, 斯建勇, 等. 红车轴草总黄酮对H2O2诱导的血管内皮细胞损伤的保护作用[J]. 中国药理学通报, 2013, 29(2): 201-207. DOI:10.3969/j.issn.1001-1978.2013.02.13.
[14] 梁盈, 鲁倩, 方婧杰, 等. 大米活性肽的抗氧化作用及其对HUVEC细胞增殖的影响[J]. 中国粮油学报, 2014, 29(7): 1-6; 17.
[15] 李霞, 姚昭, 张云龙, 等. 不同形态硒与维生素E联用对H2O2诱导下人脐血管内皮细胞的保护作用[J/OL]. 食品科学, 2015. [2016-06-21]. http://www.cnki.net/kcms/detail/11.2206.TS.20151111.1535.036.html.
[16] ALIQUE M, LUNA C, CARRACEDO J, et al. LDL biochemical modifications: a link between atherosclerosis and aging[J]. Food & Nutrition Research, 2015, 59: 29240. DOI:10.3402/fnr.v59.29240.
[17] HUNG C H, CHAN S H, CHU P M, et al. Quercetin is a potent antiatherosclerotic compound by activation of SIRT1 signaling under oxLDL stimulation[J]. Molecular Nutrition & Food Research, 2015, 59(10): 1905-1917. DOI:10.1002/mnfr.201500144.
[18] QIN M, LUO Y, MENG X B, et al. Myricitrin attenuates endothelial cell apoptosis to prevent atherosclerosis: an insight into PI3K/Akt activation and STAT3 signaling pathways[J]. Vascular Pharmacology, 2015, 70: 23-34. DOI:10.1016/j.vph.2015.03.002.
[19] HORT M A, STRALIOTTO M R, DE OLIVEIRA J, et al. Diphenyl diselenide protects endothelial cells against oxidized low density lipoprotein-induced injury: involvement of mitochondrial function[J]. Biochimie, 2014, 105(10): 172-181. DOI:10.1016/ j.biochi.2014.07.004.
[20] LIN P F, LIU J L, REN M, et al. Idebenone protects against oxidized low density lipoprotein induced mitochon-drial dysfunction in vascular endothelial cells via GSK3β/β-catenin signaling pathways[J]. Biochemical and Biophysical Research Communications, 2015, 465(3): 548-555. DOI:10.1016/j.bbrc.2015.08.058.
[21] LIU Y, LIAO W J, ZHU Z, et al. Effect of procyanidine on VEGFR-2 expression and transduction pathway in rat endothelial progenitor cells under high glucose conditions[J]. Genetics and Molecular Research: GMR, 2016, 15(1): 1-10. DOI:10.4238/gmr.15016925.
[22] 玛尔孜亚·达尼牙尔, 许晨波, 杨梅, 等. 高糖环境对血管内皮细胞增殖和氧化应激的影响[J]. 新疆医科大学学报, 2011, 34(11): 1237-1240. DOI:10.3969/j.issn.1009-5551.2011.11.014.
[23] HE M, NITTI M, PIRAS S, et al. Heme oxygenase-1-derived bilirubin protects endothelial cells against high glucose-induced damage[J]. Free Radical Biology and Medicine, 2015, 89: 91-98. DOI:10.1016/ j.freeradbiomed.2015.07.151.
[24] DYMKOWSKA D, DRABAREK B, PODSZYWAŁOW P, et al. Hyperglycaemia modifies energy metabolism and reactive oxygen species formation in endothelial cells in vitro[J]. Archives of Biochemistry and Biophysics, 2014, 542: 7-13. DOI:10.1016/ j.abb.2013.11.008.
[25] LA SALA L, PUJADAS G, DE NIGRIS V, et al. Oscillating glucose and constant high glucose induce endoglin expression in endothelial cells: the role of oxidative stress[J]. Acta Diabetologica, 2015, 52(3): 1-8. DOI:10.1007/s00592-014-0670-3.
[26] GUO L X, QIAO Y, ZHANG L N, et al. Protective role of glucagon-like peptide-1 against high-glucose-induced endothelial oxidative damage[J]. Medicine, 2015, 94(47): 1-7. DOI:10.1097/ MD.0000000000002055.
[27] 郝晓娟, 朱旅云. 血管内皮细胞功能的影响因素及其研究进展[J].医学综述, 2012, 18(20): 3371-3374.
[28] 成永霞, 刘贵波, 颜彬, 等. PKC/NADPH氧化应激途径对大鼠心脏微血管内皮细胞eNOS脱偶联的影响[J]. 基础医学与临床, 2013, 33(1): 82-87.
[29] ISHIBASHI Y, MATSUI T, UEDA S, et al. Advanced glycation end products potentiate citrated plasma-evoked oxidative and inf l ammatory reactions in endothelial cells by up-regulating protease-activated receptor-1 expression[J]. Cardiovascular Diabetology, 2014, 13: 60. DOI:10.1186/1475-2840-13-60.
[30] YU J, ZHU X Y, QI X, et al. Paeonif l orin protects human EA.hy926 endothelial cells against gamma-radiation induced oxidative injury by activating the NF-E2-related factor 2/heme oxygenase-1 pathway[J]. Toxicology Letters, 2013, 218(3): 224-234. DOI:10.1016/ j.toxlet.2013.01.028.
[31] UNGYARI Z, PODLUTSKY A, SOSNOWSKA D, et al. Ionizing radiation promotes the acquisition of a senescence-associated secretory phenotype and impairs angiogenic capacity in cerebromicrovascular endothelial cells: role of increased DNA damage and decreased DNA repair capacity in microvascular radiosensitivity[J]. Journals of Gerontology, 2013, 68(12): 1443-1457. DOI:10.1093/gerona/glt057.
[32] OLTEANU D, BALDEA I, CLICHICI S, et al. In vitro studies on the mechanisms involved in chemoprevention using Calluna vulgaris on vascular endothelial cells exposed to UVB[J]. Journal of Photochemistry and Photobiology B: Biology, 2014, 136(2): 54-61. DOI:10.1016/j.jphotobiol.2014.04.018.
[33] WEI X L, ZHU X Y, HU N, et al. Baicalin attenuates angiotensin II-induced endothelial dysfunction[J]. Biochemical and Biophysical Research Communications, 2015, 465(1): 101-107. DOI:10.1016/ j.bbrc.2015.07.138.
[34] NAKAO T, MORITA H, MAEMURA K, et al. Melatonin ameliorates angiotensin Ⅱ-induced vascular endothelial damage via its antioxidative properties[J]. Journal of Pineal Research, 2013, 55(3): 287-293. DOI:10.1111/jpi.12071.
[35] LI P, GUO X, LEI P P, et al. PI3K/Akt/uncoupling protein 2 signaling pathway may be involved in cell senescence and apoptosis induced by angiotensin II in human vascular endothelial cells[J]. Molecular Biology Reports, 2014, 41(10): 6931-6937. DOI:10.1007/s11033-014-3580-0.
[36] ANWAR S, SPECIALE A, FRATANTONIO D, et al. Cyanidin-3-O-glucoside modulates intracellular redox status and prevents HIF-1 stabilization in endothelial cells in vitro exposed to chronic hypoxia[J]. Toxicology Letters, 2014, 226(2): 206-213. DOI:10.1016/ j.toxlet.2014.01.048.
[37] 鲁诗史, 郑付春, 李振鹏, 等. 心脏微血管内皮细胞缺氧复氧时氧化应激时效研究[J]. 汕头大学医学院学报, 2014, 27(4): 190; 193-196.
[38] GABRYEL B, JARZĄBEK K, MACHNIK G, et al. Superoxide dismutase 1 and glutathione peroxidase 1 are involved in the protective effect of sulodexide on vascular endothelial cells exposed to oxygenglucose deprivation[J]. Microvascular Research, 2016, 103: 26-35. DOI:10.1016/j.mvr.2015.10.001.
[39] FRIKKE-SCHMIDT H, ROURSGAARD M, LYKKESFELDT J, et al. Effect of vitamin C and iron chelation on diesel exhaust particle and carbon black induced oxidative damage and cell adhesion molecule expression in human endothelial cells[J]. Toxicology Letters, 2011, 203(3): 181-189. DOI:10.1016/j.toxlet.2011.03.011.
[40] SHI J P, SUN X, LIN Y, et al. Endothelial cell injury and dysfunction induced by silver nanoparticles through oxidative stress via IKK/NF-κB pathways[J]. Biomaterials, 2014, 35(24): 6657-6666. DOI:10.1016/ j.biomaterials.2014.04.093.
[41] RODRÍGUEZ-YÁÑEZ Y, BAHENA-URIBE D, CHÁVEZMUNGUÍA B, et al. Commercial single-walled carbon nanotubes effects in fibrinolysis of human umbilical vein endothelial cells[J]. Toxicology in Vitro, 2015, 29(5): 1201-1214. DOI:10.1016/ j.tiv.2015.02.009.
[42] 张玉婕, 朱男, 张效林, 等. 高盐激活氧化应激-p38丝裂原活化蛋白激酶-肌动蛋白骨架重组诱导血管内皮细胞损伤[J]. 中华高血压杂志, 2014, 22(8): 742-748.
Progress in Research on Effects of Different Inducers on Oxidative Damage in Endothelial Cells
LIANG Ying, LI Jiajia, HUANG Ping, MA Youchu, LIU Yichao, LIN Qinlu*
(National Engineering Laboratory for Rice and By-Product Deep Processing, Central South University of Forestry and Technology, Changsha 410004, China)
Abstract:Nowadays, the incidence of hypertension, atherosclerosis and other cardiovascular and cerebrovascular diseases, which threaten human health, increases year by year. Previous studies showed that oxidative damage in endothelial cells was usually a common response at the early stage of these diseases. Moreover, some therapeutic strategies such as physical therapy and cardiac surgery may leave some problems affecting endothelial function. In this context, the mechanism of oxidative damage in endothelial cells is of growing interest to researchers, and many efforts have been made to seek the most suitable effectors like active components derived from foods to inhibit oxidative damage in endothelial cells, thereby preventing or reducing the occurrence of related diseases. The mechanisms of action of several common inducers such as hydrogen peroxide, oxidized low-density lipoprotein, high glucose concentration and radiation in causing oxidative damage in endothelial cells are described in this review, which will provide valuable information to select a suitable inducer for induction of oxidative damage in endothelial cells and therefore to facilitate the selection of effectors and the study of the underlying mechanism.
Key words:endothelial cells; oxidative damage; inducer
DOI:10.7506/spkx1002-6630-201715042
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)15-0265-06
引文格式:
梁盈, 李佳佳, 黄萍, 等. 不同诱导物对内皮细胞氧化损伤作用的研究进展[J]. 食品科学, 2017, 38(15): 265-270. DOI:10.7506/spkx1002-6630-201715042. http://www.spkx.net.cn
LIANG Ying, LI Jiajia, HUANG Ping, et al. Progress in research on effects of different inducers on oxidative damage in endothelial cells[J]. Food Science, 2017, 38(15): 265-270. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201715042. http://www.spkx.net.cn
收稿日期:2016-06-28
基金项目:国家自然科学基金青年科学基金项目(31201348);国家自然科学基金面上项目(31571874)湖南省自然科学基金面上项目(2017JJ2410);湖湘青年科技创新人才项目(2016RS3033);粮油深加工与品质控制2011湖南省协同创新项目;中南林业科技大学研究生教材建设项目(2015JC03)
作者简介:梁盈(1981—),女,副教授,博士,研究方向为分子营养学。E-mail:liangying498@163.com
*通信作者:林亲录(1966—),男,教授,博士,研究方向为稻谷深加工。E-mail:linql0403@126.com