石 芳1,廖 霞1,卢可可1,郑少杰1,肖星凝1,吴素蕊2,明 建1,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.重庆市特色食品工程技术研究中心,重庆 400715)
摘 要:以黑脉羊肚菌为原料,分离提取羊肚菌多酚(游离酚和结合酚),对提取物中酚类物质的含量及抗氧化活性进行研究,并采用超高效液相色谱-二极管阵列检测器/电喷雾飞行时间质谱对黑脉羊肚菌游离酚和结合酚的组分进行鉴定。结果表明,黑脉羊肚菌多酚主要为游离酚,且游离酚的DPPH自由基清除率、还原力及氧自由基吸收能力都显著强于结合酚(P<0.05),而两者清除ABTS+·能力相当。从黑脉羊肚菌多酚中鉴定出15 种组分,分别是没食子酸、焦性没食子酸、原儿茶酸、对羟基苯甲酸、儿茶素、咖啡酸、绿原酸、荭草素、芦丁、金丝桃苷、白藜芦醇、木犀草素、槲皮素、肉桂酸、阿魏酸,游离酚提取物有15 种组分,结合酚提取物有14 种组分。
关键词:黑脉羊肚菌;多酚;超高效液相色谱-电喷雾飞行时间质谱;抗氧化活性
黑脉羊肚菌(Morchella angusticeps Peck)是常见的羊肚菌种,在我国主要分布在新疆、甘肃、西藏、云南、四川、青海、内蒙古、山西等地,其富含蛋白质、维生素及多种必需氨基酸,并含有钾、钠、钙、镁、锌、铁等多种常量和微量元素,具有较高的营养及药用价值。过去人们普遍认为羊肚菌的保健功能主要是由于活性多糖的作用,但近些年研究发现其体内的多酚也具有抗氧化、抗肿瘤等活性,已有研究表明黑脉羊肚菌体内多酚含量丰富,且具有较强的抗氧化能力,如2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-amino-di (3-ethyl-benzothiazoline sulphonic acid-6) ammonium salt,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH)自由基清除能力,使β-胡萝卜素褪色等。
目前对羊肚菌多酚的研究仍集中在多酚提取、含量测定及简单的化学抗氧化活性测定,由于多酚类物质种类繁多、结构复杂,导致其抗氧化活性不同,因此鉴定黑脉羊肚菌中的酚类物质的组分对后续探讨其抗氧化构效关系尤为重要。当高效液相色谱法无法达到理想效果时,就需要首先分离出单体物质,再进一步用质谱对其结构进行分析,液相色谱-电喷雾飞行时间质谱是近年来发展并逐渐完善起来的一种软电离质谱,因其特异性高、灵敏度高,并能与多级质谱联用等技术特点,可直接用于多酚类化合物的分析[1-3]。本实验采用超高效液相色谱-二极管阵列检测器/电喷雾飞行时间质谱(ultra performance liquid chromatography-diode array detector/ electrospray ionization-time of fight-mass spectrometry,UPLC-DAD/ESI-TOF-MS)对黑脉羊肚菌中的多酚类化合物进行组分鉴定,以期为黑脉羊肚菌的开发利用提供理论依据。
1.1 材料与试剂
黑脉羊肚菌由中华全国供销合作总社昆明食用菌研究所提供。样品采摘后12 h内速冻,于-20 ℃冻藏,实验前取出冷冻羊肚菌于50 ℃烘箱烘干至恒质量,中药粉碎机粉碎,过80 目筛后密封备用。
乙腈、甲酸、甲醇(均为色谱纯) 天津四友精细化学品有限公司;没食子酸、焦性没食子酸、对羟基苯甲酸、水杨酸、绿原酸、阿魏酸、咖啡酸、肉桂酸、儿茶素、槲皮素、芦丁、白藜芦醇、荭草素、木犀草素、山柰酚、金丝桃苷、桑色素、香草醛(均为色谱纯)美国Sigma公司;丙酮、乙酸乙酯(均为分析纯)成都科龙化工试剂厂。
1.2 仪器与设备
KQ3200DE数控超声波振荡器 昆山市超声仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;DW-FL270型超低温冷冻储存箱 中科美菱低温科技有限责任公司;LC-30AD超高效液相色谱仪 日本岛津公司;Triple TOF 4600高分辨质谱仪 美国AB SCIEX公司。
1.3 方法
1.3.1 黑脉羊肚菌多酚提取
1.3.1.1 游离酚提取
参考Okarter等[4]的方法,并根据实验室条件稍作修改。准确称取1.00 g样品于100 mL离心管中,加入80%预冻丙酮溶液,冰浴均质后,于3 500×g离心10 min,取上清液。残渣重复提取2 次,合并上清液,抽滤后于45 ℃旋转蒸干,用超纯水定容至25 mL。过0.45 μm有机滤膜后于-40 ℃保存备用。
1.3.1.2 结合酚提取
参考Nuutila等[5]的方法,并根据实验室条件稍作修改。收集1.3.1.1节游离酚提取后的残渣,加入2 mol/L NaOH溶液,避光搅拌消化1.5 h,再用浓盐酸调至pH 2左右。加入正己烷20 mL,搅拌10 min后离心,除去脂肪层,重复去脂2 次。加入20 mL乙酸乙酯并充分搅拌提取10 min,3 500×g离心后取上清液,重复提取5 次,合并上清液,抽滤后于45 ℃旋转蒸干,用超纯水定容至10 mL。过0.45 μm有机滤膜后保存于-40 ℃备用。
1.3.2 多酚含量测定
参考Chu等[6]的方法,以没食子酸为标准品,得到标准曲线方程为y=0.003 4x+0.067 7(R2=0.991 7),其中y为没食子酸质量浓度(μg/mL),x为吸光度,根据该方程计算样品中多酚的含量,结果以每克羊肚菌样品中含没食子酸当量干质量(mg GAE/g)表示。
1.3.3 多酚成分的鉴定
1.3.3.1 标准品溶液的制备
准确称取标准品没食子酸、焦性没食子酸、对羟基苯甲酸、水杨酸、绿原酸、阿魏酸、原儿茶酸、咖啡酸、肉桂酸、儿茶素、槲皮素、芦丁、白藜芦醇、荭草素、木犀草素、山柰酚、金丝桃苷、桑色素、香草醛各1 mg,分别以色谱甲醇定容至10 mL容量瓶,经0.45 μm有机滤膜过滤,于-40 ℃冰箱贮藏备用。
1.3.3.2 UPLC-DAD/ESI-TOF-MS分析条件
色谱条件:Phenomenex KinetexTMC18色谱柱(100 mm×2.1 mm,2.6 μm);流动相A为0.1%甲酸,B为100%乙腈;梯度洗脱:0~1 min,10% B,1~8 min,10%~85% B,8~13 min,85% B,13~13.1 min,85~10% B,13.1~15 min,10% B;流速0.35 mL/min;进样量3 µL;柱温30 ℃;检测波长280 nm。
质谱条件:电喷雾离子化源负离子模式;TOF-MS扫描方式;质量扫描范围m/z 50~1 000;雾化电压4 500 V;辅助加热温度600 ℃;去簇电压-80 V;碰撞能量-30 eV;扩展碰撞能量15 eV。
1.3.4 抗氧化活性的测定
1.3.4.1 DPPH自由基清除率测定
参考Cheung等[7]的方法,取1 mL不同质量浓度的样品提取液和5 mL 0.1 mmol/L的DPPH溶液加入10 mL试管中,以抗坏血酸为对照,混合均匀后在室温条件下避光反应50 min,于波长520 nm处测定吸光度。以水做试剂空白,测定空白样吸光度Aj。按公式(1)计算样品的DPPH自由基清除率:
式中:Ai为不同质量浓度样品提取液的吸光度;Aj为水空白试剂的吸光度。
1.3.4.2 还原力的测定
参考Ardestani等[8]的方法,取1 mL不同质量浓度的样品提取液、2.5 mL磷酸盐缓冲溶液(0.2 mol/L pH 6.6)和2.5 mL铁氰化钾溶液加入10 mL离心管中,混合均匀后50 ℃水浴20 min。取出冷却后加入2.5 mL三氯乙酸溶液,3 500×g离心10 min,取上清液2.5 mL,加入2.5 mL去离子水和0.5 mL氯化铁溶液,混合均匀后于波长700 nm处测定吸光度。以水溶液做空白,抗坏血酸作为对照。
1.3.4.3 ABTS+·清除率的测定
参考Soong等[9]的方法,将5 mL的7 mmol/L ABTS溶液和88 μL的140 mmol/L过硫酸钾溶液混合,在室温避光条件下静置过夜(12~16 h),形成ABTS储备液。将生成的ABTS溶液用10 mmol/L pH 7.4的磷酸盐缓冲液稀释,使其在室温条件下测定波长734 nm处吸光度为0.70±0.02,得到ABTS工作液。将多酚提取液做相应稀释后,取3 mL不同质量浓度的样品提取液和1 mL ABTS工作液于10 mL试管中,以抗坏血酸为对照,混合均匀后在30 ℃水浴反应6 min,于波长734 nm处测定吸光度Ai。以水溶液做空白,测定空白样吸光度Aj。按公式(2)计算样品的ABTS+·清除率:
1.3.4.4 氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)的测定
参照Wolfe等[10]的方法,并根据本实验室条件稍作修改。分别精确吸取20 μL磷酸缓冲液(空白液)、Trolox标准液(6.25 μmol/L)和不同质量浓度的样品液,一式3份点样到96 孔酶标板。在37 ℃温育10 min,设置酶标仪参数。加入200 μL 0.96 μmol/L的荧光工作液,在37 ℃温育至少20 min并间歇摇动,等酶标板温度达到37 ℃后,迅速加入20 μL新鲜配制的119 mmol/L ABAP工作液,于激发波长485 nm,入射波长520 nm条件下立即读数,每4.5 min进行一次读数,共检测2.5 h。根据测定值计算ORAC值,按公式(3)计算荧光衰减曲线下的面积(AUC),按公式(4)计算ORAC值,最终的ORAC值以μmol TE/100 g计(干质量)。
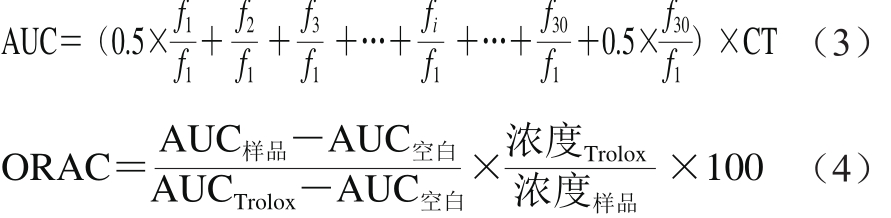
式中:f1为第1次荧光读数值;fi为第i次荧光读数值;CT为间隔测定时间/min。
1.4 数据处理
数据采用Peakview 1.2和Analyst 1.6(ABSciex)统计分析,实验重复3 次,结果以±s表示。
2.1 黑脉羊肚菌多酚含量测定结果
表1 黑脉羊肚菌多酚含量
Table 1 Polyphenols content of M. angusticepsPcek

由表1可知,游离酚含量为6.272 mg GAE/g,结合酚含量为0.618 mg GAE/g,游离酚含量约为结合酚10 倍,占总酚含量的91.03%,说明在黑脉羊肚菌中多酚主要以游离形式存在。
2.2 黑脉羊肚菌多酚的成分确定
黑脉羊肚菌游离酚提取物和结合酚提取物中主要的酚类物质均能得到有效分离,基峰色谱图见图1。所鉴定的多酚组分的保留时间、紫外特征吸收波长、m/z和特征离子碎片等信息见表2。
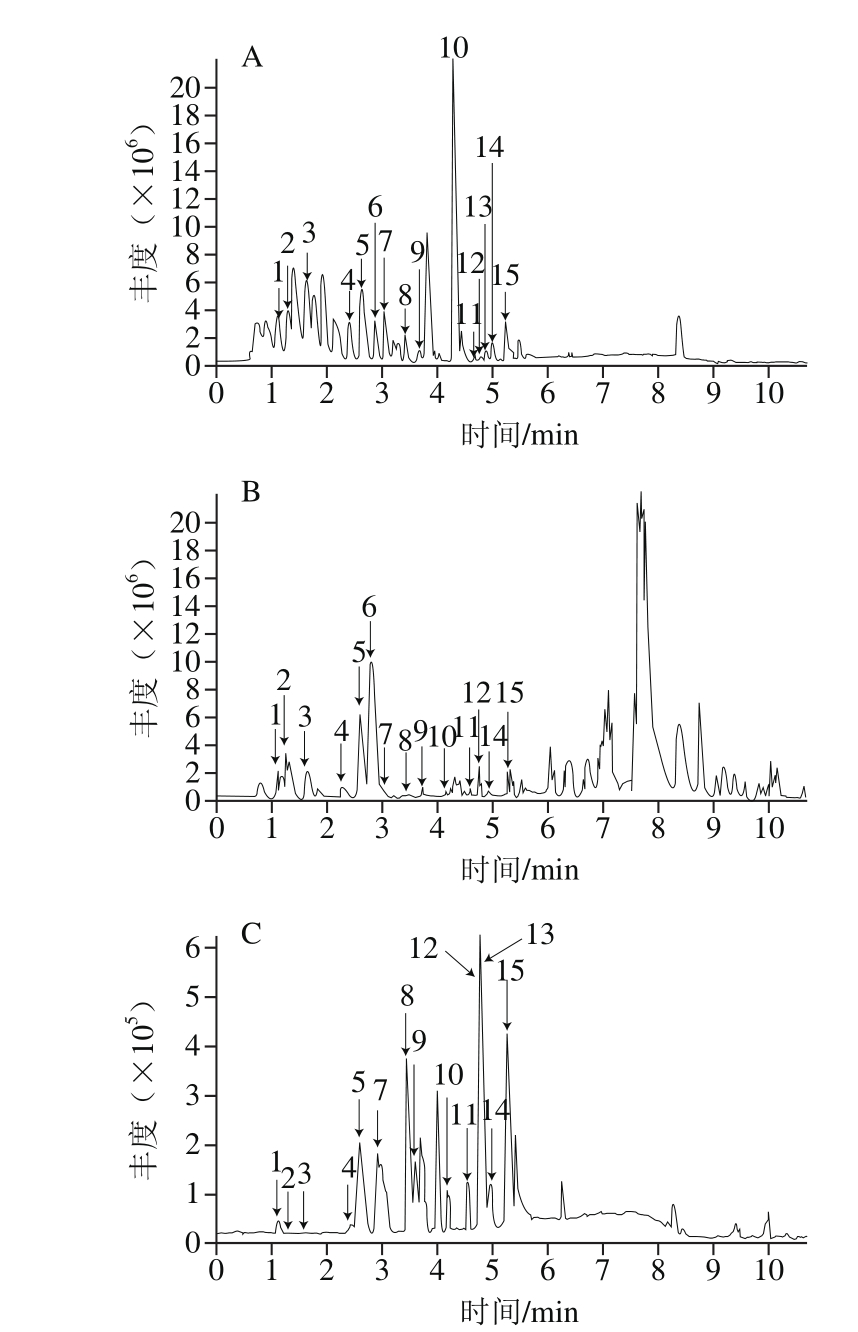
图1 游离酚(A)、结合酚(B)和混标(C)基峰色谱图
Fig. 1 Base peak chromatogram of free phenolic compounds (A), bound phenolic compounds (B) of M. angusticeps Pcek and mixture of phenolic standards (C)
峰1产生m/z 169的准分子离子峰,即[M-H]-为169,相对分子质量为170。在MS2中产生的主要碎片离子m/z 125.025 0是m/z 169失去一分子CO2得到的[M-CO2-H]-,与Biesaga[11]和Jiménez-Sánchez[12]等报道的没食子酸特征离子峰吻合,且峰1在MS及MS2中产生的碎片离子与没食子酸标准品特征离子峰相同。因此,峰1确定为没食子酸。
峰2产生m/z 125的准分子离子峰,即[M-H]-为125,相对分子质量为126。m/z 125在MS2中产生的主要碎片离子m/z 107.014 1、95.014 2、79.019 8和69.019 4,且在MS及MS2中产生的碎片离子与焦性没食子酸标准品特征离子峰相同。因此,峰2确定为焦性没食子酸。
峰3产生m/z 153的准分子离子峰,即[M-H]-为153,相对分子质量为154。在MS2中产生的主要碎片离子m/z 109.031 1,是m/z 153失去一分子CO2得到的[M-CO2-H]-,与Zhang Lu[13]和Iswaldi[14]等报道的原儿茶酸特征离子峰吻合,且在MS及MS2中产生的碎片离子与原儿茶酸标准品特征离子峰相同。因此,峰3确定为原儿茶酸。
峰4产生m/z 137的准分子离子峰,即[M-H]-为137,相对分子质量为138。在MS2中产生的主要碎片离子m/z 93.035 3为m/z 137失去一分子CO2形成的,即[MCO2-H]-,与Khallouki[15]和Biesaga[11]等报道的对羟基苯甲酸特征离子峰吻合,且在MS及MS2中产生的碎片离子与对羟基苯甲酸标准品特征离子峰相同。因此,峰4确定为对羟基苯甲酸。
峰5产生m/z 289的准分子离子峰,即[M-H]-为289,相对分子质量为290。m/z 289在MS2中产生的主要碎片离子m/z 245.083 2、221.083 4、203.072 2和179.035 7,与Khallouki[15]和Bastos[16]等报道的儿茶素特征离子峰基本吻合,m/z 245.083 1为分子离子峰失去一分子—CH2—CHOH—形成的,即[M-CH2-CHOH-H]-[17-18],且在MS及MS2中产生的碎片离子与儿茶素标准品特征离子峰相同。因此,峰5确定为儿茶素。
峰6产生m/z 179的准分子离子峰,即[M-H]-为179,相对分子质量为180。在MS2中产生的主要碎片离子m/z 135.045 9,是m/z 179失去一分子CO2得到的,即[M-CO2-H]-,与Zhang Lu[13]和Vallverdú-Queralt[19]等报道的咖啡酸特征离子峰吻合。因此,峰6确定为咖啡酸。
峰7产生m/z 353的准分子离子峰,即[M-H]-为353,相对分子质量为354。m/z 353在MS2中产生的主要碎片离子m/z 191.056 8、179.035 1和161.024 6,与Gouveia等[20]报道的3-O-咖啡酰奎宁酸特征离子峰吻合。m/z 191.056 8是分子离子失去一分子咖啡酰基得到,即[M-H-C9H8O3]-,m/z 179.035 1为分子离子失去一分子奎宁酰基得到,即[M-H-C7H10O5]-,m/z 161.024 6为咖啡酰基[21-22],且在MS及MS2中产生的碎片离子与绿原酸标准品特征离子峰相同,而绿原酸本质上为咖啡酸衍生物。因此,峰7确定为绿原酸。
峰8产生m/z 447的准分子离子峰,即[M-H]-为447,相对分子质量为448。m/z 447在MS2中产生的主要碎片离子m/z 357.063 6、327.053 0和299.057 4,与Ibrahim等[23]报道的荭草素特征离子峰基本吻合,m/z 357.063 2、327.052 7为单C-糖基黄酮类物质分子离子峰典型的C-糖基夸环断裂模式产生的代表性离子碎片,当0,2位断裂时形成[M-H-120]-,即m/z 327.052 7,当0,3位断裂时形成[M-H-90]-,即m/z 357.063 2[23-24],且在MS及MS2中产生的碎片离子与荭草素标准品特征离子峰相同。因此,峰8确定为荭草素。
峰9产生m/z 609的准分子离子峰,即[M-H]-为609,相对分子质量为610。m/z 609在MS2中产生的主要碎片离子m/z 301.037 2和m/z 300.028 9,与Riffault等[21]报道的芦丁特征离子峰吻合,m/z 301.037 2为分子离子峰失去一分子芸香糖苷所得槲皮素分子离子峰,即[MC12H20O9-H]-,m/z 300.028 9为槲皮素分子离子峰去H所得[19],且在MS及MS2中产生的碎片离子与芦丁标准品特征离子峰相同。因此,峰9确定为芦丁。
峰10产生m/z 463的准分子离子峰,即[M-H]-为463,相对分子质量为464。m/z 463在MS2中产生的主要碎片离子m/z 301.036 9、300.029 3、271.026 0、255.031 3和151.004 6,与Riffault等[21]报道的金丝桃苷特征离子峰基本吻合,m/z 301.036 9为分子离子峰失去一分子己糖苷形成的槲皮素分子离子峰,即[M-C6H10O5-H]-,m/z 300.029 3为槲皮素分子离子峰去H所得,其余碎片均为槲皮素的特征碎片[25],且在MS及MS2中产生的碎片离子与金丝桃苷标准品特征离子峰相同。因此,峰10确定为金丝桃苷。
峰11产生m/z 227的准分子离子峰,即[M-H]-为227,相对分子质量为228。m/z 227在MS2中产生的主要碎片离子m/z 185.062 1和m/z 143.051 1,与Hollecker等[26]报道的顺式和反式白藜芦醇特征离子峰基本吻合,且在MS及MS2中产生的碎片离子与白藜芦醇标准品特征离子峰相同。因此,峰11确定为白藜芦醇。
峰12产生m/z 285的准分子离子峰,即[M-H]-为285,相对分子质量为286。m/z 285在MS2中产生的主要碎片离子m/z 151.004 3、133.030 0和107.014 8等,与Biesaga等[11]报道的木犀草素特征离子峰基本吻合,分子离子峰的裂解规律可能和槲皮素的相似,即m/z 151.004 4和m/z 133.030 1可能为分子离子发生逆狄尔斯-阿德尔反应裂解并在1 位和3 位键裂解后发生逆环化反应形成的[27-28],且在MS及MS2中产生的碎片离子与木犀草素标准品特征离子峰相同。因此,峰12确定为木犀草素。
峰13产生m/z 301的准分子离子峰,即[M-H]-为301,相对分子质量为302。m/z 301在MS2中产生的主要碎片离子m/z 273.041 1、257.238 8、229.051 8、178.998 9、164.011 2和151.004 2等,与de Souza[25]和Biesaga[11]等报道的槲皮素特征离子峰基本吻合,m/z 273.041 1为分子离子峰失去一分子CO形成的,即[MCO-H]-,m/z 257.238 8为分子离子峰失去一分子CO2形成的,即[M-CO2-H]-,m/z 178.998 9和m/z 164.011 2为分子离子发生逆狄尔斯-阿德尔反应裂解并在1位和2位键裂解后发生逆环化反应形成的,m/z 151.004 2为m/z 178.998 9的离子失去一分子CO形成的[27-29],且在MS及MS2中产生的碎片离子与槲皮素标准品特征离子峰相同。因此,峰13确定为槲皮素。
峰14产生m/z 147的准分子离子峰,即[M-H]-为147,相对分子质量为148。m/z 147在MS2中产生的主要碎片离子m/z 119.050 0、103.056 2、77.040 4和61.988 4,与Ibrahim等[23]报道的肉桂酸特征离子峰有相同部分,根据Jiménez-Sánchez等[12]总结的在二级质谱中一般损失的中性离子分子质量和Pérez-Magariño等[17]报道的一般酚酸失去低分子质量离子的规律,m/z 119.050 0可能为分子离子峰失去一分子CO形成的,即[M-CO-H]-,m/z 103.056 2可能为分子离子峰失去一分子CO2形成的,即[M-CO2-H]-,m/z 77.040 4可能为分子离子峰失去一分子-CH=CH-COO-,即[M-CH=CH-COO-H]-,且在MS及MS2中产生的碎片离子与肉桂酸标准品特征离子峰相同。因此,峰14确定为肉桂酸。
峰15产生m/z 193的准分子离子峰,即[M-H]-为193,相对分子质量为194。m/z 193在MS2中产生的主要碎片离子m/z 178.028 1、149.061 1和m/z 134.038 3、178.0281,为分子离子峰失去一分子-CH3形成的,即[M-CH3-H]-,m/z 149.061 1为分子离子峰失去一分子CO2形成的,即[M-CO2-H]-,m/z 134.038 3为分子离子峰失去一分子甲基和一分子CO2形成的,即[M-CH3-CO2-H]-,与Biesaga等[11]报道的阿魏酸特征离子峰基本吻合,且在MS及MS2中产生的碎片离子与阿魏酸标准品特征离子峰相同。因此,峰15确定为阿魏酸。
表2 UPLC-DAD/ESI-TOF-MS鉴定羊肚菌多酚组分
Table 2 Identification of the phenolic components of M. angusticeps Pcek by UPLC-DAD/ESI-TOF-MS

注:+.检出;-.未检出。
2.3 黑脉羊肚菌多酚的抗氧化测定结果
采用4 种化学抗氧化活性法测定黑脉羊肚菌多酚的抗氧化活性,以半数抑制率EC50值作为DPPH自由基、还原力和ABTS+·清除能力大小的评价指标[30],如图2所示。
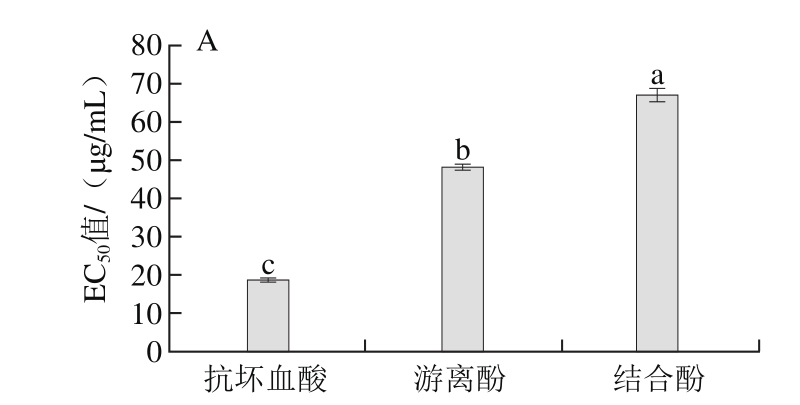
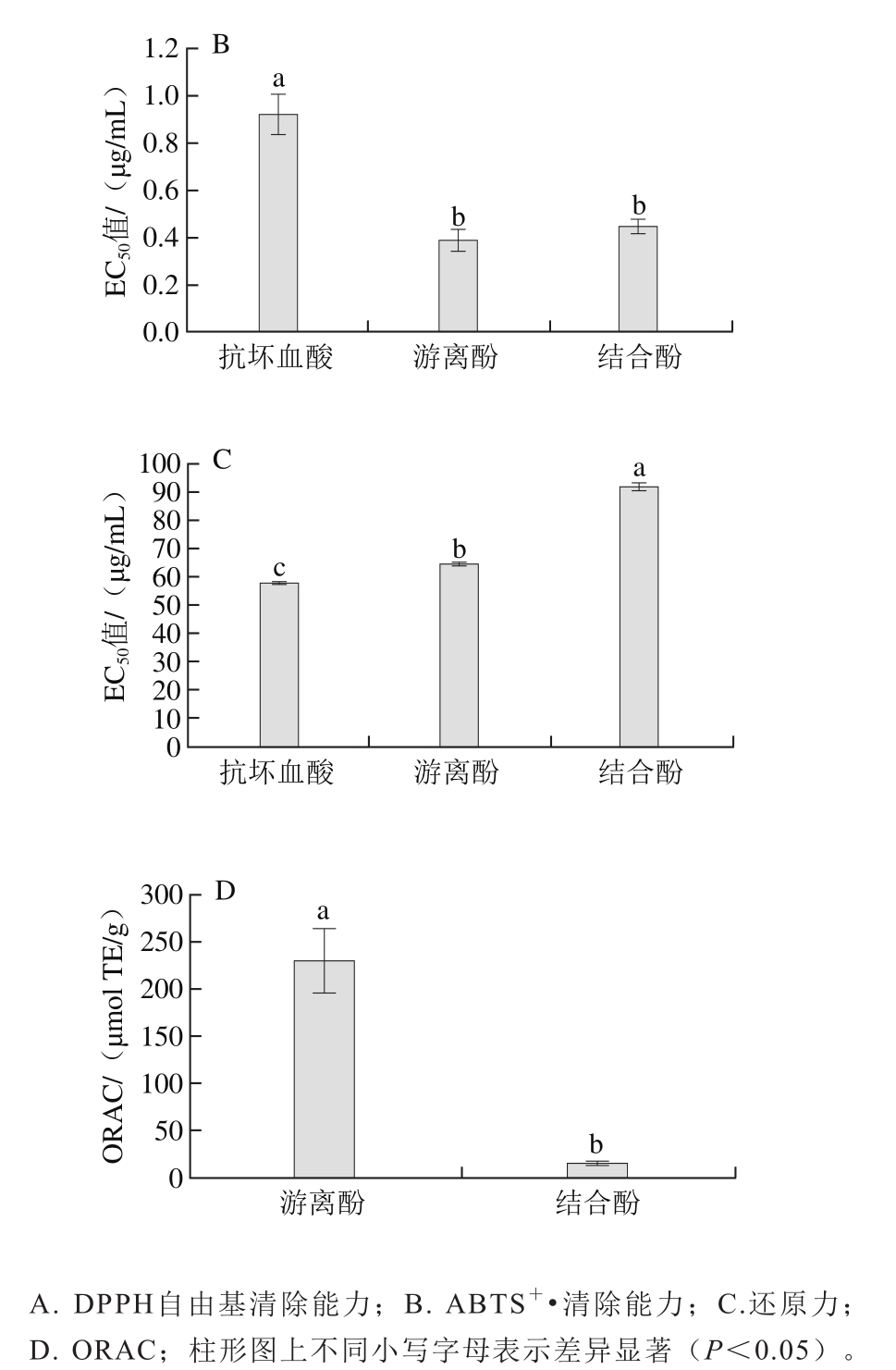
图2 黑脉羊肚菌多酚抗氧化活性
Fig. 2 Antioxidant activities of polyphenols in M. angusticeps Pcek
由图2可知,黑脉羊肚菌游离酚提取物和结合酚提取物清除DPPH自由基的EC50值分别为48.358 μg/mL和67.411 μg/mL,说明游离酚提取物清除DPPH自由基能力显著强于结合酚提取物,且两者均显著弱于抗坏血酸(EC50值18.602 μg/mL)(P<0.05);清除ABTS+•EC50值分别为0.392 μg/mL和0.454 μg/mL,说明游离酚提取物与结合酚提取物清除ABTS+•能力相当,无显著性差异(P<0.05);但两者均显著强于抗坏血酸(EC50值0.927 μg/mL)(P<0.05);还原力EC50值分别为64.543 μg/mL和91.871 μg/mL,说明游离酚提取物还原力显著强于结合酚提取物,且两者均显著弱于抗坏血酸(EC50值58.194 μg/mL)(P<0.05);ORAC值分别为231.698 μmoL TE/g 和15.272 μmoL TE/g,说明游离酚提取物氧自由基吸收能力远强于结合酚提取物。
本研究通过UPLC-DAD/ESI-TOF-MS技术鉴定出黑脉羊肚菌多酚提取物共有15 种组分,其中8种酚酸类、6 种黄酮类、1 种二苯乙烯类,分别是没食子酸、焦性没食子酸、原儿茶酸、对羟基苯甲酸、肉桂酸、阿魏酸、咖啡酸、绿原酸、荭草素、儿茶素、芦丁、金丝桃苷、木犀草素、槲皮素、白藜芦醇。其中游离酚提取物中有15 种,结合酚提取物中有14 种,没有槲皮素。
一些研究表明食用菌中多酚组分主要是酚酸类物质,如双孢蘑菇中主要为咖啡酸、原儿茶酸、儿茶素、没食子酸、阿魏酸、杨梅素[31];硫磺菌等7 种食用菌中主要为咖啡酸、绿原酸、对香豆酸、阿魏酸、没食子酸、对羟基苯甲酸、杨梅素[32],而本实验结果发现黑脉羊肚菌多酚提取物中除了常见的食用菌多酚组分外还含有一些黄酮类物质。另外,基峰色谱图中还有很多峰,根据紫外特征吸收峰、母离子碎片和二级质谱碎片不能准确分析是何种物质,因此,推断黑脉羊肚菌多酚提取物中还含有其他较复杂的酚类物质及衍生物,需要优化质谱条件或者用多级串联质谱进行分析,以更全面分析黑脉羊肚菌多酚类物质组成。
参考文献:
[1] DINELLI G, SEGURA C A, DI SILVESTRO R, et al. Determination of phenolic compounds in modern and old varieties of durum wheat using liquid chromatography coupled with time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(43): 7229-7240. DOI:10.1016/j.chroma.2009.08.041.
[2] 黄晶晶, 李倩, 高小康, 等. 高效液相色谱-电喷雾-飞行时间串联质谱分析泽兰水提物[J]. 中草药, 2013, 44(16): 2218-2222. DOI:10.7501/J.ISSN.0253-2670.2013.16.005.
[3] 王百川, 付绍平, 王丹, 等. 超高压液相色谱-飞行时间质谱法分析国产油橄榄叶中酚类化合物[J]. 食品科学, 2011, 32(18): 225-229.
[4] OKARTER N, LIU C, SORRELLS M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257. DOI:10.1016/ j.foodchem.2009.06.021.
[5] NUUTILA A M, KAMMIOVIRTA K, OKSMAN-CALDENTEy K. Comparison of methods for the hydrolysis of flavonoids and phenolic acids from onion and spinach for HPLC analysis[J]. Food Chemistry, 2002, 76(4): 519-525. DOI:10.1016/S0308-8146(01)00305-3.
[6] CHU y, SUN J, WU X, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916. DOI:10.1021/jf020665f.
[7] CHEUNG L M, CHEUNG P C K, OOI V E C. Antioxidant activity and total phenolics of edible mushroom extracts[J]. Food Chemistry, 2003, 81(2): 249-255. DOI:10.1016/S0308-8146(02)00419-3.
[8] ARDESTANI A, yAZDANPARAST R. Antioxidant and free radical scavenging potential of Achillea santolina extracts[J]. Food Chemistry, 2007, 104(1): 21-29. DOI:10.1016/j.foodchem.2006.10.066.
[9] SOONG y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417. DOI:10.1016/j.foodchem.2004.02.003.
[10] WOLFE K L, KANG X, HE X, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8418-8426. DOI:10.1021/jf801381y.
[11] BIESAGA M, PyRZyNSKA K. Liquid chromatography/tandem mass spectrometry studies of the phenolic compounds in honey[J]. Journal of Chromatography A, 2009, 1216(38): 6620-6626. DOI:10.1016/ j.chroma.2009.07.066.
[12] JIMÉNEZ-SÁNCHEZ C, LOZANO-SÁNCHEZ J, GABALDÓNHERNÁNDEZ J A, et al. RP-HPLC-ESI-QTOF/MS2based strategy for the comprehensive metabolite profiling of Sclerocarya birrea (marula) bark[J]. Industrial Crops and Products, 2015, 71: 214-234. DOI:10.1016/j.indcrop.2015.01.068.
[13] ZHANG Lu, TU Zongcai, WANG Hui, et al. Comparison of different methods for extracting polyphenols from Ipomoea batatas leaves, and identification of antioxidant constituents by HPLC-QTOF-MS2[J]. Food Research International, 2015, 70: 101-109. DOI:10.1016/ j.foodres.2015.01.012.
[14] ISWALDI I, GÓMEZ-CARAVACA A M, LOZANO-SÁNCHEZ J, et al. Profiling of phenolic and other polar compounds in zucchini (Cucurbita pepo L.) by reverse-phase high-performance liquid chromatography coupled to quadrupole time-of-flight mass spectrometry[J]. Food Research International, 2013, 50(1): 77-84. DOI:10.1016/j.foodres.2012.09.030.
[15] KHALLOUKI F, HAUBNER R, RICARTE I, et al. Identification of polyphenolic compounds in the flesh of Argan (Morocco) fruits[J]. Food Chemistry, 2015, 179: 191-198. DOI:10.1016/ j.foodchem.2015.01.103.
[16] BASTOS D H M, SALDANHA L A, CATHARINO R R, et al. Phenolic antioxidants identifled by ESI-MS from yerba mate (Ilex paraguariensis) and green tea (Camelia sinensis) extracts[J]. Molecules, 2007, 12(3): 423-432. DOI:10.3390/12030423.
[17] PÉREZ-MAGARI O S, REVILLA I, GONZÁLEZ-SANJOSÉ M L, et al. Various applications of liquid chromatography-mass spectrometry to the analysis of phenolic compounds[J]. Journal of Chromatography A, 1999, 847(1/2): 75-81. DOI:10.1016/S0021-9673(99)00255-1.
[18] RODRÍGUEZ-MEDINA I C, SEGURA-CARRETERO A, FERNÁNDEZ-GUTIÉRREZ A. Use of high-performance liquid chromatography with diod array detection coupled to electrospray-Q-time-of-flight mass spectrometry for the direct characterization of the phenolic fraction in organic commercial juices[J]. Journal of Chromatography A, 2009, 1216(23): 4736-4744. DOI:10.1016/ j.chroma.2009.04.022.
[19] VALLVERDU-QUERALT A, JAUREGUI O, DI LECCE G, et al. Screening of the polyphenol content of tomato-based products through accurate-mass spectrometry (HPLC-ESI-QTOF)[J]. Food Chemistry, 2011, 129(3): 877-883. DOI:10.1016/j.foodchem.2011.05.038.
[20] GOUVEIA S, CASTILHO P C. Characterisation of phenolic acid derivatives and flavonoids from different morphological parts of Helichrysum obconicum by a RP-HPLC-DAD-(−)-ESI-MSnmethod[J]. Food Chemistry, 2011, 129(2): 333-344. DOI:10.1016/ j.foodchem.2011.04.078.
[21] RIFFAULT L, DESTANDAU E, PASQUIER L, et al. Phytochemical analysis of Rosa hybrida cv. ‘Jardin de Granville’ by HPTLC, HPLCDAD and HPLC-ESI-HRMS: polyphenolic fingerprints of six plant organs[J]. Phytochemistry, 2014, 99: 127-134. DOI:10.1016/ j.phytochem.2013.12.015.
[22] REGUEIRO J, SANCHEZ-GONZALEZ C, VALLVERDU-QUERALT A, et al. Comprehensive identification of walnut polyphenols by liquid chromatography coupled to linear ion trap-orbitrap mass spectrometry[J]. Food Chemistry, 2014, 152: 340-348. DOI:10.1016j. foodchem./2013.11.158.
[23] IBRAHIM R M, EL-HALAWANy A M, SALEH D O, et al. HPLCDAD-MS/MS profiling of phenolics from Securigera securidaca flowers and its anti-hyperglycemic and anti-hyperlipidemic activities[J]. Revista Brasileira de Farmacognosia, 2015, 25(2): 134-141. DOI:10.1016/j.bjp.2015.02.008.
[24] FIGUEIRINHA A, PARANHOS A, PÉREZ-ALONSO J J, et al. Cymbopogon citratus leaves: characterization of flavonoids by HPLCPDA-ESI/MS/MS and an approach to their potential as a source of bioactive polyphenols[J]. Food Chemistry, 2008, 110(3): 718-728. DOI:10.1016/j.foodchem.2008.02.045.
[25] DE SOUZA L M, CIPRIANI T R, IACOMINI M, et al. HPLC/ESIMS and NMR analysis of flavonoids and tannins in bioactive extract from leaves of Maytenus ilicifolia[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(1): 59-67. DOI:10.1016/ j.jpba.2007.12.008.
[26] HOLLECKER L, PINNA M, FILIPPINO G, et al. Simultaneous determination of polyphenolic compounds in red and white grapes grown in Sardinia by high performance liquid chromatography-electron spray ionisation-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(15): 3402-3408. DOI:10.1016/j.chroma.2009.02.010.
[27] ISWALDI I, ARRÁEZ-ROMÁN D, GÓMEZ-CARAVACA A M, et al. Identification of polyphenols and their metabolites in human urine after cranberry-syrup consumption[J]. Food and Chemical Toxicology, 2013, 55: 484-492. DOI:10.1016/j.fct.2013.01.039.
[28] DUEÑAS M, MINGO-CHORNET H, PÉREZ-ALONSO J J, et al. Preparation of quercetin glucuronides and characterization by HPLCDAD-ESI/MS[J]. European Food Research and Technology, 2008, 227(4): 1069-1076. DOI:10.1007/s00217-008-0821-2.
[29] KOOLEN H H F, DA SILVA F M A, GOZZO F C, et al. Antioxidant, antimicrobial activities and characterization of phenolic compounds from buriti (Mauritia flexuosa L. f.) by UPLC-ESI-MS/MS[J]. Food Research International, 2013, 51(2): 467-473. DOI:10.1016/j. foodres.2013.01.039.
[30] WOLDEGIORGIS A Z, ABATE D, HAKI G D, et al. Antioxidant property of edible mushrooms collected from Ethiopia[J]. Food Chemistry, 2014, 157: 30-36. DOI:10.1016/j.foodchem.2014.02.014.
[31] LIU J, JIA L, KAN J, et al. In vitro and in vivo antioxidant activity of ethanolic extract of white button mushroom (Aguricus bisporus)[J]. Food and Chemical Toxicology, 2013, 51: 310-316. DOI:10.1016/ j.fct.2012.10.014.
[32] WOLDEGIORGIS A Z, ABATE D, HAKI G D, et al. Antioxidant property of edible mushrooms collected from Ethiopia[J]. Food Chemistry, 2014, 157: 30-36. DOI:10.1016/j.foodchem.2014.02.014.
Analysis of Phenolic Compounds in Morchella angusticeps Peck by Ultra Performance Liquid Chromatography-Diode Array Detector/Electrospray Ionization-Time of Fight-Mass Spectrometry
SHI Fang1, LIAO Xia1, LU Keke1, ZHENG Shaojie1, XIAO Xingning1, WU Surui2, MING Jian1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Kunming Edible Fungi Institute, All China Federation of Supply and Marketing Cooperatives, Kunming 650223, China; 3. Chongqing Engineering Research Center for Special Food, Chongqing 400715, China)
Abstract:Free and bound phenolics from Morchella angusticeps Peck were separately extracted and analyzed by ultra performance liquid chromatography-diode array detector/electrospray ionization-time of fight-mass spectrometry (UPLCDAD/ESI-TOF-MS). The antioxidant activities of the phenolic extracts were assessed. The results showed that phenolics were present mainly in the free form in Morchella angusticeps Peck. The DPPH (1,1-dipheny1-2-picryl-hydrazyl) scavenging capacity, reducing power and oxygen radical absorption capacity (ORAC) value of free phenolics from Morchella angusticeps Peck were significantly higher than those of bound ones (P < 0.05), but no significant difference in ABTS+· (2,2’-amino-di (3-ethyl-benzothiazoline sulphonic acid-6) ammonium salt) scavenging capacity existed between free and bound phenolics. A total of 15 polyphenols in Morchella angusticeps Peck, including gallic acid, pyrogallic acid, protocatechuic acid, p-hydroxybenzoic acid, catechin, caffeic acid, chlorogenic acid, orientin, rutin, hyperoside, resveratrol, luteolin, quercetin, cinnamic acid and ferulic acid, were identified. We identified 15 and 14 components in the free and bound phenolic extracts, respectively.
Key words:Morchella angusticeps Peck; polyphenol; UPLC-DAD/ESI-TOF-MS; antioxidant activities
DOI:10.7506/spkx1002-6630-201716018
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)16-0115-07
引文格式:
石芳, 廖霞, 卢可可, 等. UPLC-DAD/ESI-TOF-MS鉴定黑脉羊肚菌多酚化合物[J]. 食品科学, 2017, 38(16): 115-121. DOI:10.7506/spkx1002-6630-201716018. http://www.spkx.net.cn
收稿日期:2016-11-17
基金项目:国家自然科学基金面上项目(31471576);中央高校基本科研业务费专项(XDJK2016E113;XDJK2015D035);云南省科技厅科技创新人才计划项目(2008OC008);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
作者简介:石芳(1993—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:1107982769@qq.com
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com
SHI Fang, LIAO Xia, LU Keke, et al. Analysis of phenolic compounds in Morchella angusticeps Peck by ultra performance liquid chromatography-diode array detector/electrospray ionization-time of fight-mass spectrometry[J]. Food Science, 2017, 38(16): 115-121. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201716018. http://www.spkx.net.cn