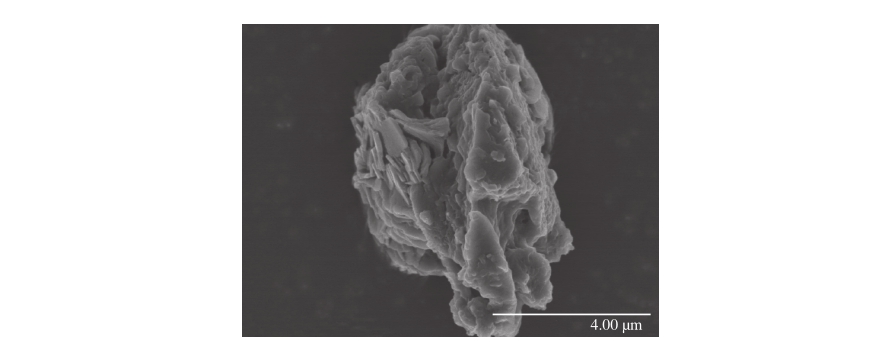
图1 合成的g-C3N4扫描电子显微镜图像
Fig. 1 Scanning electron microscopy (SEM) images of synthesized g-C3N4 sample
李 成,朱南南,王 星,谢静文,刘素芹*
(湖北文理学院化学工程与食品科学学院,低维光电材料与器件湖北省重点实验室,湖北 襄阳 441053)
摘 要:利用三聚氰胺制备石墨相的氮化碳,即g-C3N4,以氯化镍和g-C3N4为基础物质采用电沉积方法制备复合化学修饰电极。通过对裸电极、NiO/GCE、g-C3N4/GCE和NiO/g-C3N4/GCE对抗坏血酸的催化效果的比较,发现NiO和g-C3N4的复合修饰电极对抗坏血酸具有良好的电催化氧化作用。扫描速率在70~200 mV/s范围内,峰电流与扫描速率呈良好的线性关系:Ipa=-34.14-1.167v,R=0.998;Ipc=53.42+0.357 8v,R=0.982。峰电位随扫描速率增大有一定的偏移,说明该修饰电极的氧化还原过程受表面控制。当抗坏血酸的质量浓度介于0.017 6~22.88 μg/mL时,其氧化峰电流与质量浓度具有良好的线性关系,方程为:Ipa=-1.435+2.900C,R=0.998,检出限为0.008 8 μg/mL。该传感器的选择性、重复性和稳定性良好,可用于果汁中抗坏血酸的检测。
关键词:氧化镍;g-C3N4;电沉积;抗坏血酸;修饰电极
NiO是一种用途广泛的无机材料,在催化剂、玻璃、热敏元件、功能陶瓷等方面具有广泛的用途[1-3]。g-C3N4具有硬度高、密度低、化学稳定性高、耐磨性强、生物兼容性好等优点。在膜材料、催化剂及催化剂载体、高性能耐磨涂层、金属氮化物的制备等领域具有非常广泛的应用前景,长期以来受到研究人员的广泛关注[4-5]。
抗坏血酸是维持人体健康不可缺少的维生素。研究发现缺乏抗坏血酸会造成坏血病和免疫力低下等多种疾病,其含量高低常作为某些疾病诊断及营养分析的重要指标,抗坏血酸的测定在食品医药中也有着重大的意义[6]。目前测定抗坏血酸的方法较多,包括药典中的标准方法——碘量法[7]、比色法[8-9]、荧光法[10-14]、高效液相色谱法[15-18]、化学发光法[19-21]和化学修饰电化学法[22-27]等。其中化学修饰电极的出现降低了抗坏血酸的过电位,分析速度快,操作简便易行,成本低及试剂用量少,检测灵敏度高,是抗坏血酸含量测定不可缺少的有力手段。因此,本实验利用三聚氰胺制备g-C3N4,用电沉积的方法制备NiO,两者复合制备了NiO/g-C3N4修饰玻碳电极。利用循环伏安法和计时电流法研究了抗坏血酸在该电极上的电化学行为。实验证明,该修饰电极对抗坏血酸具有明显的电催化氧化作用。该传感器具有选择性、重复性和稳定性好等特点,可用于果汁中抗坏血酸的定量检测。
1.1 材料与试剂
三聚氰胺、氯化镍、盐酸多巴胺、抗坏血酸、尿酸、葡萄糖(均为分析纯)、磷酸盐缓冲溶液(phosphate buffer saline,PBS) 国药集团化学试剂有限公司。实验用水为二次去离子水。
1.2 仪器与设备
RST5000电化学工作站 苏州瑞思特仪器有限公司;S-4800扫描电子显微镜 日本日立公司;三电极体系:修饰电极作为工作电极(玻碳电极),饱和甘汞电极作为参比电极,铂电极作为辅助电极,购于上海辰华仪器有限公司。
1.3 方法
1.3.1 g-C3N4的制备
称取大约5.00 g三聚氰胺于坩埚中,然后放入马弗炉中,以3 ℃/min升温速率升至550 ℃,保温2 h,然后冷却至室温。将得到的黄色块状固体置于玛瑙研钵中研磨,得到的黄色粉末为g-C3N4。称取0.1 g制得粉末g-C3N4于烧杯中,加入200 mL水,置于超声波清洗机中超声12 h。将得到的悬浊液离心分离,然后于80 ℃干燥10 h,即得g-C3N4纳米片[28-29]。
1.3.2 修饰电极的制备
分别用粒径为0.3 μm和0.05 μm的Al2O3乳液将裸玻碳电极(直径2 mm)抛光至镜面,每次抛光后用去离子水超声清洗3 次,每次2 min,晾干备用。
称取0.2 mg所制备的g-C3N4粉末加入1 mL乙醇中,超声分散,待g-C3N4分散完全后,取5 μL分散液滴涂到处理好的电极上,自然风干,记作g-C3N4/GCE。
将之前处理好的裸玻碳电极放在含有5×10-3mol/L NiCl2的0.1 mol/L(pH 7.0)PBS溶液中,在0~-1.5 V电位范围内,以0.1 V/s的扫描速率循环扫描30 圈,即得氧化镍修饰电极,记作NiO/GCE。
取g-C3N4/GCE修饰电极,重复NiO/GCE操作,得到NiO/g-C3N4修饰电极,记作NiO/g-C3N4/GCE。
2.1 合成g-C3N4的扫描电子显微镜表征

图1 合成的g-C3N4扫描电子显微镜图像
Fig. 1 Scanning electron microscopy (SEM) images of synthesized g-C3N4 sample
如图1所示,经过超声分散处理后,所合成的g-C3N4为较小尺寸的片状纳米片的聚集结构。每个薄片的厚度小于50 nm,宽度约为几百纳米。
2.2 电极的制备过程
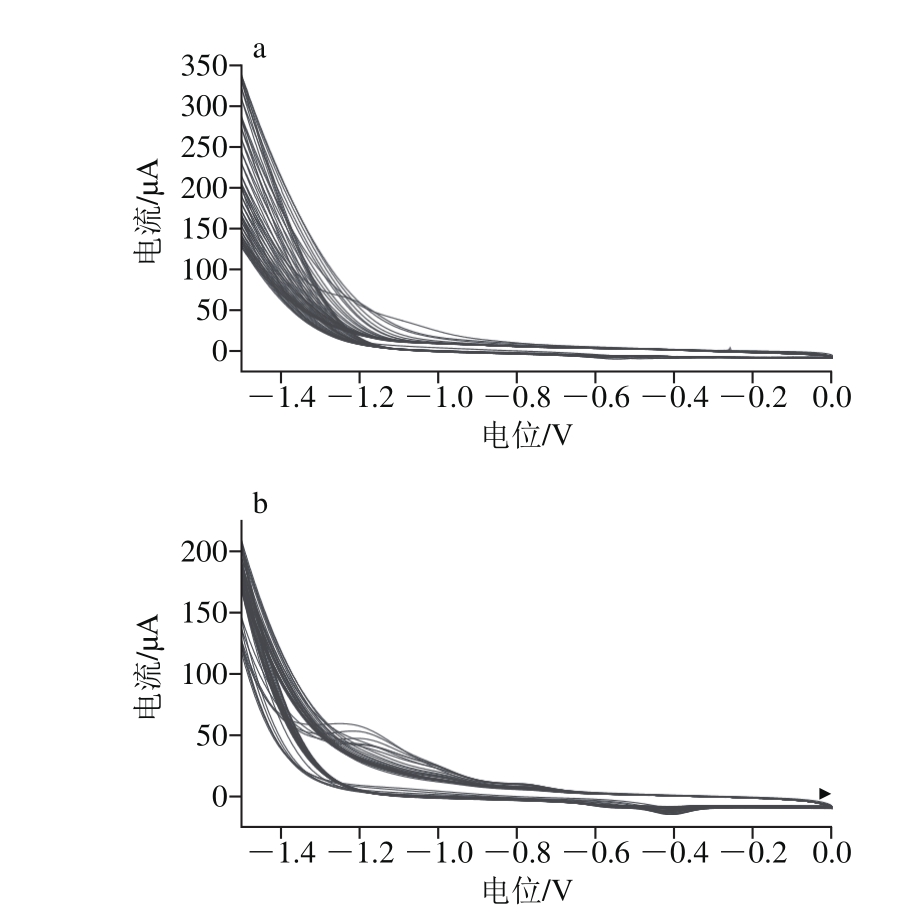
图2 单独NiO的电沉积(a)和NiO/g-C3N4/GCE制备过程(b)循环伏安图
Fig. 2 Cyclic voltammograms for electrodeposition of NiO (a) and preparation of NiO/g-C3N4composite modified electrodes (b)
如图2a所示,裸玻碳电极在含有5×10-3mol/L Ni2+的0.1 mol/L(pH 7.0)PBS溶液中电沉积NiO的过程中,只有在-0.60 V左右有一个微弱的氧化峰,则说明单独的氧化镍沉积是一个不可逆的过程。而且峰电流很小,响应不是很明显。如图2b所示,涂有g-C3N4电极在含有5×10-3mol/L Ni2+的0.1 mol/L(pH 7.0)PBS溶液中沉积NiO的过程中,在-0.40 V和-0.78 V以及-0.60 V和-1.20 V均出现了一对氧化还原峰,说明在g-C3N4修饰电极上电沉积NiO是一个准可逆的过程。由于二者的协同效应,促进了电子的传递,峰电流增加,效果明显。
2.3 抗坏血酸在不同电极上的电化学行为
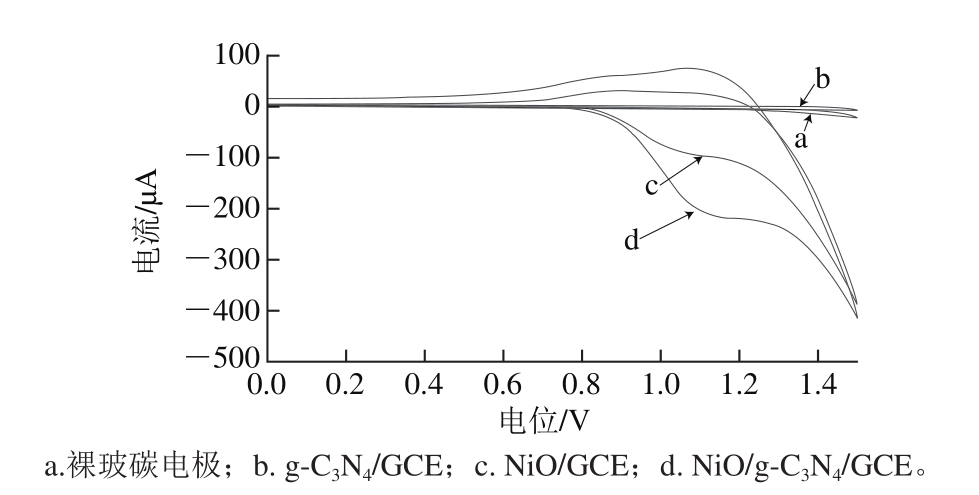
图3 抗坏血酸在不同修饰电极上的循环伏安图
Fig. 3 Cyclic voltammograms of AA (17.6 μg/mL) in 0.1 mol/L PBS (pH 7.0) with a scanning rate of 100 mV/s
分别考察裸玻碳电极、g-C3N4/GCE、NiO/GCE、NiO/g-C3N4/GCE分别在含有17.6 μg/mL抗坏血酸的0.1 mol/L(pH 7.0)PBS溶液中的电化学行为。从图3可以看出,在裸玻碳电极和g-C3N4修饰电极上,抗坏血酸基本没有氧化还原峰出现,说明单独的g-C3N4修饰电极对抗坏血酸没有催化作用;在c曲线NiO/GCE上,有明显的氧化峰出现;在d曲线NiO/g-C3N4/GCE上氧化峰电流明显增加。由此说明了g-C3N4的修饰大大增加了NiO的附着面积,也增加了复合修饰电极的电催化性能。
2.4 实验条件的优化
2.4.1 滴涂体积及电沉积圈数的选择
实验过程中考虑了修饰物量的影响,主要包括g-C3N4的滴涂体积以及电沉积NiO的圈数。分别移取1、3、5、7、10 μL相同质量浓度的g-C3N4分散液滴涂在已处理好的玻碳电极上,自然晾干,置于NiCl2溶液中循环伏安扫描30 圈进行实验。结果表明:抗坏血酸在修饰电极上的氧化峰电流随着g-C3N4分散液修饰量的增加而增大,当修饰量等于5 μL时峰电流最大,后随着修饰量的增加,峰电流反而减小。另外,控制g-C3N4分散液的体积为5 μL,改变NiO的电沉积圈数进行实验。结果表明:随着电沉积圈数的增加,抗坏血酸的氧化峰电流逐渐增加,30 圈时峰电流达到最大,继续增加电沉积圈数,峰电流降低。这是由于电极表面修饰量过多,导致其修饰层过厚,电子传输迟钝,从而阻碍了电极表面的电催化作用的发生。因此采用5 μL g-C3N4分散液和电沉积30 圈进行修饰。
2.4.2 支持电解质pH值的影响
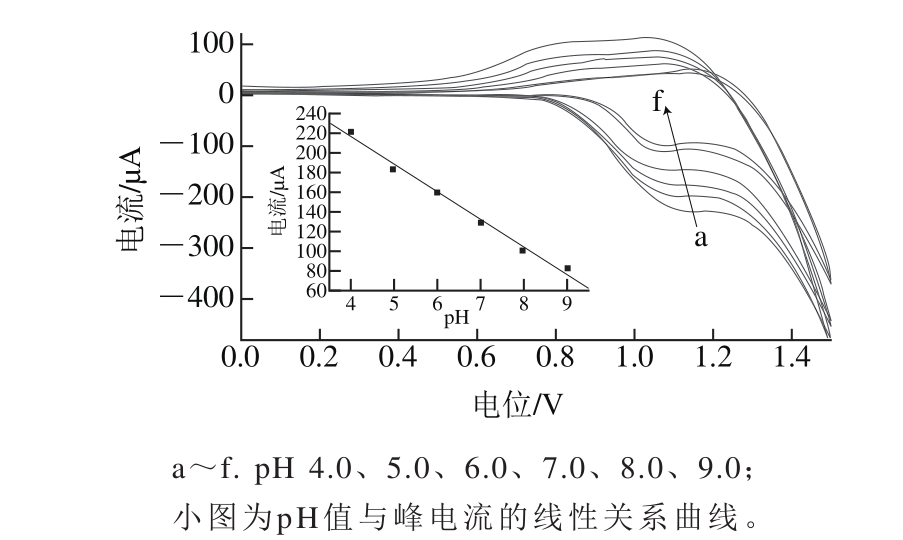
图4 NiO/g-C3N4/GCE修饰电极在不同pH值的PBS溶液中的循环伏安曲线
Fig. 4 Effects of pH on the NiO/g-C3N4/GCE-modified electrode response to 17.6 μg/mL AA in 0.1 mol/L PBS at the scanning rate of 100 mV/s
PBS溶液的pH值显著影响着抗坏血酸的电流响应强度和峰电位值。如图4所示,pH值在4.0~9.0范围内循环伏安线性扫描稳定,随着pH值的升高抗坏血酸的氧化峰电位值均负移,峰电流均呈减小趋势。表明质子参与了抗坏血酸的氧化过程。根据文献[30]报道,抗坏血酸的氧化机理为C6H8O6-2e-2H+→C6H6O6,从反应式中可以得出,抗坏血酸的氧化应该是一个2质子2电子的过程。根据图4小图,峰电流与pH值的关系曲线为Ip=-0.027 97pH+ 0.327 3,其线性响应斜率为0.059/n为0.027 97,可以证明n约等于2,因此结论与文献[30]一致,也是一个2质子2电子的过程。考虑到抗坏血酸的氧化还原反应具有良好的响应和可逆性,pH值过小会导致电极修饰物溶解,过大则响应电流小,故选择pH 7.0的PBS作为其支持电解质。
2.4.3 扫描速率的影响
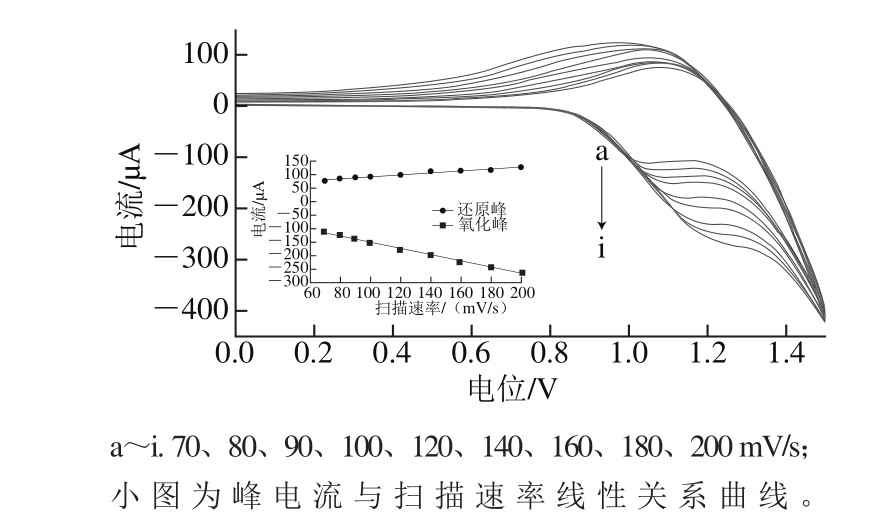
图5 NiO/g-C3N4/GCE在不同扫描速率条件下循环伏安图
Fig. 5 Cyclic voltammograms of NiO/g-C3N4/GCE at various scanning rates
如图5所示,随着扫描速率的增大,该修饰电极的氧化还原峰电流不断增大,峰电位差变大。峰电流与扫描速率呈良好的线性关系,线性方程分别为:Ipa=-34.14-1.167v,R=0.998;Ipc=53.42+0.357 8v,R=0.982。说明该修饰电极的氧化还原过程受表面控制。
2.5 电催化检测抗坏血酸
2.5.1 电催化
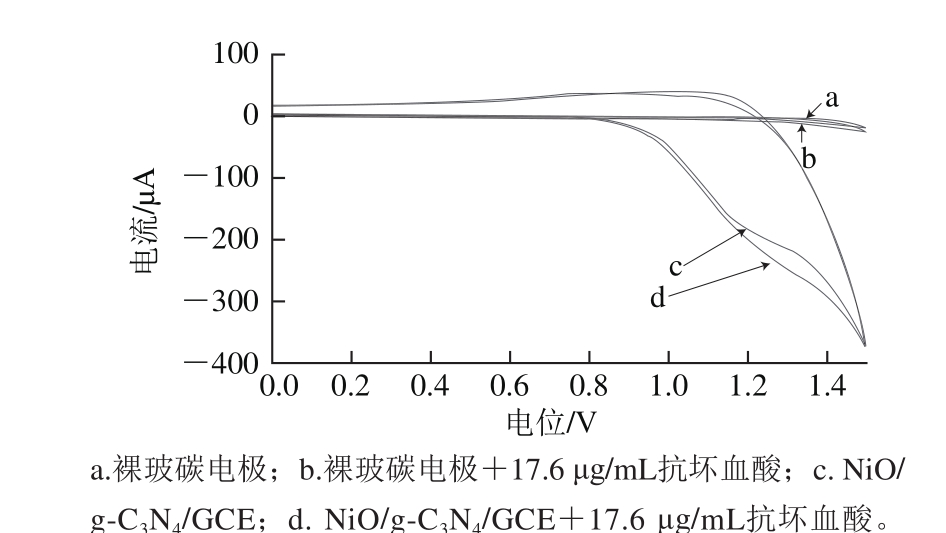
图6 裸电极加入抗坏血酸前(a)、后(b)和NiO/g-C3N4/GCE加入抗坏血酸前(c)、后(d)的循环伏安图
Fig. 6 CV curves of bare electrode in the absence (a) and presence (b) of AA and NiO/g-C3N4/GCE in the absence (c) and presence (d) of AA
如图6所示,裸玻碳电极在0.1 mol/L PBS溶液中加入17.6 μg/mL抗坏血酸后修饰电极没有发生明显变化。而NiO/g-C3N4/GCE在0.1 mol/L PBS溶液中加入17.6 μg/mL抗坏血酸后,还原峰电流减小,氧化峰电流明显增加。其催化活性比裸玻碳电极要高得多,说明g-C3N4的掺入提高了NiO对抗坏血酸的电催化活性。
2.5.2 线性范围与检出限结果
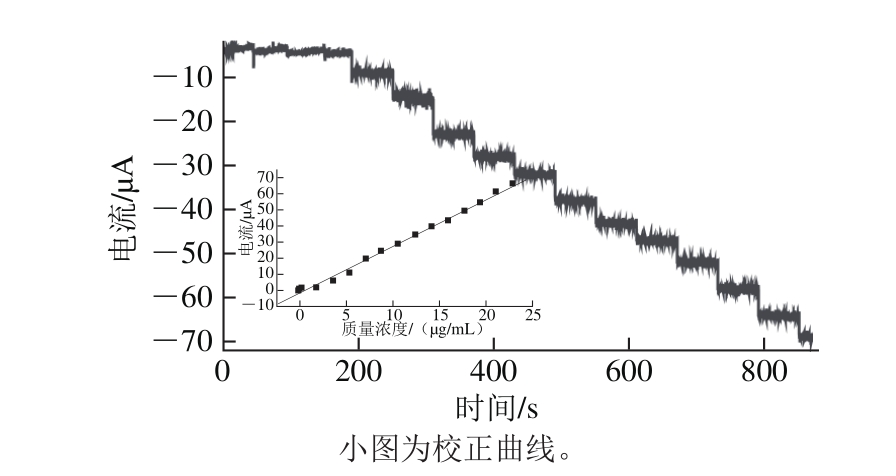
图7 NiO/g-C3N4/GCE连续加入不同质量浓度抗坏血酸时的动力学计时安培图
Fig. 7 Dynamic amperometric response to different concentration of AA at the NiO/g-C3N4/GCE
如图7所示,测定电位控制为1.1 V,随着抗坏血酸的加入,电流以台阶状逐渐增加,符合稳态电流的特征,响应时间小于5 s。在优化条件下,抗坏血酸的质量浓度在0.017 6~22.88 μg/mL范围内时,其氧化峰电流与质量浓度具有良好的线性关系(图7小图),其线性方程为:Ipa=-1.435+2.900C,相关系数R为0.998,检出限为0.008 8 μg/mL。
2.6 选择性、重复性和稳定性结果
如图8所示,其中0~150 s和520~600 s均为加入抗坏血酸的响应曲线。结果表明,这些干扰物质对测定均无影响,说明本方法具有较好的选择性。
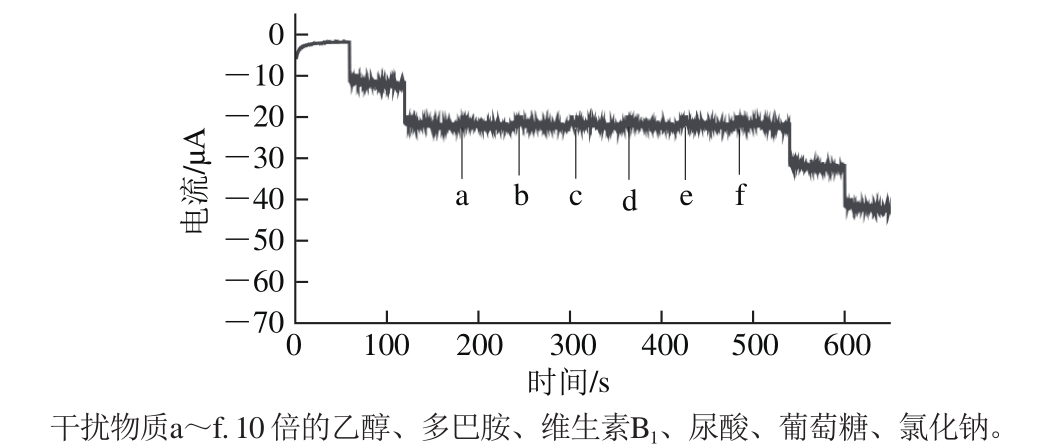
图8 NiOGCE连续加入不同干扰物质时的动力学计时安培图
Fig. 8 Dynamic amperometric response to continuous addition of different interferences at the NiO/g-C3N4/GCE
/g-C3N4/
在优化条件下,用NiO/g-C3N4/GCE对17.6 μg/mL的抗坏血酸平行测定5 次,相对标准偏差(relative standard deviation,RSD)为3.1%。对上述溶液连续扫描20 圈,峰电流的RSD为3.3%。这说明该修饰电极具有较好的稳定性。用同样的方法分别制备5 支NiO/g-C3N4/GCE,测定同一17.6 μg/mL抗坏血酸,RSD为3.9%。这说明该修饰电极具有较好的重复性。
将NiO/g-C3N4/GCE保存在干燥的空气中,用该电极每天测定质量浓度为17.6 μg/mL的抗坏血酸1 次,然后在空白缓冲溶液中经循环伏安扫描将峰扫平,再放入空气中,一周抗坏血酸的峰电流仅下降3.6%,这说明该修饰电极使用寿命较长。
2.7 实际果汁样品检测结果
表1 样品抗坏血酸检测分析
Table 1 Analysis of real samples

选取水溶C100、农夫果园和统一鲜橙多3 种不同品牌的果汁,准确移取一定体积,将其稀释100倍后用截留分子质量为500 D的超滤管于4 000 r/min超滤,取滤液再稀释1 000 倍,利用该修饰电极在样品中用电化学方法进行检测,同时进行加标回收实验,测定回收率,每个样品重复测定3 次取平均值。如表1所示,该方法的回收率为97.8%~100.9%,同时与碘滴定法作比较,2 种测定方法的结果相当吻合,结果令人满意。证明该传感器具有很好的实用性。
本实验利用三聚氰胺制备g-C3N4,并用滴涂法制备g-C3N4修饰电极;用电沉积的方法制备NiO/GCE和NiO/g-C3N4/GCE。实验证明:在优化实验条件下,NiO/g-C3N4/GCE对抗坏血酸有明显的电催化氧化作用,可以用于抗坏血酸的定量检测。当抗坏血酸的质量浓度介于0.017 6~22.88 μg/mL时,其氧化峰电流与质量浓度具有良好的线性关系,方程为:Ipa=-1.435+2.900C,R为0.998,检出限低至0.008 8 μg/mL。并且稳定性好、选择性高,有较好重复性,可用于果汁中抗坏血酸的检测。
参考文献:
[1] XIANG D, LIU X, DONG X. A facile synthetic method and electrochemical performances of nickel oxide/carbon fibers composites[J]. Journal of Materials Science, 2017, 52(13): 7709-7718. DOI:10.1007/s10853-017-1019-4.
[2] WU H, CAI K, ZHOU J, et al. Unipolar memristive switching in bulk negative temperature coefficient thermosensitive ceramics[J]. PLoS ONE, 2013, 8(11): e79832. DOI:10.1371/journal.pone.0079832.
[3] SEOK C, MOON J, PARK M, et al. Low-temperature co-sintering technique for the fabrication of multi-layer functional ceramics for solid oxide fuel cells[J]. Journal of the European Ceramic Society, 2016, 36(6): 1417-1425. DOI:10.1016/j.jeurceramsoc.2015.12.029.
[4] BOLLELLA P, FUSCO G, TORTOLINI C, et al. Beyond graphene: electrochemical sensors and biosensors for biomarkers detection[J]. Biosensors and Bioelectronics, 2017, 89: 152-166. DOI:10.1016/ j.bios.2016.03.068.
[5] ZHANG J S, WANG B, WANG X C. Chemical synthesis and applications of graphitic carbon nitride[J]. Acta Physica Sinica, 2013, 29(9): 1865-1876. DOI:10.3866/PKU.WHXB201306173.
[6] BARRY H. Antioxidants in human health and disease[J]. Nutrition, 1996, 16: 33-50. DOI:10.1146/annurev.nu.16.070196.000341.
[7] 库尔班江, 赛丽曼. 碘量法测水果蔬菜中维生素C的含量[J]. 伊犁师范学院学报(自然科学版), 2007, 65(3): 28-32. DOI:10.3969/ j.issn.1673-999X.2007.03.007.
[8] FILIK H, GIRAY D. Indirect fibre-optic colorimetric determination of ascorbic acid using 2-(5-bromo-2-pyridylazo)-5-diethylaminophenol and cloud point extraction[J]. Drug Testing and Analysis, 2013, 5(4): 228-233. DOI:10.1002/dta.290.
[9] AYE K. A simple colorimetric method for ascorbic acid determination in blood plasma[J]. Clinica Chimica Acta, 1978, 86(2): 153-157. DOI:10.1016/0009-8981(78)90128-6.
[10] LIMA M B, ANDRADE S I, BARRETO I S, et al. Automatic flowbatch approach using CdTe quantum dots for fluorescent determination of ascorbic acid in fruit juices[J]. Food Analytical Methods, 2014, 7(8): 1598-1603. DOI:10.1007/s12161-014-9794-x.
[11] LI L, CAI X Y, DING Y P, et al. Synthesis of Mn-doped CdTe quantum dots and their application as a fluorescence probe for ascorbic acid determination[J]. Analytical Methods, 2013, 5(23): 6748-6754. DOI:10.1039/C3AY41257A.
[12] GAO X, ZHAO Y, ZHANG B, et al. Determination of ascorbic acid using CdTe quantum dots immobilized on eggshell membrane surface as a turn-on fluorescence probe[J]. Journal of Luminescence, 2016, 180: 146-150. DOI:10.1016/j.jlumin.2016.08.026.
[13] ZHU X, ZHAO T, NIE Z, et al. Non-redox modulated fluorescence strategy for sensitive and selective ascorbic acid detection with highly photoluminescent nitrogen-doped carbon nanoparticles via solid-state synthesis[J]. Analytical Chemistry, 2015, 87: 8524-8530. DOI:10.1021/acs.analchem.5b02167.
[14] FONG J F Y, CHIN S F, NG S M. A unique “turn-on” fluorescence signalling strategy for highly specific detection of ascorbic acid using carbon dots as sensing probe[J]. Biosensors and Bioelectronics, 2016, 85: 844-852. DOI:10.1016/j.bios.2016.05.087.
[15] SHINTANI H. HPLC analysis of ascorbic acid (vitamin C)[J]. Pharmaceutica Analytica Acta, 2013, 4: 234. DOI:10.4172/2153-2435.1000234.
[16] SZALAI G, JANDA T, PAL M. Routine sample preparation and HPLC analysis for ascorbic acid (vitamin C) determination in wheat plants and Arabidopsis leaf tissues[J]. Acta Biologica Hungarica, 2014, 65(2): 205-217. DOI:10.1556/ABiol.65.2014.2.8.
[17] KIM Y, KIM M G. HPLC-UV method for the simultaneous determinations of ascorbic acid and dehydroascorbic acid in human plasma[J]. Translational and Clinical Pharmacology, 2016, 24(1): 37-42. DOI:10.12793/tcp.2016.24.1.37.
[18] MA L, SHI H M, LIAN K Q, et al. Highly selective and sensitive determination of several antioxidants in human breast milk using high-performance liquid chromatography based on Ag(Ⅲ) complex chemiluminescence detection[J]. Food Chemistry, 2016, 218: 422-426. DOI:10.1016/j.foodchem.2016.09.025.
[19] MA Xiaolong, ZHANG Xin, GUO Xinli, et al. Sensitive and selective determining ascorbic acid and activity of alkaline phosphatase based on electrochemiluminescence of dual-stabilizers-capped CdSe quantum dots in carbon nanotube-nafion composite[J]. Talanta, 2016, 154: 175-182. DOI:10.1016/j.talanta.2016.03.036.
[20] 石文兵, 贺薇, 万帮江. 纳米二氧化铈化学发光抑制法测定抗坏血酸[J]. 食品科学, 2015, 36(24): 112-115. DOI:10.7506/spkx1002-6630-201524019.
[21] DONG Y P, WANG J, PENG Y, et al. Chemiluminescence resonance energy transfer between CdS quantum dots and lucigenin and its sensing application[J]. Journal of Luminescence, 2016, 181: 433-438. DOI:10.1016/j.jlumin.2016.10.004.
[22] CEVIK S, AKPOLAT O, ANIK U. Ascorbic acid detection with MnO2-modified GCPE[J]. Food Analytical Methods, 2016, 9(2): 500-504. DOI:10.1007/s12161-015-0221-8.
[23] SAJID M, NAZAL M K, MANSH M, et al. Chemically modified electrodes for electrochemical detection of dopamine in the presence of uric acid and ascorbic acid: a review[J]. TrAC Trends in Analytical Chemistry, 2016, 76: 15-29. DOI:10.1016/j.trac.2015.09.006.
[24] CHEN L, GUO X M, GUO B, et al. Electrochemical investigation of a metalloporphyrin-graphene composite modified electrode and its electrocatalysis on ascorbic acid[J]. Journal of Electroanalytical Chemistry, 2016, 760(1): 105-112. DOI:10.1016/ j.jelechem.2015.11.018.
[25] PARDAKHTY A, AHMADZADEH S, AVAZPOUR S, et al. Highly sensitive and efficient voltammetric determination of ascorbic acid in food and pharmaceutical samples from aqueous solutions based on nanostructure carbon paste electrode as a sensor[J]. Journal of Molecular Liquids, 2016, 216: 387-391. DOI:10.1016/ j.molliq.2016.01.010.
[26] LI X, ZHOU C H, ZI Q J, et al. An electrochemical signal transduction amplification strategy for ultrasensitive detection of ascorbic acid[J]. Journal of Electroanalytical Chemistry, 2016, 780: 321-326. DOI:10.1016/j.jelechem.2016.09.038.
[27] ZHANG D D, LI L Z, MA W N, et al. Electrodeposited reduced graphene oxide incorporating polymerization of L-lysine on electrode surface and its application in simultaneous electrochemical determination of ascorbic acid, dopamine and uric acid[J]. Materials Science and Engineering: C, 2016, 70: 241-249. DOI:10.1016/ j.msec.2016.08.078.
[28] CHEN J, LI Z, WANG C, et al. Synthesis and characterization of g-C3N4nanosheet modified polyamide nanofiltration membranes with good permeation and antifouling properties[J]. RSC Advances, 2016, 6: 112148-112157. DOI:10.1039/C6RA21192E.
[29] ZOU L R, HUANG G F, LI D F, et al. A facile and rapid route for synthesis of g-C3N4nanosheets with high adsorption capacity and photocatalytic activity[J]. RSC Advances, 2016, 6: 86688-86694. DOI:10.1039/C6RA20514C.
[30] 周跃明, 马建国, 范杰平, 等. 聚灿烂甲酚蓝膜修饰电极测定抗坏血酸的研究[J]. 分析试验室, 2005, 24(7): 51-54. DOI:10.3969/ j.issn.1000-0720.2005.07.015.
Preparation of a NiO/g-C3N4Composite Modified Electrode and Electrocatalytic Detection of Ascorbic Acid
LI Cheng, ZHU Nannan, WANG Xing, XIE Jingwen, LIU Suqin*
(Hubei Key Laboratory of Low Dimensional Optoelectronic Materials and Devices, School of Chemical Engineering and Food Science, Hubei University of Arts and Science, Xiangyang 441053, China)
Abstract:NiO/g-C3N4complex was successfully synthesized from NiCl2and C3H6N6. The as-prepared NiO/g-C3N4composite modified glassy carbon electrode by both casting method and electrodeposition showed remarkable electrocatalytic performance for ascorbic acid (AA). The peak current displayed a linear relationship with scanning rate in the range from 70 to 200 mV/s. The equations were depicted as follows: Ipa= −34.14−1.167v, and Ipc= 53.42 + 0.357 8v, with correlation coefficients (R) equal to 0.998 and 0.982, respectively. Meanwhile, it was shown that the spike potential deviated with increasing scanning rate. This effect demonstrates that the electrochemical process was controlled by surface diffusion. The anodic current was proportional to the AA concentration and the calibration plot was Ipc= −1.435 + 2.900C, R = 0.998, which was linear over the concentration ranges of 0.017 6 to 22.88 μg/mL. The detection limit (LOD) of the method was 0.008 8 μg/mL. Furthermore, results also showed that the sensor had good selectivity, stability and reproducibility and could be used to detect AA in juice samples with satisfactory results.
Key words:NiO; g-C3N4; electrolytic deposition; ascorbic acid; modified electrode
DOI:10.7506/spkx1002-6630-201716019
中图分类号:O657.1
文献标志码:A
文章编号:1002-6630(2017)16-0122-05
引文格式:
李成, 朱南南, 王星, 等. NiO/g-C3N4修饰电极的制备及电催化检测抗坏血酸[J]. 食品科学, 2017, 38(16): 122-126. DOI:10.7506/spkx1002-6630-201716019. http://www.spkx.net.cn
LI Cheng, ZHU Nannan, WANG Xing, et al. Preparation of a NiO/g-C3N4composite modified electrode and electrocatalytic detection of ascorbic acid[J]. Food Science, 2017, 38(16): 122-126. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201716019. http://www.spkx.net.cn
收稿日期:2016-09-23
基金项目:国家自然科学基金青年科学基金项目(51508172);国家自然科学基金面上项目(51572076;51378183);湖北文理学院食品新型工业化学科群开放基金项目
作者简介:李成(1994—),男,本科生,研究方向为光电催化基础应用。E-mail:765624708@qq.com
*通信作者:刘素芹(1977—),女,副教授,硕士,研究方向为光电催化基础应用。E-mail:liusuqin888@126.com