赵红倩,宋风霞,江祥师,沈申燚,尚东亮,李莉蓉*
(昆明理工大学云南省食品安全研究院,云南 昆明 650500)
摘 要:用中性蛋白酶酶解苦荞蛋白制备抗菌肽,以抑菌率和肽质量浓度为响应值,在底物质量分数、加酶量、pH值、酶解温度和酶解时间5 个单因素试验基础上,采用Plackett-Burman试验选出其中影响显著的因素,再以肽质量浓度为评价指标,用Box-Behnken试验优化抗菌肽制备工艺。最佳工艺为:底物质量分数3.22%、加酶量4 000 U/g、pH 6.86。在此条件下,苦荞蛋白酶解产生的肽质量浓度为32.41 mg/mL(预测值为32.12 mg/mL),对大肠杆菌抑菌率为(27.88±2.78)%,对金黄色葡萄球菌的抑菌率为(94.56±0.74)%。结果表明,优化中性蛋白酶酶解苦荞蛋白制备抗菌肽工艺合理。
关键词:苦荞蛋白;酶解;抗菌肽;Plackett-Burman试验;Box-Behnken试验
抗菌肽也称为宿主防御肽,是机体内源性基因编码的先天性免疫应答物质[1-2]。抗菌肽具有抗菌活性高,抗菌谱广,还具有抗真菌[3]、抗肿瘤活性[4]、抗病毒[5-6]、降血压[7]、免疫调节[8]等活性。另外,抗菌肽选择性作用于病源生物,对宿主细胞毒性低或没有毒性;抗菌肽作用于微生物细胞时有多个靶目标,可以减少耐药产生的风险[9];抗菌肽在机体内最终被酶解为氨基酸,无残留毒性。所以,抗菌肽以分子质量较小、溶解性好、抗菌谱广、抗菌活性强、选择性好、不易产生耐药等特点,被作为新型抗菌剂应用于医药[10]、食品工业[11-12]、农业[13]等领域。
荞麦属于蓼科荞麦属的双子叶植物。荞麦属有2 个栽培种,分别为甜荞和苦荞。苦荞,学名鞑靼荞麦,是一种药食兼用的经济作物[14]。研究表明荞麦具有抗氧化、降胆固醇和降糖等功能[15],是一种极具开发潜力的食品原料。但目前对荞麦的报道主要集中在荞麦黄酮和荞麦多糖,对荞麦蛋白质和活性肽的研究相对较少。荞麦蛋白量丰富,约为8.5%~19%[16-17]。对荞麦蛋白和活性肽的研究发现了一些荞麦降糖蛋白[18]、荞麦抗氧化肽[19]、抗肿瘤肽[18]和抗菌肽[20]。Fujimura等[21]从荞麦中分离得到了Fa-AMP1和Fa-AMP2两种对革兰氏阳性菌、革兰氏阴性菌及植物病原真菌的生长均有抑制作用的荞麦抗菌肽。Leung等[22]从ttian荞麦中获得的有抗真菌作用的肽,还可抑制肝癌、乳腺癌、白血病肿瘤细胞的生长以及抑制HIV-1逆转录酶的活性。白承之等[23]研究发现苦荞肽可抑制链格孢霉、白腐菌和绿色木霉的生长。赵琳[24]研究发现苦荞萌发期蛋白具有一定的抗细菌和真菌活性。苦荞活性蛋白和肽的研究越来越受到关注,这些研究为通过酶解苦荞蛋白分离出具有抗菌活性的多肽提供了理论依据。
利用蛋白酶水解苦荞蛋白是获得大量苦荞抗菌肽的较好方法。目前国内外对酶解制备苦荞抗菌肽的相关研究报道较少。因此,优化酶解荞麦蛋白制备抗菌肽,对苦荞抗菌肽的大量制备及应用具有重要意义。本研究用中性蛋白酶水解苦荞蛋白,以抑菌率和肽质量浓度为指标,用Plackett-Burman试验和Box-Behnken试验联用优化抗菌肽制备工艺,为苦荞抗菌肽的开发提供参考。
1.1 材料与试剂
大肠杆菌(ATCC 25922)、金黄色葡萄球菌(ATCC 29213)由上海鲁微科技有限公司提供。
苦荞粉 昆明市官渡区苏荣调味食品厂;中性蛋白酶(20万 U/g) 广西南宁庞博生物工程有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BXM-30R立式压力蒸汽灭菌锅、GSP-9050MBE隔水式恒温培养箱、SW-CJ-2F超净工作台 上海博迅实业有限公司;TS-200B恒温摇床 上海天呈实验仪器制造有限公司;雷磁PHS-3G pH计 上海仪电科学仪器股份有限公司;XMTD-204数显恒温搅拌水浴锅 金坛市白塔新宝仪器厂;XR1台式高速冷冻离心机赛默飞世尔科技有限公司;UV-1800PC紫外-可见分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 苦荞蛋白的制备
参照Ma yuanyuan等[25]的方法稍作修饰提取苦荞蛋白。取20 g苦荞粉,加200 mL去离子水,在室温搅拌溶解10 min,用1.0 mol/L NaOH溶液调节荞麦溶液pH值为8.5,在4 ℃条件下搅拌提取2 h。溶液经4 ℃、10 000 r/min离心10 min,取上清液用1.0 mol/L的HCl溶液调节pH值至4.0,室温搅拌30 min后10 000 r/min离心10 min取沉淀。沉淀用去离子水洗3 遍后重新溶解在去离子水中,调节pH值至中性,经真空冷冻干燥得到苦荞蛋白。
1.3.2 中性蛋白酶酶解苦荞蛋白
用去离子水配制苦荞粗蛋白溶液,使底物质量分数为4%。搅拌溶解20 min后用1.0 mol/L NaOH溶液调节至最适pH值,置于恒温水浴锅中。加入中性蛋白酶,开始酶解反应。水解过程中维持反应溶液的pH值和温度恒定。酶解完成后将酶解液煮沸10 min以灭酶。冷却,4 ℃、10 000 r/min离心15 min取上清液,调pH值至中性,即得苦荞蛋白酶解产物。
1.3.3 肽质量浓度的测定
采用三氯乙酸沉淀结合福林-酚法测定可溶性肽含量[26]。取酶解产物,加入等体积10%的三氯乙酸,涡漩振荡后静置20 min。于4 ℃、10 000 r/min离心10 min。取1 mL上清液,加入5 mL碱性铜溶液混匀,室温放置10 min。加入0.5 mL酚试剂,混匀后置于30 ℃水浴孵育30 min显色。测定溶液在650 nm波长处的吸光度。以牛血清白蛋白为标准品制作标准曲线,从标准曲线求出可溶性肽质量浓度。
1.3.4 抑菌率测定
参照Tang Wenting等[27]方法测定抑菌率。取对数期细菌,以无菌生理盐水洗3 遍后用新鲜Luria-Bertani培养基重悬为1×105CFU/mL的菌悬液。将100 μL酶解产物加入96 孔酶标板中,再加入等体积的菌悬液作为实验组;以100 μL无菌生理盐水代替等体积酶解产物作为对照组。在37 ℃条件下培养12 h后,用酶标仪测定620 nm波长处的OD值。按如下公式计算酶解液的抑菌率:
1.3.5 单因素试验设计
根据中性蛋白酶酶解苦荞蛋白制备抗菌肽的方法,分别考察底物质量分数(2.5%、3.0%、3.5%、4.0%、4.5%、5.0%)、加酶量(2 000、3 000、4 000、5 000、6 000、7 000 U/g)、pH值(5.5、6.0、6.5、7.0、7.5、8.0、8.5)、酶解温度(35、40、45、50、55、60 ℃)和酶解时间(2.0、2.5、3.0、3.5、4.0、4.5 h)对酶解产物的肽质量浓度和抑菌率的影响,确定最佳因素水平。
1.3.6 Plackett-Burman试验设计
根据单因素试验结果确定底物质量分数、加酶量、pH值、酶解温度和时间5 个因素的水平值。利用Design-Expert 8.0.6软件进行Plackett-Burman试验设计及数据处理,确定影响显著的因素。
1.3.7 Box-Behnken试验设计
根据Plackett-Burman试验结果,选取底物质量分数、加酶量、pH值为影响中性蛋白酶酶解制备苦荞抗菌肽的主要因素,以肽质量浓度为考察指标,利用Design-Expert 8.0.6软件进行Box-Behnken试验设计、数据处理和预测优化最佳工艺条件。
1.4 数据处理
每个样品测定3 次,以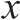 ±s表示。采用SPSS 17.0软件对数据进行统计分析,用单因素方差分析(one-way analysis of variance,ANOVA)的Tukey HSD检验进行数据多重比较。
±s表示。采用SPSS 17.0软件对数据进行统计分析,用单因素方差分析(one-way analysis of variance,ANOVA)的Tukey HSD检验进行数据多重比较。
2.1 单因素试验结果
2.1.1 底物质量分数对抑菌率和肽质量浓度的影响
如图1所示,随着底物质量分数的增加,酶解产物对大肠杆菌的抑菌率先增加后减小;当底物质量分数为3.5%时,酶解产物对大肠杆菌的抑菌活性达到最大。不同底物质量分数酶解产物对金黄色葡萄球菌的抑菌率无显著差异。酶解产物的肽质量浓度随底物质量分数的增加而增加。综合考虑底物质量分数对抑菌率和肽质量浓度的影响,选取3.5%底物质量分数。

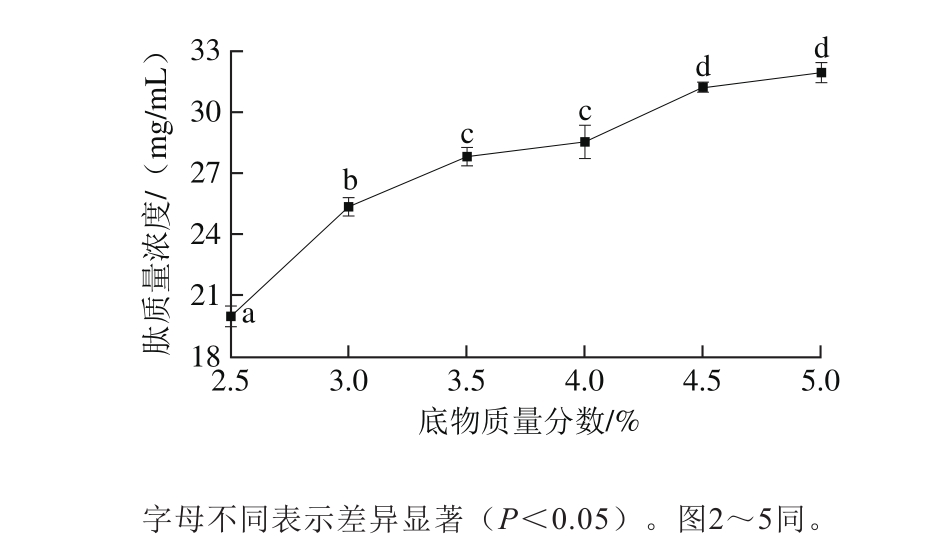
图1 底物质量分数对酶解产物抑菌率和肽质量浓度的影响
Fig. 1 Effect of substrate concentration on antibacterial activity and peptide concentration of hydrolysates
2.1.2 加酶量对酶解产物抑菌率和肽质量浓度的影响
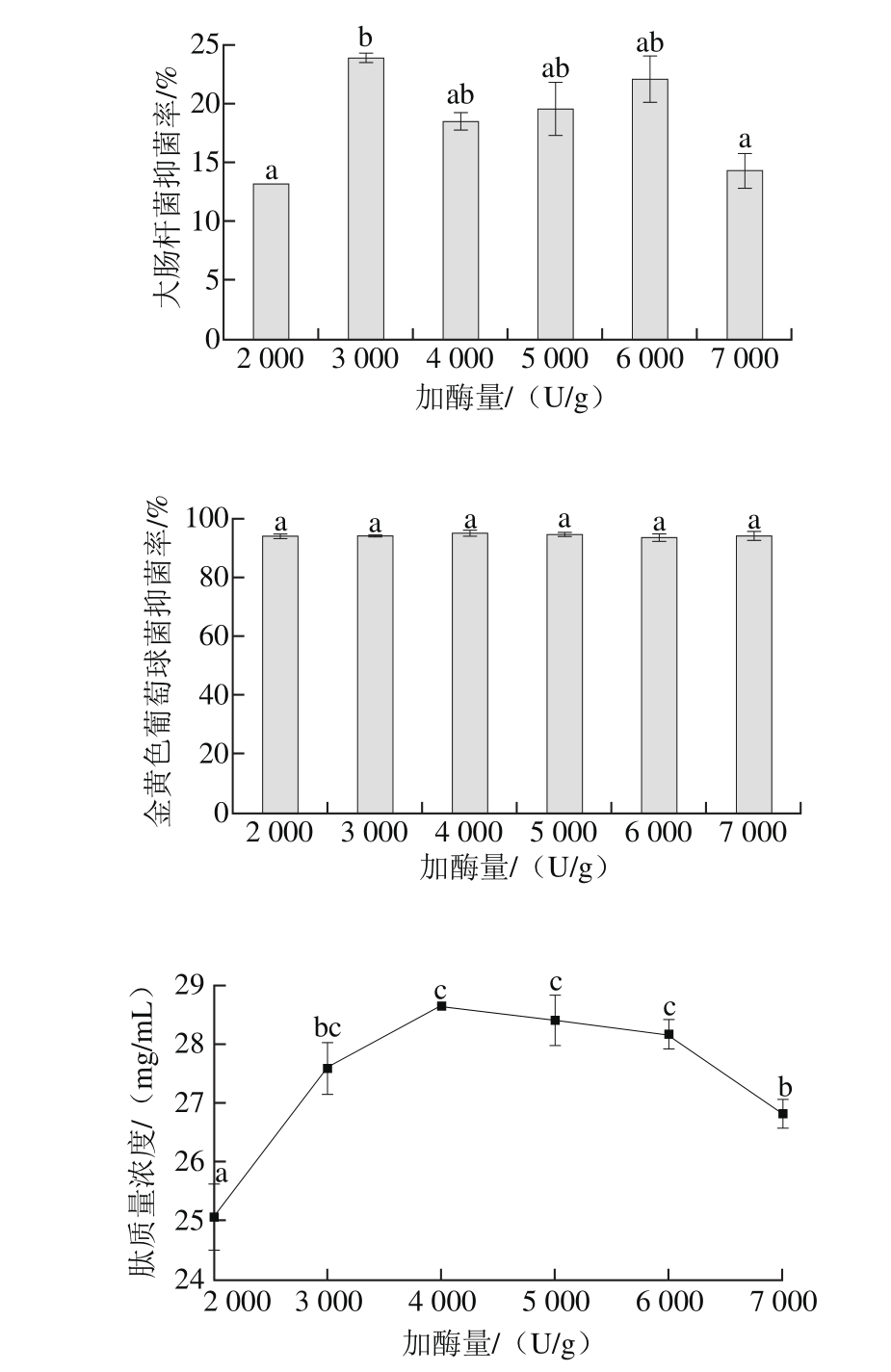
图2 加酶量对酶解产物抑菌率和肽质量浓度的影响
Fig. 2 Effect of enzyme-to-substrate ratio on antibacterial activity and peptide concentration of hydrolysates
由图2可知,加酶量从2 000 U/g增加到3 000 U/g时,酶解产物对大肠杆菌的抑菌率显著增加;加酶量从3 000 U/g增加到6 000 U/g时,酶解产物对大肠杆菌的抑菌率之间无显著差异;加酶量增加到7 000 U/g时,对大肠杆菌抑菌率下降。不同加酶量的酶解产物对金黄色葡萄球菌的抑菌率没有显著差异。酶解产物的肽质量浓度随加酶量的增加呈现先增加后减小的趋势,这是由于随着加酶量的增加,酶与底物接触增加,肽质量浓度也随着增加,加酶量继续增加反而使酶解产物中部分肽进一步酶解成氨基酸,导致肽质量浓度下降。综合考虑加酶量对抑菌率和肽质量浓度的影响,故选取3 000 U/g的加酶量。
2.1.3 酶解pH值对酶解产物抑菌率和肽质量浓度的影响
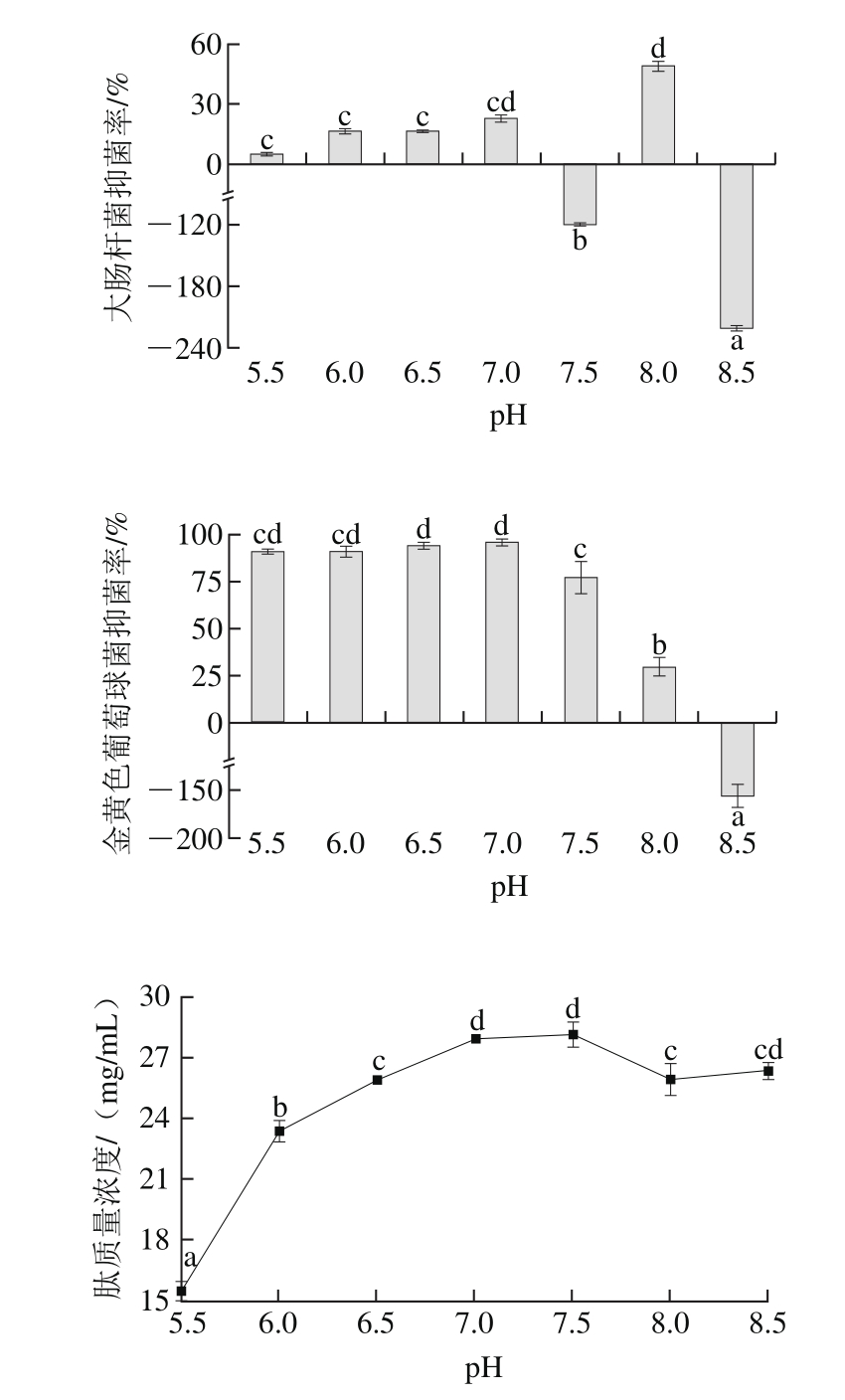
图3 pH值对酶解产物抑菌率和肽质量浓度的影响
Fig. 3 Effects of pH on antibacterial activity and peptide concentration of hydrolysates
如图3所示,随着pH值从5.5升高到7.0,酶解产物对大肠杆菌的抑菌率增加,但不同pH值组间差异不显著。pH 8.0时,对大肠杆菌抑菌率最高。在pH 7.5和pH 8.5时,酶解产物对大肠杆菌没有抑菌活性。在pH 5.5~7.0变化时,酶解产物对金黄色葡萄球菌的抑菌率无显著差异。pH值由7.0增加到8.5,酶解产物对金黄色葡萄球菌的抑菌活性呈现减小的趋势。pH 8.5时,酶解产物对金黄色葡萄球菌无抑菌活性,甚至促进菌的生长。综合考虑pH值对抑菌率和肽质量浓度的影响,选取pH 7.0。
2.1.4 酶解温度对酶解产物抑菌率和多肽质量浓度的影响
如图4所示,在35~55 ℃的酶解温度条件下,酶解产物对大肠杆菌的抑菌率无显著性差异;酶解温度继续由50 ℃升高至60 ℃,抑菌率降低。酶解产物的肽质量浓度随温度增加先增加后减小。综合考虑酶解温度对酶解产物的抑菌率和肽质量浓度的影响,选取50 ℃的酶解温度。
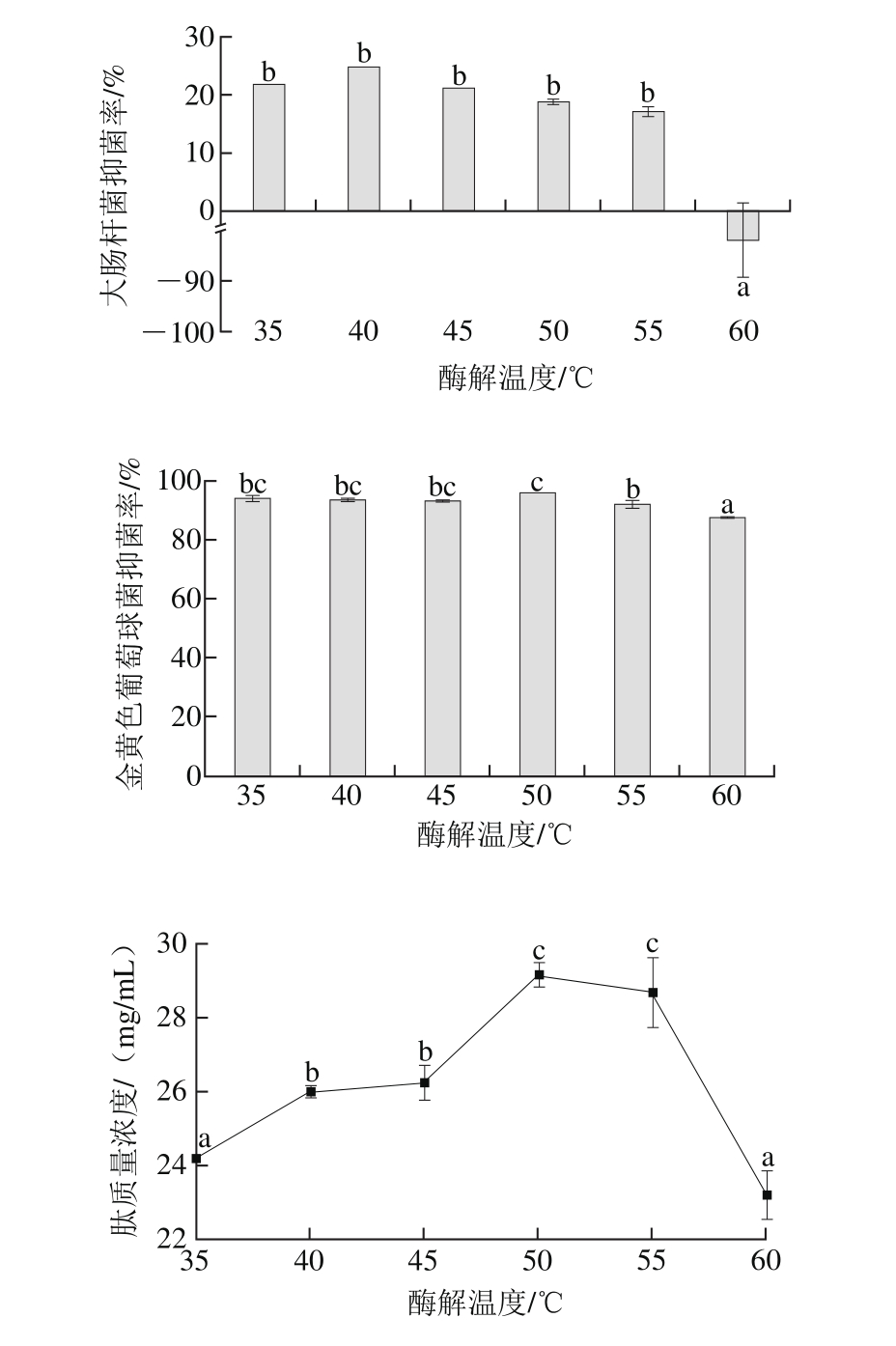
图4 酶解温度对酶解产物抑菌率和肽质量浓度的影响
Fig. 4 Effects of hydrolysis temperature on antibacterial activity and peptide concentration of hydrolysates
2.1.5 酶解时间对酶解产物抑菌率和多肽质量浓度的影响

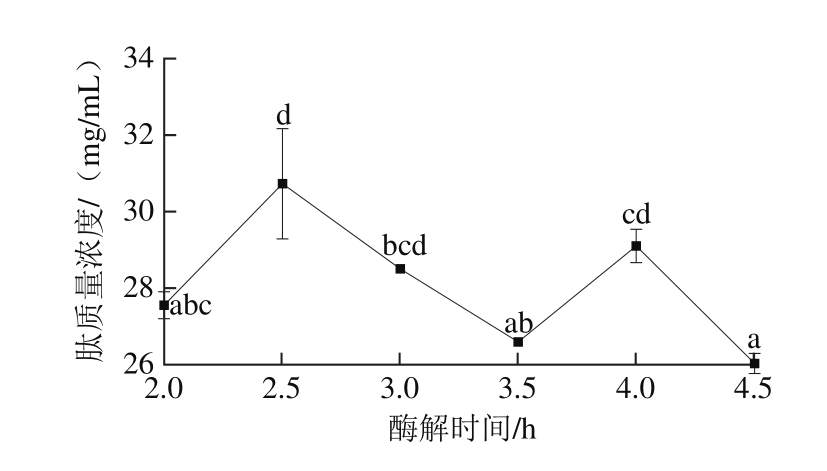
图5 酶解时间对酶解产物抑菌率和肽质量浓度的影响
Fig. 5 Effects of hydrolysis time on antibacterial activity and peptide concentration of hydrolysates
由图5可知,酶解2 h和4.5 h的酶解产物对大肠杆菌的抑菌率最低,其他酶解时间的酶解产物对大肠杆菌的抑菌率无显著差异;在酶解2 h酶解产物对金黄色葡萄球菌的抑菌率最低,其他酶解时间的酶解产物抑菌率无显著差异;肽质量浓度在酶解2.5 h时最高,随时间变化没有呈现一定的规律性。当酶解2 h时,肽质量浓度已达到27 mg/mL以上,但此时其抑菌率较其他酶解时间低,因为抗菌肽的活性与肽序列的氨基酸组成密切相关[28-29],中性蛋白酶作用于苦荞蛋白时有多个酶切位点,酶解苦荞蛋白会得到多种序列苦荞肽,但这些肽活性相对较低。综合考虑酶解温度对抑菌率和肽质量浓度的影响,选取酶解时间2.5 h。
2.2 Plackett-Burman试验结果
Plackett-Burman可通过部分因素的两水平的试验设计,比较所考察的因素两水平的差异与整体的差异来确定因素的显著性,达到筛选因素节约试验资源的目的[30]。利用Plackett-Burman试验设计对底物质量分数、加酶量、pH值、酶解温度、酶解时间这5 个因素进行筛选,得到对酶解产物的肽质量浓度影响显著的因素,试验设计及响应值见表1,试验结果的统计分析见表2。
表1 Plackett-Burman试验设计及结果
Table 1 Plackett-Burman experimental design with experimental results
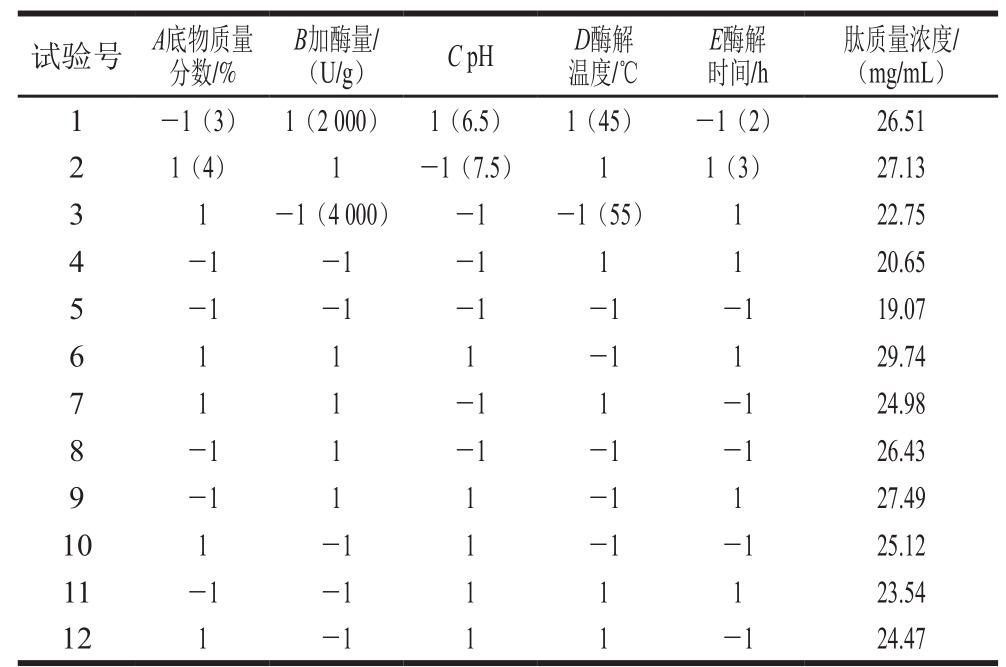
表2 Plackett-Burman试验统计分析
Table 2 Statistical analysis of the Plackett-Burman design
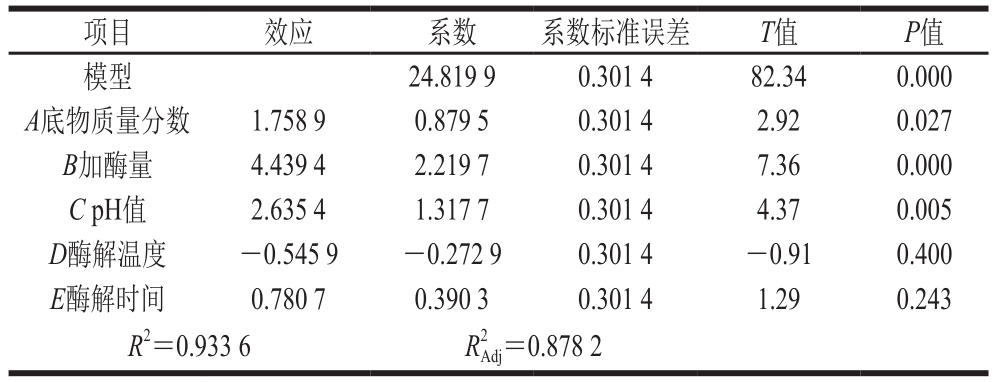
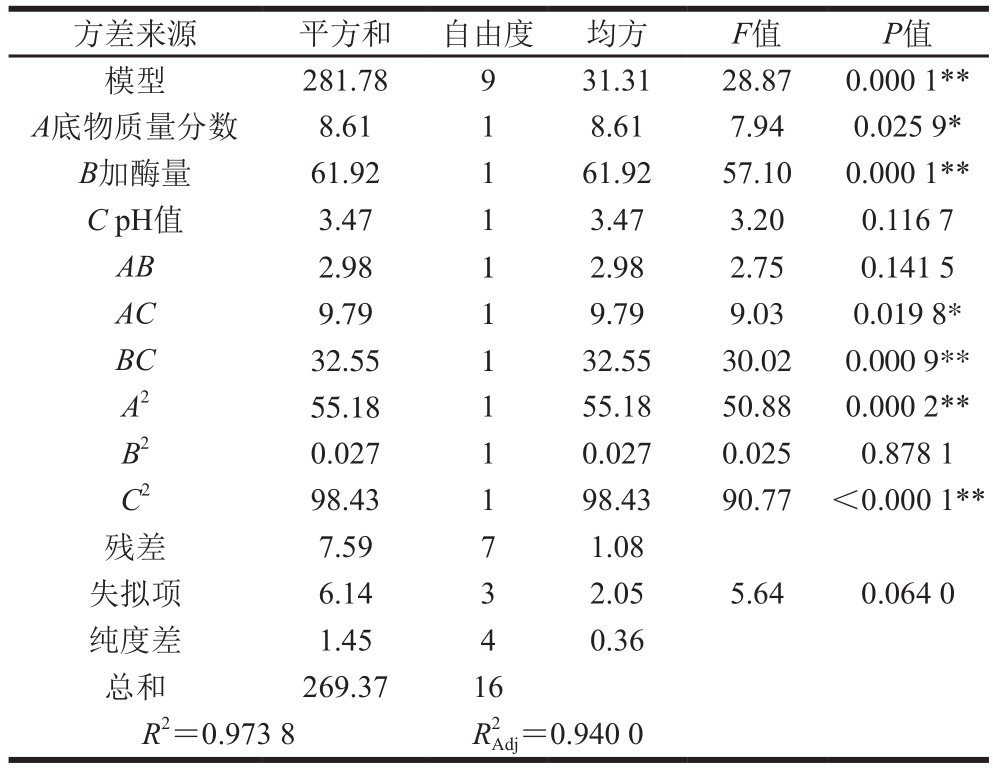
由表2可知,R2=0.933 6,即有93.36%试验数据的差异可用该模型解释。底物质量分数对肽质量浓度的影响显著(P<0.05);加酶量和pH值对肽质量浓度的影响极显著(P<0.01);酶解温度和酶解时间对肽质量浓度的影响不显著(P>0.05)。故选取底物质量分数、加酶量和pH值这3 个因素进行Box-Behnken试验。
2.3 Box-Behnken试验结果
表3 Box-Behnken试验设计与结果
Table 3 Box-Behnken design with response value

表4 Box-Behnken试验方差分析
Table 4 Analysis of variance for the Box-Behnken design
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
以底物质量分数(A)、加酶量(B)和pH值(C)为自变量,肽质量浓度为响应值进行Box-Behnken试验设计,以1、0、-1分别代表自变量的3 个水平,试验设计水平表及响应值见表3,方差分析见表4。由表4可知方程失拟项不显著(P=0.064 0>0.05),说明回归方程不失拟,表明所选模型适合,可以用该模型来拟合试验;方程模型极显著(P<0.01),说明多元回归方程能较好地拟合试验结果;模型确定系数R2为0.973 8,R2Adj为0.940 0,表明模型的相关性和解释度都很好。因此该Box-Behnken试验设计可靠,模型可以应用于中性蛋白酶酶解苦荞蛋白制备抗菌肽的理论预测。在该模型中,回归系数的显著性检验显示一次项A和交互项AC的影响达到显著水平;一次项B,平方项A2、C2和交互项BC的影响均达到极显著水平;3 个因素对酶解产物肽质量浓度影响大小的排序为:B>A>C。软件拟合出的二次多项回归方程为:Y=30.13+1.04A+2.78B-0.66C-0.86AB-1.56AC-2.85BC-3.62A2+0.81B2-4.84C2。
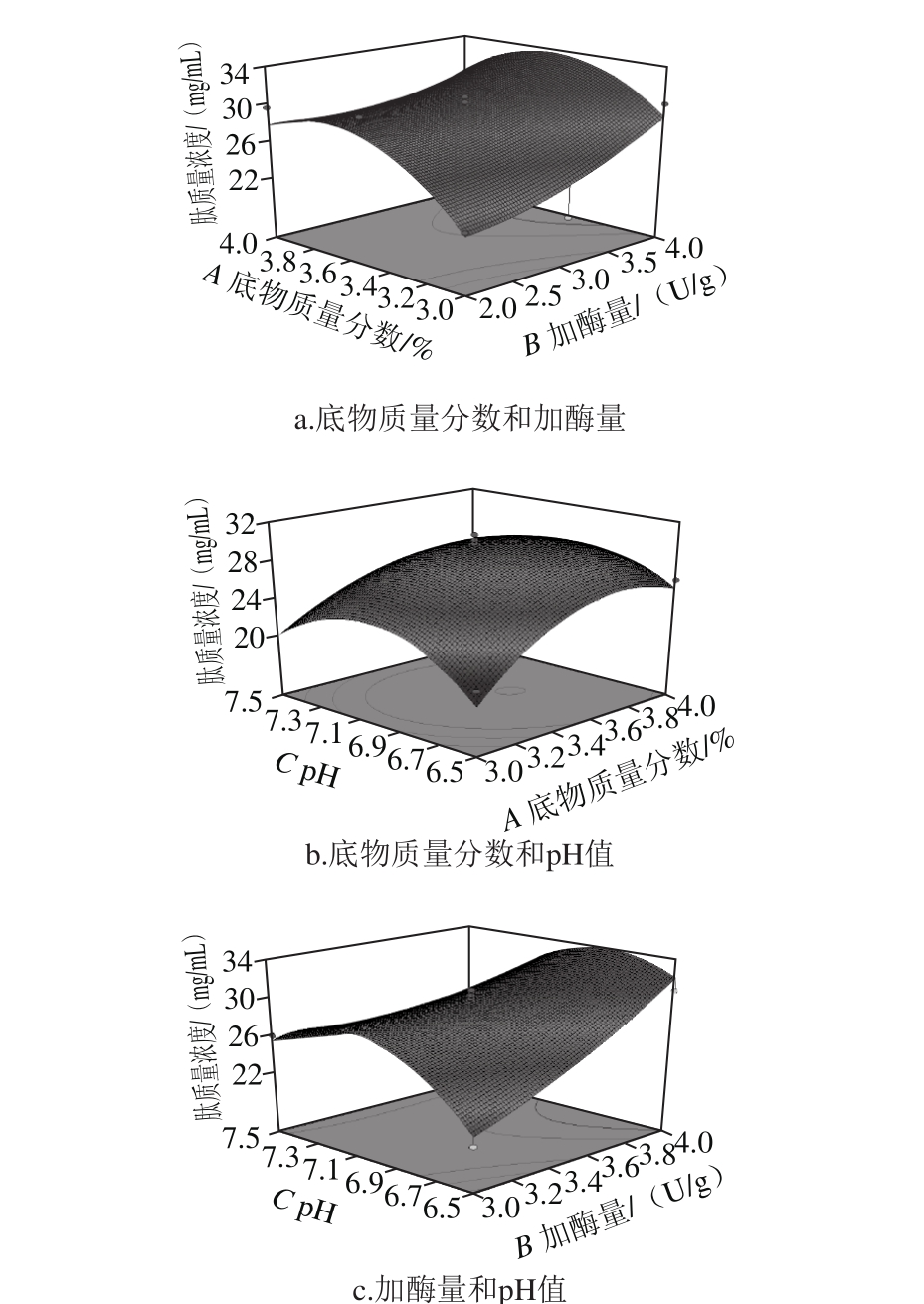
图6 各因素交互作用对肽质量浓度影响的响应面图
Fig. 6 Response surface plots showing the interactive effects of various factors on peptide concentration
由图6a可知,无论加酶量处于何种水平,随着底物质量分数的增加,酶解产物的肽质量浓度呈现先增加后降低的趋势,原因可能是酶与底物处于低水平时,酶解不充分,生成抗菌肽的量较少,而处于较高水平时,生成的抗菌肽被酶解为更小的分子片段。无论底物质量分数处于何种水平,随着加酶量的增加,酶解产物的肽质量浓度呈现增加的趋势,原因可能是随着加酶量的增加,酶与底物接触更充分。
由图6b可知,无论pH值处于何种水平,随着底物质量分数的增加,酶解产物的肽质量浓度呈现先增加后降低的趋势,原因可能为底物质量分数高时,酶解不充分,生成抗菌肽的量较少,而底物质量分数较高时,生成的抗菌肽被酶解为更小分子的肽和氨基酸。无论底物质量分数处于何种水平,随着pH值的升高,酶解产物的肽质量浓度呈现先增加后减小的趋势,原因可能为高pH值或低pH值导致蛋白酶活力降低。
图6c显示,无论加酶量处于何种水平,随着pH值的升高,酶解产物的肽质量浓度先升高后降低,原因可能为高pH值或低pH值导致蛋白酶活力降低。pH值处于低水平时,随着加酶量的增加,酶解产物的肽质量浓度呈现增加的趋势,原因可能是随着加酶量的增加,酶与底物接触更充分;pH值处于高水平时,随着加酶量的增加,肽质量浓度增加平缓,原因可能是高pH值使酶活降低,增加加酶量对肽质量浓度的增加作用受pH值影响,导致肽质量浓度增加缓慢。
2.4 最佳抗菌肽制备工艺验证实验
通过软件分析可得,中性蛋白酶酶解苦荞蛋白制备抗菌肽的最佳工艺条件为底物质量分数3.22%、加酶量4 000 U/g、pH 6.86,酶解产物的肽质量浓度预测值为32.12 mg/mL。在此条件下进行3 次平行验证实验,取平均值,实际测得酶解产物的肽质量浓度为32.41 mg/mL,实际值与预测值相对误差为0.90%,说明采用Box-Behnken试验优化得到的工艺参数准确可靠,有实际应用价值。测得在此条件下,酶解产物对大肠杆菌抑菌率为(27.88±2.78)%,对金黄色葡萄球菌的抑菌率为(94.56±0.74)%。
本研究利用用Plackett-Burman试验和Box-Behnken试验联用分析中性蛋白酶酶解苦荞蛋白制备抗菌肽过程中的底物质量分数、加酶量、pH值、酶解温度和时间对酶解产物肽质量浓度和抑菌活性的影响。确定的显著影响因素为底物质量分数、加酶量和pH值,最佳工艺参数为底物质量分数3.22%、加酶量4 000 U/g、pH 6.86,酶解产物肽质量浓度预测值为32.12 mg/mL。经验证实际值为32.41%,该模型准确可靠。该模型下,酶解产物对大肠杆菌抑菌率为(27.88±2.78)%,对金黄色葡萄球菌的抑菌率为(94.56±0.74)%。该研究表明利用中性蛋白酶酶解苦荞蛋白制备抗菌肽是可行的,研究为苦荞抗菌肽的制备和利用提供参考。
参考文献:
[1] LI Y M, XIANG Q, ZHANG Q H, et al. Overview on the recent study of antimicrobial peptides: origins, functions, relative mechanisms and application[J]. Peptides, 2012, 37(2): 207-215. DOI:10.1016/ j.peptides.2012.07.001.
[2] STECKBECK J D, DESLOUCHES B, MONTELARO R C. Antimicrobial peptides: new drugs for bad bugs?[J] Expert Opinion on Biological Therapy, 2014, 14(1): 11-14. DOI:10.1517/14712598.2013. 844227.
[3] CHOI H, HWANG J S, LEE D G. Antifungal effect and poreforming action of lactoferricin B like peptide derived from centipede Scolopendra subspinipes mutilans[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2013, 1828(11): 2745-2750. DOI:10.1016/ j.bbamem.2013.07.021.
[4] LIN M C, HUI C F, CHEN J Y, et al. Truncated antimicrobial peptides from marine organisms retain anticancer activity and antibacterial activity against multidrug-resistant Staphylococcus aureus[J]. Peptides, 2013, 44: 139-148. DOI:10.1016/j.peptides.2013.04.004.
[5] GWYER F E, CURRIE S M, DAVIDSON D J. Cationic host defence peptides: potential as antiviral therapeutics[J]. BioDrugs, 2013, 27(5): 479-493. DOI:10.1007/s40259-013-0039-0.
[6] MULDER K C, LIMA L A, MIRANDA V J, et al. Current scenario of peptide-based drugs: the key roles of cationic antitumor and antiviral peptides[J]. Frontiers in Microbiology, 2013, 4: 321. DOI:10.3389/ fmicb.2013.00321.
[7] ESCUDERO E, ARISTOY M C, NISHIMURA H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311. DOI:10.1016/j.meatsci.2012.02.008.
[8] ROBY K D, NARDO A D. Innate immunity and the role of the antimicrobial peptide cathelicidin in inflammatory skin disease[J]. Drug Discovery Today: Disease Mechanisms, 2013, 10(3/4): e79-e82. DOI:10.1016/j.ddmec.2013.01.001.
[9] JENSSEN H, HAMILL P, HANCOCK R E. Peptide antimicrobial agents[J]. Clinical Microbiology Reviews, 2006, 19(3): 491-511. DOI:10.1128/CMR.00056-05.
[10] AOKI W, KURODA K, UEDA M. Next generation of antimicrobial peptides as molecular targeted medicines[J]. Journal of Bioscience and Bioengineering, 2012, 114(4): 365-370. DOI:10.1016/j.jbiosc.2012.05.001.
[11] PRZYBYLSKI R, FIRDAOUS L, CHÂATAIGNÉ G, et al. Production of an antimicrobial peptide derived from slaughterhouse by-product and its potential application on meat as preservative[J]. Food Chemistry, 2016, 211: 306-313. DOI:10.1016/j.foodchem.2016.05.074.
[12] MILLS S, STANTON C, HILL C, et al. New developments and applications of bacteriocins and peptides in foods[J]. Annual Review of Food Science and Technology, 2011, 2: 299-329. DOI:10.1146/ annurev-food-022510-133721.
[13] DE SOUZA CÂNDIDO E, E SILVA CARDOSO M H, SOUSA D A, et al. The use of versatile plant antimicrobial peptides in agribusiness and human health[J]. Peptides, 2015, 55: 65-78. DOI:10.1016/ j.peptides.2014.02.003.
[14] JIANG J F, JIA X. Sichuan Daliangshan area is one of origin region of Fagopyrum tataricum[J]. Fagopyrum, 1990, 12(1): 18-19.
[15] WANG L, YANG X, QIN P, et al. Flavonoid composition, antibacterial and antioxidant properties of tartary buckwheat bran extract[J]. Industrial Crops and Products, 2013, 49: 312-317. DOI:10.1016/j.indcrop.2013.04.039.
[16] CHRISTA K, SORAL-ŚMIETANA M. Buckwheat grains and buckwheat products-nutritional and prophylactic value of their components-a review[J]. Czech Journal of Food Sciences, 2008, 26(3): 153-162.
[17] 杨政水. 苦荞麦的功能特性及其开发利用[J]. 食品研究与开发, 2005, 26(1): 100-103.
[18] 王毅, 齐红霞, 谷斌斌, 等. 苦荞麦蛋白提取物对Ⅱ型糖尿病大鼠治疗作用研究[J]. 浙江预防医学, 2009, 21(1): 4-5.
[19] TANG C H, PENG J, ZHEN D W, et al. Physicochemical and antioxidant properties of buckwheat (Fagopyrum esculentum Moench) protein hydrolysates[J]. Food Chemistry, 2009, 115(2): 672-678. DOI:10.1016/j.foodchem.2008.12.068.
[20] GUO X, ZHU K, ZHANG H, et al. Purification and characteriza-tion of the antitumor protein from Chinese tartary buckwheat (Fagopyrum tataricum Gaertn.) water-soluble extracts[J]. Journal of Agricultural and Food Chemistry, 2007, 55(17): 6958-6961. DOI:10.1021/jf071032+.
[21] FUJIMURA M, MINAMI Y, WATANABE K, et al. Purification, characterization, and sequencing of a novel type of antimicrobial peptides, Fa-AMP1 and Fa-AMP2, from seeds of buckwheat[J]. Bioscience Biotechnology and Biochemistry, 2003, 67(8): 1636-1647. DOI:10.1271/bbb.67.1636.
[22] LEUNG E H, NG T B. A relatively stable antifungal peptide from buckwheat seeds with antiproliferative activity toward cancer cells[J]. Journal of Peptide Science, 2007, 13(11): 762-767. DOI:10.1002/psc.891.
[23] 白承之, 王转花, 李玉英. 一种苦荞抗真菌肽的纯化及抑菌活性分析[J]. 食品科学, 2010, 31(15): 4-7.
[24] 赵琳. 苦荞萌发期生理活性及其蛋白抗菌性的研究[D]. 上海: 上海师范大学, 2012: 67-69.
[25] MA Y Y, XIONG Y L, ZHAI J J, et al. Fractionation and evaluation of radical scavenging peptides from in vitro digests of buckwheat protein[J]. Food Chemistry, 2010, 118(3): 582-588. DOI:10.1016/ j.foodchem.2009.05.024.
[26] 金文刚, 吴海涛, 朱蓓薇, 等. 虾夷扇贝生殖腺多肽的制备及分离[J].大连工业大学学报, 2011, 30(6): 391-395.
[27] TANG W T, ZHANG H, WANG L, et al. Antimicrobial peptide isolated from ovalbumin hydrolysate by immobilized liposomebinding extraction[J]. European Food Research and Technology, 2013, 237(4): 591-600. DOI:10.1007/s00217-013-2034-6.
[28] YEAMAN M R, YOUNT N Y. Mechanisms of antimicrobial peptide action and resistance[J]. Pharmacological Reviews, 2003, 55(1): 27-55. DOI:10.1124/pr.55.1.2.
[29] JAMIESON A G, BOUTARD N, SABATINO D, et al. Peptide scanning for studying structure-activity relationships in drug discovery[J]. Chemical Biology & Drug Design, 2013, 81(1): 148-165. DOI:10.1111/cbdd.12042.
[30] 葛宜元. 试验设计方法与Design-Expert软件应用[M]. 哈尔滨: 哈尔滨工业大学出版社, 2014: 19-21.
Optimization of Enzymatic Hydrolysis of Tartary Buckwheat Protein for Preparing Antibacterial Peptides by Plackett-Burman and Box-Behnken Designs
ZHAO Hongqian, SONG Fengxia, JIANG Xiangshi, SHEN Shenyi, SHANG Dongliang, LI Lirong*
(Yunnan Institute of Food Safety, Kunming University of Science and Technology, Kunming 650500, China)
Abstract:The enzymatic hydrolysis of tartary buckwheat protein with neutral protease to produce antibacterial peptides was optimized using Plackett-Burman and Box-Behnken designs. One-factor-at-a-time experiments were carried out to investigate the effect of substrate concentration, enzyme-to-substrate ratio, pH, hydrolysis temperature and time on the antibacterial activity and peptide concentration of hydrolysates. The factors with a significant influence on the response variables were selected using Plackett-Burman design and optimized for maximum peptide concentration using Box-Behnken design. The optimum parameters for enzymatic hydrolysis were determined as follows: substrate concentration 3.22%, enzyme-to-substrate ratio 4 000 U/g and pH 6.86. Under these conditions, the peptide concentration was 32.41 mg/mL, in good agreement with the predicted value (32.12 mg/mL), and the percentage inhibition of antimicrobial peptides was (27.88 ± 2.78)% against E. coli and (94.56 ± 0.74)% against S. aureus. In conclusion, this optimized procedure was reasonable.
Key words:tartary buckwheat protein; enzymatic hydrolysis; antibacterial peptides; Plackett-Burman design; Box-Behnken design
DOI:10.7506/spkx1002-6630-201716025
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)16-0158-07
引文格式:
赵红倩, 宋风霞, 江祥师, 等. Plackett-Burman和Box-Behnken试验优化苦荞蛋白酶解制备抗菌肽的工艺[J]. 食品科学, 2017, 38(16): 158-164. DOI:10.7506/spkx1002-6630-201716025. http://www.spkx.net.cn
ZHAO Hongqian, SONG Fengxia, JIANG Xiangshi, et al. Optimization of enzymatic hydrolysis of tartary buckwheat protein for preparing antibacterial peptides by Plackett-Burman and Box-Behnken designs[J]. Food Science, 2017, 38(16): 158-164. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201716025. http://www.spkx.net.cn
收稿日期:2016-10-24
基金项目:国家自然科学基金地区科学基金项目(31460424);云南省省级人培项目(KKSY20140505);昆明理工大学大学生创新创业项目(201610674099)
作者简介:赵红倩(1995—),女,本科生,研究方向为食品科学与工程。E-mail:617956328@qq.com
*通信作者:李莉蓉(1980—),女,副教授,博士,研究方向为食品营养与功能因子。E-mail:lilirong-lily@126.com