
卫 强,任定美,李四聪,孙 涛,吕来虎
(安徽新华学院药学院,安徽 合肥 230088)
摘 要:研究皖南地区野生红豆杉茎、叶中多糖的提取、纯化方法,分析其单糖组成情况。结果表明,闪式提取为最佳提取方法,其中太平红豆杉细茎和黟县红豆杉叶多糖提取量最高,分别达到7.09、10.25 mg/g,其中细茎比粗茎多糖含量高10~20 倍。Sevag法脱蛋白效果最好,对太平红豆杉细茎、黟县红豆杉叶多糖的脱蛋白率分别为66.5%、69.1%。H2O2法脱色效果最好,对太平红豆杉细茎、黟县红豆杉叶多糖的脱色率为84.2%、85.3%。红外光谱显示,红豆杉细茎、粗茎和叶多糖谱图相似。2个产地的红豆杉细茎、粗茎和叶中精制多糖Ⅰ、Ⅱ、Ⅲ,三者单糖种类相似,木糖物质的量比均较高,但单糖组成比例不同。该研究为红豆杉多糖的开发和应用提供参数。
关键词:红豆杉;多糖;提取;纯化;单糖组成
我国野生红豆杉属(Taxus Linn.)植物主要分布甘肃、陕西、安徽等省区,生于海拔1 000~1 500 m石山杂林。皖南野生红豆杉属南方红豆杉[Taxus chinensis var. mairei (Lemée et Lévl.) Cheng et L.K.Fu],在安徽境内主要分布于黟县、太平等皖南山地、丘陵区[1]。黄山脚下的谭家桥镇聂家山上新近发现的红豆杉古树群面积约100 hm2,树龄大都在500 a之上[2]。多糖是重要的活性成分,具有抗氧化[3]、降血糖[4]、降血脂[5]、抗肿瘤[6]、免疫调节[7]等作用。红豆杉茎叶可再生,可作为提取多糖的主要来源,具有环境友好特点。目前,国内采用微波[8]、超声[9]等提取出种植红豆杉中多糖。利用Sevag法[10]、三氯乙酸法[11]等脱除多糖中蛋白质,利用H2O2[12]、活性炭[13]等对多糖进行脱色。本实验拟对皖南野生红豆杉中多糖进行提取、纯化方法的筛选,制备精多糖,并进一步分离和测定其茎、叶精多糖的单糖组成,为其开发应用提供基础。
1.1 材料与试剂
皖南红豆杉茎、叶于2016年4月分别采自安徽黄山市太平县、黟县,分为太平细茎(直接连接叶的枝条,简称TP细茎)、黟县细茎(简称yX细茎)、太平粗茎(非直接连接叶的枝条,简称TP粗茎)、黟县粗茎(简称yX粗茎)、太平叶(简称TP叶)和黟县叶(简称yX叶),经李启照副教授鉴定。
Sephadex G-150 上海森雅生物技术有限公司;DEAE-52纤维素 上海抚生实业有限公司。
牛血清白蛋白 美国Roche公司;鼠李糖(Rha)、阿拉伯糖(Ara)、木糖(Xyl)、甘露糖(Man)、葡萄糖(Glc)、岩藻糖(Fuc)、半乳糖(Gal)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)标准品(含量98%) 中国食品药品检定研究院;其他试剂均为分析纯,水为纯化水。
1.2 仪器与设备
JHBE-50型闪式提取器 河南金鼎科技发展有限公司;LDZ4-1.2型低速离心机 北京京立离心机有限公司;KJ-Sy-150超声提取器 北京同德创业科技有限公司;CNWB-C型微波萃取器 广州万程微波设备有限公司;UV-4802型紫外-可见分光光度计 美国尤尼柯仪器有限公司;TJ270-30A红外光谱仪 天津拓普仪器有限公司;6890-5973N气相色谱仪 美国安捷伦公司;FA1004型电子天平 上海民桥精密科学仪器有限公司。
1.3 方法
1.3.1 红豆杉多糖提取方法的选择
回流:干燥红豆杉细茎、粗茎和叶用粉碎机粉碎,过24 目筛,精密称取各5.0 g,分别加入80%乙醇溶液200 mL浸渍3 次,每次24 h,抽滤,弃去滤液。滤渣加入1 000 mL蒸馏水回流提取3 次,每次2 h,合并滤液,减压浓缩至200 mL,加入无水乙醇调整至体积分数80%,放入冰箱冷藏24 h,抽滤,滤饼以无水乙醇、丙酮、乙醚、环己烷、淋洗3~4 次,再加入150 mL蒸馏水70 ℃溶解,加入1/4体积的氯仿-浓硫酸(体积比4∶1)置于磁力搅拌器中振荡30 min,再离心3~4 次,每次5 min(4 000 r/min),吸取上清液,加入5 mL 30% H2O2溶液50 ℃保温脱色3 h,取5 mL按照1.3.2节方法计算多糖提取率。
超声:精密称取干燥红豆杉细茎、粗茎和叶粗粉各5 g,分别加入80%乙醇溶液200 mL超声5 次,每次8 min,抽滤,弃去滤液。滤渣加入1 000 mL蒸馏水超声(功率1 kW)提取3 次,每次30 min,合并滤液后同回流操作。
微波:精密称取干燥红豆杉细茎、粗茎和叶粗粉各5 g,分别加入80%乙醇溶液200 mL浸渍3 次,每次24 h,抽滤,弃去滤液。滤渣加入1 000 mL蒸馏水微波(功率1 kW)提取3 次,每次5 min,合并滤液后同回流操作。
闪式:精密称取干燥红豆杉细茎、粗茎和叶粗粉各5 g,分别加入80%乙醇溶液200 mL超声5 次,每次10 min,抽滤,弃去滤液。滤渣加入1 000 mL蒸馏水闪式提取3 次(转速3 500 r/min),每次5 min,合并滤液后同回流操作。
上述提取方法均重复3 次,计算平均值。
1.3.2 多糖含量测定
参考文献:[14],精密称取52.6 mg葡萄糖标准品,以蒸馏水定容于100 mL容量瓶。再移取5 mL以蒸馏水定容于100 mL容量瓶。精密量取0、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准品溶液,置于6 只10 mL刻度试管中,分别加蒸馏水至2 mL,再分别加入5%苯酚溶液1 mL,摇匀,迅速加入浓硫酸5 mL,摇匀,40 ℃水浴保温15 min,冷却至室温,以蒸馏水为空白对照,在波长490 nm处测定吸光度,以吸光度A为纵坐标,葡萄糖质量浓度C为横坐标,得到回归方程:A=0.040 23C+ 0.029 80,r为0.999 1,线性范围为2.63~13.15 μg/mL。
1.3.3 脱蛋白方法
1.3.3.1 蛋白质含量的测定
参考文献[12],精密称定50 mg考马斯亮蓝G-250,以25 mL 95%乙醇溶液溶解,再加入85%磷酸溶液50 mL,蒸馏水定容至500 mL。精密称定牛血清蛋白25 mg,以蒸馏水定容至100 mL,吸取标准牛血清白蛋白溶液0.1、0.2、0.3、0.4、0.5、0.6 mL置于具塞试管,加蒸馏水至5 mL,再加考马斯亮蓝G-250溶液25 mL,放置10 min,于595 nm波长处测吸光度。以空白试剂为参比,测定其吸光度。以吸光度Y为纵坐标,蛋白质量浓度X为横坐标,得到回归方程:Y=0.172 1X+0.028 50,r为0.999 2,线性范围为0.83~5.00 μg/mL。
1.3.3.2 脱蛋白方法的选择
Sevag法:按氯仿-正丁醇(4∶1,V/V)溶液配制Sevag试剂,将10 mL Sevag试剂与50 mL质量浓度一定的粗多糖样液混合,剧烈振摇20 min,4 000 r/min离心10 min,分去下层有机相和中间的变性蛋白。收集上清液,将上述方法反复6~8 次。测定多糖含量、蛋白含量及色素吸光度。按公式(1)、(2)计算多糖损失率和脱蛋白率。

三氯乙酸法:取50 mL粗多糖样液,用10%三氯乙酸溶液调至pH 3,混匀静置过夜,4 000 r/min离心10 min,弃去沉淀,收集上清液。并按公式(1)、(2)计算多糖损失率和脱蛋白率。
石灰乳法:取粗多糖溶液50 mL,水浴温度80 ℃,用石灰乳调pH 10,加热搅拌20 min,再用磷酸调pH 6,保温10 min后,静止室温,过滤沉淀,并按公式(1)、(2)计算多糖损失率和脱蛋白率。
盐酸法:取50 mL粗多糖样液,用2 mol/L盐酸溶液调pH 3,静置过夜,4 000 r/min离心10 min,弃去沉淀,收集上清液。并按公式(1)、(2)计算多糖损失率和脱蛋白率。
上述脱蛋白方法均重复3 次,计算平均值。
1.3.4 脱色方法
考虑到大孔树脂在生产过程中有残留问题,未对大孔树脂进行考察。采用H2O2、活性炭法、反胶束溶液法、95%乙醇法进行脱色,于波长300 nm处测定吸光度[15],按公式(3)、(4)计算脱色率和多糖损失率。

H2O2法:取脱蛋白后的多糖配制成5 mg/mL的粗多糖溶液50 mL,加入30% H2O2溶液1 mL,50 ℃保温脱色3 h,直至颜色符合要求或色值不能再降低,检测其脱色前后色素吸光度和多糖含量。
活性炭法:活性炭经重蒸水清洗过滤,120 ℃干燥24 h,备用。取脱蛋白后的多糖配制成5 mg/mL的粗多糖溶液50 mL,加入2%活性炭,50 ℃条件下脱色3 h,直至颜色符合要求或色值不能再降低,检测其脱色前后色素吸光度和多糖含量。
反胶束溶液法:取脱蛋白后的多糖配制成5 mg/mL的粗多糖溶液50 mL,沸水浴中加热30 min后冷却至室温,4 000 r/min离心5 min,取20 mL上清液加入0.234 g氯化钠备用。再移取1 mL正己醇、4 mL异辛烷和0.274 g十六烷基三甲基溴化铵混合制成反胶束溶液。取3 mL粗多糖溶液和1 mL反胶束溶液,振荡3 min,静置30 min,取下层液体检测其脱色前后色素吸光度和多糖含量。
乙醇法:取脱蛋白后的多糖以1∶20料液比(g/mL)回流提取3 h,重复3 次,抽滤,合并提取液,浓缩,95%乙醇溶液醇沉,离心,取沉淀测定脱色前后色素吸光度和多糖含量[16]。
上述脱色方法均重复3 次,计算平均值。
1.3.5 红外光谱分析
选取经1.3.1节方法提取后含量较高的TP细茎和yX叶多糖2.0 mg,加入适量KBr混合均匀后压片,经红外测试,分别比较不同提取方法中红外光谱的变化。
1.3.6 单糖组成分析
将红豆杉茎、叶粗多糖以蒸馏水溶解配制成质量浓度为120 mg/mL的溶液,离心后取上清液1 mL上DEAE-52纤维素柱(1.5 cm×60 cm),以蒸馏水及0.1、0.2、0.4、0.6 mol/L氯化钠溶液依次洗脱,流速为0.5 mL/min,每管收集量为3 mL,于波长490 nm处以苯酚-硫酸测定吸光度,绘制洗脱曲线。洗脱液浓缩,再经透析、浓缩、干燥,得多糖Ⅰ、Ⅱ、Ⅲ。多糖Ⅰ、Ⅱ、Ⅲ溶解于5 mL蒸馏水中,离心得上清液过Sephadex G-150凝胶柱,用蒸馏水进行洗脱,以苯酚-硫酸法(A490nm)隔管检测糖含量,并在波长280 nm处测定吸光度,检测蛋白含量,绘制洗脱曲线,按照洗脱峰收集合并组分,透析冷冻干燥得精制多糖Ⅰ、Ⅱ、Ⅲ。
称取精制多糖Ⅰ、Ⅱ、Ⅲ各20 mg及等量的鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖标准品分别加入蒸馏水溶解,加入硼氢化钠还原3 h,以冰乙酸调pH 4~5,加入甲醇,浓缩至干。加入醋酐,90 ℃水浴1.5 h,冷却,加入甲苯3 mL,N2吹干,加入乙醇,反复吹干3 次后,2 mL三氯甲烷萃取,过滤之后进行气相色谱分析。色谱条件:HP-5毛细管柱(30 mm×0.32 mm,0.25 μm);载气为氮气,流速1 mL/min;进样量1 μL;程序升温:柱初始温度160 ℃,以6 ℃/min升至200 ℃,保持6 min;进样口和检测器温度均为250 ℃[17]。
2.1 红豆杉多糖提取方法的选择
如图1所示,不同产地和不同提取方法对红豆杉茎、叶多糖提取量影响较大。其中闪式法在TP粗茎、yX粗茎、TP细茎、yX细茎、TP叶、yX叶中提取量均较高,其中TP细茎和yX叶中提取量达到7.09、10.25 mg/g,TP叶中多糖的提取量达到7.12 mg/g。闪式提取通过高速机械剪切力和超速动态分子渗滤作用,将药材破碎成微粉,具有破壁作用强、提取时间短、耗能低、杂质少等特点[18]。而微波和回流由于是高温处理,杂质多,在醇沉和脱蛋白过程中损失严重。而细茎比粗茎多糖含量高10~20 倍,说明红豆杉新枝(即细茎)对提取多糖有非常积极的意义,而老枝(粗茎)则应给予相应的保护。另外,TP叶、yX叶中多糖含量较高,说明摘取叶有利于增加提取量,由于叶再生能力强,修剪对植物影响小,也可作为提取多糖的重要原料。

图1 提取方法对多糖提取量的影响
Fig. 1 Effect of extraction methods on the yield of polysaccharides
2.2 红豆杉粗多糖的脱蛋白结果
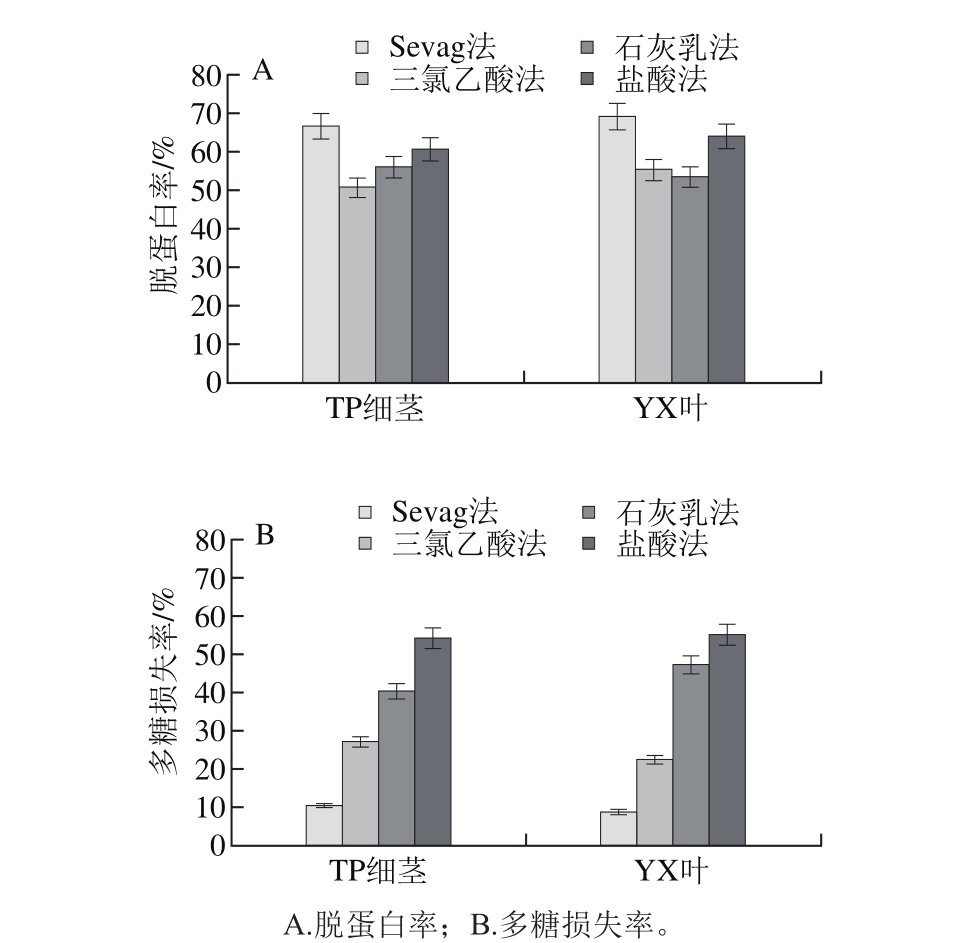
图2 脱蛋白方法对多糖的影响
Fig. 2 Effect of deproteinization methods on protein removal and polysaccharide loss
如图2所示,Sevag法脱蛋白率最高,对TP细茎和yX叶的脱蛋白率为66.5%和69.1%,而多糖损失率最低,对TP细茎和yX叶的多糖损失率为10.6%和8.9%。
2.3 红豆杉粗多糖的脱色
如图3所示,H2O2法脱色率最高,对TP细茎和yX叶的脱色率为84.2%和85.3%,而多糖损失率较低,对TP细茎和yX叶的多糖损失率为20.6%和22.5%。
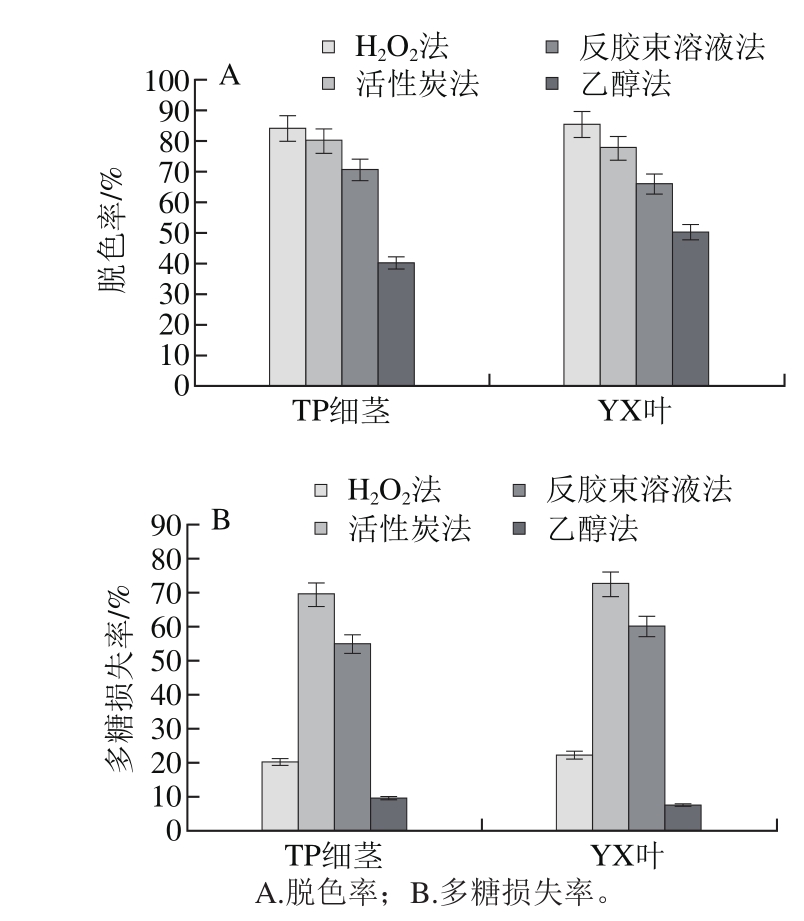
图3 脱色方法对多糖的影响
Fig. 3 Effect of decolorization methods on decoloraization rate and polysaccharide loss
2.4 红外光谱分析
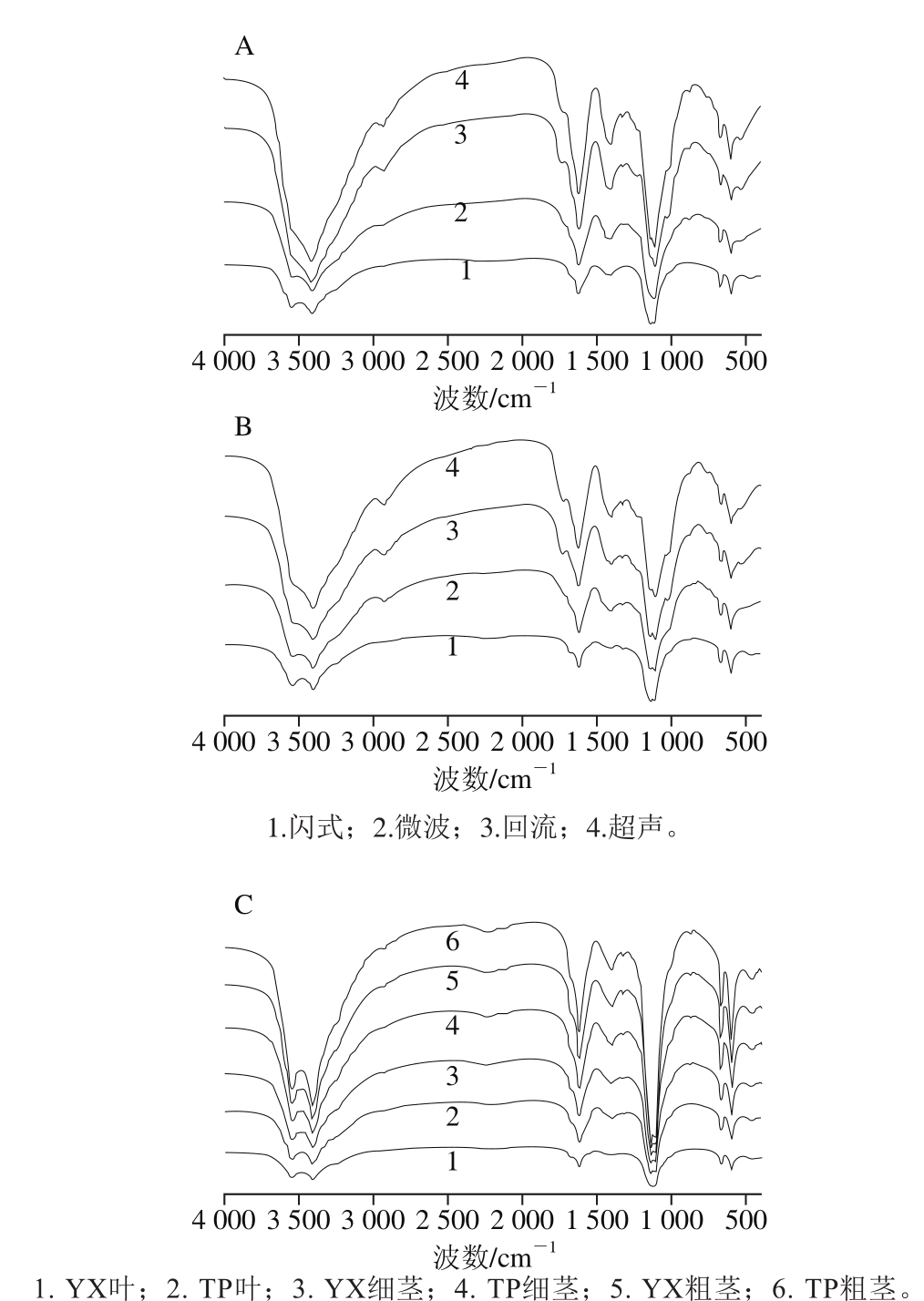
图4 TP细茎(A)和YX叶(B)不同提取多糖及闪式提取不同部位多糖(C)红外光谱谱型比较
Fig. 4 Comparison of IR spectra of polysaccharides extracted from thin stems (A) and leaves (B) by different extraction techniques and polysaccharides extracted from different parts by flash extraction (C)
表1 TP细茎多糖红外光谱比较
Table 1 Comparison of IR spectral peaks of polysaccharides extracted from thin stems by different extraction techniques

表2 YX叶多糖红外光谱比较
Table 2 Comparison of IR spectral peaks of polysaccharides extracted from leaves by different extraction techniques

表3 闪式提取叶、细茎和粗茎多糖的红外光谱比较
Table 3 Comparison of IR spectral peaks of polysaccharides extracted from leaves and thin and thick stems by flash extraction

由图4A、B可知,不同提取的TP细茎和yX叶多糖红外光谱相似。由图4C可知,红豆杉细茎、粗茎和叶闪式提取多糖红外光谱谱型也相似。由表1和表2可知,微波、回流和超声提取的细茎和叶多糖红外吸收光谱在3 400 cm-1左右是形成氢键的—OH伸缩振动,说明是分子内或分子间氢键;2 930 cm-1左右是糖类C—H伸缩振动吸收峰;1 400~1 200 cm-1是糖类C—H弯曲振动吸收峰;1740~1720 cm-1是C=O伸缩振动吸收峰,1 600~1 650 cm-1是—COOH中C=O非对称伸缩振动吸收峰,1 400 cm-1左右是—COO中的C—O伸缩振动,说明存在糖醛酸结构;1 150~1 020 cm-1是多糖中糖的醚键C—O—C伸缩振动特征峰;1 080~1 000 cm-1是吡喃环变形振动峰,说明可能是吡喃型多糖;879、881 cm-1说明TP细茎微波提取和yX叶超声提取多糖存在β-糖苷键,757 cm-1为α-吡喃环对称伸缩振动特征峰。由表3可知,3 550、3 410 cm-1左右形成氢键的—OH伸缩振动,说明闪式提取多糖中同时存在游离—OH和分子内或分子间氢键。经过与鼠李糖红外光谱比对,669、603、461 cm-1可能为鼠李糖的特征峰[19]。
2.5 单糖组成分析
由图5~7、表4~6可知,以yX叶为例,经DEAE-52纤维素柱柱层析后,得到3 个峰,表明多糖由3 种不同组成的组分构成。yX叶精制多糖经Sephadex G-150凝胶色谱柱纯化的多糖Ⅰ、Ⅱ、Ⅲ(图6a、b、c),流出曲线呈单一对称峰,说明是相对分子质量分布均一的多糖组分,为多糖结合蛋白。3 种精制多糖经衍生后,气相色谱测定单糖组成,计算物质的量比。结果表明,精制多糖Ⅰ、Ⅱ均含有鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、岩藻糖、半乳糖、葡萄糖醛酸和半乳糖醛酸。精制多糖Ⅰ、Ⅱ、Ⅲ中木糖物质的量比均较高。yX叶精制多糖Ⅰ中物质的量比较高的是Xyl、Gal、Ara(24.6∶18.4∶10.1),TP叶精制多糖Ⅰ中物质的量比较高的是Xyl、Rha、GlaA、Glc(18.0∶15.2∶10.6∶10.5),yX细茎精制多糖Ⅰ中物质的量比较高的是Man、Xyl、Glc(22.2∶19.2∶10.0),TP细茎精制多糖Ⅰ中物质的量比较高的是Man、Gal、Xyl(40.2∶20.4∶11.6),yX粗茎精制多糖Ⅰ中物质的量比较高的是GlcA、Xyl、GlaA、Man(18.0∶15.6∶15.1∶12.2),TP粗茎精制多糖Ⅰ中物质的量比较高的是Xyl、GlcA、Glc、GlaA(20.1∶14.7∶11.5∶10.3)。
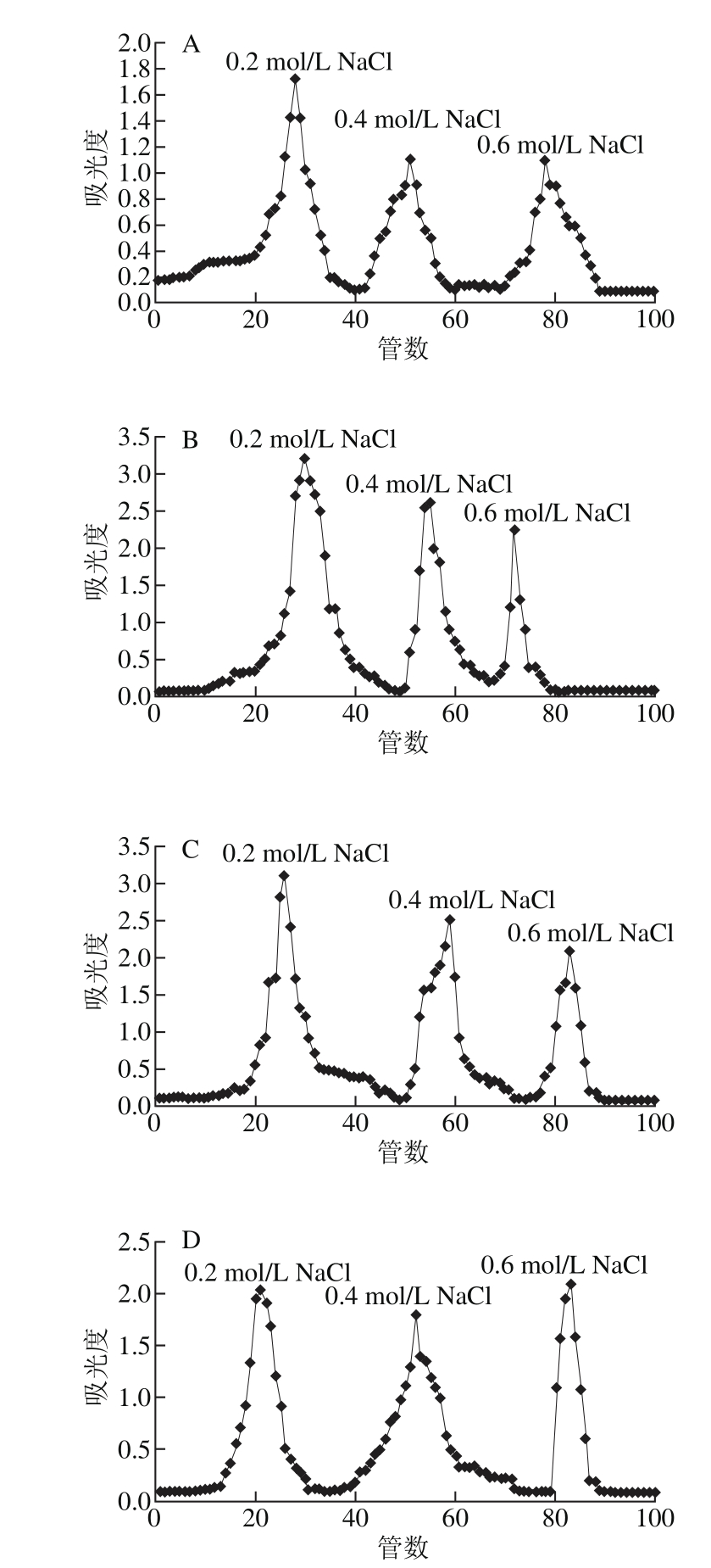
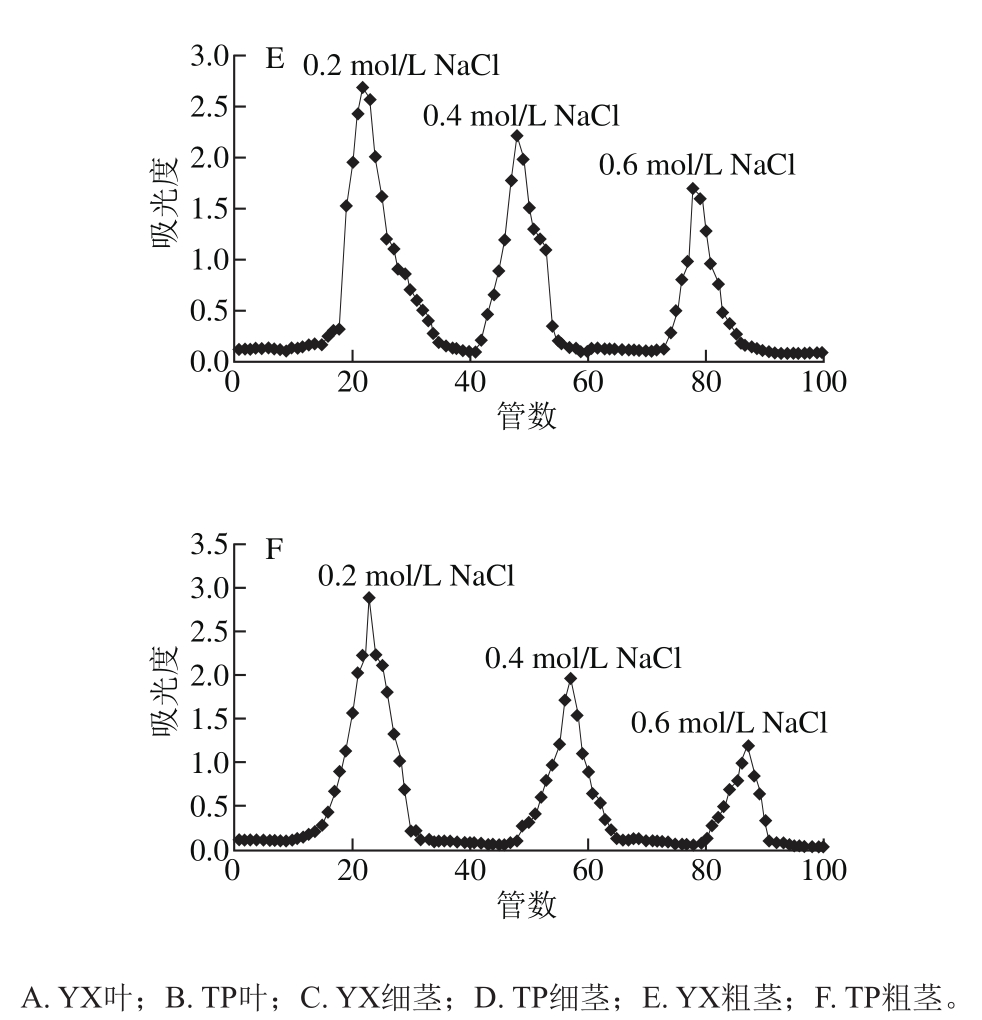
图5 多糖DEAE-52纤维素柱洗脱曲线
Fig. 5 Elution curve of polysaccharides by DEAE-52 cellulose column chromatography
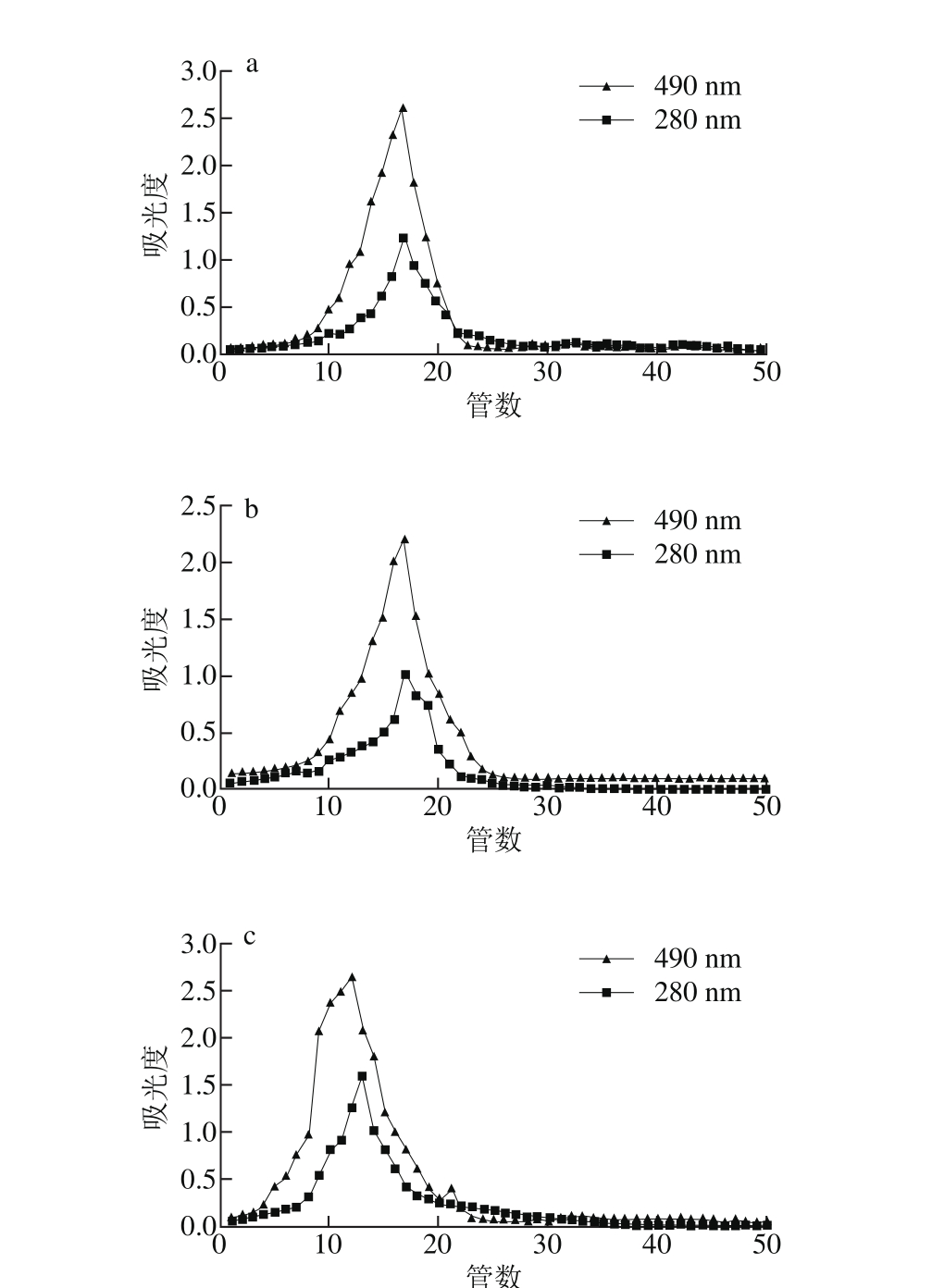
图6 YX叶多糖Ⅰ(a)、Ⅱ(b)、Ⅲ(c)经Sephadex G-150分子排阻色谱图
Fig. 6 Chromatography of purified leaf polysaccharides Ⅱ (b) andⅠ (a),Ⅲ (c) on Sephadex G-150 column

图7 单糖对照品(a)、YX叶精制多糖Ⅰ(b)、Ⅱ(c)、Ⅲ(d)气相色谱图
Fig. 7 Gas chromatograms of mixed monosaccharide standards (a), purified polysaccharides Ⅰ (b),Ⅱ(c), andⅢ (d)
表4 红豆杉细茎、粗茎和叶精制多糖Ⅰ的单糖组成比较
Table 4 Monosaccharide composition of purified polysaccharides Ⅰfrom thick and thin stems and leaves
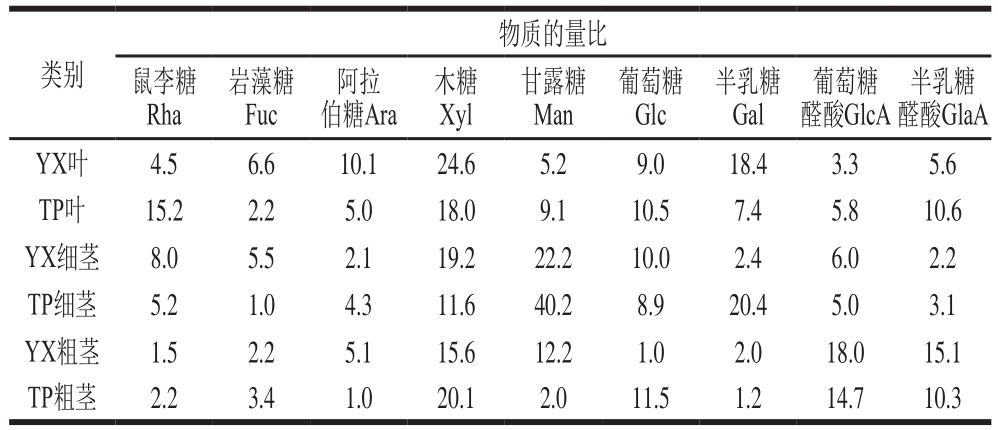
表5 红豆杉细茎、粗茎和叶精制多糖Ⅱ的单糖组成比较
Table 5 Monosaccharide composition of purified polysaccharides Ⅱfrom thick and thin stems and leaves
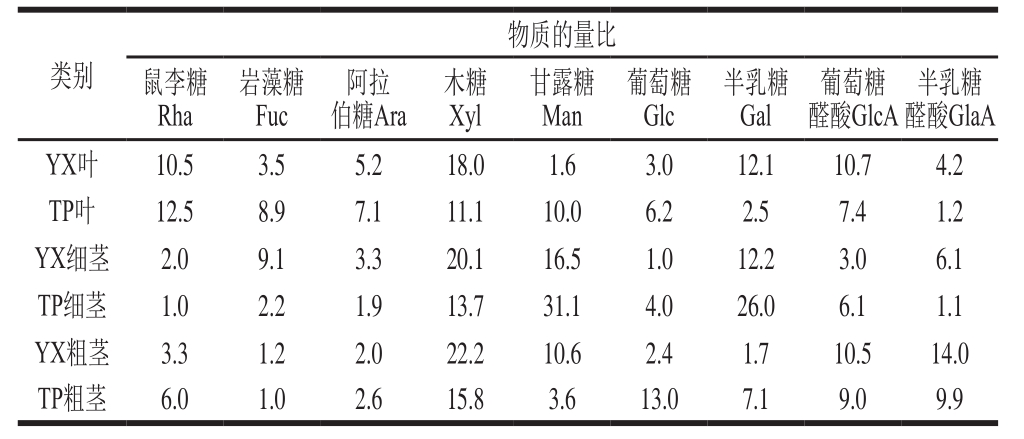
表6 红豆杉细茎、粗茎和叶精制多糖Ⅲ的单糖组成比较
Table 6 Monosaccharide composition of purified polysaccharides Ⅲfrom thick and thin stems and leaves
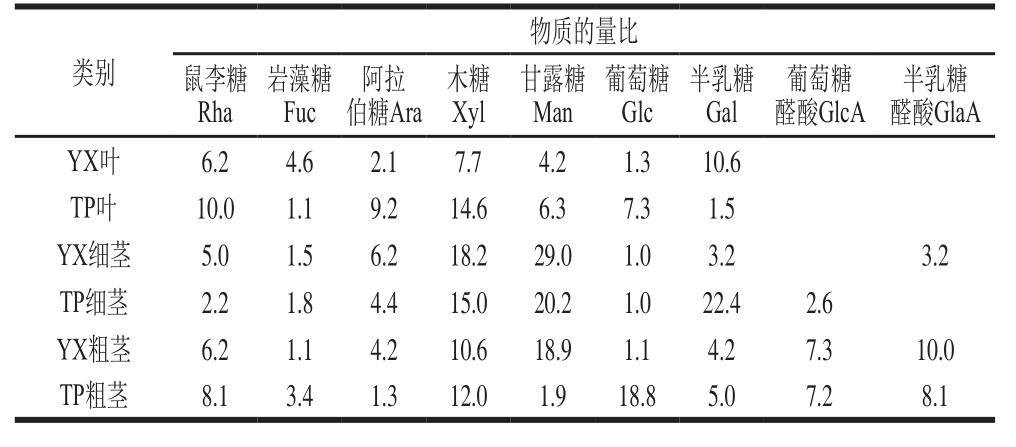
yX叶精制多糖Ⅱ中物质的量比较高的是Xyl、Gal、GlcA、Rha(18.0∶12.1∶10.7∶10.5),TP叶精制多糖Ⅱ中物质的量比较高的是Rha、Xyl、Man(12.5∶11.1∶10.0),yX细茎精制多糖Ⅱ中物质的量比较高的是Xyl、Man、Gal(20.1∶16.5∶12.2),TP细茎精制多糖Ⅱ中物质的量比较高的是Man、Gal、Xyl(31.1∶26.0∶13.7),yX粗茎精制多糖Ⅱ中物质的量比较高的是Xyl、GlaA、Man、GlcA(22.2∶14.0∶10.6∶10.5),TP粗茎精制多糖Ⅱ中物质的量比较高的是Xyl、Glc(15.8∶13.0)。
yX叶精制多糖Ⅲ中物质的量比较高的是Gal,TP叶精制多糖Ⅲ中物质的量比较高的是Xyl、Rha(14.6∶10.0),yX细茎精制多糖Ⅲ中物质的量比较高的是Man、Xyl(29.0∶18.2),TP细茎精制多糖Ⅲ中物质的量比较高的是Gla、Man、Xyl(22.4∶20.2∶15.0),yX粗茎精制多糖Ⅲ中物质的量比较高的是Man、Xyl、GlaA(18.9∶10.6∶10.0),TP粗茎精制多糖Ⅲ中物质的量比较高的是Glc、Xyl(18.8∶12.0)。
研究发现红豆杉多糖具有明显的抗肿瘤作用,如红豆杉多糖组分CPTC-2可抑制胃癌细胞SGC-7901,诱导其凋亡[20]。多糖组分PSy-1可抑制Lewis肺癌、HepA肝癌荷瘤小鼠模型的肿瘤生长[21]。多糖组分TMP90W可抑制乳腺癌MCF-7、肺癌A549细胞[22]。活性多糖PCH0.5可抑制肺癌HepA和Lewis肺癌细胞[23]。从云南红豆杉中分离出的活性多糖TMP70W可抑制白血病K562、宫颈癌MCF7细胞[24]。多糖TMP70S-1可抑制宫颈癌Hela、纤维肉瘤HT1080细胞[25]。
植物细胞壁是由纤维素、半纤维素、果胶质等物质构成的致密结构,多糖成分与维生素、蛋白质、果胶、淀粉、植物纤维等成分共存,普通提取难以破壁溶解,提取量较低[26]。红豆杉茎叶多糖的提取、纯化方法报道较多,但对茎中粗茎、细茎和叶中多糖含量差异鲜见报道。本实验通过回流、超声、微波、闪式4 种方法验证了粗茎、细茎和叶中多糖的含量,得出细茎和叶含量较高,有利于指导对其茎叶的采集、应用和开发。比较了4 种提取方法,闪式提取具有良好的提取效果。闪式提取技术是一种用于植物软、硬组织破碎的新型提取技术,能最大限度保留植物有效成分,使其不会受热破坏,具有溶剂用量小、提取时间短、效率高、刀具耐磨、结构紧凑及使用安全可靠的特点[27-28]。陈艳蕊等[29]利用单因素试验优化了黄芪多糖的闪式提取条件,与碱提法相比,闪式提取的黄芪多糖得率提高了近30%。谢霞等[30]证明,与传统提取方法比较,闪式提取法不仅节约时间和能源,而且在细柱五加茎多糖提取量上也优于回流提取法和超声提取法。本研究表明,皖南野生红豆杉茎、叶中多糖以闪式提取效果最好,新枝(细茎)比老枝(粗茎)多糖含量高,黟县叶(yX叶)中多糖含量也较高。多糖的纯化以Sevag法脱蛋白,H2O2法脱色效果最好。不同提取方法提取的红豆杉细茎、粗茎和叶多糖的红外光谱图相似,光谱数据有一定差异,说明提取方法对多糖结构影响不大。TP叶、yX叶、TP粗茎、yX粗茎、TP细茎、yX细茎中精制多糖Ⅰ、Ⅱ、Ⅲ在单糖种类相似,木糖物质的量比均较高,但单糖组成比例不同,可能对其生物活性产生一定的影响。
参考文献:
[1] 吴彦, 刘庆, 胡科, 等. 我国红豆杉资源现状和紫杉醇产业化对策[J]. 长江流域资源与环境, 2002, 11(6): 515-520. DOI:10.3969/ j.issn.1004-8227.2002.06.006.
[2] 汪友明, 樊美珍, 李增智. 安徽黄山红豆杉内生真菌多样性与生态分布[J]. 菌物学报, 2016, 35(3): 360-363. DOI:10.13346/ j.mycosystema.140210.
[3] 李广富, 陈伟, 范路平, 等. 茶新菇多糖酸奶体外抗氧化与抗衰老效果[J]. 现代食品科技, 2015, 31(8): 140-145; 173. DOI:10.13982/ j.mfst.1673-9078.2015.10.024.
[4] 夏慧, 唐华丽, 潘佳琪, 等. 枸杞多糖防治2型糖尿病的机制研究进展[J]. 食品科学, 2016, 37(9): 232-236. DOI:10.7506/spkx1002-6630-201609043.
[5] RAGHAVENDRA H R, SATHIVEL A, DEVAKI T. Effect of Sargassum polycystum (Phaeophyceae)-sulphated polysaccharide extract against acetaminophen-induced hyperlipidemia during toxic hepatitis in experimental rats[J]. Molecular and Cellular Biochemistry, 2005, 276(1/2): 89-96. DOI:10.1007/s11010-005-3194-x.
[6] ZONG A, LIU y, ZHANG y, et al. Anti-tumor activity and the mechanism of SIP-S: a sulfated polysaccharide with anti-metastatic effect[J]. Carbohydrate Polymers, 2015, 129(7): 50-54. DOI:10.1016/ j.carbpol.2015.04.017.
[7] XUE M, SUN H, CAO y, et al. Mulberry leaf polysaccharides modulate murine bone-marrow-derived dendritic cell maturation[J]. Human Vaccines and Immunotherapeutics, 2015, 11(4): 946-950. DOI: 10.1080/21645515.2015.1011977.
[8] 李石清, 徐磊, 熊耀康, 等. 基于Box-Behnken设计优选南方红豆杉多糖微波提取工艺研究[J]. 中华中医药学刊, 2013, 31(10): 2221-2223. DOI:10.13193/j.issn.1673-7717.2013.10.070.
[9] 张贵明, 王继文, 王文泽, 等. 朝鲜产东北红豆杉树皮中多糖提取工艺的比较研究[J]. 中国现代中药, 2008, 10(6): 32-34. DOI:10.3969/ j.issn.1673-4890.2008.06.012.
[10] 姚晓东, 刘章泉, 汪巍, 等. 金钗石斛水溶性多糖分子量分布及单糖组份分析[J]. 遵义医学院学报, 2015, 38(3): 239-243. DOI:10.14169/ j.cnki.zunyixuebao.2015.0058.
[11] 臧玉红, 李仁杰. 响应面法优化三氯乙酸脱除滑子菇粗多糖蛋白质的工艺[J]. 食品工业科技, 2014, 35(16): 243-247. DOI:10.13386/ j.issn1002-0306.2014.16.045.
[12] 孟宪军, 常瑜, 孙希云, 等. 微波辅助法提取蓝莓多糖BBP0-2的分离纯化及组分分析[J]. 食品科学, 2013, 34(12): 119-124. DOI:10.7506/ spkx1002-6630-201312025.
[13] 张丽红, 谢三都, 徐芳, 等. 紫苏叶多糖活性炭脱色工艺优化[J]. 食品与机械, 2015, 31(3): 224-230. DOI:10.13652/j.issn.1003-5788.2015.03.051.
[14] 彭强, 吕晓鹏, 黄琳娟, 等. 黑果枸杞多糖的纯化工艺研究[J]. 西北农业学报, 2012, 21(2): 121-126. DOI:10.3969/ j.issn.1004-1389.2012.02.025.
[15] 艾志录, 王育红, 任娜, 等. 苹果渣脱色工艺研究[J].食品研究与开发, 2006, 27(9): 77-80. DOI:10.3969/j.issn.1005-6521.2006.09.025.
[16] 张丽萍, 盛义保, 马惠玲, 等. 苹果多糖除杂脱色工艺的筛选[J]. 西北林学院学报, 2007, 22(1): 141-144. DOI:10.3969/ j.issn.1001-7461.2007.01.039.
[17] 卫强, 纪小影. 酶法联合闪式提取红叶李花多糖及单糖初步分析[J].天然产物研究与开发, 2015, 27(12): 2101-2108; 2163. DOI:10.16333/ j.1001-6880.2015.12.020.
[18] SHI S M, LIU y Z, TAI W, et al. Smashing tissue extraction and HPLC determination of active saponins from different parts of Panax notoginseng[J]. Chinese Herbal Medicines, 2012, 4(4): 341-345. DOI:10.3969/j.issn.1674-6348.2012.04.013.
[19] 李帅, 许程剑, 李应彪, 等. 阿魏菇多糖的结构分析[J]. 现代食品科技, 215, 31(3): 29-37. DOI:10.13982/j.mfst.1673-9078.2015.3.006.
[20] 叶佐武, 杨秀丽, 石佳娜, 等. 红豆杉多糖的生物活性及其提取纯化研究进展[J]. 中国现代应用药学, 2013, 30(5): 549-552. DOI:10.13748/j.cnki.issn1007-7693.2013.05.011.
[21] 华芳, 宋祖荣, 张国升, 等. 红豆杉多糖的研究进展[J]. 齐齐哈尔医学院学报, 2013, 34(7): 1016-1017. DOI:10.3969/ j.issn.1002-1256.2013.07.047.
[22] 王红晓, 闵军霞. 红豆杉多糖的分离鉴定和体外抗肿瘤活性测试[J].生命科学, 2015, 27(8): 1005-1018. DOI:10.13376/j.cbls/2015140.
[23] 卫强, 孙涛. 红豆杉的抗肿瘤活性成分及其衍生物研究进展[J]. 天然产物研究与开发, 2016, 28(10): 1664-1675; 1685. DOI:10.16333/ j.1001-6880.2016.10.031.
[24] yAN C y, yIN y, ZHANG D W, et al. Structural characterization and in vitro antitumor activity of a novel polysaccharide from Taxus yunnanensis[J]. Carbohydrate Polymers, 2013, 96(2): 389-395. DOI:10.1016/j.carbpol.2013.04.012.
[25] yIN y, yU R, yANG W, et al. Structural characterization and antitumor activity of a novel heteropolysaccharide isolated from Taxus yunnanensis[J]. Carbohydrate Polymers, 2010, 82(3): 543-548. DOI:10.1016/j.carbpol.2010.04.038.
[26] WANG D, LI y, HU X, et al. Combined enzymatic and mechanical cell disruption and lipid extraction of green alga Neochloris oleoabundans[J]. International Journal of Molecular Sciences, 2015, 16(4): 7707-7722. DOI:10.3390/ijms16047707.
[27] FAN y, yAN C P, CHEN C, et al. Tissue-smashing based ultra-rapid extraction of chemical constituents in herbal medicines[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 95: 213-219. DOI:10.1016/j.jpba.2014.03.004.
[28] TANG W Z, ZHAO y Q. Evaluation of fatty acid profiles of four kinds of Osmanthus fragrans seeds by combined smash tissue extraction and GC/MS analysis[J]. European Journal of Integrative Medicine, 2014, 6(6): 724-724. DOI:10.1016/j.eujim.2014.09.084.
[29] 陈艳蕊, 金文闻, 罗琥捷, 等. 黄芪多糖的闪式提取技术研究[J]. 现代生物医学进展, 2010, 10(17): 3322-3325. DOI:10.13241/j.cnki. pmb.2010.17.013.
[30] 谢霞, 李芝, 黄玮超, 等. 细柱五加茎多糖闪式提取工艺优化及其免疫活性研究[J]. 中草药, 2013, 44(20): 2859-2863. DOI:10.7501/ j.issn.0253-2670.2013.20.013.
Extraction and Purification of Polysaccharides from Stems and Leaves of Taxus Grown in Mountain Areas in Southern Anhui Province and Their Monosaccharide Composition
WEI Qiang, REN Dingmei, LI Sicong, SUN Tao, LÜ Laihu
(College of Pharmacy, Anhui Xinhua University, Hefei 230088, China)
Abstract:The extraction and purification of polysaccharides from the stems and leaves of wild Taxus chinensis var. mairei (Lemée et Lévl.) Cheng et L.K.Fu grown in mountain areas in the south of Anhui province were investigated and their monosaccharide compositions were determined. The results indicated that flash extraction was the best method to extract polysaccharides from these plant materials. The yields of polysaccharides extracted from thin stems from Taiping county and leaves from yi county were the highest (7.09 and 10.25 mg/g, respectively). Thin stems contained 10–20 times more polysaccharides than did thick ones. The Sevag method gave the highest deproteinization rate (66.5% and 69.1% for crude polysaccharides extracted from thin stems from Taiping county and leaves from yi county, respectively). The highest decolorization rate (84.2% and 85.3% for the two crude samples, respectively) was achieved by using hydrogen peroxide. Infrared spectra of polysaccharides extracted from thin and thick stems as well as leaves were similar. The purified polysaccharides (Ⅰ, Ⅱ and Ⅲ) from thin and thick stems as well as leaves contained a similar monosaccharide composition with xylose being predominant, but varying in monosaccharide ratio. These findings can provide valuable information for the development and application of polysaccharides from Taxus plants.
Key words:Taxus; polysaccharides; extraction; purification; monosaccharide composition
DOI:10.7506/spkx1002-6630-201716030
中图分类号:R284.1
文献标志码:A
文章编号:1002-6630(2017)16-0190-08
引文格式:
卫强, 任定美, 李四聪, 等. 皖南山区红豆杉多糖提取、纯化方法及单糖组成分析[J]. 食品科学, 2017, 38(16): 190-197. DOI:10.7506/spkx1002-6630-201716030. http://www.spkx.net.cn
WEI Qiang, REN Dingmei, LI Sicong, et al. Extraction and purification of polysaccharides from stems and leaves of Taxus grown in mountain areas in southern Anhui province and their monosaccharide composition[J]. Food Science, 2017, 38(16): 190-197. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201716030. http://www.spkx.net.cn
收稿日期:2016-10-20
基金项目:安徽省高校自然科学研究重点项目(KJ2016A313);安徽省大学生创新创业项目(201612216090)
作者简介:卫强(1977—),男,副教授,硕士,研究方向为天然产物活性成分。E-mail:weiqiang509@sina.com