任国艳1,2,宋 娅1,康怀彬1,肖 枫1,冯秋琪1,郭金英1,崔国庭1,王松军3
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.河南省新资源食品工程技术中心,河南 洛阳 471023;3.河南洛阳华鲵生物科技有限公司,河南 洛阳 471023)
摘 要:为研究高密度CO2(dense phase carbon dioxide,DPCD)前处理对鲵皮胶原蛋白提取率的影响,以冻干鲵皮为原料,采用DPCD对鲵皮进行前处理,酶法提取鲵皮胶原蛋白,设计单因素试验和响应面试验,以胶原蛋白提取率为评价指标,优化DPCD处理鲵皮的工艺条件。结果表明,DPCD处理鲵皮的最适温度32 ℃、压强30MPa、时间6 h;在该处理条件下,模型预测鲵皮胶原蛋白的提取率为39.70%,验证值为(39.48±0.74)%,无显著性差异(P>0.05);与原料未经DPCD处理胶原蛋白提取率((20.63±0.46)%)相比,提取率提高了18.85%;微观结构显示,鲵皮经DPCD处理后的组织疏松、胶束纤维有规则排列被破坏并呈现多孔状态;电泳图谱显示鲵皮经DPCD处理后,胶原蛋白保持典型的Ⅰ型胶原蛋白结构特征。DPCD处理鲵皮,在保持鲵皮胶原蛋白结构特征的同时,显著提高了胶原蛋白提取率。
关键词:鲵皮;高密度CO2;响应面试验;胶原蛋白分子结构;提取率
胶原蛋白是从不同的动物组织中获得的一种纤维蛋白,根据其特性和功能被广泛应用于食品业、医药业、皮革业、影像业和化妆品工业中[1]。目前从动物组织中提取胶原蛋白的方法主要有碱法、酸法和酶法,但有些方法存在着提取过程中胶原蛋白降解、腐蚀设备和胶原蛋白变性等不良现象,同时提取过程复杂、耗时、耗费大量化学试剂和酶制剂,有时还会造成环境污染,且提取率较低[2],因此,迫切需要更好的提取胶原蛋白的方法,以解决胶原蛋白提取方法中现存的问题。
高密度CO2(dense phase carbon dioxidense,DPCD)是近几年兴起的一种新型低耗能的非热食品加工技术,且因其具有无毒、环保安全、无化学残留、价格低廉、操作方便等优点,越来越受到关注[3]。CO2在自然状态下,对物料产生影响甚小,但当增加压力或提高温度,其密度增加,CO2会进入超临界状态(温度大于31.1 ℃,压强大于7.35 MPa),变成兼有气体和液体双重特点的流体,既具有类似液体的较大密度,又具有类似气体的高扩散性[4],该状态下的CO2会迅速渗透进物料的细胞内,溶解并破坏细胞膜,致使细胞膜的渗透性发生改变,使胞内物质更容易渗出;CO2进入物料细胞内,形成微酸环境,可能会使大分子物质如蛋白质等发生变性;当泄压时,CO2会带走物料细胞内的可溶成分,尤其是脂类物质[5]。利用这些性质,DPCD被广泛应用于食品的灭菌[6]、干燥[7]和萃取[8]等方面。Silva等[9]用水中充入高压CO2的方法,从海绵中提取胶原蛋白,能显著缩短提取时间,提高得率,而用DPCD处理固体原料提高胶原蛋白得率鲜见报道。鲵皮皮质较厚,韧性强,在胶原蛋白提取过程中,酶解效率较低。但鲵皮经一定方法处理后,组织结构会膨胀软化,有利于酶的作用[10],故本研究以干燥鲵皮为原料,采用DPCD进行预处理后酶解,并对处理工艺条件进行优化,以期提高鲵皮胶原蛋白的提取率,为胶原蛋白工业化生产提供参考。
1.1 材料与试剂
大鲵由洛阳华鲵生物科技有限公司提供。
CO2(纯度>99.99%) 洛阳斯科商贸有限公司;Marker标准品 大连宝生物工程有限公司;L-羟脯氨酸标品 美国Biosharp公司;胃蛋白酶 上海瑞永生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
TGL-20M型台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;K9860全自动凯氏定氮仪 上海海能公司;RE-5205旋转蒸发器 上海亚荣生化仪器厂;T6新世纪型紫外-可见分光光度计 北京普析通用仪器有限责任公司;SHZ-D(Ⅲ)循环水式多用真空泵河南省予华仪器有限公司;DyCZ-24DN电泳仪 北京市六一仪器厂;HA220-50-06型超临界萃取装置 江苏南通市华安超临界萃取有限公司;JFC-1600型离子溅射仪、JSM-5610LV扫描电镜仪 日本Jeol公司;凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 鲵皮基本成分分析
水分含量测定:参照GB 5009.3—2016《食品中水分的测定》;蛋白含量测定:参照GB 5009.5—2010《食品中蛋白质的测定》;粗脂肪含量测定:参照GB/T 5009.6—2003《食品中脂肪的测定》;灰分含量测定:参照GB 5009.4—2010《食品中灰分的测定》;总糖含量测定:苯酚-硫酸法[11]。
1.3.2 鲵皮预处理
去除鲵皮上残留的肌肉,清洗干净,手动剪成小块(约0.5 cm×0.5 cm),用质量分数为0.1%的NaOH溶液(液料比50∶1(mL/g))浸泡1 d,以除去杂蛋白和部分色素[12]。放置在4 ℃冰箱内,中间换液2~3 次。用去离子水将浸泡过的鲵皮洗涤干净后,经真空冷冻干燥后保存备用(干燥条件为物料温度-55 ℃、冷阱温度-65 ℃、真空度7 Pa,待物料温度升至室温即干燥完成)。
1.3.3 鲵皮胶原蛋白提取的工艺流程
取50g冻干鲵皮,用DPCD处理(具体处理方法详见1.3.5节),处理后进行酶解提取胶原蛋白(酶解条件参考肖枫等[13]研究并稍加修改:液料比20∶1,用乳酸调pH值至1.8,加胃蛋白酶量为50 U/g),4 ℃条件下振荡提取,得胶原蛋白提取液,过滤后离心(4 ℃,12 000 r/min,20 min),取上清液,测定羟脯氨酸的含量(mg/mL),并计算胶原蛋白提取率。
另取50 g冻干鲵皮,不用DPCD处理,直接按上述条件进行酶解提取胶原蛋白,计算胶原蛋白提取率,与原料经DPCD处理后胶原蛋白提取率进行比较。
1.3.4 鲵皮胶原蛋白提取率测定
羟脯氨酸含量测定参照李莉等[14]的方法,以吸光度为纵坐标,L-羟脯氨酸含量为横坐标,绘制标准曲线。y=0.060 57x+0.003 89,R2=0.999 4,其中,y为吸光度,x为L-羟脯氨酸含量,根据待测样品的吸光度可以计算样品中羟脯氨酸含量。
取适量待测样品至消化管中,加入6 mol/L盐酸溶液2 mL,于110 ℃条件下水解8 h,取出,用蒸馏水定容至50 mL,滤纸过滤,取1 mL滤液按羟脯氨酸标准曲线的测定方法,测定待测样品的吸光度。由羟脯氨酸标准曲线算出待测样品中羟脯氨酸含量,进而计算胶原蛋白提取率,如下式所示:
式中:Y为胶原蛋白提取率/%;ω为酶解液中羟脯氨酸含量/(µg/mL);11.1为羟脯氨酸换算系数;A为稀释倍数;B为鲵皮中胶原蛋白含量/(µg/mL)。
1.3.5 鲵皮提取工艺条件优化
1.3.5.1 单因素试验
每种处理称取50 g冻干鲵皮,在温度30 ℃、时间6 h时,选取压强(15、20、25、30、35 MPa)进行单因素试验。在压强30 MPa、时间6 h时,选取温度(20、25、30、35、40 ℃)进行单因素试验。在压强30 MPa、温度30 ℃时,选取提取时间(3、4、5、6、7 h)进行单因素试验,酶解提取胶原蛋白,根据提取率确定最佳压强、温度和时间的范围。
1.3.5.2 响应面优化试验
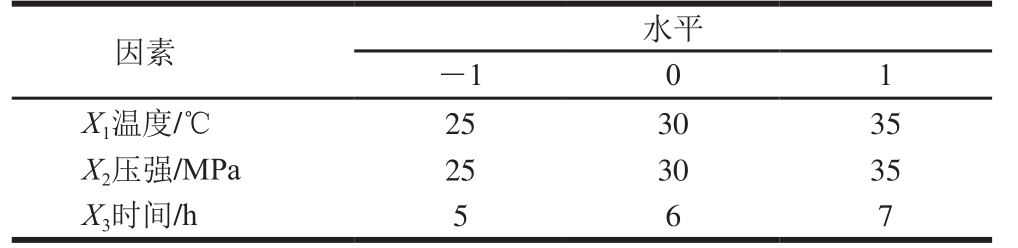
通过单因素试验,选取每个因素对胶原蛋白提取率影响较大的3 个水平,采用Box-Behnken模型设计三因素三水平的优化试验,并利用Design-Expert 8.06软件对试验因素进行编码组合(表1),对DPCD前处理鲵皮胶原蛋白的最佳工艺进行优化。
表1 Box-Behnken试验因素和水平设计
Table 1 Codes and levels of factors used in Box-Behnken design
1.3.6 鲵皮的扫描电镜分析
样品处理:将新鲜鲵皮清洗干净,手动剪成小块(约0.5 cm×0.5 cm),真空冷冻干燥后备用。取50 g冷冻干燥后的鲵皮经DPCD在最佳工艺条件下进行处理,将经DPCD处理的冻干鲵皮小块与未处理的冻干鲵皮小块,分别用JFC-1600型离子溅射仪在高真空镀膜机内喷金,用JSM-5610LV扫描电镜观察样品的微观结构。
1.3.7 胶原蛋白的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
采用垂直板型SDS-PAGE装置,使用质量分数为10%的分离胶、5%的浓缩胶,样品在浓缩胶中电压为80 V,分离胶中电压为100 V,电泳时间约2 h。用0.5%考马斯亮蓝R-250染色液染色约2 h,然后分别用自来水、蒸馏水反复将凝胶冲洗干净,最后用75 mL冰乙酸+50 mL甲醇+ 875 mL蒸馏水混合的脱色液脱色24 h,直至SDS-PAGE条带清晰可见,脱色完毕,用凝胶成像仪扫描凝胶成像。
1.4 数据统计分析
采用Design-Expert 8.06软件进行数据分析。每个样品重复测定3 次,数据用±s表示。
2.1 鲵皮的基本成分及胶原蛋白含量
表2 鲵皮基本成分及胶原蛋白含量
Table 2 Proximate composition and collagen content of Chinese giant salamander skin (on a wet weight basis)
鲵皮基本成分含量见表2。结果表明:新鲜鲵皮含水率为69.92%,粗蛋白质量分数约为26.10%,灰分质量分数约为0.99%,粗脂肪的质量分数约为0.94%,总糖质量分数约为0.64%。检测结果与李莉等[14]研究结果相似。鲵皮中胶原蛋白含量约占鲵皮湿质量的17.87%,占鲵皮中蛋白质总量的68.45%。
2.2 DPCD前处理提取鲵皮胶原蛋白工艺优化
2.2.1 DPCD前处理单因素试验结果
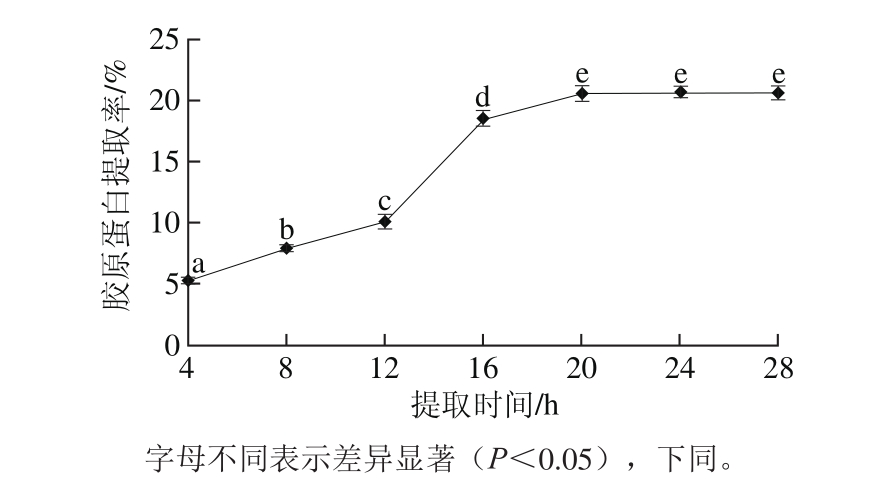
图1 提取时间对鲵皮胶原蛋白提取率的影响
Fig. 1 Effects of extraction time on collagen yield
未经DPCD处理的常压、4 ℃条件下,由图1可知,提取时间在4~20 h范围内,胶原蛋白提取率随着提取时间的延长而显著升高,但当提取时间超过20 h时,胶原蛋白提取率无显著增加。在4~28 h范围内,胶原蛋白提取率最高达到(20.63±0.46)%(24 h),显著低于李莉等[14]通过酶法从鲵皮中提取胶原蛋白的提取率(66.99%),略低于李华等[15]通过酶法从鲵皮中提取胶原蛋白的提取率(26.7%),分析原因可能是由于原料的状态(冻干样和鲜样)不同以及提取过程中所用的酸(乳酸和乙酸)不同。
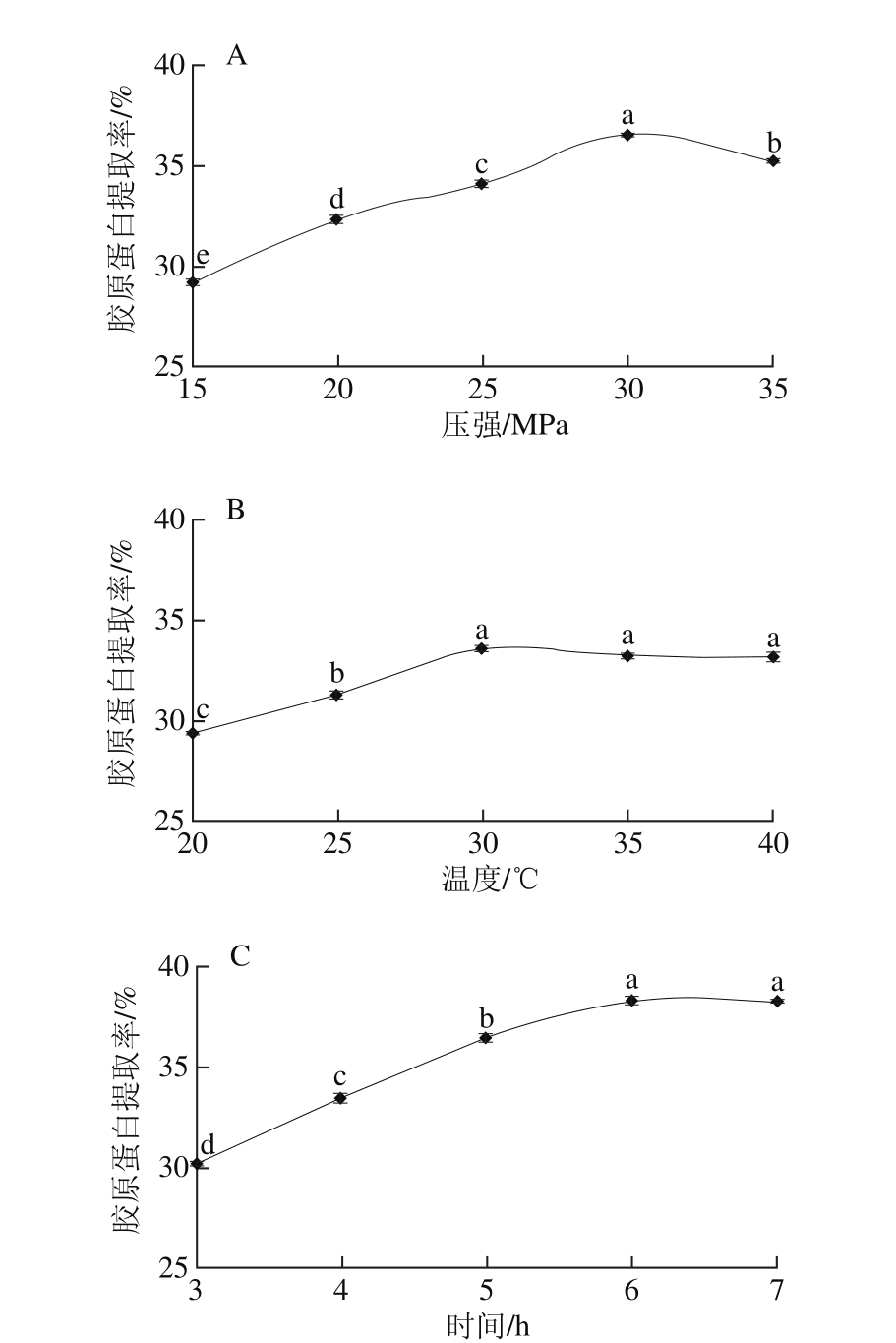
图2 DPCD处理压强(A)、温度(B)、时间(C)对鲵皮胶原蛋白提取率的影响
Fig. 2 Effects of DPCD pressure, temperature, and time on collagen yield
由图2A可知,DPCD处理压强为15~30 MPa时,随着压强的增加,鲵皮胶原蛋白提取率显著提高(P<0.05),在压强为30 MPa时,提取率达到最大值36.57%,当压强再增加时,提取率呈现显著下降趋势(P<0.05)。在压强作用下,CO2分子不断渗透进入物料细胞膜磷脂双分子层,导致细胞膜通透性发生明显变化,胞内的一些小分子物质如酶等会渗出[16-17],促进胶原蛋白分解,提高其溶解性。但当压强超过一定数值后,压强越高,CO2流体密度和黏度过大,传质的效果反而变差,影响CO2的渗透性,使胶原蛋白提取率下降[18]。如图2B所示,DPCD处理温度在20~30 ℃时,鲵皮的胶原蛋白提取率随温度的升高显著提高(P<0.05),在30 ℃达到最大值33.59%,而温度在30~40 ℃时,胶原蛋白提取率呈现下降趋势,但不显著(P>0.05)。温度对CO2流体的影响具有双重作用,随着温度的升高,CO2流体的密度会减小,但相对压强会增加。温度在20~30 ℃范围,CO2随着温度的升高扩散性增强,不断向物料细胞内部渗透,对细胞膜渗透性的改变逐渐增加,胶原蛋白的提取率也随之增高。但随着温度的不断升高,胶原蛋白提取率呈现下降趋势,这可能是随着温度的升高,胶原蛋白会发生收缩聚集,甚至变性,进而导致胶原蛋白溶解度下降[19]。由图2C可知,DPCD处理时间在3~6h时,胶原蛋白提取率随着时间的延长显著提高(P<0.05),当时间到达6 h时,提取率达到38.70%,当时间为7 h时,胶原蛋白提取率为38.72%,增大趋势不明显(P>0.05)。随着时间的延长,CO2流体与鲵皮接触的更加充分,渗透更完全,胶原蛋白提取率会显著增加,但当时间超过一定限度,CO2已经完全渗透到物料细胞,并达到平衡状态,时间对胶原蛋白提取率的影响将趋于平缓。比较图1和图2可以发现,冻干鲵皮经DPCD处理后,鲵皮胶原蛋白提取率明显提高。为了确定DPCD处理冻干鲵皮的最佳工艺条件,试验将对DPCD处理冻干鲵皮的最佳工艺进行优化。
2.2.2 响应面优化试验结果
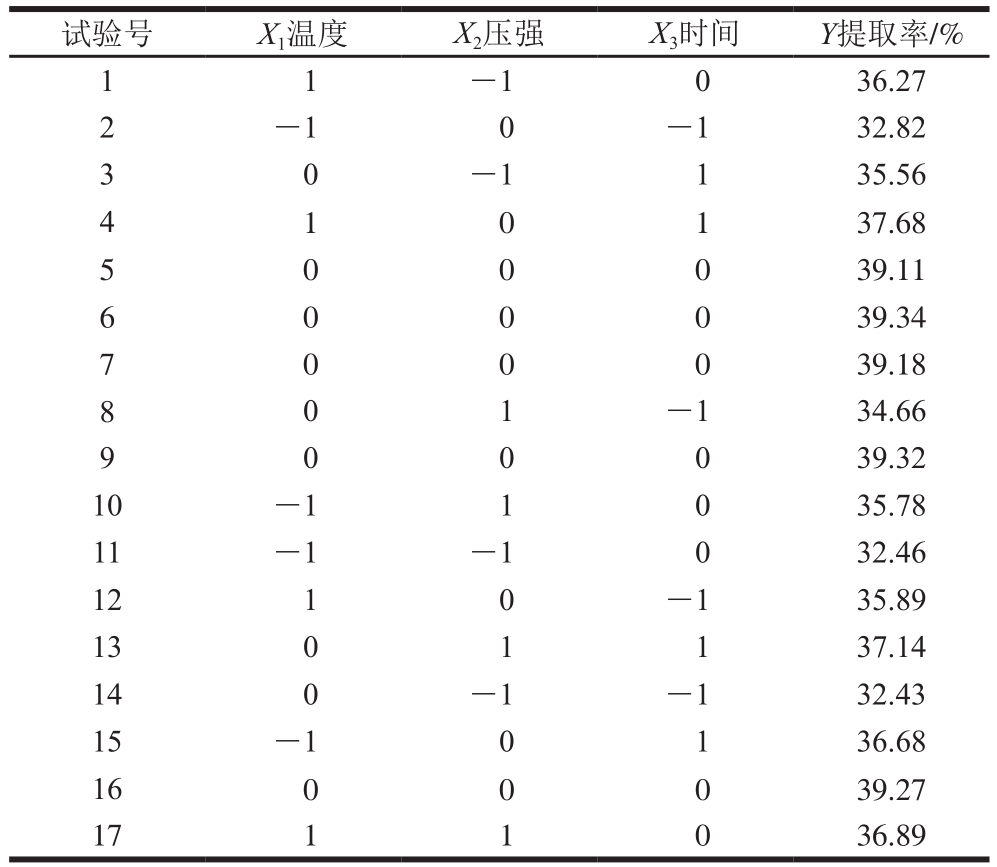
在单因素试验的基础上,按Box-Behnken设计试验(表3),采用响应面分析法优化DPCD前处理提取胶原蛋白的工艺条件,对所得数据进行分析,可得胶原蛋白提取率(Y)对温度、压强、时间的二次多项式响应面回归模型为:
Y=39.24+1.12X1+0.97X2+1.41X3-0.68X1X2-0.52XX-0.16XX-1.54X2-2.36X2-1.94X21323123
表3 Box-Behnken试验设计方案及其结果
Table 3 Box-Behnken design with experimental results
由表4方差分析可知,模型极显著(P<0.000 1),说明模型回归高度可靠;失拟项P值为0.1409(P>0.05),表示试验数据与模型拟合良好,试验误差小[20]。决定系数R2为0.998 6,表示响应值胶原蛋白提取率的变化99.86%来自于所选因变量,表明此模型与真实试验拟合情况非常好,回归方程无失拟因素存在。因此,在试验范围内可以用来解释和预测试验结果[21],确定最佳处理工艺。调整后的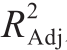 为0.996 7,可以看出调整后的
为0.996 7,可以看出调整后的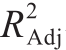 与模型的决定系数R2接近,表明该模型可以被用来进行进一步的分析。
与模型的决定系数R2接近,表明该模型可以被用来进行进一步的分析。
表4 回归模型的方差分析及回归模型系数的显著性检验
Table 4 Analysis of variance and significance test of coefficients in the regression model
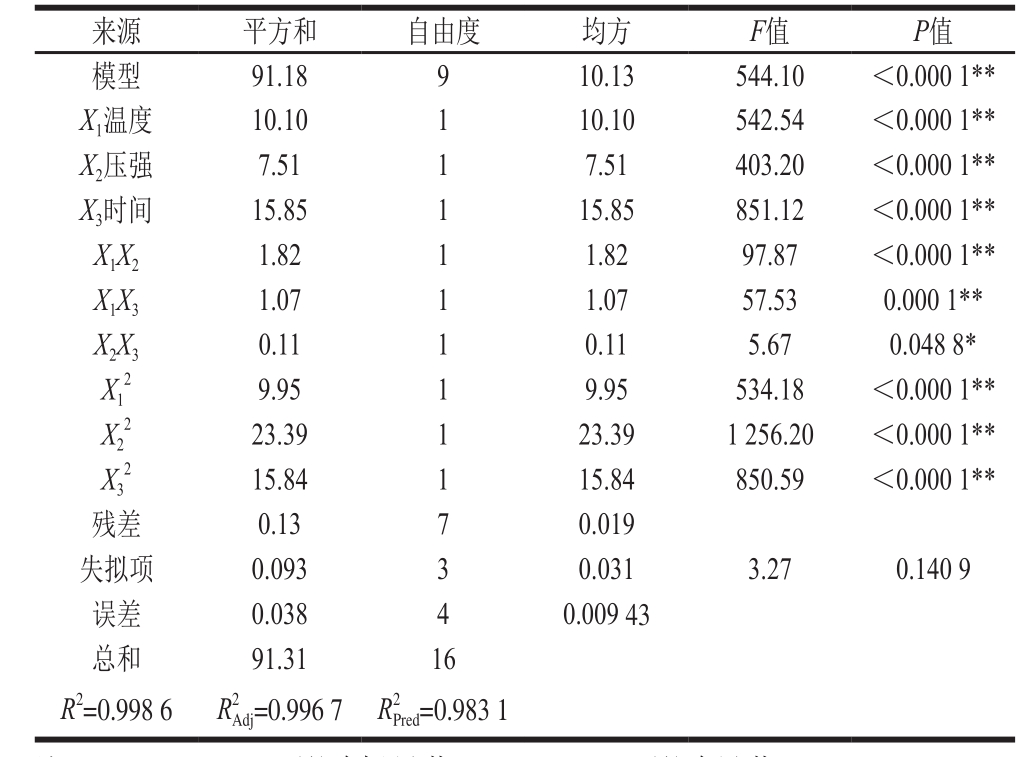
注:**. P<0.001,影响极显著;*. P<0.05,影响显著。
表4显示,回归模型的一次项X1、X2、X3影响极显著;二次项X12、X22、X32影响极显著;交互项X1X3、X1X2影响极显著,X2X3影响显著。各因素对胶原蛋白提取率影响的主次顺序为:X3>X1>X2,即时间>温度>压强。
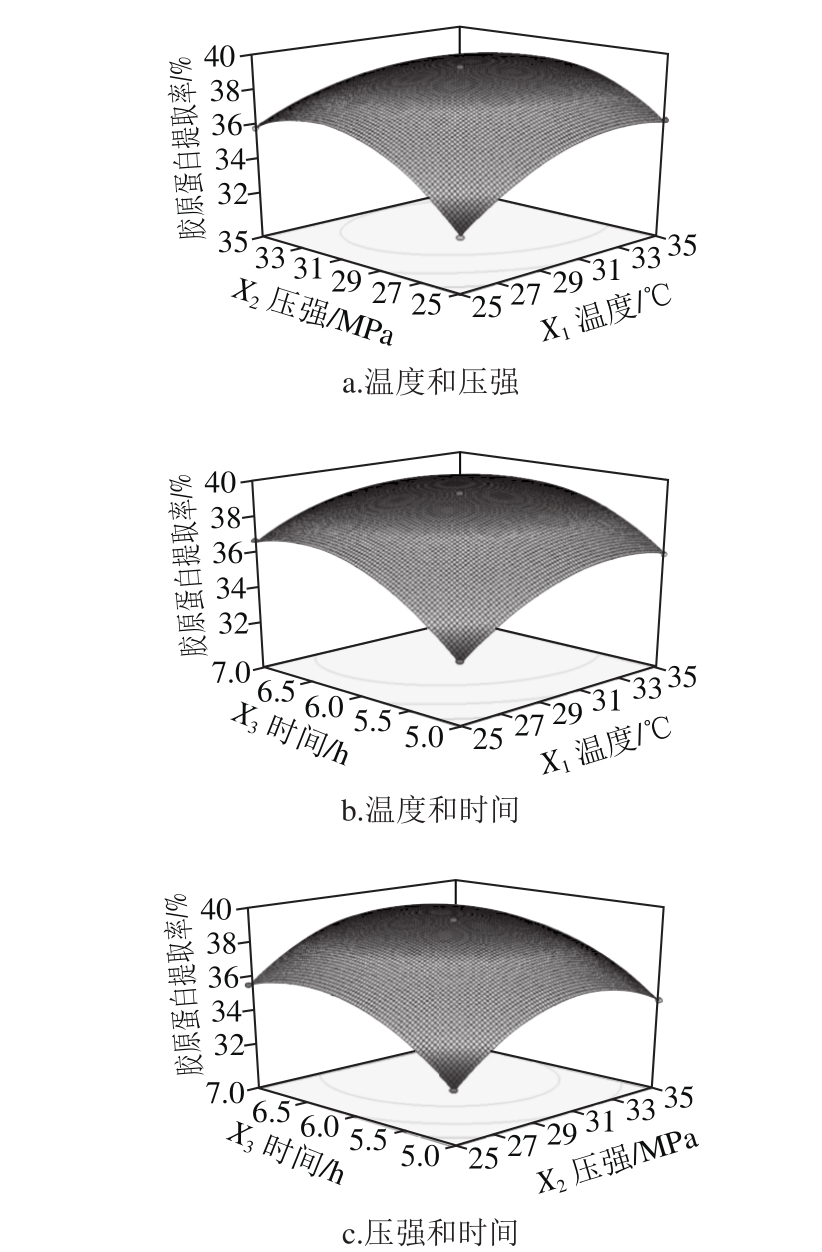
图3 各因素交互作用的响应面图
Fig. 3 Response surface plot showing the interactive effects of temperature, pressure and time on collagen yield
响应面图能够直观地反映各因素及因素之间的交互作用对响应值的影响[22]。等高线密集呈椭圆形表示两因素交互影响加大,响应面图坡度大表明因素对响应值影响较大。各因素交互作用中固定因素取0水平。图3a中沿温度方向比压强方向的响应面坡度大,表明温度对胶原蛋白提取率贡献大;图3b中沿时间方向比温度方向的响应面坡度大,表明时间对胶原蛋白提取率贡献大;图3c中沿时间方向比压强方向的响应面坡度大,表明时间对胶原蛋白提取率贡献大。以上结果与表4中模型显著性检验结果相一致,表明交互作用显著。
2.2.3 DPCD前处理鲵皮提取胶原蛋白工艺条件的确定和验证实验
根据软件对数据的分析预测,DPCD处理鲵皮提取胶原蛋白的最佳工艺条件为温度31.40 ℃、压强30.75 MPa、时间6.32 h,在此处理条件下,鲵皮胶原蛋白的理论提取率为39.70%。考虑到生产实际及仪器设备操作的方便性,对上述工艺条件稍加调整,设定实际最优处理工艺为温度32 ℃、压强30 MPa、时间6 h,在此条件下进行3 次验证实验,考察模型的可靠性。结果表明:实际最优处理工艺条件下,鲵皮胶原蛋白提取率为(39.48±0.74)%,与理论提取率无显著差异(P>0.05),模型可靠。在此条件下,冻干鲵皮经DPCD处理后胶原蛋白提取率((39.48±0.74)%)显著高于冻干鲵皮未经DPCD处理胶原蛋白提取率(20.63±0.46)%(P<0.05),且缩短提取时间,这表明DPCD前处理有利于胶原蛋白的溶出,在胶原蛋白实际生产中具有应用价值。
2.3 鲵皮扫描电镜分析

图4 鲵皮扫描电镜图
Fig. 4 Scanning electron micrographs of Chinese giant salamander skin
通过扫描电镜观察,并对DPCD处理前后鲵皮内表面、外表面和侧面微观结构进行比较,发现其变化。在未处理过的鲵皮内表面覆盖一层膜,毛细血管分布丰富,在内表面有一些细条状突起,清晰可见(图4A),但经DPCD处理后,内表面显得比较平整(图4D),这可能是由于高压作用;未处理的鲵皮外表面成凹凸不平的网状结构,这是由于在鲵皮外表面,分布一些斑瘤、形态各异的突起和腺体的外开口,开口的分布不均匀且疏密不一,造成孔径差异明显的凹窝,围绕凹窝的细胞相互连接形成网状结构,在腺体或斑瘤中会分泌一些黏液等物质[23](图4B),但经过DPCD处理后,凹窝明显加深,其周围的网状结构遭到一定程度的破坏(图4E),这可能是由于泄压后CO2带走腺体或斑瘤中分泌的疏水性物质[24],凹窝内出现空洞,凹窝周围细胞在CO2的渗透作用下,网络连接结构遭到破坏,出现裂纹;观察鲵皮截断面,能看到明显的纤维束,密集成束的纤维平行排列,纤维束间出现一些空隙(图4C),但经过处理后发现,成束的纤维被破坏,排布杂乱不平行,且纤维束之间空隙增多,比未处理前变得疏松(图4F),这可能是由于在DPCD作用下引起胶原纤维收缩造成的[25]。胶原纤维收缩主要与胶原纤维的热稳定性有关。Potekhin等[26]研究表明,压强对胶原纤维的热稳定性会产生一定的影响,随着压强的增加,胶原蛋白热变性温度提高,当压强达到200 MPa时,胶原蛋白变性温度提高了6.8 ℃,在本实验中,压强低于45 MPa,对胶原蛋白变性温度影响较小,因此,处理后鲵皮胶原纤维的收缩主要与温度有关。顾赛麒等[27]研究酶提鲵皮胶原蛋白变性温度为26.5 ℃,当温度超过变性温度时,胶原纤维就会产生收缩或交联[28],优化的温度是35 ℃,已经超过鲵皮的变性温度,因此,胶原纤维会出现一定程度的收缩,造成排列不规则和多孔现象。此外,泄压时,由于压强的突然变化以及CO2的萃取功能,也会影响到鲵皮胶原纤维的排列状态,这可能有利于胶原蛋白的溶出。
2.4 胶原蛋白的SDS-PAGE结果
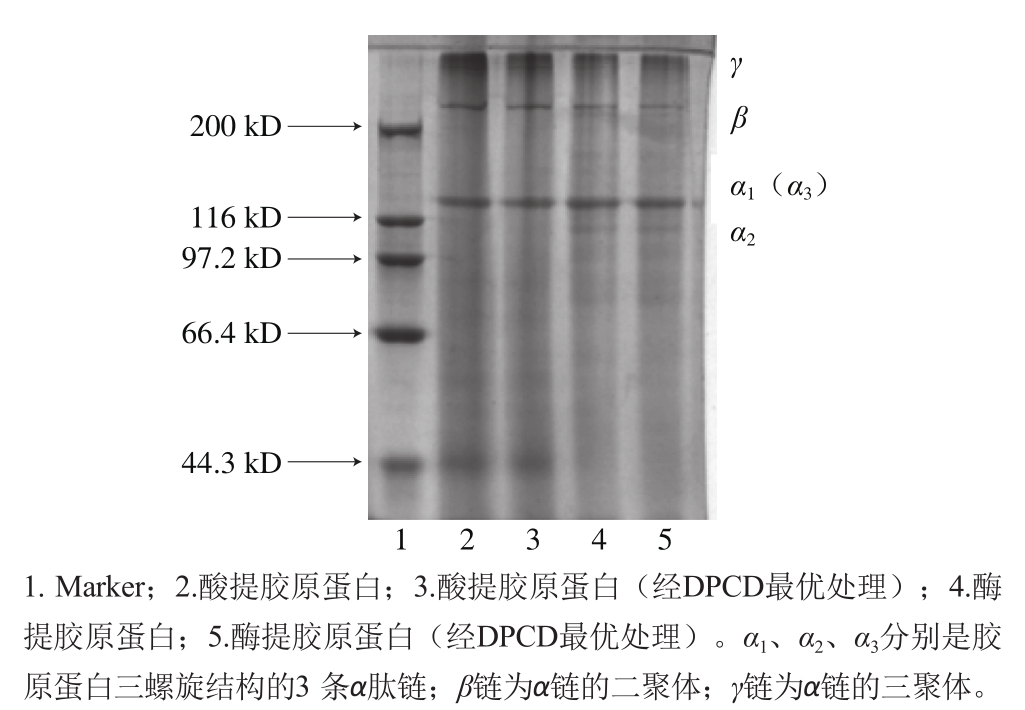
图5 鲵皮胶原蛋白的SDS-PAGE图谱
Fig. 5 SDS-PAGE patterns of collagens extracted from Chinese giant salamander skin
从图5可知,鲵皮经过DPCD处理后经酶法提取所得的胶原蛋白SDS-PAGE图谱与没有经过DPCD处理酶法提取的胶原蛋白电泳图谱没有明显变化。SDS-PAGE图谱中均出现一条γ链,一条β链和至少2条α链(α1(α3)和α2),是典型的Ⅰ型胶原蛋白[29-30]。胶原蛋白的条带较为清晰,无杂带,表明提取的胶原蛋白具有较高的纯度。虽然鲵皮经过DPCD处理前后,Ⅰ型胶原蛋白螺旋结构3 个亚基均出现在SDS-PAGE图谱中,但DPCD处理是否会对胶原蛋白的三螺旋结构产生影响,还需进一步实验验证。
经单因素试验和响应面优化试验,确定DPCD前处理的鲵皮酶法提取胶原蛋白的最佳处理工艺条件为温度32 ℃、压强30 MPa、时间6 h,在此条件下,鲵皮胶原蛋白提取率与对照相比提高了18.85%。鲵皮经DPCD处理前后,胶原蛋白的SDS-PAGE图谱未呈现明显变化。
采用DPCD方法对冻干鲵皮进行前处理,与未经DPCD处理的鲵皮相比,DPCD前处理能够改变鲵皮微观组织结构,胶束纤维有规则排列被破坏并呈现多孔状态,这些微观组织结构的变化有利于胶原蛋白的溶出。
参考文献:
[1] CHEN J D, LI L, yI R Z, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J]. LWT-Food Science and Technology, 2016, 66: 453-459. DOI:10.1016/j.lwt.2015.10.070.
[2] HUANG C y, KUO J M, WU S J, et al. Isolation and characterization of fish scale collagen from tilapia (Oreochromis sp.) by a novel extrusion–hydro-extraction process[J]. Food Chemistry, 2016, 190: 997-1006. DOI:10.1016/j.foodchem.2015.06.066.
[3] DUONG T, BALABAN M, PERERA C. Effects of combined high hydrostatic pressure and dense phase carbon dioxide on the activity, structure and size of polyphenoloxidase[J]. Journal of Food Science, 2015, 80(11): E2486-E2494. DOI:10.1111/1750-3841.13091.
[4] SHANTAROVICH V P, BEKESHEV V G, BELOV N A, et al. Effect of supercritical carbon dioxide on nanoporous polyhexafluoropropylene[J]. High Energy Chemistry, 2016, 50(4): 287-291. DOI:10.1134/S0018143916040160.
[5] TAO D D, ZHOU B, ZHANG L y, et al. Kinetics of “Laba” garlic greening and its physiochemical properties treated by dense phase carbon dioxide[J]. LWT-Food Science and Technology, 2015, 64(2): 775-780. DOI:10.1016/j.lwt.2015.06.048.
[6] JI H W, ZHANG L, LIU S C, et al. Optimization of microbial inactivation of shrimp by dense phase carbon dioxide[J]. International Journal of Food Microbiology, 2012, 156(1): 44-49. DOI:10.1016/ j.ijfoodmicro.2012.02.020.
[7] SEBASTIAN K, LOVISA E, ARWA M, et al. Effect of novel drying techniques on the extraction of anthocyanins from bilberry press cake using supercritical carbon dioxide[J]. Innovative Food Science and Emerging Technologies, 2015, 29: 209-214. DOI:10.1016/ j.ifset.2015.02.002.
[8] MIRELLE D, NILSON J, ALESSANDRA L O. Extraction of corymbia citriodora essential oil and resin using near and supercritical carbon dioxide[J]. Journal of Supercritical Fluids, 2016, 115: 54-64. DOI:10.1016/j.supflu.2016.04.015.
[9] SILVA J C, BARROS A A A, AROSO I M, et al. Extraction of collagen/gelatin from the marine demosponge chondrosia reniformis (Nardo, 1847) using water acidified with carbon dioxide-process optimization[J]. Industrial & Engineering Chemistry Research, 2016, 55(25): 6922-6930. DOI:10.1021/acs.iecr.6b00523.
[10] 李静, 叶欣, 冉旭. 高温高压提高大鲵皮胶原蛋白肽提取率的研究[J].食品工业, 2015, 36(10): 1-4.
[11] 田冰梅, 谢晓梅, 沈盼盼, 等. 分级醇沉宣木瓜多糖含量、分子量测定和活性初步研究[J]. 光谱学与光谱分析, 2015, 35(5): 1331-1334. DOI:10.3964/j.issn.1000-0593(2015)05-1331-04.
[12] 楚水晶, 农绍庄, 柳春山, 等. 酶法提取马面鱼鱼皮胶原蛋白的工艺研究[J]. 食品科技, 2010, 35(5): 234-237.
[13] 肖枫, 朱文学, 康怀彬, 等. 正交试验优化黄河鲤鱼鳞酶促溶性胶原蛋白提取工艺[J]. 食品科学, 2015, 36(12): 60-65. DOI:10.7506/ spkx1002-6630-201512011.
[14] 李莉, 顾赛麒, 王锡昌, 等. 响应面法优化酶法提取大鲵皮胶原蛋白工艺[J]. 中国水产科学, 2013, 20(4): 876-883. DOI:10.3724/ SP.J.1118.2013.00876.
[15] 李华. 大鲵皮中胶原蛋白的提取及性质研究[J]. 淡水渔业, 2013, 43(2): 71-74. DOI:10.3969/j.issn.1000-6907.2013.02.013.
[16] TAO D D, ZHOU B, ZHANG L y. ‘Laba’ garlic processed by dense phase carbon dioxide: the relation between green colour generation and cellular structure, alliin consumption and alliinase activity[J]. Journal of the Science of Food and Agriculture, 2016, 96(9): 2969-2975. DOI:10.1002/jsfa.7463.
[17] FERRENTINO G, BALZAN S, SPILIMBERGO S. Optimization of supercritical carbon dioxide treatment for the inactivation of the natural microbial flora in cubed cooked ham[J]. Internation Jounary of Food Microbioloy, 2013, 161: 189-196. DOI:10.1016/ j.ijfoodmicro.2012.12.004.
[18] DUBA K S, FIORI L. Supercritical CO2extraction of grape seed oil: effect of process parameters on the extraction kinetics[J]. Journal of Supercritical Fluids, 2015, 98: 33-43. DOI:10.1016/ j.supflu.2014.12.021.
[19] 吕妙兄, 刘书成, 屈小娟, 等. 高密度CO2处理对皱纹盘鲍肌肉品质的影响[J]. 农业工程学报, 2013, 29(s1): 301-306. DOI:10.3969/ j.issn.1002-6819.2013.z1.046.
[20] XU E B, PAN X W, WU Z Z, et al. Response surface methodology for evaluation and optimization of process parameter and antioxidant capacity of rice flour modified by enzymatic extrusion[J]. Food Chemistry, 2016: 146-154. DOI:10.1016/j.foodchem.2016.05.171.
[21] AKALIN M K, AKyUZ M, KARAGOZ S. Supercritical fluid extraction of bio-oils from hawthorn stones: a Box-Behnken design for the extraction parameters[J]. Energy Technology, 2015, 3(1): 40-47. DOI:10.1002/ente.201402103.
[22] GENG L J, ZHOU W, QU X y, et al. Optimization of the preparation of pectin from Aloe using a Box-Behnken design[J]. Carbohydrate Polymers, 2014: 193-199. DOI:10.1016/j.carbpol.2014.01.069.
[23] 李庚午, 吴淑辉, 朱命炜, 等. 大鲵皮肤的扫描电镜观察[J]. 电子显微学报, 1993(1): 24-25.
[24] CHEN J, LI J, SUN A D, et al. Supercritical CO2extraction and pre-column derivatization of polysaccharides from artemisia sphaerocephala krasch seeds via gas chromatography[J]. Industrial Crops and Products, 2016, 60: 138-143. DOI:10.1016/ j.indcrop.2014.06.013.
[25] 邓丽, 李岩, 董秀萍, 等. 热加工过程中鲍鱼腹足蛋白间作用力及其质构特性[J]. 农业工程学报, 2014, 30(18): 307-313. DOI:10.3969/ j.issn.1002-6819.2014.18.038.
[26] POTEKHIN S A, SENIN A A. ABDURAKHMANOV N N, et al. High pressure stabilization of collagen structure[J]. Biochimica et Biophysica Acta, 2009, 1794(8): 1151-1158. DOI:10.1016/ j.bbapap.2009.04.005.
[27] 顾赛麒, 李莉, 王锡昌, 等. 人工养殖大鲵皮胶原蛋白的性质研究[J].食品科学, 2014, 35(9): 74-79. DOI:10.7506/spkx1002-6630-201409016.
[28] WANG y J, GUO J, CHEN H. Influence of containing moisture on hydrothermal stability of modified collagen thermal characteristics analysis by DSC[J]. Journal of Thermal Analysis and Calorimetry, 2010, 99(1): 295-300. DOI:10.1007/s10973-009-0561-y.
[29] SOTELO C G, COMESAÑA M B, ARIZA P R, et al. Characterization of collagen from different discarded fish species of the west coast of the Iberian Peninsula[J]. Journal of Aquatic Food Product Technology, 2016, 25(3): 388-399. DOI:10.1080/10498850.2013.865283.
[30] yANG y N, LI C y, SONG W, et al. Purification, optimization and physicochemical properties of collagen from soft-shelled turtle calipash[J]. International Journal of Biological Macromolecules, 2016, 89: 344-352. DOI:10.1016/j.ijbiomac.2016.04.048.
Optimization of Processing Parameters for Collagen Extraction from Chinese Giant Salamander (Andrias davidianus) Skin after Dense Phase Carbon Dioxide Pretreatment
REN Guoyan1,2, SONG Ya1, KANG Huaibin1, XIAO Feng1, FENG Qiuqi1, GUO Jinying1, CUI Guoting1, WANG Songjun3
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China; 2. Henan Engineering Research Center of Food Material, Luoyang 471023, China; 3. Luoyang Huani Biological Technology Co. Ltd., Luoyang 471023, China)
Abstract:In this study, the effect of pretreatment with dense phase carbon dioxidense (DPCD) on improving the enzymatic extraction of collagen from Chinese giant salamander skin was investigated. For collagen extraction, lyophilized Chinese giant salamander skin was pretreated with DPCD under different operating conditions of pressure and temperature, and then hydrolyzed by pepsin for different time periods. The optimization of these three parameters for improved extraction yield was performed using a combination of one-factor-at-a-time method and response surface methodology. The optimal enzymatic extraction conditions were found to be 6 h hydrolysis after DPCD pretreatment at 32 ℃ and 30 MPa. The modelpredicted extraction yield under these optimized conditions was 39.70%, and it was not significantly different from the experimental value, (39.48±0.74)% (P > 0.05), 18.85% higher than that obtained without any pretreatment, (20.63±0.46)%. It was observed with a scanning electron microscope (SEM) that the microstructure of the skin became more loose, and collagen fibrils were damaged and became more orderly arranged and porous after DPCD treatment. The SDS-PAGE patterns showed that the typical characteristics of type I collagen was retained after DPCD treatment. Meanwhile, DPCD treatment significantly increased the extraction yield of collagen.
Key words:Chinese giant salamander skin; dense phase carbon dioxide (DPCD); response surface methodology; collagen structure; extraction yield
DOI:10.7506/spkx1002-6630-201716031
中图分类号:TQ254
文献标志码:A
文章编号:1002-6630(2017)16-0198-07
引文格式:
任国艳, 宋娅, 康怀彬, 等. 高密度CO2处理提取鲵皮胶原蛋白的工艺优化[J]. 食品科学, 2017, 38(16): 198-204. DOI:10.7506/spkx1002-6630-201716031. http://www.spkx.net.cn
收稿日期:2017-02-08
基金项目:“三区”人才支持计划项目(2016SQ041);河南省科技厅科普项目(173400410001);
企业委托项目(4009/22010041);河南科技大学大学生研究训练计划(SRTP)项目(2016067)
作者简介:任国艳(1976—),女,副教授,博士,研究方向为农(水)产品深加工与高值化利用。E-mail:renguoyan@163.com
REN Guoyan, SONG Ya, KANG Huaibin, et al. Optimization of processing parameters for collagen extraction from Chinese giant salamander (Andrias davidianus) skin after dense phase carbon dioxide pretreatment[J]. Food Science, 2017, 38(16): 198-204. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201716031. http://www.spkx.net.cn