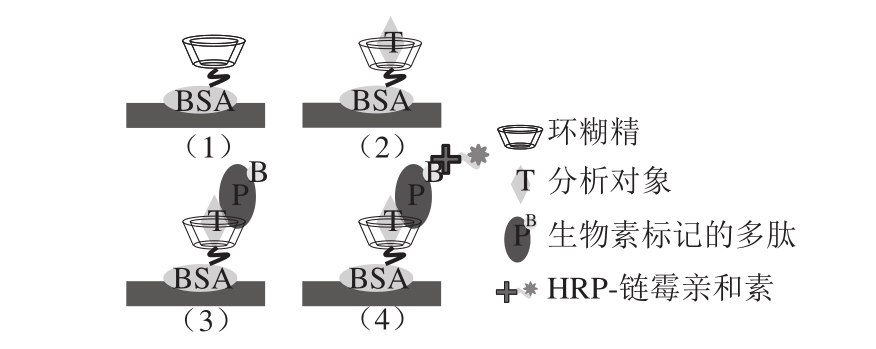
图1 环糊精和肽配体介导的毒死蜱非竞争检测模式基本原理
Fig. 1 Schematic illustration of the general principle of cyclodextrin and peptide-assisted noncompetitive assay for chlorpyrifos
贺 江,崔京珍,王伯华,雷 颂,李 娜
(湖南文理学院生命与环境科学学院,环洞庭湖水产健康养殖与加工湖南省重点实验室,湖南省水产高效健康生产协同创新中心,湖南 常德 415000)
摘 要:以毒死蜱作为对象,构建了一种由环糊精和肽配体介导的非竞争检测模式。首先利用分子模拟和光谱学方法对β-环糊精包合毒死蜱的效应进行了证实;然后将β-环糊精与牛血清蛋白进行偶联,并证实偶联状态的环糊精分子仍能包合毒死蜱;以β-环糊精-牛血清蛋白偶联产物为核心材料,从商品化的噬菌体展示线性十二肽库中筛选获得了5 个可以特异识别环糊精-毒死蜱包合物的肽配体;最后,利用亲和力最强的肽配体(8#克隆)构建毒死蜱的非竞争检测模式,该检测模式能够特异性地识别毒死蜱,而对丙溴磷、除线磷和溴硫磷等结构类似农药分子无识别。本研究所构建的检测模式无需对小分子物质进行改造和固定,可为小分子化学污染物的快速检测提供新的参考。
关键词:β-环糊精;肽配体;毒死蜱;噬菌体展示
在小分子化学污染物的快速检测领域,当前的研究热点是构建基于抗体等特异性亲和材料的免疫检测[1-2]或生物传感器[3-4],尤其是新型检测模式的开发。然而,制备针对小分子化学污染物制备亲和配体较为繁琐,需要对靶标分子进行修饰后再固定在适宜的载体蛋白上;此外,小分子化学污染物结构简单,表位单一,难以构建比竞争检测模式更具优势的非竞争检测模式[5]。国内外学者在构建重金属元素的免疫检测技术时,一般是通过制备能够特异识别金属离子-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)复合物的抗体来实现[6-9]。首先将EDTA偶联在牛血清蛋白(bull serum albumin,BSA)等载体蛋白分子上,再利用固相的EDTA螯合靶标金属离子,然后用BSA-EDTA-金属离子复合物作为免疫原进行抗体制备。其优点在于,一旦合成了BSA-EDTA,则可用其螯合任意可被螯合的金属离子,进而进行抗体制备和免疫检测方法的构建。
环糊精是由6~8 个葡萄糖分子以糖苷键结合而成的闭环低聚物,呈外亲水,内疏水的圆筒形立体结构,能以其内部空间包合脂溶性分子形成超分子复合物,而自身表现出良好的水溶性。鉴于其这一特性,环糊精已成为许多研究和应用领域的重要材料。许多学者已就环糊精在分析化学、生物医学以及其他相关领域的应用进行了系统性的评述[10-12]。受金属离子免疫检测技术构建思路的启发,结合环糊精外亲水、内疏水的特性,本实验提出一种用于小分子化学污染物免疫检测技术构建的思路:1)将环糊精分子偶联至BSA;2)用偶联物包合疏水性的小分子化学污染物;3)制备能够特异性识别包合物的亲和材料;4)构建小分子化学污染物的新型非竞争检测模式。
近年来,国内外学者利用噬菌体展示的多肽(肽配体)成功构建了多种食品安全检测技术,说明噬菌体展示多肽可作为传统抗体的有效替代物用于检测技术的构建[13-18]。此外,多种不同展示结构的噬菌体多肽库已经商品化,噬菌体展示肽筛选后易于测序和化学合成,而化学合成的多肽比原核表达的单链抗体更具稳定性,说明肽配体较传统抗体更具优势。毒死蜱是一种中等毒性的有机磷杀虫剂,能较好地防治多种作物的地上和地下害虫,成为取代高毒有机磷杀虫剂的理想药物之一。目前,毒死蜱农业生产中已有较为广泛的使用,其残留问题也日益受到关注。
本研究以β-环糊精和毒死蜱作为模式性材料,利用噬菌体展示技术从商品化的多肽库中筛选出能够特异识别β-环糊精-毒死蜱包合物的肽配体,并进一步构建毒死蜱的非竞争检测模式。
1.1 材料与试剂
毒死蜱及丙溴磷、溴硫磷、除线磷等农药标准品德国Dr. Ehrensorfer GmbH公司;β-环糊精、BSA、乙二醇二缩水甘油醚 美国Sigma公司;线性十二肽噬菌体展示库(Ph.D.-12TMPeptide Library Kit) 英国New England Biolabs公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒 碧云天生物技术研究所;HRP标记的抗M13单克隆抗体 美国GE Healthcare公司;HRP标记的链霉亲和素 美国Proteintech Group公司;多肽片段的合成与标记委托宁波康贝生物有限公司进行;其他相关试剂均为国产分析纯;实验用水由优普UPT-I-10T超纯水机制备。实验中用到的所有试剂均参照噬菌体抗体库说明书进行配制。
1.2 仪器与设备
6 孔板、96 孔板 美国康宁公司;UV-160A紫外-可见分光光度计 日本岛津公司;F-2700荧光分光光度计 日本日立公司;GC 450气相色谱仪 美国瓦里安公司;MK3酶标仪 美国热电公司。
1.3 方法
1.3.1 β-环糊精对毒死蜱包合特性的鉴定
先利用分子模拟方法对β-环糊精包合毒死蜱的过程进行计算,再利用光谱实验研究对β-环糊精包合毒死蜱作用作进一步鉴定。分子模拟计算采用AutoDock 4.0软件进行,具体操作参照文献[19-22]。光谱学实验分两部分:1)将等体积的β-环糊精溶液(浓度为0、2.5、5.0 mmol/L)与毒死蜱甲醇溶液(0.05 mmol/L)混合,室温平衡2 h,然后记录各溶液200~400 nm范围内的紫外吸收光谱;2)将等体积的β-环糊精溶液(浓度为2.5 mmol/L)或纯水与毒死蜱甲醇溶液(0.3 μmol/L)混合,室温平衡2 h,然后在激发光波长为290 nm条件下记录各溶液350~500 nm波长范围内的荧光光谱。
1.3.2 β-环糊精与BSA的偶联与鉴定
参照文献[23],以乙二醇二缩水甘油醚为交联剂将β-环糊精与BSA进行偶联,偶联效果通过SDS-PAGE进行鉴定,具体操作参照相关实验手册。设计吸附实验,对β-环糊精-BSA偶联产物上的环糊精分子包合毒死蜱的能力做进一步验证,具体过程如下:将不同质量浓度的β-环糊精-BSA偶联产物加入到6 孔板中,每孔2 mL,4 ℃包被过夜;次日,每孔加入2 mL质量浓度为0.5 mg/mL的BSA溶液,4 ℃封闭2 h;洗涤每个孔之后,每孔加入质量浓度为0.25 mg/mL的毒死蜱溶液,室温振荡孵育2 h后,将每孔中的溶液进行收集;同时再用洗涤缓冲液洗涤每个孔3 次,洗涤液与相应孔的溶液合并;采用液液萃取-气相色谱法,测定孵育后每个孔中残留的毒死蜱量(即合并液中的毒死蜱质量浓度)。
1.3.3 β-环糊精-毒死蜱复合物特异识别肽配体的筛选
采用正负交替筛选策略从噬菌体展示多肽库中筛选出能够特异结合β-环糊精-毒死蜱复合物的肽配体,以用于相应检测模式的构建。1)包被:用碳酸盐缓冲液配制质量浓度为0.5 mg/mL的β-环糊精-BSA偶联产物溶液,在6 孔细胞培养板的两孔中各加入1.5 mL该溶液,4 ℃包被过夜;次日,每孔加入2 mL封闭液,4 ℃封闭2 h。2)负筛选:将10 μL试剂盒所提供的噬菌体展示多肽库与990 μL洗涤缓冲液(0.1% TBST)混合,并加入到上述两孔中的其中一孔中(负筛选孔);同时,将一定量的农药与TBS溶液混合,并加入至另一孔中(正筛选孔);两孔同时在37 ℃、300 r/min条件下孵育2 h。3)正筛选:将正筛选孔中的样液除去,再将负筛选孔中的样液转移至正筛选孔;继续在37 ℃、300 r/min的条件下孵育一定时间后,除去样液,并用TBST溶液洗涤正筛选孔若干次。4)洗脱:于正筛选孔中加入1 mL含1 mg/mL BSA的洗脱缓冲液;37 ℃、300 r/min的条件下孵育15 min后,将样液转移至150 μL中和缓冲液中。5)滴度测定与扩增:按试剂盒说明书所述方法对中和后的洗脱液进行噬菌体滴度测定;按试剂盒说明说所述方法对洗脱的噬菌体进行扩增和滴度测定,用于下一轮筛选。
实验共进行4 轮筛选,每轮筛选的洗脱液经扩增后,用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)对其进行活性测定。1)96 孔板的每孔中加入200 μL BSA-β-环糊精(1.0 mg/mL)溶液,4 ℃包被过夜;2)倾去包被液,每孔加入200 μL封闭液,4 ℃孵育2 h;3)洗板后,一半孔中加200 μL毒死蜱溶液(0.05 μmol/L)并标记为“+”孔,另一半孔直接加入200 μL TBS缓冲液并标记为“-”孔,整个板于37 ℃振荡孵育2 h;4)洗板后,每孔加入1012PFU的噬菌体(来自于每轮洗脱液的扩增产物)并于37 ℃振荡孵育1 h;5)洗板后,每孔加入200 μL HRP标记的抗M13抗体(1∶5 000稀释)并于37 ℃振荡孵育1 h;6)按照常规ELISA,用TMB体系进行后续的显色、终止和读数操作。
1.3.4 环糊精-毒死蜱复合物特异识别肽配体的鉴定
筛选结束后,从第4轮筛选产物中分离挑选出噬菌体单克隆,并利用ELISA方法鉴定出能够特异识别β-环糊精与农药分子复合物的克隆。ELISA鉴定步骤同1.3.3节,区别在于使用的噬菌体为单个噬菌体克隆的扩增产物。分析ELISA数据,定义在“+”孔和“-”孔中的OD450nm读数比值大于2.1的噬菌体克隆为阳性克隆,即能够特异识别环糊精-毒死蜱复合物。对鉴定出的阳性克隆,按试剂盒说明书所述的步骤进行测序,并由测得的DNA序列翻译出氨基酸序列。
1.3.5 环糊精和肽配体介导的毒死蜱非竞争检测模式构建
选择活性最高的阳性克隆,对其展示的多肽片段进行化学合成并在其N-端做生物素标记,用于构建毒死蜱残留检测模式,检测模式的基本原理如图1所示。前3 步操作同ELISA鉴定的步骤1)~3);然后每孔中加入200 μL不同浓度的毒死蜱溶液,37 ℃条件下振荡孵育1 h后倾去溶液并洗涤酶标板;每孔再加入200 μL生物标记多肽溶液(0.1 μmol/L),37 ℃条件下再次振荡孵育1 h后倾去多肽溶液并洗涤酶标板;每孔再加入200 μL HRP标记的链霉亲和素(1∶5 000稀释)溶液,37 ℃振荡孵育1 h;最后按照常规ELISA,用TMB体系进行显色、终止和读数。

图1 环糊精和肽配体介导的毒死蜱非竞争检测模式基本原理
Fig. 1 Schematic illustration of the general principle of cyclodextrin and peptide-assisted noncompetitive assay for chlorpyrifos
2.1 β-环糊精对毒死蜱包合特性的鉴定结果
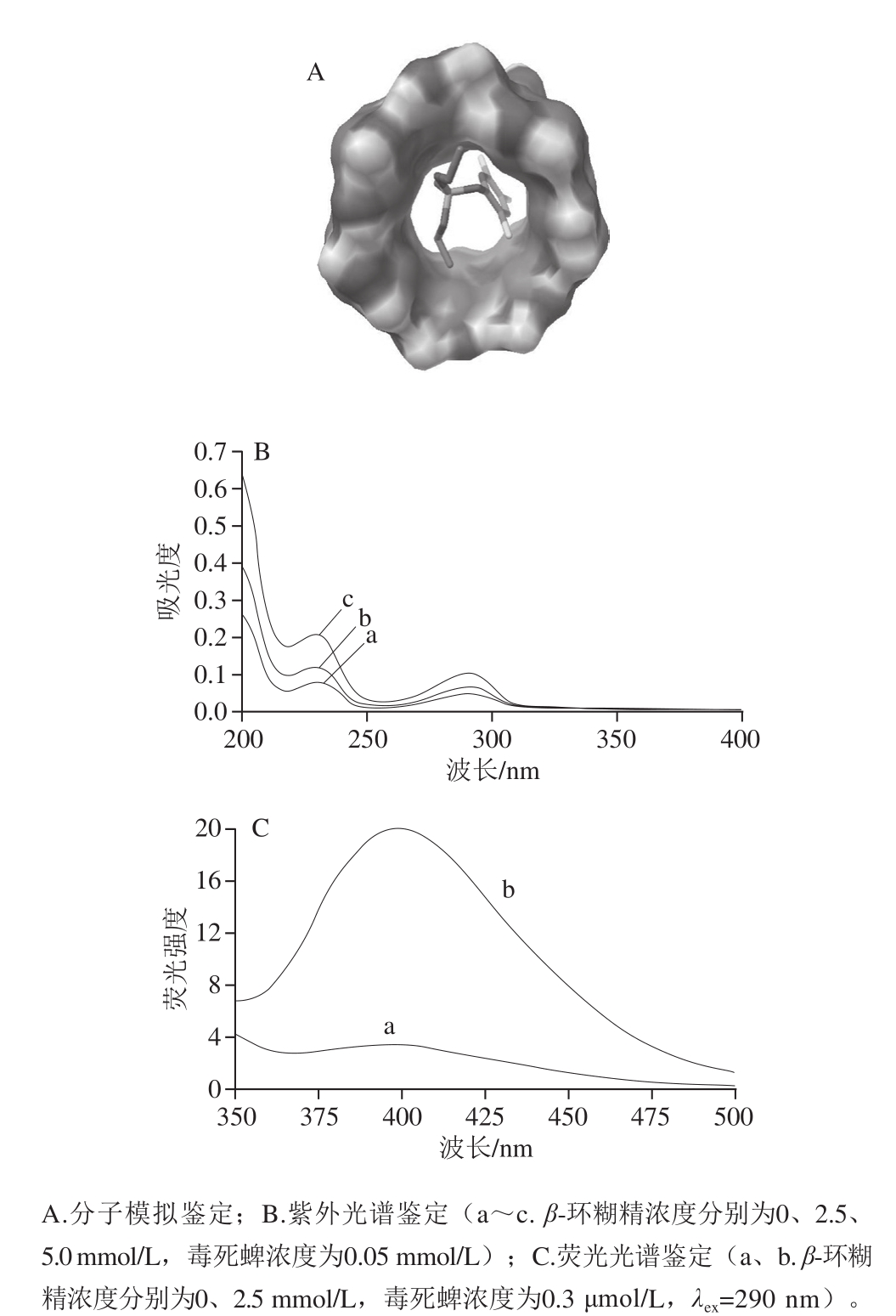
基于AutoDocking软件能量簇分析发现,毒死蜱能进入β-环糊精的空腔(图2A),结合自由能ΔGFree为-4.80 kcal/mol(N=30)。光谱鉴定结果分别如图2B、C所示,当固定客体毒死蜱浓度时,随着β-环糊精浓度的增大,整个体系的吸收峰没有明显的位移,但其最大吸收峰处的吸光度逐渐增大(图2B);当毒死蜱体系中添加一定浓度的β-环糊精时,其荧光强度显著的增大(图2C)。上述结果说明毒死蜱能够进入β-环糊精的空腔形成包合物。
2.2 β-环糊精与BSA的偶联与鉴定

图3 β-环糊精与BSA偶联效果鉴定结果
Fig. 3 Identification of BSA-β-CD conjugates
如图3a所示,偶联产物的分子质量明显大于BSA,说明环糊精分子成功偶联至BSA分子上,进一步估算表明,偶联比约为5,即每个BSA分子上约偶联有5 个环糊精分子。如图3b所示,随着微孔中β-环糊精-BSA包被浓度的增加,残留的毒死蜱浓度减小,即被包合在环糊精空腔的毒死蜱量越多。该结果进一步说明β-环糊精-BSA偶联成功,且偶联产物上的环糊精分子依然保留对毒死蜱的包合能力。
2.3 β-环糊精-毒死蜱复合物特异识别肽配体的筛选
文献资料[24-30]及前期实验研究表明,靶标分子浓度、筛选结合时间、洗涤程序等对噬菌体展示筛选结果有显著影响,本研究从第1轮到第4轮筛选,逐步降低毒死蜱的用量、减少正向筛选时间、洗涤强度逐渐增加,各轮的具体参数如表1所示。
表1 每轮筛选中正向结合与洗涤的具体参数
Table 1 Positive binding time and washing steps in each round of biopanning

每轮筛选中,投入的噬菌体数量基本一致,均约为1011PFU;同时还测定了每轮洗脱液的噬菌体滴度,即洗脱产出的噬菌体数量,结果如图4a所示。随着筛选的进行,每轮筛选的噬菌体产出/投入比逐步增加,说明噬菌体展示库在筛选中得到了有效的富集。每轮洗脱液经扩增后,采用ELISA对其进行活性测定,结果如图4b所示。从第1轮到第4轮的洗脱产物,对毒死蜱-环糊精复合物的结合活性逐步增加,说明噬菌体库的富集朝着预期目标进行。

图4 噬菌体展示肽库筛选效果
Fig. 4 Efficiency of the biopanning process
2.4 环糊精-毒死蜱复合物特异识别肽配体的鉴定


图5 环糊精-毒死蜱复合物特异识别肽配体的鉴定结果
Fig. 5 Identification of phage-displayed peptide
ELISA鉴定结果显示,共获得5 个阳性克隆(图5a),其中8#克隆的亲和力最强,17#克隆的亲和力相对最低。对5个阳性克隆的氨基酸序列进行分析表明,所有克隆均包合W(F)χχχH结构,其中χ代表任意氨基酸,因而可推测W(F)χχχH能够形成与“环糊精-毒死蜱”复合物结合的框架结构,而其他氨基酸则主要影响结合活性(图5b)。
2.5 环糊精和肽配体介导的毒死蜱非竞争检测模式构建选择亲和力最强的8#克隆,构建了毒死蜱残留检测模式,在该检测模式下,随着毒死蜱浓度的增加检测信号增强,即该模式属于一种非竞争检测模式。所建立的毒死蜱残留检测模式,能够特异的检测毒死蜱,而对丙溴磷、溴硫磷、除线磷3 种结构类似农药无识别效应,说明该检测模式具有较好的特异性(图6)。

图6 环糊精和肽配体介导的非竞争检测模式对毒死蜱及3 种结构类似农药的剂量-反应关系
Fig. 6 Dose-dependent response curves of the cyclodextrin and peptideassisted noncompetitive assay
本研究采用计算机模拟和光谱学鉴定证实了β-环糊精对毒死蜱的包合作用,并成功合成了β-环糊精-BSA偶联产物;在此基础上,进一步利用噬菌体展示技术从商品化的线性十二肽库中筛选获得了5 条能够特异识别环糊精-毒死蜱复合物的肽配体;利用亲和力较高的肽配体(8#)成功构建了一种能够对毒死蜱进行特异性检测的非竞争模式。该研究能够为食品及环境中小分子化学污染物的检测提供新的思路。
参考文献:
[1] BUMISTROVA N A, RUSANOVA T Y, YURASOY N A, et al. Multi-detection of mycotoxins by membrane based flow-through immunoassay[J]. Food Control, 2014, 46: 462-469. DOI:10.1016/ j.foodcont.2014.05.036.
[2] LIPPOLIS V, PASCALE M, VALENZANO S, et al. Fluorescence polarization immunoassay for rapid, accurate and sensitive determination of ochratoxin a in wheat[J]. Food Analytical Methods, 2014, 7(2): 298-307. DOI:10.1007/s12161-013-9627-3.
[3] SASSOLAS A, PRIETOSIMON B, MARTY J L. Biosensors for pesticide detection: new trends[J]. American Journal of Analytical Chemistry, 2012, 3(3): 210-232. DOI:10.4236/ajac.2012.33030.
[4] KARIM F, FAKHRUDDIN A N M. Recent advances in the development of biosensor for phenol: a review[J]. Reviews in Environmental Science & Biotechnology, 2012, 11(3): 261-274. DOI:10.1007/s11157-012-9268-9.
[5] FAN M T, HE J. Recent progress in noncompetitive hapten immunoassays: a review[M]//ABUELZEIN E. Trends in immunolabelled and related techniques. Croatia: In-Tech, 2012: 53-66. DOI:10.5772/36688.
[6] ABE K, NAKAMURA K, ARAO T, et al. Immunochromatography for the rapid determination of cadmium concentrations in wheat grain and eggplant[J]. Journal of the Science of Food & Agriculture, 2011, 91(8): 1392-1397. DOI:10.1002/jsfa.4321.
[7] HE H, LIU Z Y, YANG S G, et al. Preparation of anti-cadmium-EDTA complex polyclonal antibody and its application for determination of cadmium in aqueous solution[J]. Analytical Letters, 2009, 42(2): 409-424. DOI:10.1080/00032710802514832.
[8] DATE Y, TERAKADO S, SASAKI K, et al. Microfluidic heavy metal immunoassay based on absorbance measurement[J]. Biosensors & Bioelectronics, 2012, 33(1): 106-112. DOI:10.1016/ j.bios.2011.12.030.
[9] 刘艳梅, 钟辉, 向军俭. 重金属免疫学快速检测技术研究进展[J].食品科学, 2014, 35(17): 306-311. DOI:10.7506/spkx1002-6630-201417058.
[10] SZENTE L, SZEMAN J. Cyclodextrins in analytical chemistry: hostguest type molecular recognition[J]. Analytical Chemistry, 2013, 85(17): 8024-8030. DOI:10.1021/ac400639y.
[11] XING M, ZHAO Y. Biomedical applications of supramolecular systems based on host-guest interactions[J]. Chemical Reviews, 2014, 115(15): 341-352. DOI:10.1021/cr500392w.
[12] 张敏, 张宇昊, 马良. β-环糊精及其衍生物的荧光增敏作用研究进展[J].食品科学, 2011, 32(1): 297-301.
[13] GONZALEZ-TECHERA A, ZON M A, MOLINA P G, et al. Development of a highly sensitive noncompetitive electrochemical immunosensor for the detection of atrazine by phage antiimmunocomplex assay[J]. Biosensors & Bioelectronics, 2015, 64(64): 650-656. DOI:10.1016/j.bios.2014.09.046.
[14] DONG J X, CHAO X, HONG W, et al. Enhanced sensitive immunoassay: noncompetitive phage anti-immune complex assay for the determination of malachite green and leucomalachite green[J]. Journal of Agricultural & Food Chemistry, 2014, 62(34): 8752-8758. DOI:10.1021/jf5019824.
[15] KIM H J, ROSSOTTI M A, AHN K C, et al. Development of a noncompetitive phage anti-immunocomplex assay for brominated diphenyl ether 47[J]. Analytical Biochemistry, 2010, 401(1): 38-46. DOI:10.1016/j.ab.2010.01.040.
[16] CARLOMAGNO M, LASSABE G, ROSSOTTI M, et al. Recombinant streptavidin nanopeptamer anti-immunocomplex assay for noncompetitive detection of small analytes[J]. Analytical Chemistry, 2014, 86(20): 10467-10473. DOI:10.1021/ac503130v.
[17] ROSSOTTIA M A, CARLOMAGNOA M, GONZALEZ-TECHERA A, et al. Phage anti-immunocomplex assay (PHAIA) for clomazone: two-site recognition increases assay specificity and facilitates adaptation into a rapid on-site format[J]. Analytical Chemistry, 2010, 82(21): 8838-8843. DOI:10.1021/ac101476f.
[18] 胡雨欣, 何早, 陈力力, 等. 噬菌体展示技术在食源性致病菌检测中的应用[J]. 食品科学, 2015, 36(11): 236-239. DOI:10.7506/spkx1002-6630-201511044.
[19] BANIK A, GOGOI P, SAIKIA M D. Interaction of naproxen with β-cyclodextrin and its derivatives/polymer: experimental and molecular modeling studies[J]. Journal of Inclusion Phenomena, 2012, 72(3/4): 449-458. DOI:10.1007/s10847-011-0014-7.
[20] YUAN C, JIN Z, XU X. Inclusion complex of astaxanthin with hydroxypropyl-β-cyclodextrin: UV, FTIR,1H NMR and molecular modeling studies[J]. Carbohydrate Polymers, 2012, 89(2): 492-496. DOI:10.1016/j.carbpol.2012.03.033.
[21] FILIPPA M, SANCHO M I, GASULL E. Encapsulation of methyl and ethyl salicylates by β-cyclodextrin: HPLC, UV-vis and molecular modeling studies[J]. Journal of Pharmaceutical & Biomedical Analysis, 2008, 48(3): 969-973. DOI:10.1016/j.jpba.2008.06.005.
[22] PRABHU A A M, KUMAR G S S, FATIHA M, et al. Encapsulation of phenylalanine and 3,4-dihydroxyphenylalanine into β-cyclodextrin: spectral and molecular modeling studies[J]. Journal of Molecular Structure, 2015, 1079: 370-382. DOI:10.1016/j.molstruc.2014.08.045.
[23] DAI R, TANG L, LI H, et al. Synthesis and characterization of β-CD derivatized bovine serum albumin protein as chiral selector in pressurized capillary electrochromatography[J]. Journal of Applied Polymer Science, 2007, 106: 2041-2046. DOI:10.1002/app.26918.
[24] EDUPUGANTI S R, EDUPUGANTI O P, O’KENNEDY R. Generation of anti-zearalenone scFv and its incorporation into surface plasmon resonance-based assay for the detection of zearalenone in sorghum[J]. Food Control, 2013, 34(2): 668-674. DOI:10.1016/ j.foodcont.2013.06.013.
[25] INUI H, TAKEUCHI T, UESUGI A, et al. Enzyme-linked immunosorbent assay with monoclonal and single-chain variable fragment antibodies selective to coplanar polychlorinated biphenyls[J]. Journal of Agricultural & Food Chemistry, 2012, 60(7): 1605-1612. DOI:10.1021/jf203585b.
[26] 贺江, 梁颖, 樊明涛, 等. 噬菌体展示技术制备甲氧基有机磷农药抗独特型抗体[J]. 分析化学, 2011, 39(2): 178-182. DOI:10.3724/ SP.J.1096.2011.00178.
[27] RANGNOI K, JARUSERANEE N, O’KENNEDY R, et al. One-step detection of aflatoxin-B1, using scFv-alkaline phosphatase-fusion selected from human phage display antibody library[J]. Molecular Biotechnology, 2011, 49(3): 240-249. DOI:10.1007/s12033-011-9398-2.
[28] WEN S, ZHANG X, LIU Y, et al. Selection of a single chain variable fragment antibody against ivermectin from a phage displayed library[J]. Journal of Agricultural & Food Chemistry, 2010, 58(9): 5387-5391. DOI:10.1021/jf904562x.
[29] 屈玮, 袁静静, 朱威东, 等. 噬菌体展示技术筛选可特异结合阪崎肠杆菌的多肽[J]. 食品科学, 2013, 34(21): 217-220. DOI:10.7506/ spkx1002-6630-201321044.
[30] TAN Y, TIAN T, LIU W, et al. Advance in phage display technology for bioanalysis[J]. Biotechnology Journal, 2016, 11(6): 732. DOI:10.1002/biot.201500458.
Cyclodextrin and Peptide Ligand-Assisted Noncompetitive Detection of Chlorpyrifos
HE Jiang, CUI Jingzhen, WANG Bohua, LEI Song, LI Na
(Key Laboratory of Health Aquaculture and Product Processing in Dongting Lake Area of Hunan Province, Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province, College of Life and Environmental Sciences, Hunan University of Arts and Science, Changde 415000, China)
Abstract:In this work, a cyclodextrin and peptide ligand-assisted noncompetitive detection model was developed using chlorpyrifos (CPF) as typical target. The possibility of CPF encapsulated by β-cyclodextrin (β-CD) was first confirmed through the use of molecular modeling and UV and fluorescence spectroscopy. Then, bovine serum albumin (BSA)-β-CD conjugate, which was still able to include CPF, was synthesized and five positive peptide ligands specifically bound to the CPF:β-CD inclusion complexes rather other β-CD were screened from a commercialized phage-display liner dodecapeptide library. At last, a noncompetitive detection model was developed using BSA-β-CD conjugate and the most active peptide (Clone 8). The developed detection model could specially detect CPF, but not profenofos, dichlofenthion, or bromophos without the need for the modification and immobilization of the target small molecules, thereby providing an alternative method for the rapid detection of small molecules.
Key words:β-cyclodextrin; peptide; chlorpyrifos; phage display
DOI:10.7506/spkx1002-6630-201716034
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2017)16-0216-06
引文格式:
贺江, 崔京珍, 王伯华, 等. 环糊精及肽配体介导的毒死蜱非竞争检测模式[J]. 食品科学, 2017, 38(16): 216-221. DOI:10.7506/spkx1002-6630-201716034. http://www.spkx.net.cn
HE Jiang, CUI Jingzhen, WANG Bohua, et al. Cyclodextrin and peptide ligand-assisted noncompetitive detection of chlorpyrifos[J]. Food Science, 2017, 38(16): 216-221. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201716034. http://www.spkx.net.cn
收稿日期:2016-08-15
基金项目:国家自然科学基金青年科学基金项目(31401583);湖南省常德市联合基金项目(2015JJ5008)
作者简介:贺江(1983—),男,副教授,博士,研究方向为食品安全与食品生物技术。E-mail:hejiang1119@163.com