表1 不同pH值缓冲液对检测效果的影响
Table 1 Effect of different pH buffers on the detection

范 维,高晓月,李贺楠,李莹莹,郭文萍,陈淑敏*
(中国肉类食品综合研究中心,北京食品科学研究院,北京 100068)
摘 要:建立一种采用高通量微生物显色法对动物源性食品中抗生素残留进行筛检,再结合高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法对阳性样品进行复测的分析检验方法。本方法利用嗜热脂肪芽孢杆菌(Bacillus sterothermophilus)作为指示菌,制备96 微孔板,可同时对不同类别多种抗生素进行联合检测。结果表明:该微生物显色法操作简便、快捷,成本低,结果准确且易判断,选取pH 7.4磷酸盐缓冲液进行提取,以反应液150 μL、菌液50 μL(初始OD600nm为0.4左右)、样品提取液100 μL作为检测体系,检测效果最佳,对动物源性食品中氨基糖苷类检出限为60 μg/kg,β-内酰胺类检出限为20~40 μg/kg,大环内酯类检出限为60~80 μg/kg,四环素类检出限为40~60 μg/kg,符合国内外对抗生素残留限量的要求。对60 份动物源性样品进行检测,其结果与HPLC-MS/MS复测结果一致,说明该微生物法稳定性良好,可用于动物源性食品中抗生素残留的初筛检测。
关键词:高通量微生物显色法;抗生素残留;高效液相色谱-串联质谱;动物源性食品
Abstract: A new rapid and high-throughput microbial chromogenic assay was developed to analyze antibiotic residues in animal-derived food samples. The positive samples were further confirmed by high performance liquid chromatographytandem mass spectrometry (HPLC-MS/MS) method. Bacillus sterothermophilus was used as an indicator strain to produce a 96-well microplate for detecting a variety of antibiotics simultaneously. The results showed that the microbial assay was simple and cheap, and gave easy-to-interpret results. After extraction with phosphate buffer at pH 7.4, muscle samples were detected using a chromogenic assay system consisting of the reactant solution (150 μL), bacterial suspension (50 μL) with an initial optimal density (OD600nm) of around 0.4, and the sample extract (100 μL). The limits of detection (LODs) of aminoglycosides, beta-lactam, macrolide, and tetracyclines antibiotics were 60, 20–40, 60–80, and 40–60 μg/kg, respectively, which reached the requirements for the determination of antibiotic residue levels in the country and abroad. Consistent results were obtained in examining antibiotic residue in 60 animal-derived food samples using the microbial chromogenic assay and HPLC-MS/MS, indicating that the proposed assay could be used to detect antibiotic residues in animal-derived food samples with reliable results.
Key words: high-throughput microbial chromogenic assay; antibiotic residues; high performance liquid chromatographytandem mass spectrometry (HPLC-MS/MS); animal-derived food
DOI:10.7506/spkx1002-6630-201716038
中图分类号:TS251.7 文献标志码:A 文章编号:1002-6630(2017)16-0239-06
抗生素在畜禽集约化生产中起着预防和治疗疾病等作用,但滥用这些抗生素会使其通过动物体自身转移、富集进入人类食物链,最终导致人体产生抗药性,影响疾病治疗与康复[1-4]。当前,我国抗生素滥用情况依然存在且形势严峻[5]。2015年10月1日起施行的《食品安全法》中规定:食品安全监管环节,应采用国家规定的快速检测方法对食品农产品进行抽查。这说明高通量、快速的检测方法将成为未来检测发展趋势。目前,抗生素残留检测方法主要有色谱法[6]、微生物检测法[7-8]和免疫分析法[9]等,其中色谱法较为常用,可以进行定性定量检测,结果灵敏准确,但设备投入大,人员技能要求高,适合于大型综合性实验室进行仲裁判定和确证[10-11];免疫分析法虽灵敏度高,但是检测成本昂贵,只能检测单一抗生素[12],不易于推广;相较于前两种方法微生物法由于成本低廉、操作简单、具有广谱性,可作为一种高通量抗生素初筛方法应用在农产品安全监管环节,并在中小型企业得到普及。
目前,我国微生物显色法多用于牛奶中抗生素残留的检测,用此法在禽畜肉中检测抗生素残留的研究较少。因此,本实验开发出一种可检测动物源性食品中抗生素残留的高通量快速微生物显色方法,可同时对常见的4大类抗生素进行联合检测,并可根据具体需要进行色谱法复测,使结果更加准确可靠。
1.1 材料与培养基
1.1.1 菌种与样品
嗜热脂肪芽孢杆菌(Bacillus sterothermophilus)(CICC 10392) 中国工业微生物菌种保藏管理中心;实验采用的禽畜肉购自农贸批发市场。
1.1.2 试剂
氨基糖苷类:丁胺卡那霉素、双氢链霉素;大环内酯类:红霉素、罗红霉素;四环素类:四环素、土霉素、金霉素;β-内酰胺类:阿莫西林、水合氨苄青霉素、青霉素G、乙氧萘青霉素和双氯青霉素标准品德国Dr. Ehrenstorfer公司;蛋白胨、胰蛋白胨、酵母粉、牛肉粉、葡萄糖、琼脂、营养肉汤、营养琼脂、溴甲酚紫 北京陆桥技术有限责任公司;其他试剂均为色谱纯或分析纯。
抗生素标准储备液:将氨基糖苷类和β-内酰胺类各抗生素标准品分别用去离子水溶解并定容至100 μg/mL,-20 ℃避光可保存1 个月;将大环内酯类和四环素类各抗生素标品分别用甲醇溶解并定容至100 μg/mL,-18 ℃避光可保存12 个月以上。
磷酸钠缓冲溶液:A液,称取72 g Na2HPO4·12H2O,用去离子水定容至1 000 mL。B液,称取31 g NaH2PO4·2H2O,用去离子水定容至1 000 mL。pH 6.8:A液49.5 mL和B液50.0 mL进行混合;pH 7.0:取A液61.0 mL和B液39.0 mL进行混合;pH 7.4:取A液81 mL和B液19 mL进行混合;pH 8.0:取A液94.7 mL和B液5.3 mL进行混合。
1.1.3 培养基
固体培养基:蛋白胨10.0 g,牛肉膏3.0 g,NaCl 5.0 g,琼脂15.0 g溶于1 000 mL蒸馏水中,用NaOH溶液调pH 7.3,121 ℃高压灭菌15 min。
液体培养基:胰蛋白胨10.0 g,葡萄糖2.0 g,牛心粉5.0 g,NaCl 5.0 g,蒸馏水1 000 mL,用Na2HPO4·12H2O溶液调pH 7.4,121 ℃高压灭菌15 min。
检测液:蛋白胨10.0 g,牛肉浸膏3.0 g,葡萄糖10.0 g,NaCl 5.0 g,溴甲酚紫指示剂0.04 g,蒸馏水定容至1 000 mL,pH 7.0,121 ℃高压灭菌15 min。
1.2 仪器与设备
SYNERGY H4酶标仪 美国伯腾仪器有限公司;DHP-9272恒温培养箱 上海一恒科学仪器有限公司;UltiMate3000-TSQ QUANTUM ULTRA高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)联用仪(配有电喷雾离子源) 美国Thermo公司;Series 1200-Technologies 6410 HPLC-MS/MS联用仪(配有电喷雾离子源)、1260 HPLC仪(配有可变波长紫外检测器) 美国安捷伦公司;SCR20BA离心机 日本日立仪器有限公司;PHS-3C pH计 上海雷韵仪器有限公司。
1.3 方法
1.3.1 样品预处理
1.3.1.1 微生物显色法
称取4 份均质好的10 g鲜肉样品置于50 mL离心管中,分别加入10 mL pH值为6.8、7.0、7.4、8.0的磷酸钠缓冲溶液,旋涡1 min,密封置100 ℃沸水浴中加热5 min,10 000 r/min离心3 min,取上清液用于微生物检测。
1.3.1.2 色谱法
大环内酯类测定:样品参照SN/T 1777.2—2007《动物源性食品中大环内酯类抗生素残留测定方法》[13]进行前处理;四环素类测定:样品参照GB/T 21317—2007《动物源性食品中四环素类兽药残留量检测方法》[14]进行前处理;β-内酰胺类测定:样品参照SN/T 2050—2008《进出口动物源食品中14 种β-内酰胺类抗生素残留量检测方法》[15]进行前处理;氨基糖苷类测定:样品参照GB/T 21323—2007《动物组织中氨基糖苷类药物残留量的测定》[16]进行前处理。
1.3.2 微生物显色法检测
1.3.2.1 微生物初始浓度及检测体系组成比例的确定
无菌状态下,从固体培养基上挑取已培养24 h的细菌菌落,接入液体培养基中,分别配成光密度值(OD600nm)为0.1、0.4、0.6、0.8、1.0的菌悬液。取96 孔板,将各菌悬液分别加入到以下3 组体系中,检测液体积、菌悬液体积、生理盐水,A组体积分别为180、20、100 μL;B组体积分别为150、50、100 μL;C组体积分别为100、100、100 μL。于60 ℃恒温箱中培养,确定各组变色(反应液由紫变黄)时间。将变色时间较短的组合中生理盐水换成0.1 μg/mL罗红霉素标准溶液,于60 ℃恒温培养,观察变色情况,选出结果呈阳性组(检测液紫色为阳性,黄色为阴性),最终优化出最适微生物初始浓度和检测体系组成比例。
1.3.2.2 微生物显色法检测程序
取96 孔板,按1.3.2.1节优化的比例,在第1列只加入检测液,在2~12列加入检测液和菌悬液,之后在第2列加入无抗生素的鲜肉提取液,在3~12列加入不同抗生素标准液或样品提取液,于60 ℃恒温培养至第2列变成黄色,观察其他列颜色变化。
1.3.2.3 微生物显色法检出限的确定
用去离子水将12 种抗生素标准储备液分别稀释成0.02、0.04、0.06、0.08、0.1 μg/mL共5 个梯度,以注射的方式加入到无抗生素鲜肉中,使其充分吸收。按上述微生物法进行检测,确定各种抗生素的检出限。
1.3.2.4 指示菌传代稳定性的确定
将嗜热脂肪芽孢杆菌连续传代至第5代,用各代菌对双氢链霉素、阿莫西林、罗红霉素和四环素的检出限进行测定,并确定反应时间,以此判断指示菌的传代稳定性。
1.3.3 色谱法检测
大环内酯类,参照SN/T 1777.2—2007[13]方法,运用Series 1200-Technologies 6410型HPLC-MS/MS进行检测;四环素类和氨基糖苷类,分别参照GB/T 21317—2007[14]和GB/T 21323—2007[16]方法,运用UltiMate3000-TSQ QUANTUM ULTRA HPLC-MS/MS进行检测;β-内酰胺类,运用HPLC法进行测定,参照GB 29682—2013[17]和SN/T 2050—2008[16]方法。
1.3.4 色谱法标准曲线及检出限的确定
用超纯水将各类抗生素标准溶液逐级稀释,对应1.3.3节色谱条件进行测定,以质量浓度(μg/L)为横坐标、峰面积为纵坐标绘制标准曲线,并以3 倍信噪比(RSN=3)确定其检出限。
1.3.5 样品测定
从不同市场分别购进鲜猪肉20 份、牛肉10 份、羊肉10 份、禽肉20 份,共计60 份,分别用序号1~60标识,用微生物法和色谱法同时对60 份样品中这4 类、12 种抗生素进行测定。
2.1 微生物法提取缓冲液pH值的确定
本实验所用指示剂为溴甲酚紫,其变色范围是pH 6.8(紫色)~5.6(黄色),而市售鲜肉的pH值一般在6.6~5.8之间,肉汁本身酸碱性对检测液变色效果影响较大。实验选取不同pH值的磷酸盐缓冲液对样品进行前处理,结果见表1。从表1可以看出,当缓冲液pH值小于7.4时,鲜肉提取液加入到检测体系中,会使检测液瞬间变黄;缓冲液pH值较高时,则会延长反应时间。因此,选取pH 7.4的磷酸盐缓冲溶液对样品中的抗生素进行提取。
表1 不同pH值缓冲液对检测效果的影响
Table 1 Effect of different pH buffers on the detection

2.2 微生物初始浓度及检测体系的确定
用生理盐水作为样品提取液按比例加入到检测体系中,确定菌悬液浓度和检测体系组成比例对反应时间的影响,结果如表2所示。当菌悬液初始吸光度不小于0.4时,B、C两组反应时间较短,均能在4 h内变色,因此用这两组进行抗生素敏感度实验,结果如表3所示。
表2 菌悬液初始浓度及检测体系组成比例对反应时间的影响
Table 2 Effects of initial concentration of bacterial suspension and reaction mixture composition on response time min
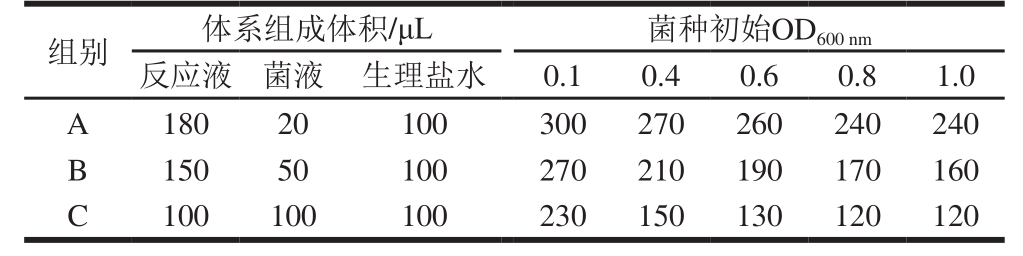
表3 菌悬液初始浓度及检测体系组成比例对抗生素敏感度的影响
Table 3 Effects of initial concentration of bacterial suspension and reaction mixture composition on the sensitivity for antibiotics
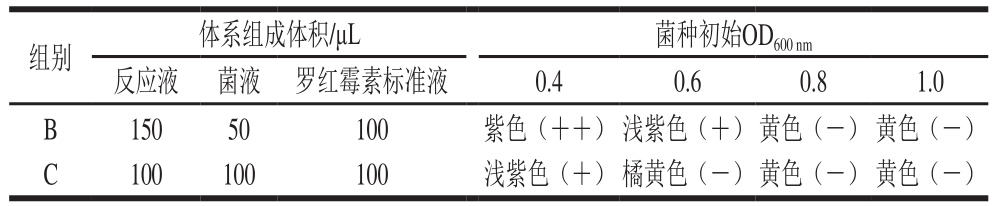
注:++.抗生素对菌强抑制;+.对菌抑制;-.对菌无抑制作用。
从表3可以看出,菌悬液初始OD600nm较高或加入菌悬液体积较大时,抗生素对菌的抑制效果不明显,反应液变为黄色,达不到检测目的,因此选择0.4作为菌悬液初始OD600nm,反应液150 μL、菌液50 μL、样品提取液100 μL作为检测体系。该法比传统平板法省时省力,采用指示剂显色作为判别标准也比抑菌圈更易于观察,满足快速检测的要求。
2.3 微生物显色法的检出限检测结果
表4 12 种抗生素的检出限量
Table 4 Limits of detection of 12 antibiotic μg/kg

按1.3.2.3节方法进行检测,以颜色未发生变化的标准液浓度为该抗生素的最小检测浓度,结果见表4。本方法各类抗生素的检出限均小于我国农业部规定的动物性食品中兽药最高残留限量[18],虽然检出的阴性样品中可能含有抗生素,但其含量低于最高残留限量,依然是合格产品,说明该法可以满足初筛检测的要求。其中对β-内酰胺类和四环素类抗生素较为敏感,检出限为20~40、40~60 μg/kg,这与刘冬梅等[19]研究的对牛奶中抗生素残留检测结果相似。
2.4 指示菌传代稳定性
表5 指示菌传代稳定性
Table 5 Genetic stability of indicator bacterium during passage

分别用5 代嗜热脂肪芽孢杆菌进行各类抗生素检出限和反应时间的测定,结果如表5所示。对于同一种抗生素,各代菌测定的检出限相同,说明前5 代菌对抗生素的敏感程度一致。从反应时间来看,第1代菌所需反应时间略长,后几代菌的反应时间趋于稳定,5 代菌均能在3~4 h内使指示剂变色。因此,前5 代菌具有较好的稳定性,均可以用于微生物显色法检测。
2.5 色谱法的检出限检测结果
将不同质量浓度的抗生素标准溶液分别在1.3.1.2节色谱条件下进行测定,12 种抗生素的质量浓度在50~200 μg/L的范围内,与其峰面积呈良好线性关系(R2>0.991),满足定量要求,其标准品色谱图见图1,检出限结果如表4所示。色谱法灵敏度较高,其检出限远小于国家规定的抗生素最大残留限量,这就导致一些含有极少抗生素的合格样品被检测出来,造成时间和成本的浪费。相较于色谱法,微生物显色法的检出限更接近最大残留限量,因此用微生物法初筛呈阳性的样品更有可能是不合格样品,之后将这些阳性样品用色谱法进行复测,可以节约时间和成本。并且有时企业并不需要太精准的数值,只想知道购入的原料肉中抗生素残留是否合格,因此太灵敏的检测过于浪费。
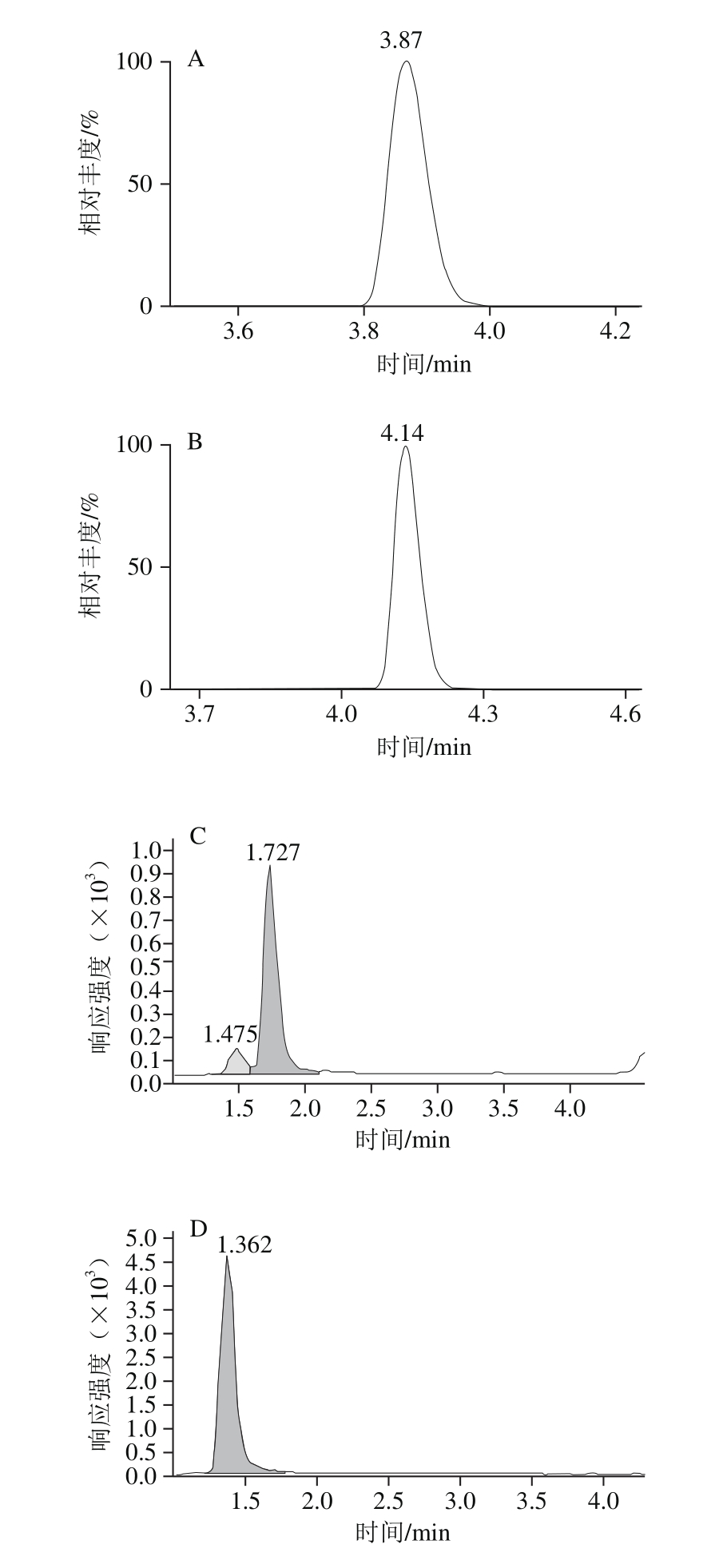
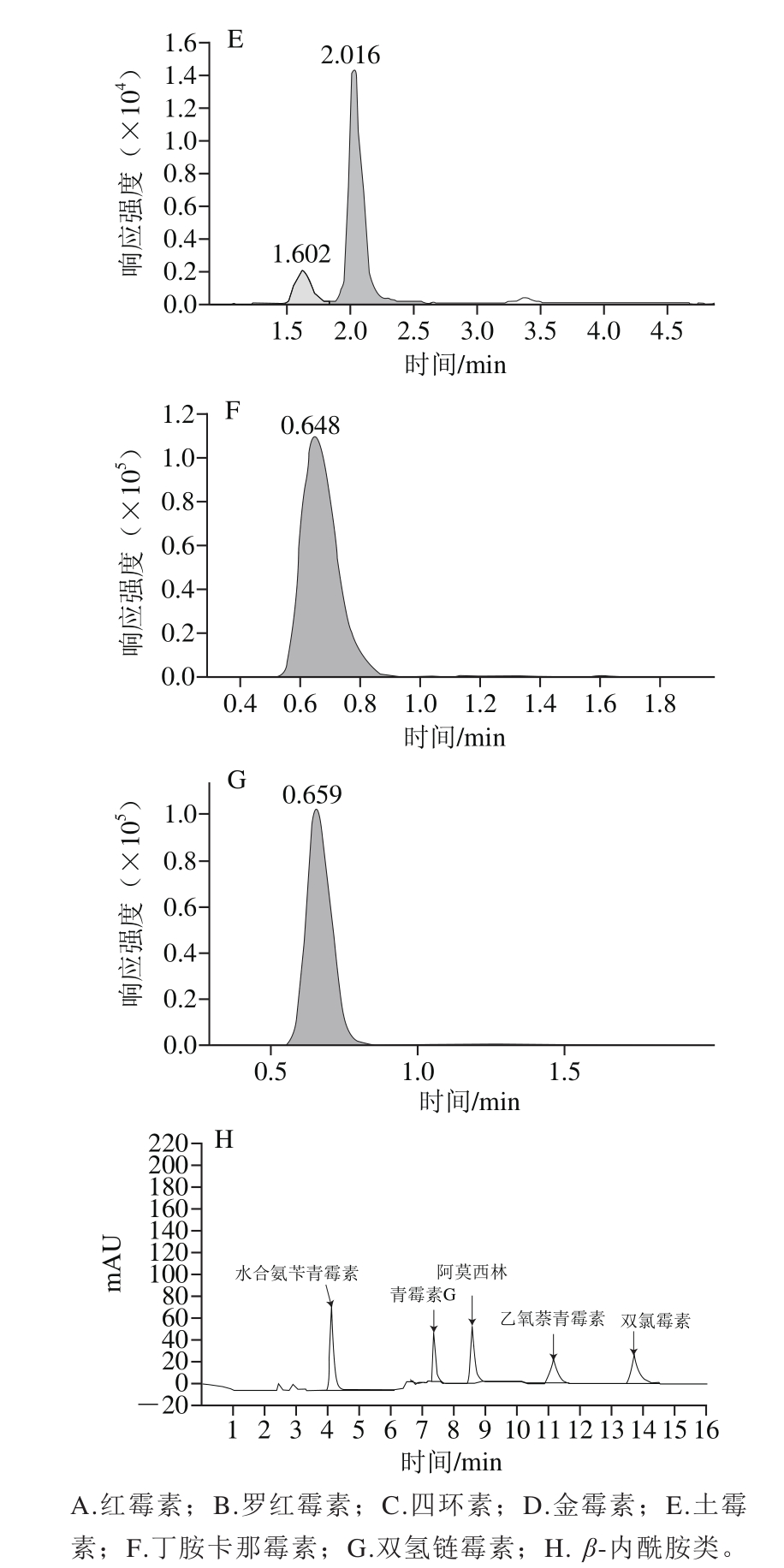
图1 12 种抗生素色谱图
Fig. 1 Chromatograms of 12 antibiotics
2.6 样品测定结果
从不同市场共购得鲜肉样品60 个,经过微生物法检测,共有14 个样品成阳性,见表6。将14个阳性样品用色谱法进行复测,共有8 个样品测出含有以上抗生素残留,包括2 个含四环素样品、1 个含金霉素样品、2 个含土霉素样品、1 个含红霉素样品、1 个含阿莫西林样品、1 个含双氢链霉素样品,而其他6 个样品没有检出这12 种抗生素,存在着含有其他抗生素残留的可能。在微生物法下呈阴性的46 个样品中,这12 种抗生素均未被检出。由表6可知,2号、9号和15号样品中四环素和金霉素残留量分别为204、118、187 μg/kg,55号样品中红霉素残留量为212 μg/kg,均超过我国农业部规定的抗生素残留最大限量。目前养殖业使用的抗生素种类繁多,这使肉类产品中抗生素残留的检测变得很难。色谱法虽灵敏精确,但不同种类抗生素检测前处理方法及检测程序均不相同,很难做到高通量,且前处理方法复杂费时[20];免疫法亦是如此,只能针对一种或几种的抗生素,无法判别是否有其他抗生素残留存在,而且试剂盒的价格较高[21]。而微生物法对于不同种类抗生素的前处理方式和检测方法均相同,且操作简单,据研究[22-23]嗜热脂肪芽孢杆菌除对以上4 类抗生素敏感外,对磺胺类、酰胺醇类及糖肽类药物也有较高的敏感性,可真正做到高通量检测。
表6 微生物法与色谱法样品检测结果
Table 6 Results obtained from the detection of antibiotics by microbial microbial chromogenic assay and HPLC-MS/MS
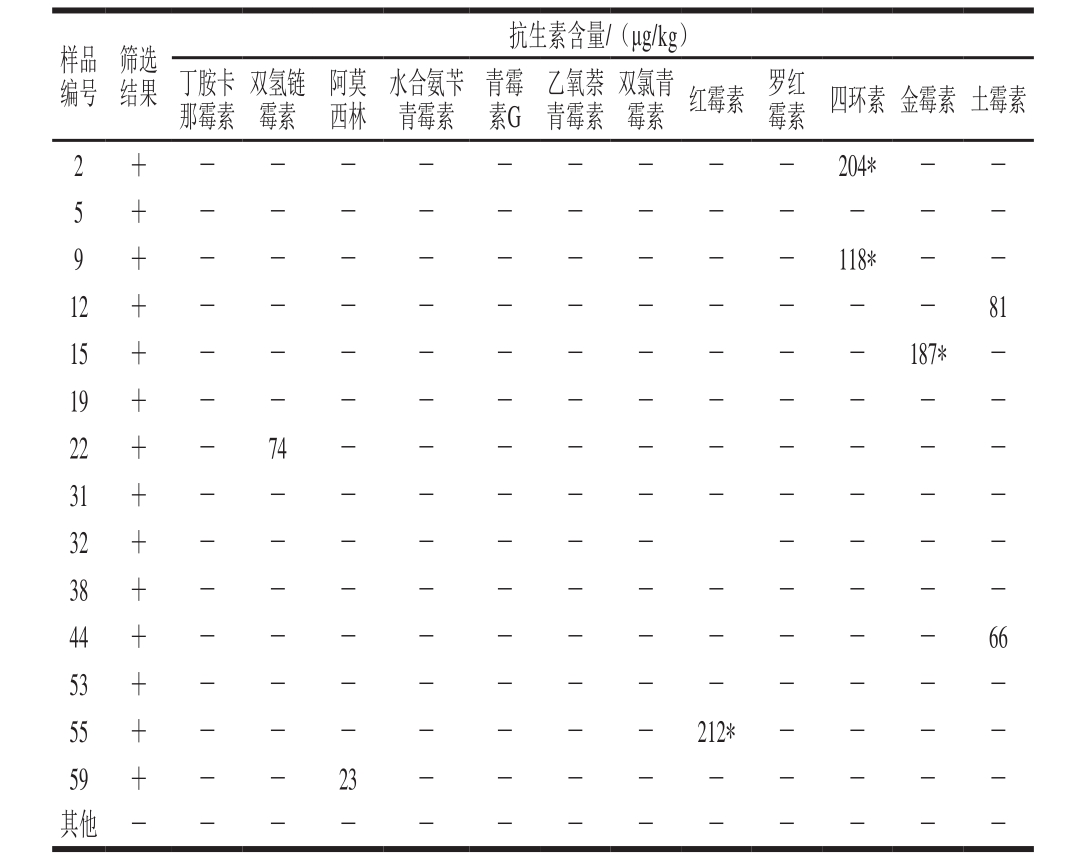
注:+.微生物显色法呈阳性;-.色谱法未测出抗生素残留;*.抗生素残留量超标。
本研究选用的嗜热脂肪芽孢杆菌具有较高广谱性,不仅对多类抗生素敏感,且产酸迅速,是一种理想的高通量抗生素快速检测菌[24-25]。菌种经24 h活化后,按本实验优化的初始浓度及检测体系进行实验,可在3~4 h内使指示剂变色,且样品前处理简便,10 min内即可完成,较传统平板法省时省力[26]。研究所用指示剂为溴甲酚紫,颜色变化明显,易用肉眼区分[27-28]。当样品中没有抗生素残留或残留量低于检出限时,嗜热脂肪芽孢杆菌在60 ℃快速生长产酸,使检测液pH值下降,指示剂由紫色变为黄色。反之,若抗生素残留质量浓度高于检出限,则会抑制检测菌的生长,使得检测液pH值基本不变,指试剂不会变色[29-30]。该方法采用96 微孔板,除去空白对照列,还有80多个孔可以用于样品检测,即便采用4 次重复,仍然可以同时对20 个样品进行检测,做到对不同样品、不同抗生素的高通量检测。
用色谱法对微生物法筛检出的46 个阴性样品进行检测,12 种抗生素均未被检出,说明本实验建立的微生物显色法结果可靠,没有假阴性。因此可以采用微生物显色法进行筛检,再以色谱法对呈阳性的样品进行检测,以便减少工作量和提高检测效率,这将在普通的检测实验室具有良好的应用前景。
参考文献:
[1] 张成虎. 动物性食品中兽药残留的危害及监控对策[J]. 甘肃农业, 2003(11): 50. DOI:10.3969/j.issn.1673-9019.2003.11.037.
[2] 李凯年, 姜荃. 严格控制药物残留确保动物性食品安全[J]. 山东饲料, 2004, 13(1): 13-16.
[3] WALDRON T T. IDEXX SNAP beta-lactam ST validation for penicillin G detection[J]. Journal of AOAC International, 2013, 96(6): 1343-1349.
[4] 刘晓冬, 林洪, 江洁. 动物源性食品中氨基糖苷类抗生素检测技术的研究[J]. 安徽农业科学, 2010, 38(8): 4128-4132. DOI:10.13989/ j.cnki.0517-6611.2010.08.13.
[5] 马丽苹, 纠敏, 秦萃丽, 等. 微生物抑制法检测牛乳中青霉素类药物残留的研究[J]. 现代食品科技, 2013, 29(1): 193-196.
[6] 农以宁, 蔡江帆, 蒙肇云, 等. SPE-HPLC法同时测定猪肉中常见抗生素和克伦特罗的研究[J]. 桂林电子科技大学学报, 2009, 29(5): 406-409. DOI:10.3969/j.issn.1673-808X.2009.05.009.
[7] PIKKEMAAT M G, DIJK S O, SCHOUTEN J, et al. A new microbial screening method for the detection of antimicrobial residues in slaughter animals: the Nouws antibiotic test (NAT-screening)[J]. Food Additives & Contaminants, 2008, 19(3): 781-789. DOI:10.1080/19440 049.2010.535027.
[8] PIKKEMAAT M G. Microbial screening methods for detection of antibiotic residues in slaughter animals[J]. Analytical Bioanalytical Chemistry, 2009, 395(5): 893-905. DOI:10.1080/1944 0049.2010.535027.
[9] 沈建忠. 动物性食品中磺胺类药物残留检测酶联免疫吸附法: 农业部1025号公告—2008[S]. 北京: 中国标准出版社, 2008.
[10] 卢坤, 童群义. 动物源性食品中抗生素残留检测技术研究进展[J]. 广州化工, 2015, 43(12): 13-14. DOI:10.3969/ j.issn.1001-9677.2015.12.006.
[11] PENG Y, HUANG Y C, CAI Y M. Screening for Streptomyces hygroscopicus strains with high production of agricultural antibiotics by streptomycin resistance[J]. Agricultural Science & Technology, 2008, 9(1): 146-149.
[12] ZHANG Y, LU S X, LIU W, et al. Preparation of anti-tetracycline antibodies and development of an indirect heterologous competitive enzyme-linked immunosorbent assay to detect residues of tetracycline in milk[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 211-218. DOI:10.1021/jf062627s.
[13] 林维宣. 动物源性食品中大环内酯类抗生素残留测定方法: SN/T 1777.2—2007[S]. 北京: 中国标准出版社, 2007.
[14] 国家标准化管理委员会. 动物源性食品中四环素类兽药残留量检测方法: GB/T 21317—2007[S]. 北京: 中国标准出版社, 2007.
[15] 林维宣. 进出口动物源食品中14 种β-内酰胺类抗生素残留量检测方法: SN/T 2050—2008[S]. 北京: 中国标准出版社, 2008.
[16] 黄志强. 动物组织中氨基糖苷类药物残留量的测定: GB/T 21323—2007[S]. 北京: 中国标准出版社, 2007.
[17] 农业部. 水产品中青霉素类药物多残留的测定: GB 29682—2013[S]. 北京: 中国标准出版社, 2013.
[18] 农业部. 动物性食品中兽药最高残留限量: 235号公告[S]. 北京: 中国标准出版社, 2002.
[19] 刘冬梅, 郭均, 梁洁英, 等. 牛奶中β-内酰胺类抗生素残留检测试剂盒的研制[J]. 现代食品科技, 2014, 30(10): 251-253.
[20] 孙兴权, 李哲, 林维宣. 动物源性食品中多肽类抗生素残留检测技术研究进展[J]. 中国食品卫生杂志, 2008, 20(3): 264-266. DOI:10.13590/j.cjfh.2008.03.018.
[21] 张亚丽, 哈婧, 赵静, 等. 动物组织中抗生素残留研究进展[J].河北科技大学学报, 2013, 32(6): 517-520. DOI:10.7535/ hbkd.2013yx06004.
[22] RENATA Z, JOANA S. An evaluation of different microbial and rapid tests for determining inhibitors in milk[J]. Food Control, 2007, 18(2): 541-547.
[23] HORIE M, TAKEGAMI H, TOYA K, et al. Determination of macrolide antibiot in meat and fish by liquid chromatographyelectrospray mass spectrometry[J]. Analytica Chimica Acta, 2003, 4(2): 187-197.
[24] 杨起恒, 李红. 嗜热脂肪芽孢杆菌检测牛奶中抗生素残留的研究[J].中国乳品工业, 2008, 36(3): 51-53.
[25] 叶健强, 严玉宝, 余华, 等. 我国进出口动物性产品兽药残留、检测的现状与对策[J]. 湖北农业科学, 2011, 50(14): 2924-2926.
[26] 徐品. 动物源性食品中抗生素残留微生物学检测的方法与进展[J].职业与健康, 2010, 26(9): 1057-1058.
[27] RENATA Z, JOANA S. An evaluation of different microbial and rapid tests for determining inhibitors in milk[J]. Food Control, 2007, 18(25): 541-547.
[28] 刘兴泉, 冯震, 姚蕾, 等. 采用高通量微生物法检测四种抗生素在鸡蛋中的残留[J]. 现代食品科技, 2011, 27(4): 465-467. DOI:10.13982/ j.mfst.1673-9078.2011.04.004.
[29] 张可煜, 王大菊, 袁宗辉, 等. 猪和鸡可食性组织中氨苄青霉素残留的微生物学检测法[J]. 中国兽医学报, 2004, 24(5): 470-472.
[30] 白国涛, 储晓刚, 潘国卿, 等. β-内酰胺类抗生素残留检测技术研究进展[J]. 食品科学, 2008, 29(7): 485-489. DOI:10.3321/ j.issn:1002-6630.2008.07.110.
Rapid and High-Throughput Detection of Antibiotic Residues in Animal-Derived Food Samples by Microbial Chromotest
FAN Wei, GAO Xiaoyue, LI Henan, LI Yingying, GUO Wenping, CHEN Shumin*
(China Meat Research Center, Beijing Academy of Food Science, Beijing 100068, China)
引文格式:
范维, 高晓月, 李贺楠, 等. 高通量微生物显色法快速检测动物源性食品中抗生素残留[J]. 食品科学, 2017, 38(16): 239-244. DOI:10.7506/spkx1002-6630-201716038. http://www.spkx.net.cn
FAN Wei, GAO Xiaoyue, LI Henan, et al. Rapid and high-throughput detection of antibiotic residues in animal-derived food samples by microbial chromotest[J]. Food Science, 2017, 38(16): 239-244. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201716038. http://www.spkx.net.cn
收稿日期:2016-09-13
基金项目:“十二五”国家科技支撑计划项目(2014BAD04B05)
作者简介:范维(1989—),女,助理工程师,硕士,研究方向为食品科学与工程。E-mail:fw837093515@163.com *通信作者:陈淑敏(1963—),女,高级工程师,本科,研究方向为食品安全。E-mail:13681032924@163.com