表1 6 种真菌毒素多反应监测模式参数
Table 1 Mass spectrometric parameters for detection of the six mycotoxins
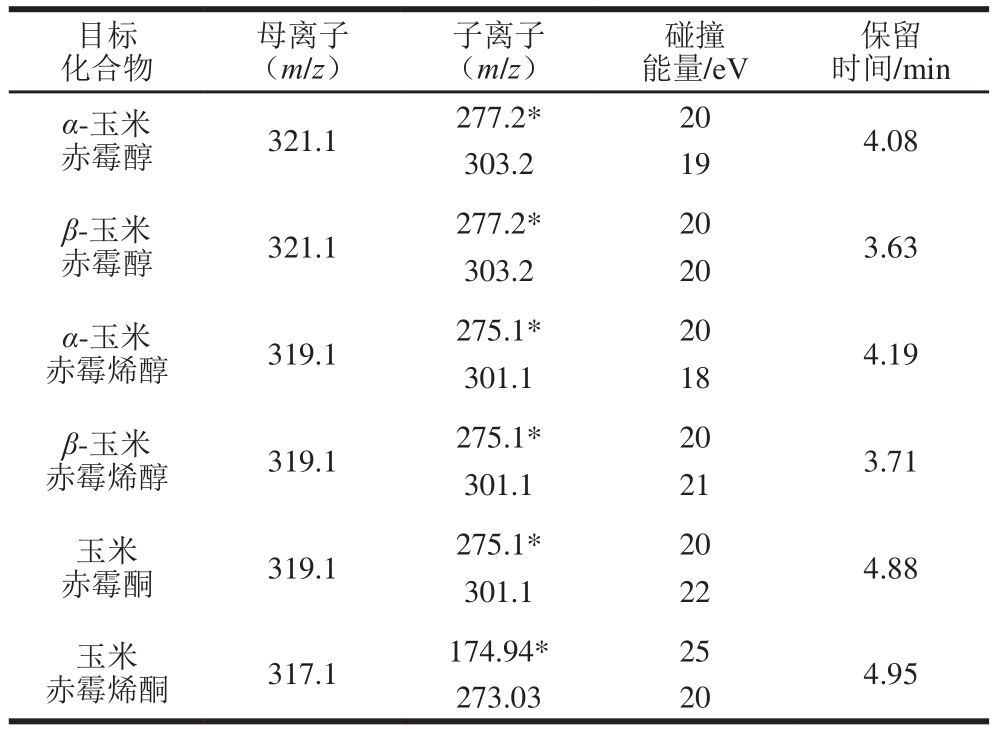
注:*.定量离子。
邵瑞婷,张丽华*,史 娜,姜 洁
(北京市食品安全监控和风险评估中心,北京 100041)
摘 要:建立食品中6 种玉米赤霉烯酮类(α-玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮、玉米赤霉烯酮)真菌毒素的免疫亲和净化-超高效液相色谱-串联质谱检测的实验方法。样品经80%乙腈溶液提取,通过免疫亲和柱净化富集,用2 mL乙腈洗脱,氮吹至近干,0.5 mL 50%乙腈溶液复溶,采用超高效液相色谱-串联质谱进行测定。在ACQUITY UPLC HSS T3反相柱上分离,梯度洗脱,流动相为乙腈和水,质谱采集模式为电喷雾负离子多反应监测模式。6 种目标物的线性范围为0.1~100 μg/L,相关系数(R2)均大于0.992,检出限为0.05 μg/kg,定量限为0.2 μg/kg,3 个不同水平的加标平均回收率为73.0%~119.1%,相对标准偏差不大于10%。该方法具有操作简单、重复性好、灵敏度高、杂质干扰小等特点,可以用于食品中玉米赤霉烯酮类真菌毒素的检测。
关键词:免疫亲和;玉米赤霉烯酮;超高效液相色谱-串联质谱;食品中真菌毒素
玉米赤霉烯酮又称F-2菌素,是由镰刀菌产生的一种非甾体霉菌毒素,具有类雌激素作用[1]。玉米赤霉烯酮在世界范围内的污染广泛存在,主要污染玉米、小麦、大麦、高粱等谷物类农产品及其制品,并通过饲料进入畜禽体内。研究表明,玉米赤霉烯酮具有生殖毒性,可引起动物雌激素水平的提高,导致动物流产、死胎、畸形等生殖异常。还具有免疫毒性、肝毒性及细胞毒性,也对肿瘤的发生有一定的影响[2-4]。人一旦食用被污染的谷物,或由被污染饲料喂养的畜禽生产出的肉、蛋、奶等动物源性食品,玉米赤霉烯酮就可通过食物链富集,对人类的健康造成极大的影响。玉米赤霉烯酮有多种结构类似的衍生物,包括:α-玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮等,其对生物体的影响与玉米赤霉烯酮相似。国内外对谷物及其制品中玉米赤霉烯酮的最高残留进行了限制:我国的国家标准中规定了小麦、玉米等谷物及其制品中玉米赤霉烯酮的最高限量为60 μg/kg[5];欧盟对谷物及其制品进行了详细的区分:婴幼儿谷物食品中玉米赤霉烯酮最高限量为20 μg/kg,其他谷物及其制品中玉米赤霉烯酮的最高限量为50~400 μg/kg不等[6]。对于其他动物源性食品,我国除将玉米赤霉醇列为动物性食品中禁止使用的药物[7]外,尚未对其他玉米赤霉烯酮类真菌毒素的残留进行限定。目前,国内外检测食品中玉米赤霉烯酮类真菌毒素的方法主要有:酶联免疫吸附法[8]、液相色谱法[9-13]、高效液相色谱-质谱联用法[14-19]、气相色谱-质谱联用法[20-21]等。
近年来,液相色谱及液相色谱-质谱在玉米赤霉烯酮类真菌毒素的检测上应用较为广泛,相关研究多集中于谷物及其制品[9-11,13]。在动物源性食品方面,现有研究主要涉及到肉、蛋、乳、水产中的单一食品类别[22-23],且需用空白基质提取液配制曲线进行定量。本方法前处理过程简便,运用免疫亲和柱净化,液标法定量,可实现6 种玉米赤霉烯酮类真菌毒素的同时定量测定。除谷物及其制品外,同样适用于肉、蛋、乳、水产及其制品多个食品类别。与现行的国家标准[24-25]相比较,本方法适用的食品类别更广泛,前处理更为简便且能达到更低的检出限。
1.1 材料与试剂
实验所用大米、麦片、牛肉、猪肉脯、鸡蛋、牛奶、鲤鱼等样品均为市售。其中大米、麦片用研磨仪制成粉末状;牛肉、猪肉脯、鲤鱼用组织捣碎机捣碎;鸡蛋、牛奶充分混匀后直接取用。
α-玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮、玉米赤霉烯酮标准品德国Dr. Ehrenstorfer GmbH公司;乙腈(色谱纯)美国Thermo Fisher公司;乙酸钠(分析纯) 国药集团化学试剂有限公司;β-葡萄糖醛苷酶/芳基硫酸酯酶 法国默克公司;玉米赤霉烯酮类免疫亲和柱 美国Vicam公司。
标准储备溶液:精确称取玉米赤霉烯酮类标准品各10 mg分别置于10 mL棕色容量瓶中,用乙腈溶解并定容,配制成1 mg/mL的标准储备溶液,避光、-18 ℃条件下保存;混合标准溶液:精密量取玉米赤霉烯酮类标准储备溶液各100 μL,用乙腈定容至10 mL,配制成10 μg/mL的混合标准溶液,避光、-18 ℃条件下保存。混合标准溶液系列:用体积分数50%乙腈溶液逐级稀释混合标准溶液,配制成0.1、0.2、0.5、1.0、5.0、10.0、20.0、50.0、100.0 μg/L的混合标准溶液系列。
1.2 仪器与设备
ACQUITYTM超高效液相色谱-TQS质谱仪 美国Waters公司;GM200型刀式研磨仪 德国Retsch公司;8010ES型组织捣碎机 美国Waring Blende公司;T18均质器 德国IKA公司。
1.3 方法
1.3.1 样品前处理
1.3.1.1 谷物及其制品
称取25 g粉碎试样(精确到0.01 g)置于组织捣碎机中,加入5 g氯化钠,100 mL体积分数80%的乙腈溶液,高速搅拌提取2 min,转移至50 mL离心管中,以4 000 r/min离心5 min,吸取上层提取液10 mL,加入40 mL水,混匀,以10 000 r/min离心5 min。取上清液20 mL,以1~2滴/s流速通过免疫亲和柱,依次用10 mL水淋洗免疫亲和柱2 次,直至空气进入亲和柱中,弃去全部流出液,抽干小柱。准确加入2.0 mL乙腈洗脱,收集全部洗脱液于干净的玻璃试管中,在40 ℃以下氮气吹至近干。残留物用0.5 mL体积分数50%的乙腈溶液复溶,涡旋混匀后,过0.22 μm微孔滤膜,供仪器检测。
1.3.1.2 肉及肉制品、蛋、乳、水产品
称取5 g(准确至0.01 g)经捣碎的样品于50 mL的具塞离心管中,加入5 mL浓度为0.2 mol/L乙酸钠缓冲液和0.025 mL β-葡萄糖醛苷酶/芳基硫酸酯酶,涡旋混匀,于37 ℃水浴中振荡12 h。水解后分别加入2 g氯化钠和20 mL乙腈高速均质1 min后,超声提取20 min,以10 000 r/min冷冻离心5 min,吸取上层提取液10 mL,加入40 mL水,混匀,以10 000 r/min离心5 min。取上清液20 mL,以1~2 滴/s流速通过免疫亲和柱,依次用10 mL水淋洗免疫亲和柱2 次,直至空气进入亲和柱中,弃去全部流出液,抽干小柱。准确加入2.0 mL乙腈洗脱,收集全部洗脱液于干净的玻璃试管中,在40 ℃以下氮气吹至近干。残留物用0.5 mL体积分数50%的乙腈溶液复溶,涡旋混匀后,过0.22 μm微孔滤膜,供仪器检测。
1.3.2 色谱条件
色谱柱:WATERS ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 µm);柱温:40 ℃;样品室温度:15 ℃;进样体积:10 μL;流速:0.3 mL/min;流动相:A为乙腈、B为水,梯度洗脱程序:0~5 min,A由25%线性升到70%,5~6 min,A相保持70%,6~9 min,A由70%线性降到25%,9~10 min,A相保持25%。
1.3.3 质谱条件
电离方式:电喷雾负离子模式,毛细管电压:2.50 kV,锥孔电压:20 V,离子源温度:150℃,脱溶剂气温度:500 ℃,脱溶剂气流速:800 L/h,锥孔气流速:150 L/h,碰撞气流速:0.22 mL/min,其他质谱条件参数见表 1。
表1 6 种真菌毒素多反应监测模式参数
Table 1 Mass spectrometric parameters for detection of the six mycotoxins

注:*.定量离子。
1.3.4 目标物的确证
本实验使用的超高效液相色谱-串联质谱属于低分辨质谱,根据欧盟指令2002/657/EC规定低分辨率质谱需满足4 分,即选取1个母离子(1 分)和2个子离子(各1.5 分)用来确证化合物。在本实验方法条件下6 种化合物的检测结果都能够满足此要求,符合对目标化合物的确证准则。
本实验按照仪器条件测定样品和混合标准溶液,样品的质量色谱峰保留时间与混合标准溶液一致且定性离子对的相对丰度与质量浓度相当的混合标准溶液的相对丰度一致,则判断样品中存在相应的被测物。
2.1 提取溶剂选择
分别用甲醇、乙腈、乙酸乙酯、叔丁基甲基醚4 种有机溶剂对粮谷、肉制品、蛋、乳等样品中6 种化合物进行提取条件实验。结果表明,对于乳、蛋样品中的6 种化合物的提取,乙腈作为提取溶剂,其回收率为74%~105%;乙酸乙酯及叔丁基甲基醚虽有一定的提取效果,但回收率较低,均不足40%;甲醇作为提取试剂,乳化现象明显,无法达到提取效果。对于肉类样品,4 种有机溶剂的提取回收率见图1。结果表明,在同时提取肉类样品中6 种化合物时,乙腈具有显著的优势。故在本研究中,选取乙腈作为提取溶剂。
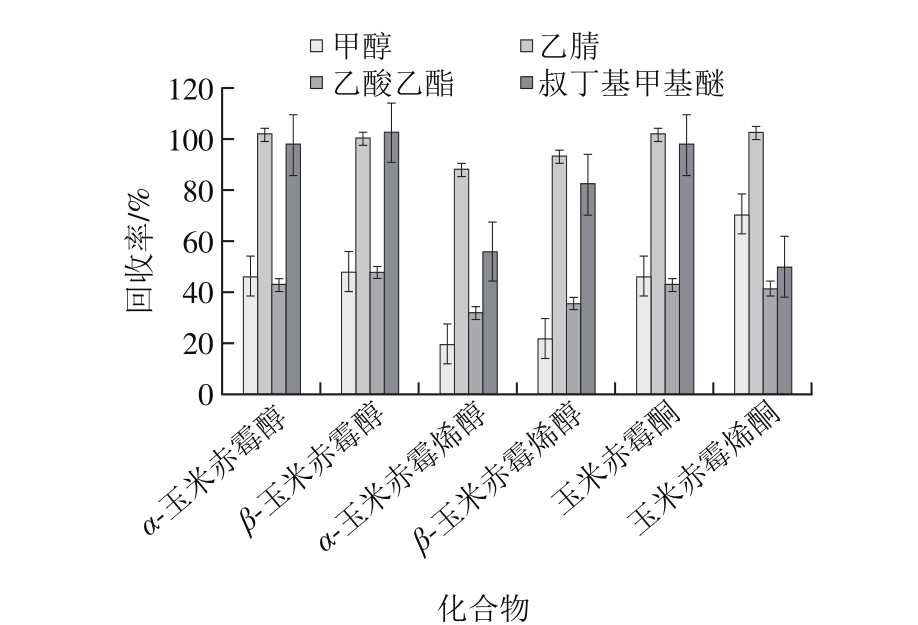
图1 不同溶剂提取牛肉中6 种真菌毒素的回收率(n=6)
Fig. 1 Recoveries of the mycotoxins from beef with different extraction solvents (n = 6)
2.2 样品净化方法的选择
目前用于玉米赤霉烯酮类真菌毒素的分离纯化的柱子主要有固相萃取小柱[26]、多功能净化柱[27-28]及免疫亲和柱[29-30]。比较了3 种净化柱对净化效果和回收率的影响,净化效果见图2。结果表明,使用多功能净化柱及固相萃取柱净化时,除在6 种目标化合物的保留时间(3.60~5.0 min)外,其他保留时间存在明显的杂质谱峰。固相萃取柱虽价格便宜,但净化效果一般,外标法回收率很低,需要购买内标;多功能净化柱可以一定程度上的吸附脂肪、蛋白质及色素等干扰物质,净化效果比固相萃取柱稍强,但同样存在外标法回收率低的问题。故本实验选用特异性强、灵敏度高、回收率好的免疫亲和柱。
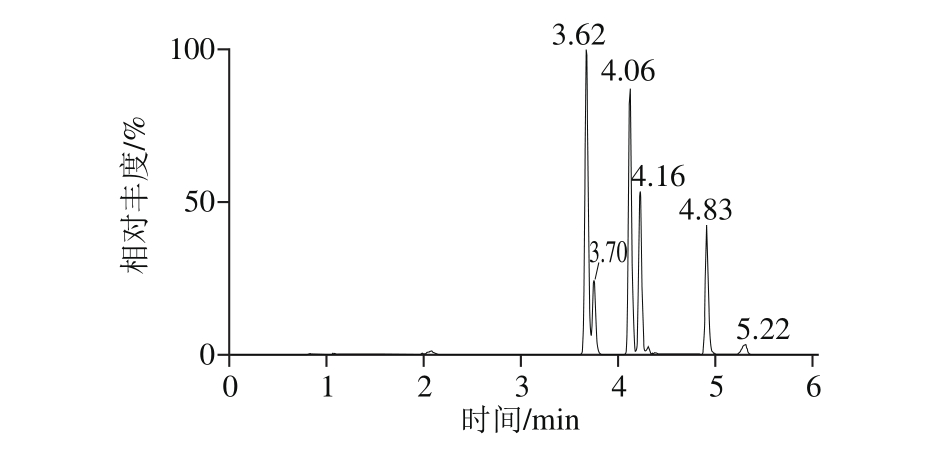
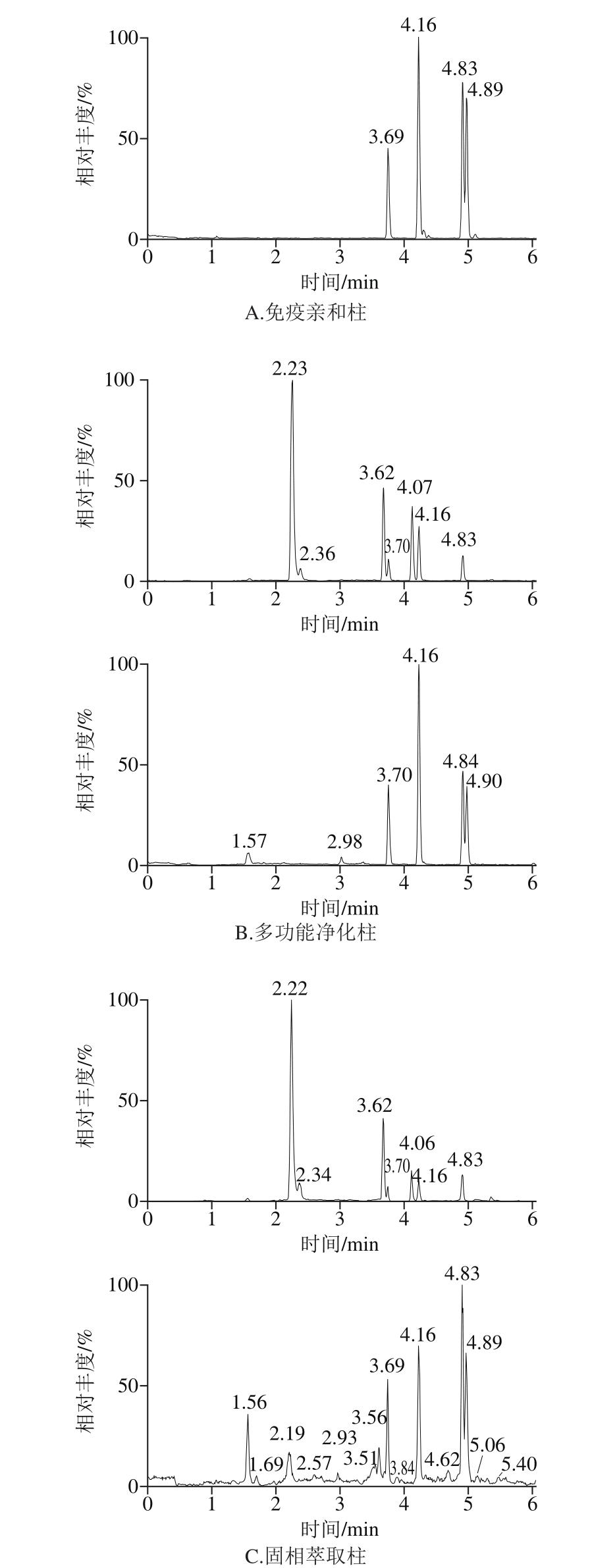
图2 不同净化方式下玉米赤霉烯酮类物质的总离子流图
Fig. 2 Total ion current (TIC) chromatograms of zearalenones purified with different columns
2.3 色谱条件的优化
2.3.1 液相色谱条件优化
实验比较了Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 µm)色谱柱和Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 µm)色谱柱,在相同参数条件下,6 种化合物的总离子流图如图3所示。结果表明,BEH C18色谱柱拖尾现象明显,且无法实现化合物3与4、5与6的基线分离;而HSS T3色谱柱的峰形尖锐,且分离效果明显优于BEH C18色谱柱。故在本实验中,选择HSS T3色谱柱。
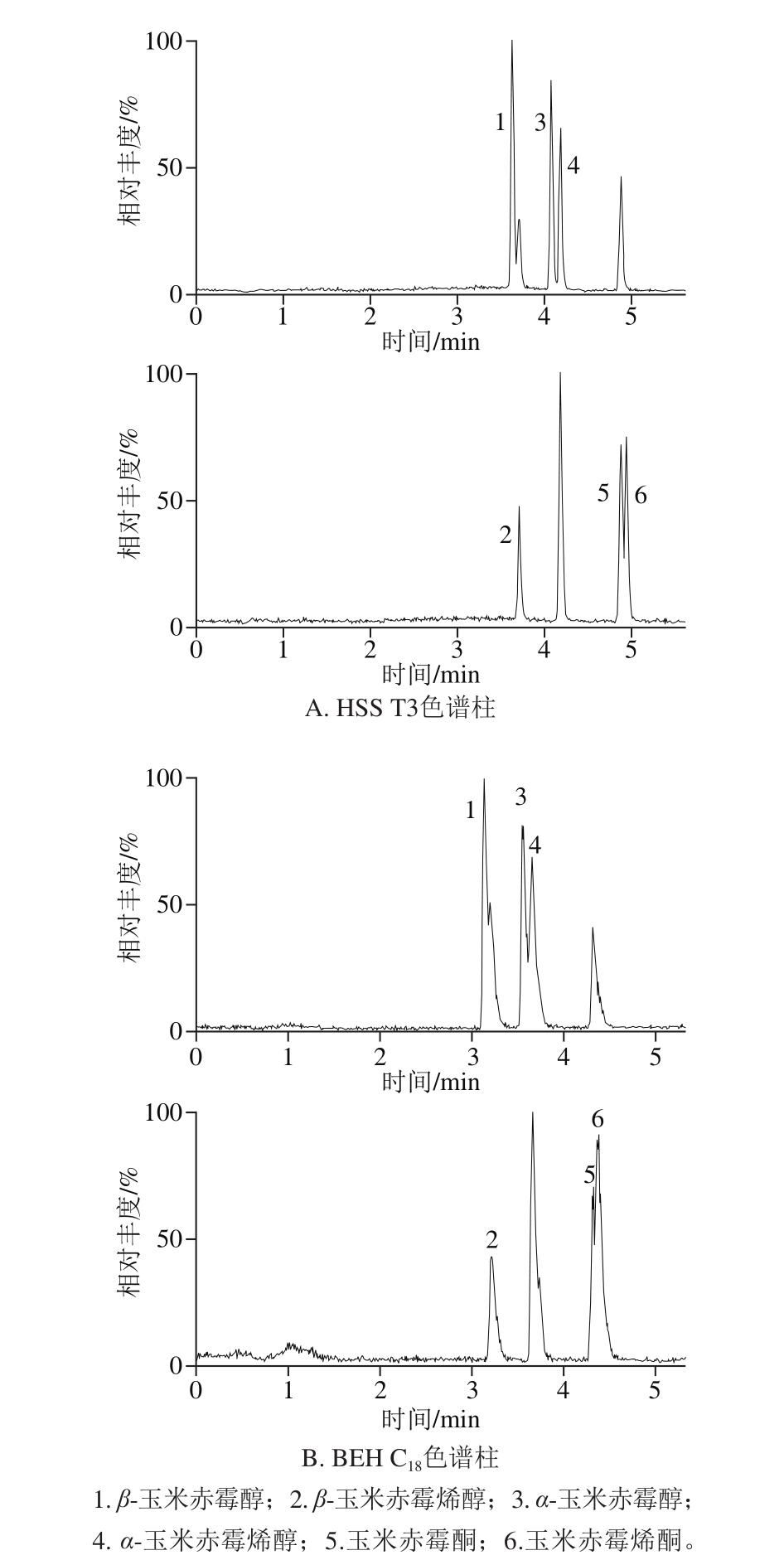
图3 不同色谱柱组成条件下玉米赤霉烯酮类物质的总离子流图
Fig. 3 TIC chromatograms of zearalenones separated with different columns
2.3.2 质谱条件优化
采用电喷雾离子源,不接色谱柱,标准品直接注射状态下,分别将100 μg/L的标准溶液在正离子和负离子模式下进行全扫描以选择适当的电离方式,结果表明,6 种玉米赤霉烯酮类(α-玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮、玉米赤霉烯酮)真菌毒素均在负离子模式下离子化效率较高。故本实验选取负离子模式。
2.4 方法学实验结果
2.4.1 检出限、定量限与线性范围
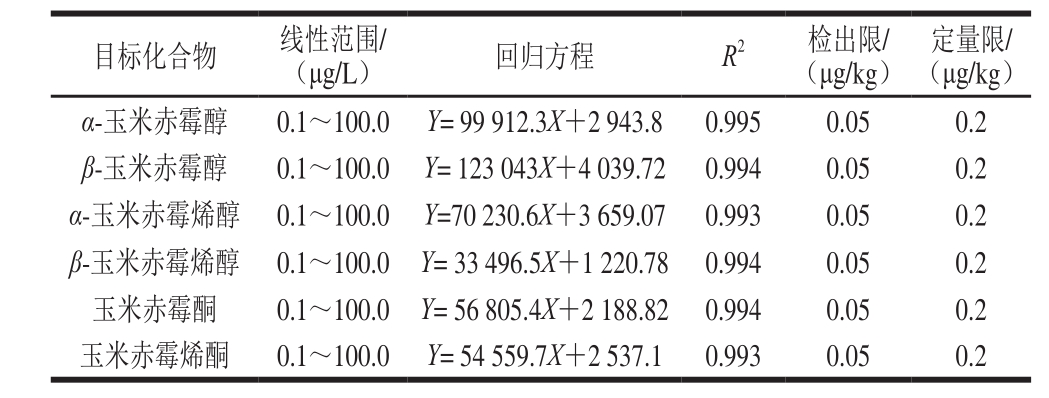
分别配制质量浓度为0.1、0.2、0.5、1.0、5.0、10.0、20.0、50.0、100.0 μg/L的6 种玉米赤霉醇类真菌毒素标准混合溶液,自动进样10 μL,进行超高效液相色谱-串联质谱分析。目标物以多反应监测模式下的峰面积为Y坐标,与其对应的标准混合溶液质量浓度为X坐标,作标准曲线。方法检出限以加标样品检测色谱峰信噪比不小于3确定,方法定量限以加标样品检测色谱峰信噪比不小于10确定,结果见表2。结果表明,6 种化合物在0.1~100.0 μg/L的线性范围内线性关系良好,线性系数R2均大于0.99,能满足定量分析的要求。方法对于6 种玉米赤霉烯酮类真菌毒素的检出限均为0.05 μg/kg,定量限均为0.2 μg/kg。
表2 6 种真菌毒素的线性范围、回归方程及线性相关系数
Table 2 Linear ranges, linear equations and correlation coefficients of the six mycotoxins
2.4.2 样品的加标回收率
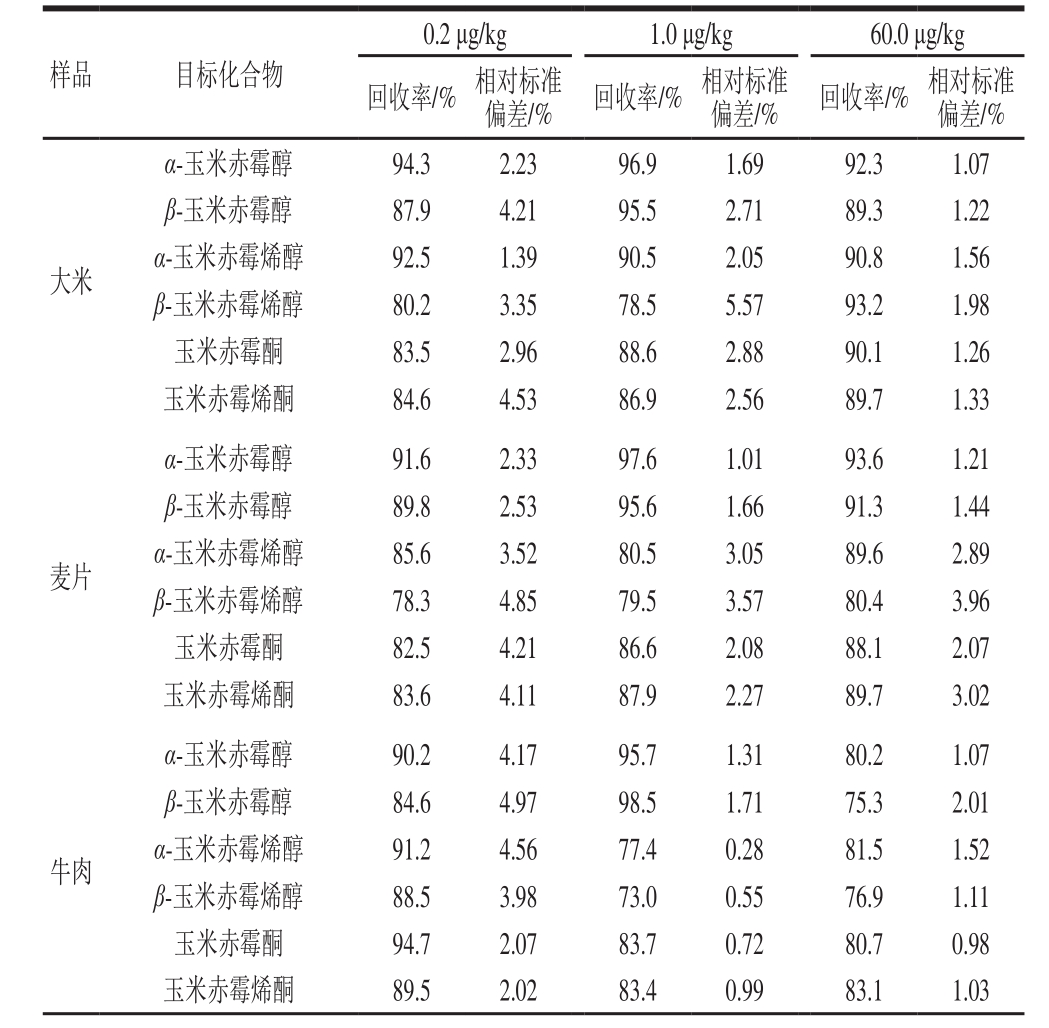
表3 6 种目标化合物在不同加标水平下的加标回收率及相对标准偏差(n= 6)
Table 3 Recoveries and RSDs of the mycotoxins spiked at three levels (n= 6)
续表3
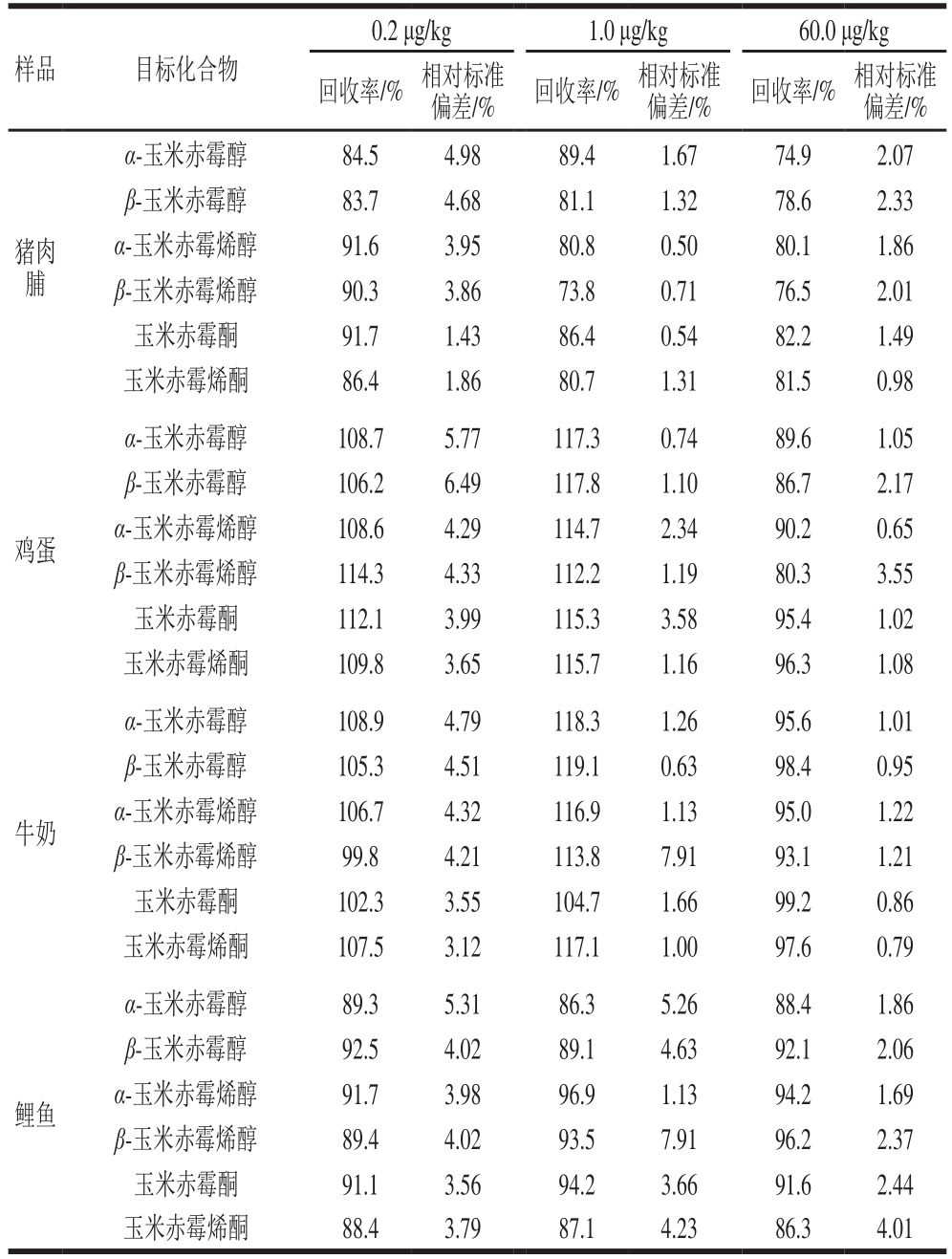
分别在25.0 g谷物及其制品,5.0 g肉及肉制品、蛋、乳、水产样品中加入含有6 种玉米赤霉烯酮类真菌毒素标准混合溶液,最终添加量分别为0.2、1.0、60.0 μg/kg,应用优化好的方法进行提取、净化分离和确证,每个添加水平测定6 份样品,得到6 种化合物的回收率和相对标准偏差如表3所示,回收率范围为73.0%~119.1%,相对标准偏差均小于10%。结果表明,各化合物在不同的添加水平均得到了满意的回收率和较好的方法重复性。
2.5 样品分析结果
运用该方法对市售的265 个谷物及肉、蛋、奶及水产等动物源性食品样本进行了检测,其中部分样品中检出玉米赤霉烯酮,检出含量为1.0~21.6 μg/kg,其结果与国内外已有研究基本一致。图4分别为阴性样品和检出含玉米赤霉烯酮样品的多反应监测色谱图。
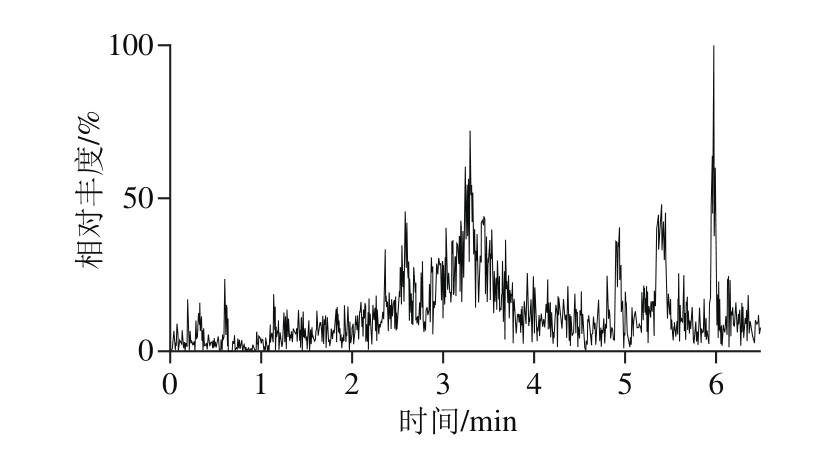
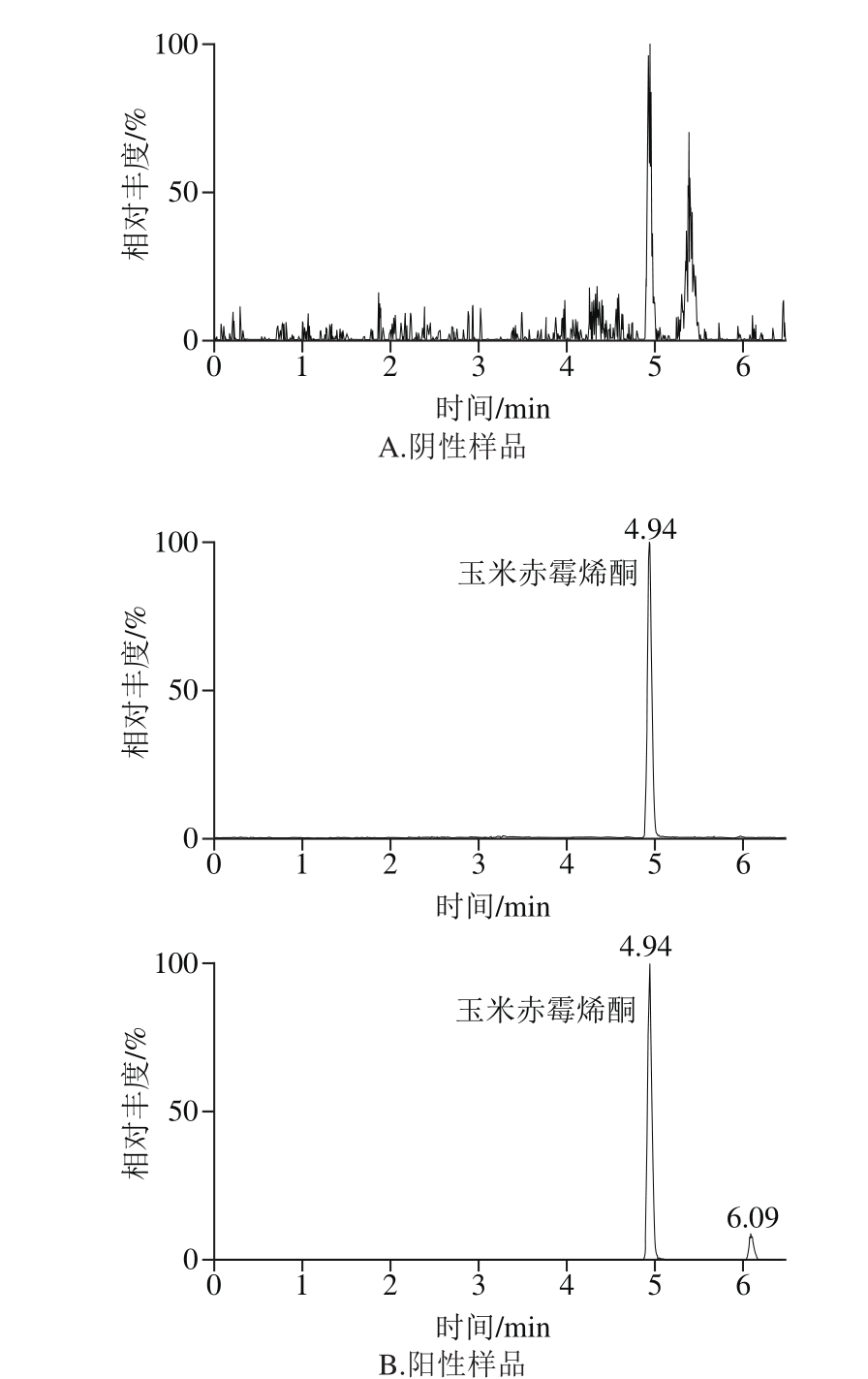
图4 实际样品的多反应监测模式色谱图
Fig. 4 MRM chromatograms of mycotoxins detected in real food samples
建立了食品中玉米赤霉烯酮类6 种真菌毒素的超高效液相色谱-串联质谱检测方法。通过免疫亲和柱的净化,可实现在大米、麦片等谷物制品以及肉、蛋、奶、水产等动物源性样品中均具有较高的回收率。该方法具有操作简单、重复性好、灵敏度高、杂质干扰小等特点,可以用于食品中玉米赤霉烯酮类真菌毒素的检测。
参考文献:
[1] BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003, 16(3): 497-516. DOI:10.1016/B978-012373944-5.00333-3.
[2] ZINEDINE A, SORIANA J M, MOLTÓ J C, et al. Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of zearalenone: an oestrogenic mycotoxin[J]. Food Chemical Toxicol, 2007, 45(1): 1-18. DOI:10.1016/j.fct.2006.07.030.
[3] 蔡雨函, 胡延春, 赵黑成, 等. 玉米赤霉烯酮的毒性及生物降解研究进展[J]. 动物医学进展, 2012, 33(5): 102-105. DOI:10.3969/ j.issn.1007-5038.2012.05.024.
[4] 冯艳忠, 沈伟, 王兆山, 等. 霉菌毒素的研究进展[J]. 饲料工业, 2014, 35(4): 58-62. DOI:10.13302/j.cnki.fi.2014.04.013.
[5] 卫生部. 食品中真菌毒素限量: GB 2761—2011[S]. 北京: 中国标准出版社, 2011.
[6] The Commission of the European Communities. Setting maximum levels for certain contaminants in foodstuffs: (EC) No 1881/2006[S]. 2006.
[7] 农业部. 中华人民共和国农业部公告 第235号[S]. 2002.
[8] 王元凯, 王君, 王雨晨, 等. 玉米赤霉烯酮单克隆抗体的制备及间接竞争ELISA检测方法的建立[J]. 微生物学通报, 2011, 38(12): 1793-1880. DOI:10.13344/j.microbiol.china.2011.12.005.
[9] 曾红燕, 黎源倩, 敬海泉. 高效液相色谱法测定粮食中玉米赤霉烯酮及其代谢物[J]. 分析化学, 2006, 34(3): 351-354. DOI:10.3321/ j.issn:0253-3820.2006.03.016.
[10] 谢刚, 王松雪, 崔华, 等. 超高效液相色谱法快速检测粮食中玉米赤霉烯酮的含量[J]. 粮油食品科技, 2014, 22(2): 71-75. DOI:10.16210/ j.cnki.1007-7561.2014.02.004.
[11] 罗小虎, 包清彬, 杨潇, 等. 高效液相色谱法测定玉米赤霉烯酮的方法研究[J]. 食品科技, 2010, 35(1): 266-270. DOI:10.13684/j.cnki. spkj.2010.01.057.
[12] IQBAL S Z, NISAR S, ASI M R, et al. Natural incidence of aflatoxins, ochratoxin A and zearalenone inchicken meat and eggs[J]. Food Control, 2014, 43: 98-103. DOI:10.1016/j.foodcont.2014.02.046.
[13] 鲍蕾, 吕宁, 吴振兴, 等. 免疫亲和柱同时净化HPLC法测定植物油中黄曲霉毒素和玉米赤霉烯酮[J]. 食品工业科技, 2013, 34(9): 306-309. DOI:10.13386/j.issn1002-0306.2013.09.022.
[14] 韩镌竹, 田晓玲, 丛鑫, 等. 超高效液相色谱-串联质谱法测定牛奶中6 种玉米赤霉烯酮类霉菌毒素的残留[J]. 中国畜牧兽医, 2013, 40(增刊1): 46-49.
[15] 葛宝坤, 赵孔祥, 王伟, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定中药材中的14 种真菌毒素[J]. 色谱, 2011, 29(6): 495-500. DOI:10.3724/SP.J.1123.2011.00495.
[16] HUANG L C, ZHENG N, ZHENG B Q, et al. Simultaneous determination of aflatoxin M1, ochratoxin A, zearalenone and α-zearalenol in milk by UHPLC-MS/MS[J]. Food Chemistry, 2014, 146: 242-249. DOI:10.1016/j.foodchem.2013.09.047.
[17] 丁雪瑶, 黄钰, 钟晓霞, 等. 动物性食品中玉米赤霉烯酮残留的LCMS/MS法测定[J]. 畜牧与兽医, 2016, 48(1): 86-89.
[18] 孙雪, 郗存显, 唐柏彬, 等. 复合免疫亲和柱净化-液相色谱-串联质谱法测定动物源食品中6 种黄曲霉毒素和6 种玉米赤霉醇类真菌毒素残留量[J]. 分析化学, 2016, 44(6): 970-978. DOI:10.11895/j. issn.0253-3820.150229.
[19] 王清, 王国民, 郗存显, 等. 复合免疫亲和柱净化-液相色谱-串联质谱法同时测定动物源性食品中6 种玉米赤霉醇类化合物和氯霉素残留量[J]. 色谱, 2014, 32(6): 640-646. DOI:10.3724/SP.J.1123.2014.01031.
[20] RODRÍGUEZ-CARRASCO Y, MOLTÓ J C, BERRADA H, et al. A survey of trichothecenes, zearalenone and patulin in milled grain-based products using GC-MS/MS[J]. Food Chemistry, 2014, 146: 212-219. DOI:10.1016/j.foodchem.2013.09.053.
[21] 张伟, 王建平, 沈建忠, 等. 牛肉组织中玉米赤霉醇及相关物残留的气相色谱-质谱法测定[J]. 畜牧兽医学报, 2007, 38(5): 513-517. DOI:10.3321/j.issn:0366-6964.2007.05.017.
[22] 游丽娜, 李贤良, 郗存显, 等. 免疫亲和柱净化-高效液相色谱法同时检测鸡蛋中6 种玉米赤霉醇类化合物残留量[J]. 色谱, 2012, 30(10): 1021-1025. DOI:10.3724/SP.J.1123.2012.08016.
[23] 钱卓真, 刘智禹, 邓武剑, 等. 高效液相色谱-串联质谱法测定水产品中玉米赤霉醇类激素药物残留量[J]. 南方水产科学, 2011, 7(1): 62-68. DOI:10.3969/j.issn.2095-0780.2011.01.010.
[24] 国家质量检验检疫总局. 动物源性食品中玉米赤霉醇残留量的测定 液相色谱-串联质谱法: GB/T 23218—2008[S]. 北京: 中国标准出版社, 2008.
[25] 国家质量检验检疫总局. 动物源食品中玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮、玉米赤霉烯酮残留量检测方法 液相色谱-质谱/质谱法: GB/T 21982—2008[S]. 北京: 中国标准出版社, 2008.
[26] 孟娟, 张晶, 张楠, 等. 固相萃取-超高效液相色谱-串联质谱法检测粮食及其制品中的玉米赤霉烯酮类真菌毒素[J]. 色谱, 2010, 28(6): 601-607. DOI:10.3724/SP.J.1123.2010.00601.
[27] 隋凯, 李军, 郑江. 多功能柱净化-高效液相色谱法检测谷物中的玉米赤霉烯酮[J]. 分析试验室, 2006, 25(1): 99-102. DOI:10.13595/ j.cnki.issn1000-0720.2006.0026.
[28] 庄倩, 曲宝涵, 李彦, 等. 高效液相色谱-串联质谱法同时测定饲料中9 种霉菌毒素及其代谢物[J]. 分析科学学报, 2016, 32(1): 37-42. DOI:10.13526/j.issn.1006-6144.2016.01.007.
[29] 姚佳, 王昕, 张建新, 等. 免疫亲和柱-高效液相色谱法测定牛奶中氯霉素和玉米赤霉醇及其类似物[J]. 食品科学, 2014, 35(18): 124-127. DOI:10.7506/spkx1002-6630-201418025.
[30] 李贤良, 游丽娜, 郗存显, 等. 免疫亲和柱净化-液相色谱-串联质谱法同时测定猪肉中6 种玉米赤霉醇类化合物残留量[J]. 分析化学, 2013, 41(8): 1147-1152. DOI:10.3724/SP.J.1096.2013.30141.
Determination of Zeranols in Food by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry with Immunoaffinity Column Clean-up
SHAO Ruiting, ZHANG Lihua*, SHI Na, JIANG Jie
(Beijing Municipal Center for Food Safety Monitoring and Risk Assessment, Beijing 100041, China)
Abstract:A method was established for the determination of 6 zeranols (α-zearalanol, β-zearalanol, α-zearalenol, β-zearalenol, zearalanone, and zearalenon) in foods by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) with immunoaffinity column clean-up. Sample extraction was carried out with 80% (V/V) acetonitrilewater mixture followed by purification on an immunoaffinity column, which was eluted with 2 mL of acetonitrile, and the eluate was blown to dryness by nitrogen and redissolved with 0.5 mL of 50% (V/V) acetonitrile-water mixture. The target compounds were assayed by UPLC-MS/MS. The chromatographic separation was performed on an ACQUITY UPLC HSS T3 column by gradient elution using acetonitrile and water as mobile phase. The mass spectrometric acquisitions were carried out by means of multiple reaction monitoring (MRM) in the electrospray negative ionization mode. Good linearities (R2> 0.992) were achieved for these 6 compounds over the concentration range of 0.1–100 μg/L. The limit of detection (LOD) of the method was 0.05 μg/kg, and the limit of quantification (LOQ) was 0.2 μg/kg. The mean recoveries of the 6 target compounds (spiked at three concentration levels) ranged from 73.0% to 119.1%, with relative standard deviations (RSDs) of not more than 10%. This method is suitable for the simultaneous determination of multiple zearalenonic mycotoxins in foods with simple pretreatment, high sensitivity, and good recovery.
Key words:immunoaffinity; zearalenon; ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); mycotoxins in foods
DOI:10.7506/spkx1002-6630-201716044
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)16-0274-06
引文格式:
邵瑞婷, 张丽华, 史娜, 等. 免疫亲和净化-超高效液相色谱-串联质谱法测定食品中玉米赤霉烯酮类真菌毒素[J]. 食品科学, 2017, 38(16): 274-279. DOI:10.7506/spkx1002-6630-201716044. http://www.spkx.net.cn
收稿日期:2016-08-25
基金项目:北京市科技计划项目(Z161100000616007)
作者简介:邵瑞婷(1984—),女,工程师,学士,研究方向为食品检测。E-mail:rtshao@126.com
*通信作者:张丽华(1988—),女,工程师,硕士,研究方向为食品检测。E-mail:zlh_bibi@126.com
SHAO Ruiting, ZHANG Lihua, SHI Na, et al. Determination of zeranols in food by ultra performance liquid chromatography-tandem mass spectrometry with immunoaffinity column clean-up[J]. Food Science, 2017, 38(16): 274-279. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201716044. http://www.spkx.net.cn