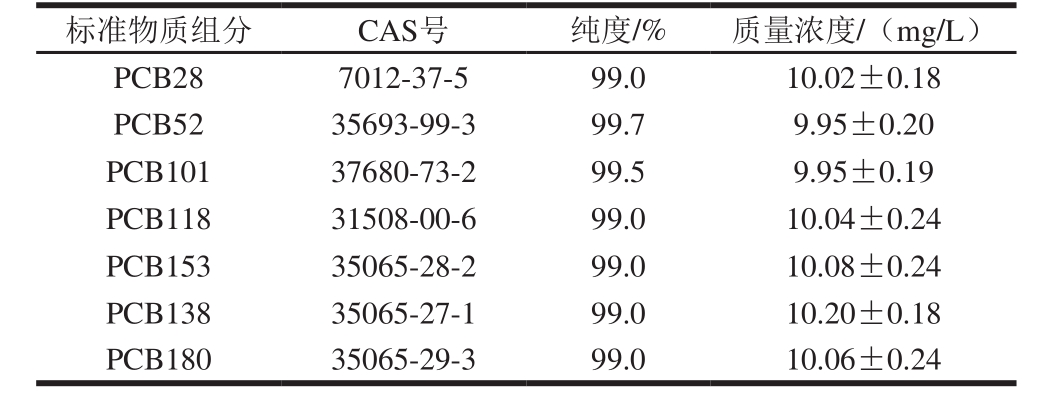
表1 标准物质信息
Table 1 Information about the standard substances used in this study
柴丽月1,邱纪时1,钟惠英1,苏 晴2,翁佩芳2,段青源1,*
(1.宁波市海洋与渔业研究院,浙江 宁波 315103;2.宁波大学海洋学院,浙江 宁波 315211)
摘 要:对宁波市场销售的3 种常见食用鱼类——大黄鱼、带鱼和马鲛鱼中7 种指示性多氯联苯(polychlorinated biphenyls,PCBs)残留量进行分析与评价,探讨PCBs污染物在鱼类不同部位中的组成特征并进行人体健康风险评估。结果表明:3 种鱼肉中PCBs含量由大到小分别为大黄鱼(3.82±1.20) µg/kg、带鱼(2.00±1.32) µg/kg和马鲛鱼(1.36±0.40) µg/kg。其中,带鱼中PCB52含量最高,为(0.78±0.07) µg/kg,马鲛鱼和大黄鱼均以PCB153含量最高,马鲛鱼为(1.59±0.10) µg/kg,大黄鱼为(0.33±0.09) µg/kg;3 种鱼类不同部位PCBs平均含量由大到小分别为皮(3.87 µg/kg)、性腺(2.57 µg/kg)、肝脏(2.53 µg/kg)、鳃(1.95 µg/kg)和肌肉(1.57 µg/kg)。根据GB 2762—2012《食品中污染物限量》中关于海产食品中PCBs允许限量(不大于0.5 mg/kg)的规定,3 种鱼类中PCBs残留量在可接受的范围内。
关键词:食用鱼;多氯联苯;残留;风险评价
多氯联苯(polychlorinated biphenyls,PCBs)是《斯德哥尔摩国际公约》中12 种持久性有机污染物之一。由于PCBs难于分解,在环境中循环造成广泛的危害,从北极的海豹到南极的海鸟蛋都含有PCBs[1]。尽管早已停产和禁用PCBs,但是环境中残留的PCBs依然严重威胁着各种生物,特别是水生动物。PCBs是典型的环境内分泌干扰物,可直接或间接影响水生动物及其后代的内分泌功能,严重影响生殖器官的形态与功能、生殖内分泌、原始生殖细胞、受精、胚胎及幼体生长发育[2]。PCBs具有很强的亲脂性,可通过胎盘屏障直接或间接毒害胚胎,导致孵化延迟、胚胎发育畸形或死亡。在受污染的大西洋海岸河口,PCBs等毒害数种鱼类的胚胎及幼体,导致死亡率增加,循环衰竭,水肿和颅面畸形等[3]。
PCBs的同类物在土壤、水体和大气等环境介质中不停地迁移,并且通过生物富集作用(富集系数达3.4×106)[4],通过食物链富集到人体中。目前在海水、河水、水底质、土壤、大气、水生生物、野生动植物以及人乳和脂肪中都发现有PCBs的污染[1]。由于其难降解性,在人体或动物体中的半衰期可达1~10 a[5],进而对皮肤、牙齿、肝脏、神经系统[6]、免疫系统[7]和内分泌系统[8]造成影响,且具有生殖毒性[9]和致畸、致癌、致突变性等“三致效应”[10-11]。研究表明,食物摄入是除了职业暴露外人类接触PCBs的最主要途径,超过人体接触量的90%[12],其中主要来源是动物性食品[13]。虽然有研究表明,通过烹饪可以减少鱼、贝类中PCBs含量,但是变化程度很小[14]。
近年来,国内外学者对不同地区水产品中PCBs的残留情况做了大量研究,如郝青等[15]对广州水产品批发市场中7 种鱼类中的PCBs残留进行了分析,张东平[16]对太湖9种野生鱼类体内的PCBs的研究,Blanes等[17]探讨了西地中海地区市售野生金头鲷中PCBs的残留和分布特征。这些研究对水体中鱼类中的PCBs含量作了广谱的调查,并对其食用风险作了评估。而宁波市地处我国东部沿海,面向东海,沿岸海域有杭州湾、三门湾、象山港水域,向外延伸至东海海域,水产品是宁波一大特色,有关宁波市居民食用水产品中PCBs污染情况的报道仅限于滩涂养殖贝类[18],对鱼类的不同部位中PCBs的残留情况则鲜有报道。
为研究鱼体中PCBs在不同组织中分布特征,本实验综合考虑水产品中PCBs残留量和居民饮食习惯等因素,选取大黄鱼、带鱼和马鲛鱼作为研究对象,检测分析其不同组织(包括鳃、皮、内脏、肌肉和性腺)中PCBs的残留,同时利用致癌风险商对人体的健康风险进行评估,为研究PCBs在生物体中的迁移转化和预测模型提供科学依据。
1.1 材料与试剂
PCBs混合标准溶液含7 种PCBs单体(PCB28、PCB52、PCB101、PCB118、PCB153、PCB138、PCB180,质量浓度均为10.0 µg/mL) 上海安谱科学仪器有限公司;标准物质详细信息见表1;正己烷、丙酮(均为色谱纯) 美国Tedia公司;浓硫酸(分析纯) 衢州巨化试剂有限公司;无水硫酸钠(分析纯) 浙江中星化工试剂有限公司;硅胶小柱(规格1 000 mg/6 mL) 美国Agela公司。
表1 标准物质信息
Table 1 Information about the standard substances used in this study

1.2 仪器与设备
6890气相色谱仪 美国Aglient公司;R-215旋转蒸发仪 瑞士Büchi公司;MMV-1000W分液漏斗振荡器日本东京RIKA公司;HGC-24A氮吹浓缩仪 天津市恒奥科技发展有限公司;VisiprepTM固相萃取装置 美国Supelco公司。
1.3 方法
1.3.1 样品的采集和制备
2015年10月,分别在宁波市路林水产品市场(宁波市水产品主要集散地)采集3 种鱼类——大黄鱼、带鱼和马鲛鱼,冰藏运至实验室放入4 ℃冰箱保存。分别取鳃丝、皮、内脏、肌肉和性腺,匀浆,置于-20 ℃冰箱中冷冻备用。每种鱼类都尽量采集体质量和体长比较一致的个体。样品信息见表2。
表2 采集的鱼样信息
Table 2 Information about the collected fish samples

1.3.2 样品检测
参照GB 5009.190—2014《食品中指示性多氯联苯含量的测定》,结合实验室条件作适当改变,并经方法的可行性确认后进行。
1.3.3 样品前处理
称取5.00 g样品匀浆于研钵中,加20 g无水Na2SO4研磨成砂状,转移至250 mL离心瓶中。加入40 mL正己烷,在振荡器上振荡0.5 h。离心取上清液于蒸发浓缩瓶中,残渣加40 mL正己烷重复萃取一次,两次上清液合并于蒸发浓缩瓶中。经旋转蒸发仪浓缩到2 mL,转移至10 mL离心管中,用3 mL正己烷洗涤浓缩瓶,并合并至离心管中。加入5 mL浓H2SO4,振摇,4 000 r/min离心15 min。
SPE硅胶柱用10 mL正己烷活化后,在柱下端接好收集瓶。移取1 mL上述正己烷提取液过柱,用9 mL的正己烷-乙酸乙酯(95∶5,V/V)溶液洗脱,并抽干柱子。收集的洗脱液经氮气吹干。正己烷定容至1 mL,供气相色谱检测。
1.3.4 色谱条件
气相色谱仪配Ni63电子捕获检测器,色谱柱为DB-1701毛细管柱(30 m×0.25 mm,0.25 µm)。进样口温度为250 ℃,检测器温度为300 ℃。程序升温:初始温度为80 ℃,保持0.5 min,15 ℃/min升温至200 ℃,保持5 min,2.5 ℃/min升温至250 ℃,保持2 min,20 ℃/min升温至265 ℃并保持5 min。载气为高纯氮气,纯度高于99.99%,流量1.6 mL/min。不分流进样,进样量为1 µL。
1.3.5 定量测定
将1.3.3节处理好的用正已烷定容至1 mL样品测定溶液按上述仪器方法进行测定。样品中7 种PCBs定量分析采用5 种质量浓度(分别为2.5、5、7.5、10、20 ng/mL)的PCBs混合标样绘制工作曲线,外标法定量。
1.3.6 质量控制和质量保证
为确保检测结果的可靠性,在进行样品分析的同时,进行方法空白、平行样测定和加标回收率实验,加标回收率为84.6%~105%。平行实验的相对标准偏差控制在10%内,每批次样品检测均绘制工作曲线,7 种PCBs回归曲线的拟合程度均为R2大于0.995。
1.4 数据处理与评价方法
测定结果均以湿质量计,低于检测限的目标物浓度值设置为0,若在空白样品中检测到PCBs,则在计算样品中目标物含量时将其扣除。用Microsoft Excel 2007和SPSS Statistics 18.0软件对不同鱼类不同部位PCBs含量进行统计与分析,用Origin 8.5绘制数据频率分布状况图及PCBs含量变化图,用商值法对鱼体PCBs进行健康风险评价,并用R语言进行蒙特卡洛模拟。
根据世界卫生组织设定的人体PCBs每日摄入量和美国环境保护署推荐的PCBs参考剂量(reference dose,RfD)以及宁波居民对水产品的消费量,评价食用安全性。使用公式(1)计算居民每日通过消费水产品所摄入的PCBs量,使用公式(2)计算该暴露量下的风险商。
式中:ID为耐受量/(ng/(kg·d));Cm为鱼类中PCBs含量/(µg/kg鲜质量);MS为居民每日鱼类的消费量/g;BW为人体体质量/kg;RfD为20 ng/(kg·d);HQ为风险商。风险商低于1表示不会对人体健康产生危害,风险商大于1表示对人体健康存在显著危害,且风险商数值越大危害程度越大。
2.1 鱼肉中PCBs的残留水平
表3 鱼肉中PCBs的残留量
Table 3 Residual concentrations of PCBs in fish
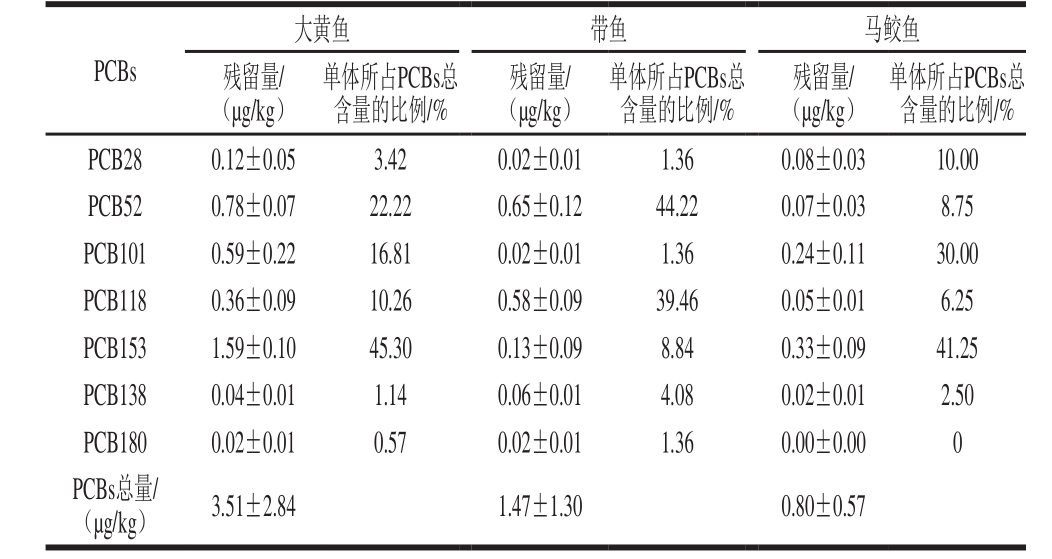
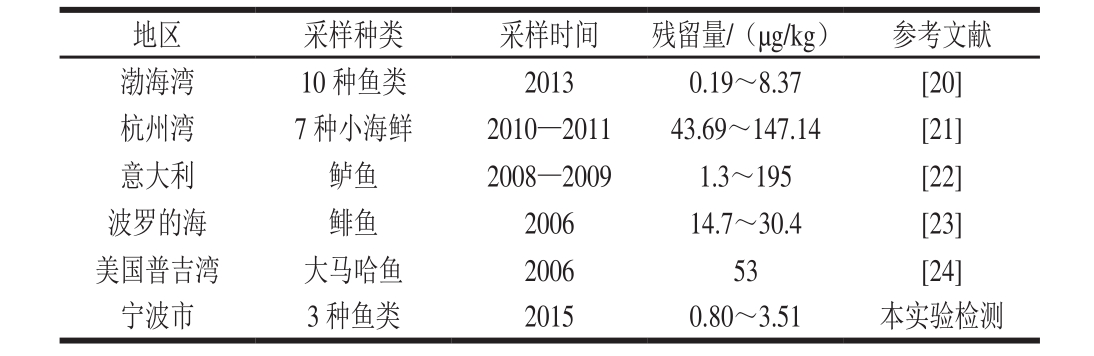
在3 种鱼肉中检测到不同残留水平的PCBs,结果如表3所示。大黄鱼、带鱼和马鲛鱼中PCBs的残留总量分别为3.51、1.47 µg/kg和0.80 µg/kg。根据GB 2762—2012《食品中污染物限量》[19]中关于海产食品中PCBs允许限量(不大于0.5 mg/kg)的规定,所采集的鱼类样品中PCBs含量均远低于此标准限量,且低于国内外报道(表4)的其他地区鱼类中PCBs残留量。
由表3可知,3 种鱼肉中PCBs异构体的组成比例不同,带鱼中PCB52含量最高,马鲛鱼和大黄鱼均以PCB153含量最高;但3 种鱼肉中均以PCB180含量最少。
表4 国内外不同地区水产品中PCBs含量比较
Table 4 Comparison of residual PCBs in aquatic products from different regions in the world
动物对PCBs的代谢率与氯取代基的数目呈负相关,即氯化程度越高,代谢率越低,但是,高氯代联苯因分子结构和相对分子质量较大,即使产生积累也有可能在生物体内代谢、脱氯成低氯代产物。研究表明,水产品体内PCBs的富集程度与其氯原子的取代个数呈抛物线关系,即在生物体内富集更多的是中等氯原子取代的同系物[25]。本实验检出的目标物以四氯和五氯取代的同系物为主,基本符合这一规律。我国曾经主要生产使用三氯联苯和五氯联苯[26],但由于三氯联苯主要用于电容器浸渍剂,一般密封保存,因此流入环境的较少[27],本实验检测结果与我国生产使用情况相符合。
2.2 鱼类不同组织中PCBs的分布特征
3 种鱼类不同部位PCBs平均含量由高到低分别为皮(3.87 µg/kg)、性腺(2.57 µg/kg)、肝脏(2.53 µg/kg)、鳃(1.95 µg/kg)和肌肉(1.57 µg/kg)。鱼体中各个部位PCBs含量见表5。
表5 鱼类不同组织PCBs含量
Table 5 Concentrations of PCBs in different organs/tissues of fish µg/kg
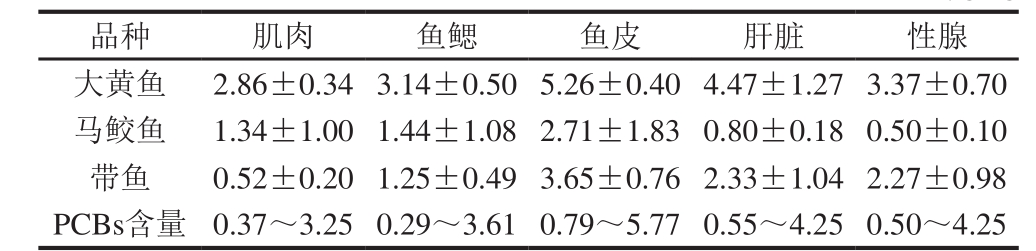
从表5可以看出,肌肉和鱼鳃中PCBs含量大黄鱼最大,其次是马鲛鱼,带鱼最小。这两个部位含量最高的异构体都为PCB52。在鱼皮、肝脏、性腺中,PCBs含量大黄鱼最大,其次是带鱼,马鲛鱼最小。主要异构体为PCB101;带鱼和马鲛鱼含量最高的异构体为PCB52;可见除大黄鱼的皮、肝脏和性腺的主要同分异构体为PCB101外,其他两种鱼的各部位中均以PCB52为主。
3 种鱼5 个不同组织中PCBs的含量除了马鲛鱼性腺中最低,大黄鱼和带鱼均是肌肉中最低。而3 种鱼均为皮中PCBs含量最高。大黄鱼和带鱼不同组织中的PCBs分布特征比较一致,各个部位中的PCBs含量除鱼皮以外,都是肝脏>性腺>鱼鳃>肌肉,这与鱼体中脂肪含量相关,也与PCBs的脂溶性特性相符。而马鲛鱼稍有不同。甘居利等[28]对南海北部陆架区海洋动物中PCBs污染情况的探讨,结果表现为肝>腹肌>皮≈背肌>肠>鳃丝,与其脂肪含量呈正相关。本研究中皮中的PCBs含量较高,可能是由于3 种鱼类所生活的水环境中有较高的PCBs残留,实验结果显示鳃中的PCBs高于肌肉也证明了这一点。
PCBs可以通过挥发、扩散、对流转移至大气、地表水和地下水中,水域沉积物被认为是水环境中PCBs主要归宿之一[29]。本研究中鱼体部位中的鱼皮、鱼鳃PCBs含量高于其他部位,与海域环境中PCBs含量有关。宁波近海岸有镇海炼化、宁波四明化工等化工区,有甬江口海洋倾倒区,石油化工企业排出的副产物中含有PCBs,倾倒区中沉积物中含有的PCBs是近海海域中PCBs的主要来源[30]。而大黄鱼是近海养殖鱼类,马鲛鱼与带鱼是近海捕捞产品,水域中PCBs通过生物富集,在鱼体中沉积,而鱼皮和鱼鳃是直接与水体接触的部位,PCBs很有可能吸附于表面。具体原因有待进一步研究。
2.3 PCBs污染的暴露风险
表6 居民每日最高PCBs耐受量及不同鱼类的风险商
Table 6 Maximum tolerable daily intakes (MTDI) of PCBs and hazard quotients (HQ) in aquatic products
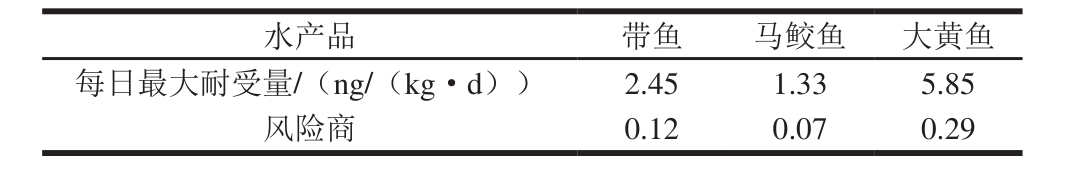
参考《中国居民膳食指南(2007)》[31]建议,鱼虾类摄入量为100 g/(人·日),成人体质量按60.0 kg计算[32],以每种鱼类样品中PCBs的最高含量计算耐受量和风险商,结果见表6。由表6可知,居民每日食用鱼类摄入PCBs的最高量为5.85 ng/(kg·d),远低于耐受量20 ng/(kg·d),且仅为规定的29.2%。尽管如此,但由于PCBs在人体内代谢缓慢,长期富集,因此,对于PCBs含量较高的海产鱼类仍有必要控制其摄入量。
表7 不同鱼类中PCBs含量
Table 7 Concentrations of PCBs in different tissues of fish µg/kg
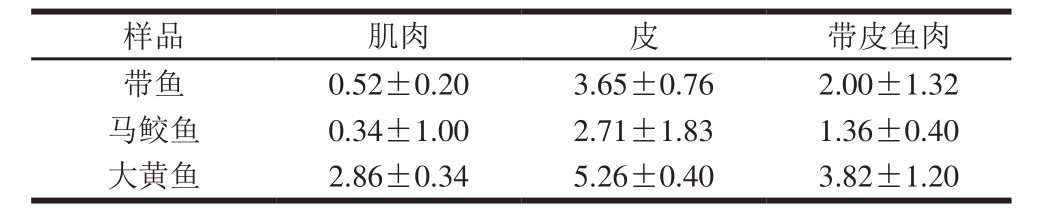
由2.2节可知,鱼皮中的PCBs含量显著高于鱼肉,如表7所示,分别对去皮鱼肉和带皮鱼肉中PCBs的耐受量和风险商进行蒙特卡洛模拟。
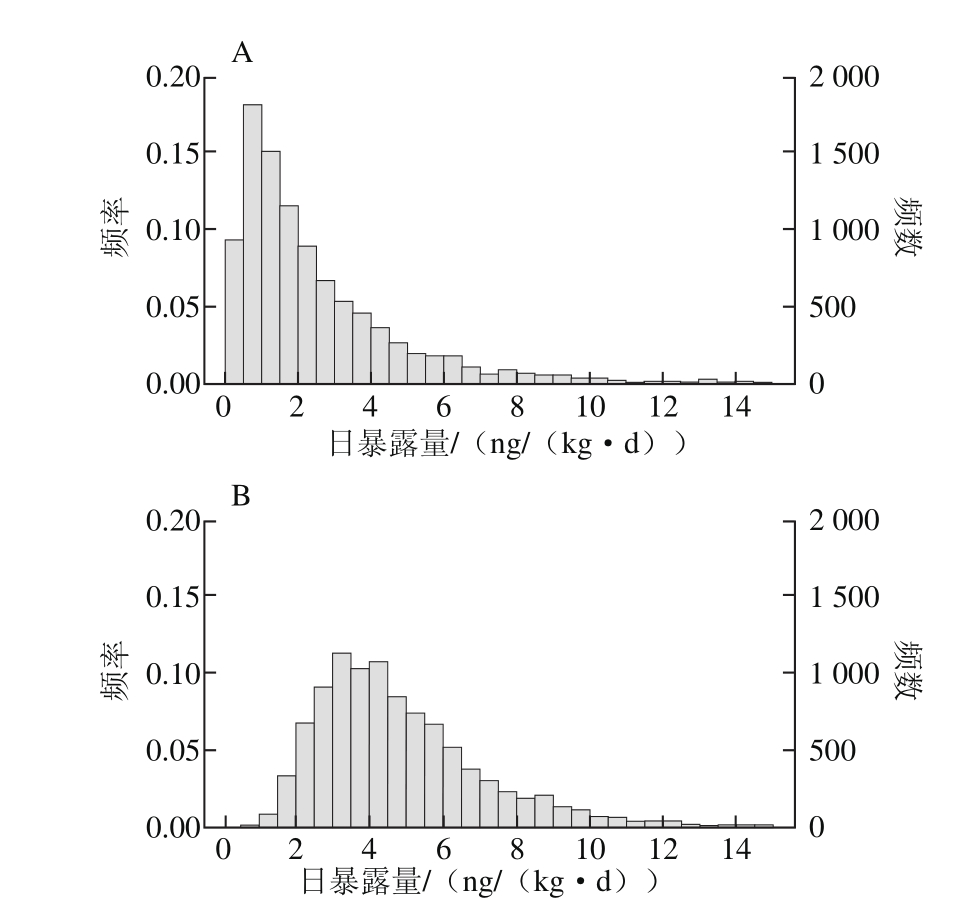
图1 去皮食用(A)和带皮食用(B)鱼类耐受量分布拟合情况
Fig. 1 Simulation results of MTDI of edible fish without and with skin
本研究通过5 000 次模拟来评估3 种鱼类(带鱼、马鲛鱼和大黄鱼)中PCBs的日暴露量和风险商。由于在蒙特卡洛模拟过程中,100%百分位点是理论极值,因此在实际风险评估中,通常采用平均值和95%、97.5%、99.5%高暴露位点作为指标来分析[33]。
3 种鱼类中PCBs的耐受量模拟结果如图1所示,若去皮食用,宁波市3 种鱼类中PCBs的耐受量平均值为2.9 ng/(kg·d),95%、97.5%和99.5%高暴露位点分别为9.12、11.23 ng/(kg·d)和14.88 ng/(kg·d);若带皮食用,耐受量平均值为4.90 ng/(kg·d),95%、97.5%和99.5%高暴露位点分别为9.60、12.43 ng/(kg·d)和22.53 ng/(kg·d)。
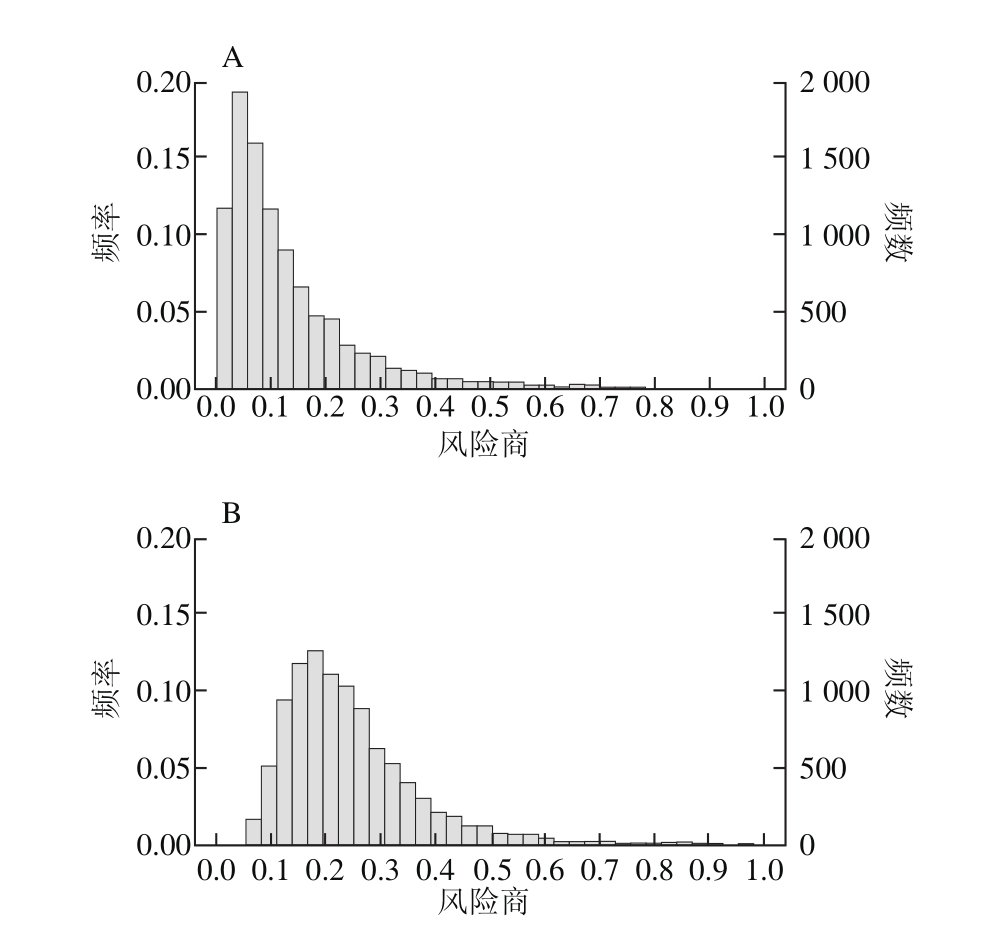
图2 去皮食用(A)和带皮食用(B)鱼类风险商数据分布拟合情况
Fig. 2 Simulation result of HQ of edible fish without and without skin
如图2所示,若去皮食用,宁波市3 种鱼类中PCBs的风险商平均值为0.14,95%、97.5%和99.5%高暴露位点的风险商分别为0.43、0.54和0.74;若带皮食用,风险商平均值为0.24,95%、97.5%和99.5%高暴露位点的风险商分别为0.47、0.57和0.97,均小于1。
表8 宁波市鱼类中PCBs的风险商
Table 8 HQ of PCBs in fish marketed in Ningbo
食用方式95%暴露位点97.5%暴露位点99.5%暴露位点去皮食用0.430.540.74
带皮食用0.470.570.97
将宁波市市售3 种鱼类不同食用方式风险商的95%、97.5%和99.5%高暴露位点的数值进行了统计。表8表明,宁波市市售3 种鱼类中PCBs的风险商低于1,即在该膳食暴露量下不会对宁波市居民的健康造成危害,但是风险商的模拟结果表明,与去皮食用相比,带皮食用的风险商更大,即食用风险更高。
通过对宁波市售3 种食用鱼类中的7 种指示性PCBs污染情况的调查分析及食用健康风险的评估,发现3 种鱼类已经受到不同程度的PCBs污染物污染,大黄鱼、带鱼和马鲛鱼PCBs的污染量总量分别为1.47、0.80 µg/kg和3.51 µg/kg,低于GB 2762—2012中不大于0.5 mg/kg的规定;鱼类不同组织中PCBs残留量由高到低依次为皮、性腺、肝脏、鳃和肌肉;3 种鱼中PCBs残留量水平在可接受范围内,去皮食用会大大降低食用鱼类造成的PCBs健康风险。
参考文献:
[1] 赵荣飚, 秦占芬, 赵汝松, 等. 水和生物样品中痕量多氯联苯的分析方法研究[J]. 分析化学, 2005, 33(10): 1361-1365.
[2] CHEVRIER C, WAREMBOURG C, GAUDREAU E, et al. Organochlorine pesticides, polychlorinated biphenyls, seafood consumption, and time-to-pregnancy[J]. Epidemiology (Cambridge, Mass.), 2013, 24(2): 251-260. DOI:10.1097/EDE.0b013e31827f53ec.
[3] CARLSON E A, ROY N K, WIRGIN I I. Microarray analysis of polychlorinated biphenyl mixture-induced changes in gene expression among Atlantic tomcod populations displaying differential sensitivity to halogenated aromatichydrocarbons[J]. Environmental Toxicology Chemistry, 2009, 28(4): 759-771. DOI:10.1897/08-195R.1.
[4] 徐亮, 刘月雪, 包维楷. 生物体内有机氯农药的研究进展[J]. 四川环境, 2003(5): 15-21. DOI:10.3969/j.issn.1001-3644.2003.05.004. [5] 叶玫, 吴成业, 余颖, 等. 福建省养殖大黄鱼中指示性多氯联苯残留水平及人体暴露风险评估[J]. 海洋科学, 2011(11): 63-68.
[6] GUO Y L, LAMBERT G H, HSU C C. Growth abnormalities in the population exposed in utero and early postnatally to polychlorinated biphenyls and dibenzofurans[J]. Environmental Health Perspectives, 1995, 103(Suppl 6): 117. DOI:10.2307/3432359.
[7] LEIJS M M, KOPPE J G, OLIE K, et al. Effects of dioxins, PCBs, and PBDEs on immunology and hematology in adolescents[J]. Environmental Science & Technology, 2009, 43(20): 7946-7951. DOI:10.1021/ es901480f.
[8] SVOBODOVÁ K, PLAČKOVÁ M, NOVOTNÁ V, et al. Estrogenic and androgenic activity of PCBs, their chlorinated metabolites and other endocrine disruptors estimated with two in vitro yeast assays[J]. Science of the Total Environment, 2009, 407(22): 5921-5925. DOI:10.1016/ j.scitotenv.2009.08.011.
[9] KRISHNAMOORTHY G, VENKATARAMAN P, ARUNKUMAR A, et al. Ameliorative effect of vitamins (α-tocopherol and ascorbic acid) on PCB (Aroclor 1254) induced oxidative stress in rat epididymal sperm[J]. Reproductive Toxicology, 2007, 23(2): 239-245. DOI:10.1016/ j.reprotox.2006.12.004.
[10] HUNTER D J, HANKINSON S E, LADEN F, et al. Plasma organochlorine levels and the risk of breast cancer[J]. New England Journal of Medicine, 1997, 337(18): 1253-1258. DOI:10.1056/NEJM199710303371801.
[11] CRINNION W J. Polychlorinated biphenyls: persistent pollutants with immunological, neurological, and endocrinological consequences[J]. Alternative Medicine Review: A Journal of Clinical Therapeutic, 2011, 16(1): 5-13.
[12] EFSA. Opinion of the scientific panel on contaminants in the food chain on a request from the commission related to the presence of non-dioxin-like polychlorinated biphenyls (PCBs) in feed and food[J]. The EFSA Journal, 2005, 284: 1-137. DOI:10.2903/j.efsa.2005.284.
[13] 韩姝媛, 余应新, 李俊岭, 等. 上海地区肉类和鱼类食品中多氯联苯含量特征及其对人体的生物有效性[J]. 环境科学学报, 2010, 30(6): 1322-1330.
[14] 董姝君, 刘国瑞, 朱青青, 等. 烹饪对食物中持久性有机污染物含量和分布的影响[J]. 科学通报, 2014, 59(16): 1479-1486.
[15] 郝青, 孙毓鑫, 徐向荣, 等. 广州市食用鱼体内PCBs和DDTs的残留水平及用风险评估[J]. 热带海洋学报, 2014(5): 84-91.
[16] 张东平. 太湖鱼体中脂肪酸与PCBs和PBDEs的暴露水平、分布特征和益害分析[D]. 上海: 上海大学, 2012.
[17] BLANES M A, SERRANO R, LÓPEZ F J. Seasonal trends and tissue distribution of organochlorine pollutants in wild and farmed Gilthead Sea Bream (Sparus aurata) from the Western Mediterranean Sea and their relationship with environmental and biological factors[J]. Archives of Environmental Contamination and Toxicology, 2009, 57(1): 133-144. DOI:10.1007/s00244-008-9221-7.
[18] 朱云海, 尤仲杰, 申屠基康, 等. 宁波滩涂贝类养殖区沉积物中有机氯农药和多氯联苯残留及生态风险评估[J]. 应用生态学报, 2012, 23(6): 1689-1694.
[19] 卫生部. 食品中污染物限量: GB 2762—2012[S]. 北京: 中国标准出版社, 2012: 11.
[20] 王莎莎, 高丽荣, 田益玲, 等. 渤海湾海域10 种鱼类中二噁英类及指示性多氯联苯的污染特征研究及风险评价[J]. 环境科学, 2014, 35(6): 2281-2286.
[21] 龚文杰, 施家威, 马建明, 等. 杭州湾南岸小海鲜和滩涂中多氯联苯残留[J]. 中国公共卫生, 2014, 30(4): 529-531. DOI:10.11847/zgggws2014-30-04-49.
[22] PACINI N, ABATE V, BRAMBILLA G, et al. Polychlorinated dibenzodioxins, dibenzofurans, and biphenyls in fresh water fish from Campania Region, southern Italy[J]. Chemosphere, 2013, 90(1): 80-88. DOI:10.1016/j.chemosphere.2012.07.039.
[23] KARL H, BLADT A, ROTTLER H, et al. Temporal trends of PCDD, PCDF and PCB levels in muscle meat of herring from different fishing grounds of the Baltic Sea and actual data of different fish species from the Western Baltic Sea[J]. Chemosphere, 2010, 78(2): 106-112. DOI:10.1016/ j.chemosphere.2009.10.013.
[24] O’NEILL S M, WEST J E. Marine distribution, life history traits, and the accumulation of polychlorinated biphenyls in Chinook salmon from Puget Sound, Washington[J]. Transactions of the American Fisheries Society, 2009, 138(3): 616-632. DOI:10.1577/T08-003.1.
[25] WU J P, LUO X J, ZHANG y, et al. Bioaccumulation of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in wild aquatic species from an electronic waste (e-waste) recycling site in South China[J]. Environment International, 2008, 34(8): 1109-1113. DOI:10.1016/ j.envint.2008.04.001.
[26] 阙明学, 温青, 刘广民, 等. 多氯联苯在自然水体中的分布现状与处理工艺[J]. 中国给水排水, 2006(24): 10-14. DOI:10.3321/ j.issn:1000-4602.2006.24.003.
[27] 施家威, 李和生, 王玉飞. 2007-2008年宁波地区海产品中多氯联苯污染状况分析[J]. 中国预防医学杂志, 2010(1): 62-65.
[28] 甘居利, 贾晓平, 李纯厚, 等. 南海北部陆架区3 种鱼类多氯联苯含量分布特征[J]. 热带海洋学报, 2007, 26(2): 69-73.
[29] 徐国锋, 金余娣, 沈继平. 甬江口海洋倾倒区沉积物中多氯联苯分布特征和生态风险评价[J]. 海洋学研究, 2014, 32(4): 76-82. DOI:10.3969/j.issn.1001-909x.2014.04.010.
[30] 李秀丽, 赖子尼, 穆三妞, 等. 珠江入海口表层沉积物中多氯联苯残留与风险评价[J]. 生态环境学报, 2012, 21(12): 135-140. [31] 葛可佑, 杨晓光, 程义勇. 平衡膳食 合理营养 促进健康: 解读《中国居民膳食指南(2007)》[J]. 中国食物与营养, 2008(5): 58-61.
[32] JIANG Q T, LEE T K M, CHEN K, et al. Human health risk assessment of organochlorines associated with fish consumption in a coastal city in China[J]. Environmental Pollution, 2005, 136(1): 155-165. DOI:10.1016/ j.envpol.2004.09.028.
[33] 段文佳. 水产品中甲醛的暴露评估与风险管理研究[D]. 青岛:中国海洋大学, 2011.
Residual Characteristics and Health Risk Assessment of Polychlorinated Biphenyls (PCBs) in Three Commercial Fish in Ningbo
CHAI Liyue1, QIU Jishi1, ZHONG Huiying1, SU Qing2, WENG Peifang2, DUAN Qingyuan1,*
(1. Ningbo Institute of Ocean and Fishery, Ningbo 315103, China; 2. School of Marine Science, Ningbo University, Ningbo 315211, China)
Abstract:This study analyzed and evaluated seven residual polychlorinated biphenyls (PCBs) in three commercial fish species in Ningbo, including large yellow croaker, ribbon fish and Scomberomorus commerson. We examined the characteristics of PCBs contaminants in different tissues of fish and conducted risk assessment for human health. The results showed that the residual concentrations of PCBs in three fish species were in the decreasing order of large yellow croaker (3.82 ± 1.20) µg/kg > ribbon fish (2.00 ± 1.32) µg/kg > S. commerson (1.36 ± 0.40) µg/kg. Among all the PCBs tested, the concentration of PCB52 in ribbon fish was the highest, which was (0.78 ± 0.07) µg/kg, while for large yellow croaker and Scomberomorus commerson, the most dominant PBC contaminants were PCB153, at levels of (0.33 ± 0.09) and (1.59 ± 0.10) µg/kg, respectively. For all three fish species, the average concentration of residual PCBs tested in different tissues followed the decreasing order of skin (3.87 µg/kg) > sexual gland (2.57 µg/kg) > liver (2.53 µg/kg) > gill (1.95 µg/kg) > muscle (1.57 µg/kg). However, according to the National Food Safety Standard GB 2762-2012, the residue levels of PCBs in three fish were all within an acceptable range.
Key words:fish; polychlorinated biphenyls; residue; risk assessment
DOI:10.7506/spkx1002-6630-201716049
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2017)16-0304-06
引文格式:
柴丽月, 邱纪时, 钟惠英, 等. 宁波市售3 种食用鱼类中多氯联苯残留特征及其健康风险评估[J]. 食品科学, 2017, 38(16): 304-309. DOI:10.7506/spkx1002-6630-201716049. http://www.spkx.net.cn
CHAI Liyue, QIU Jishi, ZHONG Huiying, et al. Residual characteristics and health risk assessment of polychlorinated biphenyls (PCBs) in three commercial fish in ningbo[J]. Food Science, 2017, 38(16): 304-309. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201716049. http://www.spkx.net.cn
收稿日期:2017-02-10
基金项目:宁波市科技局农业重大攻关项目(2013C11027);“水产”浙江省重中之重学科开放基金资助项目(XKZSC1427)
作者简介:柴丽月(1981—),女,工程师,硕士,研究方向为水产品质量与安全。E-mail:chailiyue88@sina.com
*通信作者:段青源(1959—),女,高级工程师,博士,研究方向为水产品质量与安全。E-mail:1076115389@qq.com