
图 1 乳源CGMP作用下IκBα蛋白的表达量变化
Fig. 1 Effect of CGMP on the expression of IκBα
王 泳,龚建苗,贾 彦,赵 培,庞广昌,阎亚丽*,陈庆森*
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
摘 要:以结肠癌细胞HT-29为细胞系,在确定乳源性酪蛋白糖巨肽(casein glycomacropeptide,CGMP)对脂多糖(lipopolysaccharides,LPS)诱导的HT-29细胞核因子-κB(nuclear factor-κB,NF-κB)亚单位p65蛋白影响的基础上,在最适作用时间条件下,利用Western blotting技术进一步检测乳源CGMP对NF-κB信号通路上关键蛋白IκBα、p-IκBα、E3RSIκB、UBC5表达水平的影响,以阐述乳源CGMP调控NF-κB信号通路中关键蛋白的作用机制。结果表明:乳源CGMP组的3 种质量浓度(0.001、0.010、0.100 μg/mL)均可在一定程度上抑制LPS诱导的HT-29细胞NF-κB信号通路上IκBα蛋白的降解,0.100 μg/mL作用较为明显,与空白对照组比较有显著性差异(P<0.01)。研究明确地证实了乳源CGMP可通过抑制p-IκBα、E3RSIκB、UBC5蛋白的表达来抑制IκBα蛋白的降解,进而抑制NF-κB信号通路的激 活。结论:乳源CGMP可显著降低NF-κB信号通路关键蛋白IκBα的降解,其机制是抑制了IκBα的磷酸化和泛素化,使p-IκBα和泛素化关键蛋白E3RSIκB和UBC5的表达均有所下降,进而减少了IκBα的降解,增加了IκBα-p65-p 50蛋白三聚体的数量,使p65蛋白核移位效应降低,进而减少下游基因的表达。因此,研究结果科学地阐释了乳源CGMP是通过调控NF-κB信号通路发挥抗炎的作用。
关键词:酪蛋白糖巨肽;结肠癌细胞;核因子-κB;磷酸化核因子-κB抑制因子α;泛素-蛋白连接酶亚单位
王泳, 龚建苗, 贾彦, 等. 乳源酪蛋白糖巨肽对NF-κB信号通路中关键蛋白的调控作用[J]. 食品科学, 2017, 38(17): 26-31. DOI:10.7506/spkx1002-6630-201717005. http://www.spkx.net.cn
WANG Yong, GONG Jianmiao, JIA Yan, et al. Regulatory effect of milk-derived casein glycomacropeptide on key enzymes involved in NF-κB signaling pathway[J]. Food Science, 2017, 38(17): 26-31. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717005. http://www.spkx.net.cn
Janus激酶-信号转导转录激活因子(janus kinasesignal transduction and transcription activator,JAK-STAT)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及核因子-κB(nuclear factor κB,NF-κB)是细胞内3 条重要信号通路,对于维持细胞的正常生理功能具有重要意义[1-2]。其中NF-κB广泛存在于真核生物细胞中,是与炎症反应、免疫、肿瘤的发生与发展、细胞凋亡的调节以及胚胎发育等相关的信号传导途径的枢纽,是一种密切联系这些信号途径的重要核转录因子[3-4]。
NF-κB/Rel蛋白属于Rel蛋白家族,以一定的方式两两结合成同源二聚体或异源二聚体[3,5-6]。据研究证明,所有的NF-κB复合物均与抑制因子IκB结合,在激活靶基因的转录[7]和在终止NF-κB信号中起着非常重要的作用[8]。在经典的NF-κB信号通路中,IKK是由IKKα、IKKβ和IKKγ组成的三亚基蛋白复合物,其中IKKγ是IKK复合物最后一个被发现的调节亚基 (也被称作NEMO,NF-κB essential modulator);有研究指出,NEMO(48 kD)的结构含有一定的螺旋结构,C-末端也具有LZ,但NEMO序列的前50 个氨基酸残基和后50 个氨基酸残基并无二级结构。IKKα和IKKβ首先借助于分子中的亮氨酸拉链结构域形成二聚体,再分别通过C-末端一段短的结构域与NEMO结合形成稳定的三聚体[9-10]。研究显示,NF-κB通过促进下游基因的转录而广泛参与调控细胞凋亡[11-12]、细胞黏附[13]、细胞增殖、天然以及适应性免疫应答、炎症[3,14-15]、胞内胁迫应答和组织重塑等过程。在诸如炎症、肿瘤[16]、眼部疾病、神经损伤[17-18]、糖尿病[19]等疾病的发生发展过程中起着重要作用。
乳源性酪蛋白糖巨肽(casein glycomacropeptide,CGMP)源于牛乳中酪蛋白,是奶酪加工过程中释放的一种由64 个氨基酸残基组成的肽,该肽一半以上被糖基化修饰,故称为“酪蛋白糖巨肽”[4,20-25]。本实验室经过多年的研究,揭示了乳源CGMP是一种重要的乳源生物活性肽,并围绕该肽开展了较为系统的研究工作取得了一些成果[26-31]。但乳源CGMP明确的调控NF-κB信号通路发挥其免疫调节作用的机制还有待进一步研究。本研究采用结肠癌细胞HT-29为细胞系,脂多糖(lipopolysaccharides,LPS)刺激干预,利用Western blotting测定乳源CGMP对肠上皮细胞NF-κB信号通路关键蛋白的影响,确定相应的作用靶点,以探讨并阐述乳源CGMP调控NF-κB的分子机制,为确定乳源CGMP的抗炎分子机制以及维护相关肠黏膜内环境生物学活性功能提供科学依据,为乳源CGMP作为功能性食品用于炎症性肠病的生物免疫治疗提供参考。
1.1 材料与试剂
CGMP成品 新西兰Tatua公司;人类结肠癌HT-29细胞 江苏齐氏生物科技有限公司。
1.2 仪器与设备
倒置显微镜 日本 Nikon 公司;CO2培养箱 美国Thermo公司;多功能读板机 美国Molecular Devices公司;迷你双垂直电泳槽、迷你转印电泳槽、电泳仪 北京六一仪器厂;高速冷冻离心机 美国Sigma公司。
1.3 方法
1.3.1 细胞分组及总蛋白质提取
人结肠癌细胞株HT-29细胞培养参考文献[4]方法。
用无血清培养基同步化培养6 h后,将细胞分为5 组:空白对照组(N组)、LPS组(1 μg/mL,L组)、LPS(1 μg/mL)和乳源CGMP组(设计低(0.001 μg/mL,C1)、中(0.010 μg/mL,C2)、高(0.100 μg/mL,C3)3 个剂量)。各组处理参考文献[3]方法及CGMP、LPS作用细胞的方法。按照107个细胞加入1 mL细胞总蛋白抽提试剂(含有蛋白酶、磷酸酶抑制剂),置于4 ℃摇床中速振荡10 min,4 ℃条件下14 000 r/min离心15 min,收集上清液。并利用BCA方法定量测定总蛋白质含量。
1.3.2 Western blotting分析
乳源CGMP对LPS诱导HT-29细胞NF-κB信号通路中关键蛋白IκBα、p-IκBα、E3RSIκB和UBC5的Western blotting分析方法为:1)制备凝胶UBC5用质量分数15%聚丙烯酰胺分离胶;2)湿法转膜:UBC5用迷你湿式转印电泳槽200 mA恒流转移1 h,将蛋白转移至聚偏二氟乙烯膜;3)封闭:取下聚偏二氟乙烯膜,切掉右下角作标记后p-IκBα置于2%牛血清白蛋白中,室温条件下摇床封闭1 h,主要封闭膜上的非特异结合部位。其他蛋白操作参考文献[3]方法。
1.4 统计学分析
所有数据均做平行实验,使用SPSS 17.0统计软件进行分析处理,处理结果以±s表示,定义P<0.05为差异有统计学意义。
2.1 乳源CGMP对LPS诱导HT-29细胞IκBα蛋白及其磷酸化的影响
IκBα分子中均含有6 个锚蛋白(ankyrin)的重复序列,而这些重叠螺旋结构与p65分子中的RHR(rel homology region,RHR)区域结合,与p65的核定位序列(nuclear localization sequence,NLS)结合,使p65钝化而滞留在胞质中。Arenzana-Seisdedos等[8]的研究证实了IκBα在终止p65活性的过程,确定了该活化的关键步骤是分子IκBα的磷酸化及降解。因此本研究选择IκBα作为其中靶点之一,对其磷酸化前后蛋白含量变化进行观测。
采用LPS激活打通结肠癌细胞HT-29的NF-κB信号通路后,接着给予乳源CGMP对LPS激活的HT-29细胞进行研究,探讨对IκBα、p-IκBα蛋白的影响。较适剂量乳源CGMP作用48 h后,IκBα、p-IκBα蛋白的表达量见图1、2。

图 1 乳源CGMP作用下IκBα蛋白的表达量变化
Fig. 1 Effect of CGMP on the expression of IκBα
由图1可知,与空白对照组相比,LPS组IκBα蛋白含量极显著降低(P<0.01),降解极为明显,LPS和乳源CGMP组IκBα蛋白表达先增加后降低,其中1 μg/mL LPS+ 0.010 μg/mL乳源CGMP抑制HT-29细胞IκBα蛋白的降解极为显著(P<0.01),0.001、0.100 μg/mL乳源CGMP较0.010 μg/mL乳源CGMP抑制效果降低,但也极显著抑制了IκBα蛋白的降解(P<0.01);与LPS组相比,1 μg/mL LPS分别与0.001、0.010、0.100 μg/mL乳源CGMP结合均极显著增加了LPS刺激下IκBα蛋白的表达(P<0.01),其表达量极显著高于空白对照组。
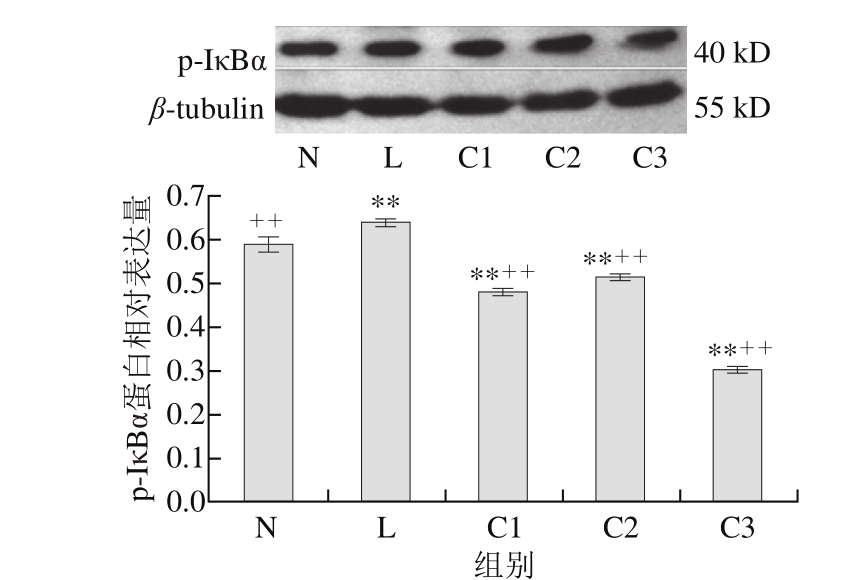
图 2 乳源CGMP作用下p-IκBα蛋白的表达量变化
Fig. 2 Effect of CGMP on the expression of p-IκBα
由图2可知,与空白对照组相比,LPS组p-IκBα蛋白含量极显著增加(P<0.01),1 μg/mL LPS+0.100 μg/mL乳源CGMP抑制HT-29细胞p-IκBα蛋白的表达极为显著(P<0.01),较0.001、0.010 μg/mL乳源CGMP抑制效果好,但0.001、0.010 μg/mL乳源CGMP也极显著抑制了p-IκBα蛋白的表达(P<0.01);与LPS组相比,0.001、0.010、0.100 μg/mL乳源CGMP均极显著抑制了LPS刺激下p-IκBα蛋白的表达(P<0.01),其表达量极显著低于空白对照组。
2.2 乳源CGMP对LPS诱导HT-29细胞IκBα降解泛素蛋白E3RSIκB和UBC5的影响
目前,研究揭示了泛素-蛋白酶体系统(ubiquitinproteasome pathway,UPP)[32-33]主要作用于细胞内一些半衰期短、结构异常、错构或受损伤的蛋白,所以在调节信号通路中蛋白质降解与功能的作用越来越受到关注。因此,研究该通路途径中泛素蛋白与乳源CGMP相互作用及其含量变化具有重要的意义,即泛素蛋白体系中相关蛋白表达水平成为人们研究NF-κB途径的另一重要靶点。
采用LPS激活打通结肠癌细胞HT-29的NF-κB信号通路后,接着给予乳源CGMP对LPS激活的HT-29细胞进行研究,探讨对E3RSIκB、UBC5蛋白的影响。较适剂量乳源CGMP作用48 h条件下,E3RSIκB和UBC5蛋白的表达量见图3、4。

图 3 乳源CGMP作用下E3RSIκB蛋白的表达量变化
Fig. 3 Effect of CGMP on the expression of E3RSIκB
由图3可知,与空白对照组相比,LPS组E3RSIκB蛋白表达量极显著增加(P<0.01),LPS和乳源CGMP组E3RSIκB蛋白的表达量逐渐降低,且呈剂量依赖性,以1 μg/mL LPS+0.100 μg/mL乳源CGMP抑制E3RSIκB蛋白的表达最为显著(P<0.01),C1抑制效果较低,仍显著高于对照组(P<0.05),C2抑制效果也不明显(P>0.05);与LPS组相比,C1、C2和C3显著抑制了LPS刺激下E3RSIκB蛋白的表达(P<0.05,P<0.01),其中0.010、0.100 μg/mL乳源CGMP抑制效果较好(P<0.01)。
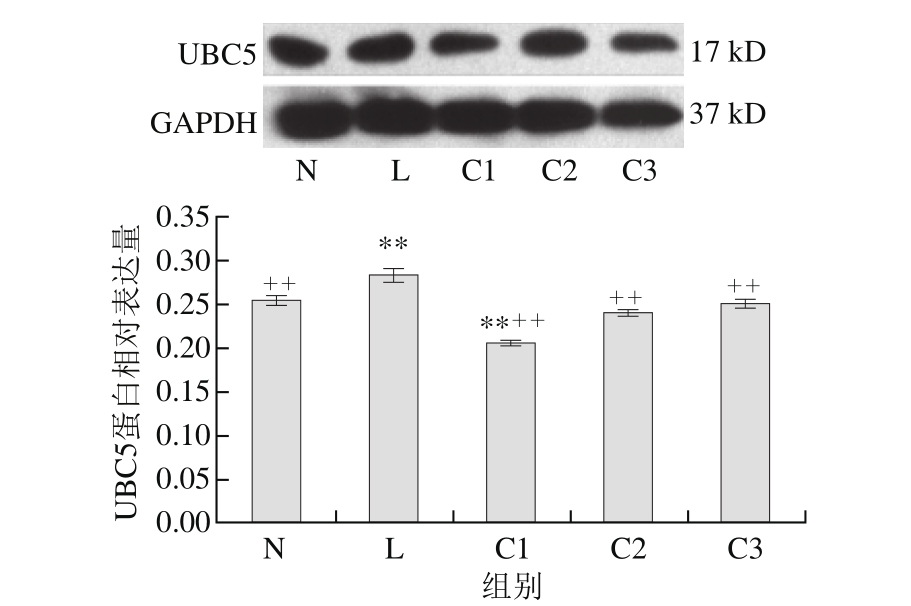
图 4 乳源CGMP作用下UBC5蛋白的表达量变化
Fig. 4 Effect of CGMP on the expression of UBC5
由图4可知,与空白对照组相比,LPS组UBC5蛋白表达量极显著增加(P<0.01),LPS和乳源CGMP组UBC5蛋白的表达量逐渐增加,且呈剂量依赖性,以0.001 μg/mL乳源CGMP抑制效果最为显著(P<0.01),0.010、0.100 μg/mL乳源CGMP抑制效果不具显著性(P>0.05);与LPS组相比,C1、C2和C3极显著抑制了LPS刺激下UBC5蛋白的表达(P<0.01),其表达量极显著低于LPS组。
当今,现代代谢综合征的发展和蔓延,已成为严重的社会问题,越来越引起社会特别是科技界的重视,使人们谈糖色变、谈脂色变,而生物活性肽具有多种人体代谢和生理调节功能,易消化吸收;已有众多的研究报道公布,由营养蛋白质释放的生物活性肽可表现出多种生物学活性,如缓解和治疗慢性炎症、调节脂代谢、抵抗和排斥有害菌、抗病毒、降血压、降血脂等作用;且食用安全性极高,重要的是在微量的状态下就能发挥强大的生理活性,因此,是目前国际食品界最热门的研究课题和极具发展前景的功能因子,从食源性的生物活性物质研究的角度,解决在相关疾病的预防及治疗取得功效更是一条可行的途径,乳源CGMP就是其中一个[34]。近期的研究已经揭示,生物活性肽发挥生理作用主要是通过和肠道内复杂的受体系统、微生物系统、代谢系统相互作用,通过改变自己的信号系统对机体发挥各种生理功能[35]。广泛存在于机体细胞的NF-κB信号通路途径能迅速对外界刺激产生反应,参与细胞凋亡、炎症等生理条件下的基因调控而受到了越来越多的重视。此外,无论是非特异性免疫还是特异性免疫的应答均是通过各种各样的信号传递实现的,因此,要研究乳源CGMP调控免疫发挥生理作用的机制,其干预免疫信号通路的研究是必不可少的。
科学研究表明NF-κB已成为疾病治疗中的一个重要靶点,其激活依靠通路上的关键蛋白,倘若抑制某些必不可少的蛋白的活性,也会间接地抑制NF-κB的激活。因此,越来越多的研究选取NF-κB经典通路中必不可少的蛋白IκBα,对其磷酸化、泛素化相关蛋白进行测定。Rahman[36]发现具生物活性的谷胱甘肽可通过抑制IκB磷酸化而减少NF-κB活化,进而抑制相关细胞因子如TNF-α、细胞间黏附分子等的合成,而达到减少对细胞蛋白作用,缓解细胞炎症状态,或减少细胞凋亡。Fraternal等[37]的研究表明GSH-C4(巯基进行修饰)略微减少了p-IκBα和p65的表达。Gao等[38]用免疫共沉淀技术研究证实抗菌肽PR39(antibacterial peptide PR39)能可逆地结合到26S蛋白酶体的α7亚基上而抑制IκBα的降解,并没有抑制IκBα的磷酸化和泛素化,且通过Western bloting技术证实这一结论。研究结果发现,以结肠癌细胞HT-29为细胞系,30 min的LPS刺激可以使IκBα的含量急剧下降,而乳源CGMP各组细胞IκBα含量均增加,且随着乳源CGMP质量浓度的升高先升高后降低,但均极显著高于空白对照组(P<0.01),以0.010 μg/mL作用效果最好,那么乳源CGMP阻止细胞IκBα的含量下降是通过刺激IκBα蛋白表达增加来实现的,亦或是通过抑制其磷酸化泛素化实现。p-IκBα蛋白表达的结果表明,LPS极显著增加了p-IκBα蛋白的表达(P<0.01),而乳源CGMP的3 个质量浓度组均极显著地抑制LPS刺激后的HT-29细胞p-IκBα蛋白的表达(P<0.01),作用效果明显,不仅极显著低于LPS组(P<0.01),更使p-IκBα蛋白的表达极显著低于空白对照组(P<0.01),且以0.100 μg/mL的CGMP作用效果最好。因此,在某种程度上讲,乳源CGMP减少了IκBα磷酸化也就是减少IκBα的降解,而是否促进IκBα的表达,还有待从基因表达水平上进行研究。
大量研究已证实,UPP在维持细胞内环境稳定方面具有关键调节作用,并且UPP对NF-κB通路的调控是在多个不同水平上进行的[33-34,39],也对各种疾病(如炎症)的发生发展调控表现出该途径的重要地位。因此,本研究中,为了证实乳源CGMP减少IκBα磷酸化而抑制IκBα的降解,这种抑制IκBα降解的作用是单纯IκBα磷酸化减少的结果,还是也抑制了后续的泛素化?本研究测定了IκBα泛素化关键蛋白E3RSIκB和UBC5的表达。E3RSIκB分子中的WD40重复区域,是其与IκBα的结合位点,而E3RSIκB分子中的F-box负责诱导IκBα的泛素化[40]。本研究结果显示,LPS刺激的HT-29细胞中E3RSIκB蛋白与空白对照组相比表达量极显著增加(P<0.01),乳源CGMP降低了LPS刺激后E3RSIκB蛋白的表达,且呈剂量依赖关系,随乳源CGMP剂量增加,抑制强度逐渐增大,以0.100 μg/mL的乳源CGMP作用效果最好(P<0.01),0.001 μg/mL的乳源CGMP虽然显著降低了LPS刺激后E3RSIκB蛋白的表达,但仍显著高于空白对照组,0.010 μg/mL乳源CGMP极显著降低了LPS刺激后E3RSIκB蛋白的表达,但与空白对照组相比,不具有显著性。在UBC5蛋白的测定中发现,LPS组UBC5蛋白与空白对照组相比表达量增加非常明显,有极显著差异(P<0.01),乳源CGMP同样降低了LPS刺激后UBC5蛋白的表达,且呈剂量依赖关系,随乳源CGMP剂量增加,抑制强度逐渐降低,以0.001 μg/mL的乳源CGMP作用效果最好,0.100、0.010 μg/mL的乳源CGMP虽然极显著降低了LPS刺激后UBC5蛋白的表达,但与空白对照组相比,不具有显著性。这些结果说明乳源CGMP可以通过UPP中关键酶的作用,抑制IκBα降解调控NF-κB信号通路,以发挥抗炎活性。
本研究指出,乳源CGMP具有显著调节NF-κB信号通路,改善炎症性肠病引发的结直肠癌的作用,其机制是通过显著降低NF-κB信号通路关键蛋白IκBα的降解,抑制了IκBα的磷酸化和泛素化,使p-IκBα和泛素化关键蛋白E3RSIκB和UBC5的表达均有所下降,进而减少了IκBα的降解,增加了IκBα-p65-p50蛋白三聚体的数量,使p65蛋白核移位效应降低,进而减少下游基因的表达。研究结果较明确地阐释了乳源CGMP是通过调控NF-κB信号通路以发挥抗炎活性的。
参考文献:
[1] 刘辉, 姚咏明. 细胞内炎症信号通路交汇作用研究进展[J]. 感染、炎症、修复, 2005, 4(8): 1607-1613. DOI:10.3969/j.issn.1672-8 521.2003.04.014.
[2] MA C F, WANG Y, DONG L, et al. Anti-inflammatory effect of resveratrol through the suppression of NF-κB and JAK/STAT signaling pathways[J]. 生物化学与生物物理学报(英文版), 2015(3): 207-213. DOI:10.1093/abbs/gmu135.
[3] GONG J M, CHEN Q S. Effect of casein glycomacropeptide on subunit p65 of nuclear transcription factor-κB in lipopolysaccharidestimulated human colorectal tumor HT-29 cells[J]. Food Science and Human Wellness, 2014, 3(2): 51-55. DOI:10.1016/j.fshw.2014.04.001.
[4] 龚建苗, 陈庆森, 阎亚丽, 等. 生物活性肽调节NF-κB信号通路的研究进展[J]. 食品科学, 2013, 34(21): 379-388. DOI:10.7506/s pkx1002-6630-201321075.
[5] GHOSH S, MAY M J, KOPP E B. NF-κB and Rel proteins: evolutionarily conserved mediators of immune responses[J]. Annual Review of Immunology, 1997, 16(1/2): 225-260. DOI:10.1146/ annurev.immunol.16.1.225.
[6] GILMORE T D. The Rel/NF-κB/IκB signal transduction pathway and cancer[J]. Spring US, 2004, 45(32): 221-228. DOI:10.1007/0-306-48158-8-10.
[7] KARIN M, BENNERIAH Y. Phosphorylation meets ubiquitination: the control of NF-κB activity[J]. Annual Review of Immunology, 2003, 18(1): 621-663. DOI:10.1146/annurev.immunol.18.1.621.
[8] ARENZANA-SEISDEDOS F, TURPIN P, RODRIGUEZ M, et al. Nuclear localization of IκBα promotes active transport of NF-κB from the nucleus to the cytoplasm[J]. Journal of Cell Science, 1997, 110 (Pt 3)(1): 369-378.
[9] LEE J, BURCKART G. Nuclear factor κB: important transcription factor and therapeutic target[J]. Journal of Clinical Pharmacology, 1998, 38(11): 981-993. DOI:10.1016/S0001-4575(01)00019-7.
[10] ZANDI E, ROTHWARF D M, DELHASE M, et al. The IκB kinase complex (IKK) contains two kinase subunits, IκKα and IκKβ, necessary for IκB phosphorylation and NF-κB activation[J]. Cell, 1997, 91(2): 243-252. DOI:10.1016/S0092-8674(00)80406-7.
[11] KUCHARCZAK J, SIMMONS M J, FAN Y, et al. To be, or not to be: NF-kappaB is the answer-role of Rel/NF-κB in the regulation of apoptosis[J]. Oncogene, 2003, 22(22): 8961-8982. DOI:10.1038/ sj.onc.1207230.
[12] DJAVAHERIMERGNY M, AMELOTTI M, MATHIEU J, et al. NF-κB activation represses tumor necrosis factor-alpha-induced autophagy[J]. Journal of Biological Chemistry, 2006, 281(41): 30373-30382. DOI:10.1074/jbc.M602097200.
[13] 崔嵩, 刘学锋, 吴斌. NF-κB在肿瘤中的研究进展[J]. 现代肿瘤医学, 2009, 17(1): 134-137.
[14] 郑力新. NF-κB及其与淋巴细胞、细胞因子、病毒的基因调控[J].免疫学杂志, 1990(3): 147-152.
[15] CLEVERS H. At the crossroads of infi ammation and cancer[J]. Cell, 2004, 118(6): 671-674. DOI:10.1016/j.cell.2004.09.005.
[16] HUNOT S, BRUGG B, RICARD D, et al. Nuclear translocation of NF-κB is increased in dopaminergic neurons of patients with parkinson disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(14): 7531-7536. DOI:10.1073/ pnas.94.14.7531.
[17] O’NEILL L, KALTSCHMIDT C. NF-κB: a crucial transcription factor for glial and neuronal cell function[J]. Trends in Neurosciences, 1997, 20(6): 252-258. DOI:10.1016/S0166-2236(96)01035-1.
[18] FLODSTRÖMA M, WELSH N, EIZIRIK D L. Cytokines activate the nuclear factor κB (NF-κB) and induce nitric oxide production in human pancreatic islets[J]. Febs Letters, 1996, 385(1/2): 4-6. DOI:10.1016/0014-5793(96)00337-7.
[19] KWON G, CORBETT J A, HAUSER S, et al. Evidence for involvement of the proteasome complex (26S) and NF-κB in IL-1beta-induced nitric oxide and prostaglandin production by rat islets and RINm5F cells[J]. Diabetes, 1998, 47(4): 583-591. DOI:10.2337/ diabetes.47.4.583.
[20] DELFOUR A, JOLLÈS J, ALAIS C, et al. Caseino-glycopeptides: characterization of a methionine residue and of the N-terminal sequence[J]. Biochemical & Biophysical Research Communications, 1965, 19(4): 452-455. DOI:10.1016/0006-291X(65)90145-2.
[21] BRODY E P. Biological activities of bovine glycomacropeptide[J]. Food Science and Technology, 2000, 84(5): 39-46.
[22] JIMENEZ H F J R. Nomenclature of the proteins of cows’ milk: sixth revision[J]. Journal of Dairy Science, 2004, 87(6): 1641-1674. DOI:10.3168/jds.S0022-0302(04)73319-6.
[23] FIAT A M, JOLLÈS P. Caseins of various origins and biologically active casein peptides and oligosaccharides: structural and physiological aspects[J]. Molecular & Cellular Biochemistry, 1989, 87(1): 5-30. DOI:10.1007/BF00421079.
[24] PISANO A, PACKER N H, REDMOND J W, et al. Characterization of O-linked glycosylation motifs in the glycopeptide domain of bovine kappa-casein[J]. Glycobiology, 1994, 4(6): 837-844. DOI:10.1093/ glycob/4.6.837.
[25] ZEVACO C, RIBADEAU D B. A study on the carbohydrate binding sites of bovine beta-casein using high performance liquid chromatography[J]. Milchwissenschaft-milk Science International, 1984, 39(4): 206-210.
[26] 李博智, 陈庆森. 利用TGase结合微滤技术从乳清粉中分离纯化GMP的研究[J]. 食品科学, 2009, 30(20): 97-103.
[27] 曹晋宜, 陈庆森. 瑞士乳杆菌对小鼠肠道粘膜和肠组织中细胞因子影响的研究[J]. 食品科学, 2009, 30(21): 343-347. DOI:10.3321/ j.issn:1002-6630.2009.21.079.
[28] 李伟, 陈庆森. 酪蛋白糖巨肽对小鼠肠道免疫系统的影响[J]. 食品科学, 2010, 31(15): 240-243.
[29] CHEN Q S, WANG H, ZHU C C, et al. Anti-apoptotic effects of milkderived casein glycomacropeptide on mice with ulcerative colitis[J]. Food and Agricultural Immunology, 2014, 25(4): 453-466. DOI:10.10 80/09540105.2013.823912.
[30] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅰ)[J]. 食品科学, 2006, 27(6): 258-264. DOI:10.3321/ j.issn:1002-6630.2006.05.058.
[31] MING Z, JIA Y, YAN Y L, et al. Amelioration effect of bovine casein glycomacropeptide on ulcerative colitis in mice[J]. Food & Agricultural Immunology, 2015, 26(5): 1-12. DOI:10.1080/09540105. 2015.1018874.
[32] ESTEBAN V, RRPEREZ M, SANCHEZLOPEZ E, et al. Angiotensin IV activates the nuclear transcription factor-kappaB and related proinflammatory genes in vaseular smooth musele cells[J]. Circulation Researeh, 2005, 96(9): 965-973. DOI:10.1161/01.RES. 0000166326.91395.74.
[33] BRUINSMA C. The role of UBE2A and UBE3A in motor- and cognitive function[D]. Rotterdam: Erasmus University Rotterdam, 2016: 12.
[34] GIESSEN T W, MARAHIEL M A. Ribosome-independent biosynthesis of biologically active peptides: application of synthetic biology to generate structural diversity[M]. Harvard: Harvard Business School Press, 1990: 2065-2075. DOI:10.1016/j.febslet.2012.01.017.
[35] 庞广昌, 陈庆森, 胡志和, 等. 蛋白质的消化吸收及其功能评述[J].食品科学, 2013, 34(9): 375-391. DOI:10.7506/spkx1002-6630-201309074.
[36] RAHMAN I. Regulation of nuclear factor-κB, activator protein-1, and glutathione levels by tumor necrosis factor-alpha and dexamethasone in alveolar epithelial cells [J]. Biochemical Pharmacology, 2000, 60(8): 1041-1049. DOI:10.1016/S0006-2952(00) 00392-0.
[37] FRATERNALE A, CRINELLI R, CASABIANCA A, et al. Molecules altering the intracellular thiol content modulate NF-κB and STAT-1/ IRF-1 signalling pathways and IL-12 p40 and IL-27 p28 production in murine macrophages[J]. PLoS ONE, 2013, 8(3): e57866.DOI:10.1371/ journal.pone.0057866.
[38] GAO Y, LECKER S, POST M J, et al. Inhibition of ubiquitin-proteasome pathway-mediated IκBα degradation by a naturally occurring antibacterial peptide[J]. Journal of Clinical Investigation, 2000, 106(106): 439-448. DOI:10.1172/JCI9826.
[39] KRAPPMANN D, SCHEIDEREIT C. A pervasive role of ubiquitin conjugation in activation and termination of IκB kinase pathways[J]. Embo Reports, 2005, 6(4): 321-326. DOI:10.1038/sj.embor.7400380.
[40] MARGOTTIN F, BOUR S P, DURAND H, et al. A novel human WD protein, h-βTrCP, that interacts with HIV-1 Vpu connects CD4 to the ER degradation pathway through an F-Box motif[J]. Molecular Cell, 1998, 1(4): 565-574. DOI:10.1016/S1097-2765(00)800 56-8.
Regulatory Effect of Milk-Derived Casein Glycomacropeptide on Key Enzymes Involved in NF-κB Signaling Pathway
WANG Yong, GONG Jianmiao, JIA Yan, ZHAO Pei, PANG Guangchang, YAN Yali*, CHEN Qingsen*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin Un iversity of Commerce, Tianjin 300134, China)
Abstract:This study was undertaken to determine the effect of casein glycomacropeptide (CGMP) on the p65 subunit of nuclear factor-κB (NF-κB) of HT-29 human colon cancer cells challenged with lipopolysaccharide (LPS). Furthermore, Western blotting technology was used to detect and compared the expression levels of the key proteins involved in the NF-κB signaling pathway such as IκBα, p-IκBα, E3RSIκB and UBC5 in the control group, milk-derived CGMP group and LPS group to uncover the molecular mechanism of CGMP in regulating the NF-κB signaling pathway. The results showed that all three doses of CGMP (0.001, 0.010 and 0.100 μg/mL) could suppress the degradation of IκBα in some degree, which is involved in the NF-κB signaling pathway of HT-29 cells challenged with LPS and this effect was more significant at the dose of 0.100 μg/mL, which was significantly different when compared with the control group (P < 0.01). Therefore, it was confi rmed that CGMP could suppress the degradation of IκBα by repressing the expression of p-IκBα, E3RSIκB and UBC5, thereby inhibiting the activation of the NF-κB signaling pathway. As a result, CGMP can signifi cantly reduce the degradation of IκBα in the NF-κB signal pathway, increase the amount of protein trimer-IκBα-p65-p50 and decrease nuclear translocation of p65 and downstream gene expression by inhibiting the phosphorylation and ubiquitination of IκBα and reducing the expression of p-IκBα and key ubiquitin proteins (E3RSIκB and UBC5). This study illustrates that milk-derived CGMP plays an anti-infi ammatory role by regulating the NF-κB signal pathway.
Key words:casein glycomacropeptide; colon cancer cells (HT-29); nuclear factor-κB; IκBα; ubiquitin-protein ligase subunit
DOI:10.7506/spkx1002-6630-201717005
中图分类号:R151
文献标志码:A
文章编号:1002-6630(2017)17-0026-06引文格式:
收稿日期:2016-09-28
基金项目:国家自然科学基金面上项目(31071522)
作者简介:王泳(1993—),女,硕士研究生,研究方向为发酵生物技术、功能成分与肠道健康的关系。E-mail:15620616749@163.com *通信作者:阎亚丽(1962—),女,副教授,硕士,研究方向为发酵生物技术、微生物学。E-mail:yyali@tjcu.edu.cn陈庆森(1957—),男,教授,博士,研究方向为发酵生物技术、功能成分与肠道健康的关系。E-mail:chqsen@tjcu.edu.cn