张 娜1,郭庆启2,黄文秀3,石彦国1,*
(1.哈尔滨商业大学食品工程学院,黑龙江省食品科学与工程重点实验室,黑龙江 哈尔滨 150076;2.东北林业大学林学院,黑龙江 哈尔滨 150040;3.山东禹王生态食业有限公司,山东 德州 251200)
摘 要:对不同pH值条件下制备的大豆蛋白肽-酪蛋白非磷酸肽组装产物(casein non-phosphopeptides-soybean peptide complex,CNPSPC)的荧光光谱及抗氧化性进行分析。结果表明,随着pH值增加,CNPSPC埋藏在疏水环境中的Trp残基暴露到分子表面的强度逐渐低于组装前的原料蛋白,且Trp残基所处的微环境极性有所降低。硫磺素T荧光光谱分析表明,pH 6.0的制备条件下,CNPSPC荧光强度最大,此时CNPSPC的β-折叠结构含量可能最多。组装改变了CNPSPC的Trp残基在空间结构中所处的微环境,使CNPSPC的分子构象发生改变。与酪蛋白非磷酸肽(casein non-phosphopeptides,CNPP)和大豆蛋白肽(soybean peptide,SP)相比,CNPSPC的抗氧化能力有所提高,在pH 6.0时其清除1,1-二苯基-2-三硝基苯肼自由基、O2-·、·OH能力达到最大,分别提高到组装前大豆蛋白的3.34、1.12 倍和1.08 倍。
关键词:大豆蛋白肽;酪蛋白非磷酸肽;组装;荧光光谱;抗氧化性
张娜, 郭庆启, 黄文秀, 等. 大豆蛋白肽-酪蛋白非磷酸肽组装产物的荧光光谱分析及抗氧化性研究[J]. 食品科学, 2017, 38(17): 42-46. DOI:10.7506/spkx1002-6630-201717008. http://www.spkx.net.cn
ZHANG Na, GUO Qingqi, HUANG Wenxiu, et al. Fluorescence spectral analysis and antioxidant effect of soybean ploypeptide-casein non-phosphorylated peptide assembly[J]. Food Science, 2017, 38(17): 42-46. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717008. http://www.spkx.net.cn
酪蛋白是乳中含量极为丰富的蛋白质,其蛋氨酸的含量约占总酪蛋白的3.26%,这些蛋氨酸主要存在于酪蛋白非磷酸肽(casein non-phosphopeptides,CNPP)部分,每100 g CNPP含蛋氨酸约3.1 g[1]。CNPP是利用酪蛋白工业化生产酪蛋白磷酸肽(casein phosphopeptides,CPP)的副产物,以疏水性氨基酸为主,我国目前有近80%的CNPP没有被合理利用,而是被作为饲料或废物弃去[2]。为提高大豆蛋白的功能性质及抗氧化性,本课题组考虑利用CNPP同大豆蛋白的疏水区域进行温和组装,完善大豆蛋白的营养组成,同时确保其具有良好的功能性质。
荧光光谱通过蛋白质分子中荧光生色基团所处的微环境信息来获得蛋白质结构变化的规律。利用检测蛋白质结构中荧旋光性氨基酸峰位强度的变化,对蛋白质中荧旋光性物质进行定量及定性分析,进而了解蛋白质中重要的氨基酸残基所处的微环境[3-4]。一般来说,天然蛋白质中能够产生荧光的氨基酸残基多分布于蛋白质分子的内部,这种氨基酸残基的极性小于其外部环境的极性。同一种荧光基团所处环境的极性发生改变时,其最大吸收波长也会发生变化[5],由此推断蛋白质分子在各种环境中或者与各种分子作用之后的构象变化,进而了解大分子的结构与功能的关系[6]。该方法具有灵敏度高、选择性强、用样量少、方法简便等优点,在蛋白质的相互作用研究中应用比较广泛[7-8]。因此,通过荧光光谱分析技术对蛋白质或组装产物进行结构分析的研究也日益增多。
目前,对于蛋白质的组装过程、机理和特性表征更多侧重于单一种类的蛋白质的组装过程,仅有少数研究是针对两种异源性蛋白质的自组装[9-11]。组装产物的结构和特性也根据原料的不同而存在明 显差别。因此,本实验利用大豆蛋白和酪蛋白这两种异源性蛋白质制备形成大豆蛋白肽-酪蛋白非磷酸肽组装产物(casein non-phosphopeptides-soybean peptide complex,CNPSPC),并通过研究不同pH值条件下制备的组装体结构及抗氧化性的变化,进而研究pH值对组装产物的影响,为异源蛋白的组装及利用提供参考。
1.1 材料与试剂
酪蛋白 北京奥博星有限公司;大豆分离蛋白哈高科食品有限公司。
碱性蛋白酶(278 000 U/g)、胰凝乳酶(440 000 U/g)、
式中:As为样品溶液的吸光度;Ab为蒸馏水的吸光度。
1.3.3.2 清除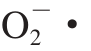 能力测定
能力测定
采用Tang Xueyan等[16]邻苯三酚自氧化方法,在517 nm波长处测定样品溶液吸光度, 清除能力计算如式(2)所示。
清除能力计算如式(2)所示。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
LD4-2A低速离心机 北京医用离心机厂;DHG-9123电热恒温转风干燥箱、HWS24电子分析天平 上海恒科有限公司;UV5100B紫外-可见分光亮度计 上海元析仪器有限公司;XMTD-204数显恒温水浴锅 天津市欧诺仪器仪表有限公司;F-4500荧光分光亮度计 日本日立公司。
1.3 方法
1.3.1 CNPSPC制备
参照黄文秀等[12]的方法进行制备。
1.3.2 CNPSPC荧光光谱分析
1.3.2.1 内源性荧光光谱分析
参照Wang Haidong等[13]方法稍加修改。测定添加与不添加胰凝乳酶情况下,不同pH值(4.0、5.0、6.0、7.0、8.0)条件制备得到的CNPSPC荧光光谱。分别将制备得到的CNPSPC样品溶解于磷酸盐缓冲液(0.01 mol/L,pH 7.0)中,使其质量浓度为0.15 mg/mL。荧光光谱的激发波长为290 nm,发射光谱扫描范围为300~400 nm,激发狭缝和发射狭缝为5 nm。
1.3.2.2 硫磺素T荧光光谱分析
根据Akkermans等[14]方法稍加修改,制备0.8 mg/mL(2.5 mmol/L)的硫磺素T(thioflavin T,ThT)荧光染料储备液,避光保存不超过1 周。分析时将ThT储备液稀释成50 μmol/L的工作液。溶解不同pH值(4.0、5.0、6.0、7.0、8.0)条件下制备得到的CNPSPC样品使其质量浓度为5 mg/mL,通过0.22 μm的滤膜,测定时将40 μL样品溶液与4 mL的ThT工作液混合反应2 min后进行测量。设定仪器的激发波长为440 nm,发射波长扫描范围为450~600 nm,激发狭缝和发射狭缝皆为5 nm。
1.3.3 CNPSPC抗氧化性测定
1.3.3.1 清除DPPH自由基能力测定
参照Nsimba等[15]方法,在517 nm波长处测定样品溶液吸光度,DPPH自由基清除能力计算见式(1)。
式中:A1为样品溶液的吸光度;A2为不加邻苯三酚时溶液的吸光度;A3为不加样品时溶液的吸光度。
1.3.3.3 清除·OH能力测定
参照申衍豪[17]的方法,在517 nm波长处测定样品溶液吸光度,·OH清除能力计算公式如式(3)所示。
式中:A1为样品溶液的吸光度;A2为无显色剂时的吸光度;A3为不加样品时的吸光度。
1.4 数据统计分析
采用Excel 2007和SPSS 17.0软件对数据进行处理、绘图,对结果进行统计、分析。所有实验重复3 次(除另说明),结果表示为±s。对数据进行方差分析(ANOVA)分析和最小显著差异(LSD)实验。显著性水平设定为P<0.05。
2.1 荧光光谱结果分析
2.1.1 内源性荧光光谱分析
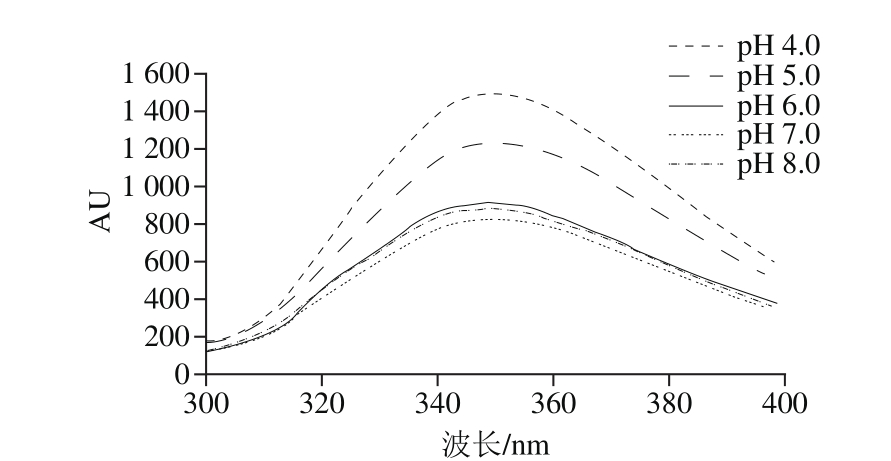
图 1 不同pH值下制备得到的CNPSPC荧光光谱图
Fig. 1 Fluorescence spectra of CNPSPC obtained at different pH values
荧光光谱中的最大发射波长(λmax)与蛋白中Trp残基所处的微环境有关[18],当λmax在330~332 nm范围内,Trp残基埋藏在非极性区域内;当λmax在340~342 nm范围内,Trp残基固定在蛋白质分子表面,且限制了其与水的接触;当λmax在350~352 nm范围内,Trp残基彻底暴露于极性环境中。不同pH值环境下制备得到的CNPSPC样品中Trp残基荧光强度的变化情况由图1可知,分析结果有两个明显的特征,即荧光强度的变化和λmax的偏移。在组装过程中,不同pH值条件下制备得到的CNPSPC的荧光光谱的形状几乎没有差异,但其λmax及荧光强度有显著变化,随着pH值的增加,最大荧光强度和λmax呈显著逐渐降低趋势。CNPSPC的λmax随着制备pH值的增加而发生蓝移,这表明CNPSPC的三级结构发生了一定变化,原来处于CNPSPC分子外部极性环境中的Trp残基逐渐向其分子内部非极性环境中转移,且其所处的微环境极性有所降低,内部拥有更多的疏水性官能团,使其的三级结构更加紧密[19-20]。荧光光谱表明组装改变了芳香氨基酸残基在空间结构中所处的微环境,使大豆分离蛋白的分子构象发生改变,且荧光光谱显示酪蛋白与大豆分离蛋白中Trp残基发生相互作用,使其周围的疏水作用减少。刘薇等[21]也研究证实,蛋白质复合过程中Trp疏水性强弱的变化,可以直接反映微环境中蛋白高级结构的变化。邹承鲁[22]通过荧光光谱研究蛋白质分子构象的变化时发现,λmax的增加导致蛋白质结构进一步伸展,说明这时整体构象发生变化使蛋白质处于整体构象解体的状态,Trp残基逐渐向其分子内部非极性环境中转移,致使位于蛋白质分子表面的色氨酸残基减少,其荧光强度降低。
2.1.2 ThT荧光光谱分析
ThT是一种阳离子的苯并噻唑,可以与蛋白质淀粉样纤维(β-折叠结构)发生高度特异性结合,也是在480 nm波长处附近的荧光强度升高的荧光染料[23]。同时随着β-折叠数量的增加,其荧光强度相应增加,被广泛应用于检测蛋白质聚集体的二级结构研究。通常情况下,ThT的荧光强度与蛋白中β-折叠结构的含量显示出正相关,但其自身不会使蛋白构象发生改变。为考察不同pH值环境下制备得到的CNPSPC中的β-折叠结构含量的变化情况,本研究分别利用在pH 4.0、5.0、6.0、7.0、8.0环境下制备得到的CNPSPC同ThT发生高度特异性结合,并进行荧光光谱测定,结果如图2所示。

图 2 不同pH值下制备得到的CNPSPC的ThT荧光光谱图
Fig. 2 ThT fi uorescence spectra of CNPSPC prepared at different pH values
随着制备pH值的增加,CNPSPC荧光强度出现先增强后减弱的变化规律。pH 6.0制得的CNPSPC荧光强度最大,此时进行CNPSPC组装,得到的CNPSPC的β-折叠结构数量最多。在更高pH值环境下制备的CNPSPC,其荧光强度略有下降。可能是由于制备组装体的pH值由4.0增大到6.0的过程中,CNPSPC聚集成线性纤维聚集体,当pH值由6.0增大到8.0时,CNPSPC由线性聚集向团状聚集转变,从而减小了荧光强度。Khurana等[24]也曾利用ThT荧光强度分析蛋白质纤维化聚集变化规律,发现ThT荧光强度与蛋白质纤维化聚集程度成正比。Akkermans等[14]发现,当pH值超过等电点并不断升高会导致蛋白线性纤维聚集结构发生分裂,变成团状结构,从而减小了与ThT染料的相互作用,导致荧光强度降低。张业辉[25]研究芸豆蛋白纤维状聚集及凝胶机理时,发现当把样品的pH值由2.0调到7.0,其ThT相对荧光强度均发生不同程度的减小。
2.2 CNPSPC抗氧化性分析
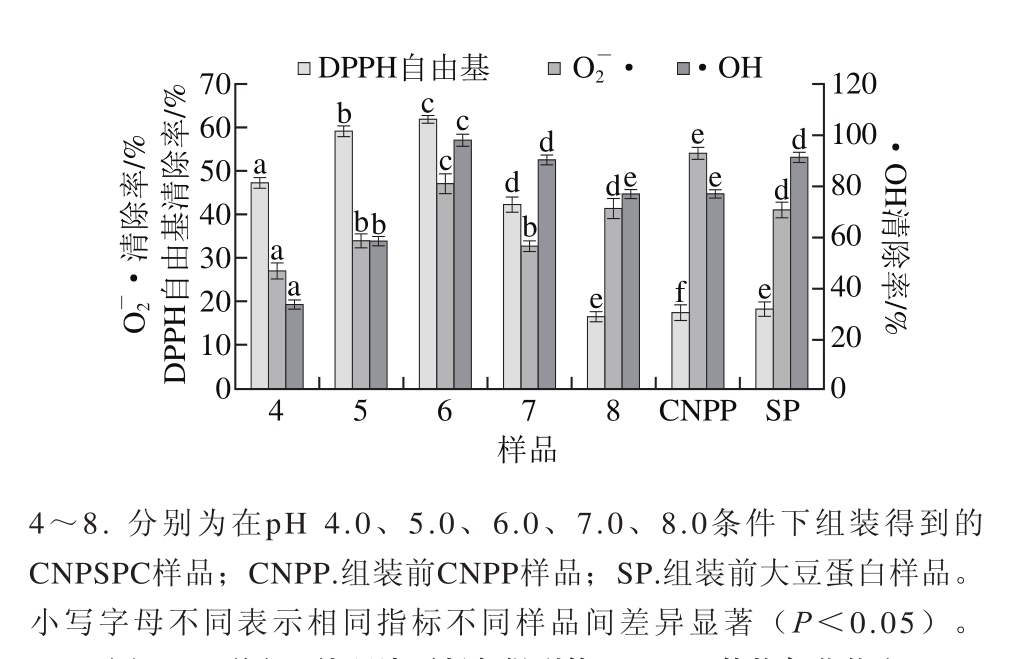
图 3 不同pH值环境下制备得到的CNPSPC的抗氧化能力
Fig. 3 Antioxidant ability of CNPSPC prepared at different pH
由图3可知,与SP相比,在pH值为6.0时进行组装,得到的产物的DPPH自由基、O2-·、•OH清除能力均显著增强(P<0.05)。DPPH自由基、O2-·、•OH清除能力随着pH值的增加,呈先增加后降低趋势,在pH 4.0~6.0范围内,CNPSPC对3 种自由基清除能力升高,而在pH 6.0~8.0范围内则下降,且在pH 6.0时DPPH自由基、O2-·、•OH清除能力最强,分别达(61.70±1.10)%,(46.99±2.30)%和(97.86±1.59)%,清除3 种自由基的能力分别提高到SP的3.34、1.12 倍和1.08 倍。研究表明,蛋白质水解物的组装反应,可以显著改善水解物的抗氧化性质[26]。王晗欣等[27]发现类蛋白组装反应可以显著改善蛋白质水解物的抗氧化性质。Giménez等[28]发现,氨基酸的序列结果对蛋白质抗氧化活性影响较大。岳楠[29]研究了13 种酪蛋白水解物的类蛋白组装反应修饰产物,测定了这些修饰产物的还原能力,•OH清除率和DPPH自由基清除率,并对样品的抗氧化活性进行分析比较。结果表明,与水解物相比,不添加氨基酸的类蛋白修饰产物的DPPH自由基清除能力、还原能力、•OH清除率都得到提高。通过酶的催化作用得到的蛋白质水解物,摆脱不了原料蛋白一级结构的限制,导致其抗氧化活性提高程度受到限制。而组装反应涉及到肽分子之间的缩合作用、转肽作用,也就是可以在肽分子末端连接大片段或疏水性氨基酸残基,所以反应的修饰产物,可以导致某些分子的氨基酸序列发生改变,产生新的肽分子,也就实现了肽分子的结构或氨基酸序列的重新组合,使其生物活性也随之发生变化[29]。Wang Xiansheng等[30]研究显示疏水性氨基酸对抗氧化活性有明显的影响,其疏水性氨基酸含量较高的水解物其DPPH自由基清除率也比较高。本研究中,内源性荧光分析发现,当λmax不断增加时,Trp残基由极性环境逐渐向内部的非极性环境转移。而且,经ThT荧光光谱分析发现,pH 6.0时制备得到的CNPSPC的蛋白线性纤维聚集结构最稳定,此时,CNPSPC清除DPPH自由基、O2-·、•OH能力也最强,这很可能是大豆分离蛋白与酪蛋白之间发生有序而稳定的相互作用,从而引起构象发生改变,使抗氧化能力得到提升。
通过内源荧光光谱结果分析表明,不同pH值条件下制备得到的CNPSPC的内源荧光光谱的形状几乎没有差异,但其λmax及荧光强度有显著变化,随着pH值的增加,最大荧光强度和λmax呈显著逐渐降低趋势。由于原来处于CNPSPC分子外部的极性环境中的Trp残基逐渐向CNPSPC分子内部非极性环境中转移,所以Trp残基所处的微环境极性有所降低。通过对ThT外源荧光测定结果表明:随着制备pH值的增加,CNPSPC荧光强度出现先增强后减弱的变化趋势,且在pH 6.0条件下制备的CNPSPC荧光强度最大,与CNPP和SP相比,CNPSPC的抗氧化能力都有所提高,说明组装后得到的CNPSPC抗氧化能力较高,且随着pH值的增加,其清除DPPH自由基、O2-·、·OH能力均呈现先增加后降低趋势,且皆在
pH 6.0时达到最大。
参考文献:
[1] 唐传核, 杨晓泉, 陈中, 等. 微生物转谷氨酰胺酶的蛋白质底物催化特性及其催化机理研究(Ⅲ)MTGase催化多底物蛋白的聚合特性[J]. 食品科学, 2003, 24(7): 26-32. DOI:10.3321/ j.issn:1002-6630.2003.07.002.
[2] COSMIN M B, CAMEN I M. The effect of protein concentration and heat treatment temperature on micellar casein soy protein mixtures[J]. Food Hydrocolloids, 2011, 25(6): 1448-1460. DOI:10.1016/ j.foodhyd.2011.01.011.
[3] 尹燕霞, 向本琼, 佟丽. 荧光光谱法在蛋白质研究中的应用[J].实验技术与管理, 2010, 27(2): 33-36; 40. DOI:10.3969/ j.issn.1002-4956.2010.02.011.
[4] 周志红, 唐传核, 杨晓泉. 大豆蛋白的体外模拟消化过程及热处理的影响[J]. 食品科学, 2006, 27(1): 37-40. DOI:10.3321/ j.issn:1002-6630.2006.01.003.
[5] 杨同香, 陈俊亮, 吴孔阳, 等. 水牛奶酪蛋白胶束结构的荧光光谱研究[J]. 食品科学, 2014, 35(23): 84-87. DOI:10.7506/spkx1002-6630-201423017.
[6] 刘永春, 胡之德. 药物与蛋白质相互作用的荧光光谱法研究概述[J].宝鸡文理学院学报(自然科学版), 2005, 25(1): 42-49. DOI:10.3969/ j.issn.1007-1261.2005.01.014.
[7] LIN X, LI W, YE C, et al. Study on the mechanism of interaction between tubeimoside I and human serum albumin at different temperatures by three-dimensional fluorescence spectrum[J]. International Journal of Thermophysics, 2014, 36(5/6): 1-5. DOI:10.1007/s10765-014-1657-6.
[8] 刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J].食品科学, 2015, 36(17): 43-47. DOI:10.7506/spkx1002-6630-201517009.
[9] TAO K, WANG J, ZHOU P, et al. Self-assembly of short Aβ (16-22) peptides: the effect of terminal capping and the role of electrostatic interaction[J]. Langmuir, 2011, 27(6): 2723-2730. DOI:10.1021/ la1034273.
[10] 徐小丁, 陈昌盛, 程荆晓, 等. 多肽分子自组装[J]. 中国科学: 化学, 2011, 41(2): 221-238. DOI:10.1360/032010-782.
[11] BELLINGHAN C M, WOODHOUSE K A, ROBSON P, et al. Self-aggregation characteristics of recombinantly expressed human elastin polypeptides[J]. Biochimica et Biophysica Acta, 2001, 1550(1): 6-19.
[12] 黄文秀, 郭庆启, 石彦国, 等. 酪蛋白非磷酸肽对大豆多肽的修饰及复合物的乳化性表征[J]. 食品科学, 2014, 35(9):157-161. DOI:10.7506/spkx1002-6630-201409032.
[13] WANG Haidong, NIU C H, YANG Qiaoqin, et al. Study on protein conformation and adsorption behaviors in nanodiamond particleprotein complexes[J]. Nanotechnology, 2011, 22(14): 145703. DOI:10.1088/0957-4484/22/14/145703.
[14] AKKEMANS C, VENEM P, VAN DER GOOT A J, et al. Peptides are building blocks of heat induced fi brillar protein aggregates of β-lactoglobulin formed at pH 2[J]. Biomacromolecules, 2008, 9(5): 1474-1479. DOI:10.1021/bm7014224.
[15] NSIMBA R Y, KIKUZAKI H, KONISHI Y. Antioxidant activity of various extracts and fractions of Chenopodium quinoa, and Amaranthus spp. seeds[J]. Food Chemistry, 2008, 106(2): 760-766. DOI:10.1016/j.foodchem.2007.06.004.
[16] TANG Xueyan, HE Zhiyong, DAI Yangfeng, et al. Peptide fractionation and free radical scavenging activity of zein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 587-593. DOI:10.1021/jf9028656.
[17] 申衍豪. 大米抗氧化活性肽的分离纯化和性质研究[D]. 长沙: 中南林业科技大学, 2011: 15-16. DOI:10.7666/d.Y1913452.
[18] VIVIAN J T, CALLIS P R. Mechanisms of tryptophan fi uorescence shifts in proteins[J]. Biophysical Journal, 2001, 80(5): 2093-2109. DOI:10.1016/S0006-3495(01)76183-8.
[19] 张蕊, 吴超仪, 刘宇, 等. 分子对接和荧光光谱法研究麦角甾醇与牛血清白蛋白的相互作用[J]. 食品科学, 2015, 36(23): 38-42. DOI:10.7506/spkx1002-6630-201523008.
[20] WANG Y Q, ZHANG H M, ZHANG G C, et al. Fluorescence spectroscopic investigation of the interaction between benzidine and bovine hemoglobin[J]. Journal of Molecular Structure, 2008, 886(1/2/3): 77-84. DOI:10.1016/j.molstruc.2007.10.039.
[21] 刘微, 李萌, 任皓威, 等. 荧光、紫外和红外光谱分析人乳和牛乳β-酪蛋白的功能和构象差异[J]. 光谱学与光谱分析, 2014(12): 3281-3287. DOI:10.3964/j.issn.1000-0593(2014)12-3281-07.
[22] 邹承鲁. 酶学研究的现状与展望[J]. 中国生物化学与分子学报, 1999, 15(3): 351-354. DOI:10.3969/j.issn.1002-4433.2001.09.014.
[23] NAIKI H, HIGUCHI K, MATSUSHIMA K, et al. Fluorometric examination of tissue amyloid fi brils in murine senile amyloidosis: use of the fi urescent indicator, thiofi avine T[J]. Lab Invest, 1990, 62(6): 768-773.
[24] KHURANA R, COLEMAN C, IONESCU-ZANETTI C, et al. Mechanism of thioflavin T binding to amyloid fibrils[J]. Journal of Structural Biology, 2005, 151(3): 229. DOI:10.1016/j.jsb.2005.06.006.
[25] 张业辉. 芸豆蛋白纤维状聚集及凝胶机理研究[D]. 广州: 华南理工大学, 2010: 76-96.
[26] ZHAO X H, WU D, LI T J. Preparation and the radical scavenging activity ofpapain-catalyzed casein plasteins[J]. Dairy Science and Technology, 2010, 90(5): 521-535. DOI:10.1051/dst/2009054.
[27] 王晗欣, 杜双奎, 赵艳, 等. 鹰嘴豆蛋白水解物类蛋白反应修饰与抗氧化活性研究[J]. 中国食品学报, 2015, 15(1): 34-40. DOI:10.16429/ j.1009-7848.2015.01.006.
[28] GIMÉNEZ B, PÉREZ-SANTIN E, GÓMEZ-GUILLÉN M C, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry, 2012, 125(2): 334-341. DOI:10.1016/j.foodchem.2010.08.058.
[29] 岳楠. 两种氨基酸添加下酪蛋白类蛋白物的抗氧化活性研究[D]. 哈尔滨: 东北农业大学, 2012: 18-30.
[30] WANG Xiansheng, TANG Chuanhe, CHEN Ling, et al. Characterization and antioxidant properties of hemp protein hydrolysates obtained with neutrase[J]. Food Technology and Biotechnology, 2009, 47(4): 428-434.
Fluorescence Spectral Analysis and Antioxidant Effect of Soybean Ploypeptide-Casein Non-Phosphorylated Peptide Assembly
ZHANG Na1, GUO Qingqi2, HUANG Wenxiu3, SHI Yanguo1,*
(1. Key Laboratory of Food Science and Engineering of Heilongjiang Province, School of Food Engineering, Harbin University of Commerce, Harbin 150076, China; 2. School of Forestry, Northeast Forestry University, Harbin 150040, China; 3. Shandong Yuwang Ecological Food Industry Co. Ltd., Dezhou 251200, China)
Abstract:The fluorescence spectra and antioxidant properties of casein non-phosphopeptides-soybean peptide complex (CNPSPC) prepared under different pH conditions were analyzed. The results showed that with the increase of pH, the content of surface-exposed Trp residues buried in hydrophobic environment in CNPSPC was became lower than in the raw protein, and the microenvironment polarity of Trp residues was decreased. The results of thiofi avin T (ThT) fi uorescence assay showed that the fluorescence intensity of CNPSPC was maximum at pH 6.0, which represented β-sheet was the dominant secondary structure of CNPSPC. The microenvironment of Trp residues was changed by the assembly, thereby changing the molecular conformation of CNPSPC. Compared with casein non-phosphopeptides (CNPP) and soybean peptide (SP), the antioxidant capacity of CNPSPC was improved. The scavenging activities of CNPSPC against 1,1-diphenyl-2-picrylhydrazyl (DPPH), superoxide anion and hydrolxyl radicals were maximum at pH 6.0, which increased by 3.34, 1.12 and 1.08 times compared to soybean protein respectively.
Key words:soybean polypeptide; casein non-phosphorylated peptide; assembly; fi uorescence spectrum; antioxidant activity
DOI:10.7506/spkx1002-6630-201717008
中图分类号:TS 201.2
文献标志码:A
文章编号:1002-6630(2017)17-0042-05引文格式:
收稿日期:2016-06-09
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0400400);黑龙江省博士后科研启动项目(LBH-Q15073);哈尔滨市科技局科技创新人才研究专项资金项目(2016RAQXJ146);中国食品科学技术学会食品科技基金项目(2016-002);国家自然科学基金青年科学基金项目(31301602);黑龙江省应用技术研究与开发计划项目(GC13B215;GA14B201)
作者简介:张娜(1979—),女,教授,博士,研究方向为食品安全与食品化学。E-mail:foodzhangna@163.com
*通信作者:石彦国(1960—),男,教授,硕士,研究方向为大豆科学。E-mail:yanguosh@163.com