表 1 不同饲养方式下牦牛源沙门氏菌检出率
Table 1 Detection rates of Salmonella in yaks with different feeding regimens
注:-.未检出。下同。
柏 雪1,文勇立2,刘少文1,陈 宇1,钟金城2,王 永2,郭春华1,*
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.西南民族大学,青藏高原研究院,四川 成都 610041)
摘 要:肉中的致病微生物污染是危害人类健康的重要因素。本研究采集了青藏高原部分地区无腹泻症状的放牧型牦牛样品155 份,舍饲育肥型牦牛样品122 份,对其粪便及各组织中沙门氏菌、大肠菌群、金黄色葡萄球菌和单增李斯特菌进行分离,并对沙门氏菌进行血清学鉴定和抗生素药敏实验。结果发现,2 种饲养方式下,牦牛组织病原微生物携带率统计学上无显著差异(P>0.05),但放牧型牦牛的检出率绝对值都略高于舍饲育肥型牦牛;2 种不同饲养方式的牦牛样品中分离出的沙门氏菌血清型差异较大,舍饲育肥型和放牧型牦牛肌肉中检出的血清型分别为纽波特沙门氏杆菌和肠炎沙门氏杆菌,放牧型牦牛粪便中的沙门氏菌为鼠伤寒沙门氏杆菌、肠炎沙门氏杆菌和圣保罗沙门氏菌,而舍饲育肥型牦牛仅有都柏林沙门氏菌;舍饲育肥型和放牧型牦牛源沙门氏菌对抗生素耐药性规律基本一致,对林可霉素(83.33%、81.82%)、四环素(66.67%、63.64%)和麦迪霉素(66.67%、72.73%)具有较高的耐药性。从实验结果可以得出,放牧型牦牛的微生物安全性和舍饲育肥型牦牛一致,沙门氏菌对抗生素的耐药性都较为严重。
关键词:牦牛;饲养方式;沙门氏菌;大肠菌群;金黄色葡萄球菌;单增李斯特菌
柏雪, 文勇立, 刘少文, 等. 青藏高原部分地区自由放牧与舍饲育肥耗牛食源性致病微生物污染的差异[J]. 食品科学, 2017, 38(17): 66-71. DOI:10.7506/spkx1002-6630-201717012. http://www.spkx.net.cn
BAI Xue, WEN Yongli, LIU Shaowen, et al. Differentiation of foodborne pathogenic contamination of muscle and visceral tissues between free grazing and stall-fed fattening yaks from some areas of Qinghai-Tibetan plateau[J]. Food Science, 2017, 3 8(17): 66-71. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717012. http://www.spkx.net.cn
牦牛是青藏高原山脉附近的特有牲畜,中国现有牦牛1400多万头,约占世界牦牛总数的95%以上[1]。牦牛是牧民赖以生存的资源[2],也是我国畜牧业中不可缺少的畜种之一。由于牦牛肉“天然、绿色”的特点,牦牛肉制品如牦牛肉干、牦牛肉酱等受到了消费者的追捧。随着现代冷链物流的发展,近几年新鲜牦牛肉的需求量也日趋上升,但牦牛肉及其制品中的食源性致病微生物污染却不可小觑。胡萍等[3]报道天祝白牦牛乳中金黄色葡萄球菌的检出率为26.67%,牦牛肉干中金黄色葡萄球菌检出率为14.70%;孔雪英等[4]在新鲜牦牛肉中检出了致病性沙门氏菌。青藏高原海拔高、沸点低,特别是牧民又有生吃牦牛肉的饮食传统,肉品中的食源性致病微生物给牧民与消费者健康带来极大的风险[5]。羊云飞[6]研究发现四川甘孜色达藏区牦牛源与牧民源的大肠杆菌进化树接近,并存在耐药性的传递。
目前牦牛的养殖仍以传统饲养方式为主,即全天然散养[7]。在这种完全自由的放牧状态下,牦牛没有经过规范的防疫与饲养管理,自身的健康风险较大[7-8]。王慧玲等[9]对甘南州放牧犊牦牛进行病原菌调查,发现沙门氏菌感染率达13.5%。关伏龙等[10]研究表明,健康放牧牦牛肠系膜淋巴结沙门氏菌检出率为6.7%。其次,我国青藏高原地区牦牛屠宰尚处在较原始的阶段,部分牧民选择在草地就地屠宰,食源性病原微生物通过食物链进入人体的机率大大增加。近几年在克服了牦牛半野生的驯化和饲料的适应等困难之后,也逐渐兴起了舍饲饲养方式。本研究团队和其他研究者发现,经过舍饲育肥之后,牦牛肉的产量和品质得到了较大的提高[11]。然而对于牦牛来讲,这种新兴的舍饲集中饲养是否存在潜在的食品安全威胁,目前尚无定论。
本研究通过舍饲的方式对适宜体质量牦牛进行育肥,采集其新鲜粪便与肉样,并同时采集自由放牧的同品种牦牛样品,采用常规沙门氏菌、大肠菌群、金色葡萄球菌和单增李斯特菌国标分离技术对样品进行菌株分离,并对沙门氏菌进行血清学鉴定和耐药性实验,研究舍饲育肥与放牧饲养方式对牦牛自身沙门氏菌携带率及牦牛肉、肝脏等产品安全的影响,为保障牦牛肉的食品安全和公共安全提供依据。
1.1 材料与试剂
麦洼公牦牛 四川省阿坝藏族羌族自治州小金县和汶川县。
浓缩料 四川新通达饲料有限公司;伊维菌素四川显华动物药业有限公司;缓冲蛋白胨水、亚硒酸盐胱氨酸增菌液、亚硫酸铋琼脂、木糖赖氨酸脱氧胆盐琼脂、沙门氏菌-志贺氏菌琼脂培养基、大肠杆菌分离培养基、金色葡萄球菌分离培养基、单增李斯特菌分离培养基、头孢噻肟(10 μg/片)、氨苄西林(10 μg/片)、头孢拉定(30 μg/片)、头孢曲松(10 μg/片)、链霉素(10 μg/片)、庆大霉素(10 μg/片)、万古霉素(30 μg/片)、卡那霉素(30 μg/片)、四环素(30 μg/片)、氯霉素(30 μg/片)、林可霉素(2 μg/片)、左氧氟沙星(5 μg/片)、环丙沙星(5 μg/片)、吡哌酸(30 μg/片)、麦迪霉素(30 μg/片)、乙酰螺旋霉素(30 μg/片)和罗红霉素(15 μg/片)药敏试纸片 杭州微生物试剂有限公司;沙门氏菌属诊断血清 宁波天润生物药业有限公司。其他化学试剂均为国产分析纯。
1.2 仪器与设备
SYQ-DSX-280B手提式不锈钢压力蒸汽灭菌锅上海申安医疗器械厂;THZ-98C恒温振荡培养箱 上海科学仪器有限公司;SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司。
1.3 方法
1.3.1 动物饲养
2015年8月—2015年12月,分别在四川省阿坝藏族羌族自治州小金县和汶川县(海拔2 000~3 000 m)进行牦牛舍饲育肥实验。选取体质量在160~180 kg的麦洼公牦牛(小金县35 头、汶川县40 头),采用分栏栓系饲养,每头牦牛占圈舍面积约为2.5 m2。牦牛进场前对圈舍进行彻底消毒,进场后立即注射伊维菌素驱虫。自由饮水,每日定时饲喂2 次(8:00和16:00),粗料自由采食(玉米秸秆和青干草),精料占牦牛体质量的1.3%。精料日粮组成为60%玉米,40%浓缩料,参照NY/T 815—2004《肉牛饲养标准》[12]添加维生素、矿物质元素、磷酸氢钙和碳酸氢钠等添加剂。舍饲饲喂期间禁止使用任何抗生素。舍饲育肥100 d后出栏,出栏体质量为240~260 kg。
放牧牦牛在天然草原(海拔3 000~4 000 m)自由采食新鲜青草并饮水,不补饲,每日晚间归牧。
1.3.2 样品选择
在舍饲育肥实验结束时,随机屠宰牦牛33 头(小金县15 头、汶川县18 头)。于屠宰前采集牦牛新鲜无污染的粪便样品33 份,屠宰后立即采集肌肉33 份、肝脏28 份、肠系膜淋巴结30 份和心肌31 份样品,放入无菌封样袋内,-4 ℃保存,立即送回实验室检测样品病原微生物污染情况。同时在当地牦牛屠宰点按上述方法采集放牧牦牛的粪便和各组织样品,其中粪便32 份、肌肉28 份、肝脏22 份、肠系膜淋巴结20 份和心肌20 份样品。
1.3.3 病原微生物检测
参照食品安全国家标准GB 4789.4—2010《食品微生物学检验 沙门氏菌检验》[13]、GB 4789.3—2010《食品微生物学检验 大肠菌群计数》[14]、GB 4789.10—2010《食品微生物学检验 金黄色葡萄球菌检验》[15]和GB 4789.30—2010《食品微生物学检验 单核细胞增生李斯特氏菌检验》[16]分别对样品进行沙门氏菌、大肠菌群、金黄色葡萄球菌和单增李斯特菌进行检测。
1.3.4 药敏实验
采用临床和实验室标准化研究所推荐的琼脂纸片扩散法对样品中的沙门氏菌进行药敏实验[17]。通过测定抑菌圈直径(d)判断耐药情况,即d≤1 cm为耐药;1 cm<d≤1.5 cm为中度敏感;d>1.5 cm为高度敏感。
1.4 数据统计
病原微生物检出率采用两样本百分数差异显著性μ检验进行统计,μ>1.96(即P<0.05)为差异显著。
2.1 牦牛粪便和肉样中沙门氏菌检测结果
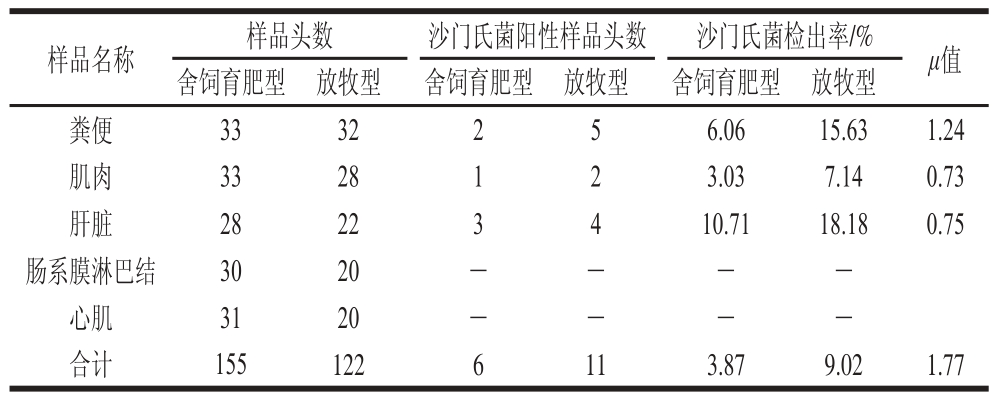
表 1 不同饲养方式下牦牛源沙门氏菌检出率
Table 1 Detection rates of Salmonella in yaks with different feeding regimens

注:-.未检出。下同。
由表1可知,虽然不同饲养方式下牦牛源沙门氏菌检出率在统计学上无显著差异(P>0.05),但检出率的绝对值,放牧型饲养方式牦牛高于舍饲育肥型牦牛,特别是总检出率(放牧型9.02%、舍饲育肥型3.87%),其μ值已接近1.96。不同组织部位,肝脏中沙门氏菌检出率最高,舍饲育肥型和放牧型牦牛分别为10.71%和18.18%;心肌和肠系膜淋巴结中均未检出沙门氏菌;放牧型牦牛的粪便和肌肉中沙门氏菌检出率分别为15.63%和7.14%,约为舍饲育肥型牦牛的2.50 倍。
表 2 不同饲养方式下牦牛源大肠菌群检出率
Table 2 Detection rates of coliform bacteria in yak with different feeding regimens

由表2可知,在各组织的样品中,放牧型牦牛大肠菌群的检出率和舍饲育肥型无显著差异(P>0.05),但放牧型牦牛检出率绝对值均高于舍饲育肥型。其中,粪便、肝脏及肠系膜淋巴结是大肠菌群检出率最高的组织部位。粪便是大肠菌群检出率最高的部位,其次是肝脏,并且,放牧型和舍饲育肥型的耗牛在这两个组织部位中的检出率绝对值相差不大,而放牧型耗牛在肠系膜淋巴结的检出率约为舍饲育肥型耗牛的2.5 倍。
表 3 不同饲养方式下牦牛源金黄色葡萄球菌检出率
Table 3 Detection rates of Staphylococcus aureus in yak with different feeding regimens

由表3可知,在统计学上2 种饲喂方式下,牦牛各部位金黄色葡萄球菌检出率无显著差异(P>0.05)。肌肉是舍饲育肥型牦牛金黄色葡萄球菌检出率最高的部位(9.09%),比放牧型高出1.95%;肠系膜淋巴结是放牧型牦牛检出率最高的部位(15.00%),是舍饲育肥型牦牛的2.5倍(6.67%)。
由表4可知,牦牛源单增李斯特菌仅在粪便和肝脏中检出,其中粪便检出率最高,2 种饲喂方式下牦牛各部位的单增李斯特菌检出率无显著差异(P>0.05)。
表 4 不同饲养方式下牦牛源单增李斯菌特检出率
Table 4 Detection rates of Listeria monocytogenes in yak with different feeding regimens

2.2 沙门氏菌血清型
表 5 沙门氏菌血清型鉴定结果
Table 5 Serotype identifi cation of Salmonella

表5为牦牛粪便与组织分离得到的沙门氏菌血清型鉴定结果。牦牛样品中总共分离得到17 株沙门氏菌和5 种血清型,分别是都柏林沙门氏菌(S. dublin)、纽波特沙门氏杆菌(S. newport)、肠炎沙门氏杆菌(S. enteritidis)、圣保罗沙门氏菌(S. saintpaul)、鼠伤寒沙门氏杆菌(S. typhimurium)。这5 种血清型中肠炎沙门氏菌检出数量最高,占总菌株数的47.06%;其次为都柏林沙门氏菌,占总菌株数23.53%;纽波特沙门氏杆菌检出数最少,仅有1 株(5.88%)。舍饲育肥型和放牧型牦牛样品中也都是肠炎沙门氏菌检出数量最高,分别占总菌株数的33.33%和54.55%。
舍饲育肥型和放牧型牦牛不同种类样品中分离到的沙门氏菌血清型差异较大,其中放牧型粪便中检出的沙门氏菌为鼠伤寒沙门氏杆菌、肠炎沙门氏杆菌和圣保罗沙门氏菌这3 种血清型,而舍饲育肥型牦牛粪便中仅检出都柏林沙门氏菌;舍饲育肥型和放牧型牦牛肌肉中分别检测到的血清型为纽波特沙门氏杆菌和肠炎沙门氏杆菌;舍饲育肥型和放牧型牦牛肝脏共同检测出肠炎沙门氏杆菌。
2.3 沙门氏菌药敏实验结果
从表6可以看出,2 种饲养方式的牦牛源沙门氏菌对抗生素的耐药规律基本一致。无论是舍饲育肥型牦牛源还是放牧型牦牛源的沙门氏菌,对4 种β-内酰胺类抗生素耐药率较低;在氨基糖苷类抗生素中,对卡那霉素和链霉素耐药率为0.00%,对庆大霉素和万古霉素耐药性较强,且舍饲育肥型比放牧型略高;对喹诺酮类抗生素耐药性较弱,舍饲育肥略低于自由放牧;在大环内酯类抗生素中,对麦迪霉素耐药性较高(66.67%和72.73%),对乙酰螺旋霉素耐药性中等;对四环素和林可霉素均表现出高度耐药性,舍饲育肥型和放牧型对沙门氏菌的耐药率分别为:对四环素66.67%和63.64%、对林可霉素83.33%和81.82%;对氯霉素的耐药性中等。
表 6 沙门氏菌药敏实验结果
Table 6 Drug sensitivity of Salmonella isolates

3.1 饲养方式对牦牛源病原微生物的影响
牦牛肉是青藏高原人民主要的肉类消费品,也是我国牛肉产品中重要的组成,牦牛肉的微生物安全对牧民的身体健康和牦牛肉产业的发展十分重要。本研究中放牧型牦牛粪便的沙门氏菌检出率与储倩等[18]的报道接近,比陈朝喜等[19]的报道低,这可能和牦牛自身健康状况、采样地点、采样季节不同有关;大肠杆菌的检出率与羊云飞[6]的研究结果保持一致;放牧型牦牛肌肉中未检测出单增李斯特菌,与高媛等[20]研究结果一致;放牧牦牛肌肉中金黄色葡萄球菌检出率低于胡萍等[3]对甘肃白牦牛的研究,高于高媛等[20]研究,这可能和采样地区与样品新鲜度的差异有关。
目前,国内有关饲养方式与青藏高原牦牛携带各种病原微生物间的关系罕见报道。本研究中放牧型牦牛粪便中所有食源性病原微生物的携带率都高于舍饲育肥型牦牛,说明放牧型牦牛自身更易感染病原微生物,这可能与牦牛自身的健康状态有关。由于青藏高原冷暖季极为分明,冷季气候寒冷、牧草缺乏,在不补饲的情况下,放牧型的牦牛在冷季只能依靠分解自身脂肪和蛋白勉强过冬,长期以来处于“夏壮、秋肥、冬瘦、春死”的恶性循环之中[7-8],王亚明[21]报道在冷季牦牛体质量平均下降可达44 kg,平均体质量减少24.4%;而舍饲饲养的牦牛经过科学饲养管理和日粮搭配,体质增强,研究报道经舍饲育肥的牦牛其血液中免疫球蛋白含量、总蛋白含量等显著上升,机体对病原菌的抵抗能力加强[22-23]。另一方面,放牧型牦牛暴露在草场上,粪便和变质腐烂的牧草都可能构成牦牛暴露病原菌下的潜在因素,这也是牦牛乳房炎和腹泻发病重要原因之一[24];而舍饲饲养方式之下,粪便进行了无害化处理,牦牛携带病原微生物的机率大大降低。本实验在采样过程中发现放牧型牦牛半数以上瘤胃内壁发现有大量的吸虫附着,这和蔡进忠等[25]对牦牛寄生虫病的流行病学调查结果吻合;而舍饲育肥型牦牛在进场初期进行了驱虫处理,屠宰后眼观未发现寄生虫。
自身携带病原微生物越高的牦牛,其畜产品安全性可能越差。本研究发现,除金色葡萄球菌以外,放牧型牦牛的肝脏、肌肉中病原微生物检出率均比舍饲育肥型牦牛高,这和其粪便中的检出率结果相一致。饲养方式影响畜产品安全的另一个重要原因是屠宰模式。虽然国家也在逐步规范动物的屠宰,但由于青藏高原条件有限和各种原因,大部分的牦牛并未进行宰前宰后检疫,胴体清洗粗糙。周玉春等[26]研究报道牦牛屠宰前环境污染最严重,胴体随着剥皮、劈半和分割的进行,菌落总数和大肠杆菌显著增加。本研究采集的舍饲育肥型牦牛样品都是在固定屠宰点自行屠宰采样,严格遵从了宰前清洗等必要消毒流程。虽然这样,但屠宰条件仍然简陋,这也是其病原微生物检出率高于内地肉牛的重要原因。
3.2 青藏高原牦牛的放牧方式与其携带沙门氏菌血清型间的关系
沙门氏菌在自然界分布极广,且种类繁多。目前全世界已分离得到的沙门氏菌血清型多达2 500多种[27]。其中,在我国青藏高原放牧家畜中就已经分离到数百种沙门氏菌,对牦牛肉的食品安全已构成不可小觑的威胁[28]。本研究发现肠炎沙门氏菌和都柏林沙门氏菌是牦牛主要携带的沙门氏菌血清型,这和詹发茂[29]在甘肃省天祝县对副伤寒牦牛和董映辉等[30]在甘孜藏族自治州对腹泻牦牛的结果一致,也和张斌等[31]在青藏高原部分地区对健康牦牛粪便沙门氏菌血清型的调查结果一致。从饲养方式来看,本研究发现放牧型粪便中分离到的沙门氏菌血清型种类多于舍饲育肥型,可能是牦牛在自由放牧时接触环境复杂,携带微生物多样性的可能变大,而舍饲育肥饲养时环境相对固定,外源微生物丰度降低。
3.3 青藏高 原牦牛的放牧方式与其携带沙门氏菌耐药性间的关系
本研究中的牦牛源沙门氏菌对抗生素的耐药性与其他学者的报道有一定差异。陈朝喜等[19]报道腹泻牦牛粪便中分离出的沙门氏菌对抗生素耐药性大体上高于本研究结果,这可能与采样牦牛的健康状态有关。而储倩等[18]2011年报道川西北高原健康牦牛粪便中的沙门氏菌对氯霉素、四环素、氨苄青霉素和阿莫西林等14 种抗生素均无耐药性。而本研究发现沙门氏菌对四环素、林可霉素和麦迪霉素等抗生素的耐药性较前者高。这可能因为随着近几年青藏高原畜牧业的快速扩张和发展,抗生素的滥用情况也变得广泛和频繁,沙门氏菌株的耐药性可能变得更为严重。
本研究发现饲养方式对沙门氏菌的耐药性并无显著的影响,主要原因可能是本研究中的舍饲牦牛是只在育肥期集中饲喂,虽然期间未使用任何抗生素,但舍饲时间相对放牧时间仍然较短,对病原的耐药性影响无法显现。
通过对青藏高原放牧型牦牛和舍饲育肥型牦牛的粪便及各组织部位样品进行食源性病原微生物的研究,发现由于屠宰、检疫等各方面条件有限,2 种饲养方式的牦牛畜产品都存在一定的微生物安全风险,但牦牛在放牧状态下自身的病原携带情况比舍饲牦牛稍严重,其肉类畜产品的质量安全也更具风险。因此,为保障牦牛肉的质量安全,在引进舍饲技术的同时,还需加强屠宰等方面的规范建设。
参考文献:
[1] 钟金城, 赵素君, 陈智华, 等. 牦牛品种的遗传多样性及其分类研究[J]. 中国农业科学, 2006, 39(2): 389-397. DOI:10.3321/ j.issn:0578-1752.2006.02.025.
[2] 黄友鹰. 加速发展中国西部青藏高原牦牛畜产品加工业的探讨及对策[J]. 西南民族大学学报(自然科学版), 2001, 27(2): 221-224. DOI:10.3969/j.issn.1003-2843.2001.02.023.
[3] 胡萍, 苏诚玉, 权玉玲, 等. 天祝白牦牛牛肉和鲜乳中金黄色葡萄球菌及其肠毒素污染的分析研究[J]. 中国卫生检验杂志, 2005, 15(7): 840-841. DOI:10.3969/j.issn.1004-8685.2005.07.034.
[4] 孔雪英, 周晏阳, 罗薇, 等. 33 株牦牛肉源沙门氏菌血清型鉴定及其对小鼠的致病性研究[J]. 黑龙江畜牧兽医, 2016(12): 108-110.
[5] 高媛, 刘菲, 王春晓, 等. 生食牛肉的主要潜在危害与控制措施[J].肉类研究, 2012, 26(10): 30-33.
[6] 羊云飞. 牦牛、牧民源大肠杆菌分离鉴定、耐药基因检测、PFGE分析及耐药性传递的研究[D]. 雅安: 四川农业大学, 2011: 45-60.
[7] 文亚洲, 张掖. 浅谈高寒牧区牦牛的放牧要点[J]. 中国畜禽种业, 2014, 10(9): 70-71.
[8] LONG R J, DING L M, SHANG Z H, et al. The yak grazing system on the Qinghai-Tibetan plateau and its status[J]. Rangeland Journal, 2008, 30(2): 241-246. DOI:10.1071/RJ08012.
[9] 王慧玲, 王志义, 桑吉草. 甘南牦牛犊牛腹泻病因调查及防治[J]. 中国畜禽种业, 2012, 8(4): 96-97. DOI:10.3969/ j.issn.1673-4556.2012.04.076.
[10] 关龙伏, 罗淑贞, 林多杰, 等. 牦牛隐性感染沙门氏菌强度的试验研究[J]. 中国兽医科技, 1985(2): 16-18.
[11] 方雷. 饲养方式对夏季牦牛生长性能、屠宰性能、牛肉品质和瘤胃细菌多样性的影响[D]. 北京: 中国农业大学, 2015: 25-27.
[12] 中国农业科学院畜牧研究所. 肉牛饲养标准: NY/T815—2004[S].北京: 中国农业出版社, 2004.
[13] 卫生部. 食品微生物学检验 沙门氏菌检验: GB 4789.4—2010[S]. 北京: 中国标准出版社, 2010.
[14] 卫生部. 食品微生物学检验 大肠菌群计数: GB 4789.3—2010[S]. 北京: 中国标准出版社, 2010.
[15] 卫生部. 食品微生物学检验 金黄色葡萄球菌检验: GB 4789.10—2010[S]. 北京: 中国标准出版社, 2010.
[16] 卫生部. 食品微生物学检验 单核细胞增生李斯特氏菌检验: GB 4789.30—2010[S]. 北京: 中国标准出版社, 2010.
[17] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing, twentieth informational supplement: M100—S20[S]. Wayne: Clinical and Laboratory Standards Institute, 2010: 40-48.
[18] 储倩, 朱晓霞, 岳华, 等. 川西北牦牛沙门氏菌的健康带菌调查及药敏实验[J]. 四川畜牧兽医, 2011, 38(1): 23-25. DOI:10.3969/ j.issn.1001-8964.2011.01.011.
[19] 陈朝喜, 杜雄伟, 师志海. 不同来源沙门氏菌的分离鉴定及其耐药谱型的比较[J]. 湖北农业科学, 2012, 51(21): 4834-4836. DOI:10.3969/j.issn.0439-8114.2012.21.040.
[20] 高媛, 衣文正, 张荣, 等. 风干牦牛肉品质形成与微生物变化规律研究[J]. 中国农业科技导报, 2013, 15(2): 125-130. DOI:10.3969/ j.issn.1008-0864.2013.02.20.
[21] 王亚明. 成年牦牛体重季节性消长规律的研究[J]. 当代畜牧, 2013(24): 4-5.
[22] 陈光吉, 彭忠利, 宋善丹, 等. 发酵酒糟对舍饲牦牛生产性能、养分表观消化率、瘤胃发酵和血清生化指标的影响[J]. 动物营养学报, 2015, 27(9): 2920-2927. DOI:10.3969/j.issn.1006-267x.2015.09.032.
[23] DONG Q M, ZHAO X Q, MA Y S, et al. Live-weight gain, apparent digestibility, and economic benefi ts of yaks fed different diets during winter on the Tibetan plateau[J]. Livestock Science, 2006, 101(1/2/3): 199-207. DOI:10.1016/j.livprodsci.2005.11.009.
[24] 肖鸿运, 郝葆青, 高闻, 等. 牦牛乳房炎病原菌的快速检测与鉴别研究[J]. 西南民族大学学报(自然科学版), 2008, 34(5): 955-959. DOI:10.3969/j.issn.1003-2843.2008.05.016.
[25] 蔡进忠, 李春花, 雷萌桐, 等. 青海高原牦牛寄生虫病流行病学与防治新技术研究[C]//中国畜牧兽医学会兽医寄生虫学分会学术研讨会. 北京: 中国畜牧兽医学会兽医寄生虫学分会, 2015: 219-220.
[26] 周玉春, 张丽, 孙宝忠, 等. 牦牛屠宰过程中菌落总数和大肠菌群污染状况的分析[J]. 食品工业科技, 2014, 35(11): 147-151. DOI:10.13386/j.issn1002-0306.2014.11.024.
[27] CHIU C H, SU L H, CHU C. Salmonella enterica serotype choleraesuis: epidemiology, pathogenesis, clinical disease and treatment[J]. Clinical Microbiology Reviews, 2004, 17(2): 311-322.
[28] 朱晓霞, 岳华, 汤承. 牦牛源沙门氏菌分离株血清群鉴定及其对小鼠的致病性[C]//第三届全国微生物资源学术暨国家微生物资源平台运行服务研讨会会议论文摘要集. 北京: 中国微生物学会微生物资源专业委员会, 2011.
[29] 詹发茂. 甘肃省天祝县牦牛副伤寒流行病学调查与免疫效果观察[J].中国兽医科技, 1998, 28(5): 33-34.
[30] 董映辉, 张朝辉, 毛全富, 等. 甘孜州牦牛沙门氏菌的分离和鉴定[J]. 四川畜牧兽医, 2011, 38(2): 27-29. DOI:10.3969/ j.issn.1001-8964.2011.02.013.
[31] 张斌, 朱晓霞, 岳华, 等. 青藏高原部分地区牦牛源沙门菌血清型及毒力基因的调查[J]. 畜牧兽医学报, 2013, 44(7): 1167-1172. DOI:10.11843/j.issn.0366-6964.2013.07.024.
Differentiation of Foodborne Pathogenic Contamination of Muscle and Visceral Tissues between Free Grazing and Stall-Fed Fattening Yaks from Some Areas of Qinghai-Tibetan Plateau
BAI Xue1, WEN Yongli2, LIU Shaowen1, CHEN Yu1, ZHONG Jincheng2, WANG Yong2, GUO Chunhua1,*
(1. College of Life Science and Technology, Southwest Minzu University, Chengdu 610041, China; 2. Institute of Qinghai-Tibetan Plateau, Southwest Minzu University, Chengdu 610041, China)
Abstract:Pathogenic microorganisms in meat are one of the most important factors in human food-borne diseases. In the present study, the prevalence of Salmonella, coliform bacteria, Staphylococcus aureus and Listeria monocytogenes in various yak tissues, and the serological identification and antibiotic resistance of Salmonella were investigated. Totally, 277 samples of muscle and visceral tissues from yaks in Northwest Sichuan plateau were collected including 155 samples from free grazing yaks and 122 samples from stall-fed fattening yaks both without diarrhea symptoms. The results showed that no significant difference in the carrier rate of pathogenic microorganisms in various yak tissues was between two feeding regimens (P > 0.05), but the absolute value of detection rate in free grazing yak was higher than that in stall-fed fattening yak. Different Salmonella serotypes were isolated from yak tissue samples from two different feeding systems. The Salmonella serotypes isolated from stall-fed fattening and grazing yak muscle were S. newport and S. enteritidis, respectively. The Salmonella serotypes isolated from fecal samples of grazing yak were S. typhimurium, S. enteritidis and S. saintpaul, while only S. dublin was isolated from fecal samples of stall-fed fattening yaks. The feeding regimens had no effect on the antibiotic resistance of Salmonella isolated from yaks, and the Salmonella isolated from stall-fed and free grazing yaks showed high resistance to lincomycin (83.33% and 81.82%), tetracycline (66.67% and 63.64%), and midecamycin (66.67% and 72.73%). Overall, the microbiological safety of yaks was identical between two feeding regimens, and the antibiotic resistance of Salmonella isolated from the yaks was high.
Key words:yak; feeding regimens; Salmonella; coliform bacteria; Staphylococcus aureus; Listeria monocytogenes
DOI:10.7506/spkx1002-6630-201717012
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2017)17-0066-06引文格式:
收稿日期:2016-08-31
基金项目:“十二五”国家科技支撑计划项目(2014BAD13B03);四川省阿坝州应用技术研究与开发项目
作者简介:柏雪(1985—),女,实验师,硕士,研究方向为饲料及畜产品安全。E-mail:yukivy@163.com
*通信作者:郭春华(1957—),女,教授,博士,研究方向为反刍动物营养。E-mail:531893818@qq.com