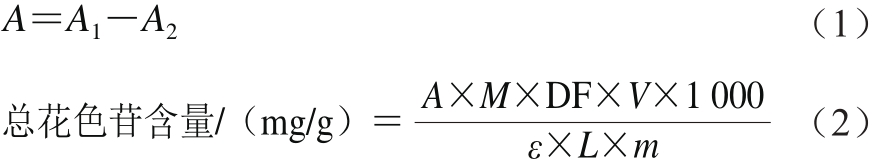
樊梓鸾,陈凯莉,柳雅馨,杨蕾玉,付玉杰*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
摘 要:以矮丛红豆越橘为研究对象,用体积分数95%乙醇提取后,分别用石油醚、乙酸乙酯、正丁醇进行萃取,评价乙醇粗提取物和不同溶剂萃取物中总酚、总黄酮、总花色苷、齐墩果酸含量及体外抗氧化能力(1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2 -联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基(2,2 -azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS+·)清除能力)。红豆越橘粗提取物及不同溶剂萃取物均具有一定的抗氧化活性,其中乙酸乙酯、正丁醇萃取物的抗氧化活性较强,乙酸乙酯萃取物具有最好的DPPH自由基清除能力(半抑制浓度(50% inhibitory concentration,IC50)为0.27 mg/mL)与ABTS+•清除能力(IC50为0.05 mg/mL)。不同溶剂萃取物的抗氧化活性与总黄酮和总酚的含量具有较强的相关性。
关键词:红豆越橘;抗氧化;总酚;总黄酮;总花色苷;齐墩果酸
樊梓鸾, 陈凯莉, 柳雅馨, 等. 红豆越橘不同溶剂萃取物组成及抗氧化相关性[J]. 食品科学, 2017, 38(17): 138-144. DOI:10.7506/spkx1002-6630-201717023. http://www.spkx.net.cn
FAN Ziluan, CHEN Kaili, LIU Yaxin, et al. Correlation between antioxidant activity in vitro and active components of different solvent extracts from lingonberry[J]. Food Science, 2017, 38(17): 138-144. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717023. http://www.spkx.net.cn
自由基会诱发脂质、蛋白质及DNA的氧化,而抗氧化剂的重要功能之一是清除自由基,因此抗氧化剂清除自由基的作用不仅引起了科学家的关注,公众对此也有极大的兴趣[1-3]。从食物和天然植物中寻找抗氧化的天然活性成分,如多酚、黄酮、三萜类等物质已成为当前营养与食品研究的热点之一[4-7]。
红豆越橘(Vaccinium vitis-idaea L.),又名牙疙瘩,隶属于杜鹃花科(Ericaceae)越橘属(Vaccinium spp.),是常绿小灌木,主要分布于东亚、北美、北欧等高山地区[8],在我国主要集中于大兴安岭地区,是重要的野生自然资源,具有很高的利用价值,同时也是风靡世界的新兴保健水果蓝莓的重要野生品种之一。红豆越橘果实为亮红色,是提取天然色素的重要原料。在越橘的果实和茎叶中含有花色苷、黄酮、萜类等多种活性成分,具有多种生理功能,对于保健和疾病治疗有很好的作用。红豆越橘富含的多酚类物质对自发性高血压大鼠有降压作用,对内皮依赖性血管舒张具有改善作用并具有抗炎功效[9-12]。蔓越莓中类黄酮和花青素对预防心血管疾病有显著的功效[13]。越橘类提取物可治疗尿道感染[14-15]。越橘果渣所含的黄酮类成分具有较高的抗氧化活性[16]。通过研究越橘和蓝莓提取物对鼠大脑细胞氧化应激反应防护作用发现越橘和蓝莓对神经具有明显的保护作用[17]。蔓越莓和越橘的浓缩物可抑制水果中真菌的生长[18]。Yin等[19]用含有0.5%三萜酸的食物喂小鼠4~8 周,对小鼠的血浆、大脑、心脏等部位进行研究,发现摄入三萜类的小鼠具有更强的抗 氧化能力。因此,对红豆越橘各种活性成分的研究是近年来国内外的热点之一。关于红豆越橘的报道已经有很多,但是对其不同溶剂萃取,测定不同萃取物的活性成分含量及其抗氧化相关性的研究鲜见报道,因此本实验研究红豆越橘粗提取物及不同溶剂萃取物的抗氧化活性与其总酚、总黄酮、总花色苷、齐墩果酸含量的关系,为更好地了解红豆越橘抗氧化成分的存在部位,更有效地开发与利用红豆越橘提供一定的理论依据。
1.1 材料与试剂
矮丛红豆越橘(Vaccinium vitis-idaea L.)于成熟季节采摘于大兴安岭加格达奇区,-4 ℃冷冻保存。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox,水溶性VE)、福林-酚试剂 美国Sigma公司;2,2 -联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2 -azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、没食子酸标准品(纯度≥98%)、儿茶素标准品(纯度≥95%)、香草醛、齐墩果酸标准品(纯度≥97%) 上海阿拉丁试剂公司;其他试剂均为国产分析纯。
1.2 仪器与设备
722型分光光度计、PHS-26数显pH计 上海精密仪器有限公司;FA25高剪切分散乳化机 上海弗鲁克流体机械制造有限公司;RE-52A旋转蒸发仪、SHB-3真空泵循环水系统 上海亚荣生化仪器厂。
1.3 方法
1.3.1 红豆越橘粗提取物及不同溶剂萃取物的制备
用电子天平称取冻存浆果1 kg,加入2 L体积分数95%的乙醇,在组织捣碎机中匀浆5 min,从捣碎机中取出匀浆,在FA25高剪切分散乳化机中均质3 min,真空抽滤。收集滤液置于旋转蒸发仪中,在45 ℃条件下减压浓缩至近干时,用少量乙醇转移到蒸发皿中,冷冻干燥得乙醇粗提取物。将红豆越橘粗提物用水(1∶10,m/V)溶解,分别用等量体积的石油醚、乙酸乙酯和正丁醇萃取,之后浓缩、冻干即得不同溶剂萃取物,于-80 ℃保存待用。
1.3.2 红豆越橘抗氧化活性物质测定
以初步分析红豆越橘抗氧化活性为目的,对红豆越橘粗提物和不同极性萃取物的总酚、总黄酮、总花色苷、齐墩果酸含量进行测定,以此推测粗提取物及不同萃取物对DPPH自由基、ABTS+•清除能力与总黄酮、总酚、总花色苷、齐墩果酸含量之间的相关性。
1.3.2.1 总酚含量的测定
采用福林-酚比色法检测总酚含量[20],并稍作调整。
没食子酸标准曲线绘制:精密吸取40 μL没食子酸标准溶液(0.00、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40 mg/mL及0.45 mg/mL),分别置于10 mL试管中,加入1.8 mL 0.1mol/L的福林-酚试剂,样品混合充分,避光5 min,加入1.2 mL质量分数7% Na2CO3水溶液,90 min后在765 nm波长处测定蓝色溶液的吸光度。参比为不含提取液的空白试剂。以没食子酸的质量浓度为横坐标(X)、吸光度为纵坐标(Y)绘制标准曲线。
总酚含量的测定:分别精密量取粗提取物和各萃取物40 μL(1 mg/mL),按上述操作测得765 nm波长处吸光度,并根据没食子酸的标准曲线,计算粗提取物和各萃取物的总酚含量。
1.3.2.2 总黄酮含量的测定
采用AlCl3比色法检测总黄酮含量[21],并稍作调整。儿茶素标准曲线绘制:精密吸取1 mL儿茶素标准溶液(0.032 5、0.062 5、0.125 0、0.250 0 mg/mL及0.500 0 mg/mL)分别置于10 mL试管中,加入300 μL质量分数5% NaNO2,混合均匀,6 min后加入300 μL质量分数10% AlCl3•6H2O,摇匀放置6 min;然后加入4 mL质量分数4% NaOH溶液,混匀,15 min后于510 nm波长处测定各溶液的吸光度。参比为不含提取液的空白试剂。以儿茶素的质量浓度为横坐标(x)、吸光度为纵坐标(y)绘制标准曲线。
总黄酮含量测定:分别精密量取红豆越橘粗提取物及各萃取物1 mL(1 mg/mL),按上述操作测得510 nm波长处吸光度,并根据儿茶素的标准曲线,计算粗提取物和各萃取物的总黄酮含量。
1.3.2.3 齐墩果酸含量的测定
参照文献[22]并稍作调整。齐墩果酸标准曲线绘制:精密吸取0.1 mg/mL齐墩果酸标准溶液0.0、0.4、0.8、1.2、1.6 mL及2.0 mL分别置于10 mL试管中,水浴挥干,加入新配制的质量分数5%香草醛-冰醋酸溶液0.2 mL、高氯酸1.2 mL,于60 ℃水浴加热15 min后取出,立即用冰水冷却,加入冰醋酸5.0 mL,摇匀,静置10 min后,用紫外分光光度计,于550 nm波长处测定吸光度。以齐墩果酸的质量浓度为横坐标(X)、吸光度为纵坐标(Y)绘制标准曲线。
齐墩果酸含量测定:分别精密量取红豆越橘取粗提取物及各萃取物1 mL(0.5 mg/mL),按上述操作测得在550 nm波长处测定吸光度,并根据齐墩果酸的标准曲线,计算粗提取物及各萃取物齐墩果酸含量。
1.3.2.4 总花色苷含量的测定
总花色苷含量的测定用pH-示差分光光度法[23]。精密量取红豆越橘粗提取物及各萃取物200 μL(1 mg/mL)各2 份于10 m L试管中,分别加入5 mL氯化钾缓冲液(0.025 mol/L、pH 1.0)、乙酸钠缓冲液(0.4 mol/L、pH 4.5),分别在510 nm和700 nm波长处测定吸光度,以蒸馏水为空白对照。总花色苷含量按式(1)、(2)计算。
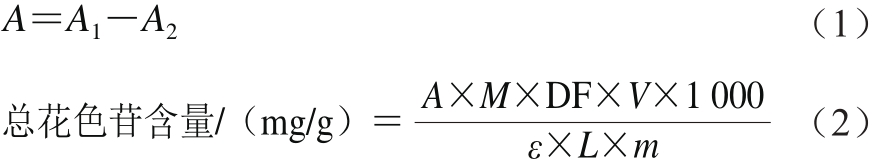
式中:A1为pH 1.0条件下A510nm与A700nm之差;A2为pH 4.5条件下A510nm与A700nm之差;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数(26 900 L/(mol•cm));DF为稀释因子;M为矢车菊素-3-葡萄糖苷的摩尔质量(449.2 g/mol);V为最终体积/mL;m为产品质量/g;L为光程(1 cm)。
1.3.2.5 DPPH法测定抗氧化能力
参照文献[24]并稍作调整。将红豆越橘粗提取物、各萃取物及Trolox配制成0.062 5、0.125 0、0.250 0、0.500 0、1.000 0、2.000 0 mg/mL及4.000 0 mg/mL的样品溶液。取0.1 mL样品溶液加入1.4 mL无水乙醇,之后再加入1.0 mL 1×10-4mol/L DPPH溶液,混匀,放置于室温暗处70 min后测定517 nm波长处吸光度。以Trolox为阳性对照,DPPH自由基的清除率按式(3)计算。
式中:A1为0.1 mL样品液+1.4 mL无水乙醇+1.0 mL DPPH的吸光度;A2为0.1 mL样品液+2.4 mL无水乙醇的吸光度;A3为1.5 mL无水乙醇+1.0 mL DPPH的吸光度。
按上述方法计算DPPH自由基清除率,根据Calcusyn Demo软件求出半抑制浓度(50% inhibitory concentration,IC50)即清除率为50%的样品质量浓度。
1.3.2.6 ABTS法测定抗氧化能力
参照文献[25]并稍作调整。将5 mL 7 mmol/L ABTS和88 μL 140 mmol/L过硫酸钾混合,在室温、避光的条件下静置过夜,形成ABTS储备液。使用前将ABTS储备液用磷酸盐缓冲液稀释成ABTS工作液,要求在30 ℃、734 nm波长下吸光度为0.70±0.02。将红豆越橘粗提取物、各萃取物及Trolox配制成0.062 5、0.125 0、0.250 0、0.500 0、1.000 0、2.000 0 mg/mL及4.000 0 mg/mL质量浓度的样品溶液,取0.1 mL样品溶液加入1.5 mL ABTS工作液,充分振荡混匀,避光放置6 min,在734 nm波长处测定吸光度。以Trolox作为阳性对照,对ABTS+•清除率计算见式(4)。
式中:Acontrol为0.1 mL无水乙醇+1.5 mL ABTS的吸光度;Asample为0.1 mL样品溶液+1.5 mL ABTS的吸光度。
按上述方法计算ABTS+•清除率,根据Calcusyn Demo软件求出IC50。
1.4 数据分析
所有实验数据均为3 次重复,实验结果以±s表示。采用Microsoft Offi ce Excel 2007、Origin 8.0、SPSS 21.0、Calcusyn Demo软件进行数据处理工作。
2.1 红豆越橘粗提取物及各萃取物活性成分分析
2.1.1 红豆越橘粗提取物及各萃取物总酚含量
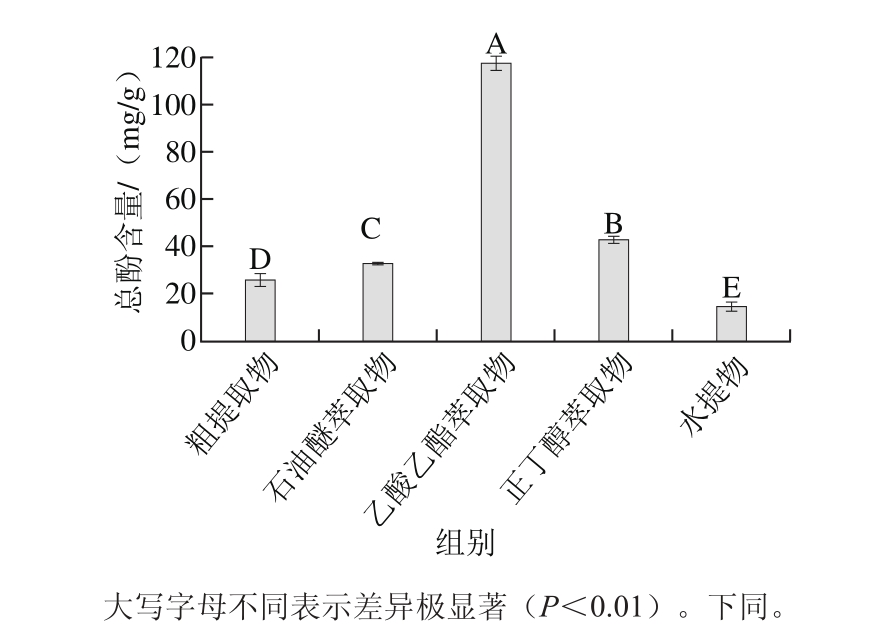
图 1 红豆越橘不同溶剂提取物总酚含量
Fig. 1 Total polyphenol contents in different extracts
由图1可知,红豆越橘粗提取物及各萃取物中总酚含量存在极显著性差异(P<0.01)。植物多酚具有多元酚的结构,是广泛存在于植物体内的多元酚类次生代谢产物,且含量较多,成分复杂且结构不稳定,极性较大,因此总酚主要存在于乙酸乙酯和正丁醇提取物中。粗提取物及各萃取物中按总酚含量排序为:乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物>粗提取物>水提物。乙酸乙酯萃取物含量最高为(117.95±2.97) mg/g,是含量最少的水提物(14.65±2.05) mg/g的8.05 倍。赵国玲等[26]对坛紫菜不同溶剂组分中的总酚含量进行测定,得到:乙酸乙酯萃取物>粗提取物>正丁醇萃取物>石油醚萃取物>水提物,其含量最高的乙酸乙酯部为69.84 mg/g,是含量最低水部的6.29 倍。
2.1.2 红豆越橘粗提取物及各萃取物总黄酮含量
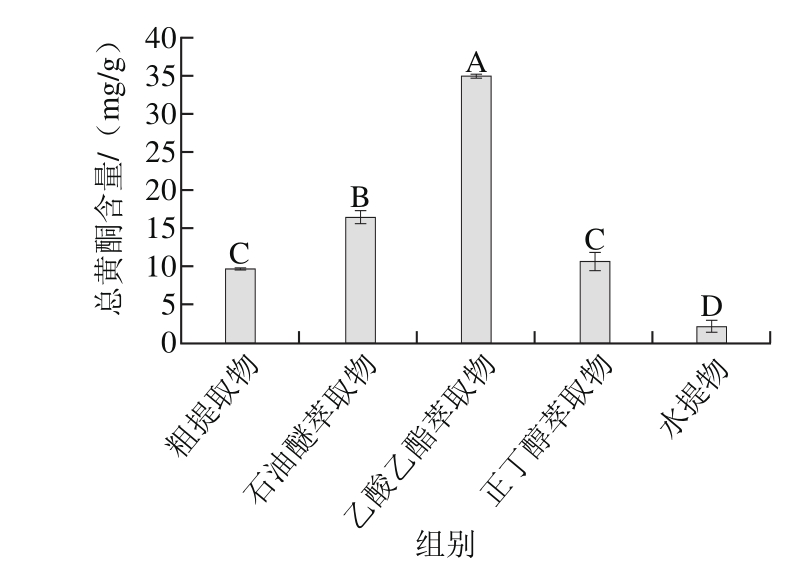
图 2 红豆越橘不同溶剂提取物总黄酮含量
Fig. 2 Total fi avonoid contents in different extracts
由图2可知,红豆越橘粗提取物总黄酮含量除与正丁醇萃取物差异不显著外,与其他组别都存在极显著性差异(P<0.01)。黄酮类化合物的基本母核由两个具有酚羟基的苯环通过中央3 个碳原子连接构成,母核上一般连接有甲基、羟基、异戊烯基和甲氧基等官能团。天然黄酮类化合物多与糖结合以苷类形式存在,为低中等极性化合物,低级性黄酮苷元存在于石油醚组分中,极性较大的黄酮苷类主要存在于乙酸乙酯组分中。粗提取物及各萃取物按总黄酮的含量排序为:乙酸乙酯萃取物>石油醚萃取物>正丁醇萃取物>粗提取物>水提物。乙酸乙酯萃取物含量最高为(34.98±0.24) mg/g,是含量最少的水提物(2.13±0.75) mg/g的16.42 倍。乔明福等[27]通过研究蒲桃不同溶剂提取物总黄酮的含量得出乙酸乙酯萃取物>正丁醇萃取物>水萃取物>石油醚萃取物,总黄酮含量最高的乙酸乙酯萃取物为3.953 mg/g,是含量最低石油醚萃取物的4.95 倍。
2.1.3 红豆越橘粗提取物及各萃取物齐墩果酸含量
由图3可知,红豆越橘粗提取物齐墩果酸含量除与正丁醇萃取物差异不显著外,与其他组别均存在极显著性差异(P<0.01)。因石油醚的极性较小,主要萃取一些极性较低的物质,可能含有脂溶性成分或者是萜类物质。而大部分的萜类物质极性都比较低,因此三萜类化合物在石油醚萃取物和乙酸乙酯萃取物中含量较高。粗提取物及各萃取物按齐墩果酸的含量顺序依次为:石油醚萃取物>乙酸乙酯萃取物>粗提取物>正丁醇萃取物>水提物。含量最高的石油醚萃取物((362.180±0.014) μg/g)是含量最少的水提物((76.920±0.006) μg/g)的4.70 倍。谢文仙[28]研究狼毒大戟的不同溶剂萃取物中齐墩果酸的含量得出:石油醚萃取物>水提物>乙酸乙酯萃取物>正丁醇萃取物,含量最高的石油醚部为301 mg/g,是含量最低正丁醇部的7.53 倍。
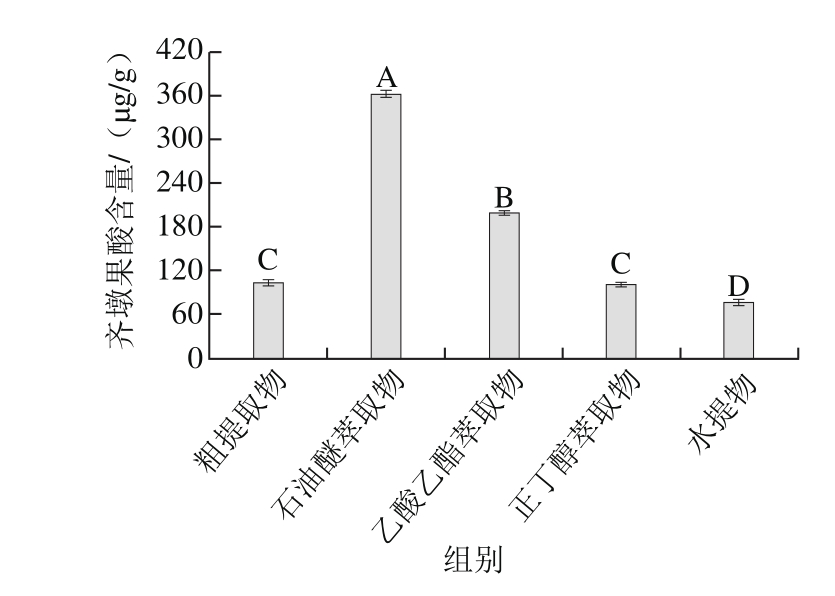
图 3 红豆越橘不同溶剂提取物齐墩果酸含量Fig. 3 Oleanolic acid contents in different extracts
2.1.4 红豆越橘粗提取物及各萃取物总花色苷含量

图 4 红豆越橘不同溶剂提取物总花色苷的含量
Fig. 4 Contents of total anthocyanins in different extracts
由图4可知,红豆越橘粗提取物及各萃取物中总花色苷含量存在极显著性差异(P<0.01)。花色苷的基本骨架由中央的三碳原子来连接两个苯环。花色苷的配基为花色素,具有2-苯基-苯并吡喃阳离子的结构,花青素可以与糖以糖苷键结合形成不同种类的花色苷。由于某些花色苷含有羟基,羟基极性大,因此花色苷主要存在于正丁醇中。总花色苷含量排序为:正丁醇萃取物>石油醚萃取物>粗提取物>水提物>乙酸乙酯萃取物。正丁醇萃取物含量最高为(22.09±1.18) mg/g,是含量最少的乙酸乙酯萃取物(1.40±0.10) mg/g的15.78 倍。陈智力等[29]研究蓝靛果不同提取部位花青素的含量得出:正丁醇萃取物>水提物>石油醚萃取物>乙酸乙酯萃取物,含量最高的正丁醇萃取物为37.3 mg/g,是含量最低乙酸乙酯部萃取物的22.34 倍。
2.2 红豆越橘粗提取物及各萃取物抗氧化作用比较
2.2.1 红豆越橘粗提取物、各萃取物清除DPPH自由基能力

图 5 红豆越橘不同溶剂提取物对DPPH自由基的清除活性
Fig. 5 DPPH radical-scavenging activity of different extracts
由图5可知,红豆越橘粗提取物及各萃取物对DPPH自由基清除能力大小依次为:乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物>粗提取物>水提物。各提取物对DPPH自由基都表现出清除能力,在质量浓度范围内呈良好的剂量-效应关系,随质量浓度的增加而增强。整体而言,乙酸乙酯萃取物对DPPH自由基的清除能力高于其他4 种提取物,当质量浓度为2 mg/mL时清除率达到最大(92.43±0.13)%。另外正丁醇萃取物的清除能力也较强。
表 1 红豆越橘不同溶剂提取物及Trolox清除DPPH自由基活性的IC50值
Table 1 IC50values of Trolox and different extracts for DPPH radical scavenging activity
由表1可知,红豆越橘粗提取物及各层萃取物IC50分别为1.71、0.96、0.27、0.65 mg/mL及6.86 mg/mL,各萃取部位清除DPPH自由基能力相对于阳性对照Trolox弱。其中,清除能力最好的乙酸乙酯萃取物(IC50为0.27 mg/mL)约为阳性对照Trolox IC50的2 倍。乙酸乙酯萃取物含有较高的总酚和总黄酮含量,它们是氢或电子的良好给予体,因此能对产生过氧化作用的自由基有明显的清除作用。清除DPPH自由基的能力与总酚含量的顺序一致,同时含有较多花色苷的正丁醇萃取物清除自由基的能力也较强。
2.2.2 红豆越橘粗提取物、各萃取物清除ABTS+•能力
由图6可知,红豆越橘粗提取物及各层萃取物清除ABTS+•能力大小依次为:乙酸乙酯萃取物>正丁醇萃取物>粗提取物>石油醚萃取物>水提物。各萃取物对ABTS+•都表现出较强的清除能力,在质量浓度范围内呈良好的剂量-效应关系,随质量浓度的增加而增强。在各个质量浓度条件下,乙酸乙酯萃取物均表现出最强的ABTS+•清除能力,随着质量浓度的增加,除乙酸乙酯萃取物外正丁醇萃取物的清除能力增大得最快。整体而言,乙酸乙酯萃取物对ABTS+•的清除能力高于其他4 种萃取物,当质量浓度为1 mg/mL时清除率达到最大(99.79±0.25)%。

图 6 红豆越橘不同溶剂提取物和Trolox对ABTS+的清除活性
Fig. 6 ABTS radical-scavenging activity of Trolox and different extracts
表 2 红豆越橘不同溶剂提取物清除ABTS+活性的IC50值
Table 2 IC50values of Trolox and different extracts for ABTS radical scavenging activity
由表2可知,红豆越橘粗提取物及各萃取物IC50分别为0.22、0.45、0.05、0.20 mg/mL及0.78 mg/mL。多酚、花色苷、黄酮类活性物质在乙酸乙酯萃取物和正丁醇萃取物含量较高,这些活性物质含有羟基或酚羟基,能够能提供氢或者电子从而使自由基失活,因此对ABTS+•的清除能力强,除乙酸乙酯萃取物外其他各萃取物清除ABTS+•能力相对于阳性对照Trolox弱,清除能力最强的乙酸乙酯萃取物的IC50为0.05 mg/mL,与阳性对照Trolox IC50相当。
2.3 总酚、总黄酮、齐墩果酸含量与抗氧化活性相关性分析
红豆越橘总酚、总黄酮、齐墩果酸含量与抗氧化活性相关性分析详见表3。红豆越橘乙醇粗提取物及不同萃取物中总黄酮和总酚含量与抗氧化能力之间有较好的相关性。总酚含量与抗氧化活性正相关,总酚含量与DPPH自由基清除能力极显著相关(P<0.01),与ABTS+•清除能力显示出一定的线性相关性(P>0.05)。总黄酮含量与ABTS+•、DPPH自由基清除能力极显著正相关(P<0.01)。齐墩果酸含量与ABTS+•、DPPH自由基清除能力相关性不显著(P>0.05)。说明红豆越橘粗提取物及不同溶剂萃取物中黄酮、总酚含量的多少直接反映萃取物抗氧化能力强弱。樊梓鸾[30]研究包括红豆越橘在内的11 种浆果的多酚和黄酮含量与清除ABTS+•和DPPH自由基的能力呈现显著的正相关性(P<0.05)。
表 3 总酚、总黄酮、齐墩果酸含量与抗氧化活性相关性
Table 3 Correlation analysis between total phenols, total fi avonoids or oleanolic acid and antioxidant activity

注:**.极显著相关(P<0.01);*.显著相关(P<0.05)。
通过测定红豆越橘乙醇提取物及不同溶剂萃取物中活性成分及其各提取物清除ABTS+•、DPPH自由基的能力,考察各提取物中不同活性成分的含量与抗氧化活性之间的关系。实验结果表明,红豆越橘粗提取物及各溶剂萃取物中总酚、总黄酮、总花色苷、齐墩果酸含量存在极显著性差异,总酚、总黄酮、齐墩果酸、总花色苷含量最高的分别为乙酸乙酯萃取物、乙酸乙酯萃取物、石油醚萃取物、正丁醇萃取物。经皮尔森系数分析可知,红豆越橘提取物中起主要抗氧化作用的是总酚、总黄酮。乙酸乙酯萃取物在质量浓度为1.0 mg/mL时其对DPPH自由基清除率为80.46%(IC50为0.27 mg/mL),乙酸乙酯萃取物在质量浓度为0.5 mg/mL时其对ABTS+•的清除率为99.79%(IC50为0.05 mg/mL)。乙酸乙酯萃取物活性最高,下一步可 对其进行系统地分离与分析,确定抗氧化物质,为红豆越橘进一步的开发及利用提供一定的理论依据。
参考文献:
[1] MCCORD J M. Oxygen-derived free radicals in postischemic tissue injury[J]. New England Journal of Medicine, 1985, 312(3): 159-163. DOI:10.1056/NEJM198501173120305.
[2] BECKMAN J S, BECKMAN T W, CHEN J, et al. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide and superoxide[J]. Proceedings of the National Academy of Sciences, 1990, 87(4): 1620-1624. DOI:10.1073/ pnas.87.4.1620.
[3] NIKI E. Antioxidant capacity: which capacity and how to assess it?[J]. Journal of Berry Research, 2011, 1(4): 169-176. DOI:10.3233/JBR-2011-018.
[4] MEHLHORN R J, COLE G. The free radical theory of aging: a critical review[J]. Advances in Free Radical Biology and Medicine, 1985, 1(1): 165-223. DOI:10.1016/8755-9668(85)90007-9.
[5] LEHTONEN H M, LEHTINEN O, SUOMELA J P, et al. Flavonol glycosides of sea buckthorn (Hippophae rhamnoides ssp. sinensis) and lingonberry (Vaccinium vitis-idaea) are bioavail able in humans and monoglucuronidated for excretion[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 620-627. DOI:10.1021/jf9029942.
[6] FERREIRA R G S, SILVA JÚNIOR W F, VEIGA JUNIOR V F, et al. Physicochemical characterization and biological activities of the triterpenic mixture α, β-amyrenone[J]. Molecules, 2017, 22(2): 1-9. DOI:10.3390/molecules22020298.
[7] PERUSKO M, Al-HANISH A, MIHAILOVIC J, et al. Antioxidative capacity and binding affinity of the complex of green tea catechin and beta-lactoglobulin glycated by the Maillard reaction[J]. Food Chemistry, 2017, 232: 744-752. DOI:10.1016/j.foodchem.2017.04.074.
[8] LI J, PERCIVAL D, HOYLE J, et al. Phenology and yield of native fruits cloudberry/bakeapple (Rub us chamaemorus L.) and lingonberry/ partridgeberry (Vaccinium vitis-idaea L.) grown in Southern Labrador, Canada[J]. Canadian Journal of Plant Science, 2016, 96(3): 329-338. DOI:10.1139/cjps-2015-0131.
[9] GONZÁLEZ R, BALLESTER I, LÓPEZ-POSADAS R, et al. Effects of f lavonoids and other polyphenols on inflammation[J]. Critical Reviews in Food Science & Nutrition, 2011, 51(4): 331-362. DOI:10.1080/10408390903584094.
[10] KIVIMAKI A S, EHLERS P I, SILTARI A, et al. Lingonberry, cranberry and blackcurrant juices affect mRNA expressions of inflammatory and atherothrombotic markers of SHR in a long-term treatment[J]. Journal of Functional Foods, 2012, 4(2): 496-503. DOI:10.1016/j.jff.2012.02.010.
[11] TANGNEY C C, RASMUSSEN H E. Polyphenols, inflammation, and cardiovascular d isease[J]. Current Atherosclerosis Reports, 2013, 15(5): 1-10. DOI:10.1007/s11883-013-0324-x.
[12] KIVIMAKI A S, EHLERS P I, TURPEINEN A M, et al. Lingonberry juice improves endothelium-dependent vasodilatation of mesenteric arteries in spontaneously hypertensive rats in a long-ter m intervention[J]. Journal of Functional Foods, 2011, 3(4): 267-274. DOI:10.1016/j.jff.2011.05.001.
[13] ISAAK C K, PETKAU J C, O K, et al. Manitoba lingonberry (Vaccinium vi tis-idaea) bioactivities in ischemia-reperfusion injury[J]. Journal of Agricultural and Food Chemistry, 2015, 63(23): 5660-5669. DOI:10.1021/acs.jafc.5b00797.
[14] KONTIOKARI T, SUNDQVIST K, NUUTINEN M, et al. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women[J]. British Medical Journal, 2001, 322: 1-5. DOI:10.1136/bmj.322.7302.1571.
[15] HOWELL A B, VORSA N, DER MARDEROSIAN A, et al. Inhibition of the adherence of P-fimbriated Escherichia coli to uroepithelialcell surfaces by proanthocya nidin extracts from cranberries[J]. New England Journal of Medicine, 1998, 339(15): 1085-1086. DOI:10.1056/NEJM199810083391516.
[16] 潘一峰, 瞿伟菁, 顾于蓓, 等. 越桔果渣中黄酮类成分抗氧化活性的研究[J]. 食品科学, 2005, 26(10): 206-210.
[17] VYA S P, DEBNATH M, KALIDINDI S, et al. Protective effect of lingonberry and blueberry extracts on rat brain cells exposed to oxidative stress[J]. Free Radical Biology and Medicine, 2015, 86(Supp1): 39. DOI:10.1016/j.freeradbiomed.2015.07.136.
[18] ERMIS E, HERTEL C, SCHNEIDER C, et al. Characterization of in vitro antifungal activities of small and American cranberry (Vaccinium oxycoccos L. and V. macrocarpon Aiton) and lingonberr y (Vaccinium vitis-idaea L.) concentrates in sugar reduced fruit spreads[J]. International Journal of Food Microbiology, 2015, 204: 111-117. DOI:10.1016/j.ijfood micro.2015.03.017.
[19] YIN M C, LIN M C, MONG M C, et al. Bioavailability, distribution, and antioxidative effects of selected triterpenes in mice[J]. Journal of Agricultural and Food Chemistry, 2012, 60(31): 7697-7701. DOI:10.1021/jf302529x.
[20] LIU M, LIN L Q, SONG B B, et al. Cranberry phytochemical extract inhibits SGC-7901 cell growth and human tumor xenografts in BALB/c nu/nu mice[J]. Journal of Agr icultural and Food Chemistry, 2009, 57(2): 762-768. DOI:10.1021/jf802780k.
[21] SUN J, LIU R H. Apple phytochemical extracts inhibit proliferation of estrogen-dependent and estrogen-independent human breast cancer cells through cell cycle modulation[J]. Journal of Agricultural and Food Chemistry, 2008, 56(24): 11661-11667. DOI:10.1021/jf8021223.
[22] 沈思, 李孚杰, 梅光明, 等. 茯苓皮三萜类物质含量的测定及其抑菌活性的研究[J]. 食品科学, 2009, 30(1): 95-98.
[23] BAO J S, CAI Y Z, SUN M, et al. Anthocyani ns, flavonols, and free radical scavenging activity of Chinese bayberry (Myrica rubra) extracts and their color properties and stability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2327-2332. DOI:10.1021/jf048312z.
[24] CESPEDES C L, VALDEZ-MORALES M, AVIL A J G, et al. Phytochemical profi le and the antioxidant activity of Chilean wild blackberry fruits, Aristote lia chilensis, (Mol) Stuntz (Elaeocarpaceae)[J]. Food Chemistry, 2010, 119(3): 886-895. DOI:10.1016/ j.foodchem.2009.07.045.
[25] TARUSCIO T G, BARNEY D L, EXON J. Content and profile of flavanoid and phenolic acid compounds in conjunction with the antioxidant capacity for a variety of northwest Vaccinium Berries[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10): 3169-3176. DOI:10.1021/jf0307595.
[26] 赵国玲, 刘承初, 谢晶, 等. 坛紫菜不同溶剂组分的抗氧化活性[J].食品科学, 2010, 31(17): 186-191.
[27] 乔明福, 杨秋霞, 何洋. 蒲桃不同提取部位总黄酮含量比较研究[J].广州化工, 2014, 42(15): 125-127.
[2 8] 谢文仙. 狼毒大戟三萜的提取纯化、鉴定与抑瘤抑菌等作用研究[D].广州: 广东工业大学, 2015: 36-37.
[29] 陈智力, 王秋红, 匡海学. 蓝靛果不同提取部位花青素、多酚类的含量测定及体外抗氧化活性[J]. 中国实验方剂学杂志, 2016, 22(1): 48-52. DOI:10.13422/j.cnki.syfjx.2016010048.
[30] 樊梓鸾. 红豆越橘多酚对氧化诱导损伤及癌细胞增殖抑制作用研究[D]. 哈尔滨: 哈尔滨工业大学, 2012: 62-64.
Correlation between Antioxidant Activity in Vitro and Active Components of Different Solvent Extracts from Lingonberry
FAN Ziluan, CHEN Kaili, LIU Yaxin, YANG Leiyu, FU Yujie*
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
Abstract:The 95% ethanol extract from lingonberry (Vaccinium vitis-idaea L.) was fractionated by successive extraction with petroleum ether, ethyl acetate and n-butanol. The contents of total phenols, total fi avonoids, total anthocyanins and oleanolic acid in the crude extract and its fractions were evaluated as well as their antioxidant activit ies in vitro as indicated by radical scavenging capacities against 1,1-diphenyl-2-picrylhydrazyl (DPPH) and (2,2 -azinobis-(3-ethylbenzthiazoline-6-sulphonate (ABTS) radicals. Besides, the correlation between total phenols, total fi avonoids, total anthocyanins or oleanolic acid and antioxidant activity was analyzed. Results indicated that different solvent extracts from lingonberry showed a significant antioxidant activity. The ethyl acetate-soluble and butyl alcohol-soluble fractions had higher free radical scavenging capacity, and the former exhibited the strongest DPPH and ABTS radical scavenging activity with an IC50value of 0.27 and 0.05 mg/mL, respectively. There was a positive correlation between the antioxidant activity of the different extracts and the contents of total phenols and total fi avonoids.
Key words:lingonberries; antioxidant; total phenolics; total fi avonoids; total anthocyanins; terpenoid
DOI:10.7506/spkx1002-6630-201717023
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)17-0138-07引文格式:
收稿日期:2016-06-28
基金项目:黑龙江省自然科学基金青年科学基金项目(QC2016021);中央高校科学前沿与交叉学科创新基金项目(2572016CA06);国家自然科学基金面上项目(31170510);中国博士后科学基金项目(2016M600239)
作者简介:樊梓鸾(1981—),女,讲师,博士,研究方向为天然产物分离纯化及功能活性评价。E-mail:fzl_1122@163.com *通信作者:付玉杰(1967—),女,教授,博士,研究方向为森林植物生态学、林业生物制剂。E-mail:985461289@qq.com