苏健裕1,2,梅国栋1,2,方立明2,3,*,黄滟波1,2,4
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.广东省天然产物绿色加工与产品安全重点实验室,广东 广州 510640;3.华南理工大学材料科学与工程学院,广东 广州 510640;4.制浆造纸工程国家重点实验室,广东 广州 51 0640)
摘 要:通过水蒸气蒸馏法从梅片树叶中提取挥发油,冷冻、离心得粗右旋龙脑,用石 油醚、120号汽油和无水乙醇分别进行重结晶,得到 高纯度右旋龙脑晶体,并对晶体的成分、旋光 性、形态和热性能进 行了表征。结果表明,梅片树树叶挥发油中右旋龙脑 含量为68.1 0%;重结晶后纯度达98%以上,质谱图分析结果和标准品基本一致,旋光度也相近;石油醚和120号汽油重结晶晶体呈规则六边形大片状,边界清晰,无水乙醇重结晶晶体形状不规则,呈分散 或团聚的小颗粒状,但两者的热分析结果基本相同,说明重结晶晶体形貌不影响其热性能。右旋龙脑晶体非等温结晶过程中,莫志深方程能很好地描述右旋龙脑的非等温结晶动力学。本实验结果可为梅片树的综合利用及高纯度天然右旋龙脑新资源的研究开发提供参考。
关键词:梅片树;右旋龙脑;重结晶;晶型;高纯度
引文格式:
苏健裕, 梅国栋, 方立明, 等. 梅片树中高纯度右旋龙脑制备及其性质表征[J]. 食品科学, 2017, 38(17): 151-157. DOI:10.7506/spkx1002-6630-201717025. http://www.spkx.net.cn
SU Jianyu, MEI Guodong, FANG Liming, et al. Preparation and characterization of D-boreonl from leaves of Dryobalanops aromatica[J]. Food Science, 2017, 38(17): 151-157. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717025. http://www.spkx.net.cn
龙脑(borneol),俗称“冰片”,是一种单萜醇,分子式为C10H18O(154.25 g/mol)[1]。龙脑按来源分为天然龙脑和合成龙脑,天然龙脑按旋光不同又分为左旋龙脑(艾片)和右旋龙脑(天然冰片、梅片),合成龙脑是人工合成的龙脑和异龙脑的混合体。药理学研究发现,右旋龙脑具有良好的抑菌[2-3]、抗炎[4-5]、抗血栓[6]、DNA保护及修复[7-9]、保护心脑等器官组织[10-11]、调节中枢神经[12-14]、开放生理性屏障[15-18]、促进其他药物吸收[19-23]等作用。自古以来,右旋龙脑就是一种珍稀药材和名贵的香料,在医药、化妆品、食品工业上应用广泛[24-25]。
天然右旋龙脑原产于印度尼西亚苏门答腊群岛,由龙脑香科植物龙脑香树脂中析出或树干及树枝经水蒸馏冷却结晶后所得,我国一直以来依靠进口满足需要。由于当地过度采伐,该地龙脑香树已近枯竭,不能满足需要,从而导致国际上天然右旋龙脑奇缺、价格昂贵。20世纪80年代,李毓敬等[24]在我国广东梅州等地发现了枝叶富含天然右旋龙脑的梅片树,可用于天然右旋龙脑的规模化生产。然而,现有的梅片树中提取的右旋龙脑纯度较低,形貌较差,影响其疗效和品质,且价格远低于高纯度右旋龙脑。因此,研究右旋龙脑的提纯工艺,成为提高其附加值的重要途径。
重结晶是常用的提纯方法之一,本研究拟通过比较不同溶剂重结晶工艺对右旋龙脑纯度、形貌和性能的影响。首先,通过水蒸气蒸馏法从梅片树树叶中提取挥发油,采用气相色谱-质谱(gas chromatography mass spectrometry,GC-MS)法分析其化学成分,然后用石油醚、120号汽油和无水乙醇3 种溶剂对粗右旋龙脑进行重结晶纯化,通过GC-MS、旋光性、形态学和热分析,获得高纯度、高质量的天然右旋龙脑制备方法,并对右旋龙脑晶体非等温结晶动力学进行研究。本实验结果可为梅片树的综合利用及天然右旋龙脑新资源的研究开发提供参考。
1.1 材料与试剂
梅片树树叶、粗右旋龙脑 广东华清园生物有限公司;右旋龙脑标准品(含量>99.90%) 北京天然药物及生物制品控制研究所;无水硫酸钠(色谱纯) 天津市科密欧化学试剂开发中心;石油醚(分析纯)、无水乙醇(分析纯)、正己烷(色谱纯) 广州化学试剂公司;120号汽油 廊坊开发区大明化工有限公司。
1.2 仪器与设备
SHZ-D(Ⅲ)循环水式真空泵 巩义市英峪予华仪器厂;BS224S电子天平 德国Sartorius公司;7890B-5977B GC-MS仪 美国Agilent公司;WZZ-2A数显自动旋光仪 上海光学仪器厂;Axioskop 40多功能光学显微镜 德国Zeiss公司;Pyris-1型热重分析仪、8000差示扫描量热(differential scanning calorimetry,DSC)仪美国PerkinElmer公司;D8 ADVANCE X射线衍射仪德国Bruker公司。
1.3 方法
1.3.1 挥发油的提取
将新鲜的梅片树树叶粉碎,按《中华人民共和国药典》[26]水蒸气蒸馏法提取挥发油。收集蒸馏的馏出物,向其中投入过量无水硫酸钠并充分振荡。使用循环水式真空泵抽滤此混合物得到不含水分的挥发油(黄色透明油状物)。
1.3.2 龙脑樟精油成分的分析
GC条件:HP-5MS弹性石英毛细柱管(30 mm×0.25 mm,0.25 μm);升温程序:80 ℃恒温1 min,以15 ℃/min的升温速率从室温升温至250 ℃并保持5 min,进样量1 μL,分流比为1∶10,进样口温度为250 ℃,检测温度为300 ℃,载气为氮气,载气保持恒定速率为2 mL/min。
MS条件:电子轰击(EI)离子源,电子能量70 eV,传输线温度275 ℃,离子源温度230 ℃,发射电流34.6 μA,电子倍增电压1 392 V,扫描质量范围m/z 33~450。
1.3.3 粗右旋龙脑的制备
将提取的挥发油冷冻后5 000 r/min离心30 min,并将水和其他液体油分滤出。待澄清后分离出水和液体油分。
1.3.4 粗右旋龙脑的重结晶及成分分析
分别将30 mL加热到微沸的石油醚、120号汽油、无水乙醇加入到盛有10 g粗右旋龙脑的烧杯中,边加热边搅拌,至完全溶解后趁热过滤,将滤液在室温条件下静置,使之缓缓冷却,析出晶体。待晶体析出完全后经过抽滤,使晶体和母液分离,收集滤纸上的晶体并干燥。重结晶后右旋龙脑的成分分析条件同1.3.2节。
1.3.5 右旋龙脑重结晶后晶体理化性质的测定
1.3.5.1 旋光性分析
参考《中华人民共和国药典》[26],以无水乙醇为溶剂,将右旋龙脑晶体制成0.1 g/mL的溶液。采用钠光谱的D线(589.3 nm)测定旋光度,测定管长度为1 dm,测定温度为20 ℃。
1.3.5.2 晶体形态学观察
分别在正常视野、多功能显微镜(目镜10 倍,物镜10 倍)和环境扫描电子显微镜(1 000 倍)下观察右旋龙脑晶体的形貌。
1.3.5.3 晶体热分析
热重分析测试条件:取一定量的右旋龙脑晶体样品置于热重分析仪的样品盘中,采用升温程序为:30~300 ℃,10 ℃/min,吹扫气体为氮气,流速为20 mL/min。
DSC法分析测试条件[27-28]:铝质坩埚,样品质量为2~5 mg,气氛为氮气,流速为40 mL/min,升温速率为10 ℃/min。
1.3.5.4 X射线衍射分析
X射线衍射测试条件:Cu-Kα辐射;LynxExe阵列探测器:电压40 kV,电流40 mA;扫描方式为连续扫描;扫描范围为5°~55°;扫描步长为0.02°;扫描速率为17.7 s/步。
1.3.5.5 非等温结晶
采用DSC仪研究右旋龙脑的非等温结晶行为,铝质坩埚,样品量为2~5 mg,氮气流速为40 mL/min,样品被迅速升温至100 ℃ , 恒温10 min以消除热历史,分别按照5、10、15、20、25 ℃/min降温速率从100 ℃降至0 ℃,记录该过程的热焓变化,由DSC冷却曲线可得到任意时刻(t)的相对结晶度(Xc),按式(1)计算。
式中:ΔHf是样品的熔融热/(J/g);ΔHf0是样品结晶度达100%时的熔融热/(J/g)。
在非等温条件下,对于同一体系,在冷却(或加热)速率为Φ时,某时刻t和温度T的关系为式(2)。
式中:T0为t= 0 min时刻的温度/℃;Φ为冷却速率/(℃/min)。
1.4 数据统计分析
各组实验均重复3 次,得平均值,用SPSS 17.0软件进行统计分析,用Origin 8.0软件进行作图。
2.1 梅片树树叶挥发油成分测定结果
表 1 梅片树树叶挥发油中成分分析
Table 1 Volatile components from the essential oil

由表1可知,从梅片树树叶中挥发 油的提取率为0.58%,通过GC-MS的定性定量分析,鉴定出26 种成分,占总离子图峰面积的95.70%。其中主要成分为2,6,6-三甲基二环[3.3.1]庚-2-烯(1.03%)、崁烯(0.82%)、月桂烯(0.64%)、邻异丙基甲苯(1.20%)、柠檬烯(2.83%)、桉叶油醇(1.49%)、樟脑(4.27%)、右旋龙脑(68.10%)、4-萜烯醇(0.83%)、α-松油醇(0.96%)、乙酸龙脑酯(8.40%)、桉油烯醇(1.66%)、愈创木醇(1.28%)等。
2.2 重结晶后晶体中右旋龙脑的纯度
表 2 3 种重结晶样品中右旋龙脑含量
Table 2 D-borneol contents of three recrystallized samples

图 1 重结晶后右旋龙脑GC-MS图
Fig. 1 GC-MS profi les of recrystallized D-borneol
从表2可以看出,石油醚、120号汽油、无水乙醇3 种溶剂重结晶后右旋龙脑的含量分别为99.82%、99.74%和98.38%,含量相差不大,均在98%以上,表明重结晶大大提高了右旋龙脑的纯度;由图1可以看出,3 种溶剂重结晶后的右旋龙脑质谱图和右旋龙脑标准品的质谱图基本一致。
2.3 右旋龙脑重结晶后晶体的理化性质
2.3.1 旋光性测定结果
表 3 3 种重结晶样品的旋光度测定结果
Table 3 Optical rotation of three recrystallized D-borneol samples
由表3可以看出,右旋龙脑标准品的旋光度为+37.5°,石油醚、120号汽油、无水乙醇3 种溶剂重结晶后的右旋龙脑样品旋光度分别为+36.03°、+35.74°和+35.36°,与右旋龙脑标准品的旋光度非常接近。
2.3.2 晶体形貌分析

图 2 右旋龙脑晶体形貌图
Fig. 2 Crystal morphology of three recrystallized D-borneol samples
从图2可以看出,石油醚和120号汽油重结晶晶体在形貌上相似,无水乙醇重结晶晶体与前两者存在显著的差异。在正常视野下,石油醚和120号汽油结晶出来的天然右旋龙脑晶体呈片状,面积较大;无水乙醇结晶出来的晶体呈颗粒状,体积较小。多功能显微镜下,石油醚和120号汽油结晶出来的天然右旋龙脑晶体形状规整、边界清晰;无水乙醇结晶出来的晶体形状不规则,分散或团聚的颗粒状。环境扫描电子显微镜下,石油醚和120号汽油结晶出来的天然右旋龙脑晶体表面清晰平整,呈板状,无水乙醇结晶出来的晶体呈团簇状。
2.3.3 热分析测定结果
2.3.3.1 热重分析
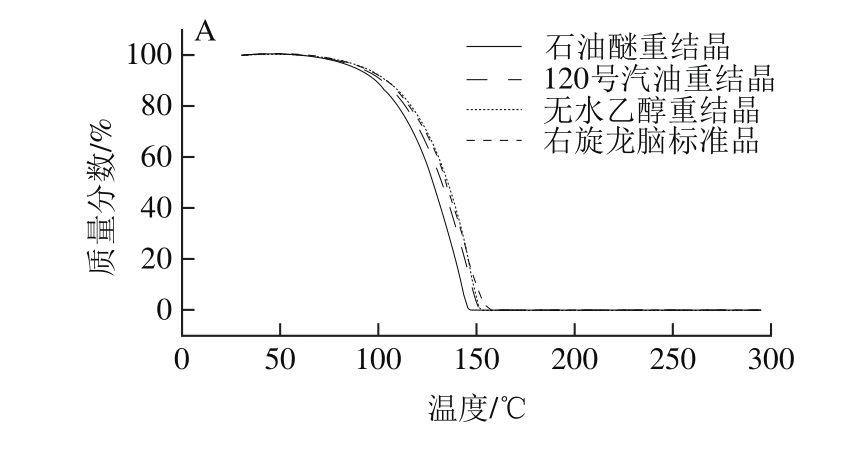
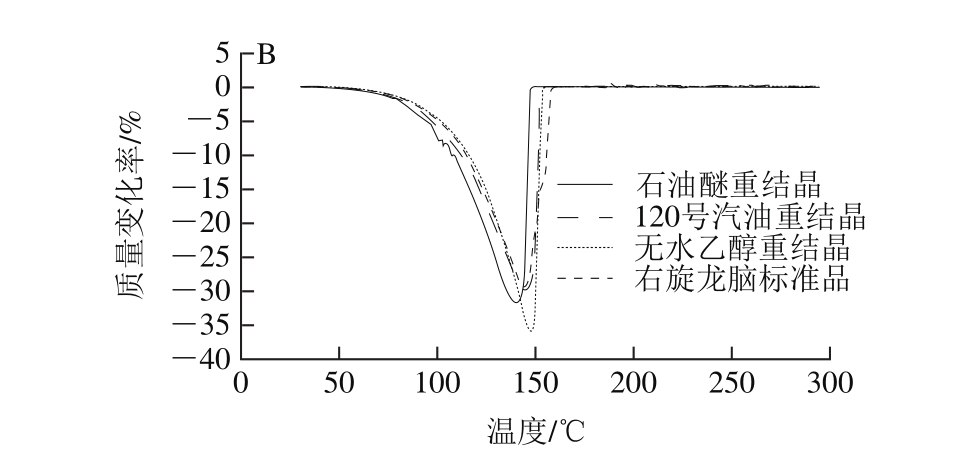
图 3 3 种溶剂重结晶后样品的热失重曲线(A)和热失重速率曲线(B)Fig. 3 Thermogravimetry curves (A) and thermogravimetry rate curves (B) of three recrystallized samples
由图3可知,随着温度的升高,3 种溶剂重结晶后晶体样品出现质量损失,热失重特征峰的起始温度均在70 ℃左右;随着温度的继续升高,热失重速率增大,在145 ℃左右达到热失重特征峰的峰值温度;且三者的热失重曲线和失重速率曲线与右旋龙脑标准品相似,表明3 种溶剂重结晶后晶体的热稳定性一致。

图 4 3 种溶剂重结晶后样品的DSC曲线
Fig. 4 DSC curves of three recrystallized samples
2.3.3.2 DSC分析从图4可以看出,3 种溶剂重结晶晶体均在约75 ℃附近出现单一的吸热峰,也说明3 种溶剂重结晶后的右旋龙脑纯度较高,并且随着温度的升高,样品在75 ℃左右时出现熔融峰;三者的DSC曲线右旋龙脑标准品相似,表明3 种溶剂重结晶后晶体热力学性质相同,这也说明不同溶剂重晶体后,晶体虽然在形貌上有所差异,但没有影响其热力学性质。
2.3.4 X射线衍射分析
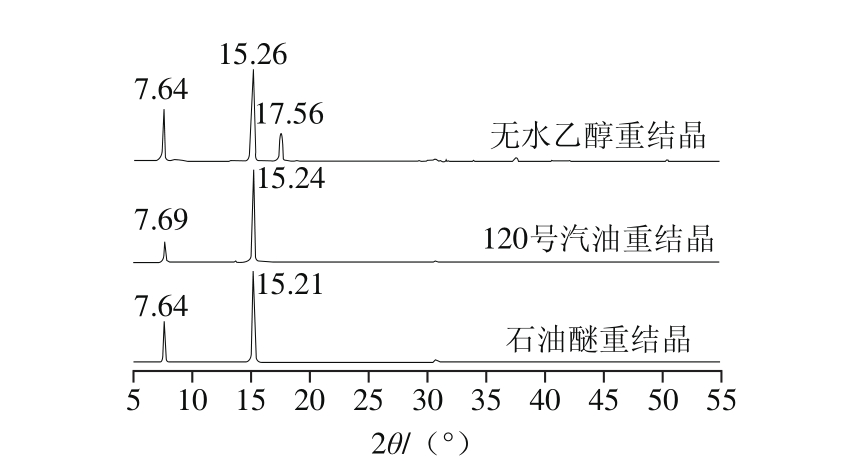
图 5 3 种溶剂重结晶后样品的X射线衍射曲线
Fig. 5 XRD curves of three recrystallized samples
从图5可以看出,120号汽油和石油醚重结晶晶体在2θ为7.6°和15.2°附近出现衍射峰,无水乙醇重结晶晶体另外在17.5°附近还出现了一个衍射峰。根据布拉格公式:2dsinθ=nλ,可以由θ,计算出晶面间距d,说明无水乙醇重结晶晶体具有不同的晶间距。
结合2.3.2节结果中120号汽油和石油醚重结晶晶体呈片状,而无水乙醇重结晶晶体呈颗粒状,在外观上与前两者存在显著差别。原因是晶体与不同溶剂分子间的作用力不同,导致晶体生长基元的大小和结构形式不同,从而使得晶体外观上存在差异[29]。
2.3.5 右旋龙脑非等温结晶分析

图 6 右旋龙脑在不同降温速率下的非等温结晶DSC曲线
Fig. 6 Non-isothermal crystallization DSC curves of D-borneol at different cooling rates
表 4 右旋龙脑非等温结晶动力学参数
Table 4 Non-isothermal crystallization kinetics parameters for D-borneol
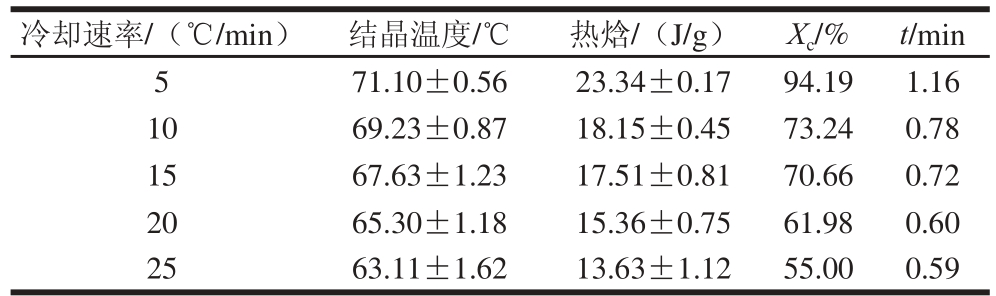
由图6可以看出,右旋龙脑在不同降温速率下的非等温结晶,随着冷却速率的提高,结晶峰变宽,结晶峰的位置和结晶温度向低温方向移动,因为在较低的冷却速率下有更多的时间去克服晶体成核的能垒,因此会在温度较高的区域结晶。由表4可以看出,随着冷却速率的提高,结晶度降低,结晶的时间变短。
莫志深[30]综合了Avrami方程和Ozawa方程,推导了在某一给定结晶度下的非等温结晶动力学过程,如式(3)所示。
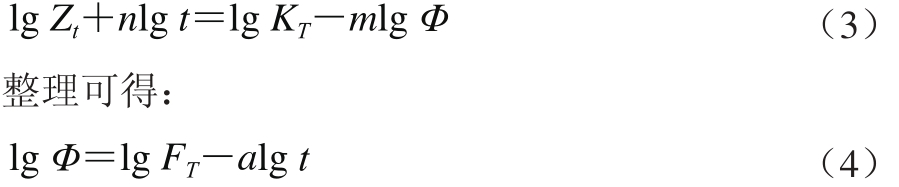
式中:K是结晶速率常数,K值越大,结晶速率越快;FT= [KT/Zt]/m;a= n/m,n为Avrami指数,m为Ozawa指数,FT为单位结晶时间内体系达到某一结晶度必须选择的降温速率/(K·mina-1),表征样品在一定结晶时间内达到某一结晶度时的难易程度,其具有明确的物理意义;T为温度,t为时间,t= |T-T0|/Φ,其中Φ为冷却(或加热)速率。以lg Φ对lg t作图,由直线的斜率和截距可分别求出a和lg FT。
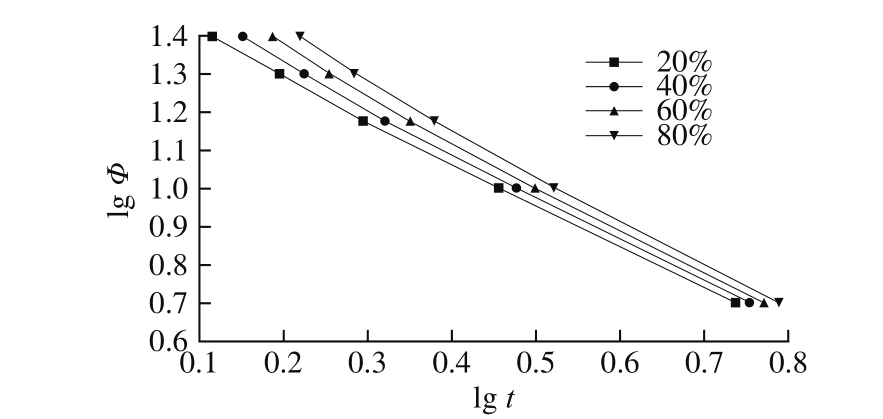
图 7 莫志深方程分析右旋龙脑的lg Φ与lg t的关系
Fig. 7 lg Φ versus lg t from the Mo s equation for D-borneol
表 5 莫志深方程分析的非等温结晶动力学参数
Table 5 Non-isothermal crystallization kinetics parameters analyzed by Mo s equation

注:Xt表示结晶过程中对应时间的相对结晶度。
由图7可以看出,在一定结晶度下,用lg Φ对lg t作图能够得到较好的线性关系,表明莫志深方程能很好地应用于右旋龙脑的非等温结晶动力学。从表5可以看出,右旋龙脑的FT随着相对结晶度的增加而增大,表明在相同时间内相对结晶度高的结晶速率高于相对结晶度低的结晶速率。
通过水蒸气蒸馏法提取从梅片树树叶中得到的挥发油含量为0.58%,挥发油中右旋龙脑含量为68.10%,同时含有多种小分子杂质。经过3 种溶剂重结晶后得到的右旋龙脑纯度比较高,石油醚和120号汽油重结晶后的晶体呈形状规则的片状,而无水乙醇重结晶后的晶体呈形状不规则的颗粒状,此结果与宋永芳等[31]的研究结果一致。虽然无水乙醇重结晶得到的晶体在形貌上与石油醚和120号汽油有所不同,但是三者在旋光性和热性能上基本上与标准品保持一致,说明3 种溶剂重结晶后的晶体形貌上的不同没有改变其他理化性质。右旋龙脑晶体非等温结晶过程中,随着降温速率的提高,结晶温度降低,相对结晶度减小,结晶时间变短。在相同时间内相对结晶度高的结晶速率高于相对结晶度低的结晶速率。考虑到实际销售中片状的晶体型产品比较受到市场欢迎,以石油醚和120号汽油作为重结晶溶剂更为合适。因此,通过溶剂重结晶提纯,可得到高纯度的右旋龙脑片晶体,为梅片树的开发利用提供了技术参考。
参考文献:
[1] CHEN L, SU J Y, LI L, et al. A new source of natural D-borneol and its characteristic[J]. Journal of Medicinal Plants Research, 2011, 5(15): 3440-3447.
[2] 吴少云, 苏健裕, 石磊, 等. 梅片树叶挥发油和天然右旋龙脑的抑菌性能研究[J]. 食品工业科技, 2012, 33(7): 85-87.
[3] 常颂平, 李玉春. 冰片对真菌细胞超微结构的影响及治疗化脓性中耳炎的临床应用[J]. 中国中药杂志, 2000(5): 50-52.
[4] JUHÁS S, CIKOS S, CZIKKOVÁ S, et al. Effects of borneol and thymoquinone on TNBS-induced colitis in mice[J]. Folia Biologica, 2008, 54(1): 1-7.
[5] 何晓静, 吕庆杰, 刘玉兰. 冰片注射液对缺血再灌注大鼠脑内炎症反应的影响[J]. 华西药学杂志, 2006(6): 523-526.
[6] 杨蕾, 李伟荣, 宓穗卿, 等. 冰片对三氯化铁诱导的大鼠动脉血栓形成的抑制作用及机制[J]. 中国实验方剂学杂志, 2010,16(6): 164-166; 170.
[7] HORVÁTHOVÁ E, SLAMEŇOVÁ D, MARŠÁLKOVÁ L, et al. Effects of borneol on the level of DNA damage induced in primary rat hepatocytes and testicular cells by hydrogen peroxide[J]. Food and Chemical Toxicology, 2009, 47(6): 1318-1323. DOI:10.1016/ j.fct.2009.03.002.
[8] HORVATHOVA E, KOZICS K, SRANCIKOVA A, et al. Borneol administration protects primary rat hepatocytes against exogenous oxidative DNA damage[J]. Mutagenesis, 2012, 27(5): 581-588. DOI:10.1093/mutage/ges023.
[9] SLAMENOVA D, HORVATHOVA E, WSOLOVA L, et al. Investigation of anti-oxidative, cytotoxic, DNA-damaging and DNA-protective effects of plant volatiles eugenol and borneol in humanderived HepG2, Caco-2 and VH10 cell lines[J]. Mutation Research, 2009, 677(1/2): 46-52.
[10] LIU R, ZHANG L, LAN X, et al. Protection by borneol on cortical neurons against oxygen-glucose deprivation/reperfusion: involvement of anti-oxidation and anti-inflammation through nuclear transcription factor kappaB signaling pathway[J]. Neuroscience, 2011, 176: 408-419. DOI:10.1016/j.neuroscience.2010.11.029.
[11] HUR J, PAK S C, KOO B, et al. Borneol alleviates oxidative stress via upregulation of Nrf2 and Bcl-2 in SH-SY5Y cells[J]. Pharmaceutical Biology, 2012, 51(1): 30-35. DOI:10.3109/13880209.2012.700718.
[12] LI W R, CHEN R Y, YANG L, et al. Pharmacokinetics of natural borneol after oral administration in mice brain and its effect on excitation ratio[J]. European Journal of Drug Metabolism and Pharmacokinetics, 2012, 37(1): 39-44. DOI:10.1007/s13318-011-0058-5.
[13] ZHANG N, LIU P, HE X. Effect of borneol, moschus, storax, and acorus tatarinowii on expression levels of four amino acid neurotransmitters in the rat corpus striatum[J]. Neural Regeneration Research, 2012, 7(6): 440-444. DOI:10.3969/ j.issn.1673-5374.2012.06.006.
[14] 李伟荣, 陈瑞玉, 黄天来, 等. 天然冰片对小鼠脑内氨基酸类神经递质含量的影响[J]. 中药新药与临床药理, 2011, 22(2): 164-167.
[15] JIN D, WANG F, QU L, et al. The distribution and expression of claudin-5 and occludin at the rat blood-optic nerve barrier after borneol treatment[J]. Molecular Biology Reports, 2011, 38(2): 913-920. DOI:10.1007/s11033-010-0184-1.
[16] YU B, RUAN M, DONG X, et al. The mechanism of the opening of the blood-brain barrier by borneol: a pharmacodynamics and pharmacokinetics combination study[J]. Journal of Ethnopharmacology, 2013, 150(3): 1096-1108. DOI:1 0.1016/ j.jep.2013.10.028.
[17] SONG J, BI H, XIE X, et al. Natural borneol enhances geniposide ophthalmic absorption in rabbits[J]. International Journal of Pharmaceutics, 2013, 445(1/2): 163-170. DOI:10.1016/ j.jep.2013.10.028.
[18] 陈建平. 右旋龙脑促进姜黄素类化合物抑制HepG2肝癌细胞增殖的分子机制研究[D]. 广州: 华南理工大学, 2015: 1-141.
[19] CHEN J P, LI L, SU J Y, et al. Enhancing effect of natural borneol on the cellular uptake of demethoxycurcumin and their combined induction of G2/M arrest in HepG2 cells via ROS generation[J]. Journal of Functional Foods, 2015, 17: 103-114. DOI:10.1016/ j.jff.2015.05.013.
[20] CHEN J P, LI L, SU J Y, et al. Proteomic analysis of G2/M arrest triggered by natural borneol/curcumin in HepG2 cells, the importance of the reactive oxygen species-p53 pathway[J]. Journal of Agricultural and Food Chemistry, 2015, 63: 6440-6449. DOI:10.1021/acs. jafc.5b01773.
[21] CHEN J P, LI L, SU J Y, et al. Natural borneol enhances bisdemethoxycurcumin-induced cell cycle arrest in the G2/M phase through up-regulation of intracellular ROS in HepG2 cells[J]. Food & Function, 2015, 6: 740-748. DOI:10.1039/c4fo00807c.
[22] CHEN J P, LI L, SU J Y, et al. Synergistic apoptosis-inducing effects on A375 human melanoma cells of natural borneol and curcumin[J]. PLoS ONE, 2014, 27, 9(6): e101277. DOI:10.1371/journal. pone.0101277.
[23] SU J Y, LAI H Q, CHEN J P, et al. Natural borneol, a monoterpenoid compound, potentiates selenocystine-induced apoptosis in human hepatocellular carcinoma cells by enhancement of cellular uptake and activation of ROS-mediated DNA damage[J]. PLoS ONE, 2013, 8(6): e63502. DOI:10.1371/journal.pone.0063502.
[24] 李毓敬, 朱良锋, 陆碧瑶, 等. 天然右旋龙脑新资源梅片树的研究[J].植物学报, 1987, 29(5): 527-531.
[25] CHEN X Y, ZHAO X N, ZENG H F, et al. Natural borneol recycling from Cinnamomum camphor chvar. borneol oil residue by fractional distillation and recrystallization[J]. Tropical Journal of Pharmaceutical Research, 2014, 13(9): 1463-1470. DOI:10.4314/tjpr.v13i9.12.
[26] 国家药典委员会. 中华人民共和国药典[M]. 北京: 化学工业出版社, 2010: 2010-2098.
[27] SU J, CHEN J, LI L, et al. Formation of β-cyclodextrin inclusion enhances the stability and aqueous solubility of natural borneol[J]. Journal of Food Science, 2012, 77(6): 658-664. DOI:10.1111/j.1750-3841.2012.02713.x.
[28] SU J, CHEN J, LI L, et al. Preparation of natural borneol/ 2-hydroxypropyl-β-cyclodextrin inclusion complex and its effect on the absorption of tetramethylpyrazine phosphate in mouse[J]. Chemical & Pharmaceutical Bulletin, 2012, 60(6): 736-742.
[29] 田龙. 不同溶剂重结晶对HMX晶体密度影响的研究[D]. 太原: 中北大学, 2013: 1-47.
[30] 莫志深. 一种研究聚合物非等温结晶动力学的方法[J]. 高分子学报, 2008(7): 656-661.
[31] 宋永芳, 罗嘉梁. 高纯度天然右旋龙脑的制备研究[J]. 林产化学与工业, 2003, 23(3): 11-14. DOI:10.3321/j.issn:0253-2417.2003.03.003.
Preparation and Characterization of D-Boreonl from Leaves of Dryobalanops aromatica
SU Jianyu1,2, MEI Guodong1,2, FANG Liming2,3,*, HUANG Yanbo1,2,4(1. School of Food Science and Engineering, South China University of Technology, Guangzhou 510640, China;
2. Guangdong Province Key Laboratory for Green Processing of Natural Products and Product Safety, Guangzhou 510640, China; 3. School of Materials Science and Engineering, South China University of Te chnology, Guangzhou 510640, China; 4. State Key Laboratory of Pulp and Paper Engineering, Guangzhou 510640, China)
Abstract:In this study, we investigated the preparation of highly pure D-borneol from the essential oil extracted from the leaves of Dryobalanops aromatica through steam distillation. Crude D-borneol was obtained after the essential oil was subjected to freeze-drying and centrifugation. Then, the crude product was purifi ed by recrystallization in petroleum ether, 120#gasoline, and anhydrous ethanol, respectively. The chemical composition, optical rotation, morphology and thermal properties of the as-obtained crystals were characterized. The results showed that the content of D-borneol in the essential oil was about 68.10%, and its purity was more than 98% after recrystallization. There were no obvious differences in mass spectrum or optical rotation between D-bormeol standard and the solvent recrystallized crystals. The appearance of the petroleum ether and gasoline 120#recrystallized crystals showed regular hexagons with clear boundary, while the ethanol recrystallized crystal was irregularly and granularly dispersed or aggregated. However, the results of thermal analysis showed that the thermal properties of all three recrystallized crystals were the same, indicating that the appearance of crystals did not affect their thermal performance. Furthermore, Mo’s equation could describe the non-isothermal crystallization process of D-borneol crystal. This study can provide an important technical reference for the exploitation and utilization of Dryobalanops aromatica and the production of high-purity D-borneol.
Key words:Dryobalanops aromatica; D-borneol; recrystallization; crystal morphology; high purity
DOI:10.7506/spkx1002-6630-201717025
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2017)17-0151-07
收稿日期:2016-06-02
基金项目:广东省自然科学基金项目(2014A030313265);广东省科技计划项目(2016A010105020;2015A020209020;2015A020209036);广东省扬帆计划项目(201312H05);广州市科技计划项目(201707010129);华南理工大学中央高校基本科研业务费专项资金项目(2017ZD084)
作者简介:苏健裕(1979—),男,副研究员,博士,研究方向为天然产物制备与生物利用。E-mail:jysu@scut.edu.cn
*通信作者:方立明(1979—),男,副研究员,博士,研究方向为生物医用材料制备与利用。E-mail:lmfang@scut.edu.cn