
图 1 3 种混合标准品的HPLC色谱图
Fig. 1 HPLC chromatogram of mixture of three standards
刘梦培,铁珊珊,纵 伟*,张丽华,赵光远
(郑州轻工业学院食品与生物工程学院,河南 郑州 450002)
摘 要:研究高压微射流处理对从葡萄籽中提取得到的原花青素中儿茶素、原花青素B2和表儿茶素含量的影响。将原花青素在不同的处理压力(100、140、180、220 MPa和260 MPa)条件下进行1~4 次循环处理,采用高效液相色谱进行定量分析。结果表明:随着处理压力的增加,儿茶素、原花青素B2和表儿茶素含量随之增加;随着处理次数的增加,含量基本呈先增加后减少的趋势;与其他处理条件下的原花青素含量相比,260 MPa条件下循环处理两次,儿茶素(0.163 2 mg/mL)、表儿茶素的质量浓度(0.128 6 mg/mL)最高;260 MPa条件下循环3 次获得的原花青素B2质量浓度(0.057 6 mg/mL)最高。说明高压微射流处理会破坏高聚原花青素分子链之间的非共价键,使其解聚生成活性更高的单体、低聚体。
关键词:动态高压微射流;儿茶素;原花青素B2;表儿茶素;高效液相色谱
原花青素又称缩合单宁,通常存在于植物的果实和种子中,在谷物、蔬菜和水果中含量较为丰富[1-3]。它是由儿茶素和表儿茶素单体以及这些单体通过C2-O-C7的醚键和C4-C8/C4-C6两个键连接在一起(A型)或者C4-C8/ C4-C6一个键结合(B型)而成的低聚体和高聚体组成的混合物[4-6]。聚合度2~4的为低聚原花青素,聚合度大于4的为高聚原花青素[7]。原花青素的抗氧化活性与聚合度有很大的关系,单体的抗氧化活性低于二聚体,其抗氧化活性随着聚合度的升高而降低[8-9]。赵平等[10]研究发现采用酸处理可以使平均聚合度为6.28的高聚原花青素水解为平均聚合度为2.74的低聚原花青素(乙醇体积分数为39%);Qi Yajing等[11]研究发现在酸性条件下儿茶素可以促进高粱高聚原花青素解聚生成低聚原花青素。
动态高压微射流(dynamic high pressure microfluidization,DHPM)均质技术是一种特殊的均质技术[12-13],主要利用高速压力、高频振动、瞬时压力下降、强烈的剪切、空穴爆炸力和短时间内(少于5 s)达到一定压力等综合作用达到相应的目的[14-15],其在处理过程中只发生物理变化。Lagoueyte等[16]研究发现黄原胶经高压微射流处理后其非共价键发生断裂,导致高聚体降解为小的聚合体;章文琴等[17]研究发现可溶性膳食纤维经DHPM处理后,分子氢键断裂重组、侧链断裂、分子质量降低;新疆大学敬思群等[18]研究发现采用DHPM辅助提取技术提取原花青素,会对原花青素的结构产生影响。但关于DHPM物理改性对原花青素具体的影响机制报道较少。
儿茶素是一种黄酮类物质,具有抗菌、抗氧化、抗癌等作用[19];原花青素B2为二聚体,具有抗氧化、抗肿瘤等活性[20];表儿茶素是一种在人类饮食中含量丰富的黄酮类物质,具有降血压、血脂的作用[21]。因此,本实验主要研究DHPM处理结合高效液相色谱(high performance liquid chromatography,HPLC)法研究DHPM处理压力和次数对原花青素中儿茶素、原花青素B2和表儿茶素含量的影响。
1.1 材料与试剂
葡萄籽提取物(原花青素含量≥95%)、儿茶素、原花青素B2以及表儿茶素标准品(纯度均≥98%)天津市尖峰天然产物研究开发有限公司;乙腈、甲醇、乙醇、冰乙酸均为色谱级 国药集团试剂公司。
1.2 仪器与设备
FPG12800高压纳米均质机 安盛联合科技有限公司;XP205微量天平 瑞士梅特勒-托利多公司;KQ-700DE型数控超声波清洗机 昆山市超声仪器有限公司;1525-2489型HPLC仪 美国Waters公司。
1.3 方法
1.3.1 色谱条件
HPLC系统由1525高压泵和2489紫外-可见检测器组成。色谱柱为SunFireTMC18(4.6 mm×150 mm,5 μm),柱温为25 ℃,样品的上样体积为20 μL。流动相A为0.4%的醋酸溶液,流动相B为乙腈,洗脱程序为:0~55 min,5%~20% B;55~70 min,20%~25% B;最后用5%流动相B与95%流动相A平衡5 min,以备下次进样。总流速为1 mL/min,检测波长为280 nm[22]。
1.3.2 原花青素的处理
将5 g原花青素溶于50%的乙醇溶液中,定容至1 000 mL,超声溶解20 min。然后采用DHPM在不同的处理压力(100、140、180、220 MPa和260 MPa)条件下进行1~4 次循环处理,经0.45 μm有机滤膜过滤后,与原液进行比较,分析DHPM对原花青素中儿茶素、原花青素B2以及表儿茶素的影响。
1.3.3 标准曲线的制备
准确称取儿茶素、原花青素B2和表儿茶素标准品各4 mg分别溶于50%的乙醇溶液中,定容至10 mL的棕色容量瓶中,以此为母液稀释至不同的质量浓度(0.40、0.25、0.20、0.10、0.05、0.01 mg/mL),经0.45 μm的微孔过滤后用于HPLC分析。
1.4 数据处理
采用Origin 8.5、SPSS等软件处理实验数据,结果采用±s表示,P<0.05表示差异显著。
2.1 标准曲线
按照上述的HPLC条件测定儿茶素(0.15 mg/mL)、原花青素B2(0.04 mg/mL)、表儿茶素(0.15 mg/mL)混合标准品溶液。由图1可知,3 种混合标准品的HPLC完全分离且基线平稳,说明该方法可以用来测定不同处理条件下原花青素中儿茶素、原花青素B2和表儿茶素的含量[23]。

图 1 3 种混合标准品的HPLC色谱图
Fig. 1 HPLC chromatogram of mixture of three standards
为了准确测定儿茶素、原花青素B2和表儿茶素的含量,分别测定不同质量浓度梯度下的这3 种标准品溶液,以峰面积为纵坐标、质量浓度为横坐标,计算3 种标准品的标准曲线。从表1中可知,回归系数R2均大于0.990 0,说明各种标准品的溶液质量浓度与峰面积呈现良好的线性关系[24],可以准确反映出原花青素中各物质的含量。
表 1 3 种标准品的保留时间、回归方程
Table 1 Retention times and regression equations of three standards
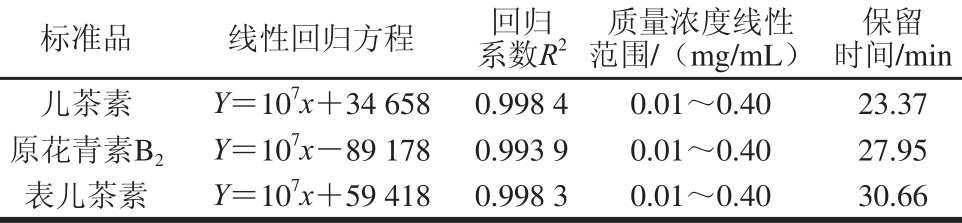
2.2 原花青素HPLC谱图
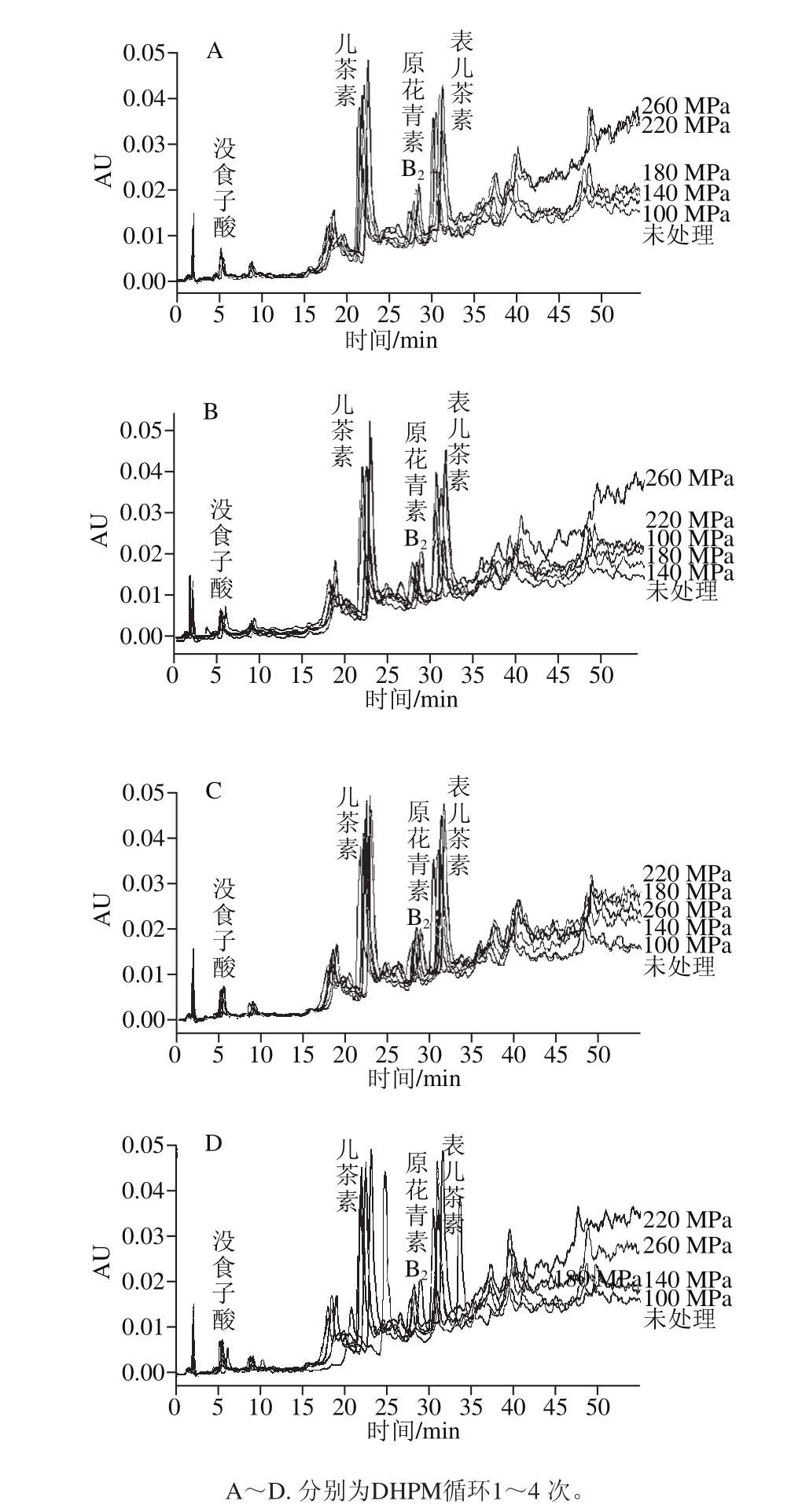
图 2 不同处理压力和循环次数下原花青素的HPLC图
Fig. 2 HPLC chromatograms of proanthocyanidins subjected to different cycles of DHMP at different pressures
由图2可知,不同条件下原花青素的变化趋势一致,但相对峰面积有所不同,随着处理压力增大,儿茶素、原花青素B2以及表儿茶素的相对峰面积呈现增加趋势,说明高压微射流处理对原花青素的组分含量具有影响。
2.3 DHPM处理对原花青素组分的影响
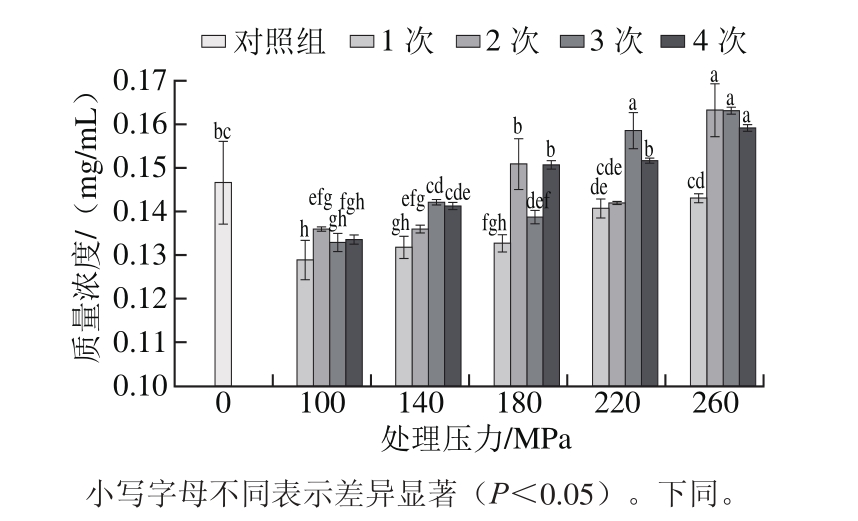
图 3 DHPM处理压力和循环次数对原花青素中儿茶素含量的影响
Fig. 3 Effect of DHMP cycle and pressure on catechin content of GSPE
2.3.1 DHPM处理对儿茶素含量的影响不同DHPM处理压力和次数对儿茶素含量的影响见图3,随着处理压力增加,儿茶素的含量呈现增加趋势,处理次数对其含量也存在一定影响,当处理压力为
260 MPa,循环两次条件下获得的儿茶素质量浓度最高(0.163 2 mg/mL)。未经高压处理的儿茶素(对照组)质量浓度为0.146 8 mg/mL,一次处理条件下儿茶素的含量总体显著低于对照组(P<0.05),说明一次处理对儿茶素含量影响较小,随着处理次数的增加,儿茶素的含量基本呈现先增加后降低的趋势。100、140 MPa条件下获得的儿茶素含量低于对照组,然后随着压力的增加,儿茶素质量浓度升高,这是因为DHPM 的一部分能量用于扯开聚合物的长链,当链被打开后,聚合物暴露更多的非共价键,使其更加容易受到机械力的降解[25];随着处理压力的增大,DHPM提供的剪切作用力、碰撞作用力以及空穴作用增强[26],容易造成高聚原花青素分子链断裂,所以儿茶素含量增加,这与梁瑞红等[27]对于低酯果胶分子质量降低研究结果一致。
2.3.2 DHPM处理对原花青素B2含量的影响
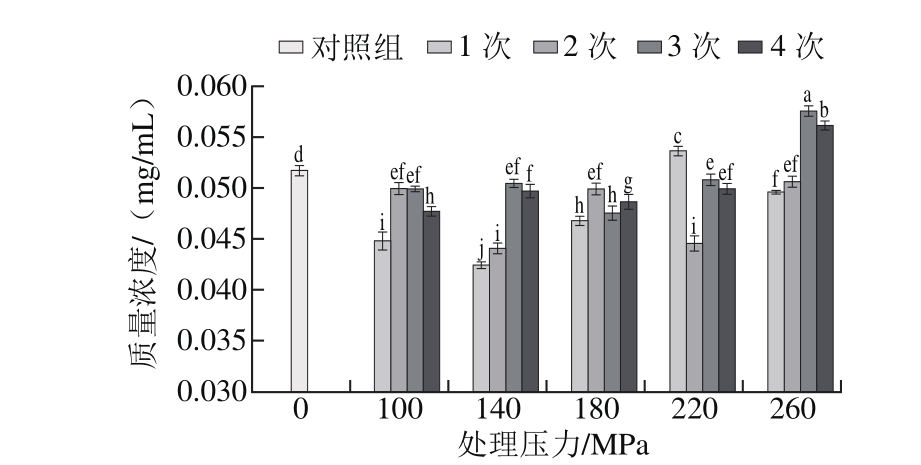
图 4 DHPM处理压力和循环次数对原花青素B2含量的影响
Fig. 4 Effect of DHMP cycle and pressure on procyanidin B2content of GSPE
由图4可知,DHPM处理压力和次数对原花青素B2的含量影响较小,未经高压处理的原花青素B2质量浓度为0.051 8 mg/mL,100、140、180 MPa条件下原花青素B2的质量浓度均低于该值,随着压力的进一步上升,质量浓度有所增加,260 MPa条件下循环处理3 次获得的原花青素B2质量浓度最高(0.057 6 mg/mL)。可能是由于随着处理压力的升高,高聚原花青素解聚,其含量有所增加,但构成高聚体中所含的原花青素B2较低,所以其含量变化不大。
2.3.3 DHPM处理对表儿茶素含量的影响

图 5 DHPM处理压力和次数对原花青素中表儿茶素含量的影响
Fig. 5 Effect of DHMP cycle and pressure on epicatechin content of GSPE
由图5可知,处理压力和次数对表儿茶素含量影响较大,在260 MPa条件下循环处理两次获得表儿茶素质量浓度最高(0.128 6 mg/mL)。未经高压处理的原花青素中表儿茶素质量浓度为0.091 5 mg/mL,除140 MPa条件下处理一次,经高压处理的表儿茶素含量均显著高于对照组(P<0.05),随着处理次数增加,含量总体呈先上升后下降趋势,且随着处理压力增加,含量呈上升趋势,可能是由于动态超高压微射流处理过程中,会使高聚原花青素的氢键、离子键等非共价键发生断裂[28],从而生成的表儿茶素含量相对较高,该结论与施雅等[29]关于金荞麦高聚原花青素的催化氢解反应研究结果一致。
本实验研究了DHPM对从葡萄籽中提取得到的原花青素中儿茶素、原花青素B2和表儿茶素含量的影响。根据HPLC定量分析可知,随着处理压力增加,几种物质的含量随之增加;随着处理次数的增加,含量先增加后下降;不同处理条件下这几种物质的含量均存在差异,260 MPa条件下循环处理两次,儿茶素、表儿茶素的含量最高;260 MPa条件下循环处理3 次获得的原花青素B2含量最高。说明随着处理压力和次数的变化,DHPM所提供的机械作用力增强,破坏高聚原花青素分子内的非共价键,导致这几种物质含量增加,具体的影响机制需要进一步分析。
参考文献:
[1] KUHNERT S, LEHMANN L, WITERHALTER P. Rapid characterisation of grape seed extracts by a novel HPLC method on a diol stationary phase[J]. Journal of Functional Foods, 2015, 15: 225-232. DOI:10.1016/j.jff.2015.03.031.
[2] 彭元鸿. 葡萄籽主要成分及高纯度低聚原花青素制备研究[D]. 重庆:重庆大学, 2014: 14-18.
[3] GU L W, KELM M, HAMMERSTONE J F, et al. Fractionation of polymeric procyanidins from Lowbush Blueberry and quantifi cation of procyanidins in selected foods with an optimized normal-phase HPLCMS fi uorescent detection method[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4852-4860. DOI:10.1021/jf020214v.
[4] SUI Y, ZHENG Y, LI X P, et al. Characterization and preparation of oligomeric procyanidins from Litchi chinensis pericarp[J]. Fitoterapia, 2016, 112: 168-174. DOI:10.1016/j.fi tote.2016.06.001.
[5] 张慧文, 张玉, 马超美. 原花青素的研究进展[J]. 食品科学, 2015, 36(5): 296-304. DOI:10.7506/spkx1002-6630-201505052.
[6] KÖHLERA N, WRAY V, WINTERHALTER P. Preparative isolation of procyanidins from grape seed extracts by high-speed countercurrent chromatography[J]. Journal of Chromatography A, 2008, 1177(1): 114-125. DOI:10.1016/j.chroma.2007.11.028.
[7] 格日勒, 亓伟, 刘淑娟. 原花青素HPLC测定方法研究进展[J]. 中国酿造, 2014, 33(6): 6-9. DOI:10.11882/j.issn.0254-5071.2014.06.002.
[8] 孙芸, 徐宝才, 谷文英, 等. 葡萄籽原花青素的聚合度与抗氧化活性关系[J]. 食品与发酵工业, 2006, 32(10): 41-46. DOI:10.13995/ j.cnki.11-1802/ts.2006.10.011.
[9] CAI Y, YU Y J, DUAN G L, et al. Study on infrared-assisted extraction coupled with high performance liquid chromatography (HPLC) for determinate on of catechin, epicatechin, and procyanidin B2 in grape seeds[J]. Food Chemistry, 2011, 127(4): 1872-1877. DOI:10.1016/j.foodchem.2011.02.026.
[10] 赵平, 张月萍, 任鹏. 原花青素高聚体水解[J]. 中国食品添加剂, 2012(5): 124-128.
[11] QI Yajing, ZHANG Hui, AWIKA J M, et al. Depolymerization of sorghum procyanidin polymers into oligomers using HCl and epicatechin: reaction kinetics and optimization[J]. Journal of Cereal Science, 2016, 70: 170-176. DOI:10.1016/j.jcs.2016.06.002.
[12] ZOU L Q, LIU W, LIU W L, et al. Characterization and bioavailability of tea polyphenol nanoliposome prepared by combining an ethanol injection method with dynamic high-pressure microfluidization[J]. Journal of Agricultural and Food Chemistry, 2014, 62(4): 934-941. DOI:10.1021/jf402886s.
[13] SUN C X, YANNG J, LIU F G, et al. Effects of dynamic highpressure microfi uidization treatment and the presence of quercetagetin on the physical, structural, thermal, and morphological characteristics of zein nanoparticles[J]. Food and Bioprocess Technology, 2016, 9(2): 320-330. DOI:10.1007/s11947-015-1627-4.
[14] LIU C M, LIANG R H, DAI T T, et al. Effect of dynamic high pressure microfluidization modified insoluble dietary fiber on gelatinization and rheology of rice starch[J]. Food Hydrocolloids, 2016, 57: 55-61. DOI:10.1016/j.foodhyd.2016.01.015.
[15] WAN J, LIU C M, LIU W, et al. Optimization of instant edible films based on dietary fiber processed with dynamic high pressure microfi uidization for barrier properties and water solubility[J]. LWTFood Science and Technology, 2015, 60(1): 603-608. DOI:10.1016/ j.lwt.2014.07.032.
[16] LAGOUEYTE N, PAQUIN P. Effects of microfluidization on the functional properties of xanthan gum[J]. Food Hydrocolloids, 1998, 12(3): 365-371. DOI:10.1016/S0268-005X(98)00004-6.
[17] 章文琴, 刘成梅, 刘伟, 等. 动态高压微射流技术对可溶性大豆多糖结构的影响[J]. 食品科学, 2010, 31(9): 30-34.
[18] 敬思群, 柴文杰. 一种昆仑雪菊原花青素的提取方法及其在延缓衰老中的应用: 201410365439.4[P]. 2014-07-29.
[19] FATHIMA A, RAO J R. Selective toxicity of catechin: a natural fi avonoid towards bacteria[J]. Applied Microbiology and Biotechnology, 2016, 100(14): 6395-6402. DOI:10.1007/s00253-016-7492-x.
[20] 王皎, 宋新波, 刘成航, 等. HPLC法测定不同品种苹果中原花青素B2的含量[J]. 食品科学, 2012, 33(24): 293-295.
[21] LITTERIOA M C, VAZQUEZ PRIETO M A, ADAMO A M, et al. (-)-Epicatechin reduces blood pressure increase in high-fructosefed rats: effects on the determinants of nitric oxide bioavailability[J]. The Journal of Nutritional Biochemistry, 2015, 26(7): 745-751. DOI:10.1016/j.jnutbio.2015.02.004.
[22] 韦琴. 板栗壳中原花青素含量检测方法的比较研究[J]. 食品与机械, 2016, 32(3): 77-81. DOI:10.136562/j.issn.1003-5788.2016.03.01.
[23] 李学伟, 蹇华丽, 周婉红, 等. 采用高效液相色谱法分析荔枝酒中的酚类物质[J]. 食品与发酵工业, 2012, 38(11): 142-146. DOI:10.13995/j.cnki.11-1802/ts.2012.11.007.
[24] 张璐, 潘佩佩, 陈赛贞. RP-HPLC法同时测定原花青素中儿茶素、表儿茶素、没食子酸、原花青素B2的含量[J]. 中国药科大学学报, 2016, 47(1): 54-57. DOI:10.11665/j.issn.1000-5048.20160107.
[25] 陈军, 戴涛涛, 刘成梅, 等. 动态高压微射流在食品大分子改性方面的应用[J]. 中国农业科技导报, 2015, 17(5): 106-113. DOI:10.13304/ j. nykjdb.2015.479.
[26] 王飞, 韩东辉, 魏晓奕, 等. 动态超高压微射流技术对纤维素水化性质的影响研究[J]. 广东化工, 2014, 41(22): 49-50; 59.
[27] 梁瑞红, 王玲华, 帅希祥, 等. 动态高压微射流处理对低酯果胶物化性质及其结构的影响[J]. 现代食品科技, 2015, 31(1): 114; 115-119. DOI:10.13982/j.mfst.1673-9078.2015.1.021.
[28] 王国栋. 超高压处理对食品品质的影响[D]. 大连: 大连理工大学, 2013: 11-14.
[29] 施雅, 雍克岚, 汪凌波, 等. 金荞麦高聚原花青素的氢化降解反应[J].食品研究与开发, 2010, 31(3): 138-141.
Effect of Dynamic High-Pressure Microfi uidization on the Composition of Grape Seed Proanthocyanidins
LIU Mengpei, TIE Shanshan, ZONG Wei*, ZHANG Lihua, ZHAO Guangyuan
(School of Food and Bioengineering, Zhengzhou University of Light Industry, Zhengzhou 450002, China)
Abstract:In this study, the effect of dynamic high-pressure microfluidization (DHPM) on the contents of catechin, procynidin B2and epicatechin in grape seed proanthocyanidin extract (GSPE) was studied. The proanthocyanidins were subjected to different cycles (1–4) of DHPM at different pressures (100, 140, 180, 220 and 260 MPa) and then analyzed by high performance liquid chromatography (HPLC). The results showed that the contents of these substances increased with increasing DHPM pressures, but they rose fi rstly and then declined with increasing number of DHPM cycles. Two DHPM cycles at 260 MPa resulted in the highest contents of catechin and epicatechin (0.163 2 and 0.128 6 mg/mL, respectively) among all treatments and the highest content of procynidin B2of 0.057 6 mg/mL was obtained after three DHPM cycles. Hence, it was demonstrated that DHPM could destroy the non-covalent bonds between polymeric proanthocyanidin chains and consequently depolymerize them into oligomers and monomers with higher biological activity.
Key words:dynamic high-pressure microfluidization (DHPM); catechic; procynidin B2;epicatechic; high performance liquid chromatography chromatography (HPLC)
DOI:10.7506/spkx1002-6630-201717027
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)17-0164-04
引文格式:
刘梦培, 铁珊珊, 纵伟, 等. 高压微射流处理对葡萄籽原花青素组分构成的影响[J]. 食品科学, 2017, 38(17): 164-167.
DOI:10.7506/spkx1002-6630-201717027. http://www.spkx.net.cn
LIU Mengpei, TIE Shanshan, ZONG Wei, et al. Effect of dynamic high-pressure microfi uidization on the composition of grape seed proanthocyanidins[J]. Food Science, 2017, 38(17): 164-167. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201717027. http://www.spkx.net.cn
收稿日期:2017-03-01
基金项目:河南省科技创新杰出人才计划项目(174200510002);河南省高校科技创新项目(16IRTSHN010)
作者简介:刘梦培(1984—),女,讲师,博士,研究方向为果蔬加工。E-mail:qasd0232@163.com
*通信作者:纵伟(1965—),男,教授,博士,研究方向为果蔬加工。E-mail:Zongwei1965@126.com