表 1 实验所用酸性电解水理化指标
Table 1 Physicochemical parameters of acidic electrolyzed water used in the experiment

注:TW.自来水(tap water);-.未检出。
刘 瑞1,于章龙2,*,薛 冲1,武 艺1,武欣燕1,李明依1
(1.运城学院生命科学系,山西 运城 044000;2.山西省农业科学院棉花研究所,山西 运城 044000)
摘 要:为了探究市售豆芽携带细菌种类,寻求有效的杀菌方法,采用16S rRNA基因序列分析对分离的细菌进行种属鉴定,并考察了不同pH值的酸性电解水对豆芽的杀菌效果。结果表明,分离出的5 株细菌分别为Kosakonia、Staphylococcus、Klebsiella、Enterobacter和Enterobacter属成员。pH值为3.02、4.47和5.58,有效氯质量浓度为46.00 mg/L左右的酸性电解水处理市售新鲜豆芽,可以显著降低其微生物数量。pH 4.47、有效氯质量浓度为46.09 mg/L的酸性电解水处理黄豆芽,使其细菌总数、酵母菌和霉菌菌落总数、大肠菌群菌落数分别降低了1.14、2.48、1.29(lg(CFU/g)),该指标的酸性电解水处理绿豆芽,使其细菌菌落总数、酵母菌和霉菌菌落总数、大肠菌群菌落数分别降低1.23、1.42、1.25(lg(CFU/g))。因而酸性电解水对于提高市售豆芽的食用安全性可以发挥积极的作用。关键词:豆芽;细菌;种属鉴定;酸性电解水;杀菌
豆芽是利用豆类种子发芽、生长而得到的,因其质地清脆爽口、鲜嫩味美、营养丰富以及生产方便等特点,使得豆芽成为深受人们喜爱的蔬菜之一。
豆芽的市场销售量逐年递增,该产业被一致看好的同时,也逐渐暴露出一些问题,这其中最令人担忧的便是豆芽的食用安全性问题。由于在种子发芽生长为豆芽的过程中,其生长环境的温度、湿度也同样适宜微生物的繁殖,因此种子上携带的微生物会出现在豆芽上,而对于钟爱生鲜食品的消费者而言,这成为一个巨大的安全隐患[1-3]。例如,于2011年在欧洲爆发的一起大规模食源性疾病事件,起因为德国一家农场的豆芽污染了Escherichia coli O104:H4。该事件的发生也再一次为我们敲响警钟。而当前我国的豆芽生产多以家庭作坊式生产为主,不具备必要的卫生控制条件,但为了防止豆芽被污染而腐烂,使用了大量杀菌剂等化学药品,更有甚者使用青霉素等药品,使得豆芽的质量安全难以保证。
因此,有必要探究常见市售豆芽携带微生物的种类及数量,并寻求一种安全、高效、经济的适用于豆芽的杀菌措施,切实提高豆芽的食用安全性。而电解水的应用为该问题的解决提供了切实可行的思路。
电解水,又称电生功能水、电解离子水,是指在特殊的电解装置中电解稀盐酸或氯化钠溶液而得到的酸性电解水(acidic electrolyzed water,AEW)和碱性电解水(alkaline electrolyzed water,AlEW)的总称[4]。AEW因其杀菌瞬时高效、杀菌谱广[5]、无害安全、制取方便、成本低廉等特点而被广泛应用于食品加工[6-7]、医疗卫生[8]和农业生产[9-10]等领域。
本研究旨在对常见的市售豆芽即绿豆芽和黄豆芽表面携带的细菌种类进行鉴定,确定是否存在潜在的食源性致病菌,以期为电解水处理豆芽、杀灭其携带的细菌的作用机理提供研究基础;另外,明确市售绿豆芽和黄豆芽的细菌菌落总数、酵母菌和霉菌菌落总数、大肠菌群菌落数,并考察不同pH值的电解水对豆芽的杀菌效果。以期为电解水在提高豆芽食用安全性方面的应用提供理论依据。
1.1 材料与试剂
绿豆芽、黄豆芽,市售,于4 ℃保存备用,并于6 h内使用完毕。
平板计数琼脂培养基、孟加拉红培养基、结晶紫中性红胆盐琼脂培养基、营养肉汤培养基 北京奥博星生物技术有限责任公司。实验所用试剂均为分析纯。实验用水为去离子水。
1.2 仪器与设备
XY-L-150电生功能水发生装置 宝鸡新宇光机电有限责任公司;HS-1300U超净工作台 苏州净化设备有限公司;DNP-9052恒温培养箱 上海精宏实验设备公司;TGL-16M冷冻高速离心机 长沙湘仪离心机仪器有限公司;LDZX-50K立式压力蒸汽灭菌锅 上海申安医疗器械厂;聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国伯乐公司。
1.3 方法
1.3.1 豆芽表面细菌的分离
称取25 g新鲜豆芽菜样品,置于225 mL无菌生理盐水中,充分摇匀振荡,然后梯度稀释,取适宜稀释度,采用倾注法与平板计数琼脂培养基混合并摇匀,待培养基凝固后,倒置平板于37 ℃培养48 h。观察平板上长出的单菌落,分别挑取色泽、形态、大小等外观不同的菌落,接种于营养肉汤培养基中,于37 ℃培养48 h备用。
1.3.2 菌株的16S rRNA基因序列分析及系统发育树构建
提取菌株基因组总DNA,以此为模板,采用细菌通用引物进行16S rRNA的PCR扩增。正向引物:5 -AGAGTTTGATCCTGGCTCAG-3 ;反向引物:5 -TACGGTTACCTTGTTACGACTT-3 ,由大连宝生物公司合成。扩增体系为:DNA模板(约50 mg/L)1 μL,扩增Buffer 2 μL,dNTPs (20 mmol/L) 1.6 μL,正、反向引物(5 μmol/L)各1 μL,补水至20 μL。扩增条件:94 ℃预变性6 min;94 ℃变性45 s,52 ℃退火45 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。PCR产物纯化及测序由北京三博远志生物科技公司完成。测序结果在EzBioCloud(EzTaxon)数据库[11]中进行同源性搜索,选取与其同源性较高的相关序列,采用MEGA 6.0软件包进行同源性比较分析,并构建系统发育进化树。
1.3.3 电解水的制备及理化指标测定
向电解水发生装置的电解质储存罐中注入16 g/L的氯化钠溶液,启动仪器后,当电流值显示为28 A左右时,用相应的容器在AEW和AlEW出口,同时接取AEW和AlEW。电解水的pH值用pH计直接测定,而电解水的有效氯浓度采用碘量法测定[12]。本实验所用有效氯基本相同,而不同pH值电解水的制备,是将AlEW添加于AEW中,调整其pH值,而维持其有效氯质量浓度在46.00 mg/L左右。实验所用AEW的理化指标如表1所示。
表 1 实验所用酸性电解水理化指标
Table 1 Physicochemical parameters of acidic electrolyzed water used in the experiment

注:TW.自来水(tap water);-.未检出。
1.3.4 样品的处理
将25 g新鲜豆芽样品置于灭过菌的烧杯中,并浸泡于200 mL相应的电解水处理液中(表1)维持10 min。然后将处理液倒掉,豆芽沥干备用。
1.3.5 豆芽表面微生物数量的统计
豆芽微生物数量的统计参照已有文献[13]并稍作修改。将1.3.4节中沥干的豆芽浸泡于225 mL无菌生理盐水中,振荡溶液使得豆芽表面附着的微生物转移至生理盐水中。充分摇匀后,取1 mL液体进行梯度稀释,而后取适宜的稀释度的菌液,采用倾注法进行菌落计数。菌液与平板计数培养基充分混匀,待培养基凝固后,倒置于37 ℃培养48 h,用于统计菌落总数。
菌液与孟加拉红培养基充分混匀,待培养基凝固后,倒置于28 ℃培养48 h,用于统计酵母菌和霉菌菌落总数;菌液与结晶紫中性红胆盐琼脂培养基充分混匀,待培养基凝固后,倒置于37 ℃培养48 h,用于统计大肠菌群菌落数;微生物的菌落数为3 次平行实验所得数值的均值。
1.4 数据统计分析
对于每项指标的测定,均有独立的重复实验,将数值汇总求得平均值,并用SPSS 16.0软件中的Duncan方差分析比较处理组间的差异显著性,显著性差异水平为P<0.05。
2.1 市售豆芽携带细菌种属鉴定
通过对市售新鲜绿豆芽和黄豆芽表面分离的色泽、形态、大小等外观不同的细菌16S rRNA基因进行扩增,共鉴定出5 株细菌,分别为菌株A、B、C、D、E。
采用PCR扩增菌株A的16S rRNA基因获得大小为1 439 kb的片段,菌株A的16S rRNA基因序列测定结果显示其为Kosakonia属成员,EzTaxon数据库登录号为AJ 508303。用MEGA 6.0软件包邻接法构建菌株的系统发育进化树如图1所示。

图 1 菌株A(AJ 508303)系统发育进化树
Fig. 1 Phylogenetic tree of strain A (AJ 508303)
采用PCR 扩增菌株B的16S rRNA基因获得大小为1 456 kb的片段。菌株B的16S rRNA基因序列测定结合系统发育分析显示其为Staphylococcus属成员,EzTaxon数据库登录号为L 37605,构建菌株的系统发育进化树如图2所示。

图 2 菌株B(L 37605)系统发育进化树Fig. 2 Phylogenetic tree of strain B (L 37605)
采用PCR扩增菌株C的16S rRNA基因获得大小为1 438 kb的片段。菌株C的16S rRNA基因序列测定结合系统发育分析显示其为Klebsiella属成员,EzTaxon数据库登录号为JQ 070300,构建菌株的系统发育进化树如图3所示。
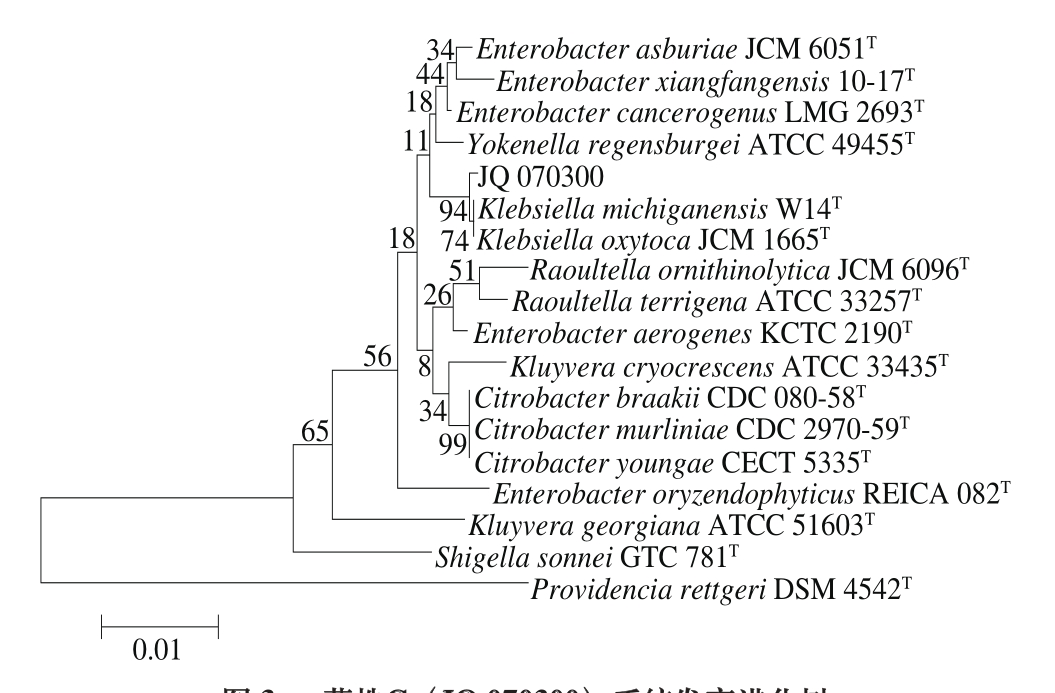
图 3 菌株C(JQ 070300)系统发育进化树
Fig. 3 Phylogenetic tree of strain C (JQ 070300)
采用PCR扩增菌株D的16S rRNA基因获得大小为1 438 kb的片段。菌株D的16S rRNA基因序列测定结合系统发育分析显示其为Enterobacter属成员,EzTaxon数据库登录号为Z 96079,构建菌株的系统发育进化树如图4所示。
采用PCR扩增菌株E的16S rRNA基因获得大小为1 443 kb的片段。菌株E的16S rRNA基因序列测定结合系统发育分析显示其为Enterobacter属成员,EzTaxon数据库登录号为JF 795011,构建菌株的系统发育进化树如图5所示。
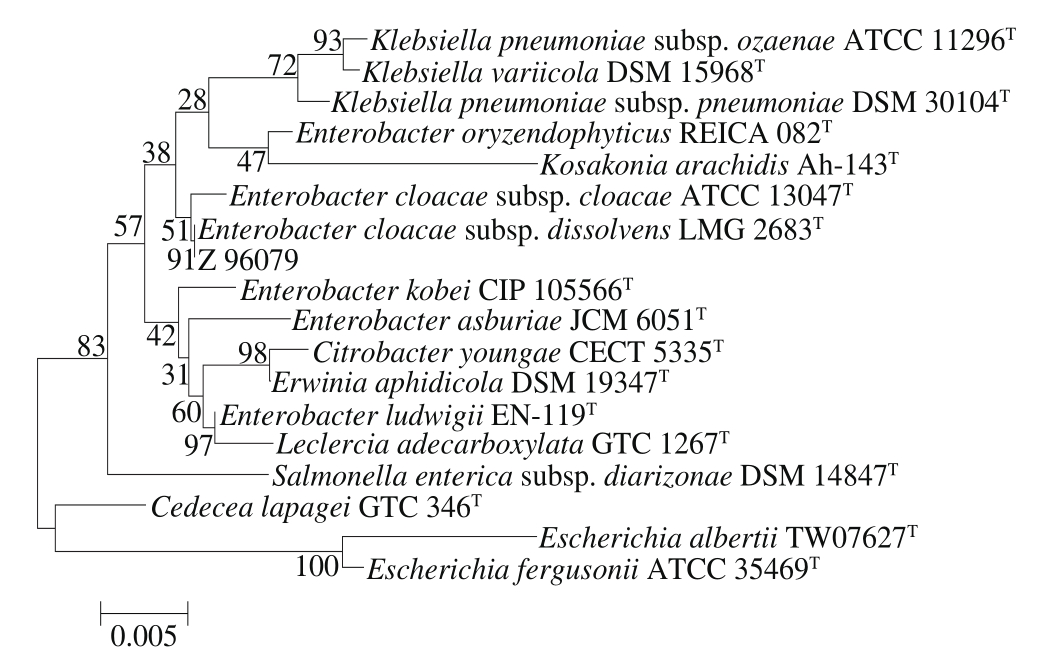
图 4 菌株D(Z 96079)系统发育进化树
Fig. 4 Phylogenetic tree of strain D (Z 96079)

图 5 菌株E(JF 795011)系统发育进化树
Fig. 5 Phylogenetic tree of strain E (JF 795011)
对本研究中鉴定出的5株菌进行同源性比对,结果如表2所示。结合图1~5与表2可知,菌株A在系统发育进化树中与Kosakonia属同一分支,菌株A的最相似菌株为K. cowanii CIP 107300T,相似率达到98.97%。菌株B在系统发育进化树中与Staphylococcus属同一分支,菌株B的最相似菌株为S. epidermidis ATCC 14990T,相似率达到99.11%。菌株C在系统发育进化树中与Klebsiella属同一分支,菌株C的最相似菌株为K. michiganensis W 14T,相似率达到99.19%。菌株D在系统发育进化树中与Enterobacter属同一分支,菌株D的最相似菌株为E. cloacae subsp. dissolvens LMG 2683T,相似率达到99.02%。菌株E在系统发育进化树中与Enterobacter属同一分支,菌株E的最相似菌株为E. oryzendophyticus REICA 082T,相似率达到98.43%。
表 2 测序菌株的同源性分析
Table 2 Homology analysis of tested strains

一些关于本研究中分离出的5 株菌最相似菌株的报道显示,被重新归属为Kosakonia cowanii的菌[14],之前属于E. cowanii,即一株最初从临床标本中分离到的菌株[15]。S. epidermidis可以形成生物膜[16-17],并能够导致一些传染病的发生[18],诸如菌血症[19]。K. michiganensis为兼性厌氧的革兰氏阴性菌,属于肠杆菌科、克雷伯氏菌属[20],而克雷伯氏菌属的细菌为重要的病原菌[21]。E. cloacae是一种病原菌,且对抗生素具有抗性[22]。E. oryzendophyticus之前也从稻谷的根系中分离得到,为革兰氏阴性菌,该菌对氨苄青霉素、链霉素、卡那霉素等抗生素具有抗性,且其可对植物提供氮与磷,从而促进植物的生长[23]。然而对于能够促进植物生长的细菌,如果是致病菌则不能作为生物肥料使用[24]。且最近一项基于rpoB、atpD、gyrD和infB基因的序列分析结果表明,E. oryzendophyticus与Kosakonia属归为同一分支,因此将其重新归类为Kosakonia oryzendophytica[25]。
2.2 AEW对市售黄豆芽的杀菌效果
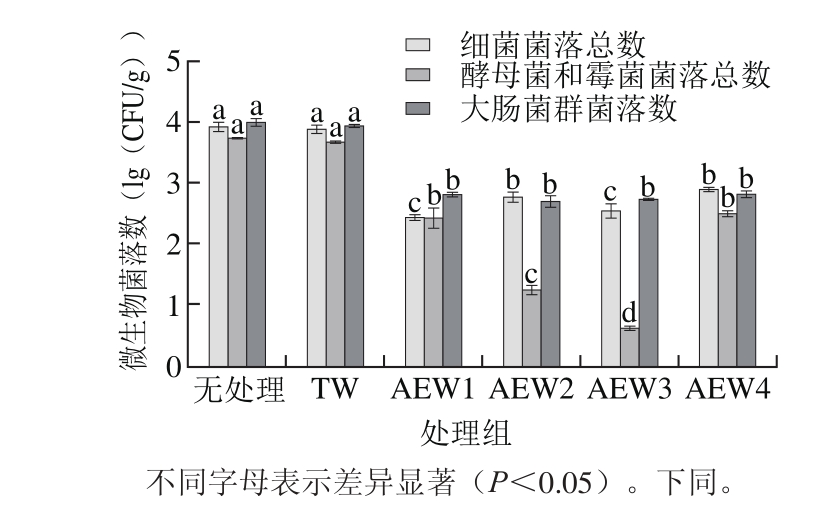
图 6 AEW对市售黄豆芽的杀菌效果
Fig. 6 Effi cacy of AEW in killing microorganisms on commercial soybean sprouts
不同pH值的AEW对黄豆芽杀菌效果的影响如图6所示。新鲜市售黄豆芽表面携带细菌菌落总数、酵母菌和霉菌菌落总数、大肠菌群菌落数分别为3.91、3.72、3.99(lg(CFU/g))。而经过TW或AEW浸泡10 min后,微生物菌落数有不同程度的降低。
与不经处理的市售黄豆芽表面细菌菌落总数相比,经过TW处理和pH值为3.02、4.47、5.58、6.51的AEW处理之后,黄豆芽细菌菌落总数分别降低了0.02、1.47、1.14、1.37、1.02(lg(CFU/g))。TW组黄豆芽的细菌菌落总数与无处理组之间无显著差异(P>0.05),而不同pH值的AEW均可显著降低黄豆芽细菌菌落总数(P<0.05),其中AEW1组(pH3.02)的黄豆芽细菌菌落总数最低,为2.44 (lg(CFU/g))。
与不经处理的市售黄豆芽表面酵母菌和霉菌菌落总数相比,TW处理和pH值为3.02、4.47、5.58、6.51的AEW处理黄豆芽,酵母菌和霉菌菌落总数分别降低了0.06、1.31、2.48、3.10、1.23(lg(CFU/g))。TW组的酵母菌和霉菌菌落总数与无处理组之间无显著差异(P>0.05),而不同pH值的AEW均可显著降低黄豆芽酵母菌和霉菌菌落总数(P<0.05),其中AEW3组(pH5.58)的黄豆芽酵母菌和霉菌菌落总数最低,为0.62(lg(CFU/g))。
TW组及pH值为3.02、4.47、5.58、6.51的AEW组的黄豆芽大肠菌群菌落数分别降低了0.06、1.18、1.29、1.26、1.18(lg(CFU/g))。TW组与无处理组之间无显著差异(P>0.05),AEW组均可显著降低黄豆芽大肠菌群菌落数(P<0.05),但不同pH值的AEW组之间无显著差异。
从结果中可知,消费者常用来清洗豆芽的自来水基本没有杀菌效果,更多的是将微生物冲洗下来,结果表明,这种冲洗的效果也非常有限。相比之下,AEW中含有多种含氯的氧化物质,例如HClO、ClO-及Cl2等,而这些含氯物质可以有效杀灭多种微生物[26]。本研究表明,pH值介于3.02~5.58之间的AEW对市售黄豆芽表现出良好的杀菌效果。且本研究中所使用的AEW的有效氯质量浓度相近,在该前提下,AEW的杀菌能力受到有效氯存在形式的影响,而有效氯的存在形式又受到pH值的强烈影响。当pH值小于2时,AEW中有效氯的主要存在形式是Cl2和HClO。随着pH值的上升,Cl2逐渐溶于水,转化为HClO,即当pH值介于3~6之间时,有效氯的主要存在形式为HClO[27]。且对AEW进行紫外光谱扫描得知,当AEW的pH值在4左右时,其232 nm波长处的吸收峰达到极大值,而232 nm波长处的吸收峰被认为是HClO的特征吸收峰[28]。HClO作为pH值介于3~6之间AEW的主要杀菌成分,具有很强的杀菌能力,且比ClO-的杀菌效果要强数十倍[29]。因此,在本研究中,AEW尤其是pH值为3.02~5.58的AEW,处理新鲜市售黄豆芽,显著降低其细菌菌落总数、酵母菌和霉菌菌落总数、大肠菌群菌落数(P<0.05)。
2.3 AEW对市售绿豆芽的杀菌效果
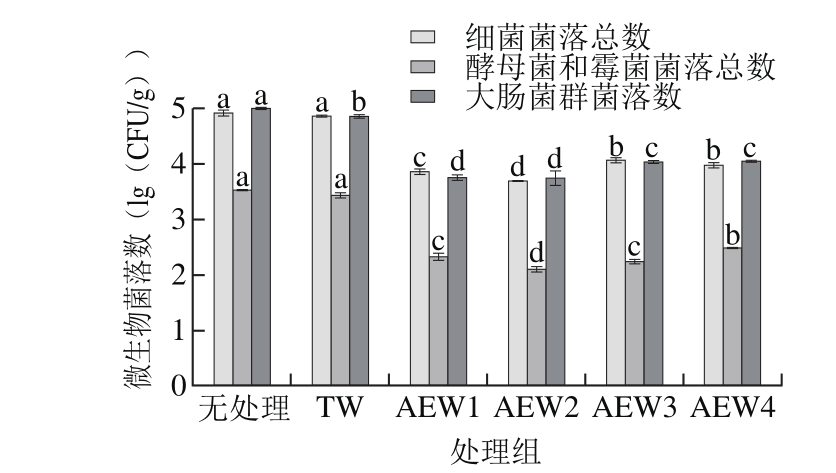
图 7 AEW对市售绿豆芽的杀菌效果
Fig. 7 Effi cacy of AEW in killing microorganisms on commercial mung bean sprouts
AEW对新鲜市售绿豆芽的杀菌效果如图7所示。未经处理的新鲜绿豆芽表面携带细菌菌落总数、酵母菌和霉菌菌落总数、大肠菌群菌落数分别为4.91、3.53、 4.99 (lg(CFU/g))。而经过TW及不同pH值的AEW浸泡10 min后,绿豆芽的细菌菌落总数、酵母菌和霉菌菌落总数、大肠菌群菌落数均有不同程度的降低。
相比无处理的绿豆芽而言,经过TW处理及pH值为3.02、4.47、5.58、6.51的AEW处理后,绿豆芽细菌菌落总数分别降低了0.07、1.06、1.23、0.85、0.95(lg(CFU/g))。TW组的细菌菌落总数与无处理组间无显著差异(P>0.05),而AEW组均显著降低细菌总数(P<0.05)。
相比无处理的绿豆芽而言,TW处理及pH值为3.02、4.47、5.58、6.51的AEW组使绿豆芽酵母菌和霉菌菌落总数分别降低了0.09、1.21、1.42、1.29、1.04(lg(CFU/g))。TW组的酵母菌和霉菌菌落总数与无处理组间无显著差异(P>0.05),AEW组均显著降低市售绿豆芽酵母菌和霉菌菌落总数(P<0.05)。
相比无处理新鲜市售绿豆芽而言,TW组及pH值为3.02、4.47、5.58、6.51的AEW组使绿豆芽大肠菌群菌落数分别降低了0.15、1.24、1.25、0.96、0.94 (lg(CFU/g))。AEW1和AEW2处理组的大肠菌群菌落数要显著低于其他处理组(P<0.05)。
各组降低市售绿豆芽微生物数量的结果与黄豆芽类似。通过各组处理市售绿豆芽,并对其微生物统计的结果再次表明,TW处理降低微生物数的程度非常有限,因此,只用TW进行清洗豆芽,仍有较多的微生物残留。而用AEW处理之后,尤其是pH值3.02~5.58的AEW,能显著降低市售绿豆芽的微生物数量。
通过比较AEW对市售黄豆芽和绿豆芽的杀菌效果可知,AEW对市售黄豆芽表现出更好的杀菌效果,体现在微生物数量的降低程度更大。究其原因,可能是由于市售黄豆芽和绿豆芽的初始菌落数不同。实验所用市售绿豆芽的初始菌落数更大。而当微生物附着在豆芽上,可能会与一些有机物共存,而该有机物可以中和AEW中的含氯成分,并在某种程度上防止了菌落细胞膜通透性增加,降低了AEW的杀菌效果[30]。
本研究从市售新鲜绿豆芽和黄豆芽中分离出5 株外观形态不同的细菌,且经过16S rRNA基因序列分析及系统发育树构建,结果表明这5 株菌分别为Kosakonia、Staphylococcus、Klebsiella、Enterobacter和Enterobacter属成员。且通过用不同pH值的AEW对市售新鲜豆芽进行杀菌,并以无处理组及TW组为对照,结果表明自来水降低微生物数的程度非常有限,效果不理想,而AEW,尤其是pH 3.02~5.58的AEW,能够显著降低市售豆芽的微生物数量,因而对于提高市售豆芽的食用安全性可以起到非常积极的作用。
参考文献:
[1] GABRIEL A A, BERJA M C, ESTRADA A M P, et al. Microbiology of retail mung bean sprouts vended in public markets of National Capital Region, Philippines[J]. Food Control, 2007, 18(10): 1307-1313. DOI:10.1016/j.foodcont.2006.09.004.
[2] YANG Y, MEIER F, ANN L J, et al. Overview of recent events in the microbiological safety of sprouts and new intervention technologies[J]. Comprehensive Reviews in Food Science and Food Safety, 2013, 12(3): 265-280. DOI:10.1111/1541-4337.12010.
[3] RIMHANEN FINNE R, NISKANEN T, LIENEMANN T, et al. A nationwide outbreak of Salmonella bovismorbifi cans associated with sprouted alfalfa seeds in Finland, 2009[J]. Zoonoses and Public Health, 2011, 58(8): 589-596. DOI:10.1111/j.1863-2378.2011.01408.x.
[4] LIU R, YU Z L. Application of electrolyzed water on reducing the microbial populations on commercial mung bean sprouts[J]. Journal of Food Science and Technology, 2017, 54(4): 995-1001. DOI:10.007/ s13197-016-2445-z.
[5] HUANG Y R, HUNG Y C, HSU S Y, et al. Application of electrolyzed water in the food industry[J]. Food Control, 2008, 19(4): 329-345. DOI:10.1016/j.foodcont.2007.08.012.
[6] ISSA-ZACHARIA A, KAMITANI Y, MIWA N, et al. Application of slightly acidic electrolyzed water as a potential non-thermal food sanitizer for decontamination of fresh ready-to-eat vegetables and sprouts[J]. Food Control, 2011, 22(3): 601-607. DOI:10.1016/ j.foodcont.2010.10.011.
[7] AL-HAQ M, SUGIYAMA J, ISOBE S. Applications of electrolyzed water in agriculture & food industries[J]. Food Science and Technology Research, 2005, 11(2): 135-150. DOI:10.3136/fstr.11.135.
[8] 陈英, 郭嬿, 邢冰. 酸性氧化电位水对直肠癌术后伤口的消毒效果[J]. 肿瘤基础与临床, 2014, 27(1): 69-70. DOI:10.3969/ j.issn.1673-5412.2014.01.023.
[9] TSUKAGOSHI S, SUNOHARA Y, NOMA Y, et al. Control of powdery mildew by spraying the electrolyzed water in hydroponically grown strawberry[J]. Acta Horticulturae, 2001, 559: 753-758. DOI:10.17660/ActaHortic.2001.559.111.
[10] 王春芳, 于勇, 和劲松, 等. 酸性电解水杀菌技术在农业中的应用[J].农业工程, 2012, 2(9): 33-37.
[11] CHUN J, LEE J H, JUNG Y, et al. EzTaxon: a web-based tool for the identifi cation of prokaryotes based on 16S ribosomal RNA gene sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57: 2259-2261. DOI:10.1099/ijs.0.64915-0.
[12] BLOCK S S. Disinfectants and antiseptics[M]. Hoboken: Wiley, 2000: 157-160.
[13] HAO J X, LIU H J, LIU R, et al. Efficacy of slightly acidic electrolyzed water (SAEW) for reducing microbial contamination on fresh-cut cilantro[J]. Journal of Food Safety, 2011, 31(1): 28-34. DOI:10.1111/j.1745-4565.2010.00261.x.
[14] BRADY C, CLEENWERCK I, VENTER S, et al. Taxonomic evaluation of the genus Enterobacter based on multilocus sequence analysis (MLSA): proposal to reclassify E. nimipressuralis and E. amnigenus into Lelliottia gen. nov. as Lelliottia nimipressuralis comb. nov. and Lelliottia amnigena comb. nov., respectively, E. gergoviae and E. pyrinus into Pluralibacter gen. nov. as Pluralibacter gergoviae comb. nov. and Pluralibacter pyrinus comb. nov., respectively, E. cowanii, E. radicincitans, E. oryzae and E. arachidis into Kosakonia gen. nov. as Kosakonia cowanii comb. nov., Kosakonia radicincitans comb. nov., Kosakonia oryzae comb. nov. and Kosakonia arachidis comb. nov., respectively, and E. turicensis, E. helveticus and E. pulveris into Cronobacter as Cronobacter zurichensis nom. nov., Cronobacter helveticus comb. nov. and Cronobacter pulveris comb. nov., respectively, and emended description of the genera Enterobacter and Cronobacter[J]. Systematic and Applied Microbiology, 2013, 36(5): 309-319. DOI:10.1016/j.syapm.2013.03.005.
[15] INOUE K, SUGIYAMA K, KOSAKO Y, et al. Enterobacter cowaniisp. nov., a new species of the family Enterobacteriaceae[J]. Current Microbiology, 2000, 41(6): 417-420. DOI:10.1007/ s002840010160.
[16] BÜTTNER H, MACK D, ROHDE H. Structural basis of Staphylococcus epidermidis biofilm formation: mechanisms and molecular interactions[J]. Frontiers in Cellular and Infection Microbiology, 2015, 5(14): 1-15. DOI:10.3389/fcimb.2015.00014.
[17] CALÀ C, AMODIO E, DI CARLO E, et al. Biofilm production in Staphylococcus epidermidis strains, isolated from the skin of hospitalized patients: genetic and phenotypic characteristics[J]. New Microbiologica, 2015, 38: 521-529.
[18] ROGERS K L, FEY P D, RUPP M E. Coagulase-negative staphylococcal infections[J]. Infectious Disease Clinics of North America, 2009, 23(1): 73-98. DOI:10.1016/j.idc.2008.10.001.
[19] KLEINSCHMIDT S, HUYGENS F, FAOAGALI J, et al. Staphylococcus epidermidis as a cause of bacteremia[J]. Future Microbiology, 2015, 10(11): 1859-1879. DOI:10.2217/fmb.15.98.
[20] SAHA R, FARRANCE C E, VERGHESE B, et al. Klebsiella michiganensis sp. nov., a new bacterium isolated from a tooth brush holder[J]. Current Microbiology, 2013, 66(1): 72-78. DOI:10.1007/ s00284-012-0245-x.
[21] BRISSE S, PASSET V, HAUGAARD A B, et al. Wzi gene sequencing, a rapid method for determination of capsular type for Klebsiella strains[J]. Journal of Clinical Microbiology, 2013, 51(12): 4073-4078. DOI:10.1128/JCM.01924-13.
[22] DAVIN-REGLI A. Enterobacter aerogenes and Enterobacter cloacae; versatile bacterial pathogens confronting antibiotic treatment[J]. Frontiers in Microbiology, 2015, 6: 1-10. DOI:10.3389/ fmicb.2015.00392.
[23] HARDOIM P R, NAZIR R, SESSITSCH A, et al. The new species Enterobacter oryziphilus sp. nov. and Enterobacter oryzendophyticus sp. nov. are key inhabitants of the endosphere of rice[J]. BMC Microbiology, 2013, 13(1): 1-13. DOI:10.1186/1471-2180-13-164.
[24] VELÁZQUEZ E, MENÉNDEZ E, JUANES F S, et al. Identifi cation of human pathogenic bacteria in plant roots by using MALDI-TOF MS methodology[M]//GONZÁLEZ-ANDRÉS F, JAMES E. Biological nitrogen fi xation and benefi cial plant-microbe interaction. Switzerland: Springer International Publishing, 2016: 3-12. DOI:10.1007/978-3-319-32528-6_1.
[25] LI C Y, ZHOU Y L, JI J, et al. Reclassification of Enterobacter oryziphilus and Enterobacter oryzendophyticus as Kosakonia oryziphila comb. nov. and Kosakonia oryzendophytica comb. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(8): 2780-2783. DOI:10.1099/ijsem.0.001054.
[26] YANG H, SWEM B L, LI Y. The effect of pH on inactivation of pathogenic bacteria on fresh-cut lettuce by dipping treatment with electrolyzed water[J]. Journal of Food Science, 2003, 68(3): 1013-1017. DOI:10.1111/j.1365-2621.2003.tb08280.x.
[27] XIONG K, LIU H, LI L. Product identifi cation and safety evaluation of aflatoxin B1 decontaminated by electrolyzed oxidizing water[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9770-9778. DOI:10.1021/jf303478y.
[28] XIONG K, LI X, GUO S, et al. The antifungal mechanism of electrolyzed oxidizing water against Aspergillus flavus[J]. Food Science and Biotechnology, 2014, 23(2): 661-669. DOI:10.1007/ s10068-014-0090-8.
[29] RAHMAN S M E, DING T, OH D H. Effectiveness of low concentration electrolyzed water to inactivate foodborne pathogens under different environmental conditions[J]. International Journal of Food Microbiology, 2010, 139(3): 147-153. DOI:10.1016/ j.ijfoodmicro.2010.03.020.
[30] ZHANG C, CAO W, HUNG Y C, et al. Disinfection effect of slightly acidic electrolyzed water on celery and cilantro[J]. Food Control, 2016, 69: 147-152. DOI:10.1016/j.foodcont.2016.04.039.
Identifi cation of Bacterial Species and Microbial Inactivation by Acidic Electrolyzed Water on Commercial Bean Sprouts
LIU Rui1, YU Zhanglong2,*, XUE Chong1, WU Yi1, WU Xinyan1, LI Mingyi1
(1. Department of Life Sciences, Yuncheng University, Yuncheng 044000, China; 2. Cotton Research Institute, Shanxi Academy of Agricultural Sciences, Yuncheng 044000, China)
Abstract:The bacterial species on commercial bean sprouts were identifi ed by 16S rRNA gene sequence analysis, and the effi cacy of acidic electrolyzed water (AEW) with different pH values in killing bacteria, yeast and mold on commercial bean sprouts was evaluated. The results showed that 5 bacterial strains were isolated, belonging to the genera of Kosakonia, Staphylococcus, Klebsiella, Enterobacter and Enterobacter, respectively. AEW with available chlorine concentration of 46.00 mg/L and pH values of 3.02, 4.47 and 5.58 could signifi cantly decrease microbial counts on commercially available fresh bean sprouts. AEW with pH 4.47 and available chlorine concentration of 46.09 mg/L could decrease the total bacterial count, mould and yeast count and coliform count by 1.14, 2.48 and 1.29 (lg(CFU/g)) on soybean sprouts and by 1.23, 1.42 and 1.25 (lg(CFU/g)) on mung bean sprouts, respectively. AEW could play an active role in improving the safety of commercial bean sprouts for consumption.
Key words:bean sprout; bacteria; species identifi cation; acidic electrolyzed water; microbial inactivation
DOI:10.7506/spkx1002-6630-201717028
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2017)17-0168-06
引文格式:
刘瑞, 于章龙, 薛冲, 等. 市售豆芽携带细菌种属鉴定及酸性电解水的杀菌效果[J]. 食品科学, 2017, 38(17): 168-173.
DOI:10.7506/spkx1002-6630-201717028. http://www.spkx.net.cn
LIU Rui, YU Zhanglong, XUE Chong, et al. Identification of bacterial species and microbial inactivation by acidic electrolyzed water on commercial bean sprouts[J]. Food Science, 2017, 38(17): 168-173. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717028. http://www.spkx.net.cn
收稿日期:2016-08-23
基金项目:运城学院博士科研启动项目(YQ-2014026);“131”领军人才工程项目(XK-2015019)
作者简介:刘瑞(1987—),女,讲师,博士,研究方向为食品加工新技术。E-mail:thebest69@126.com
*通信作者:于章龙(1984—),男,助理研究员,硕士,研究方向为农产品加工。E-mail:y_zl1230@163.com