王 海,周 游,黄姗婉,高丽萍*
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100191)
摘 要:目的:研究枸杞多糖(Lycium barbarum polysaccharides,LBP)对顺铂(cis-dichlorodiamineplatinum (Ⅱ),CDDP)诱导的小鼠睾丸支持细胞TM4氧化损伤的影响,并探讨其可能的作用机制。方法:噻唑蓝法测定CDDP、LBP分别对TM4细胞生长的影响以及LBP对CDDP诱导的细胞毒性的拮抗作用。硫代巴比妥酸法测定细胞中丙二醛(malondialdehyde,MDA)含量,二硫代二硝基苯甲酸法测定谷胱甘肽(glutathione,GSH)含量,黄嘌呤氧化酶法测定超氧化物歧化酶(superoxide dismutase,SOD)活力。结果:5~100 mg/L LBP可极显著提高TM4细胞存活率(P<0.01),20~100 mg/L LBP能够极显著抑制CDDP造成的细胞毒性(P<0.01),50 mg/L的LBP保护效果最佳。50 mg/L LBP能够极显著抑制CDDP(12 mg/L)引起的MDA含量升高以及GSH含量和SOD活力降低(P<0.01)。结论:LBP能有效拮抗顺铂诱导的TM4细胞氧化损伤,其机制与LBP较强的抗氧化作用有关。
关键词:枸杞多糖;顺铂;小鼠睾丸支持细胞TM4;氧化损伤
王海, 周游, 黄姗婉, 等. 枸杞多糖对顺铂诱导小鼠睾丸支持细胞TM4氧化损伤的影响[J]. 食品科学, 2017, 38(17): 198-202. DOI:10.7506/spkx1002-6630-201717032. http://www.spkx.net.cn
WANG Hai, ZHOU You, HUANG Shanwan, et al. Protective effect of Lycium barbarum polysaccharides on cis-dichlorodiamineplatinum (Ⅱ) -induced oxidative damage in mouse testis sertoli cells TM4[J]. Food Science, 2017, 38(17): 198-202. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717032. http://www.spkx.net.cn
顺铂(cis-dichlorodiamineplatinum (Ⅱ),CDDP)是临床化疗应用较广泛的药物,对肿瘤的治疗效果明显,但对人体产生的毒副作用成为临床应用上的瓶颈。以CDDP为基础的化疗对不同的组织均有损害,如肾、肝、睾丸等,其中肾毒性是CDDP最主要的毒副作用,而生殖毒性也不能被忽视[1]。CDDP在不同动物体中具有遗传毒性,表现在染色体畸变、姐妹染色体交换和骨髓与精原细胞的微核实验中。由于CDDP的精子毒性,几乎所有使用CDDP临床化疗的癌症患者都表现出了精子缺乏症[2-4]。
枸杞多糖(Lycium barbarum polysaccharides,LBP)是从枸杞中提取而得的一种水溶性多糖。枸杞具有药理活性,主要是因为含有生物活性物质LBP。LBP对机体没有毒性,展示出广泛的药理活性。在生殖毒性的防护方面,有研究表明LBP可以减少热损伤小鼠生精上皮细胞的凋亡[5]。黄晓兰等[6]认为LBP可通过抗氧化及调节下丘脑-垂体-性腺轴实现对大鼠生殖系统的保护。Luo Qiong等[7]发现LBP对高温和H2O2引起的小鼠生精细胞及染色体损伤具有修复和保护作用。现代科学研究表明,LBP除具有很高的抗氧化作用外,同时也具有调节免疫、抑制肿瘤、清除自由基、延缓衰老、降血脂和抗疲劳等作用,具有良好的开发前景[8-10]。
目前,LBP对CDDP所致睾丸支持细胞(sertoli cell,SC)氧化损伤的影响鲜见报道,本课题探讨LBP对CDDP诱导的生殖毒性的防护作用及其作用机制,为其应用于临床、提高CDDP的化疗效果及为癌症化疗提供有效的辅助品提供参考。
1.1 材料与试剂
小鼠睾丸SC(TM4)由中国协和医科大学提供。
CDDP(注射用冻干粉剂) 齐鲁制药有限公司;LBP(纯度≥90%) 南京泽朗医药科技有限公司;DMEM/F12培养基、胎牛血清 美国Hyclone公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 美国Sigma公司;BCA蛋白浓度测定试剂盒 北京鼎国昌盛生物技术有限公司;丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
TE2000-M倒置显微镜 日本Nikon公司;3K15台式高速冷冻离心机 德国Sigma公司;MQX-200微孔板分光光度计 美国Bio-Tek公司;WFZ UV-4802H紫外-可见分光光度计 上海尤尼柯仪器有限公司。
1.3 方法
1.3.1 细胞培养
TM4细胞采用含双抗和10%胎牛血清的DMEM/F12培养基,并置于37 ℃、5% CO2的饱和湿度培养箱中培养。选择对数生长期的细胞进行实验。
1.3.2 CDDP对TM4细胞生长的影响
将细胞(1×105个/mL)接种于96 孔板,每孔200 μL。待细胞生长到融合状态,弃掉培养液,每孔加入200 μL含不同质量浓度的CDDP(0.0(对照)、0.5、1.0、2.0、4.0、8.0、16.0、32.0、64.0、128.0 mg/L)的无血清培养基。每组设置6 个平行。在培养箱中培养24 h后,弃掉培养液,各孔加入200 μL终质量浓度为0.5 mg/mL MTT,继续孵育4 h后,弃去废液,每孔加入150 μL二甲基亚砜,用酶标仪在570 nm波长处测吸光度。按照下式计算细胞存活率。
1.3.3 LBP对TM4细胞生长的影响
同1.3.2节的方法,将CDDP换成不同质量浓度的LBP(0(对照)、1、2、5、10、16、25、32、50、64、100、200、400、600、800 mg/L和1 000 mg/L)。计算细胞存活率。
1.3.4 LBP对CDDP所致TM4细胞毒性的影响
根据1.3.1的结果,实验分为3组:对照组未加入CDDP和LBP;CDDP组,TM4细胞CDDP质量浓度为12 mg/L;CDDP+LBP组,在加入12 mg/L CDDP前24 h分别加入不同质量浓度的LBP(10、20、30、40、50、60、70、80 mg/L和100 mg/L),不加药组以相应量的无菌水作为对照,继续培养24 h后,计算细胞存活率。
1.3.5 TM4细胞蛋白浓度及细胞内MDA、GSH含量、SOD活力的测定
根据1.3.4节的结果,将细胞分为4 个组:对照组,未加入CDDP和LBP;CDDP组,加入12 mg/L CDDP;LBP组,加入50 mg/L LBP;CDDP+LBP组,加入12 mg/L CDDP和50 mg/L LBP。将2 mL(浓度为1×105个/mL)处于生长期的细胞接种到6 孔板,待细胞生长至融合状态时,按照实验分组加药处理。继续培养24 h后,弃去培养液,每孔加入300 μL 0.01 mol/L pH 7.4的磷酸盐缓冲液,用细胞刮收集细胞后,1 000 r/min离心10 min,弃上清液,1 mL上述磷酸盐缓冲液重悬,于细胞破碎仪上30 Hz破碎10 s;取匀浆液10 000 r/min离心10 min,收集上清液,按照测试盒说明进行操作,测定细胞蛋白质量浓度、MDA、GSH含量以及SOD活力。
1.4 统计分析
采用SPSS 19.0软件进行统计分析,结果表示为±s,单因素方差分析对数据进行Duncan检验,P<0.05表示差异显著,P<0.01表示差异极显著。用Origin 9.1软件作图。
2.1 CDDP对TM4细胞生长的影响

图 1 CDDP对TM4细胞存活率的影响
Fig. 1 Effect of CDDP on the survival of TM4 cells
用不同质量浓度的CDDP处理TM4细胞24 h,如图1所示,随着CDDP质量浓度的增大,TM4细胞存活率逐渐降低。CDDP从1 mg/L开始,各加药组抑制率与对照组相比有极显著性差异(P<0.01)。通过SPSS软件计算CDDP对TM4细胞抑制率的半抑制浓度(half maximal inhibitory concentration,IC50)为12.276 mg/L,因此选择12 mg/L质量浓度的CDDP用于后续实验。
2.2 LBP对TM4细胞生长的影响

图 2 LBP对TM4细胞存活率的影响
Fig. 2 Effect of LBP on the survival of TM4 cells
图2 为LBP处理TM4细胞24 h后的实验结果。当LBP质量浓度小于50 mg/L时,TM4细胞存活率随LBP质量浓度升高而增大,与对照组比较,LBP(5mg/L)各组存活率极显著升高(P<0.01)。当LBP质量浓度大于64 mg/L时,TM4细胞存活率随LBP质量浓度升高呈明显下降趋势,除200 mg/L质量浓度外,LBP各组细胞存活率较对照组极显著降低(P<0.01)。在LBP质量浓度大于200 mg/L后细胞存活率小于正常细胞,且存活率大幅度下降,在1 000 mg/L的LBP作用下,细胞存活率几乎为0%。这表明在一定程度上LBP可以促进细胞生长,但较高质量浓度条件下会抑制细胞存活。
2.3 LBP对CDDP所致TM4细胞毒性的影响
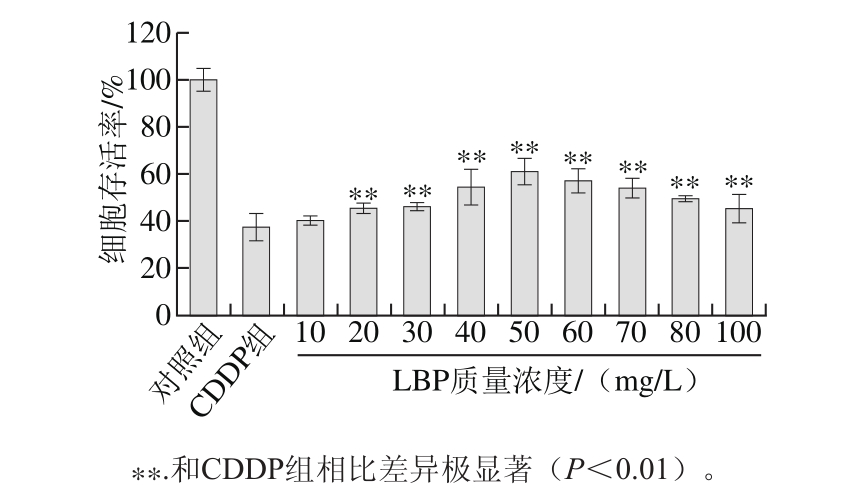
图 3 LBP对CDDP诱导TM4细胞存活率的影响
Fig. 3 Effect of LBP on the survival of TM4 cells exposed to CDDP
用质量浓度为12 mg/L的CDDP建立TM4细胞损伤模型,用不同质量浓度LBP提前24 h处理TM4细胞。结果如图3所示,当LBP质量浓度大于等于20 mg/L时,与CDDP模型组对比,CDDP+LBP组细胞存活率极显著提高(P<0.01),但随着LBP浓度的升高细胞存活率先升高后降低,在LBP浓度为50 mg/L时,细胞存活率达到最高62.30%。这表明在一定质量浓度范围内,LBP对CDDP所致细胞损伤具有明显的保护作用,50 mg/L质量浓度的LBP保护效果最佳。
2.4 LBP对CDDP诱导TM4细胞内抗氧化指标的影响
表 1 LBP对CDDP诱导TM4细胞内抗氧化指标的影响
Table 1 Effect of LBP on antioxidant indexes in TM4 cells exposed to CDDP
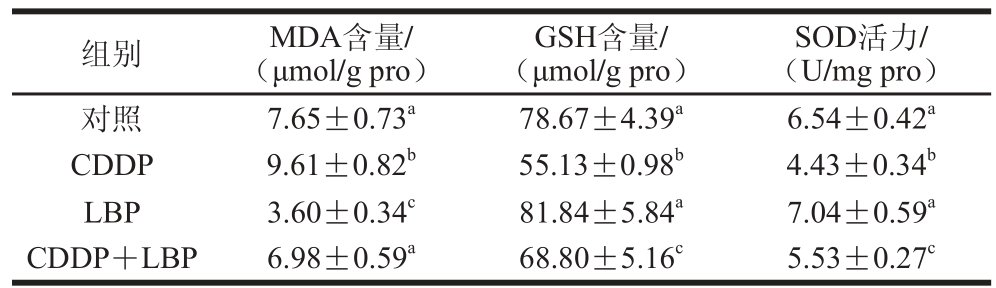
注:同列肩标小写字母不同表示差异极显著(P<0.01)。
LBP对CDDP诱导TM4细胞内抗氧化指标的影响的实验结果见表1。和对照组相比,CDDP组MDA含量极显著增加(P<0.01),GSH含量和SOD活力极显著降低(P<0.01);LBP组MDA含量极显著减少(P<0.01),GSH含量和SOD活力无显著差异(P>0.05),说明CDDP引起TM4细胞抗氧化水平降低。提前加入LBP预处理后,和CDDP组比较,CDDP+LBP组细胞内MDA含量极显著减少(P<0.01),GSH含量和SOD活力均极显著提高(P<0.01)。结果表明,LBP可有效拮抗CDDP诱导的TM4细胞氧化损伤。
最近,化疗引起的睾丸功能性障碍已引起人们广泛的关注。Ishikawa等[11]报道CDDP化学疗法是一种治疗生精细胞肿瘤最有效的化学疗法,然而对精子有严重的毒性。另外,有研究表明以CDDP为基础的化学疗法引起了精子中线粒体异常,暂时或永久性的精子活力缺乏或精子减少[12]。Turk等[13]报告说CDDP处理组中睾丸和附睾质量的减少归因于生发层细胞厚度在薄壁组织的萎缩和其他病理结果的恶化。许多研究证明大鼠精子游动性的显著性降低与注射CDDP有关[13-14]。
SC是存在于睾丸生精小管内皮,从曲细精管基底膜直达管腔的长锥形上皮样贴壁生长的细胞,其主要作用是支持生精细胞生长,为生精细胞的分化发育提供合适的微环境。在哺乳动物的睾丸组织中,SC在形成和保护精子的过程中起关键作用[15],是生精小管的重要组成部分。SC数量决定生精细胞数量、睾丸大小以及精子产量等[16]。任何可能影响男性幼年SC数量处于正常值范围内的生殖毒性物质将间接影响其在成年后的生育情况。因此,减轻CDDP造成的生殖毒性显得至关重要。LBP作为一种天然活性物质,具有较强的细胞保护作用和免疫活性[17]。在本实验中,LBP在0~50 mg/L质量浓度范围内可剂量依赖性地提高TM4细胞存活率,在20~100 mg/L质量浓度范围内可极显著提高CDDP损伤的细胞存活率(P<0.01),以终质量浓度50 mg/L效果最佳,表明一定质量浓度的LBP对CDDP诱导的TM4细胞毒性有明显的保护作用。
但是,关于CDDP所致生殖毒性的机制尚未完全阐述清楚,一种观点认为,脂质过氧化和氧化应激是CDDP细胞毒性机制之一[18]。氧自由基广泛存在于体内各种组织中,可以破坏氧化与抗氧化的平衡。机体内氧自由基能引发生物膜中脂质过氧化作用,形成脂质过氧化物如MDA、酮基等,导致细胞代谢、功能和结构的改变[19]。体内产生过多的自由基或清除自由基的能力降低将引发机体和组织功能障碍[20]。由于药物毒性的分子生物学机制,活性氧和氧化性损伤可能通过减弱精子的功能引起雄性不育。已经确定在低生育或不育男性的精浆和精子中有过多的氧自由基产生[21]。本实验指出,CDDP可极显著提高TM4细胞中MDA含量(P<0.01),Atessahin等[14]在一项研究中报道,CDDP能够引起血浆、精子和睾丸组织中MDA水平的增加,与本研究结果一致。另外,在用50 mg/L的LBP进行干预后发现,LBP保护组TM4细胞中MDA含量极显著减少(P<0.01),LBP和CDDP联合处理组的MDA含量同样极显著降低,趋于正常对照组水平(P>0.05)。王建华等[22-23]经过提取,研究了LBP不同组分的抗羟基氧化和抗脂质过氧化的作用。结果表明,LBP可以清除羟基所导致的MDA的产生,抑制羟基所致细胞膜流动性下降和线粒体膨胀程度,减少红细胞出现溶血现象,从而起到抗羟基氧化的作用。本研究结果说明一定质量浓度的LBP能够清除TM4细胞内过多的脂质过氧化物,从而保护细胞免受因自由基引起的氧化损伤。
GSH是细胞防御有毒化合物或氧化应激化学反应的最重要的分子之一。细胞中GSH的含量减少和GSH合成能力的降低使细胞对特定的药物变得敏感,GSH含量升高是保持细胞内巯基氧化还原状态的主要机制[24]。细胞内GSH合成量增加,GSH用于解毒提示机体内存在着抵抗化学损伤的重要保护机制[25]。SOD是一种金属蛋白,和GSH有相似的功能,都能够清除氧自由基,从而保护细胞免受超氧化物自由基的损伤[26]。邵鸿娥等[27]在LBP对小鼠体内抗氧化酶活性及耐力的影响的实验中发现,LBP可使小鼠血中SOD活力明显升高、MDA含量明显降低,认为LBP具有良好的体内抗氧化作用,可以延缓衰老。本研究结果表明,CDDP模型组GSH含量和SOD活力明显低于对照组,提示CDDP诱发产生的自由基超出细胞抗氧化系统的代偿能力,最终引起细胞的氧化损伤。本实验中,50 mg/L LBP+CDDP组较CDDP组GSH含量和SOD活力极显著提高(P<0.01)。实验同时测定LBP对正常TM4细胞抗氧化指标的影响,结果表明LBP可极显著降低MDA水平,提高GSH含量和SOD活力(P<0.01)。提示LBP对CDDP诱导的TM4细胞氧化损伤具有明显的拮抗作用。
综上所述,LBP能够在一定质量浓度范围提高TM4细胞存活率,可拮抗CDDP所致TM4细胞的氧化损伤,然而LBP对CDDP诱导的细胞凋亡及是否通过阻滞细胞周期来拮抗CDDP生殖毒性,仍需进一步研究。
参考文献:
[1] YEH J, KIM B S, PERESIE J. Protection against cisplatin-induced ovarian damage by the antioxidant sodium 2-mercap toeth anesulfon ate (mesna) in female rats[J]. American Journal of Obstetrics and Gynecology, 2008, 198(4): 1-7. DOI:10.1016/j.ajog.2007.12.027.
[2] TOHAMY A A, EL-GHOR A A, EL-NAHAS S M, et al. Betaglucaninhibits the genotoxicity of cyclophosphamide, adriamycin and cisplatin[J]. Mutation Research, 2003, 541(1/2): 45-53.
[3] ANTUNES L M, DARIN J D, BIANCHI M D. Protective effects of vitamin C against cisplatin-induced nephrotoxicity and lipid peroxidation in adult rats: a dose-dependent study[J]. Pharmacological Research, 2000, 41(4): 405-411. DOI:10.1006/phrs.1999.0600.
[4] HOWELL S J, SHALET S M. Testicular function following chemotherapy[J]. Human Reproduction Update, 2001, 7(4): 363-369.
[5] WANG Y R, ZHAO H, SHENG X S, et al. Protective effect of Fructus Lycii polysaccharides against time and hyperthermia-induced damage in cultured seminiferous epithelium[J]. Journal of Ethnopharmacology, 2002, 82(2/3): 169-175. DOI:10.1016/S0378-8741(02)00169-1.
[6] 黄晓兰, 杨明亮, 吴晓旻, 等. 枸杞多糖对大鼠生殖系统保护作用的机制探讨[J]. 武汉大学学报(医学版), 2004, 25(1): 29-31; 41. DOI:10.3969/j.issn.1671-8852.2004.01.009.
[7] LUO Qiong, LI Zhuoneng, HUANG Xiaolan, et al. Lycium barbarum polysaccharides: protective effects against heat-induced damage of rat testes and H2O2-induced DNA damage in mouse testicular cells and beneficial effect on sexual behavior and reproductive function of hemicastrated rats[J]. Life Science, 2006, 79(7): 613-621. DOI:10.1016/j.lfs.2006.02.012.
[8] 王金童, 王秀娟. 枸杞子的化学成分和药理研究概况[J]. 天津药学, 1999, 11(3): 14-16.
[9] LUO Q, CAI Y Z, YAN J, et al. Hypoglycemic and hypolipidemic effects and antioxidantactivity of fruit extracts from Lycium barbarum[J]. Life Science, 2004, 76(2): 137-149. DOI:10.1016/ j.lfs.2004.04.056.
[10] 田庚元. 枸杞子糖缀合物的结构与生物活性研究[J]. 世界科学技术-中医药现代化, 2003, 5(4): 22-30; 77. DOI:10.3969/ j.issn.1674- 3849.2003.04.005.
[11] ISHIKAWA T, KAMIDONO S, FUJISAWA M. Fertility after high-dose chemotherapy for testicular cancer[J]. Urology, 2004, 63(1): 137-140. DOI:10.1016/j.urology.2003.08.029.
[12] MARTIN R H, ERNST S, RADEMAKER A, et al. Analysis of sperm chromosome complements before, during, and after chemotherapy[J]. Cancer Genetics and Cytogenetics, 1999, 108(2): 133-136. DOI:10.1016/S0165-4608(98)00125-3.
[13] TURK G, ATESSAHIN A, SONMEN M, et al. Improvement of cisplatin-induced injuries to sperm quality, the oxidant-antioxidant system, and the histologic structure of the rat testis by ellagic acid[J]. Fertility and Sterility, 2008, 89(Suppl 5): 1474-1481. DOI:10.1016/ j.fertnstert.2007.04.059.
[14] ATESSAHIN A, KARAHAN I, TURK G, et al. Protective role of lycopene on cisplatin-induced changes in sperm characteristics, testicular damage and oxidative stress in rats[J]. Reproductive Toxicology, 2006, 21(1): 42-47. DOI:10.1016/j.reprotox.2005.05.003.
[15] CARREAU S, FOUCAULT P, DROSDOWSKY M A. Sertoli cells. Functional aspects compared in rats, pigs and man[J]. Annales Endocrinologie, 1994, 55(6): 203-220.
[16] ALLAN C M, GARCIA A, SPALIVIERO J, et al. Complete sertoli cell proliferation induced by follicle-stimulating hormone (FSH) independently of luteinizing hormone activity: evidence from genetic models of isolated FSH action[J]. Endocrinology, 2004, 145(4): 1587-1593. DOI:10.1210/en.2003-1164.
[17] 陈庆伟, 陈志桃. 枸杞多糖药理作用研究进展[J]. 海峡药学, 2005, 17(4): 4-7. DOI:10.3969/j.issn.1006-3765.2005.04.002.
[18] SALEH S, EL-DEMERDASH E. Protective effects of L-arginine against cisplatin induced renal oxidative stress and toxicity: role of nitric oxide[J]. Basic & Clinical Pharmacology Toxicology, 2005, 97(2): 91-97. DOI:10.1111/j.1742-7843.2005.pto_114.x.
[19] 陈瑗, 周玫. 自由基医学基础与病理生理[M]. 北京: 人民卫生出版社, 2002: 36-58.
[20] 艾浩, 牛建昭, 薛晓鸥, 等. 化疗损伤性卵巢功能早衰小鼠动物模型的研究[J]. 中国实验动物学报, 2007, 15(1): 35-38; 83. DOI:10.3969/ j.issn.1005-4847.2007.01.009.
[21] BAKER M A, AITKEN R J. Reactive oxygen species in spermatozoa: methods for monitoring and significance for the origins of genetic disease and infertility[J]. Reproductive Biology and Endocrinology, 2005, 3: 67. DOI:10.1186/1477-7827-3-67.
[22] 王建华, 王汉中, 张民, 等. 枸杞多糖组分3对小鼠抗脂质过氧化作用的影响[J]. 中国兽医学报, 2002, 22(3): 267-268. DOI:10.3969/ j.issn.1005-4545.2002.03.021.
[23] 王建华, 张民, 甘璐, 等. 枸杞多糖-2的抗羟基自由基氧化作用[J]. 食品科学, 2001, 22(1): 11-13. DOI:10.3321/j.issn:1002-6630.2001.01.001.
[24] 邓茂先, 吴德生, 陈祥贵, 等. 双酚A雄性生殖毒性的体内外实验研究[J]. 中华预防医学杂志, 2004, 38(6): 383-387.
[25] 逄兵, 吴向东, 任道风, 等. 双酚A对大鼠睾丸Leyding细胞的毒性作用[J]. 卫生毒理学杂志, 2000, 14(3): 173-174. DOI:10.16421/ j.cnki.1002-3127.2000.03.017.
[26] YILDIRIM Z. Oral erdosteine administration attenuates cisplatin-induced renal tubular damage in rats[J]. Pharmacological Research, 2003, 47(2): 149-156.
[27] 邵鸿娥, 刘斌钰, 邢雁霞, 等. 枸杞多糖对小鼠体内抗氧化酶活性及耐力的影响[J]. 中国自然医学杂志, 2010, 12(2): 133-134. DOI:10.16505/j.2095-0136.2010.02.009.
Protective Effect of Lycium barbarum Polysaccharides on cis-Dichlorodiamineplatinum (Ⅱ)-Induced Oxidative Damage in Mouse Testis Sertoli Cells TM4
WANG Hai, ZHOU You, HUANG Shanwan, GAO Liping*
(Beijing Key Laboratory of Bioactive Substances and Functional Foods, College of Arts and Sciences, Beijing Union University, Beijing 100191, China)
Abstract:Objective: To explore the effect of Lycium barbarum polysaccharides (LBP) on cis-dichlorodiamineplatinum (II) (CDDP)-induced oxidative damage in mouse testis sertoli cells TM4 and its possible mechanism. Methods: The survival rate of the cells was evaluated by MTT assay. Superoxide dismutase (SOD) activity was examined by xanthine oxidase method. Malondialdehyde (MDA) content was measured by thiobarbituric acid assay. Glutathione (GSH) content was determined by nitrobenzoic acid method. Results: LBP at 5–100 mg/L could signifi cantly enhance the survival rate of TM4 cells (P < 0.01), and at 20–100 mg/L could signifi cantly inhibit the toxic effect of CDDP on TM4 cells (P < 0.01), and the best protective effect was observed as 50 mg/L. LBP at 50 mg/L could significantly reduce intracellular MDA content, increase SOD activity and GSH levels drop compared with CDDP control group (P < 0.01). Conclusion: CDDP-induced damage in TM4 cells could be remarkably reversed by LBP, which may be related with the strong antioxidant potential of LBP.
Key words:Lycium barbarum polysaccharides (LBP); cis-dichlorodiamineplatinum (Ⅱ); mouse testis sertoli cells TM4; oxidative damage
DOI:10.7506/spkx1002-6630-201717032
中图分类号:R285.6
文献标志码:A
文章编号:1002-6630(2017)17-0198-05引文格式:
收稿日期:2016-12-10
基金项目:北京市自然科学基金项目(7163211)
作者简介:王海(1992—),男,硕士,研究方向为生物活性物质对机体的生化作用。E-mail:916319176@qq.com
*通信作者:高丽萍(1962—),女,教授,博士,研究方向为生物活性物质对机体的生化作用。E-mail:gaolip62@163.com