陈玉胜,陈全战*
(南京晓庄学院食品科学学院,植物遗传与种质创新研究室,江苏 南京 211171)
摘 要:目的:研究灵芝多糖对CCl4诱导的急性肝损伤模型小鼠的抗炎和保肝作用,并探讨其可能机理。方法:小鼠随机均分为6 组,即空白对照组,急性肝损伤模型组(体积分数0.1%的CCl4溶液,20 mL/(kg•d)),灵芝多糖低、中、高剂量组(50、100、150 mg/(kg•d),以体质量计,下同)、联苯双酯组(100 mg/(kg•d))。1 周后测定小鼠的体质量、肝质量和肝指数;测定血清中谷丙转氨酶(alanine transferase,ALT)和谷草转氨酶(aspartate transferase,AST)活力及总胆红素(total bilirubin,TBIL)水平;测定肝组织中丙二醛(malondialdehyde,MDA)和还原型谷胱甘肽(glutathione-SH,GSH)水平及一氧化氮合酶(nitric oxide synthase,NOS)活力;测定血清及肝组织炎性因子白细胞介素(interleukin,IL)-1β、IL-18、IL-6及肿瘤坏死因子(tumor necrosis factor,TNF)-α水平;Western blot法测定肝组织中NOD样受体3(NOD-like receptor 3,NLRP3)、凋亡相关微粒蛋白(apoptosisassociated speck-like protein containing CARD,ASC)及胱冬肽酶-1(caspase-1)蛋白表达水平。结果:与空白对照组相比,CCl4显著提高急性肝损伤模型组小鼠的肝质量和肝指数(P<0.05),提高血清ALT和AST活力及TBIL水平,表明造模成功,并且提高IL-1β、IL-18、IL-6、TNF-α水平,提高肝组织MDA、IL- 1β水平及NOS活力,提高肝组织NLRP3、ASC及caspase-1的蛋白表达水平,显著降低肝组织GSH水平(P<0.05)。与模型组相比,灵芝多糖及联苯双酯显著降低小鼠肝质量和肝指数(P<0.05)、降低血清ALT和AST活力及TBIL、IL-1β、IL-18、IL-6、TNF-α水平,降低肝组织MDA、IL-1β水平及NOS活力,下调肝组织NLRP3、ASC及caspase-1的蛋白表达水平,改善肝组织形态学病变,显著提高肝组织GSH水平(P<0.05)。结论:灵芝多糖对CCl4所致急性肝损伤小鼠具有抗炎和保肝作用,其机制可能与抑制自由基脂质过氧化、抑制炎性因子活化及NOS活性有关。
关键词:灵芝多糖;肝损伤;抗炎;保肝;联苯双酯
陈玉胜, 陈全战. 灵芝多糖对CCl4诱导的急性肝损伤小鼠的抗炎和保肝活性[J]. 食品科学, 2017, 38(17): 210-215. DOI:10.7506/spkx1002-6630-201717034. http://www.spkx.net.cn
CHEN Yusheng, CHEN Quanzhan. Anti-infi ammatory and hepatoprotective effects of Ganoderma lucidum polysaccharides on carbon tetrachloride-induced acute liver injury in mice[J]. Food Science, 2017, 38(17): 210-215. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717034. http://www.spkx.net.cn
肝脏是机体解毒和调节糖、脂代谢平衡的主要器官[1]。随着人们生活水平的提高和生活环境(水、空气、食品等)的变化,肝病发病率呈逐年上升趋势。如病毒性肝炎、异源性肝损伤(酒精或药物、杀虫剂、致癌物等引起)、肝纤维化及自身免疫性肝炎等在全球范围内严重威胁着人类健康[2]。众所周知,诱导肝毒害的试剂CCl4曾广泛用作氯化、脱脂和提取的溶剂,直至发现其对人类具有致癌性和肝毒害性[3]。临床上多种药物可以引起肝损伤,如抗菌药物、非甾体抗炎药、中枢抑制药、抗肿瘤药、抗甲状腺药、免疫抑制剂、降糖药、降脂药等[4]。此外,护肝药物本身也具有潜在的肝损害问题。因此,寻找防治肝病的无副作用的天然药物显得尤为迫切。
近年来,中草药及其提取物广泛用于动物及人的疾病防治。许多研究已报道有关天然抗氧化物,如多糖、酮、苷及生物碱等,能有效抑制活性氧引起的肝病[5]。多糖广泛存在于植物、动物及微生物,并对肝损伤表现出积极的疗效[6]。灵芝多糖(Ganoderma lucidum polysaccharides,GLPS)是多孔菌属灵芝(G. lucidum)的主要活性成分。研究表明,GLPS具有显著的免疫调节、抗癌、抗衰老、降血糖及保肝活性[7-8]。然而,对GLPS的抗炎和保肝活性机理研究甚少。因此,本研究通过GLPS对CCl4诱导的昆明小鼠肝损伤的抗炎和保肝活性及其机理的研究,为临床防治肝病的新药研发提供参考。
1.1 动物、材料与试剂
60 只健康清洁级雄性昆明小鼠(22±2) g,购自上海杰思捷实验动物有限公司,动物许可证号SCKK(沪)2016-0005。实验动物饲养温度为(24±2) ℃,12 h光照/12 h黑暗的室内,常规饲料,自由饮水进食,适应1 周后用于实验。
灵芝子实体由南京晓庄学院药用菌物研究所提供。
谷丙转氨酶(alanine transferase,ALT)、谷草转氨酶(aspartate transferase,AST)、总胆红素(total bilirubin,TBIL)、丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione-SH,GSH)、一氧化氮合酶(nitric oxide synthase,NOS)及蛋白 试剂盒南京建成生物工程研 究所;酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、白细胞介素(interleukin,IL)-1β、IL-6、IL-18、肿瘤坏死因子(tumor necrosis factor,TNF)-α 美国IBL公司;一抗mNLRP3、mASC、mcaspase-1、mGAPDH(m指小鼠mice)及二抗IgG(羊抗兔) 美国Abcam公司;联苯双酯 北京协和制药厂;其他试剂均为国产分析纯。
1.2 仪器与设备
JA3003N电子天平 上海精密仪器有限公司;GRT16-2型高速冷冻离心机 北京时代北利离心机有限公司;Perfection 4870扫描仪 爱普生(中国)有限公司;XHF-D匀浆机 宁波新芝生物科技股份有限公司;冰箱(DW-86L388A,-80 ℃;BCD-201STPA,4 ℃) 青岛海尔股份有限公司;Multiskan FC酶标仪 赛默飞世尔科技(中国)有限公司;VE-180电泳仪 上海天能科技有限公司;HH-4数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 GLPS的制备
GLPS的制备 参照文献[9]的方法,取烘干粉碎的灵芝子实体200 g,室温条件下用95%乙醇脱脂48 h,然后加4 L双蒸水煮沸(100 ℃)提 取2 h,过滤后收集滤液,滤渣加1.5 L双蒸水煮沸1 h后过滤,合并两次滤液,用旋转蒸发仪浓缩(50 ℃),过滤,在滤液中加入4倍体积的乙醇,置于4 ℃冰柜过夜,醇沉后离心(4 ℃、4 800 r/min,20 min)。沉淀物溶于600 mL双蒸水,用120 mL CHCl3-n-BuOH(体积比5∶1)溶液脱蛋白20 次。水相部分用双蒸水透析3 d,再加入4 倍体积的乙醇,置于4 ℃冰柜过夜,醇沉后离心(4 ℃、4 800 r/min,20 min)。沉淀物用无水乙醇洗涤后,冷冻成冻干粉,得灵芝多糖6.3 g(色谱级,纯度大于95%)。
1.3.2 动物分组及处理
60 只昆明小鼠随机均分为6 组,分别为空白对照组、模型组、GLPS低、中、高剂量组和阳性对照(联苯双酯)组。GLPS低、中、高剂量组小鼠分别给予GLPS 50、100、150 mg/(kg·d)灌胃;阳性对照组小鼠给予联苯双酯100 mg/(kg·d)灌胃。灌胃体积为15 mL/kg(以体质量计,下同),空白对照组和模型组均给予等剂量生理盐水灌胃,每日1次,连续7 d。末次给药1 h后,模型组及各给药组小鼠腹腔注射20 mL/(kg·d)) CCl4溶液(体积分数0.1%),造成小鼠肝损伤。空白对照组小鼠腹腔注射同体积生理盐水,禁食不禁水。所有程序遵循中国小动物保护协会的要求。
1.3.3 生化指标测定
血清采集及肝指数的测定参照文献[10]的方法。上述小鼠造模6 h后摘眼球取血,离心(8 000×g,15 min),取上层血清,-20 ℃冻存备用。小鼠被断颈处死后迅速破腹取出肝脏,放冷生理盐水中洗净,用滤纸吸干后称质量,按下式计算肝指数。
取肝组织100 mg加入900 μL生理盐水,冰浴匀浆后离心(4 ℃、12 000×g,20 min),取上清液,4 ℃保存。其余肝组织切成小块迅速用液氮冷冻,然后-80 ℃冻存备用。按试剂盒说明书分别测定血清ALT、AST、TBIL、IL-1β、IL-6、IL-18、TNF-α水平及肝组织IL-1β、MDA、GSH、NOS水平。
1.3.4 肝脏组织学观察
不同肝小叶组织样本迅速浸泡在体积分数10%甲醛溶液中,脱水后嵌入石蜡内,切成5 μm厚的薄片,经苏木精-伊红(hematoxylin-eosin,HE)染色后进行组织形态学分析。
1.3.5 蛋白表达水平测定
参照文献[11]的Western blot法,分析肝组织NLRP3、ASC、caspase-1的蛋白表达水平。
1.4 数据统计分析
所有实验结果以±s表示(n=10),采用数据分析软件Graph Pad Prism 5进行单因素方差分析,两组平均数间差异采用t检验,P<0.05认为差异具有统计学意义。
2.1 GLPS对急性肝损伤小鼠体质量与肝指数的影响
表 1 GLPS对急性肝损伤小鼠体质量与肝指数的影响
Table 1 Effect of GLPS on body weight and liver index in mice with liver injury
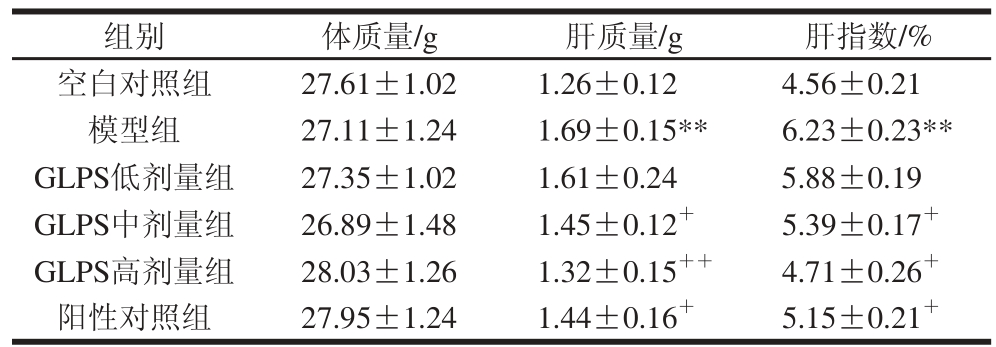
注:**.与空白对照组相比差异极显著(P<0.01);+.与模型组相比差异显著(P<0.05);++.与模型组相比差异极显著(P<0.01)。下同。
由表1可知,GLPS对小鼠体质量无显著性影响。模型组小鼠肝质量及肝指数均极显著高于空白对照组(P<0.01);与模型组相比,中、高剂量GLPS显著降低急性肝损伤小鼠的肝质量和肝指数(P<0.05,P<0.01)。联苯双酯显著降低急性肝损伤小鼠的肝质量及肝指数(P<0.05),而对小鼠体质量无显著性影响。
2.2 GLPS对急性肝损伤小鼠肝组织MDA、GSH含量及NOS活性的影响
表 2 GLPS对急性肝损伤小鼠肝组织MDA、GSH和NOS水平的影响
Table 2 Effect of GLPS on hepatic MDA, GSH and NOS levels in mice with liver injury

由表2可知,相比空白对照组,CCl4诱导的模型组小鼠产生了显著的氧化应激反应,表现在肝组织MDA含量、NOS活力极显著提高及GSH含量极显著降低(P<0.01)。与模型组相比,GLPS中、高剂量组及联苯双酯能显著缓解CCl4诱导的小鼠肝组织氧化应激(P<0.05,P<0.01)。
2.3 GLPS对急性肝损伤小鼠血清ALT、AST活力和TBIL含量的影响
表3表明,模型组小鼠血清ALT、AST活力及TBIL含量极显著高于空白对照组(P<0.01,P<0.001)。与模型组相比,GLPS中、高剂量显著降低急性肝损伤小鼠血清ALT、AST活力(P<0.05)和TBIL含量(P<0.05,P<0.01)。同样,联苯双酯显著降低急性肝损伤小鼠血清ALT活力(P<0.05)、AST活力(P<0.01)活力和TBIL含量(P<0.01)。
表 3 GLPS对急性肝损伤小鼠血清ALT、AST活力和TBIL水平的影响
Table 3 Effect of GLPS on ALT, AST and TBIL levels in serum of mice with liver injury
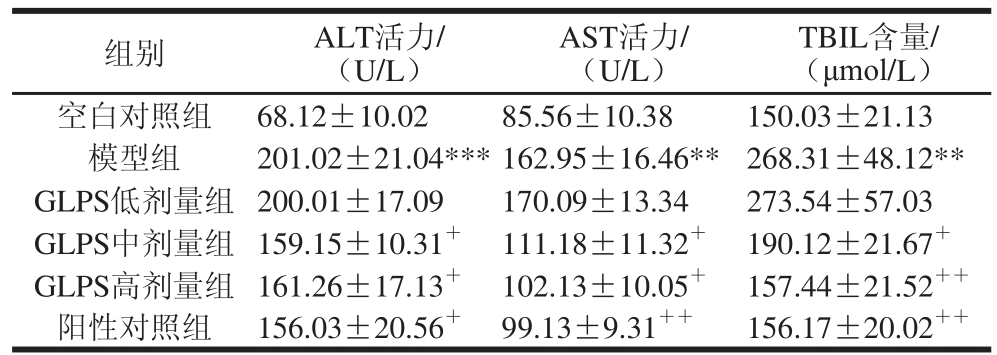
注:***.与空白对照组相比差异高度显著(P<0.0 01)。
2.4 GLPS对急性肝损伤小鼠血清IL-1β、IL-6、IL-18、TNF-α及肝组织IL-1β水平的影响
表 4 GLPS对急性肝损伤小鼠血清IL-1β、IL-6、IL-18、TNF-α及肝组织IL-1β水平的影响
Table 4 Effect of GLPS on the levels of IL-1β, IL-6, IL-18 and TNF-α in serum and IL-1β in liver tissue of mice with liver injury
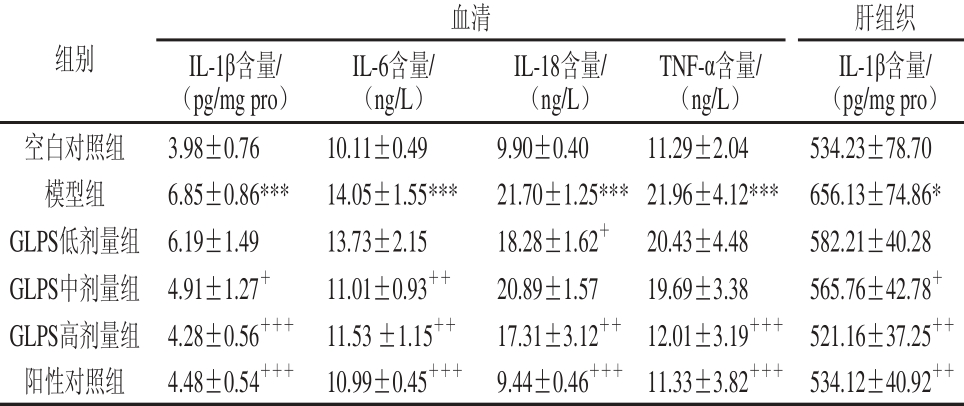
注:+++.与模型组相比差异高度显著(P<0.001)。
由4表可知,模型组小鼠血清IL-1β、IL-6、IL-18、TNF-α含量及肝组织IL-1β含量均显著高于空白对照组(P<0.001,P<0.05)。50 mg/kg GLPS显著降低急性肝损伤小鼠血清IL-18含量(P<0.05);100 mg/kg GLPS显著降低急性肝损伤小鼠血清IL-1β(P<0.05)、IL-6(P<0.01)及肝组织IL-1β(P<0.05)含量;150 mg/kg GLPS极显著降低急性肝损伤小鼠血清炎性因子IL-1β水平和TNF-α含量(P<0.001)、IL-6和IL-18含量、肝组织IL-1β含量(P<0.01)。联苯双酯极显著降低急性肝损伤小鼠血清IL-1β、IL-6、IL-18、TNF-α含量(P<0.001)和肝组织IL-1β含量(P<0.01)。
2.5 GLPS对急性肝损伤小鼠肝组织NLRP3炎性小体活化的抑制效应
从图1A~C可以看出,模型组小鼠肝组织NLRP3、ASC及caspase-1蛋白相对表达量极显著高于空白对照组(P<0.01)。GLPS中、高剂量组显著降低急性肝损伤小鼠NLRP3、ASC及caspase-1蛋白相对表达水平(P<0.05,P<0.01);阳性对照组显著降低急性肝损伤小鼠NLRP3(P<0.01)、ASC(P<0.05)及caspase-1(P<0.01)蛋白相对表达水平。
图1D为肝组织切片HE染色结果,模型组小鼠肝组织病理学变化主要表现在门管区严重淤血,血窦、大量液泡和坏疽清晰可见。100、150 mg/kg GLPS和100 mg/kg联苯双酯能够显著改善这种病变。
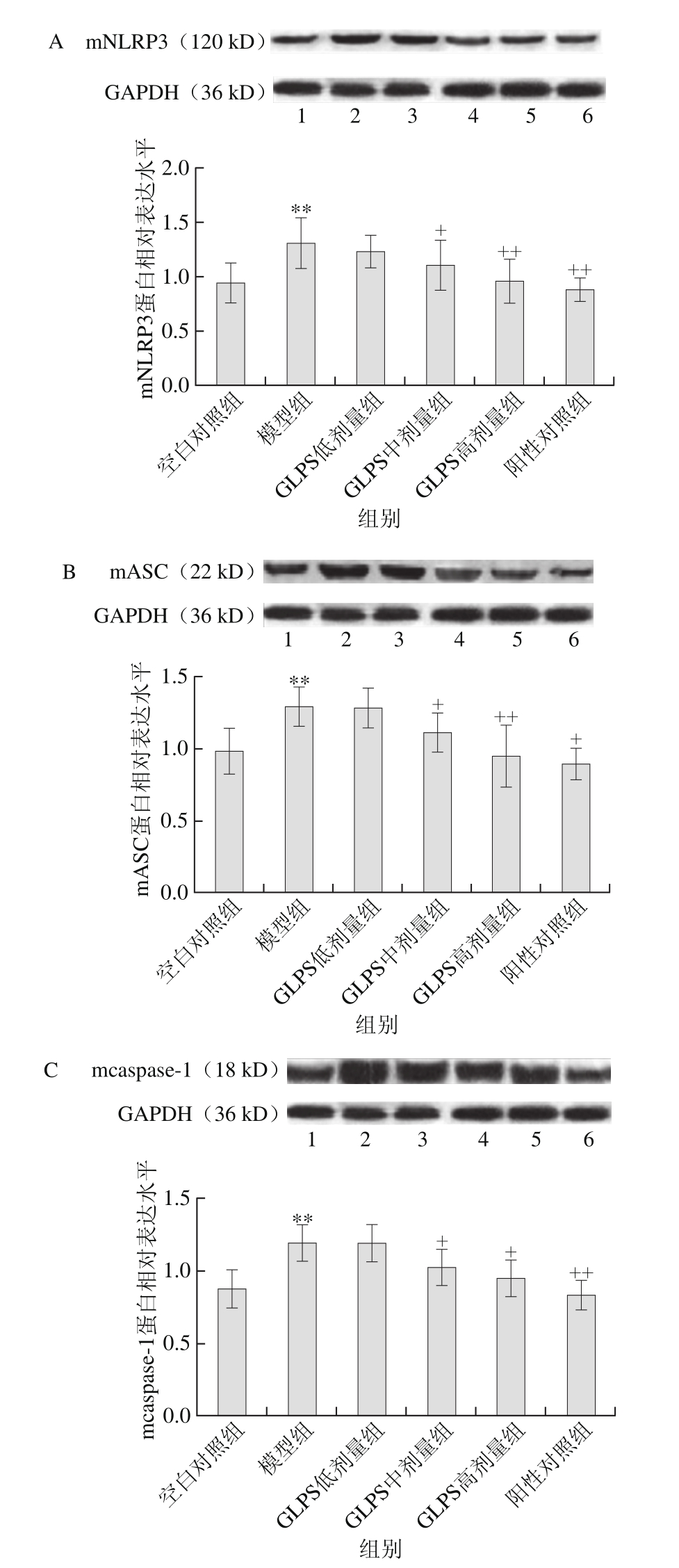
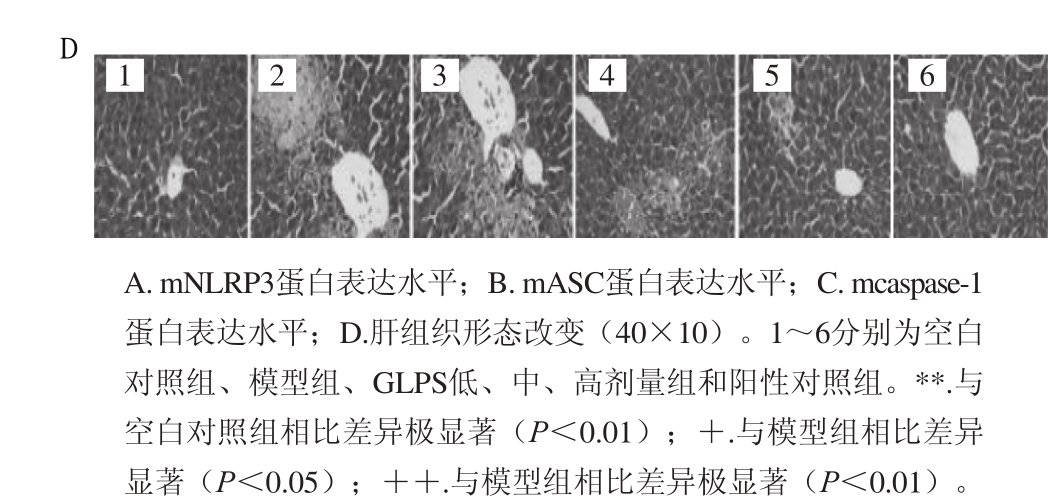
图 1 GLPS对急性肝损伤小鼠肝组织的影响
Fig. 1 Effect of GLPS on protein expression levels in liver
CCl4诱导的急性肝损伤动物模型是用来评价和筛选保肝药物的经典模型[12-13]。通常,氧化胁迫和脂质过氧化是CCl4诱导肝损伤的主要机制[14-15]。CCl4代谢产生大量的自由基,启动脂质过氧化的链式反应[16-17]。当体内产生过多的自由基时,GSH将被耗竭[18]。脂质过氧化产物MDA会随着膜结构和功能的损伤而显著提高[19]。因此MDA和GSH水平能反映肝细胞膜脂质过氧化的强弱和受自由基攻击而致肝损伤的程度。本实验中,100、150 mg/(kg·d)GLPS显著降低急性肝损伤小鼠肝组织MDA水平(P<0.05,P<0.01),提高GSH水平(P<0.05),说明一定剂量的GLPS能够通过提高GSH水平来抑制MDA的生成,抑制自由基脂质过氧化反应,阻止肝细胞脂质过氧化,维持膜的正常结构,从而避免肝细胞的损伤,这可能是GLPS发挥保肝活性的一条途径。
肝细胞脂质过氧化会打破细胞膜的完整性,细胞胞浆内ALT和AST这两种酶大量泄漏入血液,使血清中ALT和AST活力显著增强[20-21]。血清ALT和AST活力亦是反映肝损伤程度的重要敏感指标[22]。肝损伤还会导致肝脏清除TBIL的能力下降,致使TBIL水平升高。本实验中,100、150 mg/(kg·d)GLPS显著降低CCl4所致急性肝损伤小鼠血清ALT和AST活性及TBIL水平(P<0.05,P<0.01),效果与100 mg/(kg·d)联苯双酯相当。这表明一定剂量的GLPS对CCl4所致小鼠急性肝损伤具有保护作用。
肝损伤的严重程度还与肝细胞中NO的浓度有关。当肝细胞中NO及活性氧水平均较高时,二者发生氧化反应,生成细胞毒性很强的离子(ONOO-),发挥自由基对肝细胞的DNA、蛋白质和脂质的毒性,引起严重的肝损伤[23-24]。NOS是NO合成的关键酶,且与抗炎因子的活化有关。Ramadori等[25]实验表明,在CCl4诱导的肝损伤模型中,早期TNF-α水平的提高诱导了促炎基因,包括可诱导一氧化氮合酶(iNOS)基因的表达。本实验中,100、150 mg/(kg·d)GLPS显著降低了肝损伤小鼠肝组织NOS活性(P<0.05),从而减轻了炎症的发生和肝损伤。
各种肝脏毒素所致的肝脏炎症过程促使了许多病理的发生[26]。CCl4诱导ROS的产生,ROS能够活化NLRP3炎性小体,并导致促炎因子IL-1β、IL-18、IL-6和TNF-α等的释放及损伤组织其他细胞因子的表达[27-28]。本研究中,CCl4诱导的模型组小鼠血清IL-1β、IL-18、IL-6及TNF-α水平高度显著高于空白对照组(P<0.01);肝组织mNLRP3、mASC及mcaspase-1蛋白表达水平亦极显著提高(P<0.01);肝组织内血窦、液泡和坏疽等病理特征清晰可见,这些结果表明CCl4显著诱导了急性肝损伤和系统性炎症反应。而100、150 mg/(kg·d)GLPS和联苯双酯显著抑制肝脏NLRP3炎性小体的活化,减轻了组织病理学炎症症状。这表明GLPS对CCl4所致急性肝损伤小鼠具有抗炎功效,其机理可能是GLPS通过抑制TNF-α等促炎因子的形成来抑制NOS的活力,从而共同抑制了炎性反应。
这些结果表明一定剂量的GLPS具有抗炎和保肝活性,其机理可能是通过抑制自由基脂质过氧化作用,保护膜的完整性,降低血清ALT和AST两种酶的活力,从而发挥保肝作用;通过抑制TNF-α等促炎因子的形成及NOS活力,来抑制NLRP3炎性小体的活化,减轻炎症反应,从而发挥抗炎功效。
参考文献:
[1] YANG J, LI Y, WANG F, et al. Hepatoprotective effects of apple polyphenols on CCl4-induced acute liver damage in mice[J]. Journal of Agricultural and Food Chemistry, 2010, 58(10): 6525-6531. DOI:10.1021/jf903070a.
[2] HERKEL J, SCHUCHMANN M, TIEGS G, et al. Immune mediated liver injury[J]. Journal of Hepatology, 2005, 42(6): 920-923. DOI:10.1016/j.jhep.2005.02.009.
[3] CLAWSON G. Mechanisms of carbon tetrachloride hepatotoxicity[J]. Pathology and Immunopathology Research, 1989, 8(2): 104-112.
[4] 刘备, 马国. 抗菌药物致肝损伤的研究进展[J]. 中国医院药学杂志, 2016, 36(9): 1-7. DOI:10.13286/j.cnki.chinhosppharmacyj.2016.09.20.
[5] BALUNAS M J, KINGHORN A D. Drug discovery from medicinal plants[J]. Life Sciences, 2005, 78(5): 431-441. DOI:10.1016/j.lfs.2005.09.012.
[6] OTTU O J, ATAWODI S E, ONYIKE E. Antioxidant, hepatoprotective and hypolipidemic effects of methanolic root extract of Cassia singueana in rats following acute and chronic carbon tetrachloride intoxication[J]. Asian Pacifi c Journal of Tropical Medcine, 2013, 6(8): 609-615. DOI:10.1016/S1995-7645(13)60105-4.
[7] 王英. 灵芝水煎剂对老年大鼠NO、GSH-PX、LIP以及免疫功能影响的实验研究[J]. 牡丹江医学院学报, 2003, 24(5): 6-9. DOI:10.3969/j.issn.1001-7550.2003.05.003.
[8] ZHANG H N, HE J H, YUAN L, et al. In vitro and in vivo protective effect of Ganoderma lucidum polysaccahrides on alloxan-induced pancreatic islets damage[J]. Life Sciences, 2003, 73(18): 2307-2319.
[9] CHEN Y, XIE M Y, NIE S P, et al. Purifi cation, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry , 2008, 107(1): 231-241. DOI:10.1016/j.foodchem.2007.08.021.
[10] 陈玉胜, 陈全战. 大豆水提物对四氯化碳诱导的肝损伤小鼠肝脏抗氧化活力的影响[J]. 大豆科学, 2015, 34(2): 66-69. DOI:10.11861/ j.issn.1000-9841.2015.02.0341.
[11] KIM S B, KANG O H, LEE Y S, et al. Hepatoprotective effect and synergism of bisdemethoycurcumin against MCD diet-induced nonalcoholic fatty liver disease in mice[J]. PLoS ONE, 2016, 11(2): e0147745. DOI:10.1371/journal.pone.0147745.
[12] KURIAKOSE G C, KURUP M G. Antioxidant and antihepatotoxic effect of Spirulina laxissima against carbon tetrachloride induced hepatotoxicity in rats[J]. Food & Function, 2011, 2(3/4): 190-196. DOI:10.1039/c0fo00163e.
[13] TOMASI A, ALBANO E, BANNI S, et al. Free-radical metabolism of carbon tetrachloride in rat liver mitochondria. A study of the mechanism of activation[J]. The Biochemical Journal, 1987, 246(2): 313-317. DOI:10.1042/bj2460313.
[14] 王会, 郭立, 谢文磊. 抗氧化剂抗氧化活性的测定方法[J]. 食品与发酵工业, 2006, 32(3): 92-99. DOI:10.3321/j.issn:0253-990X.2006.03.026.
[15] JIA R, CAO L P, DU J L, et al. Effects of carbon tetrachloride on oxidative stress, inflammatory response and hepatocyte apoptosis in common carp (Cyprinus carpio)[J]. Aquatic Toxicology, 2014, 152: 11-19. DOI:10.1016/j.aquatox.2014.02.014.
[16] POLI G, ALBANO E, DIANZANI M U. The role of lipid peroxidation in liver damage[J]. Chemistry and Physics of Lipids, 1987, 45(2/3/4): 117-142. DOI:10.1016/0009-3084(87)90063-6.
[17] FATHY S M, DREES E A. Protective effects of Egyptian cloudy apple juice and apple peel extract on lipid peroxidation, antioxidant enzymes and infi ammatory status in diabetic rat pancreas[J]. BMC Complement Altern Med, 2016, 11(16): 8. DOI:10.1186/s12906-015-0957-0.
[18] SAEED N, KHAN M R, SHABBIR M. Antioxidant activity, total phenolic and total fi avonoid contents of whole plant extracts Torilis leptophylla L.[J]. BMC Complementary and Alternative Medcine, 2012, 16(12): 221-228. DOI:10.1186/1472-6882-12-221.
[19] MICHIELS C, RAES M, TOUSSAINT O, et al. Importance of Se-glutathione peroxidase, catalase, and Cu/Zn-SOD for cell survival against oxidative stress[J]. Free Radical Biology and Medcine, 1994, 17(3): 235-248. DOI:10.1016/0891-5849(94)90079-5.
[20] WEBER L W, BOLL M, STAMPFL A. Hepatotoxicity and mechanism of action of haloalkanes: carbon tetrachloride as a toxicological model[J]. Critical Reviews in Toxicology, 2003, 33(2): 105-136. DOI:10.1080/713611034.
[21] SHAH H, HARTMAN S P, WEINHOUSE S. Formation of carbonyl chloride in carbon tetrachloride metabolism by rat liver in vitro[J]. Cancer Research, 1979, 39(10): 3942-3947.
[22] 张红, 史天陆, 王静, 等. 五乙酰栀子酰苯胺对D-GalN所致小鼠急性肝损伤的保护作用[J]. 安徽医科大学学报, 2013, 48(7): 786-789.
[23] MININ E A, BUCHWALOW I B, WELLNER M, et al. L-Arginine-NO-cGMP signaling following acute liver injury in the rat[J]. Experimental and Toxicology Pathology, 2005, 57(2): 161-171. DOI:10.1016/j.etp.2005.08.003.
[24] BEN A H, ZAOUALI M A, ALFANY-FERNANDEZ I, et al. How to protect liver graft with nitric oxide[J]. World Journal of Gastroenterology, 2011, 17(24): 2879-2889. DOI:10.3748/wjg.v17. i24.2879.
[25] RAMADORI G, AMBRUST T. Cytokines in the liver[J]. European Journal of Gastroenterology & Hepatology, 1999, 13(7): 777-784. DOI:10.1097/00042737-200107000-00004.
[26] BADGER D A, SAUER J M, HOGLEN N C, et al. The role of inflammatory cells and cytochrome P450 in the potentiation of CCl4-induced liver injury by a single dose of retinol[J]. Toxicology and Applied Pharmacology, 1996, 141(2): 507-519. DOI:10.1006/ taap.1996.0316.
[27] NIC HOLAS S A, BUBNOV V V, YASINSKA I M, et al. Involvement of xanthine oxidase and hypoxia-inducible factor 1 in Toll-like receptor 7/8-mediated activation of caspase 1 and interleukin-1β[J]. Cellular and Molecular Life Sciences, 2011, 68(1): 151-158. DOI:10.1007/s 00018-010-0450-3.
[28] BEUTLER B, KRUYS V. Lipopolysaccharide signal transduction, regulation of tumor necrosis factor biosyn thesis, and signaling by tumor necrosis factor itself[J]. Journal of Cardiovascular Pharmacology, 1995, 25(Suppl 2): 1-8.
Anti-Infi ammatory and Hepatoprotective Effects of Ganoderma lucidum Polysaccharides on Carbon Tetrachloride-Induced Acute Liver Injury in Mice
CHEN Yusheng, CHEN Quanzhan*
(Laboratory of Plant Genetics and Germplasm Innovation, School of Food Science, Nanjing Xiaozhuang University, Nanjing 211171, China)
Abstract:Objective: To study the anti-infi ammatory and hepatoprotective effects of Ganoderma lucidum polysaccharides (GLPS) in mice with acute liver injury induced by carbon tetrachloride (CCl4), and to explore the possible mechanism. Methods: Mice were randomly divided into six groups: normal control group, acute liver injury model group (0.1% (V/V) CCl4, 20 mL/(kg bw·d), low, medium and high-dose GLPS groups (50, 100 and 150 mg/(kg bw·d)), and bifendate group (100 mg/(kg bw·d)). After administration for 7 continuous days, the body weight, liver weight, liver index, alanine transferase (ALT) and aspartate transferase (AST) activities, and total bilirubin (TBIL) level in serum were detected, and the malondialdehyde (MDA) and glutathione-SH (GSH) levels, and nitric oxide synthase (NOS) activity in liver tissue were also analyzed. The levels of interleukin (IL)-1β, IL-18, IL-6 and TNF-α in serum and IL-1β in liver tissue were analyzed by commercial enzyme linked immunosorbent assay (ELISA) kits. The protein expression levels of NLRP3, ASC and caspase-1 in liver tissue were evaluated by Western blot. Results: Compared with the normal control group, CCl4significantly increased liver weight and liver index, improved serum ALT and AST activities, enhanced the levels of TBIL, IL-1β,IL-18, IL-6 and TNF-α in serum and MDA, IL-1β and NOS in liver tissue, up-regulated the protein expression of NLRP3, ASC and caspase-1 in live r tissue, and remarkably reduced GSH level in liver tissue in the model group. Compared with the acute liver injury model group, GLPS and bifendate notably inhibited ALT and AST activities, decreased liver weight and index, as well as TBIL, IL-1β, IL-18, IL-6 and TNF-α in serum and MDA, IL-1β and NOS in liver tissue, remarkably enhanced GSH levels, down-regulated the protein expression NLRP3, ASC and caspase-1 in liver tissue, notably ameliorated the morphological changes of liver tissue. Conclusion: GLPS has a significant anti-inflammatory and hepatoprotective effect on CCl4-induced liver injury in mice. The possible mechanism may be related to the inhibition of free radical lipid peroxidation, NOS activity and the activation of liver infi ammatory fac tors.
Key words:G anoderma lucidum polysaccharides; liver injury; anti-infi ammatory; hepatoprotective; bifendate
DOI:10.7506/spkx1002-6630-201717034
中图分类号:R285. 5
文献标志码:A
文章编号:1002-6630(2017)17-0210-06引文格式:
收稿日期:2016-06-27
基金项目:南京市重点学科基金项目(NJZDXK201407)
作者简介:陈玉胜(1968—),男,高级实验师,博士,研究方向为植物生理生化及药理。E-mail:yschen@njxzc.edu.cn *通信作者:陈全战(1964—),男,教授,博士,研究方向为分子生物学。E-mail:qzchen65@hotmail.com