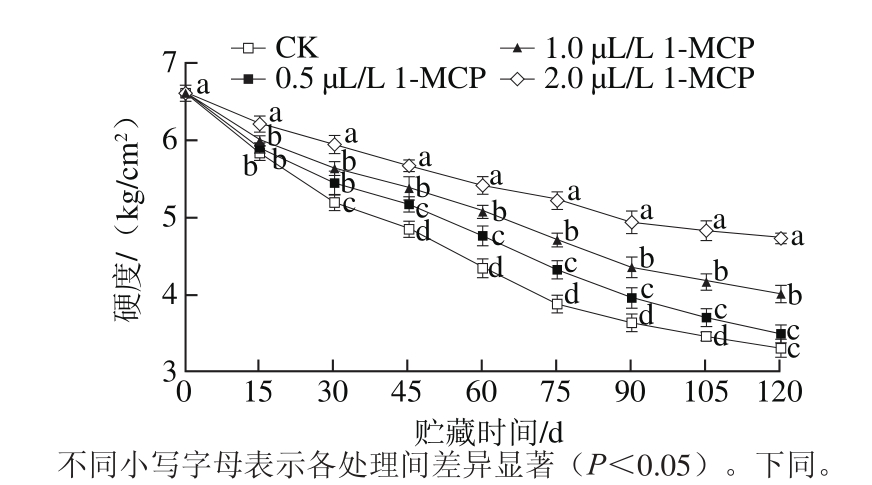
图 1 1-MCP处理对“岳帅”苹果冷藏期间果实硬度的影响
Fig. 1 Effect of 1-MCP on fruit fi rmness of Yueshuai apples during cold storage
郭 丹,韩英群,魏 鑫,魏 潇,王柏松,郝 义*
(辽宁省果树科学研究所,辽宁 营口 115009)
摘 要:研究1-甲基环丙烯(1-methylcyclopropene,1-MCP)处理对“岳帅”苹果低温贮藏期间与软化相关的主要物质含量及酶活性的影响,探讨1-MCP处理对“岳帅”苹果果实软化的调控机理,为“岳帅”苹果贮藏保鲜提供理论依据。以“岳帅”苹果为研究对象,使用0.0、0.5、1.0、2.0 μL/L的1-MCP处理后,于(0.0±0.5)℃、相对湿度90%~95%的冷库内贮藏,定期测定果实硬度、呼吸强度、乙烯释放量、细胞壁组成成分及相关酶活性。“岳帅”苹果采后呼吸强度和乙烯释放量均于第30天时达到峰值,多聚半乳糖醛酸酶(polygalacturonase,PG)也在第30天达活力高峰,果胶甲酯酶、纤维素酶(cellulose,Cx)、β-葡萄糖苷酶第45天达活力高峰,同时果实可溶性果胶含量迅速上升,原果胶、纤维素含量不断下降。0.5 μL/L 1-MCP处理可推迟果实呼吸强度高峰、乙烯释放量高峰、PG和Cx活力高峰的出现,对抑制可溶性果胶含量升高和原果胶含量的降低作用显著(P<0.05),但对冷藏结束时果实硬度的降低抑制效果不显著(P0.05);1.0 μL/L和2.0 μL/L 1-MCP处理对果实呼吸强度、乙烯释放量、细胞壁降解酶、可溶性果胶含量均有显著抑制作用(P<0.05),并且能显著抑制果实硬度下降(P<0.05)。“岳帅”苹果在冷藏期间原果胶、纤维素不断被分解,可溶性果胶不断生成,果实硬度迅速下降;除PG外,各细胞壁降解酶活力高峰均出现在呼吸强度和乙烯释放量高峰之后。1-MCP处理通过改变“岳帅”苹果呼吸强度和乙烯释放量,抑制果实细胞壁降解酶活性并推迟活性高峰,从而减缓果实细胞壁组成成分降解,抑制果实软化。1.0 μL/L和2.0 μL/L的1-MCP处理效果较为显著。
关键词:1-甲基环丙烯;“岳帅”苹果;冷藏;软化;生理
郭丹, 韩英群, 魏鑫, 等. 1-MCP处理对 岳帅 苹果冷藏软化及相关生理指标的影响[J]. 食品科学, 2017, 38(17): 266-272. DOI:10.7506/spkx1002-6630-201717043. http://www.spkx.net.cn
GUO Dan, HAN Yingqun, WEI Xin, et al. Effect of 1-MCP treatment on softening and related physiological indices in Yueshuai apples during cold storage[J]. Food Science, 2017, 38(17): 266-272. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201717043. http://www.spkx.net.cn
“岳帅”苹果是辽宁省果树科学研究所以“金冠”为母本、“红星”为父本杂交选育出的优良品种,其丰产性好、适应性强、香味浓郁、品质突出,但其贮藏性差,常温贮藏半个月或冷库贮藏2~3 个月后,果实硬度急剧降低,品质迅速劣变,贮藏期易软化已成为“岳帅”苹果不耐贮藏的关键因素,严重影响该品种的推广和销售[1]。质地软化是果实采后成熟衰老的明显标志,软化程度影响着果实的贮藏性、食用价值和商品价值[2]。苹果属于呼吸跃变型果实,具有明显的呼吸强度高峰和乙烯释放高峰,除去果实中的乙烯或抑制果实乙烯形成的方法可抑制果实成熟衰老进程[3]。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)作为一种乙烯受体抑制剂,可阻断乙烯与受体的结合,抑制果实软化、抑制果实细胞结构的分解及相关酶活性、延缓果实后熟衰老、保持果实品质[4]。由于安全无毒、简便高效,1-MCP已在多种果品采后保鲜上广泛应用,并取得显著效果。在苹果保鲜中,1-MCP可维持果实硬度、延缓可滴定酸和可溶性固形物含量下降,抑制呼吸强度和乙烯释放量,明显延缓果实的后熟与衰老,保持风味,延长货架期[5]。不同品种对1-MCP的反应不同,张锋等[6]研究发现,1-MCP能显著延缓“新红星”苹果果实软化,但对“富士”果实软化影响较小。1-MCP能提高“岳帅”苹果贮藏品质、抑制果实软化的研究也有相关报道[7-8],但其对“岳帅”苹果细胞壁降解酶变化和抑制细胞壁组成成分降解的作用机制尚不清楚,并且抑制“岳帅”苹果软化的适宜1-MCP处理浓度也不明确。
本实验使用不同剂量的1-MCP处理“岳帅”苹果,研究贮藏期间果实硬度、呼吸强度、乙烯释放量、细胞壁组成成分及相关酶活性变化规律,分析“岳帅”苹果软化生理生化机制及1-MCP处理对其软化的调控机理,为1-MCP在“岳帅”苹果贮藏保鲜中的应用和完善栽培推广技术提供理论依据。
1.1 材料与试剂
实验所用“岳帅”苹果采自辽宁省果树科学研究所苹果示范园。
1-MCP缓释剂(有效质量浓度1×103mg/L)咸阳西秦生物科技有限公司。
1.2 仪器与设备
53205型数显果实硬度计、G100型二氧化碳培养分析仪 北京阳光亿事达科技有限公司;Varian CP-3800气相色谱仪 北京军洋科技有限公司;GL-16G-Ⅱ型离心机 上海安亭科学仪器厂;UV-2550型紫外-可见分光光度计 岛津国际贸易上海有限公司;ME204E型分析天平 瑞士梅特勒-托利多仪器公司;Milli-Q超纯水系统 默克化工技术(上海)限公司。
1.3 方法
1.3.1 实验设计与处理
2015年9月29日,选取树冠中部靠外围无病虫害、无机械损伤、大小均匀、着色程度一致、八九成成熟度的果实,装入内衬为0.04 mm厚的聚乙烯保鲜膜的塑料箱中备用。实验共设4 个处理组,于室温(20~25 ℃)条件下分别用0.5、1.0、2.0 μL/L的1-MCP密闭熏蒸24 h,以密闭不加1-MCP 为对照(CK),每个处理组用苹果90 kg,15 千克/箱(约50 个/箱),每个处理组重复3 次。处理完毕后于(0.0±0.5)℃敞口预冷24 h,再于(0.0±0.5)℃、相对湿度90%~95%的冷库内贮藏。冷藏期间,每半个月测定1 次,每次随机取苹果10 个立即送入实验室内,常温下进行相关指标分析测定,所有测定重复3 次。
1.3.2 指标测定
硬度:采用53205型意大利数显果实硬度计测定,探头直径8 mm,重复测定5 个果实;呼吸强度:选取6~8 个果实装入保鲜盒内,采用G100型二氧化碳培养箱分析仪测定,参考曹建康等[9]的方法计算;乙烯释放量:采用美国Varian CP-3800气相色谱仪测定,参考程顺昌等[10]的方法;可溶性果胶和原果胶含量:咔唑比色法,参考曹建康等[9]的方法测定;纤维素含量:比色法,参考王鸿飞等[11]的方法;多聚半乳糖醛酸酶(polygalacturonase,PG)活力:比色法,参考曹建康等[9]的方法测定,以每小时每克果蔬组织样品在37 ℃催化多聚半乳糖醛酸水解形成半乳糖醛酸的质量表示;果胶甲酯酶(pectinesteras,PME)活力:参考索标[12]的方法,以每克样品每分钟在620 nm波长处吸光度变化0.01为1个活力单位(U);纤维素酶(cellulose,Cx)活力:比色法,参考曹建康等[9]的方法测定,以每小时每克果蔬组织样品在37 ℃催化羧甲基纤维素水解形成还原糖的质量表示;β-葡萄糖苷酶活力:水杨苷水解法,参考曹建康等[9]所用方法测定。
1.4 数据处理
实验数据采用Microsoft Excel 2007软件进行统计分析与制图,采用DPS 7.05软件进行差异显著性分析。
2.1 1-MCP处理对“岳帅”苹果果实硬度的影响

图 1 1-MCP处理对“岳帅”苹果冷藏期间果实硬度的影响
Fig. 1 Effect of 1-MCP on fruit fi rmness of Yueshuai apples during cold storage
从图1可以看出,在贮藏期间,4 个处理组中的“岳帅”苹果果实硬度均呈下降趋势,与CK相比,1-MCP处理能延缓果实硬度下降。贮藏30 d开始,CK果实硬度开始显著低于其他处理组果实(P0.05),2.0 μL/L 1-MCP处理组果实硬度显著高于其他含量1-MCP处理组的果实(P0.05);至贮藏结束时,CK、0.5、1.0、2.0 μL/L 1-MCP处理组果实硬度分别下降了49.80%、47.04%、39.17%和28.28%。不同1-MCP含量处理组果实硬度差异显著(P0.05),0.5 μL/L 1-MCP处理组与CK果实硬度差异不显著(P>0.05)。
2.2 1-MCP处理对“岳帅”苹果果实呼吸强度和乙烯释放量的影响
由图2可知,“岳帅”苹果属于呼吸跃变型果实。在贮藏期间,各处理组果实均出现呼吸强度高峰。采收后果实呼吸强度逐渐增强,CK、0.5、1.0、2.0 μL/L 1-MCP处理组果实分别于第30、45、60、60天达到呼吸强度高峰,呼吸强度高峰值分别为17.00、14.80、14.00、12.35 mg CO2/(kg·h),1-MCP处理显著降低了“岳帅”苹果呼吸强度高峰值(P<0.05);贮藏后期(75 d以后),除2.0 μL/L 1-MCP处理组外,果实呼吸强度再次增高,可能是由于果实品质生理劣变所致[13]。由此可见,1-MCP能降低“岳帅”苹果呼吸强度,延缓其呼吸强度高峰的到来。

图 2 1-MCP处理对“岳帅”苹果冷藏期间呼吸强度的影响
Fig. 2 Effect of 1-MCP on respiration intensity of Yueshuai apples during cold storage

图 3 1-MCP处理对“岳帅”苹果冷藏期间乙烯释放量的影响
Fig. 3 Effect of 1-MCP on ethylene production rate in Yueshuai apples during cold storage
从图3可以看出,在冷藏期间,“岳帅”苹果果实乙烯释放量变化与呼吸强度变化趋势相似, 1-MCP处理降低了果实乙烯释放量,同时延缓了果实乙烯释放量高峰的发生。在第30 天时,CK果实乙烯释放量达到高峰,为6.34 μL/(kg·h)。0.5、1.0、2.0 μL/L 1-MCP处理果实分别于第45、60、60天达到高峰,峰值为5.74、5.63、4.92 μL/(kg·h)。冷藏结束时,CK果实乙烯释放量显著高于其他3个处理组果实(P<0.05),各不同含量1-MCP处理组果实乙烯释放量差异显著(P<0.05)。乙烯是引起呼吸强度高峰产生及果实衰老软化的关键物质,乙烯释放量的增加是果实成熟衰老的最明显标志之一[13-14]。本实验中,乙烯释放量高峰的出现同时,出现了呼吸强度高峰,随后果实迅速软化衰老,可见,乙烯是果实衰老软化的重要影响因素。2.3 1-MCP处理对“岳帅”苹果果实可溶性果胶、原果胶、纤维素含量的影响
图4为“岳帅”苹果冷藏期间果实可溶性果胶、原果胶、纤维素含量变化情况。目前研究认为,质地软化是由细胞壁结构和组成成分的变化引起的,果实果肉细胞壁多糖组分(果胶、纤维素等)的降解或解聚是果实后熟和贮藏期间果肉软化的主要原因[15-16]。
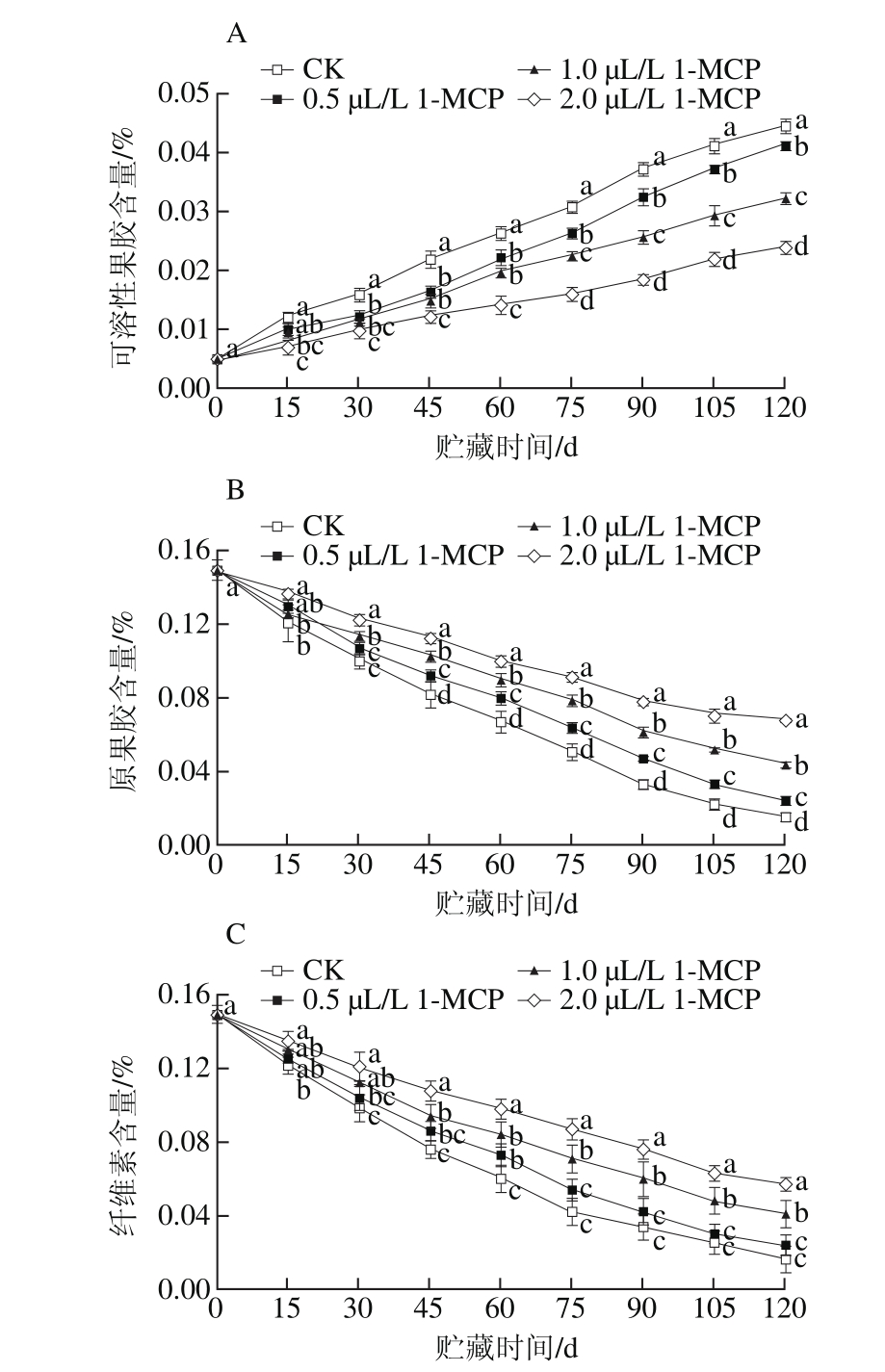
图 4 1-MCP处理对“岳帅”苹果冷藏期间可溶性果胶(A)、原果胶(B)、纤维素(C)含量的影响
Fig. 4 Effect of 1-MCP on the contents of water-soluble pectin (A), proto pectin (B) and cellulose (C) in Yueshuai apples during cold storage
由图4A可知,果实采后可溶性果胶含量逐渐上升,1-MCP处理能显著抑制果实可溶性果胶含量的上升(P<0.05),第30天开始,2.0 μL/L的1-MCP处理组果实的可溶性果胶含量显著低于其他浓度处理(P<0.05);冷藏结束时,CK、0.5、1.0、2.0 μL/L 1-MCP处理组果实可溶性果胶含量分别为采收时的8.94、8.28、6.50、4.80倍,各处理组间差异显著(P<0.05)。
从图4B可知,“岳帅”苹果冷藏期间果实原果胶含量呈下降趋势。冷藏结束时,CK、0.5、1.0、2.0 μL/L 1-MCP处理组果实原果胶含量分别由采摘时的0.15%降至0.015%、0.024%、0.044%、0.068%,各处理组果实原果胶含量差异显著(P<0.05)。
从图4C可以看出,“岳帅”苹果冷藏期间果实纤维素含量不断降低,1-MCP处理延缓果实纤维素的降解。冷藏期间,CK、0.5、1.0、2.0 μL/L 1-MCP处理组果实纤维素含量下降幅度分别为89.33%、84.00%、72.67%和62.00%,除CK组果实与0.5 μL/L 1-MCP处理组果实纤维素含量差异不显著外(P0.05),其他处理组差异显著(P<0.05)。
2.4 1-MCP处理对“岳帅”苹果果实PG、PME、Cx、β-葡萄糖苷酶活力的影响

图 5 1-MCP处理对“岳帅”苹果果实冷藏期间PG(A)、PME(B)、Cx(C)、β-葡萄糖苷酶(D)活力的影响
Fig. 5 Effect of 1-MCP on PG (A), PME (B), Cx (C) and β-glucosidase (D) activities in Yueshuai apples during cold storage
由图5A可知,在冷藏期间,“岳帅”苹果PG出现一次明显的活力高峰。CK果实于第30天达活力高峰,0.5、1.0、2.0 μL/L 1-MCP处理组将果实活力高峰推迟至第45、60、60天,各处理组峰值分别为787、675、660、465 μg/(h·g)。1-MCP处理可显著降低果实PG活力(P<0.05),2.0 μL/L处理效果最好。PG活性与果实硬度变化密切相关,其活性增高可加速果胶物质的降解。在贮藏后期,PG活力再次升高,可能导致果实急剧软化衰老[17]。
由图5B可以看出,在冷藏期间,“岳帅”苹果PME活力呈现上升-下降-上升的变化趋势。采摘时果实PME活力值为0.40 U/g,CK、0.5 μL/L 1-MCP处理组果实在第45天时达活力高峰,峰值分别为1.87、1.56 U/g;1.0、2.0 μL/L 1-MCP处理组果实活力高峰出现于第75天,峰值分别为1.92、1.65 U/g;冷藏后期(90 d后)PME活力再次升高。冷藏结束时,PME活力由高到低分别是CK、0.5、1.0、2.0 μL/L 1-MCP处理组果实,各处理组酶活力均呈显著性差异(P<0.05)。
由图5C可知,在冷藏期间,“岳帅”苹果Cx活力出现不止一次活性高峰。1-MCP处理能延缓Cx活力高峰的出现,降低果实Cx活力。Cx主要分解果实纤维素和半纤维素,与果实软化密切相关,对其活力的抑制可减缓果实软化[18]。本实验中,CK果实Cx活力高峰分别出现于第45天和第90天,峰值为345、440 μg/(h·g);0.5 μL/L 1-MCP处理组延缓了第一次活力高峰的出现,峰值分别为338、398 μg/(h·g);1.0 μL/L 和2.0 μL/L 1-MCP处理组延缓了2 次Cx高峰的出现,峰值分别为280、340 μg/(h·g)和211、176 μg/(h·g)。
β-葡萄糖苷酶是一类细胞壁多糖水解酶,对维持细胞壁的稳定性有重要作用[19]。从图5D可以看出,在冷藏期间,“岳帅”苹果β-葡萄糖苷酶活力变化呈现上升-下降-上升的变化趋势。其活力上升导致细胞壁结构破坏,活力升至最高时,果实硬度开始迅速下降,后期其活力再次升高可能导致果实硬度快速降低、品质急剧劣变。采摘时,“岳帅”苹果β-葡萄糖苷酶活力为850 μg/(h·g);CK、0.5 μL/L 1-MCP处理组果实在第45天时活力升至最高,为1 800、1 600 μg/(h·g);1.0、2.0 μL/L 1-MCP处理果实在第60天时活力升至最高,分别为1 630、1 150 μg/(h·g)。1-MCP处理可降低果实β-葡萄糖苷酶活力,延缓活力的升高,浓度越高效果越明显,贮藏结束时各处理β-葡萄糖苷酶活力均呈显著性差异(P<0.05)。
近年来,虽对“岳帅”苹果采后品质生理的研究已有相关报道,但多集中在果实品质变化方面。张景娥等[20]认为,盛花期后153~156 d采收的果实贮藏品质较优。箱式气调箱和1-MCP保鲜处理均能延缓“岳帅”苹果贮藏品质下降,使果实保持较高的硬度和内容物含量[8,21]。李宏建等[8]认为,在贮藏期间,“岳帅”苹果的Cx、PG、脂氧合酶活性变化与果实纤维素、果胶、可溶性固形物和总糖含量密切相关并影响果实软化。以上研究结果表明细胞壁降解酶活性与“岳帅”苹果软化生理具有相关性,且1-MCP处理可延缓“岳帅”苹果软化进程,但其对“岳帅”苹果软化相关酶的影响研究还不够深入,也没有进行呼吸强度、乙烯释放量等指标与果实软化相关性的研究,细胞壁降解酶变化和细胞壁组成成分降解抑制的作用机制也尚不清楚。因此,有必要将1-MCP处理技术对“岳帅”苹果贮藏期间软化及抑制机理进行系统研究。
3.1 “岳帅”苹果果实贮藏期软化相关物质和酶活性的变化规律
软化是果实成熟与衰老的典型特征,是限制果实长期贮藏的关键因素。软化是一个极其复杂的生理过程,主要是在PG、PEX、Cx等的作用下,构成细胞壁的果胶质、纤维素、半纤维素和糖蛋白等物质的水解引起细胞壁组成成分结构的破坏和细胞间连接减少,导致细胞发生分离[22-23]。同时,果实的软化又受到果实呼吸作用和乙烯的影响[24]。硬度是果实贮藏品质的重要衡量指标之一,直接反应果实软化程度。本实验中,“岳帅”苹果冷藏中期(贮藏30~90 d)果实硬度下降,果实呼吸强度、乙烯释放量、各类细胞壁降解酶活力均达到峰值。其中,果实采后呼吸强度和乙烯释放量均于第30天时出现峰值,而各细胞壁降解酶活力迅速升高并达到峰值,PG活力在第30天出现峰值,PME、Cx、β-葡萄糖苷酶活力第45天达到峰值,同时,果实可溶性果胶含量迅速上升,原果胶、纤维素含量快速下降,这些变化互为因果,导致果实硬度迅速下降。除PG外,各细胞壁降解酶活力高峰均出现在果实硬度快速降低期及呼吸强度和乙烯释放量的峰值出现之后,PG、呼吸强度和乙烯释放量高峰出现伴随着果实硬度迅速下降,说明呼吸作用和乙烯可能是“岳帅”苹果软化启动因子,影响和调控果实软化,PG也是影响“岳帅”苹果贮藏期软化的关键细胞壁降解酶。乙烯可促进苹果等呼吸跃变型果实成熟已被公认,本实验中乙烯释放量高峰出现先于细胞壁降解酶高峰,说明乙烯可诱导果实软化衰老。这与刘超超等[25]的研究结论类似,乙烯释放量高峰的出现可能是导致“泰山早霞”PG活力上升并出现活性高峰及硬度快速下降的关键原因。
3.2 1-MCP处理对“岳帅”苹果果实软化的调控机制
乙烯作为一种成熟激素,是启动和促进成熟基因表达的主要因子,也是呼吸强度高峰产生及果实衰老软化的关键物质,它可引起果实呼吸强度的变化,导致果实中PG、淀粉酶、果胶酶等的活力上升,水解酶类活性增强,破坏维持果实硬度的细胞物质,从而使果实硬度发生改变,失去贮藏性[26-27]。1-MCP作为乙烯作用抑制剂,通过与乙烯竞争受体,阻断乙烯反馈调节的生物合成,推迟果实呼吸强度高峰和乙烯释放量高峰的出现,减少呼吸强度和乙烯释放量,抑制水解酶类活性,延缓乙烯引起的衰老作用,进而推迟或抑制果实软化[28]。随着果实软化及调控生理研究的深入和1-MCP抑制果实后熟软化生理研究的不断开展,1-MCP抑制不同果实软化生理机制逐步明确,1-MCP对果实软化相关酶活性的影响有显著区别[29-30]。
本实验结果表明:1-MCP处理对“岳帅”苹果软化有明显的抑制作用,显著延缓果实硬度降低(P<0.05),随着1-MCP含量的增加,抑制作用加强。其中,0.5 μL/L 1-MCP可显著延缓果实贮藏期间(30~105 d)硬度的降低(P<0.05),但冷藏结束时与CK果实的硬度差异不显著(P0.05),将呼吸强度高峰和乙烯释放量高峰的出现推迟了15 d,降低细胞壁降解酶活力并推迟PG、Cx活力高峰的出现,显著抑制原果胶的分解和可溶性果胶的生成(P<0.05);1.0 μL/L和2.0 μL/L 1-MCP均显著延缓果实硬度的降低(P<0.05),其中2.0 μL/L 1-MCP组果实在贮藏期间,硬度一直显著高于其他处理组(P<0.05),1.0 μL/L 1-MCP组果实在第45天后,硬度也显著高于其他处理组(P<0.05),二者均将果实呼吸强度高峰和乙烯释放量高峰推迟了30天,也推迟了PG、PME、Cx、β-葡萄糖苷酶活力高峰出现并显著降低了活性(P<0.05),显著抑制原果胶的分解、可溶性果胶的生成及纤维素含量的降低(P<0.05),并与0.5 μL/L 1-MCP处理组也呈现显著性差异(P<0.05)。张锋等[6]、刘美艳等[31]研究发现1-MCP能抑制“新红星”、“泰山早霞”苹果乙烯释放速率、延缓果实软化;吴小华等[32]认为1.0 μL/L 1-MCP对降低“富士”苹果冷藏期间乙烯释放量和呼吸强度、保持果实硬度等效果要显著好于0.5 μL/L 1-MCP处理结果。本实验中随着剂量的增加,1-MCP抑制果实软化作用加强,说明1-MCP竞争乙烯受体作用增强,使能促进果实软化衰老的乙烯减少。大量研究表明,1-MCP作用效果与处理浓度、处理时间、处理温度密切相关,对于大部分苹果,1-MCP适宜处理含量为1.0 μL/L,过高的含量反而会加剧果实病害[33]。本实验中,可能由于果实采后处理时室温较低而导致1-MCP含量增加,今后应设定果实处理的温度条件,确保实验环境稳定。
另外,许多研究表明,冷藏、气调贮藏、防腐保鲜处理、涂膜处理、辐射、电磁处理、热处理等技术均可使果实细胞壁降解酶活性、呼吸强度等得到有效抑制,起到调控果实软化的作用[34-35]。今后,可将这些技术与1-MCP处理联合使用,以期达到更好地保持“岳帅”苹果果实质地和品质、延长果实贮藏期、降低1-MCP使用量的目的。
在冷藏期间,“岳帅”苹果原果胶、纤维素不断分解,可溶性果胶不断生成,果实硬度下降迅速,出现明显的呼吸高峰和乙烯释放量高峰。除PG外,各细胞壁降解酶活力高峰均出现在呼吸强度和乙烯释放量高峰之后,呼吸强度和乙烯可能是“岳帅”苹果软化的启动因子,是果实软化调控的关键步骤。PG也是“岳帅”苹果贮期软化的关键细胞壁降解酶。
1-MCP处理能够降低“岳帅”苹果的呼吸强度和减少乙烯释放量,推迟了果实细胞壁降解酶活力高峰的出现,延缓果实硬度降低,从而对果实软化起到了明显的抑制作用。其中,1.0 μL/L和2.0 μL/L的1-MCP处理效果更为显著。
参考文献:
[1] 庄军平, 陈维信, 吴振先, 等. 苹果采后软化研究进展[J]. 中国农学通报, 2004, 20(4): 73-77. DOI:10.3969/j.issn.1000-6850.2004.04.025.
[2] WEI J M, MA F W, SHI S G, et al. Changes and the postharvest regulation in the activity and gene expression of enzymes related to cell wall degradation in ripening apple fruit[J]. Postharvest Biology and Technology, 2010, 56(2): 147-154. DOI:10.1016/ j.postharvbio.2009.12.003.
[3] 王建军, 周雅涵, 曾凯芳. 乙烯催熟对采后果实贮藏品质的影响[J]. 食品工业科技, 2012, 33(21): 361-364. DOI:10.13386/ j.issn.1002-0306.2012.21.061.
[4] 李志文, 张平, 刘翔, 等. 1-甲基环丙烯调控采后果蔬质地变化研究进展[J]. 食品安全质量检测学报, 2013, 4(6): 1671-1677.
[5] 赵君. 1-甲基环丙烯在苹果贮藏保鲜上的应用研究进展[J]. 安徽农学通报, 2013, 19(14): 121-122. DOI:10.3969/j.issn.1007-7731.2013.14.066.
[6] 张锋, 张莹莹, 龚新明, 等. 1-MCP延缓采后苹果果实后熟软化的生化机制[J]. 河北农业大学学报, 2011, 34(4): 54-59. DOI:10.3969/ j.issn.1000-1573.2011.04.011.
[7] 张秀美, 刘志, 伊凯, 等. 1-MCP对 岳帅 苹果呼吸速率及果实贮藏品质的影响[J]. 北方园艺, 2011(20): 160-162.
[8] 李宏建, 刘志, 王宏, 等. PG和LOX酶活性变化与岳帅苹果果实软化的关系研究[J]. 西南农业学报, 2014, 27(1): 268-271. DOI:10.16213/ j.cnki.scjas.2014.01.071.
[9] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 84-101.
[10] 程顺昌, 冷俊颖, 任小林, 等. 不同环丙烯类乙烯抑制剂对苹果常温贮藏保鲜效果的影响[J]. 农业工程学报, 2012, 28(6): 269-273. DOI:10.3969/j.issn.1002-6819.2012.06.044.
[11] 王鸿飞, 邵兴锋. 果品蔬菜贮藏与加工实验指导[M]. 北京: 科学出版社, 2012: 54-59.
[12] 索标. 桃果实软化过程中细胞壁多糖降解特性的研究[D]. 扬州: 扬州大学, 2006: 21-22.
[13] 杨力. 乙烯对苹果细胞壁组分降解效应及其机理的研究[D]. 杨凌:西北农林科技大学, 2009: 11-12.
[14] 孙思胜. 1-MCP与采后番木瓜(Carica papaya Linn.)果实成熟软化关系的研究[D]. 海口: 海南大学, 2010: 6.
[15] 张鹏龙, 陈复生, 杨宏顺, 等. 果实成熟软化过程中细胞壁降解研究进展[J]. 食品科技, 2010, 35(11): 62-66. DOI:10.13684/j.cnki. spkj.2010.11.059.
[16] 潘晓倩, 申琳, 生吉萍. 苹果采后软化过程中糖类物质代谢的研究进展[J]. 中国食物与营养, 2011, 17(11): 29-32. DOI:10.3969/ j.issn.1006-9577.2011.11.008.
[17] 罗自生, 寿浩林. NSCC涂膜对黄花梨软化和细胞壁代谢的影响[J]. 果树学报, 2011, 28(1): 143-146. DOI:10.13925/j.cnki. gsxb.2011.01.021.
[18] NG J K, SCHRÖDER R, SUTHERLAND P W, et al. Cell wall structures leading to cultivar differences in softening rates develop early during apple fruit growth[J]. BMC Plant Biology, 2013, 13: 183-200. DOI:10.1186/1471-2229-13-183.
[19] SHARMA S, SHARMA R R, PAL R K, et al. 1-Methylcyclopropene infi uences biochemical attributes and fruit softening enzymes of Santa Rosa Japanese plum (Prunus salicina Lindl.)[J]. Journal of Plant Biochemistry and Biotechnology, 2012, 21(2): 295-299. DOI:10.1007/ s13562-011-0098-6.
[20] 张景娥,郭丹,韩英群,等.采收期对岳帅苹果采后贮藏品质的影响[J].保鲜与加工, 2012, 12(1): 12-15. DOI:10.3969/ j.issn.1009-6221.2012.01.003.
[21] 郭丹, 郝义, 韩英群. 1-MCP处理对 岳帅 苹果货架品质的影响[J].北方园艺, 2011(4): 63-64.
[22] PAYASI A, MISHRA N N, CHAVES A L S, et al. Biochemistry of fruit softening: an overview[J]. Physiology and Molecular Biology Plants, 2009, 15(2): 103-113. DOI:10.1007/s12298-009-0012-z.
[23] KOLNIAK-OSTEK J, WOJDYTO A, MARKOWSKI J, et al. 1-Methylcyclopropene postharvest treatment and their effect on apple quality during long-term storage time[J]. European Food Research and Technology, 2014, 239(4): 603-612. DOI:10.1007/s00217-014-2256-2.
[24] IRELAND H S, GUNASEELAN K, MUDDUMAGE R, et al. Ethylene regulates apple (Malus×domestica) fruit softening through a dose-by-time dependent mechanism and through differential sensitivities and dependencies of cell wall-modifying genes[J]. Plant Cell Physiology, 2014, 55(5): 1005-1016. DOI:10.1093/pcp/pcu034.
[25] 刘超超, 魏景利, 徐玉亭, 等. 苹果3 个早熟品种果实发育后期硬度及其相关生理指标的初步研究[J]. 园艺学报, 2011, 38(1): 133-138. DOI:10.16420/j.issn.0513-353x.2011.01.019.
[26] 刘美艳. 早熟苹果果实软化分子机理的初步研究[D]. 泰安: 山东农业大学, 2012: 34.
[27] BAPAT V A, TRIBEDI P K, GHOSH A, et al. Ripening of fi eshy fruit: molecular insight and the role of ethylene[J]. Biotechnology Advances, 2010, 28(1): 94-107. DOI:10.1016/j.biotechadv.2009.10.002.
[28] 郝晓玲, 王如福, 孙建斌. 1-甲基环丙烯延缓果实衰老的应用研究进展[J]. 保鲜与加工, 2012, 12(2): 46-50.
[29] 张鹏, 陈绍慧, 李江阔, 等. 1-MCP对 磨盘柿 采后成熟软化的调控效应[J]. 果树学报, 2012, 29(3): 409-415. DOI:10.13925/j.cnki. gsxb.2012.03.012.
[30] 马文平, 倪志婧, 任贤, 等. 1-MCP对 玉金香 甜瓜采后果实软化的作用机理[J]. 西北农林科技大学学报(自然科学版), 2012, 40(2): 103-108. DOI:10.13207/j.cnki.jnwafu.2012.02.022.
[31] 刘美艳, 魏景利, 刘金, 等. 泰山早霞 苹果采后1-甲基环丙烯处理对其软化及相关基因表达的影响[J]. 园艺学报, 2012, 39(5): 845-852. DOI:10.16420/j.issn.0513-353x.2012.05.005.
[32] 吴小华, 颉敏华, 王学喜, 等. 不同来源1-MCP处理对冷藏富士苹果保鲜效果的影响[J]. 保鲜与加工, 2015, 15(3): 24-27. DOI:10.3969/ j.issn.1009-6221.2015.03.005.
[33] 朱向秋, 王学军, 魏建梅, 等. 1-甲基环丙烯在果实贮藏保鲜上的应用研究现状与展望[J]. 河北农业科学, 2009, 13(2): 21-23. DOI:10.3969/j.issn.1088-1631.2009.02.009.
[34] 宋晓雪, 胡文忠, 毕阳, 等. 鲜切果蔬软化机理及其调控的研究进展[J]. 食品工业科技, 2013, 34(4): 397-400. DOI:10.13386/ j.issn.1002-0306.2013.04.084.
[35] 张广华, 葛会波, 张进献, 等. 草莓果实软化机理及调控研究进展[J]. 果树学报, 2001, 18(3): 172-177. DOI:10.3969/j.issn.1009-9980.2001.03.012.
Effect of 1-MCP Treatment on Softening and Related Physiological Indices in Yueshuai Apples during Cold Storage
GUO Dan, HAN Yingqun, WEI Xin, WEI Xiao, WANG Baisong, HAO Yi* (Liaoning Institute of Pomology, Yingkou 115009, China)
Abstract:The effect of 1-methylcyclopropene (1-MCP) treatment on softening-related compound contents and enzyme activities in Yueshuai apples during cold storage was investigated, and the regulatory mechanism of 1-MCP treatment on the softening of Yueshuai apples was also explored for the purpose of providing the theoretical basis for the preservation of Yueshuai apples. The apples were stored at (0.0 ± 0.5) ℃ and relative humidity of 90%–95% after pretreatment with 0.0, 0.5, 1.0 and 2.0 μL/L 1-MCP. The fruit fi rmness, respiration intensity, ethylene production rate, cell wall components and related enzyme activities of Yueshuai apples were determined at regular intervals during storage. The peaks of respiration and ethylene production rate appeared after cold storage for 30 days; at the same time, polygalacturonase activity reached its peak. The peaks of pectin methyl esterase, cellulose and β-glucosidase appeared after cold storage for 45 days; the water-soluble pectin content was increased rapidly and protopectin and cellulose content were decreased constantly during the 45 days of storage. Treatment with 0.5 μL/L 1-MCP delayed the peaks of respiration intensity, ethylene production rate, and polygalacturonase (PG) and cellulose (Cx) activity. It signifi cantly inhibited the decline in protopectin and water-soluble pectin contents rather than the decline in fruit fi rmness at the end of cold storage (P < 0.05). In addition, 1.0 and 2.0 μL/L 1-MCP treatment could significantly inhibit respiration intensity, ethylene production rate, the activities of cell wall-degrading enzymes, the contents of pectin and cellulose, and the decline of fruit firmness (P < 0.05). During cold storage, protopectin and cellulose were decomposed continuously, leading to continuous generation of water-soluble pectin and a rapid decline of fruit fi rmness. The activity peak of all cell wall-degrading enzymes expect PG appeared after the peaksof respiration and ethylene production rate. Respiration intensity and ethylene production rate could control the softening of Yueshuai apples. In conclusion, 1-MCP treatment can delay the degradation of cell wall components and suppress the softening of Yueshuai apples by inhibiting respiration intensity, ethylene production rate and fruit softening-related enzyme activities. Meanwhile, the effect of 1.0 and 2.0 μL/L treatment is more signifi cant.
Key words:1-methylcyclopropene treatment; Yueshuai apple; cold storage; softening; physiology
DOI:10.7506/spkx1002-6630-201717043
中图分类号:TS255.3
文献标志码:A
文章编号:1002-6630(2017)17-0266-07引文格式:
收稿日期:2016-08-19
基金项目:辽宁省自然科学基金项目(2015020808);辽宁省果树产业技术体系项目(LNGSCYTX-13/14-9)
作者简介:郭丹(1984—),女,助理研究员,硕士,研究方向为果品贮藏保鲜。E-mail:guodan0407@163.com *通信作者:郝义(1969—),男,研究员,硕士,研究方向为果品贮藏保鲜。E-mail:lnhy7849023@163.com