郭宇欢,何 玲*,齐 馨,王宇婷,郭赛赛,杨晨茜
(西北农林科技大学园艺学院,陕西 杨凌 712100)
摘 要:研究不同臭氧处理方式对离体及接种在活体葡萄上的灰霉菌的抑制作用,为降低采后葡萄贮藏过程中灰霉病带来的损失提供理论依据。在(20±1)℃条件下用不同剂量的臭氧(0、30、60、90 μL/L)对离体灰霉菌分别处理不同时间(5、10、15 min),通过测定菌丝生长长度、孢子形成抑制率、孢子细胞膜完整性及扫描电镜观察来探究臭氧对其抑制效果。用上述4 种剂量的臭氧分别对接种了灰霉菌的‘红地球’葡萄处理15 min后(20 ±1) ℃条件下存放5 d。通过测定发病率、病斑直径及相关酶活性来观察臭氧对葡萄灰霉病的控制效果。结果表明:在离体实验中,与对照相比,不同剂量的臭氧对离体灰霉菌处理不同时间后,灰霉菌菌丝的生长均受到了不同程度抑制,随贮藏时间延长抑制效果逐渐减弱;灰霉菌的产孢子率显著下降,部分孢子的细胞膜完整性被破坏,臭氧剂量越高、处理时间越长,效果越好。在接种了灰霉菌的活体实验中,与对照组相比,用60 μL/L和90 μL/L剂量臭氧处理接种灰霉菌的葡萄果实后,灰霉菌在果实上的生长明显受到抑制;臭氧处理可以使果实丙二醛含量积累减慢,维持较高的抗氧化酶活性。综合分析,臭氧通过抑制灰霉菌菌丝在葡萄果实上的生长和诱导葡萄果实提高抗性来抵抗灰霉菌的侵染,采用90 μL/L剂量臭氧处理15 min对离体条件下和接种在‘红地球’葡萄活体上的灰霉菌抑制效果均为最好。
关键词:臭氧;‘红地球’葡萄;灰霉病;贮藏保鲜
引文格式:
郭宇欢, 何玲, 齐馨, 等. 臭氧对葡萄灰霉病的抑制效果[J]. 食品科学, 2017, 38(17): 273-278. DOI:10.7506/spkx1002-6630-201717044. http://www.spkx.net.cn
GUO Yuhuan, HE Ling, QI Xin, et al. Effect of ozone on controlling gray mold in grapes[J]. Food Science, 2017, 38(17): 273-278. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717044. http://www.spkx.net.cn
葡萄含有丰富的糖、有机酸、蛋白质、矿物质和维生素,具有很高的营养和食疗价值。由于葡萄果实多易受病菌浸染而腐烂变质,在贮藏过程中灰霉病发病严重,这给鲜食葡萄的贮藏、运输、销售等带来困难,造成了很大的经济损失[1]。目前,采用二氧化硫熏蒸结合冷藏仍然是降低葡萄贮藏灰霉病的主要方法,但‘红地球’葡萄对二氧化硫非常敏感,用量稍有不适便会造成伤害,且二氧化硫会在果蔬表面残留,危害人体健康[2-4]。近年来对葡萄保鲜研究偏向于开发无毒、无害绿色环保的保鲜方式,臭氧是一种高效清洁的杀菌剂,可降解果蔬表面农药残留、杀虫剂[5-6],对果蔬发育、成熟、衰老等代谢过程也有影响[7]。大量研究表明采用臭氧处理可以增强果蔬的采后保鲜效果,如葡萄[8-11]、番木瓜[12]、芒果[13]、圣女果[14]等,但关于臭氧对离体灰霉菌及对葡萄活体接种灰霉菌的抑制效果却鲜有报道。本实验旨在探究臭氧处理对离体灰霉菌的抑制作用,对其抑菌机理进行探讨,并在葡萄果实上接种验证,为臭氧处理在葡萄贮藏保鲜中的应用提供理论依据。
1.1 材料与试剂
实验用‘红地球’葡萄于2015年9月23日采于陕西省周至县豆家堡村葡萄园中,挑选大小均匀、无机械损伤、无病虫害果实,采摘当天运回实验室,存于冷库备用。病原菌为灰葡萄孢霉,课题组从西北农林科技大学植物保护学院购买,PDA培养基中4℃冰箱保存。
碘化丙啶、磷酸二氢钠、磷酸氢二钠、次氯酸钠、邻苯二酚、愈创木酚、过氧化氢、柠檬酸、冰醋酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、三氯乙酸、葡萄糖、琼脂、硫代巴比妥酸均为国产分析纯。
1.2 仪器与设备
XM型臭氧发生器 青岛欣美净化设备有限公司;BX51研究级正置荧光显微镜 日本Olympus公司;JSM-6360LV钨灯丝扫描电子显微镜 日本电子株式会社;GT10-1高速台式离心机 北京时代北利离心机有限公司;MIC-800臭氧浓度检测仪 深圳市逸云天电子有限公司;SX-500高压蒸汽灭菌锅 日本TOMY公司;TU-1901紫外-可见分光光度计 北京普析通用仪器公司;LR250恒温生化培养箱 上海轧艮仪器设备有限公司;SW-CJ-2FD型双人单面净化工作台 苏州苏净有限公司;MPC-5V300型冰箱 安徽中科都菱公司。
1.3 方法
1.3.1 孢子悬浮液制备
采用Lachhab等[15]的方法,将课题组保存的灰霉菌在PDA培养基上23 ℃培养7 d后,用含0.05% 吐温-80的无菌水冲洗平板洗下孢子,采用托马计数池计数,调整孢子悬浮液的孢子浓度为1×106个/mL。
1.3.2 样品处理
离体实验:取20 μL菌悬液滴在PDA培养基中心,室温条件下放置4 h后放入消毒特制密闭箱中(80 cm×55 cm×50 cm),在室温(20±1)℃空气湿度为85%的条件下通入臭氧气体,使箱内的臭氧剂量分别达到30、60、90 μL/L时分别处理5、10、15 min,然后在23 ℃培养箱中培养,以不做任何处理作为对照处理,每天测定一组数据。以5 个培养皿为一个处理,每个处理设置3 个重复,整个实验重复2 次。
活体接种实验:果实用2%次氯酸钠浸泡2 min,无菌水漂洗3 次,晾干后剪下15 粒葡萄果实(保留果梗),无菌接种针在葡萄赤道部刺伤(深度3 mm),滴入10 μL的菌悬液,室温条件下(20±1)℃放置在上述特制密闭箱中4 h后,分别用30、60、90 μL/L的臭氧处理15 min,以在密闭箱中不通入臭氧为对照处理。每2 d测定一组数据,第8天时测定其发病率、病斑直径、相关酶活性等指标。每个处理放置15 粒葡萄,设置3 个重复,整个实验重复2 次。
1.3.3 相关指标测定
1.3.3.1 菌丝生长速率和抑制率的测定
菌丝生长速率测定参照Edwards等[16]的方法。
用十字交叉法统计每天灰霉菌的病斑直径,用第4天时病斑直径来计算菌丝生长抑制率。菌丝生长抑制率计算见公式(1)。
1.3.3.2 孢子形成抑制率的测定
参照宋磊[17]的方法。将上述培养5 d后的灰霉菌用直径为0.6 cm的打孔器在培养皿边缘补位取3 个菌碟,无菌水洗下孢子并用托马计数池进行计数,每组处理重复3次,通过公式(2)计算孢子形成抑制率。
1.3.3.3 孢子细胞膜完整性的观察
采用碘化丙啶染色法[18]。用10 μg/mL的碘化丙啶染液对各处理的孢子悬浮液进行染色,在30 ℃环境中固定10 min,再用磷酸盐缓冲液漂洗3 次,在荧光显微镜下观察拍照,取3 个视野,统计暗场下显示红色的孢子数及明场下观察到的孢子总数计算平均值,按照公式(3)计算孢子细胞膜完整性的破坏率。
1.3.3.4 灰霉菌菌丝扫描电子显微镜观察
基于臭氧对灰霉菌孢子的完整性观察,为了进一步研究臭氧对灰霉菌菌丝形态的影响,对灰霉菌菌丝进行扫描电子显微镜观察。用90 μL/L臭氧对灰霉菌处理15 min后,在23 ℃条件下培养7 d形成菌落,取灰霉菌菌丝,参照郭素枝[19]的方法进行制样并观察拍照,以不做臭氧处理为对照,整个实验重复2 次。
1.3.3.5 发病率及病斑直径测定
每2 d统计病斑直径及发病率,病斑直径采用十字交叉法,取平均值;病斑直径若大于0.5 mm则确定为发病。发病率计算见公式(4)。
1.3.3.6 过氧化物酶、多酚氧化酶活力和丙二醛含量的测定
过氧化物酶(peroxidase,POD)活力测定:采用愈创木酚法[20];多酚氧化酶(polyphenol oxidase,PPO)活力测定:采用邻苯二酚比色法[21];丙二醛(malondialdehyde,MDA)含量测定:采用三氯乙酸和硫代巴比妥酸法[22]。
1.4 统计方法
实验数据采用OriginPro 9.0软件整理并进行方差分析,用Duncan s作差异显著性检验(P<0.05)。
2.1 不同臭氧处理对灰霉菌菌丝生长的抑制
从表1可以看出,在前2 d,与对照处理相比,不同剂量臭氧处理显著抑制灰霉菌菌丝生长,抑制效果随着处理时间和剂量的增加而提高。从第3天开始,臭氧处理组之间的差异不显著(P0.05),但臭氧处理与对照处理之间差异显著(P<0.05),表明随时间的延长臭氧处理对灰霉菌菌丝生长的抑制效果会逐渐降低。
表 1 臭氧处理对灰霉菌菌丝生长的抑制
Table 1 Inhibitory effect of ozone on the mycelial growth of Botrytis cinerea

注:同列肩标小写字母不同代表差异性显著(P<0.05)。下同。
2.2 臭氧处理对灰霉菌孢子形成的抑制作用

图 1 臭氧处理对灰霉菌孢子形成的抑制作用
Fig. 1 Inhibitory effect of ozone on the formation of Botrytis cinerea spores
如图1所示,臭氧处理可以抑制灰霉菌孢子的形成,且剂量越高效果越好。当处理时间为5 min时,30、60 μL/L和90μL/L臭氧处理的孢子形成抑制率分别为11.6%、88.3%、93.5%,各处理之间差异显著(P<0.05);处理10 min和15 min时,60 μL/L和90μL/L处理组抑制率均显著高于30 μL/L处理组(P<0.05),但二者之间无显著性差异(P>0.05)。
2.3 臭氧处理对灰霉菌孢子细胞膜完整性的影响


图 2 臭氧处理对灰霉菌孢子细胞膜完整性的影响
Fig. 2 Plasma membrane integrity of Botrytis cinerea after different ozone treatments
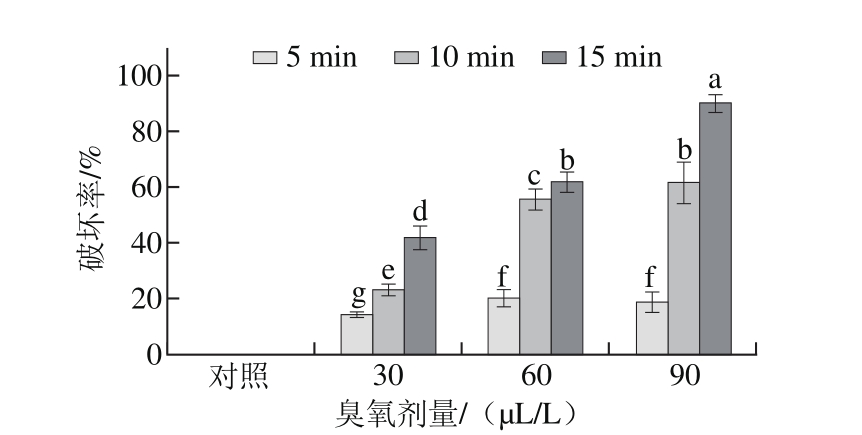
图 3 不同臭氧处理后灰霉孢子细胞膜完整性的破坏率
Fig. 3 Loss rate of the plasma membrane integrity of Botrytis cinerea after ozone treatment
碘化丙啶是一种膜透性荧光染料,它不能穿过完整的活细胞膜,但可以进入细胞膜被破坏的细胞与其DNA结合,而碘化丙啶的最大激发波长为488 nm和630 nm,使细胞膜被破坏的孢子在荧光显微镜的紫外光下显红色。如图2所示,随着臭氧处理剂量增加和处理时间延长,暗场下红色孢子数量随之增多。由图3可知,随着臭氧剂量增加和处理时间延长,臭氧对灰霉菌孢子细胞膜完整性的破坏率不断上升,臭氧剂量为90 μL/L处理15 min时,90%的灰霉菌的孢子被杀死,与对照处理及其他处理组差异显著(P<0.05)。说明臭氧处理会破坏灰霉孢子的细胞膜完整性,且臭氧剂量越高处理时间越长效果越好。
2.4 臭氧处理对灰霉菌菌丝形态的影响
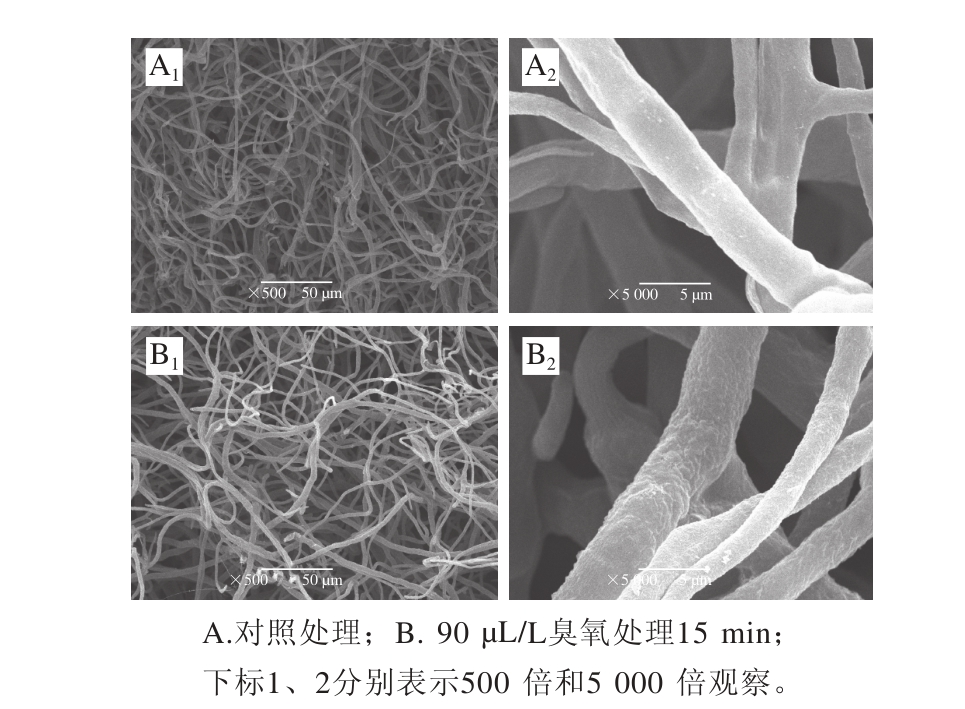
图 4 臭氧对灰霉菌菌丝处理后扫描电子显微镜观察
Fig. 4 Scanning electron microscope observation of Botrytis cinerea mycelia after ozone treatment
如图4A1、B1所示,与对照组相比,经过臭氧处理后,灰霉菌菌丝密度有明显的下降;如图4A2、B2所示,与对照组相比,臭氧处理使灰霉菌菌丝表面出现沟壑。说明臭氧处理对灰霉菌菌丝造成损伤。
2.5 臭氧处理对接种灰霉菌的葡萄发病率及病斑直径的影响
由图5A可知,接种灰霉菌后第2天,60 μL/L和90 μL/L臭氧处理发病率显著低于对照处理(P<0.05),30 μL/L处理与对照差异不显著(P>0.05);从第4天开始,各臭氧处理发病率均显著低于对照处理(P<0.05),其中90 μL/L臭氧处理的效果最好,30 μL/L与60 μL/L臭氧处理差异不显著(P>0.05)。
如图5B所示,接种灰霉菌后第2天,60 μL/L和90 μL/L臭氧处理病斑直径显著小于对照处理(P<0.05),30 μL/L臭氧处理与对照处理相比差异不显著(P>0.05)。90 μL/L臭氧处理效果最好,在第8天时病斑直径仅为9.31 mm,显著低于其他处理(P<0.05)。说明将灰霉菌接种至葡萄果实后,臭氧处理降低了灰霉病发病率和病斑直径。

图 5 不同臭氧处理对‘红地球’葡萄灰霉病发病率(A)和病斑直径(B)的影响
Fig. 5 Effect of different ozone treatments on gray mold incidence (A) and lesion size (B) in Red Globe grapes
2.6 臭氧处理对接种灰霉菌的葡萄中MDA含量的影响
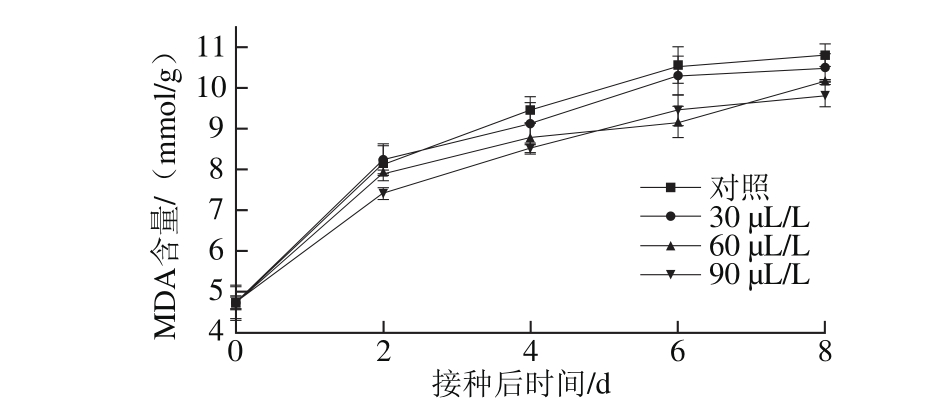
图 6 不同臭氧处理对‘红地球’葡萄果实MDA含量的影响
Fig. 6 Effect of different ozone treatments on MDA content in Red Globe grapes
如图6所示,将灰霉菌接种至葡萄果实后,果实内MDA含量不断上升,这是由于果实受到损伤所致。臭氧处理的MDA含量均低于对照处理,其中第8天90 μL/L臭氧处理MDA含量仅为9.8 mmol/g,显著低于其他处理组(P<0.05),说明臭氧处理可以降低果实内MDA的积累。
2.7 臭氧处理对接种灰霉菌的葡萄中PPO和POD活性的影响
由图7A可知,PPO活力呈现出先升高后降低的趋势,90 μL/L臭氧处理在第4天达到峰值0.68 U/g,显著高于其他处理(P<0.05),而其他处理均在第6天达到峰值。到第8天时,臭氧处理PPO活力显著高于对照处理。
由图7B可知,对照处理与臭氧处理的POD活力先升高后降低,峰值均出现在第4天,60 μL/L和90 μL/L臭氧处理的POD活力在整个过程中显著高于30 μL/L臭氧处理与对照处理(P<0.05)。90 μL/L臭氧处理的POD活力在第6天时达到了0.446 U/g,显著高于其他处理(P<0.05)。
以上结果表明,臭氧处理可以使葡萄果实维持较高的PPO和POD活性,有利于果实抵抗灰霉菌的侵染。

图 7 不同臭氧处理对‘红地球’葡萄果实PPO(A)和POD(B)活性的影响
Fig. 7 Effect of different ozone treatments on PPO (A) and POD (B) activities in Red Globe grapes
研究不同剂量、不同时间的臭氧处理对离体灰霉菌的抑制效果。结果表明,在臭氧处理后第1天,灰霉菌菌丝的生长均受到了明显的抑制,臭氧剂量越高,处理时间越长效果越好,可能是由于臭氧处理降低了菌体生长环境中的氧气含量。碘化丙啶是一种双链DNA染料,其不能透过完整的细胞膜,但可以通过完整性被破坏的细胞膜并以嵌入的方式与双链DNA结合后产生荧光[23]。从碘化丙啶染色的结果可以看出,随着臭氧剂量增加和处理时间延长,失去细胞膜完整性的孢子数量在不断上升,而细胞膜完整性的破坏会使细胞内容物外渗诱导细胞死亡[24-25],使灰霉菌萌发的菌丝数量减少且菌丝的生长受到抑制。从第2天开始,各臭氧处理对灰霉菌菌丝生长的抑制效果逐渐降低,可能是臭氧通过在常温下分解为氧气后,促进了灰霉菌菌丝的生长。与对照相比,臭氧处理灰霉菌孢子产量显著下降,90 μL/L臭氧处理灰霉菌菌丝密度降低,是因为臭氧破坏了部分灰霉菌孢子细胞膜完整性。与王倩[26]用一氧化氮处理灰霉菌的结果相似。
在离体实验中发现臭氧处理15 min对灰霉菌的孢子细胞膜完整性的破坏率最高,因此在活体接种实验中,处理的时间设定为15 min。结果表明,经不同剂量臭氧处理后,灰霉菌孢子的萌发受到抑制,接种灰霉菌的葡萄果实发病率有所降低。
臭氧处理可以诱导植物分泌植保素如白藜芦醇等来抵抗外界真菌的侵染[27]。植物组织中的MDA是膜脂过氧化的产物,细胞受到损伤时会积累MDA。经过臭氧处理的果实中MDA含量均低于对照处理,说明臭氧处理可以降低MDA的积累从而增加果实的抗性。PPO可以氧化为酚醛类物质,同时产生对入侵真菌有很强毒性的有色化合物,如奎宁[28]。POD参与氧化自由基的消除反应,在调控细胞内自由基水平的过程中起到重要作用[29-30]。这两种酶都是植物防御体系中重要的抗氧化酶类。经过臭氧处理的葡萄,PPO和POD活力均高于对照处理,表明臭氧处理可以在一定程度上诱导果实内PPO和POD活力的升高,有利于葡萄在长期贮藏过程中抵抗灰霉菌的侵染。其中效果最好的是90 μL/L臭氧处理,与杨娟侠[31]用二氧化氯对甜樱桃保鲜的结果相似。在第8天时,灰霉菌在果实上的生长仍受抑制,而离体实验中,第4天臭氧对灰霉菌的抑制率最高仅为2.5%,可能是臭氧对灰霉菌菌丝生长的抑制作用与果实自身的防御机制协同作用所致,且臭氧处理主要是通过诱导果实产生抗性来抵抗灰霉菌的侵染。间隔进行臭氧处理是否可以提高抑制效果还有待进一步的研究。
臭氧处理能够抑制离体灰霉菌菌丝的生长,抑制效果逐渐降低。臭氧处理可以破坏部分灰霉菌孢子的细胞膜完整性,抑制孢子的形成并对灰霉菌菌丝造成损伤。对离体灰霉菌效果最好的处理是用90 μL/L臭氧处理15 min。
臭氧处理降低了接种了灰霉菌的葡萄的发病率和病斑直径,降低了果实MDA含量的积累,维持了较高的PPO和POD活性,提高了葡萄在贮藏过程中抵抗灰霉菌侵染的能力,效果最好的处理是90 μL/L臭氧处理15 min。
参考文献:
[1] 刘亚平. 采前喷布壳聚糖处理和采后适度失水处理对红地球葡萄保鲜效应研究[D]. 杨凌: 西北农林科技大学, 2012: 1-2.
[2] 安红梅, 关文强, 刘兴华. 红地球葡萄贮藏效果预测因子初探[J]. 中国农学通报, 2007, 23(9): 176-180. DOI:10.3969/ j.issn.1000-6850.2007.09.040.
[3] 赵飞, 张平, 朱志强, 等. SO2气态熏蒸结合固态缓释保鲜剂处理对红地球葡萄贮藏品质的影响[J]. 食品与发酵工业, 2013, 39(12): 182-186.
[4] 高海燕, 刘邻渭. 葡萄采后贮运SO2伤害的研究进展[J]. 食品与发酵工业, 2005, 31(5): 153-157. DOI:10.3321/j.issn:0253-990X.2005.05.038.
[5] ONG K C, CASH J N, ZABIK M J, et al. Chlorine and ozone washes for pesticide removed from apples and processed apple sauce[J]. Food Chemistry, 1996, 5(2): 153-160. DOI:10.1016/0308-8146(95)00097-6.
[6] 王秋芳, 乔勇进, 陈召亮, 等. 臭氧处理对巨峰葡萄品质与生理生化的影响[J]. 果树学报, 2010(1): 63-68.
[7] 黎继烈, 彭湘莲, 钟海雁, 等. 臭氧保鲜处理对金橘采后生理的影响[J]. 中国食品学报, 2007, 7(3): 112-115. DOI:10.3969/ j.issn.1009-7848.2007.03.020.
[8] 武杰, 朱飞. 臭氧处理对不同成熟度葡萄保鲜效果[J]. 食品工业科技, 2012, 33(17): 359-362.
[9] PALOU L, CRISOSTO C H, SMILANICK J L, et al. Effects of continuous 0.3 ppm ozone exposure on decay development and physiological responses of peaches and table grapes in cold storage[J]. Postharvest Biology and Technology, 2002, 24: 39-48. DOI:10.1016/ S0925-5214(01)00118-1.
[10] LAUREANO J, GIACOSA S, SEGADE S R, et al. Effects of continuous exposure to ozone gas and electrolyzed water on the skin hardness of table and wine grape varieties[J]. Journal of Texture Studies, 2016, 47(1): 40-48. DOI:10.1111/jtxs.12158.
[11] MARTÍNEZ-LÜSCHER J, SÁNCHEZ-DÍAZ M, DELROT S, et al. Ultraviolet-B alleviates the uncoupling effect of elevated CO2and increased temperature on grape berry (Vitis vinifera cv. Tempranillo) anthocyanin and sugar accumulation[J]. Australian Journal of Grape and Wine Research, 2016, 22(1): 87-95. DOI:10.1111/ajgw.12213.
[12] ONG M K, ALI A. Antifungal action of ozone against Colletotrichum gloeosporioides and control of papaya anthracnose[J]. Postharvest Biology and Technology, 2015, 100: 113-119. DOI:10.1016/ j.postharvbio.2014.09.023.
[13] 滕建文, 曾文谨, 霍峰岩, 等. 芒果的臭氧保鲜研究[J]. 食品科技, 2008, 29(8): 233-235. DOI:10.3969/j.issn.1005-9989.2008.08.069.
[14] 田华, 韩慢慢, 陈乐玲. 圣女果保鲜技术研究进展[J]. 食品工业科技, 2016, 37(7): 396-400. DOI:10.13386/j.issn1002-0306.2016.07.068.
[15] LACHHAB N, SANZANI S M, BAHOUAOUI M A, et al. Effect of some protein hydrolysates against gray mould of table and wine grapes[J]. European Journal of Plant Pathology, 2016, 144: 821-830. DOI 10.1007/s10658-015-0749-x.
[16] EDWARDS S G, SEDDON B. Mode of antagonism of Brevibacillus brevis against Botrytis cinerea in vitro[J]. Journal of Applied Microbiology, 2001, 9: 652-659. DOI:10.1046/j.1365-2672.2001.01430.x.
[17] 宋磊. BIT对灰霉菌的抑制作用及机理[D]. 西安: 西北大学, 2010: 24-25.
[18] ZHANG Z Q, QIN G Z, LI B Q, et al. Effect of cinnamic acid for controlling gray mold on table grape and its possible mechanisms of action[J]. Current Microbiology, 2015, 71: 396-402. DOI:10.1007/ s00284-015-0863-1.
[19] 郭素枝. 扫描电镜技术及其应用[M]. 厦门: 厦门大学出版社, 2006: 74-96.
[20] 陈建勋, 王晓峰. 植物生理学实验[M]. 广州: 华南理工大学出版社, 2006: 74.
[21] 孙群, 胡景江. 植物生理学研究技术[M]. 杨凌: 西北农林科技大学出版社, 2006: 172-174.
[22] 曹健康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 154-156.
[23] 胡梦裳, 张云艳, 万建美, 等. 不同浓度的碘化丙啶染色对细胞周期分布的影响[J]. 激光杂志, 2015, 36(1): 144-147. DOI:10.14016/ j.cnki.jgzz.2015.01.144.
[24] MANN C L, CIDLOWSKI J A. Glucocorticoids regulate plasma membrane potential during rat thymocyte apoptosis in vivo and in vitro[J]. Endocrinology, 2001, 142: 421-429.
[25] QIN G Z, ZONG Y Y, CHEN Q L, et al. Inhibitory effect of boron against Botrytis cinerea on table grapes and its possible mechanisms of action[J]. International Journal of Food Microbiology 2010, 138: 145-150.
[26] 王倩. 一氧化氮对采后病原真菌Botrytis cinerea的生长发育影响及机制研究[D]. 合肥: 安徽农业大学, 2013: 18-22.
[27] SARIG, P, ZAHAVI T, ZUTKHI Y, et al. Ozone for control of postharvest decay of table grapes caused by Rhizopus stolonifer[J]. Physiological and Molecular Plant Pathology, 1996, 48: 403-415.
[28] CAMPOS-VARGAS R, SALTVEIT M E. Involvement of putative chemical wound signals in the induction of phenolic metabolism in wounded lettuce[J]. Plant Physiology, 2002, 114: 73-84. DOI:10.1034/ j.1399-3054.2002.1140111.x.
[29] NYOCHEMBENG L M, BEYL C A, PACUMBABA R P. Peroxidase activity, Isozyme patterns and electrolyte leakage in roots of cocoyam infected with Pythium myriotylum[J]. Journal of Phytopathology, 2007, 155: 454-461. DOI:10.1111/j.1439-0434.2007.01257.x.
[30] LACAN D, BACCOU J. High levels of antioxidant enzymes correlate with delayed senescence in nonnetted muskmelon fruits[J]. Planta, 1998, 204: 377-382. DOI:10.1007/s004250050269.
[31] 杨娟侠. 二氧化氯对甜樱桃 红灯 和 布鲁克斯 贮藏保鲜效果研究[D].泰安: 山东农业大学, 2011: 25-26.
Effect of Ozone on Controlling Gray Mold in Grapes
GUO Yuhuan, HE Ling*, QI Xin, WANG Yuting, GUO Saisai, YANG Chenxi
(College of Horticulture, Northwest A & F University, Yangling 712100, China)
Abstract:The aim of this study is to provide theoretical support for reducing the loss of grapes caused by Botrytis cinerea during storage. Botrytis cinerea was exposed to ozone at different concentrations (0, 30, 60 and 90 μL/L) for different times (5, 10 and 15 min), and then stored at (20 ± 1) ℃. The mycelial diameter, the formation of Botrytis cinerea spores and plasma membrane integrity were analyzed to explore the inhibitory effect of ozone on Botrytis cinerea. In a second experiment, postharvest Red Globe grapes were inoculated with Botrytis cinerea and exposed to four different concentrations of ozone for 15 min, and then stored at (20 ± 1) ℃ for 5 days. The incidence, lesion size and related enzymes activities were measured to evaluate the inhibitory effect of ozone on controlling gray mold in postharvest grapes. The results indicated that compared with the control group, the growth of Botrytis cinerea was inhibited by ozone but the effect decreased gradually over storage time. Ozone could concentration-dependently and time-dependently damage the integrity of the plasma membrane of Botrytis cinerea and reduce conidia germination. On the other hand, the growth of Botrytis cinerea in grapes was strongly inhibited by ozone at concentrations of 60 and 90 μL/L. Meanwhile, ozone could inhibit the accumulation of malondialdehyde (MDA) content and help maintain higher levels of antioxidant enzyme activities. Taken together, this study suggested that ozone was effective against gray mold in postharvest Red Globe grapes by inhibiting the growth of the pathogen and inducing host resistance and the best effect was observed at a concentration of 90 μL/L and 15 min treatment.
Key words:ozone; Red Globe grapes; gray mold; storage and preservation
DOI:10.7506/spkx1002-6630-201717044
中图分类号:S663.4
文献标志码:A
文章编号:1002-6630(2017)17-0273-06
收稿日期:2016-07-04
基金项目:杨凌示范区科技计划项目(2014NY-44)
作者简介:郭宇欢(1991—),男,硕士研究生,研究方向为园艺产品采后生理与贮藏保鲜。E-mail:mmmdddpo@sohu.com *通信作者:何玲(1965—),女,副教授,博士,研究方向为果蔬加工及园艺产品采后贮藏保鲜。E-mail:heliurui@nwsuaf.edu.cn