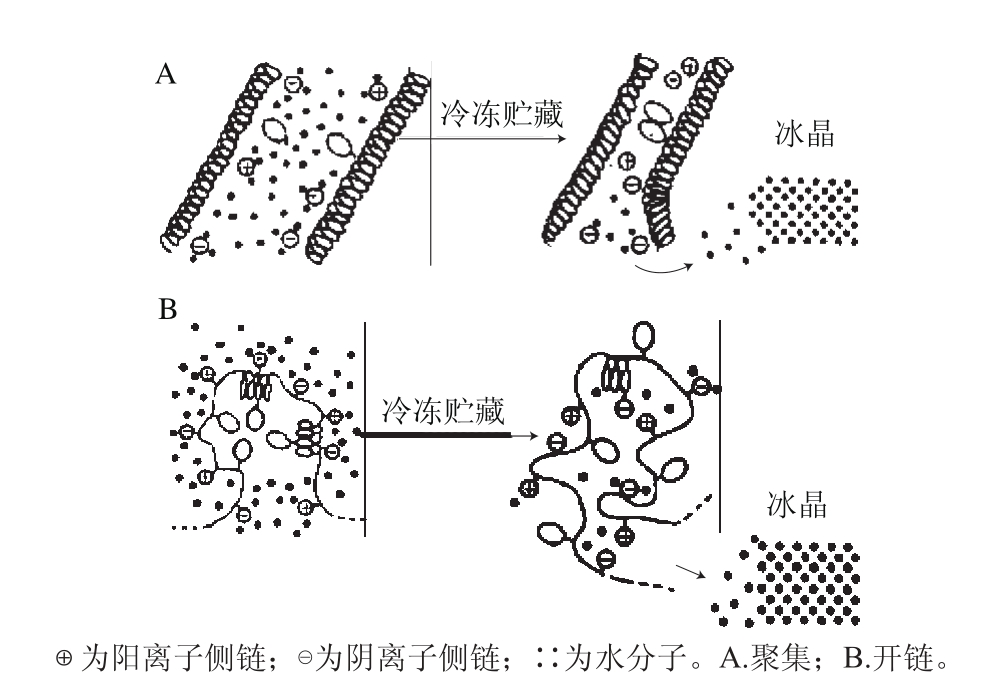
图 1 蛋白质冷冻变性模型[28]
Fig. 1 Model illustrating the mechanism of protein denaturation in frozen fi sh[28]
朱文慧,宦海珍,步 营,李学鹏,仪淑敏,励建荣*
(渤海大学食品科学与工程学院,辽宁省高校重大科技平台“食品贮藏加工及质量安全控制工程技术研究中心”,辽宁 锦州 121013)
摘 要:鱿鱼是我国重要的远洋渔业捕捞对象,捕捞后需要及时进行船上冻结,因此,冷冻鱿鱼是各类鱿鱼制品生产的主要原料。低温贮藏尤其是冻藏是目前广泛 应用的一种保鲜方法,冷冻水产品在加工前必须进行解冻,鱿鱼在低温贮藏和解冻过程中会发生汁液流失,影响其营养价值,导致品质劣变。冷冻水产品最终品质的好坏不仅取决于冷冻方法、冻藏温度、温度波动,还和后续的解冻方式有关。本文综述了鱿鱼在低温贮藏和解冻过程中 发生的物理化学变化,主要从水分含量、蛋白质变性及氧化、脂质氧化、色泽、pH值和微生物组成及特定腐败菌等几个方面进行了阐述,旨在为水产加工企业在鱿鱼保鲜加工方面提供理论参考。
关键词:鱿鱼;低温贮藏;解冻;品质;劣变
朱文慧, 宦海珍, 步营, 等. 低温贮藏和解冻过程对鱿鱼品质的影响研究进展[J]. 食品科学, 2017, 38(17): 279-285. DOI:10.7506/spkx1002-6630-201717045. http://www.spkx.net.cn
ZHU Wenhui, HUAN Haizhen, BU Ying, et al. Progress in the effects of low-temperature storage and thawing on squid quality[J]. Food Science, 2017, 38(17): 279-285. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717045. http://www.spkx.net.cn
鱿鱼属软体动物门头足纲,是乌贼类的一种,常见的鱿鱼主要有枪乌贼科和柔鱼科2 种科目。《2016中国渔业统计年鉴》统计数据显示我国鱿鱼捕获量为38.01万 t,占世界鱿鱼捕获量的36%左右,是我国重要的远洋渔业捕捞对象。鱿鱼产量巨大,是一种可供开发和工业化生产的重要经济水产动物。从营养学角度来看,鱿鱼是一种高蛋白、低脂肪的水产种类,富含钙、磷、铁、牛磺酸等[1]。鱿鱼可食部分达80%以上,比一般鱼类高出20%左右,是良好的水产加工原料。鱿鱼捕捞后需要及时进行船上冻结,因此,冷冻鱿鱼是各类鱿鱼制品生产的主要原料。
低温贮藏尤其是冻藏是目前广泛应用的一种保鲜方法,冷冻水产品在加工前必须要进行解冻,然而在低温贮藏和解冻过程中,鱼肉均不可避免地发生品质劣变(如蛋白质变性、脂肪氧化、色泽劣变、质构劣变、风味下降等)[2-3],鱼肉蛋白质的冷冻变性问题一直是水产品质量的研究重点[4-5]。水产品原料的品质对水产品的加工品质有重要影响,是水产品加工企业重点控制的对象。冷冻水产品最终品质的好坏不仅取决于冷冻方法、冻藏温度、温度波动,还和后续的解冻方法有关[6],鱿鱼的胴体组织结构独特,与鱼、畜禽肉等一般可食性的肉类结构差别很大[7],因此,了解低温贮藏和解冻过程对冷冻鱿鱼原料品质的影响对水产加工企业是很有必要的。本论文综述了国内外学者有关低温贮藏和解冻过程对鱿鱼品质影响的研究,旨在为水产加工企业对鱿鱼保鲜加工提供理论参考。
食品低温贮藏是利用低温技术将食品温度降低,并维持在低温状态以阻止食品腐败变质,延长食品保质期[8]。根据贮藏温度及货架期,可将低温贮藏大致分为3 类:冷藏、冰温和冷冻(即速冻、冻藏)。冻结的食品原料在加工前必须经过解冻处理,解冻是一个复杂的相变传热传质过程,不同的解冻方式对解冻产品品质的影响差异显著[9]。目前主要的解冻方式有空气解冻、水解冻、电解冻(低频、高频、微波、高静压电场)以及一些新型解冻方式如射频解冻、高压脉冲解冻等。
1.1 水分含量
鱿鱼水分含量约为76.2%~80.0%(本实验室测得秘鲁鱿鱼含水量为78%左右),一旦被冻结,形成的冰晶就会损伤肌纤维,从而影响肌蛋白的持水能力。低温贮藏和解冻能够改变鱿鱼肌肉中的水分分布状态,致使肌肉组织形成“滴水通道”,从而使冻藏和解冻过程复杂化[10-11]。随着水分冻结结晶,蛋白质、碳水化合物、脂肪、维生素和微量元素等可溶性物质的浓度增加,肌肉体系的平衡被打破[12],而肌纤维直接环境的改变影响了细胞膜的特征,反过来影响肉类的品质[13]。水分作为鱿鱼的品质特性可以从几方面评价,包括滴水损失、解冻损失、蒸煮损失、持水力(water holding capacity,WHC)和总水分含量。然而,由于测定鱿鱼水分损失和变化的这些方法没有可以参照的国际标准,所以很难对采用不同方法测定水分损失的这些文献研究进行直接比较和得出结论[14]。
低温贮藏和解冻方式影响肌肉汁液损失量(解冻损失和滴水损失),汁液损失部分是由于冰晶破坏了肌肉细胞膜,同时肌肉组织的收缩在一定程度上也造成了汁液损失[15]。在-18 ℃冻藏条件下,鱿鱼冻藏1~30 d过程中,随着冻藏时间的延长,冰晶增长,汁液损失量显著增加[16]。García-Sánchez等[17]研究发现,-20 ℃冻藏30 d鱿鱼的含水量显著低于在同等温度下冻藏1 d的,表明冻藏时间对鱿鱼的含水量具有显著影响,并指出该水分损失可能与持水率略微下降有关。路钰希等[18]研究了在-10、-20、-30、-40 ℃冻藏过程中鱿鱼失水率的变化,结果发现各冻藏温度下鱿鱼的失水率与冻藏时间有良好的相关性(R=0.989),随着冻藏时间的延长,4 组冷冻温度条件下的失水率均呈上升的趋势,相同冻藏时间内,温度越低,失水率越低。冻藏过程中,蛋白质二级结构的有序性明显降低,蛋白质发生变性和聚集,持水性能下降。蛋白质变性程度取决于冰晶的大小,大冰晶的形成可使蛋白质高度变性,肌肉持水力降低。冻藏温度越低,产品中心温度下降越快,-10 ℃和-20 ℃条件下冻藏,鱿鱼水分趋向于形成大冰晶,-30 ℃和-40 ℃条件下冻藏,鱿鱼水分趋向于形成小冰晶,因此,冻藏温度越低,失水率越小,持水性越强。然而,Ueng等[19]研究发现,在-20 ℃冻藏条件下,阿根廷鱿鱼贮藏4 个月过程中汁液损失量基本没有变化,压榨损失量远远高于自由汁液损失量。Dublán-García等[20]研究发现,4 ℃条件下秘鲁鱿鱼胴体肌肉的持水力随着贮藏时间的延长而增加,这可能是因为极性基团的释放使蛋白多肽键-水的相互作用增强,增加了蛋白质分子之间的斥力作用,从而使蛋白质的溶解性增加。
关于解冻对肉品质的影响,目前主要的分歧是解冻速率和汁液损失量的相关性[14],部分学者认为快速解冻使汁液没有充足的时间重新进入细胞中,从而产生大量汁液流失;另有学者则认为快速解冻可以降低汁液损失量。Gonzalez-Sanguinetti等[21]和Haugland等[22]实验后均提出缩短解冻时间(提高解冻速率)可降低汁液损失量的观点。冻融循环处理可导致细胞结构破坏,肌原纤维横向收缩使肌肉的持水性下降,随着冻融次数的增加,鱿鱼解冻损失和蒸煮损失均显著增加(P<0.05);反复冻融7次后,鱿鱼的解冻损失和蒸煮损失分别从冻融前的3.34%和5.18%增加至12.83%和15.38%[23]。
目前的研究认为,低温贮藏和解冻过程使肌肉的持水力下降主要是由水产品经过冻结与冻藏后,其蛋白质变性程度增大所引起的,而蛋白质变性程度的大小主要是与冻结及冻藏过程中形成冰晶的分布及大小有关[24]。
1.2 蛋白质变性及氧化
冷冻及冻藏过程会导致鱼肉蛋白质变性,多数研究认为这与冻结过程形成的冰晶大小及冻藏过程中冰晶的变化密切相关[25-27]。鱼肉蛋白质在冻藏过程中发生2 种变性,一是蛋白质分子的聚集,二是蛋白质多肽链的展开(图1)[28]。目前关于蛋白质冷冻变性的机理比较有说服力的有3 种:1)结合水的分离学说,即蛋白质中的部分结合水被冻结,使蛋白质大分子在冰晶的挤压作用下靠拢、聚集,导致蛋白质变性,其中具有α-螺旋结构的蛋白质在冻藏过程中易发生聚集变性;2)细胞液浓缩学说,即冻结时细胞内未冻结的那部分细胞液,由于冰晶的析出而被浓缩,导致细胞液离子浓度上升,pH值发生变化,引起蛋白质变性;3)水和水合水的相互作用引起蛋白质变性的水化作用学说,即冰晶的生成引起结合水和蛋白质结合状态的改变,使蛋白质分子内部结构发生变化,从而使蛋白质变性[29-30]。据目前文献报道,低温贮藏期间鱿鱼蛋白质物理化学性质的变 化及由此引起的蛋白质变性,主要集中在肌原纤维蛋白质空间结构、溶解性、Ca2+-ATPase活性、巯基和二硫键含量及表面疏水性变化等方面。

图 1 蛋白质冷冻变性模型[28]
Fig. 1 Model illustrating the mechanism of protein denaturation in frozen fi sh[28]
鱿鱼肌原纤维蛋白与其他鱼和哺乳动物的不同,它更易溶于水、不易冻结且更容易发生热变性[31]。从十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析结果发现,冻藏期间,秘鲁鱿鱼的肌原纤维蛋白模式(包括剪切力和差示扫描量热数据)发生改变,说明秘鲁鱿鱼在冻藏期间蛋白质片段发生了部分变性[32]。4 ℃条件下贮藏8 d后,秘鲁鱿鱼胴体肌肉的剪切力极显著降低(P<0.001)[20]。秘鲁鱿鱼胴体在不同温度条件下贮藏期间,肌肉纤维发生了不同的变化,在0 ℃冷藏条件下,鱿鱼的肌肉纤维发生降解,在-20 ℃冷藏条件下,鱿鱼的肌肉纤维发生聚集且在组织结构中形成圆形/球形的“孔洞”[33],但这些孔洞的形成是否和解冻汁液流失有关需要进一步研究。
冻藏温度对鱿鱼头足类肌肉的蛋白溶解性影响不显著[34],-30 ℃冻藏过程中阿根廷鱿鱼蛋白质的溶解性未发生明显变化(P>0.05)[35],-20 ℃条件下冻藏1 个月后,鱿鱼可溶性蛋白质含量及蛋白质功能特性均未发生变化[36]。García-Sánchez等[17]将碾碎的鱿鱼和整个鱿鱼样品在-30 ℃冻藏条件下存放1 d和30 d,差示扫描量热法实验结果未发现蛋白质发生任何变性,说明鱿鱼蛋白质具有较高的稳定性。在0 ℃条件下贮藏的第4天,秘鲁鱿鱼胴体蛋白质溶解性显著降低(P<0.05),然而在整个贮藏期间,蛋白质溶解性未发生显著变化[37]。Paredi等[38]研究发现,鱿鱼在-30 ℃条件下贮藏1 个月后,蛋白质的溶解性降低,肌球蛋白重链的相对百分比显著降低(P<0.05),副肌球蛋白含量显著增加(P<0.05),证实了在贮藏期间肌动球蛋白发生了变性。另有研究发现秘鲁鱿鱼在0 ℃条件下长期贮藏 可使蛋白质的溶解度增加40%[33],这可能是贮藏过程中肌原纤维蛋白降解产生的低分子质量蛋白质更易溶于水造成的。
冻藏引起鱼肉肌动球蛋白(主要是肌球蛋白)的打开与伸展,暴露的非极性氨基酸和邻近的类似基团引起了蛋白质的疏水相互作用,从而导致了蛋白质的变性[39]。通过鱿鱼钓机捕捞的阿根廷鱿鱼在-30 ℃条件下冻藏8 个月后,蛋白质的表面疏水性显著性增加(P<0.05),而通过拖网捕捞 的阿根廷鱿鱼冻藏3~5 个月期间,其蛋白质的表面疏水性先增加随后趋于稳定[35]。
Ca2+-ATPase活性被广泛用于监测肌球蛋白的状态,研究发现鱿鱼在-30 ℃条件下贮藏5 个月后,Ca2+-ATPase活性降低了50%以上,这证明在冻藏期间鱿鱼的肌球蛋白发生了变性[38]。在-30 ℃条件下贮藏3个月,鱿鱼肌球蛋白的Mg2+-ATPase活性降低约60%(P<0.01),且肌球蛋白生化特性的降低和鱿鱼的性成熟阶段没有关系[40]。
巯基是蛋白质中的重要功能基团,可以通过巯基含量判断冻藏过程中蛋白质的变性程度[41]。在冻藏过程中因巯基氧化形成的二硫键会导致肌球蛋白重链的聚合,从而降低其盐溶性。在-10、-20、-30、-40 ℃冻藏条件下,随着冻藏时间的延长,活性巯基含量呈显著下降趋势;相同贮藏时间不同贮藏温度条件下,鱿鱼的巯基含量差异显著(P<0.05),特别是15 d后,-30 ℃和-40 ℃冻藏条件下鱿鱼巯基含量显著高于其他两组(P<0.05)[18]。经反复冻融处理后,鱿鱼的蛋白质羰基含量和表面疏水性增加,总巯基含量下降,蛋白出现一定程度的聚集,说明反复冻融可促进蛋白质氧化,从而导致鱿鱼肌肉品质的下降[23]。然而Seidler等[41]研究却发现随着冻藏(-28 ℃)时间的延长,阿根廷鱿鱼的巯基含量呈上升趋势。
在冻藏和解冻过程中,蛋白质很容易发生氧化,且是一个持续的过程[42]。已有文献报道蛋白质氧化会降低蛋白质的溶解度和凝胶性,影响水产品肌肉中水分的分布,从而造成冻藏和解冻期间水产品品质劣变[43-44]。国内外关于鱿鱼在冻藏和解冻过程中针对蛋白质氧化更深入细致的报道很少,如水分含量的变化是否对机体内部的酶产生影响从而导致蛋白质氧化尚未可知。有研究发现,冻藏期间潜在的脂质损伤效应对蛋白质变性的影响主要和游离脂肪酸的产生有关[26,45]。
1.3 脂质氧化
肌肉冻结和贮藏的最终温度决定了未被冻结水的量。Petrović[46]研究发现温度高于-20 ℃时肌肉的生化反应仍在进行,因为在此温度条件下仍有充足未被冻结的水保证生化反应的进行。肉冻藏的最佳温度为-40 ℃,因为在此温度下仅有很小部分的水未被冻结[47]。冻结的水会引起细胞内外可溶性物质的浓度增加,从而导致冻藏阶段化学反应的加剧[48]。
未被冻结水的量是肉冻藏期间发生最初的脂质氧化的重要因素,也会导致解冻期间的二次脂质氧化反应[49]。脂质氧化的程度可以通过过氧化物值(peroxide value,PV)来反映;硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)涵盖了大部分脂质氧化产生的醛酮类物质,因此,TBARS是衡量次级脂质氧化程度的重要指标。Atayeter等[50]研究了-20、-40、-80 ℃冻藏条件下鱿鱼的脂质氧化情况,结果证明鱿鱼的PV和TBARS值随着贮藏时间的延长而增加,且贮藏温度越高,PV和TBARS值越大。鱿鱼的TBARS以丙二醛(mmalonaldehyde,MDA)计,初始值在0.07 mg MDA/kg左右,在-10、-20、-30、-40 ℃冻藏条件下,分别于贮藏的第70、105、140、210测定TBARS值为0.42、0.20、0.19、0.10 mg MDA/kg,鱿鱼在-10 ℃条件下贮藏70 d后的TBARS增加量极显著高于其他3组(P<0.01)[18]。鱿鱼脂肪含量较低,因此在冻藏过程中TBARS值低于一般水产品。冻藏过程中,冰晶的形成使得磷脂质膜的细胞结构遭到破坏,磷脂质减少,释放出促氧化剂使得底物和酶之间直接接触[51]。
1.4 色泽
肌红蛋白是影响鱼肉色泽最主要的色素成分,已有文献报道,在低温贮藏和解冻期间,肌红蛋白会发生氧化变性,从而影响鱼肉的色泽及品质[52]。研究表明,脂肪氧化与肌红蛋白氧化具有相互促进的作用,脂肪氧化可促进高铁肌红蛋白的形成,从而导致鱼肉色泽的变化[14]。因此,在冻藏过程中,肌红蛋白的氧化速率随着脂质氧化速率的增加而增加[53]。
Lapaguimaraes等[54]研究发现,在冻藏条件下鱿鱼皮红色(a*)和黄色(b*)随着贮藏时间的延长而加深,未用冰处理的鱿鱼肌肉a*和b*值明显高于用冰处理的,实验结果证明感官和色泽分析具有高度相关性。Sungsri-In等[55]研究发现在冻藏条件下,去皮鱿鱼的a*值基本无变化,未去皮鱿鱼a*值随贮藏时间延长呈上升趋势,去皮和未去皮鱿鱼的b*值都随贮藏时间延长而增加。与此同时还发现鱿鱼皮色素细胞发生显著破坏,这种破坏随着贮藏时间的延长而加剧,并提出利用安全的抗菌剂和充足的冰可以延缓冰藏期间鱿鱼粉红霉变的发生和维持鱿鱼的品质。沈萍等[56]研究发现,在冷藏(0 ℃)条件下,a*值无显著变化,L*值和b*值均呈现增加的趋势,并指出b*值的增加是由褐变反应所致。Ramirez-Suarez等[57]报道显示,冻藏条件下鱿鱼的L*值无太大变化。
1.5 pH值
pH值是衡量水产动物宰后品质变化的重要指标[58],亦是衡量肌肉蛋白质功能性的一项重要指标。pH值的变化依赖于很多因素,包括贮藏时间、贮藏温度和动物体本身的生理状态[59]。
通常认为,肉在冻结和解冻后产生的汁液损失会导致蛋白质变性,释放的H+使pH值降低[60]。鱿鱼的初始pH值为6.58,在冷藏条件下随着贮藏时间的延长,挥发性碱(总挥发碱、三甲胺和氨)的含量增加,使鱿鱼的pH值显著增加(P<0.05)[55]。在-20、-40、-80 ℃冻藏条件下鱿鱼胴体和触须的pH值显著增加,且温度越低,pH值增加的幅度越大[49]。Jeyasekaran等[61]研究发现,利用干冰和冰水混合物贮藏鱿鱼筒一段时间后,pH值呈上升趋势。Dublán-García等[20]研究发现,4 ℃条件下秘鲁鱿鱼胴体肌肉的pH值随着贮藏时间的延长而增加。
然而,路钰希等[18]研究发现,不同贮藏温度(-10、-20、-30、-40 ℃)下鱿鱼pH值一直保持在6.4~7.0之间,pH值变化与冻藏时间和冻藏温度没有显著相关性,其原因可能是鱿鱼在低于-10 ℃的贮藏条件下,胴体肌球蛋白ATP酶和微生物的活性降低,不能分解蛋白质产生氨类物质来中和H+,导致pH值变化不明显。Prafulla等[62]发现秘鲁鱿鱼在0 ℃条件下贮藏15 d,其胴体pH值也未发生明显变化,实验结果证明秘鲁鱿鱼胴体肌肉呈现出和陆生动物及其他水产品不同的死后僵直期[57]。
1.6 微生物组成及特定腐败菌
水产品所含的细菌主要来源于水中,大多数为需氧型细菌。它们的初始菌相受水产品品种和外界环境等影响,其中水产品栖息水域的温度和盐度是影响菌相组成的主要因素[63-64]。来源于寒带、温带干净水域的水产品主要携带的是革兰氏阴性嗜冷菌,包括一些好氧菌及兼性厌氧菌;而热带水域菌群与温带水域相似,但水产品嗜温菌比例较高[65]。有氧冷藏温、热带水域淡水鱼的特定腐败菌(specific spoilage organism,SSOs)为假单胞菌属(Pseudomonas sp.),有氧冻藏海水鱼的SSOs为腐败希瓦氏菌(Shewanella putrefacens)[66]。水产品在深度冻藏条件下,易受冷冻影响的生物体不断死亡或受伤,细菌的存活数大幅下降,随后下降速率逐渐减缓[67]。冻结的鱿鱼在-18 ℃条件下贮藏时,微生物一般不易生长繁殖,但是鱿鱼如果在冷藏前已被细菌或霉菌污染,或者在条件不好的情况下冷藏就会出现细菌或霉菌。
在有氧冷藏中,水产品最常见的SSOs为假单胞菌与腐败希瓦氏菌。沈萍等[56]在0~15 ℃条件下贮藏鱿鱼,只发现假单胞菌这一种优势腐败菌。冻藏条件下贮藏16 d,去皮和未去皮鱿鱼中嗜冷细菌的数量均显著增加(P<0.05),而到16 d后便不再增加[55]。新鲜鱿鱼的细菌种类包括哈夫尼菌属、假单胞菌菌属、芽孢杆菌属、黄杆菌属和产碱菌属,其中哈夫尼菌属数量占总菌落数的74%[61]。Jeyasekaran等[61]研究发现,利用干冰和50%冰水包装鱿鱼的优势菌均为产碱杆菌属(Alcaligenes),分别占总菌落数的47%和56%;利用20%干冰和50%冰水包装鱿鱼的优势菌为单胞菌属(Alteromonas),占总菌落数的30%。捕获1 d后测定鱿鱼的嗜冷菌数为8×102CFU/g,商业化鱿鱼嗜冷菌在冰藏12 d后由最初的1×104CFU/g增加至5×106CFU/g[68]。
鱿鱼特别是秘鲁鱿鱼产量巨大,其加工已成为国内水产品加工业的重要组成部分之一。鱿鱼在低温贮藏和后续的解冻过程中物理化学性质发生变化,致使产品品质下降。然而,国内外学者对低温贮藏和解冻过程中鱿鱼色泽、氧化敏感性、微生物数量、pH值等指标变化的研究观点却不尽相同,鱿鱼持水力下降的具体机制及鱿鱼蛋白质冷冻变性的分子作用机制尚不清楚,低温贮藏和解冻过程中鱿鱼蛋白质氧化、空间结构变化及解冻过程中汁液损失与空间结构变化之间的关系等鲜有报道,因此需要更深入地研究鱿鱼在低温贮藏和解冻过程中物理化学性质发生变化的作用机制,以便对低温贮藏和解冻过程中鱿鱼的品质进行更好的控制,从而促进水产品加工业的良性发展。
参考文献:
[1] KEYL F, ARGUELLES J, TAFUR R. Interannual variability in size structure, age, and growth of jumbo squid (Dosidicus gigas) assessed by modal progression analysis[J]. ICES Journal of Marine Science, 2011, 68(3): 507-518. DOI:10.1093/icesjms/fsq167.
[2] MATSUMOTO J J. Denaturation of fi sh muscle proteins during frozen storage[M]//FENNEMA O. Proteins at low temperatures. American Chemical Society, 1979: 205-224. DOI:10.1021/ba-1979-0180.ch010.
[3] ALVAREZ C, HUIDOBRO A, TEJADA M, et al. Consequences of frozen storage for nutritional value of hake[J]. Food Science and Technology International, 1999, 5(6): 493-499. DOI:10.1177/108201329900500607.
[4] SHENOUDA S Y K. Theories of protein denaturation during frozen storage of fish flesh[J]. Advances in Food Research, 1980, 26: 275-311. DOI:10.1016/S0065-2628(08)60320-1.
[5] MACKIE I M. The effects of freezing on fi sh proteins[J]. Food Reviews In ternational, 1993, 9(4): 575-610. DOI:10.1080/87559129309540979.
[6] ERSOY B, AKSAN E, OZEREN A. The effect of thawing methods on the quality of eels (Anguilla anguilla)[J]. Food Chemistry, 2008, 111(2): 377-380. DOI:10.1016/j.foodchem.2008.03.081.
[7] OTWELL W S, HAMANN D D. Textural characterization of squid (Loligo pealei Lesuer): scanning electron microscopy of cooked mantle[J]. Journal of Food Science, 1979, 44(6): 1629-1635. DOI:10.1111/j.1365-2621.1979.tb09104.x.
[8] 曾庆孝. 食品加工与保藏原理[M]. 北京: 化学工业出版社, 2007: 136.
[9] 张珂, 关志强, 李敏, 等. 解冻方法对冻藏肉类食品品质影响的研究进展[J]. 肉类研究, 2014, 28(8): 24-29.
[10] VIEIRA C, DIAZ M T, MARTINEZ B, et al. Effect of frozen storage conditions (temperature and length of storage) on microbiolog ical and sensory quality of rustic crossbred beef at different states of ageing[J]. Meat Science, 2009, 83(3): 398-404. DOI:10.1016/ j.meatsci.2009.06.013.
[11] LAWSON M A. The role of integrin degradation in post-mortem drip loss in pork[J]. Meat Science, 2004, 68(4): 559-566. DOI:10.1016/ j.meatsci.2004.05.019.
[12] LAWRIE R A. Lawrie s meat science[M]. 6th ed. Lancaster, PA: Technomic Publishing Inc, 1998: 1-336. DOI:10.1533/9781845691615.
[13] FELLOWS P J. Food processing technology, principles and practice[M]. 2th ed. London: Woodhead Publishing Limited, 2000: 418-440.
[14] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2): 93-98. DOI:10.1016/j.meatsci.2012.01.013.
[15] SHIRAI Y, YOSHIKAWA T. Change in components during freezing and thawing for food storage (in Japanese)[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 1999, 46(7): 447-453.
[16] MAMI A, MASAMITSU M. Influence of freezing and thawing on the change in texture of squid meat[J]. Journal of Home Economics of Japan, 2002, 53(12): 1177-1184. DOI:10.11428/jhej1987.53.1177.
[17] GARCÍA-SÁNCHEZ G, SOTELO-ROMERO C R, PACHECOAGUILAR R, et al. Effect of freezing on protein denaturation and gelling capacity of jumbo squid (Dosidicus gigas) mantle muscle[J]. LWT-Food Science and Technology, 2015, 60(2): 737-742. DOI:10.1016/j.lwt.2014.10.051.
[18] 路钰希, 林玉海, 李学英, 等. 冻藏温度对鱿鱼品质的影响[J]. 食品与发酵工业, 2015, 41(3): 105-111. DOI:10.13995/j.cnki.11-1802/ ts.201503019.
[19] UENG Y E, CHOW C J. Textural and histological changes of different squid mantle muscle during frozen storage[J]. Journal of Agricultural and Food Chemistry, 1998, 46(11): 4728-4733. DOI:10.1021/ jf9788032.
[20] DUBLÁN-GARCÍA O, CRUZ-CAMARILLO R, GUERREROLEGARRETA I, et al. Effect of refrigerated storage on proteolytic activity and physicochemical and microstructural properties of giant squid (Dosidicus gigas) mantle muscle[J]. Journal of Muscle Foods, 2006, 17(3): 291-310. DOI:10.1111/j.1745-4573.2006.00051.x.
[21] GONZALEZ-SANGUINETTI S, AÑÓN M C, CAVELO A. Effect of thawing rate on the exudate production of frozen beef[J]. Journal of Food Science, 1985, 50: 697-700. DOI:10.1111/j.1365-2621.1985. tb13775.x.
[22] HAUGLAND A. Industrial thawing of fi sh-to improve quality, yield and capacity[D]. Norway: Norwegian University of Science and Technology, 2002: 64-65.
[23] 姜晴晴, 李珊, 刘文娟, 等. 冻融循环对秘鲁鱿鱼蛋白及肌肉品质的影响[J]. 现代食品科技, 2014, 30(7): 171-178. DOI:10.13982/ j.mfst.1673-9078.2014.07.036.
[24] SAVAGE A W, WARRIS P D, JOLLEY P D. The amount and composition of the proteins in drip from stored pig meat[J]. Meat Science, 1990, 27: 289-303. DOI:10.1016/0309-1740(90)90067-G.
[25] SHENOUDA S Y K. Theories of protein denaturation during frozen storage of fi sh fi esh[J]. Advances in Food Research, 1980, 26: 275-311. DOI:10.1016/S0065-2628(08)60320-1.
[26] MACKIE I M. The effects of freezing on flesh proteins[J]. Food Reviews International, 19 93, 9(4): 575-610. DOI:10.1080/87559129309540979.
[27] 宋广磊, 戴志远. 鱼肉蛋白质冷冻变性研究进展[J]. 食品科技, 2006, 31(3): 17-20. DOI:10.13684/j.cnki.spkj.2006.03.008.
[28] 鸿巢章二, 桥本周久. 水产利用化学[M]. 郭晓峰, 邹胜祥, 译. 北京:中国农业出版社, 1994: 65-68; 271-276.
[29] 方竞. 鱼肉蛋白冷冻变性机理、测定方法及防止措施[J]. 福建水产, 2001(3): 67-71. DOI: 10.14012/j.cnki.fjsc.2001.03.012.
[30] 郭园园, 孔保华. 冷冻贮藏引起的鱼肉蛋白质变性及物理化学特性的变化[J]. 食品科学, 2011, 32(7): 335-340.
[31] KOŁODZIEJSKA I, SIKORSKI Z E, NIECIKOWSKA C. Parameters affecting the isolation of collagen from squid (Illex argentinus) skins[J]. Food Chemistry, 1999, 66(2): 153-157. DOI:/10.1016/S0308-8146(98)00251-9.
[32] OLIVAS R R, SÁNDEZ O R, HAARD N F, et al. Changes in fi rmness and thermal behavior of ice-stored muscle of jumbo squid (Dosidicus gigas)[J]. European Food Research & Technology, 2004, 219(4): 312-315. DOI:10.1007/s00217-004-0991-5.
[33] FUENTE-BETANCOURT G D L, GARCÍA -CARREÑO F, PACHECO-AGUILAR R, et al. Effect of storage at 0 ℃ on mantle proteins and functional properties of jumbo squid[J]. International Journal of Food Science & Technology, 2008, 43(7): 1263-1270. DOI:10.1111/j.1365-2621.2007.01602.x.
[34] PALAFOX H, CORDOVA-MURUETA J H, DEL TORO M A N, et al. Protein isolates from jumbo squid (Dosidicus gigas) by pH-shift processing[J]. Process Biochemistry, 2009, 44(5): 584-587. DOI:10.1016/j.procbio.2009.02.011.
[35] MIGNINO L A, CRUPKIN M, PAREDI M E. Surface hydrophobicity and functional properties of myofibrillar proteins of mantle from frozen-stored squid (Illex argentinus) caught either jigging machine or trawling[J]. LWT-Food Science and Technology, 2008, 41(4): 678-685. DOI:10.1016/j.lwt.2007.05.006.
[36] GOMEZ-GUILLEN M C, MARTINEZ-ALVAREZ O, MONTERO P. Functional and thermal gelation properties of squid mantle proteins affect by chilled and frozen storage[J]. Journal of Food Science, 2003, 68: 1962-1967. DOI:10.1111/j.1365-2621.2003.tb07002.x.
[37] RAMIREZ-SUAREZ J C, IBARRA-LEÓN L R, PACHECOAGUILAR R, et al. Physicochemical and functional changes in jumbo squid (Dosidicus gigas) mantle muscle during ice storage[J]. Food Chemistry, 2008, 111(3): 586-591. DOI:10.1016/ j.foodchem.2008.04.024.
[38] PAREDI M E, ROLDÁN H A, CRUPKIN M. Changes in myofi brillar proteins and lipids of squid (Illex argentinus) during frozen storage[J]. Journal of Food Biochemistry, 2006, 30(5): 604-621. DOI:10.1111/ j.1745-4514.2006.00088.x.
[39] NATSEBA A, LWALINDA I, KAKURA E, et al. Effect of pre-freezing icing duration on quality changes in frozen Nileperch (Lates niloticus)[J]. Food Research International, 2005, 38(4): 469-474. DOI:10.1016/ j.foodres.2004.10.014.
[40] PAREDI M E, CRUPKIN M. Bioche mical properties of actomyosin from frozen stored mantles of squid (Illex argentinus) at different sexual maturation stages[J]. Journal of Agricultural and Food Chemistry, 1997, 45(5): 1629-1632. DOI:10.1021/jf960776c.
[41] SEIDLER T, BRONOWSKI M. Effects of storage time and thermal treatment on the nutritive value of squid (Illex argentinus)[J]. Die Nahrung, 1987, 31(10): 949-957. DOI:10.1002/food.19870311004.
[42] DELLES R M, XIONG Y L. The effect of protein oxidation on hydration and water-binding in pork packaged in an oxygen-enriched atmosphere[J]. Meat Science, 2014, 97(2): 181-188. DOI:10.1016/ j.meatsci.2014.01.022.
[43] HERRERO A M, CARMONA P, CARECHE M. Raman spectroscopic study of structural changes in hake (Merluccius merluccius) muscle proteins during frozen storage[J]. Journal of Agricultural and Food Chemistry, 2004, 52: 2147-2153. DOI:10.1021/jf034301e.
[44] BERTRAM H C, KRISTENSEN M, ØSTDAL H, et al. Does oxidation affect the water functionality of myofibrillar proteins?[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2342-2348. DOI:10.1021/jf0625353.
[45] SIKORSKI Z E. Protein changes in muscle foods due to freezing and frozen storage[J]. International Journal of Refrigeration, 1978, 1(3): 173-180. DOI:10.1016/0140-7007(78)90094-4.
[46] PETROVIĆ L, GRUJIĆ R, PETROVIĆ M. Definition of the optimal freezing rate-2. Investigation of the physico-chemical properties of beef M. longissimus dorsi frozen at different freezing rates[J]. Meat Science, 1993, 33(3): 319. DOI:10.1016/0309-1740(93)90004-2.
[47] ESTEVEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89: 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[48] FENNEMA O R. Reaction kinetic in partially frozen aqueous systems[M]. London: Academic Press, 1975: 440-455. DOI:10.1016/ B978-0-12-223150-6.50034-1.
[49] OWEN J E, LAWRIE R A. The effect of an artifi cially induced high pH (hydrogen-ion concentration) on the susceptibility of minced porcine muscle to undergo oxidative rancidity under frozen storage[J]. Journal of Food Technology, 1975, 10: 169-180. DOI:10.1111/j.1365-2621.1975.tb00019.x.
[50] ATAYETER S, ERCOSKUN H. Chemical composition of European squid and effects of different frozen storage temperatures on oxidative stability and fatty acid composition[J]. Journal of Food Science and Technology, 2011, 48(1): 83-89. DOI:10.1007/s13197-010-0139-5.
[51] MUELA E, SANUDO C, CAMPO M M, et al. Effect of freezing method and frozen storage duration on instrumental quality of lamb throughout display[J]. Meat Science, 2010, 84(4): 662-669. DOI:10.1016/j.meatsci.2009.10.028.
[52] CALVELO R J. Recent studies on meat freezing[M]. London: Elsevier Applied Science Publishers, 1981: 125-158.
[53] XIONG Y L. Protein oxidation and implications for muscle food quality[M]. Chichester: John Wiley & Sons, 2000: 3-23; 85-111; 113-127.
[54] LAPAGUIMARAES J, DA SILVA M A A, DE FELICIO P E, et al. Sensory, colour and psychrotrophic bacterial analyses of squids (Loligo plei) during storage in ice[J]. LWT-Food Science and Technology, 2002, 35(1): 21-29. DOI:10.1006/fstl.2001.0783.
[55] SUNGSRI-IN R, BENJAKUL S, KIJROONGROJANA K. Pink discoloration and quality changes of squid (Loligo formosana) during iced storage[J]. LWT-Food Science and Technology, 2011, 44(1): 206-213. DOI:10.1006/fstl.2001.0783.
[56] 沈萍, 李学英, 杨宪时, 等. 低温贮藏过程中鱿鱼细菌组成的变化及优势腐败菌鉴定[J]. 现代食品科技, 2015, 31(6): 236-242. DOI:10.13982/j.mfst.1673-9078.2015.6.037.
[57] RAMIREZ-SUAREZ J C, IBARRA-LEON L R, PACHECOAGUILAR R, et al. Physicochemical and functional changes in jumbo squid (Dosidicus gigas) mantle muscle during ice storage[J]. Food Chemistry, 2008, 111(3): 586-591. DOI:10.1016/ j.foodchem.2008.04.024.
[58] SONGSAENG S, SOPHANDORA P, KAEWSRITHONG J, et al. Quality changes in oyster (Crassostrea belcheri) during frozen storage as affected by freezing and antioxidant[J]. Food Chemistry, 2010, 123(2): 286-290. DOI:10.1016/j.foodchem.2010.04.033.
[59] MORAL A. Metodos fisco-quimicos de control de calidad depescados[J]. Alimentacian Equiposy Technologia, 1987, 5: 115-122.
[60] LEYGONIE C, BRITZ T J, HOFFMAN L C. Oxidative stability of previously frozen ostrich M. iliofibularis packaged under different modified atmosphere conditions[J]. International Journal of Food Science & Technology, 2011, 46(6): 1171-1178. DOI:10.1111/j.1365-2621.2011.02603.x.
[61] JEYASEKARAN G, SHAKILA R J, SUKUMAR D, et al. Quality changes in squid (Loligo duvaucelli) tubes chilled with dry ice and water ice[J]. Journal of Food Science & Technology, 2010, 47(4): 401-407. DOI:10.1007/s13197-010-0066-5.
[62] PRAFULLA V, FRANCIS L, LAKSHMANAN P T. Effect of different methods of icing on the quality of squid and cuttlefi sh during storage[J]. Fishery Technology, 2000, 37: 81-88.
[63] CAMPOS C A, GLIEMMO M F, AUBOURG S P, et al. Novel technologies for the preservation of chilled aquatic food products[M]// MCELHATTON A, DO AMARAL SOBRAL P J. Novel technologies in food science. New York: Springer-Verlag, 2012: 299-323. DOI:10.1007/978-1-4419-7880-6_13.
[64] LAUZON H L, MARGEIRSSON B, SVEINSDÓTTIR K, et al. Overview on fi sh quality research. Impact of fi sh handling, processing, storage and logistics on fi sh quality deterioration[R]. 2010: 32-47.
[65] SVAEVIK C S, LUNESTAD B T. Characterisation of the microbiota of atlantic mackerel (Scomber scombrus)[J]. International Journal of Food Microbiology, 2011, 151(2): 164-170. DOI:10.1016/ j.ijfoodmicro.2011.08.016.
[66] GRAM L, HUSS H H. Microbiological spoilage of fish and fish products[J]. International Journal of Food Microbiology, 1996, 33(1): 121-137. DOI:10.1016/0168-1605(96)01134-8.
[67] 许磊. 冷冻食品细菌学检验方法的研究[D]. 扬州: 扬州大学, 2010: 8.
[68] LAPA-GUIMARÃES J, FELICIO P E D, GUZMÃN E S C. Chemical and microbial analyses of squid muscl e (Loligo plei) during storage in ice[J]. Food Chemistry, 2005, 91(3): 477-483. DOI:10.1016/ j.foodchem.2004.04.038.
Progress in the Effects of Low-Temperature Storage and Thawing on Squid Quality
ZHU Wenhui, HUAN Haizhen, BU Ying, LI Xuepeng, YI Shumin, LI Jianrong*
(Engineering and Technology Research Center of Food Preservation, Processing and Safety Control of Liaoning Province, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China)
Abstract:Squids are an important resource for oversea fi sheries in China. Immediate freezing of squids after harvest is required. Therefore, frozen squids are the major raw material for all squid products. Low-temperature storage especially frozen storage has been widely used in food preservation. Frozen aquatic products must be thawed before they are processed. However, the process may also cause drip loss and reduced quality. The quality of frozen aquatic products depends not only on freezing methods and temperature and temperature fi uctuations, but also on subsequent thawing methods. This review article discusses many physical and chemical changes including moisture content, protein denaturation and oxidation, lipid oxidation, color and pH and microbial changes including specifi c spoilage organisms during low-temperature storage and thawing of squids, in order to provide valuable information on improving squid storage process.
Key words:squid; low-temperature storage; thawing; quality; deterioration
DOI:10.7506/spkx1002-6630-201717045
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2017)17-0279-07引文格式:
收稿日期:2016-08-26
基金项目:国家自然科学基金青年科学基金项目(31301569);“十二五”国家科技支撑计划项目(2015BAD17B01)
作者简介:朱文慧(1982—),女,讲师,博士,研究方向为水产品加工及贮藏。E-mail:wenhuiby130@163.com
*通信作者:励建荣(1964—),男,教授,博士,研究方向为水产品贮藏加工及质量安全控制。E-mail:lijr6491@163.com