吕艳芳1,2,张艳平2,蔡路昀2,励建荣2,杨铭铎1,*
(1.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076;2.渤海大学食品科学与工程学院,辽宁 锦州 121013)
摘 要:为研究曲酸对南美白对虾酚氧化酶(phenol oxidase,PO)活性和结构的影响,以南美白对虾头胸部分离纯化出的PO为原料,研究不同浓度曲酸(0、0.1、0.3、0.5、0.7、0.9、1.1、1.3、1.5 mmol/L)对PO活性的抑制,确定曲酸作用PO的抑制类型;通过测定不同浓度曲酸(0、0.1、0.3、0.5、0.7、0.9、1.1 mmol/L)处理的PO蛋白内源荧光光谱、表面疏水性和二级结构类型含量的变化,研究曲酸对PO空间结构的影响。结果表明:随着作用PO曲酸浓度的增加,PO的剩余酶活逐渐减少,当曲酸浓度达到1.5 mmol/L时,PO的剩余酶活仅为9.8%,参与的反应体系褐变指数变化值为3.02,抑褐变效果明显;曲酸能够有效的抑制PO活性,曲酸作用PO的抑制类型属于竞争性抑制剂;随着作用PO曲酸浓度的增加,PO的内源荧光强度不断降低,最大发射波长发生红移,PO蛋白表面疏水性先增加后降低;随着作用PO曲酸浓度的增加,二级结构类型α-螺旋和β-折叠含量降低,无规则卷曲和β-转角增加。可以推测,曲酸与PO结合后,酶蛋白空间结构发生了改变。
关键词:南美白对虾;曲酸;酚氧化酶;酶活;三级结构;二级结构
多酚氧化酶(polyphenol oxidase,PPO)广泛存在于动物、植物、真菌和细菌中,节肢动物体中一般称为酚氧化酶(phenoloxidase,PO),植物中一般称为多酚氧化酶,脊椎动物、微生物和软体动物中一般称为酪氨酸酶。它是一种结构复杂的含铜金属氧化酶,根据所催化的底物结构特性,可以分为3种类型:单酚氧化酶、双酚氧化酶,漆酶[1]。在生物体内,多酚氧化酶是黑色素合成的关键酶[2],水果、蔬菜、对虾等食品的褐变都与其活性有关。因而,多酚氧化酶的抑制剂成为食品保鲜和加工研究的热点。近年来在研究抑制剂对酶的抑制效果的同时,还对抑制剂导致酶蛋白高级结构的变化进行了研究,如Zhou Lei等[3]对超声波结合苹果酸对蘑菇多酚氧化酶的活性和构象的影响进行了研究,方志超等[4]研究了乳酸对蘑菇多酚氧化酶活性和构象的影响,Xiong Zhiqiang等[5]通过分子对接的方式研究了芹黄素与蘑菇多酚氧化酶的作用,Liu Fang等[6]通过分子对接建模的方法对富士苹果的膜结合态多酚酶氧化酶的结构进行了分析,Masuda等[7]对日本囊对虾(Marsupenaeus japonicus)酚氧化酶原结构进行了分析,这些研究有助于在分子水平上进一步研究多酚氧化酶。
南美白对虾(Penaeus vannamei)是亚洲南部和东南部地区重要水产品之一[8],因为它味道鲜美,备受世界各国人们喜爱,但在虾类的血淋巴中含有大量的酚氧化酶,在活虾中该酶以酶原的形式存在,没有活性,当虾死后,体内的各种酶组分平衡被打破,酚氧化酶酶原被激活,催化体内的酚类底物转化为黑色素类物质,因而造成虾死后迅速变黑[9]。虾类的黑变造成质量下降,营养物质流失,从而造成虾类价格降低。大量的对虾PO抑制剂开始研究与应用,如化学抑制剂4-己基间苯二酚等,有机酸类阿魏酸等[10],还有从植物中提取的一些天然混合物,如绿茶提取物[11]、石榴皮提取物[12]等,但这些研究主要集中在防黑保鲜效果上,而对于抑制剂与酶结合后,酶的结构是否发生变化,研究的比较少。
曲酸是微生物产生的一种弱酸性代谢物,可抑制多酚氧化酶,在果蔬防黑保鲜领域中已经被使用[13],如曲酸能明显抑制莴苣、马铃薯、莲藕等褐变[14];另外,冻虾、猪肉、酱黄瓜、酱油等食品中就含有曲酸[15]。曲酸对酶促褐变抑制作用的报道比较多,但对对虾PO活性的抑制及结构的影响相关研究比较少。本研究首先对南美白对虾PO进行分离纯化,然后研究曲酸对其活性和结构的影响,为南美白对虾PO抑制剂的使用和在分子水平上进一步研究提供参考依据。
1.1 材料与试剂
南美白对虾(Penaeus vannamei)养殖于辽宁锦州渤海湾,购买时为活虾,将虾保持鲜活状态运到实验室,用冰猝死,将其头胸部剪下,贮藏于-80 ℃超低温冰箱备用。
L-多巴(L-β-(3,4-二羟基苯)-丙氨酸,L-DOPA)(BR级)、十二烷基聚乙二醇醚(Brij-35)、非变性聚丙烯酰胺凝胶电泳(non-denaturing po lyacrylam ide gel electrophoresis,Native-PAGE)试剂 美国Sigma公司;8-苯胺-1-萘磺酸(8-(phenylam ino)naphthalene-1-sulfonic acid,ANS) 上海克拉玛尔试剂公司;曲酸(纯度99%) 上海阿拉丁生化科技股份有限公司;DEAE Sepharose Fast Flow、葡聚糖凝胶G-100(Sephadex G-100) 美国GE-Healthcare Amersham公司;其他试剂均为分析纯 上海国药集团化学试剂有限公司。
1.2 仪器与设备
UV-2550紫外-可见分光光度计 日本岛津公司;蛋白电泳仪、GS-800图像扫描仪 美国Bio-Rad公司;M illi-Q超纯水装置 美国M illipore公司;DK 8D型电热恒温水槽 上海一恒科技有限公司;Biofuge stratos台式冷冻高速离心机 美国Thermo Scientific 公司;CR-400 色彩色差计 日本Konica Minolta公司;Scimitar2000 Near傅里叶变换红外(Fourier transform in frared,FT-IR)光谱仪 美国安捷伦公司;970CRT型荧光分光光度计 上海精密科学仪器有限公司;蛋白质层析系统上海青浦沪西仪器厂。
1.3 方法
1.3.1 南美白对虾PO分离纯化
南美白对虾PO的分离纯化,参考相关文献[16],并进行部分修改,具体步骤为:将冷冻于-80 ℃超低温冰箱的南美白对虾头胸部的头胸甲及肌肉去掉,将其内脏团使用液氮研磨,称取200 g粉末加入到800 m L、0.067 mol/L、pH值为7.2的预冷磷酸缓冲液中(含有Brij-35,质量分数0.1%),混合后置于4 ℃下,浸提2 h,然后用尼龙网布过滤,滤液使用高速冷冻离心机在4 ℃下10 000 r/m in离心20 m in,弃沉淀,收集上清液,获得的上清液即为粗酶液。
将饱和硫酸铵溶液缓慢加入粗酶液中,使硫酸铵的质量分数先后达到30%、40%和50%,每级沉淀都在4 ℃静置2 h,4 ℃、10 000 r/m in离心20 m in,将30%、40%硫酸铵沉淀的蛋白质弃去,收集50%硫酸铵沉淀的酶蛋白,溶于适量的磷酸缓冲液。将上述酶液在4 ℃进行透析,在pH 7.2、0.067 mol/L磷酸缓冲液中透析16 h,期间更换两次透析液,聚乙二醇浓缩后离心,收集上清液。取12 m L透析、浓缩后的PO液上样于DEAE Sepharose Fast Flow弱阴离子交换柱(1.6 cm×25 cm),分别用含 0、0.2、0.3、0.4、0.5 mol/L NaCl溶液,pH 7.2、0.02 mol/L的磷酸缓冲液进行洗脱,每个梯度洗脱70 m L,流速1 m L/m in,每5 m L收集1 管,收集0.4 mol/L NaCl磷酸缓冲液洗脱的蛋白峰,聚乙二醇浓缩,然后取6 m L酶液上样于Sephadex G-100葡萄糖凝胶进一步纯化,用pH 7.2、0.067 mol/L的磷酸缓冲液进行洗脱,流速18 m L/h,每3 m L收集1 管,收集合并酶活性较高的蛋白峰,使用10 kD超滤离心管浓缩,然后保存于-80 ℃超低温冰箱中备用。
1.3.2 Native-PAGE
实验采用Native-PAGE检测酶蛋白纯度和活性检测[17]。Native-PAGE中采用的浓缩胶和分离胶质量分数分别为4%和12%,酶蛋白分别用考马斯亮蓝R-250和底物L-DOPA(pH 6.8、0.067 mo l/L的磷酸缓冲液配制,25 mmol/L)染色,底物L-DOPA染色在45 ℃条件下进行。1.3.3 曲酸处理PO
分离纯化、浓缩后的PO(酶活为731 U/m L,蛋白含量1.2 mg /m L)作为本实验用酶;用pH 6.8、0.067 mol/L磷酸缓冲液配制曲酸溶液,浓度为10 mmol/L。用曲酸溶液处理PO,将曲酸和4 m L PO混合于pH 6.8、0.067 mol/L的磷酸缓冲液,曲酸终浓度分别为0、0.1、0.3、0.5、0.7、0.9、1.1、1.3、1.5 mmol/L,处理后的酶液终体积为8 m L,室温下作用15 min,此酶作为实验研究用酶。
1.3.4 PO与曲酸作用前后催化L-DOPA生成产物最大吸收波长的测定
反应体系的缓冲溶液是pH 6.8(PO的最适pH值)、0.067 mol/L的磷酸缓冲液,反应体系加入0.4 m L的酶液,底物L-DOPA终浓度分别为15、20、25 mmol/L,每个反应体系总体积5 m L。将反应液于PO的最适温度45 ℃的水浴锅中反应5 m in,取出立即放入冰中,终止反应,用紫外分光光度计在300~700 nm波长范围内每隔 2 nm 进行扫描,确定产物的最大吸收波长。将上述酶液改为经曲酸(终浓度0.5 mmol/L)处理的酶液,检测其产物吸收峰。两组实验用来判定PO被曲酸处理前后对产物最大吸收峰是否有影响。
1.3.5 PO活性的测定
将1.8 m L的L-DOPA和1.8 m L的pH 6.8、0.067 mol/L的磷酸缓冲液混合,置于45 ℃恒温水浴3 m in,然后加入0.4 m L预先在45 ℃条件下预热3 m in的PO(含有激活剂SDS,质量分数为0.8%),立即将混合液置于比色皿中,选择紫外-可见分光光度计动力学模块,在产物的最大吸收波长下测定反应液的吸光度变化,每隔5 s记录1 次吸光度,测定6 m in,选取反应体系吸光度直线上升区间数据计算酶活,此阶段属于酶促反应的初速度阶段。
一个酶活力单位(U)定义为单位体积酶液(m L)在单位时间(m in)使酶促反应体系的单位体积(m L)吸光度增加0.001;酶促反应速率(v)以单位时间(m in)内吸光度(A)增加量表示,见公式(1)。
酶被抑制剂处理前后活性变化以剩余酶活性表示[18],见公式(2)。
1.3.6 曲酸处理的PO催化的反应体系颜色变化的测定
不同浓度曲酸处理的PO催化的反应体系酶促反应的快慢,可以根据反应体系褐变程度来表示,即褐变指数(browning index,BI)[19],见公式(3);因为PO为淡黄色,刚加入反应体系时,体系有颜色,所以用褐变指数的变化量(ΔBI)来比较反应体系的反应快慢,见公式(4)。反应体系为:1.8 m L、pH 6.8、0.067 mol/L磷酸缓冲液和1.8 m L、20 mmol/L的L-DOPA混合,置于45 ℃恒温水浴3 m in,然后再与预先45℃预热3 m in的0.4 m L被不同浓度曲酸处理的PO液迅速混合,45 ℃反应5 m in,用全自动色差计测其L*、a*和b*,重复测定3 次,取平均值。

式中:L*、a*和b*分别表示明暗、红绿、黄蓝。BIt为反应t m in后,反应体系的褐变值;BI0为反应体系最开始时的褐变值。
1.3.7 曲酸处理的PO催化的反应体系酶促动力学常数Km、vmax测定
反应温度45 ℃、反应体系缓冲液pH值为6.8条件下,测定当底物L-DOPA终浓度为5、10、15、20、25 mmol/L,不同浓度曲酸(0、0.1、0.3、0.5 mmo l/L)处理的PO催化的反应体系酶促反应速率,具体操作步骤参考1.3.5节,然后用Lineweaver-Burk作图,得出动力学参数米氏常数(Km)和最大催化速率(vmax)。
1.3.8 曲酸处理的PO内源荧光光谱扫描
不同浓度曲酸(0、0.1、0.3、0.5、0.7、0.9、1.1 mmol/L)处理的PO内源荧光的变化利用970CRT型荧光光度计测量,参考Zhou Lei等[3]方法加以修改,将被不同浓度曲酸处理的PO用磷酸缓冲液(pH 6.8)进行稀释,终质量浓度为0.07 mg/m L,激发波长λex为288 nm,发射波长λem的范围为200~600 nm,狭缝矫正均为5 nm,扫描PO荧光光谱。
1.3.9 曲酸处理的PO表面疏水性测定
选用ANS作为荧光探针,根据Yongsawatdigul等[20]实验方法略有修改,将不同浓度曲酸(0、0.1、0.3、0.5、0.7、0.9、1.1 mmol/L)处理的PO,用pH 6.8、0.067 mol/L磷酸缓冲液稀释至蛋白质质量浓度在0.06~0.22 mg/m L之间,选取5 个质量浓度梯度作为研究梯度,然后分别取上述酶液4 m L,加入20 μL ANS(8 mmol/L,pH 7.0、0.01 mol/L的磷酸缓冲液配制),混匀后置于4 ℃黑暗处静置15 m in,然后用荧光光度计在激发波长λex为346 nm,发射波长λem范围为480~510 nm,狭缝矫正均为5 nm下进行荧光光谱扫描,测定其最大荧光强度(fluorescence intensity,FI)。以蛋白质质量浓度为横坐标,FI为纵坐标作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数(S0)[21]。
1.3.10 曲酸处理的PO二级结构变化的测定
参考相关文献[22],将不同浓度曲酸(0、0.1、0.3、0.5、0.7、0.9、1.1 mmo l/L)处理的PO冷冻干燥,取适量干燥的PO与适量KBr混合进行压片,测定各PO的FT-IR光谱。在16 cm-1分辨率下,进行400~4 000 cm-1全波段扫描,扫描200 次,每个样品检测3 次,收集样品光谱。因酰胺Ⅰ带中α-螺旋和无规则卷曲相邻较近,样品中残留的水对其图谱分析有一定的影响,而酰胺Ⅲ带α-螺旋和无规则卷曲距离较远,样品中的水不会影响实验结果的分析[23],参考文献[24],采用Peak Fitv4.12软件,选取酰胺Ⅲ带(1 220~1 330 cm-1)波段图谱进行曲线拟合,多次拟合使残差(r2)大于0.99,然后研究PO蛋白质二级结构含量。
2.1 南美白对虾PO分离纯化结果
南美白对虾PO经硫酸铵沉淀、DEAE Sepharose Fast Flow弱阴离子交换柱、Sephadex G-100葡萄糖凝胶分离纯化后,酶的比活力为614.78 U/mg(731.59 U/m L),是粗酶液纯度的9.68 倍,结果见表1。所得酶液,经Native-PAGE进行纯度和活性检测,结果见图1,经考马斯亮蓝R-250染色(图1A)后,出现两条蛋白带,说明所得酶液纯度已经非常高;经底物L-DOPA活性染色(图1B)后,蛋白2表现出很强的酶活性,说明纯化后的蛋白含有高活性的PO,可以满足研究PO活性和结构的要求。
表1 南美白对虾PO提取过程比活力及纯化倍数变化
Table 1 Change in specif i c activity of Penaeus vannamei PO enzyme during extraction and purif i cation
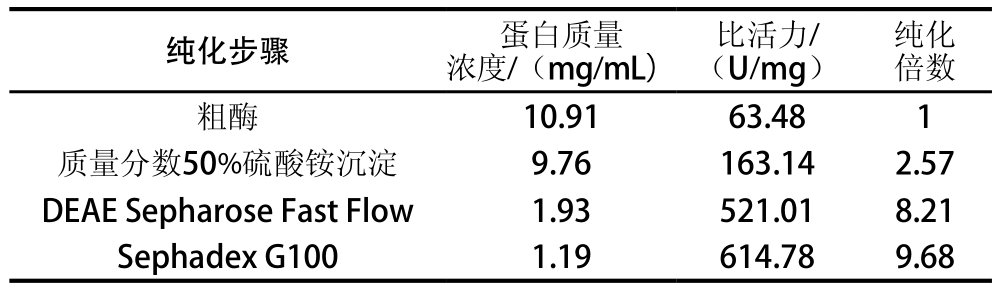
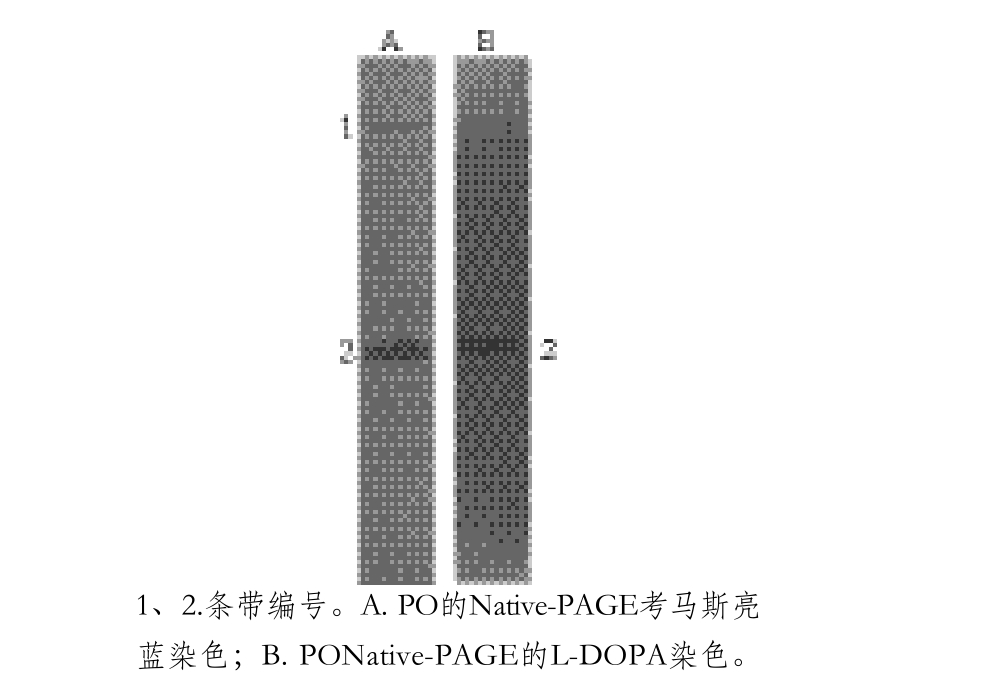
图1 纯化后PO非变性凝胶电泳图
Fig. 1 Native-PAGE of purif i ed PO enzyme.
2.2 PO与曲酸作用前后催化底物L-DOPA生成产物最大吸收波长的确定
南美白对虾PO被曲酸处理前后分别参与反应,反应后对产物进行光谱扫描,由图2可以看出,未被曲酸处理的PO(图2A)和被曲酸处理的PO(图2B)催化的反应,生成的产物在465~475 nm波长处有最大吸收峰,曲酸的加入不会影响产物的吸收峰,所以实验中确定产物的吸收波长为470 nm。从图2可以看出,随着底物浓度(15、20、25 mmol/L)的增加,产物的吸光度也在增加;相同底物浓度的反应体系,由于抑制剂的加入,反应时间相同时,被抑制剂作用的酶催化的反应体系产物的生成量低于未加抑制剂的反应体系,说明反应速度低于对照组。在一定反应时间内,反应中生成的产物是稳定的,抑制剂的加入减少了产物的生成量,对产物的最大吸收峰无影响。
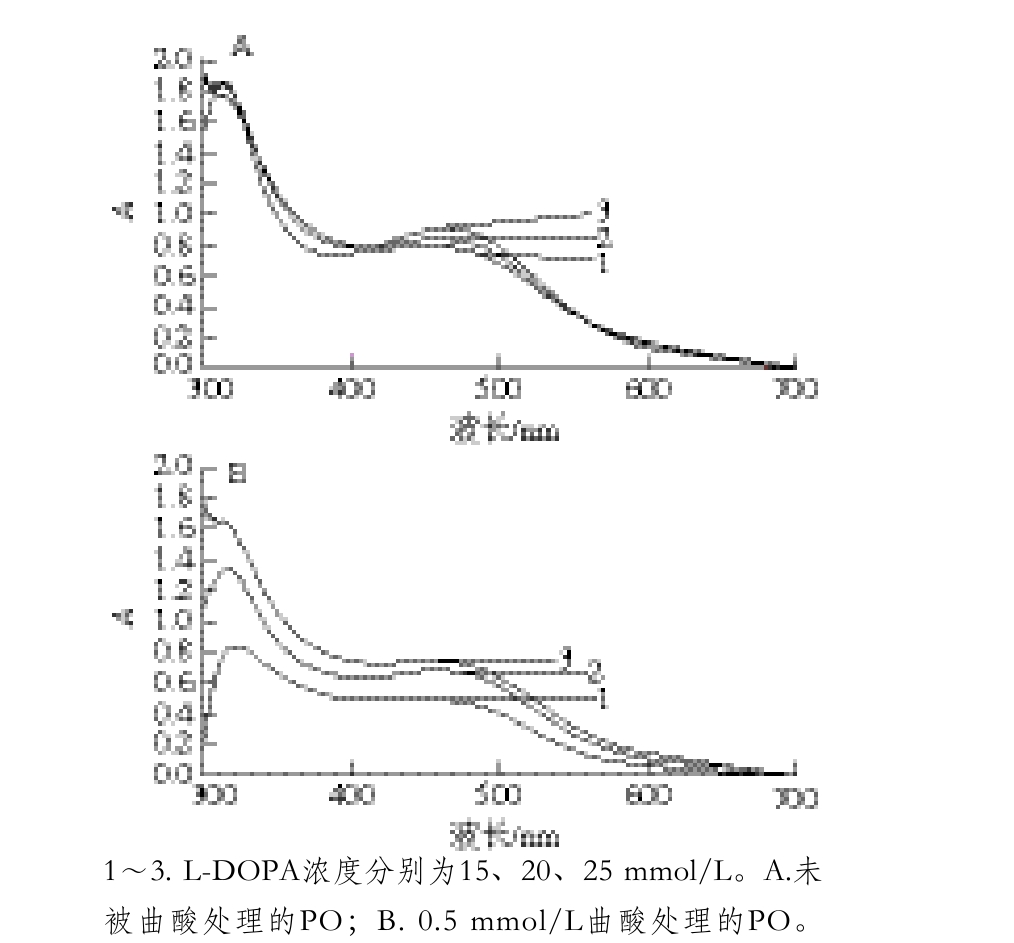
图2 PO与曲酸作用前后催化底物L-DOPA生成产物最大吸收波长
Fig. 2 Maximum absorption wavelength of the product generated from the reaction of PO with and without kojic acid treatment and L-DOPA
图3 曲酸对PO活性的影响
Fig. 3 Effect of kojic acid on PO activity
2.3 不同浓度曲酸对PO活性的影响由图3可知,随着处理PO曲酸浓度的增加,PO剩余酶活性不断降低,曲酸浓度为0.1~0.7 mmol/L时,PO的剩余酶活下降比较快,当曲酸浓度为0.7 mmol/L时,剩余酶活性仅为21.51%;当曲酸浓度为0.9~1.5 mmol/L时,PO剩余酶活下降比较缓慢,当曲酸浓度达到1.1 mmol/L时,PO的剩余酶活性为10.26%,再继续加入曲酸,剩余酶活性基本维持在9.8%,此时PO的活性已经非常低,所以,实验中选择曲酸的抑制浓度为0~1.1 mmol/L。
2.4 不同浓度曲酸处理PO催化的反应体系褐变指数变化

图4 不同浓度曲酸处理的PO参与的反应体系褐变指数变化
Fig. 4 Effect of PO treatment with kojic acid on change in browning index
不同小写字母表示数据间存在显著性差异(P<0.05)。
从图4可以看出,随着作用酶的曲酸浓度的升高,褐变指数的变化量逐渐减少,说明反应体系褐变程度逐渐降低;被0.1 mmol/L曲酸处理的酶催化的反应体系,褐变指数变化与对照组比较差异不明显,说明酶活性抑制不明显;当曲酸的浓度为0.3 mmol/L以上时,反应体系的褐变指数变化与对照组比较,差异明显,说明褐变程度明显低于对照,抑制褐变效果明显;当曲酸浓度为1.1 mmol/L,褐变指数变化值为3.02,说明参与反应的PO活性已经很低了,这个结果与2.3节结果基本一致。总之,其他条件一定的情况下,酶的活性决定反应体系褐变情况。
2.5 不同浓度曲酸处理的PO参与的酶促反应体系Km及vmax值
底物L-DOPA浓度([S])不同的条件下,测定被不同浓度曲酸处理的PO参与的反应体系酶促反应速率(v),结果以Lineweaver-Burk双倒数法作图,见图5。不同浓度曲酸处理的PO参与的酶促反应体系Lineweaver-Burk双倒数曲线交于1/v轴(Y轴)的同一点,可以判断曲酸在此酶促反应中属于竞争性抑制剂,这与金一琼等[25]研究曲酸对蘑菇、M ishra等[26]研究曲酸对茄子多酚氧化酶的作用结果一致。不同浓度曲酸处理的PO催化的反应体系的Lineweaver-Burk回归方程及根据回归方程所得出的Km和vmax值,见表2。
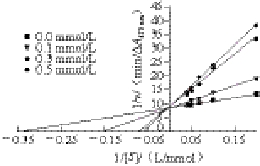
图5 不同浓度曲酸处理的PO的Lineweaver-Burk图
Fig. 5 Lineweaver-Burk plots of PO treated with different concentrations of kojic acid
表2 曲酸对PO抑制作用的回归方程及动力学参数
Table 2 Kinetic parameters and regression equation for the inhibition of kojic acid action against PO
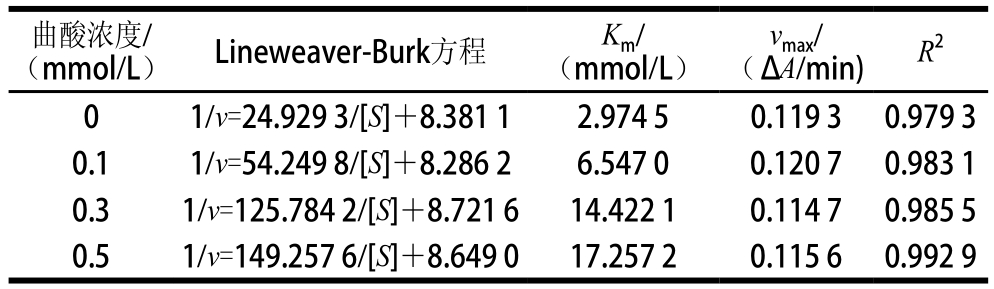
从表2可以看出,随着作用南美白对虾PO曲酸浓度的增加,PO参与的反应体系的Km值逐渐增加,而vmax近似趋于一致,符合竞争性抑制剂作用于酶的特点。当底物浓度较低时,曲酸与底物竞争酶活性中心的结合部位,曲酸结合于酶的活性部位,底物被排斥在酶活性部位之外,导致酶促反应被抑制;随着底物浓度的增加,底物与抑制剂竞争酶的活性中心,大量的底物又与酶结合,所以不同曲酸处理的酶参与的反应体系中,当底物浓度增加到一定浓度时,最大反应速率接近对照组的最大反应速率,这个作用模式符合竞争性抑制剂的作用特点。因此,可以通过增大底物浓度,提高底物的竞争能力来消除竞争性抑制剂对酶的抑制作用。
2.6 曲酸对PO内源荧光的影响
当蛋白质处于280 nm左右的激发波长下,内源荧光主要来自色氨酸(Trp)和酪氨酸(Tyr)残基,其内源荧光对环境非常敏感[27],因此,内源荧光的改变,可以反应出蛋白质结构是否发生改变[28]。不同浓度曲酸对PO内源荧光光谱的影响见图6,随着作用PO曲酸浓度的增加,PO的内源荧光强度不断降低(图6A),当曲酸浓度为0.1 mmol/L时,PO内源荧光强度为原酶的94.15%;当曲酸浓度为1.1 mmol/L时,PO内源荧光强度为原酶的81.61%;最大荧光发射峰从334.8 nm移动到336.7 nm,最大发射波长发生红移,具体结果见图6B。方志超等[4]研究乳酸对蘑菇多酚氧化酶结构的影响时发现,随着乳酸浓度的增加,蘑菇多酚氧化酶的内源荧光强度显著降低;Liu Wei等[18]研究柠檬酸对蘑菇多酚氧化酶构象影响时发现,酶蛋白的荧光强度也降低了,最大荧光发射波长由341 nm红移到344 nm。南美白对虾PO经曲酸处理后,内源荧光发生的改变情况与这些结果相似,由此可以推测,有机酸与多酚氧化酶结合后,导致酶的内源荧光强度发生改变,最大发射波长多数发生红移。
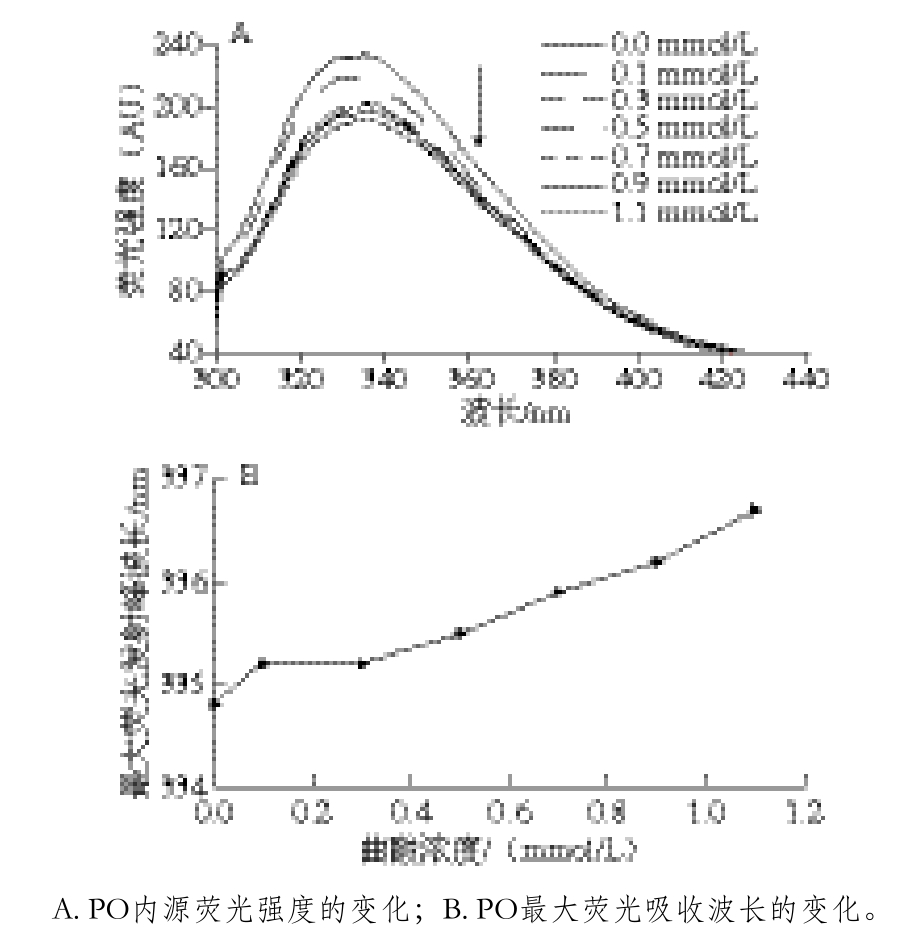
图6 不同浓度曲酸对PO内源荧光发射光谱的影响
Fig. 6 Effect of various concentrations of kojic acid on intrinsic f l uorescence em ission spectrum of PO
2.7 曲酸对PO蛋白表面疏水性的影响
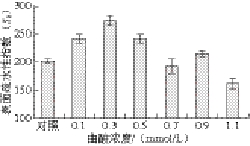
图7 不同浓度曲酸对PO表面疏水性的影响
Fig. 7 Effect of various concentrations of kojic acid on PO surface hydrophobicity
图7 为PO被曲酸处理后,酶蛋白表面疏水性的变化,当曲酸浓度为0~0.3 mmol/L时,随着作用PO曲酸浓度的增加,表面疏水性逐渐增加,当作用PO的曲酸浓度为0.3 mmol/L时,PO表面疏水性增加到最大,这可能是因为曲酸与酶结合后,使酶蛋白内部有些疏水基团展开外露,酶分子之间没有发生聚集;随着曲酸浓度的继续增加,表面疏水性开始降低,这可能是因为随着结合曲酸酶蛋白分子的增加,内部疏水基团展开外露的酶分子不断增加,展开的酶蛋白相互靠近,疏水基团相互聚集,从而导致表面疏水性指数又下降[29]。疏水基团的暴露将会引起蛋白质二级结构肽链卷曲或三级结构的变化。从表面疏水性指数的改变可知,PO与曲酸结合后表面疏水性先增加后降低。
2.8 曲酸对PO二级结构影响
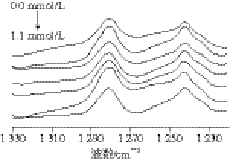
图8 不同浓度曲酸处理的PO酰胺Ⅲ带FT-IR光谱图
Fig. 8 FT-IR spectra of am ide III of PO treated with different concentrations of kojic acid
表3 曲酸处理后PO二级结构含量
Table 3 Secondary structures contents PO treated with different concentrations of kojic acid

注:同一列不同小写字母表示存在显著性差异(P<0.05)。
酰胺Ⅲ带各子峰的归属为:1 330~1 290 cm-1为α-螺旋,1 250~1 220 cm-1为β-折叠,1 295~1 265 cm-1为β-转角,1 270~1 245 cm-1为无规则卷曲[30]。不同浓度曲酸处理的PO红外酰胺Ⅲ带谱图见图8,采用Peak Fitv4.12 软件计算得到的PO二级结构含量见表3。被曲酸处理的南美白对虾PO与未处理的PO相比,二级结构空间构象类型含量发生了变化,随着作用PO曲酸浓度的增加,α-螺旋从21.99%减少到20.65%,β-折叠从27.20%减少到20.52%,无规则卷曲从30.33%增加到34.45%,β-转角从20.48%增加到24.38%,变化都比较明显(P<0.05)。在蛋白质中,α-螺旋是稳定其空间结构的重要条件,如果α-螺旋含量发生改变,说明蛋白质的结构也发生了一定的改变[5]。2.5节中结果显示,曲酸抑制南美白对虾PO活性的类型属于竞争性抑制剂,所以,曲酸与PO结合后,酶的空间结构虽然发生了改变,但这种改变,应该不会造成酶的变性。
南美白对虾PO经硫酸铵沉淀、DEAE Sepharose Fast Flow弱阴离子交换柱、Sephadex G-100葡萄糖凝胶分离纯化后,酶的比活力为614.78 U/mg(731.59 U/m L),经Native-PAGE进行纯度和活性检测,可以满足酶的活性和结构研究。随着作用PO曲酸浓度的增加,PO活性逐渐降低,反应体系褐变程度逐渐降低,说明曲酸能够有效抑制PO的活性。曲酸对PO活性的抑制属于竞争性抑制剂。
曲酸与酶结合后,导致酶的内源荧光强度发生改变,最大发射波长发生红移;当作用PO的曲酸浓度较低时,酶蛋白表面疏水性增加,随着曲酸浓度的增加,内部疏水基团展开外露的酶分子之间发生聚集,从而导致表面疏水性指数下降。这些结果说明曲酸与PO结合后,PO空间结构发生了改变。随着作用PO曲酸浓度的增加,α-螺旋和β-折叠含量降低,无规则卷曲和β-转角含量增加。
参考文献:
[1] 许传俊, 李玲. 植物多酚氧化酶的研究进展[J]. 生命科学研究, 2002, 6(1): 45-48; 55. DOI:10.16605/j.cnki.1007-7847.2002.s1.011.
[2] HAGHBEEN K, TAN E W. Direct spectrophotometric assay of monooxygenase and oxidase activities of mushroom tyrosinase in the presence of synthetic and natural substrates[J]. Analytical Biochem istry, 2003, 312(1): 23-32. DOI:10.1016/S0003-2697(02)00408-6.
[3] ZHOU L, LIU W, XIONG Z Q, et al. Effect of ultrasound combined with malic acid on the activity and conformation of mushroom (Agaricus bisporus) polyphenoloxidase[J]. Enzyme and Microbial Technology, 2016, 90: 61-68. DOI:10.1016/j.enzm ictec.2016.05.001.
[4] 方志超, 周磊, 刘伟, 等. 乳酸对多酚氧化酶活性与构象的影响[J]. 食品工业科技, 2014, 35(16): 117-120. DO I:10.13386/ j.issn1002-0306.2014.16.017.
[5] XIONG ZQ, LIU W, ZHOU L, et al. Mushroom (Agaricus bisporus) polyphenoloxidase inhibited by apigenin: multi-spectroscopic analyses and computational docking simulation[J]. Food Chem istry, 2016, 203: 430-439. DOI:10.1016/j.foodchem.2016.02.045.
[6] LIU F, ZHAO J H, WEN X, et al. Purif i cation and structural analysis of membrane-bound polyphenol oxidase from Fuji app le[J]. Food Chemistry, 2015, 183: 72-77. DOI:10.1016/j.foodchem.2015.03.027.
[7] MASUDA T, MOMOJI K, HIRATA T, et al. The crystal structure of a crustacean prophenoloxidase provides a clue to understanding the functionality of the type 3 copper proteins[J]. FEBS Journal, 2014, 281(11): 2659-2673. DOI:10.1111/febs.12812.
[8] WANG J J, LIN T, LI J B, et al. Effect of acidic electrolyzed water ice on quality of shrimp in dark condition[J]. Food Control, 2014, 35(1): 207-212. DOI:10.1016/j.foodcont.2013.07.005.
[9] BENJAKUL S, VISESSANGUAN W, TANAKA M. Properties of phenoloxidase isolated from the cephalothorax of kuruma prawn (Penaeus japonicus)[J]. Journal of Food Biochem istry, 2005, 29: 470-485. DOI:10.1111/j.1745-4514.2005.00042.x.
[10] NIRMAL N P, BENJAKUL S. Effect of catechin and ferulic acid on melanosis and quality of Pacif i c white shrimp subjected to prior freezethawing during refrigerated storage[J]. Food Control, 2010, 21(9): 1263-1271. DOI:10.1016/j.foodcont.2010.02.015.
[11] N IRMAL N P, BENJAKUL S. Retardation of quality changes o f Pacific white shrimp by green tea extract treatment and modified atmosphere packaging during refrigerated storage[J]. International Journal of Food Microbiology, 2011, 149(3): 247-253. DOI:10.1016/ j.ijfoodm icro.2011.07.002.
[12] BASIRI S, SHEKARFOROUSH S S, AMINLARI M, et al. The effect of pomegranate peel extract (PPE) on the polyphenol oxidase (PPO) and quality of Pacif i c white shrimp (Litopenaeus vannamei) during refrigerated storage[J]. LWT-Food Science and Technology, 2015, 60(2): 1025-1033. DOI:10.1016/j.lwt.2014.10.043.
[13] RHO H S, AHN S M, YOO D S, et al. Kojyl thioether derivatives having both tyrosinase inhibitory and anti-inf l ammatory properties[J]. Bioorganic & Medicinal Chem istry Letters, 2010, 20: 6569-6571. DOI:10.1016/ j.bmcl.2010.09.042.
[14] 陈功, 余文华, 徐德琼, 等. 天然保鲜剂在净菜加工中的应用研究[J]. 食品工业科技, 2005, 26(6): 81-83. DOI:10.13386/ j.issn1002-0306.2005.06.017.
[15] 黄娟, 刘艳, 丁涛, 等. 高效液相色谱-串联质谱法测定食品中曲酸[J].色谱, 2012, 30(6): 578-583. DOI:10.3724/SP.J.1123.2012.02002.
[16] 吕艳芳, 张思涵, 蔡路昀, 等. 南美白对虾酚氧化酶催化不同底物的生化特性研究[J]. 食品工业科技, 2016, 37(23): 139-144. DOI:10.13386/j.issn1002-0306.2016.23.018.
[17] NIRMAL N P, BENJAKUL S. Inhibition kinetics of catechin and ferulic acid on polyphenoloxidase from cephalothorax of Pacif i c white shrimp (Litopenaeus vannamei)[J]. Food Chem istry, 2012, 131(2): 569-573. DOI:10.1016/j.foodchem.2011.09.025.
[18] LIU W, ZOU L Q, LIU J P, et al. The effect of citric acid on the activity, thermodynam ics and conformation of mushroom polyphenoloxidase[J]. Food Chem istry, 2013, 140(1/2): 289-295. DO I:10.1016/ j.foodchem.2013.02.028.
[19] ZAMBRANO-ZARAGOZA M L, GUTIÉRREZ-CORTEZ E, REAL A D, et al. Fresh-cut Red Delicious app les coating using tocopherol/ mucilage nanoemulsion: effect of coating on polyphenol oxidase and pectin methylesterase activities[J]. Food Research International, 2014, 62: 974-983. DOI:10.1016/j.foodres.2014.05.011.
[20] YONGSAWATDIGUL J, PARK J W. Thermal denaturation and aggregation of thread f i n bream actomyosin[J]. Food Chem istry, 2003, 83(3): 409-416. DOI:10.1016/S0308-8146(03)00105-5.
[21] JIA D, YOU J, HU Y, et al. Effect of CaCl2on denaturation and aggregation of silver carp myosin during setting[J]. Food Chem istry, 2015, 185: 212-218. DOI:10.1016/j.foodchem.2015.03.130.
[22] 曹莹莹, 张亮, 王鹏, 等. 超高压结合热处理对肌球蛋白凝胶特性及蛋白二级结构的影响[J]. 肉类研究, 2013, 27(1): 1-7.
[23] 曹栋, 史苏佳, 张永刚, 等. 酰胺I带和酰胺III带测定花生磷脂酶D的α-螺旋和β-折叠含量[J]. 化学通报, 2008(1): 877-880. DOI:10.14159/ j.cnki.0441-3776.2008.11.001.
[24] 刘萍, 刘靖, 祁兴普, 等. 绿色木霉产双功能酶二级结构的FT-IR光谱法分析[J]. 食品科学, 2012, 33(17): 150-153.
[25] 金一琼, 陈周谭, 赖富饶, 等. 曲酸与阿魏酸对酪氨酸酶的抑制作用研究[J]. 现代食品科技, 2012, 28(4): 378-381. DOI:10.3969/ j.issn.1673-9078.2012.04.004.
[26] M ISHRA B B, GAUTAM S, SHARMA A. Purif i cation and characterization of polyphenol oxidase(PPO) from eggplant (Solanum melongena) [J]. Food Chem istry, 2012, 134(4):1855-1861. DOI:10.1016/ j.foodchem.2012.03.098.
[27] SUN N, LEE S, SONG K B. Effect of high-pressure treatment on the molecular properties of mushroom polyphenoloxidase[J]. LWTFood Science and Technology, 2002, 35(4): 315-318. DOI:10.1006/ fstl.2001.0871.
[28] ZHOU L Y, WU J H, HU X S, et al. Alterations in the activity and structure of pectin methylesterase treated by high pressure carbon dioxide[J]. Journal of Agricultural and Food Chem istry, 2009, 57(5): 1890-1895. DOI:10.1021/jf803501q.
[29] ALIZADEH-PASDAR N, LI-CHAN E C Y. Comparison of protein surface hydrophobicity measured at various pH values using three different fluorescent probes[J]. Journal of Agricultural and Food Chem istry, 2000, 48(2): 328-334. DOI:10.1021/jf990393p.
[30] 谢孟峡, 刘媛. 红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J]. 高等学校化学学报, 2003, 24(2): 226-231. DOI:10.3321/ j.issn:0251-0790.2003.02.007.
Effect of Kojic Acid on Enzymatic Activity and Structure of Phenoloxidase from the Shrimp Penaeus vannamei
LÜ Yanfang1,2, ZHANG Yanping2, CAI Luyun2, LI Jianrong2, YANG Mingduo1,*
(1. College of Food Engineering, Harbin University of Commerce, Harbin 150076, China; 2. College of Food Science and Engineering, Bohai University, Jinzhou 121013, China)
Abstract:The effect of kojic acid on the enzymatic activity and structure of phenoloxidase (PO) from Penaeus vannamei was investigated. The PO enzyme purif i ed from shrimp heads was treated with different concentrations (0–1.5 mmol/L) of kojic acid. Kojic acid was found to be able to inhibit PO activity. The type of inhibition was determ ined and the effect of different concentrations (0–1.1 mmol/L) of kojic acid on the spatial structure of the PO enzyme was examined by measuring changes in the intrinsic f l uorescence spectrum, surface hydrophobicity and secondary structure contents. The results showed that the residual PO activity gradually decreased to 9.8% of the initial activity with increasing kojic acid concentration up to 1.5 mmol/ L, and the change in browning index was 3.02, suggesting prominent browning inhibition. Kojic acid could effectively inhibit PO activity, and the type of inhibition was competitive. The intrinsic f l uorescence intensity of PO continuously decreased with increasing kojic acid concentration and the maximum emission wavelength (λmax) was red shifted. The surface hydrophobicity of PO decreased after an initial increase. In addition, as the concentration of kojic acid increased, the α-helix and β-sheet contents decreased, but β-turn and random coil increased. It was speculated that the spatial structure of PO was changed due to its reaction with kojic acid.
Key words:Penaeus vannamei; kojic acid; phenoloxidase; enzymatic activity; tertiary structure; secondary structure
DOI:10.7506/spkx1002-6630-201718004
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2017)18-0022-07
引文格式:
吕艳芳, 张艳平, 蔡路昀, 等. 曲酸对南美白对虾酚氧化酶活性和结构的影响[J]. 食品科学, 2017, 38(18): 22-28. DOI:10.7506/spkx1002-6630-201718004. http://www.spkx.net.cn
LÜ Yanfang, ZHANG Yanping, CAI Luyun, et al. Effect of kojic acid on enzymatic activity and structure of phenoloxidase from the shrimp Penaeus vannamei[J]. Food Science, 2017, 38(18): 22-28. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201718004. http://www.spkx.net.cn
收稿日期:2016-08-28
基金项目:辽宁省科技攻关项目(2015103020)
作者简介:吕艳芳(1977—),女,讲师,博士研究生,研究方向为水产品贮藏加工。E-m ail:lvyan fang2003@126.com
*通信作者:杨铭铎(1956—),男,教授,博士,研究方向为烹饪科学与传统食品工业化技术。E-mail:yangm ingduo5663@163.com