宋兰兰,马春丽*,屈 倩,张 瑞,石静文
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
摘 要:为筛选能改善低盐干酪苦味缺陷的附属发酵剂,从原料乳和Cheddar干酪中分离出21 株乳酸杆菌,对其低温生长情况、产酸性能、自溶性能、氨肽酶比活力、蛋白水解能力及γ-氨基丁酸含量进行评定,采用多元统计法进行分析,结果表明实验菌株C5产酸量小,有高肽酶活性和高自溶性能,同时在蛋白水解能力方面表现出良好的性能,菌株C8氨肽酶比活力较高,菌株C9在蛋白水解能力方面表现出良好的性能,且具有高自溶性能,并且这3 株菌产γ-氨基丁酸浓度均小于5 μmol/L,因此筛选出菌株C5、C8和C9具有改善低盐干酪苦味的潜力,可以作为低盐干酪附属发酵剂的候选菌株。
关键词:低盐干酪;苦味;附属发酵剂;筛选
NaCl可改善干酪风味、硬化凝块和增强防腐作用,它影响干酪中微生物的生长、酶活性、水解作用,进而影响干酪风味、质构及贮存期[1]。根据干酪品种不同,NaCl含量不同。天然干酪中钠质量分数约为1.5%,除高盐Feta或Dom iati(大约4%)外[2]。NaCl含量高,增加高血压、心血管疾病、骨质疏松症、肾结石等发病率[3-4]。而低盐干酪一直倍受欢迎。根据美国食品与药品安全管理局的定义,低盐干酪是指每50 g干酪含钠小于140 mg[5]。但低盐干酪存在一些缺陷:干酪硬度、韧性、脆度减小,蛋白水解大大增加,负面影响感官特性,尤其明显增加酸味和苦味。低盐干酪缺陷(主要是风味方面)影响干酪的消费量,需采用一些方法尽量弥补低盐干酪的风味缺陷[6]。
多种干酪已通过不同方法降低NaCl含量。第1种是通过减少NaCl添加量,减少的量以不引起不良风味为限[7-9];Karahadian等[10]报道低盐干酪与正常盐量干酪相比,低盐Cheddar干酪有不良的感官特性。第2种是使用KCl、M gCl2、CaCl2、乳化盐等替代NaCl[11-13];Ashrafi等[14]用KCl替代NaCl,当KCl替代质量分数高于27.7%时可接受性变差。第3种是使用风味强化剂掩盖风味缺陷,如谷氨酸钠、肌苷酸二钠、鸟苷酸二钠[15];Rodrigues等[16]使用NaCl、KCl、谷氨酸钠的混合盐研究低盐Mozzarella干酪,表明使用混合盐降低54%的NaCl,其感官特性不受影响;还有研究使用乳化盐替代部分钠盐[17]。这些结果大部分可行,大部分干酪可接受,但减少盐量会导致风味变差和苦味增加。
近年有研究使用发酵剂来弥补低盐干酪中的风味缺陷。Karim i等[18]研究Feta干酪减少25% NaCl时,干酪中Lactobacillus casei菌数达到最大且干酪风味可接受。有研究表明降低盐浓度引起发酵剂肽酶与蛋白酶活比值降低,同时发酵剂溶菌能力降低,导致游离氨基酸积累量减少、过多苦味肽形成[19]。因此,将具有高肽酶活性和高自溶性能的菌株作为干酪附属发酵剂可加速苦味肽降解、释放游离氨基酸[20-21],降低干酪苦味[22]。Møller等[23]使用Lactobacillus helveticus CHCC4481增加了苦味肽分解,谷氨酸脱羧酶阴性发酵剂有助于产生少量谷氨酸,Lactobacillus pentosus CHCC13992促使残余柠檬酸转化为增味剂琥珀酸,结果明显改善了低盐Cheddar干酪苦味缺陷。谷氨酸脱羧酶是唯一能催化谷氨酸脱羧转化为γ-氨基丁酸(γ-am ino butyric acid,GABA)的酶,GABA含量越少,谷氨酸量越多。谷氨酸脱羧酶阴性发酵剂(GAD-)的定义为产GABA浓度小于5 μmol/L的乳酸菌菌株[23]。有报道显示少量谷氨酸能产生鲜味,根据鲜味、苦味和酸味的相互作用能达到降低苦味和酸味程度的效果[24]。因此本研究以产酸能力、低温生长情况、自溶度、氨肽酶比活力、蛋白水解能力以及GABA含量为指标,通过多元统计方法筛出综合性能较强的发酵剂菌株,以期为获得优良的低盐干酪附属发酵剂提供菌源。
1.1 材料与试剂
原料乳(新鲜无抗乳)购于哈尔滨市香坊农场完达山奶源基地;金凯利爱尔兰风味切达干酪(淡味,成熟期9 个月)购于哈尔滨市大润发超市。
L-亮氨酸对硝基苯胺(Leu-p-NA)、牛血清白蛋白、考马斯亮蓝G-250 上海麦克林生化科技有限公司;革兰氏染色试剂盒 北京路桥技术股份有限公司;三氯乙酸 上海凌峰化学试剂有限公司;邻苯二甲醛(o-phthaldialdehyde,OPA) 天津市东丽区天大化学试剂厂;Tris 美国Sigma公司;L-谷氨酸 、GABA标准品(99.0%) 上海源叶生物科技有限公司;乙腈(色谱纯) 美国Dikma Pure公司。
乳酸杆菌分离培养使用含2% CaCO3的MRS固体培养基[25]。
1.2 仪器与设备
HPS-160型生化培养箱 哈尔滨东联电子技术开发有限公司;VD-1320超净工作台 北京东联哈尔仪器制造有限公司;Sartorius PB-10型pH计 北京朋利驰科技有限公司;高速冷冻离心机 无锡建仪实验器材有限公司;UV-6000pc紫外-可见分光光度计 北京京科瑞达科技有限公司;超声细胞破碎仪 宁波新芝生物科技股份有限公司;2695型高效液相色谱仪、2489型紫外检测器 美国Waters公司。
1.3 方法
1.3.1 发酵剂乳酸杆菌的分离
无菌条件下取0.5 m L原料乳和干酪1~2 g,加少量无菌生理盐水进行无菌研磨,分别于MRS液体培养基中37 ℃培养48 h;采用平板涂布法在含2% CaCO3的MRS固体培养基上37 ℃培养48 h,挑取有溶钙圈的单菌落,进行平板划线分离,经纯化后挑取具有典型乳酸菌菌落特征的G+,过氧化氢酶阴性乳酸杆菌,接种于MRS固体斜面培养基培养24 h,于4 ℃冰箱中备用。
1.3.2 发酵剂乳酸杆菌的筛选
通过对菌株产酸、低温生长情况、自溶度、氨肽酶比活力、蛋白水解能力及GABA含量测定,综合这些指标筛选出符合低盐干酪附属发酵剂的乳酸杆菌。
1.3.2.1 菌株的活化
将各供试菌株转接至MRS液体培养基中,于37 ℃条件下培养24 h,活化2~3 代,直至恢复活力。
1.3.2.2 菌株在低温条件下生长能力测定
取1 m L已活化好的各菌株培养液,接种于19 m L的MRS液体培养基,在5、10、15 ℃条件下培养 24 h,观察低温条件下菌株生长情况[26]。
1.3.2.3 菌株产酸性能实验
将已活化好的菌株分别以3%接种于灭菌脱脂乳中,接种后于37 ℃条件下培养,分别测定其0、24 h的 pH 值[27]。以ΔpH24表示菌株产酸性能,ΔpH24= pH0-pH24。
1.3.2.4 菌株蛋白水解能力测定
菌株以1%接种量接种于10%脱脂乳中,于37 ℃培养24 h,以未接菌的脱脂乳作为空白。5.00 m L样品、1.00 m L重蒸水和1.00 m L 0.75 mol/L三氯乙酸混匀,静置10 m in,过滤得上清液用于测定菌株蛋白水解能力。采用镉-茚三酮方法[28]测定其游离氨基酸的量。以甘氨酸作标准曲线,结果以mg甘氨酸/L发酵乳表示。
1.3.2.5 菌株氨肽酶比活力测定
参考Ma Chunli等[29]的方法并修改。将菌株培养至稳定生长期,8 000×g、4 ℃离心15 m in,收集菌体细胞,用灭菌的0.85%生理盐水洗涤2 次,得菌体细胞。将菌体细胞悬浮于Tris-HCl缓冲液(50 mmol/L,pH 7.0)中,然后预冷到4 ℃,经超声破碎细胞(130 W,26 m in,工作3 s,间歇5 s)在8 000×g、15 m in、4 ℃离心,去掉细胞碎片,得到的上清液即为菌体无细胞提取液(cell free extracts,CFE),贮存于-20 ℃备用。
取50 μL的Leu-p-NA(16.4 mmol/L)、2.85 m L的Tris-HCl缓冲液(50 mmol/L,pH 7.0)和0.1 m L CFE,混合后于37 ℃培养1 h,加0.5 m L的30%乙酸溶液终止反应,于410 nm波长处比色[30]。CFE的蛋白质质量浓度采用Bradford考马斯亮蓝G-250方法测定[31]。酶活力单位定义:37 ℃时,在410 nm波长处每分钟使吸光度变化0.01 个单位所需酶的数量为1 U。以比活力表示结果,即U/mg蛋白质。
1.3.2.6 菌株自溶度的测定
将已活化好的各菌株冷冻离心(10 000×g,10 min, 4 ℃),得到的菌体悬浮于20 mmol/L、pH 6.8磷酸盐缓冲液中,调整初始A650nm为0.6~0.8,用磷酸盐缓冲液作为空白调零。将悬浮液和空白试剂放置在37 ℃培养24 h,在650 nm波长处分别测定初始和24 h的吸光度[27]。菌体自溶度计算如下:
式中:A0表示菌体初始吸光度;A24表示菌体在24 h后吸光度。
1.3.2.7 GABA含量测定
菌株以1%接种量接种于含0.147 g/L L-谷氨酸的10%脱脂乳中,37 ℃培养3 d。取上述培养液5 m L与 1 m L 30 g/100 m L三氯乙酸混匀,8 000×g、4 ℃离心20 m in。用高效液相色谱法测定GABA含量。
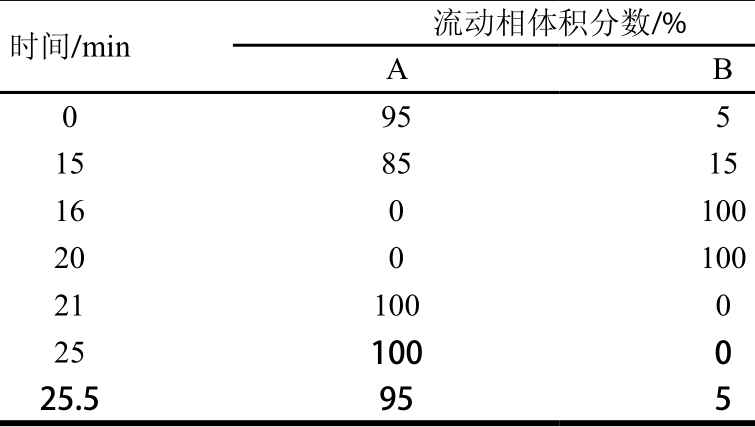
色谱条件参照文献[32],略有改动。色谱柱采用Tris-Sal Plus C18柱(4.6 mm×250 mm,5 μm);紫外检测器,检测波长为333 nm;流动相:流动相A为90 mmol/L pH 6.5乙酸钠溶液,含7%乙腈,流动相B为80%乙腈溶液;梯度洗脱程序如表1所示;流速1 m L/m in;柱温30 ℃;进样量10 μL。经OPA柱前衍生反应2 min,进样。
表1 HPLC梯度洗脱程序
Table 1 G radient elution program of HPLC
注:A. 90 mmol/L pH 6.5乙酸钠溶液,含7%乙腈;B. 80%乙腈溶液。
2.1 样品中乳酸杆菌的分离
挑取典型菌落接种于2% CaCO3的MRS固体培养基上,划线分离得到35 株纯培养菌株。镜检观察后保留21 株革兰氏阳性无芽孢杆菌。干酪来源的菌株编号为C1、C2、C3、C4、C5、C6、C7、C8、C9、C10、C11;原料乳来源的菌株编号为M 1、M 2、M 3、M 4、M 5、M 6、M 7、M 8、M 9、M 10。
2.2 发酵剂乳酸杆菌的筛选
2.2.1 菌株在低温条件下的生长能力分析
干酪成熟温度一般为5~15 ℃,所以对各菌株低温条件下生长情况进行实验,这也是低盐干酪生产的重要条件。由表2可知,所有菌株在5 ℃环境下均能生存但生长状况不佳,而随着温度升高,菌株生长状态趋于良好,这与江丽红[26]研究结果一致。因此所有实验菌株均能在干酪成熟温度下生长,符合低盐干酪附属发酵剂筛选条件之一。
表2 菌株低温生长情况
Table 2 Grow th status of strains at low temperatures
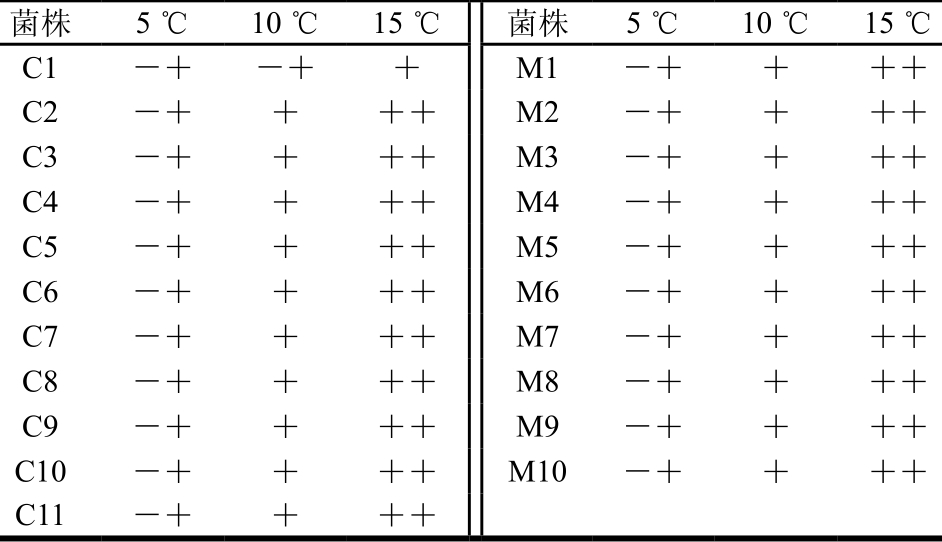
注:-+.略有生长;+.生长;++.生长较强。
2.2.2 实验菌株产酸能力比较
附属发酵剂对干酪产酸、凝乳作用不大,并且低盐干酪易产生酸味缺陷,应筛选产酸能力弱的菌株。21 株乳杆菌产酸能力如表3所示,可以看出,菌株C3、C4产酸能力最弱,ΔpH24分别为0.46、0.50,其次是菌株C1、C5、C11、M 5、M 7,ΔpH24均小于1,其余菌株ΔpH24均大于1,尤其菌株C2产酸最多,ΔpH24为2.38。此结果与Nieto-Arribas等[27]的研究结果菌株间产酸存在显著差异相一致。
表3 21 株菌株产酸能力
Table 3 Acid-producing activities of 21 strains

注:不同小写字母表示差异显著(P<0.05)。下同。
2.2.3 菌株蛋白水解能力
乳酸菌的适度蛋白水解对改善干酪风味和质地是必不可少的,蛋白水解产生的各种氨基酸和肽是许多风味物质的前体物质。然而强蛋白水解能力产生过量的游离氨基酸,引起苦味肽及不良物质的生成,同时使干酪质地变软[33]。
表4 21 株菌株蛋白水解能力
Table 4 Proteolytic activities of 21 strains
mg/L

由表4可知,2 1 株菌株蛋白水解能力为6.29~40.59 mg/L,不同菌株之间蛋白水解能力差异显著(P<0.05),发酵脱脂乳24 h后菌株C5、C9和C7释放更多的游离氨基酸,其水解能力分别为40.59、35.64、32.53 mg/L。而菌株C1、C2、C3、C4、C8、C10、C11、M 1、M 3、M 4和M 5在21 株菌株中蛋白水解能力次之,水解能力为22.95~30.32 mg/L。此结果与Nieto-Arribas等[27]的研究结果菌株间蛋白水解能力存在显著差异相一致。
2.2.4 菌株氨肽酶比活力
乳酸菌产生的氨肽酶是一类从多肽链的氮末端顺序逐个水解氨基酸的胞内酶,具有降解苦味肽的作用,可以降低低盐干酪苦味,同时加速干酪成熟[34]。菌株的高氨肽酶活性是选择低盐干酪附属发酵剂的重要指标之一。

图1 21 株菌株氨肽酶活性
Fig. 1 Aminopeptidase activity of 21 strains
由图1可知,21 株菌株氨肽酶比活力相差较大,在17.48~126.59 U/m g之间变化,不同菌株之间氨肽酶比活力差异显著(P<0.05),该结果与Azarnia等[35]结论一致。菌株C5、C6、C8、C11、M 5氨肽酶比活力显著高于其他菌株,分别为114.30、126.59、111.78、114.95、124.00 U/mg,并且这5 株菌株间差异不显著(P>0.05)。菌株C1、M 7、M 8和M 10氨肽酶比活力相对弱,分别为22.88、25.98、17.48、21.56 U/mg。
2.2.5 自溶度结果
细胞自溶是干酪体系中微生物释放出胞内酶从而作用反应底物的过程。所以,低盐干酪成熟过程中,附属发酵剂细胞快速自溶促进了胞内肽酶及早释放并在干酪中保持活性,使苦味肽进一步分解为游离氨基酸,降低低盐干酪苦味。

图2 21 株菌株的自溶度
Fig. 2 Autolytic activity of 21 strains
由图2可知,2 1 株菌株的自溶度范围为6.64%~36.5%,分布较广,根据Ayad等[36]对菌株自溶度能力的划分,自溶度能力强的菌株为C1、C2、C3和M 5,其值分别为36.05%、26.16%、33.83%和36.50%;自溶度能力中等的菌株分别为C4、C5、C6、C7、C9、C10、C11、M 3、M 7和M 10,其值在16.36%~23.78%之间。这与江丽红[26]研究结果菌株间自溶性存在显著差异一致。
2.2.6 菌株发酵特性的多元统计筛选
以产酸、蛋白水解能力、氨肽酶比活力和自溶度为筛选指标应用主成分分析法对21 株菌株进行复筛,结果见表5。
表5 解释的总方差
Table 5 Total variance explained

由表5可知,前两个主成分的累计贡献率达到74.19%,因此,这两个主成分可以反映21 株菌株的特性,所以接下来选前两个主成分进行分析。利用载荷矩阵与特性向量之间的关系,计算出载荷表达方式为:Y1=-0.545X1+0.614X2+0.454X3+0.346X4;Y2=0.373X1+0.277X2+0.582X3-0.668X4。式中:X1、X2、X3和X4分别为菌株的产酸能力、蛋白水解能力、氨肽酶比活力和自溶度。采用主成分得分的方法进行选择,并通过得分顺序来获得优势菌株,得分越高观测项所包含的信息也就越多,越拥有利用的价值,结果见表6。由表6可知,菌株C5、C11、C9、M 5和C8的综合得分较高,菌株C5、C9和M 5蛋白水解能力和氨肽酶比活力高,同时菌株M 5自溶度能力较强;而菌株C5、C9和C11自溶度能力中等;菌株C8和C11在氨肽酶比活力表现出良好的性能。本研究筛选在产酸、蛋白水解能力、氨肽酶比活力、自溶4个方面具有优良发酵性能的菌株,因此最后选择C5、C8、C9、C11和M 5作为低盐干酪附属发酵剂进一步筛选菌株。
表6 21 株菌株的综合得分以及排名结果
Table 6 Principal component scores and ranking of 21 strains

2.2.7 GABA含量测定结果
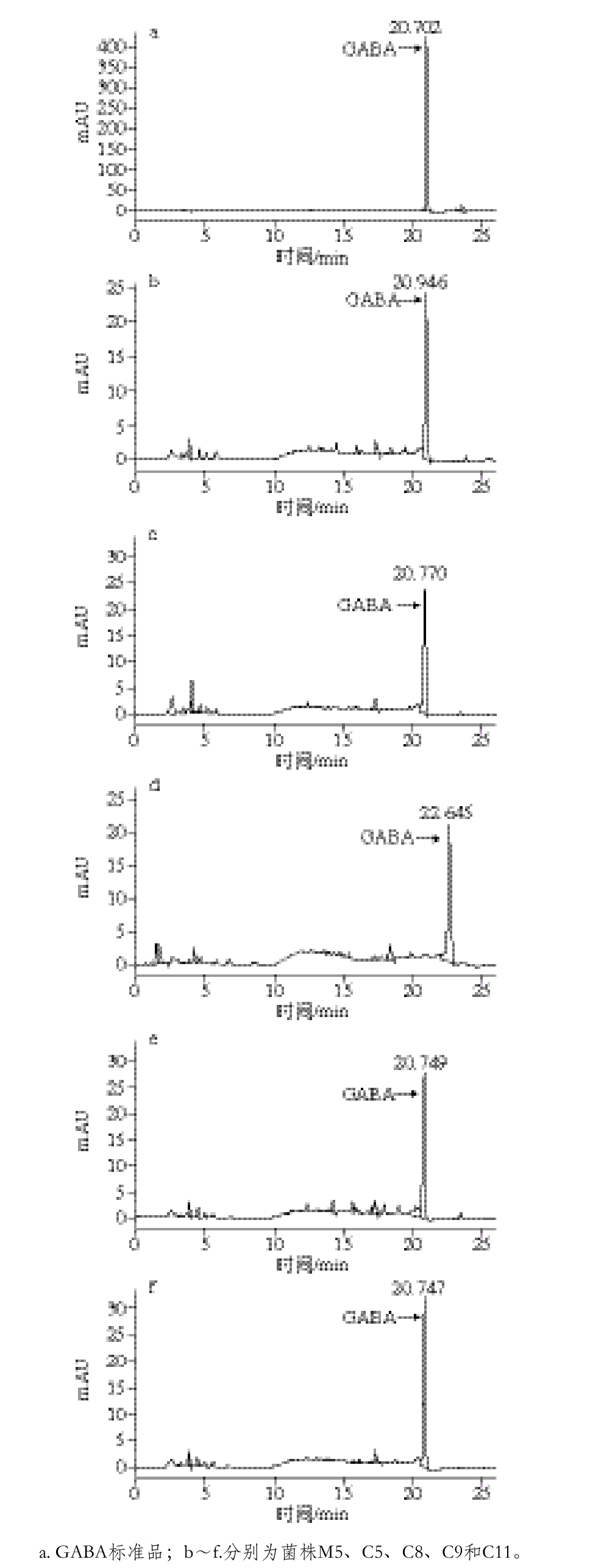
图3 GABA含量测定的高效液相色谱图
Fig. 3 HPLC chromatograms of GABA standard and GABA produced by fi ve selected strains
GABA标准品和各菌株发酵乳中产GABA含量的结果如图3所示。根据鲜味、苦味和酸味相互作用能达到降低苦味的效果,并且根据Møller等[23]对谷氨酸脱羧酶阴性发酵剂的定义,应选择GABA浓度低于5 μmol/L(质量浓度5.16×10-4mg/m L)的菌株,由表7可知,C5、C8和C9符合条件,适合作为低盐干酪附属发酵剂。
表7 5 株乳酸杆菌发酵液GABA含量的测定
Table 7 The amounts of γ-aminobutyric acid produced by the f i ve strains

注:nr.未检出。
从原料乳和Cheddar干酪中筛选出21 株乳杆菌,筛选低产酸能力、低温生长良好、高自溶度、高氨肽酶比活力、高蛋白水解能力和GABA含量低于5 μmol/L的菌株,结果筛选出符合低盐干酪生产的菌株为C5、C8和C9,具备开发低盐干酪附属发酵剂的潜力,以期达到降低低盐干酪苦味的目的。
参考文献:
[1] 王芳, 张昊, 郭慧媛, 等. 减少干酪中的钠含量: 科研及工业应用[J].中国乳业, 2011(2): 48-51. DOI:10.3969/j.issn.1671-4393.2011.02.013.
[2] 罗洁, 任发政, 王紫薇, 等. 干酪质构与风味控制技术研究进展[J]. 农业机械学报, 2016, 47(1): 190-201. DO I:10.6041/ j.issn.1000-1298.2016.01.025.
[3] JEW S, ABUMWEIS S S, JONES P J. Evolution of the human diet: linking our ancestral diet to modern functional foods as a means of chronic disease prevention[J]. Journal of Medicinal Food, 2009, 12(5): 925-934. DOI:10.1089/jm f.2008.0268.
[4] M INHAS R. Em inence-based guidelines: a quality assessment of the second Joint British Societies’ guidelines on the prevention of cardiovascular disease[J]. International Journal of Clinical Practice, 2007, 61(7): 1137-1144. DOI:10.1111/j.1742-1241.2007.01310.x.
[5] FDA. Nutrient content claims for the sodium content of foods[S]. Washington, USA: Department of Health and Human Services, 2008.
[6] MURTAZA M A, HUMA N, SAMEEN A, et al. Texture, flavor, and sensory quality of buffalo milk Cheddar cheese as inf l uenced by reducing sodium salt content[J]. Journal of Dairy Science, 2014, 97(11): 6700-6707. DOI:10.3168/jds.2014-8046.
[7] RULIKOWSKA A, K ILCAWLEY K N, DOOLAN I A, et al. The im pact o f reduced sodium ch loride content on Cheddar cheese quality[J]. International Dairy Journal, 2013, 28(2): 45-55. DOI:10.1016/ j.idairyj.2012.08.007.
[8] CATARINA S, LUISA F A, BEN ILDE M, et al. The effect of lowering salt on the physicochem ical, m icrobiological and sensory properties of São João cheese of Pico Island[J]. International Journal of Dairy Technology, 2015, 68(3): 409-419. DOI:10.1111/1471-0307.12198.
[9] 任星环, 任发政, 雷蕾. NaCl含量对Mozzarella干酪品质的影响[J]. 食品科学, 2004, 25(11): 89-94. DOI:10.3321/j.issn:1002-6630.2004.11.014.
[10] KARAHADIAN C, LINDSAY R C. Flavor and textural properties of reduced-sodium process American cheeses[J]. Journal of Dairy Science, 1984, 67(9): 1892-1904. DOI:10.3168/jds.S0022-0302(84)81522-2.
[11] THIBAUDEAU E, ROY D, ST-GELAIS D. Production of brine-salted Mozzarella cheese with different ratios of NaCl/KCl[J]. International Dairy Journal, 2015, 40: 54-61. DOI:10.1016/j.idairyj.2014.07.013.
[12] M∅LLER K K, RATTRAY F P, BREDIE W L P, et al. Physicochem ical and sensory characterization of Cheddar cheese with variable NaCl levels and equal moisture content[J]. Journal of Dairy Science, 2013, 96(4): 1953-1971. DOI:10.3168/jds.2012-5524.
[13] MCMAHON D J, OBERG C J, DRAKE M A, et al. Effect of sodium, potassium, magnesium, and calcium salt cations on pH, proteolysis, organic acids, and microbial populations during storage of full-fat Cheddar cheese[J]. 2014, 97(8): 4780-4798. DOI:10.3168/jds.2014-8071.
[14] ASHRAFI R, BARI M R, KHOSROSHAHI A, et al. Minim ization of sodium in Iranian white brined cheese[J]. Asian Journal of Chem istry, 2009, 21(3): 1995-2004.
[15] GRUMMER J, BOBOWSKI N, KARALUS M, et al. Use of potassium chloride and f l avor enhancers in low sodium Cheddar cheese[J]. Journal of Dairy Science, 2013, 96(3): 1401-1418. DOI:10.3168/jds.2012-6057.
[16] RODRIGUES J F, GONCALVES C S, PEREIRA R C, et al. Utilization of temporal dominance of sensations and time intensity methodology for development of low-sodium Mozzarella cheese using a m ixture of salts[J]. Journal of Dairy Science, 2014, 97(8): 4733-4744. DOI:10.3168/jds.2014-7913.
[17] 罗洁, 张昊, 郭慧媛, 等. 乳化盐在干酪中应用的研究进展[J]. 中国乳业, 2011(3): 40-43. DOI:10.3969/j.issn.1671-4393.2011.03.013.
[18] KARIMI R, MORTAZAVIAN A M, KARAM I M. Incorporation of Lactobacillus casei, in Iranian ultraf i ltered Feta cheese made by partial replacement of NaCl with KCl[J]. Journal of Dairy Science, 2012, 95(8): 4209-4222. DOI:10.3168/jds.2011-4872.
[19] M∅LLER K K, RATTRAY F P, H∅IER E, et al. Manufacture and biochem ical characteristics during ripening of Cheddar cheese w ith variable NaCl and equal moisture content[J]. Dairy Science & Technology, 2012, 92(5): 515-540. DOI:10.1007/s13594-012-0076-3.
[20] DAKO E, SODA M E, VUILLEMARD J C, et al. Autolytic properties and am inopeptidase activities of lactic acid bacteria[J]. Food Research International, 1995, 28(5): 503-509. DOI:10.1016/0963-9969(95)00032-1.
[21] HANNON J A, WILKINSON M G, DELAHUNTY C M, et al. Use of autolytic starter systems to accelerate the ripening of Cheddar cheese[J]. International Dairy Journal, 2003, 13(4): 313-323. DOI:10.1016/S0958-6946(02)00178-4.
[22] RUYSSEN T, JANSSENS M, VAN GASSE B, et al. Characterisation of Gouda cheeses based on sensory, analytical and high-f i eld1H nuclear magnetic resonance spectroscopy determ inations: effect of adjunct cultures and brine composition on sodium-reduced Gouda cheese[J]. International Dairy Journal, 2013, 33(2): 142-152. DO I:10.1016/ j.idairyj.2013.04.009.
[23] M∅LLER K K, RATTRAY F P, ARDÖ Y. App lication of selected lactic acid bacteria and coagulant for improving the quality of low-salt Cheddar cheese: chem ical, m icrobiological and rheological evaluation[J]. International Dairy Journal, 2013, 33(2): 163-174. DO I:10.1016/ j.idairyj.2013.05.015.
[24] BRESLIN P A S. Interactions among salty, sour and bitter compounds[J]. Trends in Food Science & Techno logy, 1996, 7(12): 390-399. DOI:10.1016/S0924-2244(96)10039-X.
[25] 李远宏, 吕凤霞, 邹晓葵, 等. 鲜奶中产γ-氨基丁酸乳酸菌株的筛选与鉴定[J]. 食品科学, 2010, 31(15): 198-202.
[26] 江丽红. 切达奶酪附属发酵剂的筛选及其在促熟中的应用[D].无锡: 江南大学, 2014.
[27] NIETO-ARRIBAS P, POVEDA J M, SESEÑA S, et al. Technological characterization of Lactobacillus isolates from traditional Manchego cheese for potential use as adjunct starter cultures[J]. Food Control, 2009, 20(12): 1092-1098. DOI:10.1016/j.foodcont.2009.03.001.
[28] FOLKERTSMA B, FOX P F. Use of the Cd-ninhydrin reagent to assess proteolysis in cheese during ripening[J]. Journal of Dairy Research, 1992, 59(2): 217-224. DOI:10.1017/S0022029900030466.
[29] MA C L, ZHANG L W, YI H X, et al. Technological characterization of Lactococci isolated from traditional Chinese fermented m ilks[J]. Journal of Dairy Science, 2011, 94(4): 1691-1696. DOI:10.3168/jds.2010-3738.
[30] PAN D aodong, LUO Yongkang, TANOKURA M, et al. Antihypertensive peptides from skimmed milk hydrolysate digested by cell-free extract of Lactobacillus helveticus JCM1004[J]. Food Chemistry, 2005, 91(1): 123-129. DOI:10.1016/j.foodchem.2004.05.055.
[31] BRADFORD M M. A Rapid method for the quantitation of m icrogram quantities of protein utilizing the princip le of protein-dye binding[J]. Analytical Biochem istry, 2015, 72(s1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[32] ZHAO M, MA Y, WEI Z Z, et al. Determ ination and comparison of γ-am inobutyric acid (GABA) content in Pu-erh and other types of Chinese tea[J]. Journal of Agricultural & Food Chem istry, 2011, 59(8): 3641-3648. DOI:10.1021/jf104601v.
[33] BUFFA M, MORA IS J, JIMÉNEZ-BELENGUER A, et al. Technological characterisation of lactic acid bacteria isolated from raw ewes’ m ilk for cheese making[J]. M ilchw issenschaft-M ilk Science International, 2006, 61(4): 404-407.
[34] CHUNLI M A, ZHANG L, DEXING M A, et al. Technological characterisation of Lactobacilli, isolated from Chinese artisanal fermented m ilks[J]. International Journal of Dairy Technology, 2012, 65(1): 132-139. DOI:10.1111/j.1471-0307.2011.00743.x.
[35] AZARNIA S, LEE B H, YAYLAYAN V, et al. Proteolysis development in enzyme-modified Cheddar cheese using natural and recombinant enzymes of Lactobacillus rhamnosus, S93[J]. Food Chemistry, 2010, 120(1): 174-178. DOI:10.1016/j.foodchem.2009.10.003.
[36] AYAD E H E, NASHAT S, EL-SADEK N, et al. Selection of wild lactic acid bacteria isolated from traditional Egyptian dairy products according to production and technological criteria[J]. Food M icrobiology, 2004, 21(6): 715-725. DOI:10.1016/j.fm.2004.02.009.
Screening of Strains of Adjunct Culture for Improving Bitterness of Low-Sodium Cheese
SONG Lanlan, MA Chunli*, QU Qian, ZHANG Rui, SHI Jingwen
(Key Laboratory of Dairy Science, Ministry of Education, College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:With the aim of counteracting the bitterness of low-sodium cheese, 21 Lactobacillus strains isolated from raw m ilk and Cheddar cheese were evaluated for low-temperature growth, acid-producing capacity, autolytic activity, aminopeptidase activity, proteolytic activity and gamma-am inobutyric acid (GABA) content. The isolated strains were analyzed further by multivariate statistical method. The results showed that strain C5 presented not only low acid-producing activity, high am inopeptidase activity and high autolytic activity, but also high proteolytic capacity; strain C8 displayed higher aminopeptidase activity; strain C9 exhibited higher proteolytic capacity in addition to higher autolytic activity. In addition, the fermentation broth of all the three strains contained lower than 5 μmol/L GABA. Therefore, they had the potential to improve the bitterness of low-sodium cheese, and could be the good candidates of adjunct cultures for low-sodium cheese production.
Key words:low-sodium cheese; bitterness; adjunct cultures; screening
DOI:10.7506/spkx1002-6630-201718006
中图分类号:TS252.53
文献标志码:A
文章编号:1002-6630(2017)18-0035-07
引文格式:
宋兰兰, 马春丽, 屈倩, 等. 改善低盐干酪苦味附属发酵剂菌株的筛选[J]. 食品科学, 2017, 38(18): 35-41. DOI:10.7506/
spkx1002-6630-201718006. http://www.spkx.net.cn
SONG Lanlan, MA Chunli, QU Qian, et al. Screening of strains of adjunct culture for improving bitterness of low-sodium cheese[J]. Food Science, 2017, 38(18): 35-41. (in Chinese w ith English abstract)
DOI:10.7506/spkx1002-6630-201718006. http://www.spkx.net.cn
干酪被称为“奶黄金”,含有优质蛋白、碳水化合物、有机酸、微量元素、维生素等具有重要生理功能的物质。
收稿日期:2016-11-08
基金项目:黑龙江省教育厅科学技术研究面上项目(12521026)
作者简介:宋兰兰(1990—),女,硕士研究生,研究方向为乳品科学。E-m ail:song lan lan29@163.com
*通信作者:马春丽(1978—),女,副教授,博士,研究方向为乳品科学。E-m ail:m achun li8@163.com