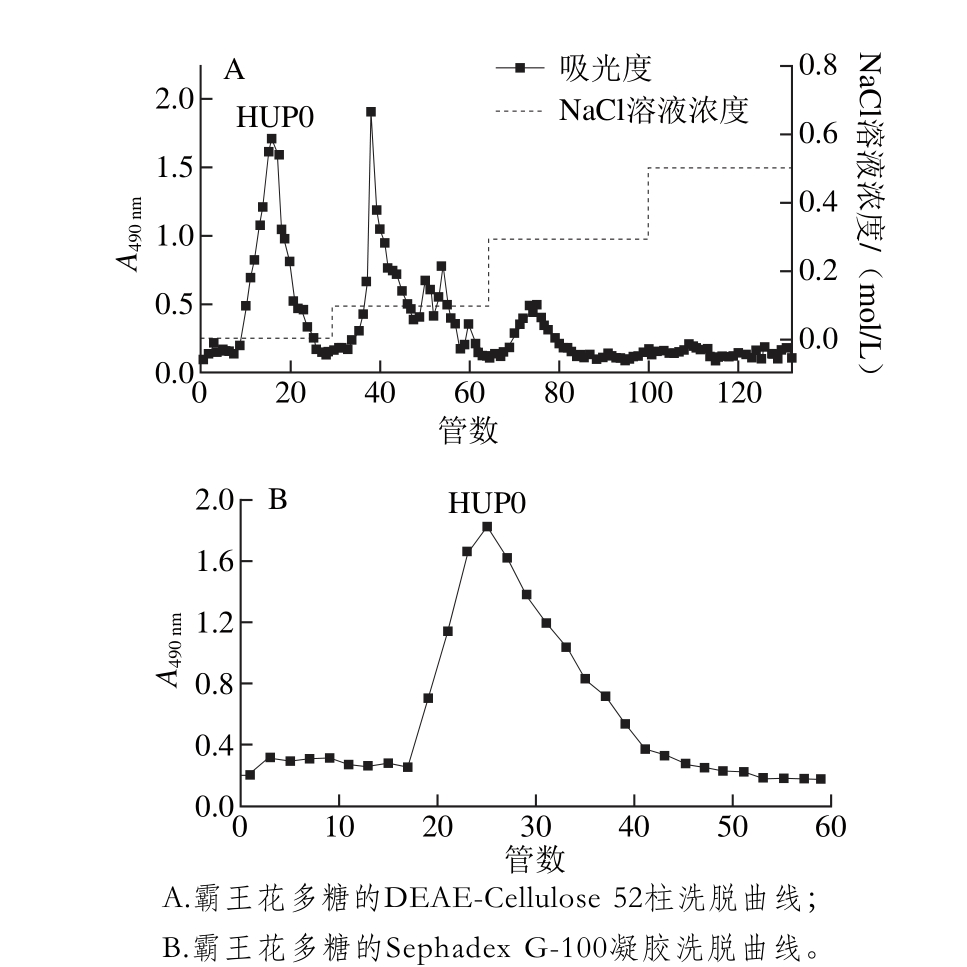
图1 霸王花多糖洗脱曲线
Fig. 1 Elution curve of polysaccharide
何慕雪1,孟凡成1,王春明1,李绍平1,王 英2,叶文才2,张庆文1,*
(1.澳门大学中华医药研究院,中药质量研究国家重点实验室,澳门 999078;2.暨南大学中药及天然药物研究所,广东 广州 510632)
摘 要:目的:从霸王花中提取分离和纯化多糖,并对其理化性质、光谱学特征和结构特征进行研究。方法:霸王花经水提醇沉、脱蛋白、冷冻干燥得到水溶性粗多糖(hylocereus undatus po lysaccharide,HUP),再通过DEAE-Cellulose 52纤维素柱和Sephadex G-100凝胶柱层析分离纯化,得到1种水溶性均一多糖HUP0。对获得的纯化组分采用傅里叶变换红外光谱(Fourier transform in frared spectroscopy,FT-IR)、高效分子排阻色谱、气相色谱-质谱联用和核磁共振波谱(nuclear magnetic resonance,NMR)等方法进行化学结构分析。结果:经纯化后得到均一的霸王花多糖样品HUP0,分子质量为33.24 kD,特性黏度(η)为47.16 m L/g,比旋度为+69°,平均粒径为196.96 nm;FT-IR图谱结果表明HUP0是中性糖且以β-构型为主;结合高效液相色谱、单糖组成、甲基化分析、NMR对HUP0的结构进行鉴定分析后,表明HUP0为(1→4)-β-D-半乳聚糖。
关键词:霸王花;多糖;结构特征;半乳聚糖
本研究主要以霸王花为原料,通过水提醇沉、脱蛋白、冷冻干燥得到霸王花粗多糖,利用DEAE-Cellulose 52纤维素柱和Sephadex G-100凝胶柱层析等现代分离手段,纯化得到高纯度的霸王花多糖,并对其理化性质、光谱学特性及结构特征等进行了研究。
1.1 材料与试剂
实验用霸王花药材购于广州市清平药材市场,经暨南大学中药及天然药物研究所周光雄教授鉴定为仙人掌科量天尺属植物量天尺(Hylocereus undatus (Haw.) Britt.et Rose)的花,标本(ICMS20071009A)保存于澳门大学中华医药研究院。
甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖等单糖标准品(分析纯)美国Sigma-Aldrich公司;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazalone,PMP)、醋酐、硼氢化钠、二甲基亚砜、碘甲烷等试剂(均为分析纯) 上海Aladdin公司; DEAE-Cellulose 52纤维素柱 美国Whatman公司;Sephadex G-100凝胶柱 美国GE Healthcare公司。
1.2 仪器与设备
NanoSight NS500纳米颗粒分析仪 英国Malvern公司;341 LC精密旋光仪 美国PerkinElmer公司;1200高效液相色谱仪 美国Agilent公司;FT-IR 100型傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR) 美国PerkinElmer公司;Trace 1300 ISQ LT型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 美国Therm o Fisher公司;Bruker Ascend-600型核磁共振仪 瑞士Bruker公司。
1.3 方法
1.3.1 提取与分离纯化
称取烘干后的霸王花1.8 kg,加料液比为1∶10(g/mL)的无水乙醇,回流提取脱脂3 次,每次2 h,脱脂后的药渣放置在通风橱中干燥过夜。干燥后的药渣加1∶10(g/m L)的蒸馏水加热提取3 次,每次2 h。用纱布趁热过滤,滤液合并减压浓缩,浓缩液加4 倍体积的无水乙醇,醇沉室温过夜。离心,沉淀用乙醇冲洗后在烘箱中干燥。干燥后的样品溶于蒸馏水,用Sevag试剂(氯仿-正丁醇(4∶1,V/V)脱蛋白[16],静置分层后除去溶剂层和水层交接处的蛋白质,得到的水相溶液再次用无水乙醇沉淀,沉淀烘干后复溶于蒸馏水,离心,取上清液冻干,称量,得到霸王花粗多糖(hylocereus undatus polysaccharide,HUP)。
取1.5 g HUP溶于100 m L蒸馏水中,离心,将上清液上样于DEAE-Cellulose 52纤维素柱(26 cm×5 cm,50 mm),依次用含有0、0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液梯度洗脱,流速为0.8 m L/m in,10 m in收集1 管,自动收集洗脱液,用苯酚-硫酸法检测。检测结果表明用蒸馏水洗脱的组分单一且含量高,收集该部分的样品,合并,浓缩。进一步纯化水洗脱下来的组分,将浓缩后的样品离心,将上清液上样于Sephadex G-100凝胶柱(138 cm×2 cm,40~120 mm),用蒸馏水洗脱,流速为0.6 m L/m in,12 m in收集1 管,自动收集洗脱液,用苯酚-硫酸法检测[17]。合并样品,浓缩,冻干,得到水洗脱部分的纯化多糖样品HUP0。
1.3.2 HUP基本成分和含量测定
粗多糖样品HUP的总糖含量使用苯酚-硫酸法测定,以葡萄糖作为标准品绘制标准曲线,用酶标仪在490 nm波长下测得粗多糖样品的吸光度,根据标准曲线可得到相应的粗多糖样品浓度,计算其含量[18]。粗多糖HUP的蛋白质含量测定使用考马斯亮蓝法,以牛血清白蛋白作为标准品绘制标准曲线,在酶标仪595 nm波长下测定粗多糖样品的吸光度,计算其含量[19]。粗多糖HUP的糖醛酸含量测定使用间羟基联苯法,以葡萄糖醛酸作为标准品绘制标准曲线,在酶标仪529 nm波长下测定粗多糖样品的吸光度,计算其含量[20]。
1.3.3 多糖HUP0理化性质测定
1.3.3.1 特性黏度的测定
精确称取HUP0多糖样品40.0 m g溶于20 m L蒸馏水中,按照《中国药典》(2015版)二部附录[21],利用乌式黏度计测定。样品和溶剂各重复测定2 次,2 次测定值相差不得超过0.1 s,取2 次的平均值为流出时间,按公式计算得出特性黏度。
1.3.3.2 比旋光度测定
精确称取HUP0多糖样品2.00 m g溶于2 m L蒸馏水中,按照《中国药典》(2015版)二部附录,于20 ℃进行比旋光度测定。
1.3.3.3 粒径测定
精确称取HUP0多糖样品2.00 m g溶于2 m L蒸馏水中,稀释成100 µg/m L,取1 m L用NanoSight NS500纳米颗粒分析仪测定其粒径大小。
1.3.4 多糖HUP0纯度及分子质量测定
利用高效分子排阻色谱-多角度激光光散射检测器-示差折光检测器(high perfom ance size exclusion chromatography-multi-angle laser light scattering detectordifferential refraction detector,HPSEC-MALLS-RID)联用测定霸王花多糖样品H U P 0的分子质量[22]。取2 m g多糖样品H U P 0,溶于1 m L质量分数0.9% N aC l溶液,过0.45 mm膜,进样。色谱柱:TSK-Gel G 6000PWXL(300 mm×7.8 mm,13 mm)和TSK-GEL G3000PWXL(300 mm×7.8 mm,6 mm);进样量50 µL;检测波长:658 nm;流动相:0.9% NaCl溶液;流速:0.5 m L/m in。数据处理和分析采用激光光散射操作软件。
1.3.5 多糖HUP0 FT-IR分析
取2 mg HUP0样品加适量干燥的KBr粉末进行压片,保持环境干燥,利用FT-IR在4 000~400 cm-1范围内扫描,初步分析纯化后的多糖样品HUP0的结构。
1.3.6 多糖HUP0单糖组成分析
采用PMP柱前衍生高效液相色谱(high performance liquid chromatography,HPLC)测定霸王花多糖样品HUP0的单糖组成[23]。取3 mg的HUP0冻干样品,溶于3 m L三氟乙酸(trifluoroacetic acid,TFA)溶液(2 mol/L)中,100 ℃水解8 h。待水解产物冷却至室温,旋干,加甲醇除去多余的TFA溶液,重复3 次,旋干。水解完的干燥样品溶于200 µL的蒸馏水中,溶液中加入200 µL 0.5 mol/L的PMP溶液和200 µL 0.3 mol/L的NaOH溶液,该混合溶液在70 ℃进行衍生化反应1 h。衍生化反应产物冷却至室温,加200 µL 0.3 mo l/L HCl溶液中和,中和后的反应液加1 m L的氯仿溶液萃取,重复3 次,离心(4 000 r/m in,10 m in)取水相,过0.22 µm微孔滤膜,待HPLC进样分析。各单糖标准品也如上进行衍生化反应,得到的水相过膜进样。色谱柱:RP-C18Column(250 mm×4.6 mm,25~40 mm);流动相:A相为7 g/L醋酸钠缓冲盐溶液(pH 5.5,加醋酸调节pH值),B相为乙腈;梯度洗脱:0~20 m in 18% B相,20~50 m in 18%~24% B相;柱温:25 ℃;检测波长:245 nm;流动相流速:1 m L/m in;进样体积:10 µL。1.3.7 多糖HUP0甲基化分析
采用改良的Hakomori法对多糖样品HUP0进行甲基化反应[24]。取16 mg冻干的多糖样品HUP0,加2 m L二甲基亚砜溶液和干燥的NaOH粉末,无水氮气环境下搅拌过夜。在无水冰浴条件下,缓慢滴加1 m L碘甲烷溶液,逐滴加入防止碘甲烷挥发,搅拌过夜。在反应体系中滴加1 m L蒸馏水终止反应,停止搅拌。反应产物用二氯甲烷萃取3 次,取二氯甲烷萃取相,氮吹干燥。取少量干燥的甲基化产物进行FT-IR测定,通过FT-IR结果判断甲基化反应是否完全,如果反应不完全则重复多次甲基化反应,直至红外图谱中羟基峰消失[25]。甲基化产物完全酸水解:加入3 m L 2 mol/L TFA溶液,于100 ℃水解8 h至甲基化产物完全水解。水解产物加适量还原剂NaBH4和NaOH粉末,超声,静置进行还原反应,反应后加乙酸除去过多的还原剂,旋转蒸干,加甲醇3 次除去硼酸,旋转蒸干。还原产物加乙酸酐和吡啶各500 µL,室温静置过夜进行乙酰化反应。乙酰化产物旋干,加甲醇,旋转蒸干,重复3次后用甲醇溶解,过0.22 µm微孔滤膜,进样用GC-MS分析。
GC-MS分析条件:色谱柱:Agilent 122-5532 DB-5MS(30 m×0.25 mm,0.25 µm);升温程序:初始柱温为130 ℃,保持2 m in,以6.5 ℃/m in的升温速度将柱温升至170 ℃,保持0 m in,再用2.8 ℃/m in升温速度升至250 ℃,保持9 m in;载气(He)流速1.0 m L/m in;进样口温度:250 ℃;进样量:1 µL;分流比:30∶1。
1.3.8 多糖HUP0核磁共振波谱测定
取干燥的HUP0多糖样品20 mg,溶解于0.6 m L D2O中,加3 0 µL氘代丙酮为内标。用核磁共振仪(600 MHz)进行分析。
2.1 粗多糖HUP分离纯化
霸王花药材经干燥、粉碎、脱脂风干、沸水提取、乙醇沉淀、脱蛋白和冷冻干燥后,得到霸王花水提粗多糖(HUP),得率为8.09%。如图1A所示,利用DEAE-Cellu lose 52柱对霸王花粗多糖HUP进行初步纯化,水洗脱的多糖组分HUP0为单一峰且含量大,0.1 m o l/L NaCl溶液洗脱的多糖组分成分复杂,0.2~0.5 mol/L NaCl溶液洗脱的多糖组分含量少不利于分离纯化。综上所述,本实验对水洗脱的多糖组分HUP0进行进一步纯化和结构解析的研究。如图1B所示,利用Sephadex G-100凝胶柱对HUP0进一步纯化,得到单一洗脱对称峰,说明经过纯化后霸王花多糖样品HUP0为均一多糖。将得到的多糖样品HUP0进行收集、合并、浓缩和冻干,用于进一步的研究与分析。

图1 霸王花多糖洗脱曲线
Fig. 1 Elution curve of polysaccharide
2.2 粗多糖HUP的基本成分和含量
利用苯酚-硫酸法测得霸王花粗多糖HUP中的多糖质量分数为67.06%,反应后溶液呈淡黄色;通过考马斯亮蓝法可测得粗多糖的蛋白质质量分数为18.04%;根据间羟基联苯法,粗多糖中糖醛酸的质量分数为26.65%。
2.3 多糖HUP0理化性质分析
乌氏黏度计2次测定值没有超过0.1 s,2次测定值的平均值代入公式,得到多糖样品HUP0的特性黏度(η)为47.16 m L/g。实验中配制1 mg/m L的多糖样品HUP0,旋光仪在20 ℃测得比旋度为+69°。用NanoSight NS500纳米颗粒分析仪检测质量浓度为100 µg/m L的多糖样品的粒径大小,得到HUP0的平均粒径为196.96 nm。
2.4 多糖HUP0纯度分析与分子质量测定
HPSEC-MALLS-RID联用测定多糖分子质量,如图2所示,图中30 m in为多糖样品HUP0的色谱峰,38 m in为一小杂峰,峰面积比为1.7%,41 m in是溶剂峰,由于HUP0的锋面积大于98%,可以说明霸王花多糖组分HUP0是一个纯化后的均一多糖。检测得到HUP0的重均分子质量(mw)为33.24 kD(RSD=3.402%),数均分子质量(mn)为24.30 kD(RSD=6.513%),分子质量分散度(mw/mn)为1.368(RSD=7.348%)。

图2 HUP0的分子质量测定HPSEC图
Fig. 2 HPSEC chromatogram of HUP0 for molecular weight determination
2.5 多糖HUP0的FT-IR分析

图3 HUP0的FT-IR
Fig. 3 FT-IR spectrum of HUP0
由图3可知,在3 191.87 cm-1处有一个很强且宽的峰,这是O—H的伸缩振动峰[26]。在2 930、1 400.79 cm-1波数处的峰是C—H的伸缩振动和变角振动的吸收峰,这些吸收峰是多糖类物质的特征吸收峰[27]。在1 600 cm-1波数附近并无明显吸收峰,说明无羰基存在,多糖样品HUP0可能为中性糖。1 162.07、1 051.08 cm-1波数处的吸收峰是由吡喃糖环中醚键的C—O—C和O—H的变角振动引起的,说明HUP0主要为吡喃糖结构[28]。在1 000 cm-1波数以下的区域称为指纹区,此区的光谱更为繁琐,可用于整体分子特征的研究分析。在889.41 cm-1波数处有较弱吸收峰,说明HUP0中糖苷键主要以β-构型为主[29]。
2.6 多糖HUP0单糖组成分析

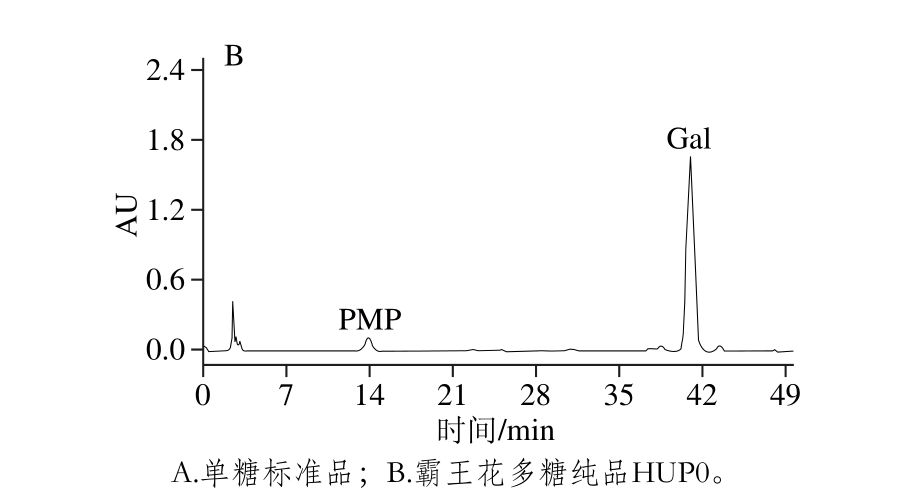
图4 多糖HUP0的单糖组成HPLC图
Fig. 4 HPLC analysis of monosaccharide composition in HUP0
对甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖7 种单糖标准品及霸王花多糖样品HUP0进行PMP柱前衍生化HPLC分析,结果见图4。未知样品的单糖组成按单糖标准品保留时间进行定性,霸王花多糖样品HUP0只由半乳糖组成。
2.7 多糖HUP0甲基化分析
对多糖样品HUP0经甲基化反应后得到的部分甲基化糖醇乙酸酯产物进行GC-MS分析,根据质子碎片峰和糖组成结合标准图谱对各峰进行归属。其GC-MS谱中的2个峰分别对应于直链(1→4)半乳糖聚糖中T-Galp和→4)-Galp-(1→2个片段所对应形成的衍生物峰(表1)。
表1 HUP0的甲基化产物GC-MS结果分析
Table 1 Methylation and GC-MS analysis of HUP0

2.8 多糖HUP0核磁共振分析
1H-核磁共振(1H-nuclear m agnetic resonance,1H-NMR)波谱主要用于分析多糖中糖苷键的构型[30]。在1H-NMR的4.3~5.9之间只出现一个端基信号峰,说明糖苷键主要只有一种连接方式。一般端基氢的化学位移值大于5为α型,化学位移值小于5为β型。由图5可知,端基氢的化学位移为4.55(<5),且J1.2=7.68 Hz,表明其糖环为β-构型[31];在5.4附近没有任何峰出现,为吡喃糖;综上所述,多糖HUP0主要由β-Galp构成,此结果与红外图谱结果一致。
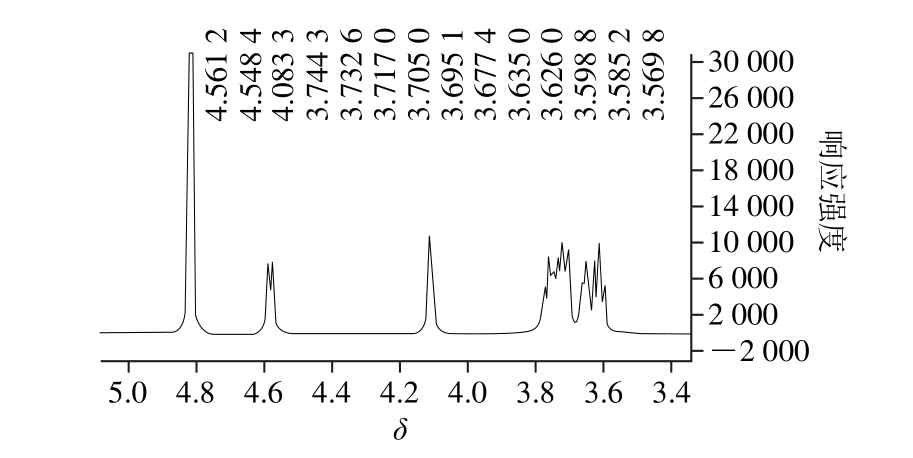
图5 HUP0的1H-NMR谱图
Fig. 51H-NMR spectrum of HUP0
13C-NMR在多糖结构分析上具有很重要的地位,通过这种方法不但能够确定各种碳的位置,还能区别分子的构型和构象,它主要用于分析多糖结构中的异头碳构型以及多糖中残基的取代位置等。当多糖残基中—OH发生取代,相应碳原子化学位移会向低场区移动[32]。α型连接的C-1化学位移比β型低1.5~3.0,α型为97~101,β型为103~105;但此规律不适合甘露糖和鼠李糖,因为它们的化学位移α与β几乎落在同一位置上。HUP0的碳谱如图6所示,端基碳的化学位移为104.72,说明为β-构型。在82~84之间无信号,说明不存在呋喃糖,则为吡喃糖构型。以上结果可以得到HUP0主要由β-Galp构成,与氢谱结果信息一致。一般情况下,在吡喃型糖残基中,未被取代部位(C-2、C-3、C-4)的碳的共振区为70~75,若发生取代则该碳的化学位移将移至76~85。HUP0的C4化学位移为78.04,C4信号明显向低场移动,说明C-4位有取代,表明HUP0中有→4)-Galp-(1→糖苷键[33]。

图6 HUP0的13C-NMR谱图Fig. 613C-NMR spectrum of HUP0
1H-1H COSY可归属同一糖环上氢的完整信号,1H-1H COSY谱如图7所示,从最低场区端基氢(H 1)信号4.55开始,归属与其相关3.59信号为的H 2质子信号;再根据糖上各质子之间的相关信号,依次归属H 3(3.68),H4 (4.08),H5(3.63)和H6(3.72)。
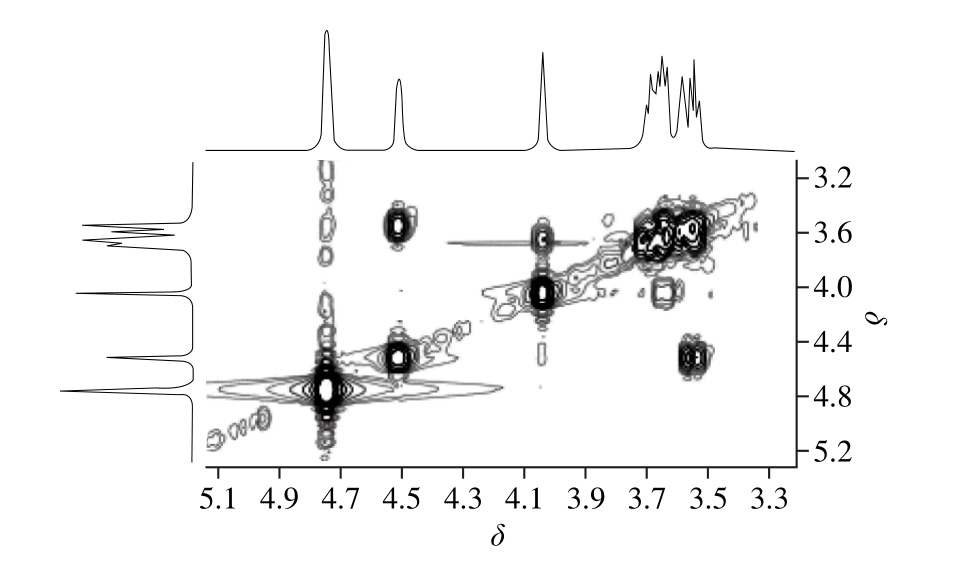
图7 HUP0的1H-1H COSY谱图
Fig.71H-1H COSY spectrum of HUP0
HSQC为异核单量子相关,其反映的是直接相连的1H、13C核之间的耦合关系[34]。通过HSQC就可以将糖单元中氢核进行化学归属。HUP0的HSQC谱如图8所示,由异头区可知,4.55处的氢信号与104.72处的碳信号相关。通过1H-1H COSY谱归属了糖上的氢核信号,再通过HSQC归属碳核,对HUP0的C和H信号归属如表2所示。
表2 HUP0的1H-NMR和13C-NMR信号归属
Table 21H-NMR and13C-NMR chem ical shifts of HUP0

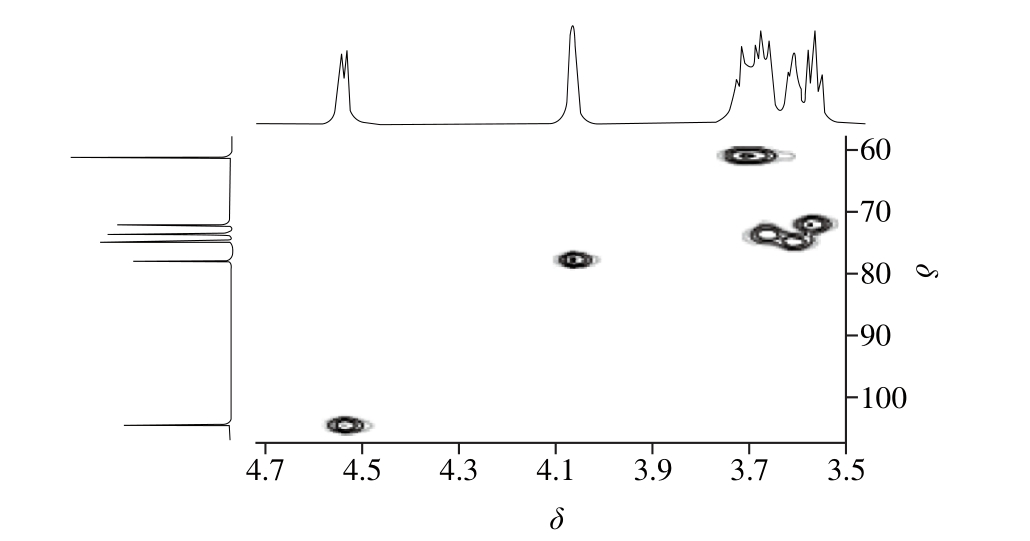
图8 HUP0的HSQC谱图
Fig. 8 HSQC spectrum of HUP0
HMBC是异核多键相关,其将1H核与长程耦合的13C核关联起来,从而给出分子连接骨架的结构信息。对于多糖,它可以作为序列分析的工具对糖单元之间连接次序进行分析[35]。HUP0的HMBC谱(图9)表明,β-D-半乳糖的端基氢H-1(4.55)与另一β-D-半乳糖C-4(78.03)偶合,β-D-半乳糖的端基碳C-1(104.72)与另一β-D-半乳糖H-4(4.08)偶合[36],以上结果表明半乳糖之间以(1→4)糖苷键连接。结合HUP0的单糖组成和GC-MS分析结果,可得HUP0多糖片段结构单元为→4)-β-D-Galp-(1→。

图9 HUP0的HMBC谱图
Fig. 9 HMBC spectrum of HUP0
在1H-NMR谱和13C-NMR谱图中只出现→4)-β-DGalp-(1→片断信号,而没有显示T-Galp片段信号,表明T-Galp在HUP0结构中所占比例很小,同时也可以说明HUP0的分子质量较大,此结果与分子质量测定结果(重均分子质量为33.24 kD)一致。
本实验通过对霸王花进行脱脂、水提醇沉、脱蛋白、冷冻干燥得到霸王花粗多糖,得率为8.09%。利用DEAE-Cellulose 52 纤维素柱和Sephadex G-100凝胶层析柱对霸王花粗多糖进行分离纯化,得到一个水溶性均一多糖HUP0。通过HPSEC-MALLS-RID测定HUP0的纯度和分子质量,结果表明HUP0为均一纯多糖,且分子质量为33.24 kD。红外图谱表明HUP0为中性吡喃糖,糖苷键主要以β-构型为主。单糖组成结果表明HUP0只有半乳糖。甲基化结果表明,HUP0的糖苷键连接位置为(1→4)连接。核磁图谱结合以上分析结果表明,HUP0的结构为(1→4)-β-D-半乳聚糖。本实验对霸王花多糖进行分离纯化和结构特征的研究,为霸王花多糖的结构与生物活性的深入研究提供一定的参考依据。
参考文献:
[1] 曹裕汉, 沈汉华, 郑卓辉, 等. 霸王花生产技术规程[J]. 广东农业科学, 2006 (7): 77-78. DOI:10.3969/j.issn.1004-874X.2006.07.029.
[2] 赵日坚. 剑花生产和加工新技术[J]. 广东农业科学, 2009(6): 212-214. DOI:10.3969/j.issn.1004-874X.2009.06.067.
[3] 陈胜龄. 剑花中氨基酸与微量元素分析[J]. 广东药学, 2000, 10(6): 24. DOI:10.3969/j.issn.1674-229X.2000.06.015.
[4] 国家中医药管理局中华本草编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1998: 865.
[5] 夏杏洲, 钟日初, 郭茵薇. 火龙果花保健饮料的研制[J]. 现代食品科技, 2004, 20(4): 69-71. DOI:10.3969/j.issn.1673-9078.2004.04.026.
[6] WU X, WANG Y, HUANG X J, et al. Three new glycosides from Hylocereus undatus[J]. Journal of Asian Natural Products Research, 2011, 13(8): 728-733. DOI:10.1080/10286020.2011.586944.
[7] YI Y, ZHANG Q W, LI S L, et al. Simultaneous quantification of major flavonoids in “Bawanghua”, the edible flower of Hylocereus undatus using pressurised liquid extraction and high performance liquid chromatography[J]. Food Chem istry, 2012, 135(2): 528-533. DOI:10.1016/j.foodchem.2012.05.010.
[8] 巫鑫, 王英, 范春林, 等. 霸王花药材HPLC指纹图谱研究[J]. 药物分析杂志, 2012(3): 400-405.
[9] 易衍, 巫鑫, 王英, 等. 霸王花黄酮类成分研究[J]. 中药材, 2011, 34(5): 712-716.
[10] 高慧颖, 王琦, 黄贤贵, 等. 火龙果花不同部位多糖的测定及其体外抗氧化活性[J]. 福建农业学报, 2015, 30(10): 944-947. DOI:10.3969/ j.issn.1008-0384.2015.10.004.
[11] 熊建文, 许金蓉, 张佳艳, 等. 酶法辅助超声波提取火龙果多糖及其抗菌活性[J]. 食品工业科技, 2015, 36(17): 229-233.
[12] XU L S, ZHANG Y J, WANG L Z. Structure characteristics of a watersoluble polysaccharide purif i ed from dragon fruit (Hylocereus undatus) pulp[J]. Carbohydrate Polymers, 2016, 146: 224-230. DO I:10.1016/ j.carbpol.2016.03.060.
[13] 何聪芬, 李鹏, 赵进, 等. 火龙果茎多糖的提取及结构鉴定[J]. 食品与发酵工业, 2009(11): 140-143.
[14] 高慧颖. 一种提取火龙果花多糖的方法: CN103772525A[P/OL]. 2014-05-07[2016-07-18]. http://www2.soopat.com/Patent/201410046363.
[15] 高慧颖, 王琦, 陈源, 等. 微波辅助提取火龙果花多糖的工艺研究[J]. 福建农业学报, 2014, 29(9): 909-912. DO I:10.3969/ j.issn.1008-0384.2014.09.017.
[16] WANG X, YUAN Y, WANG K, et al. Deproteinization of gellan gum p roduced by Sphingomonas paucimobilis ATCC 31461[J]. Journal of Biotechnology, 2007, 128(2): 403-407. DOI:10.1016/ j.jbiotec.2006.09.019.
[17] CUESTA G, SUAREZ N, BESSIO M I, et al. Quantitative determination of pneumococcal capsular polysaccharide serotype 14 using a modif i cation of phenol-sulfuric acid method[J]. Journal of Microbiological Methods, 2003, 52(1): 69-73. DOI:10.1016/S0167-7012(02)00151-3.
[18] DUBOIS M M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determ ination of sugars and related substances[J]. Analytical Chem istry, 1956, 28(3): 350-356. DOI:10.1021/ac60111a017.
[19] BRADFORD M M. A rapid and sensitive method for the quantitation of m icrogram quantities of protein utilizing the princip le of proteindye binding[J]. Analytical Biochem istry, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[20] BLUMENKRANTZ N, ASBOE H G. New method for quantitative determ ination of uronic acids[J]. Analytical Biochem istry, 1973, 54(2): 484-489. DOI:10.1016/0003-2697(73)90377-1.
[21] 卢锋, 吴明一, 高娜, 等. 黑乳海参硫酸化多糖的提取纯化、结构特征及其抗凝活性[J]. 大理学院学报, 2013, 12(6): 12-16. DOI:10.3969/ j.issn.1672-2345.2013.06.004.
[22] WU D T, LI W Z, CHEN J, et al. An evaluation system for characterization of polysaccharides from the fruiting body of Hericium erinaceus and identif i cation of its commercial product[J]. Carbohydrate Polymers, 2015, 124(7): 201-207. DOI:10.1016/j.carbpol.2015.02.028.
[23] DAI J, WU Y, CHEN S W, et al. Sugar compositional determination of polysaccharides from Dunaliella salina by modif i ed RP-HPLC method of precolumn derivatization with 1-phenyl-3-methyl-5-pyrazolone[J]. Carbohyd rate Po lymers, 2010, 82(3): 629-635. DO I:10.1016/ j.carbpol.2010.05.029.
[24] PETTOLINO F A, WALSH C, FINCHER G B, et al. Determ ining the polysaccharide composition of plant cell walls[J]. Nature Protocols, 2012, 7(9): 1590-1607. DOI:10.1038/nprot.2012.081.
[25] 方积年. 多糖的甲基化分析方法[J]. 国际药学研究杂志, 1986(4): 222-226.
[26] 陈苑, 李建霞, 朱瑞倩, 等. 响应面法优化落叶松阿拉伯半乳聚糖闪式提取工艺及其性质研究[J]. 食品工业科技, 2016, 37(12): 306-310.
[27] GERESH S, MAMONTOV A, WEINSTEIN J. Sulfation of extracellular polysaccharides of red m icroalgae: preparation, characterization and properties[J]. Journal of Biochem ical and Biophysical Methods, 2002, 50(2/3): 179-187. DOI:10.1016/S0165-022X(01)00185-3.
[28] KAVITAKE D, DEVI P B, SINGH S P, et al. Characterization of a novel galactan produced by Weissella confusa KR780676 from an acidic fermented food[J]. International Journal of Biological Macromolecules, 2016, 86: 681-689. DOI:10.1016/j.ijbiomac.2016.01.099.
[29] MIAO M, BAI A J, JIANG B, et al. Characterisation of a novel watersolub le po lysaccharide from Leuconostoc citreum SK 24.002[J]. Food H yd roco lloids, 2014, 36(5): 265-272. DO I:10.1016/ j.foodhyd.2013.10.014.
[30] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 1999: 242-244.
[31] 王海松, 施用晖, 乐国伟. 微波辅助合成半乳聚糖及其结构分析[J].食品科学, 2014, 35(24): 35-39. DO I:10.7506/spkx1002-6630-201424007.
[32] 方积年. C-13 NMR在多糖结构分析上的应用[J]. 国外药学: 抗生素分册, 1982(2): 107-112.
[33] 徐德平, 胡长鹰, 刘鹏, 等. 苦荞β-半乳聚糖的提取分离与结构鉴定[J].食品与发酵工业, 2010(9): 172-174.
[34] 李波, 陈海华, 许时婴. 二维核磁共振谱在多糖结构研究中的应用[J]. 天然产物研究与开发, 2005, 17(4): 523-526. DOI:10.3969/ j.issn.1001-6880.2005.04.035.
[35] 蹇华丽, 田文祥, 杨幼慧, 等. 多粘类芽孢杆菌PS04胞外多糖分子结构研究[J]. 食品工业科技, 2014, 35(8): 114-117.
[36] 刘刚, 王辉, 周本宏. 松茸多糖的理化性质与结构表征[J]. 中国药师, 2013, 16(3): 319-321. DOI:10.3969/j.issn.1008-049X.2013.03.001.
Isolation, Purif i cation and Structural Characterization of a Water-Soluble Polysaccharide from the Flower of Hylocereus undatus (Haw.) Britton & Rose
HE Muxue1, MENG Fancheng1, WANG Chunm ing1, LI Shaoping1, WANG Ying2, YE Wencai2, ZHANG Qingwen1,*
(1. State Key Laboratory of Quality Research in Chinese Medicine, Institute of Chinese Medical Sciences, University of Macau, Macau 999078, China; 2. Institute of Traditional Chinese Medicine and Natural Products, Jinan University, Guangzhou 510632, China)
Abstract:Objective: To extract and purify polysaccharide fractions from the flower of Hylocereus undatus (Haw.) (H. undatus) Britton & Rose and investigate their physicochemical, spectroscopic, and structural properties. Methods: The crude water-soluble polysaccharide (HUP) was extracted, precipitated, deproteinized and lyophilized from f l ower of H. undatus. A homogeneous polysaccharide fraction, designated HUP0, was obtained by consecutive DEAE-cellulose and Sephadex G-100 column chromatography. Structural characterization of the polysaccharide fraction was conducted using high performance size exclusion chromatography coupled with multi-angle laser light scattering and refractive index detection (HPSEC-MALLS-RID), Fourier transform infrared (FT-IR) spectroscopy, high performance liquid chromatography (HPLC), gas chromatography-mass spectrometry (GC-MS) and nuclear magnetic resonance (NMR) spectroscopy. Results: The weight-average molecular mass, intrinsic viscosity, specif i c rotation and mean diameter of HUP0 were measured to be 33.24 kD, 47.16 m L/g, +69°, and 196.96 nm, respectively. The FT-IR spectra showed that HUP0 was a neutral polysaccharide, which mainly contained β-conf i guration. Methylation, HPLC and NMR analyses indicated that HUP0 was a (1→4)-β-D-galactan.
Key words:f l ower of Hylocereus undatus (Haw.) Britton & Rose; polysaccharide; structural characterization; galactan带和亚热带地区均有栽培,我国主要分布于广东、广西和台湾等地[2];其果实火龙果是一种著名热带水果,其花俗称霸王花在华南地区是一种著名的药食两用原料,可作汤料或蔬菜食用[3]。霸王花入药始载于《岭南采药录》,具有清肺止咳、解毒消肿功效[4]。研究表明霸王花具有预防便秘、促进眼睛保健、抗氧化、抗自由基、增强免疫力、降血糖、降血脂、降血压、抗癌、治疗高尿酸症的功效;此外,霸王花对咳嗽、气喘亦有独特疗效[5]。本课题组曾对这一岭南地区常用道地中药材的次生代谢产物进行研究,从中分离得到了一系列黄酮及酚苷类化合物[6-9],同时发现霸王花中含有大量多糖。多糖是与生命活动紧密相关的天然活性物质之一,具有调节机体免疫力、抗肿瘤、抗氧化等广泛的药理作用[10]。熊建文等[11]对火龙果多糖的酶法辅助超声波提取工艺及其抗菌活性进行了研究。Xu Lishan等[12]对火龙果肉进行分离纯化得到火龙果多糖,其结构由主链→4-β-DG lcpA-1→、→6-β-D-Galp-1→、→4-α-L-Rhap-1→和支链α-L-Araf-1→5-α-L-Araf-1→组成。何聪芬等[13]从火龙果茎中分离出一个火龙果茎多糖,一个含有乙酰化-β-D-吡喃甘露聚糖的混合物。而目前对霸王花多糖的研究,主要集中在粗多糖的提取工艺和药理活性方面。高慧颖等[14]研究了霸王花多糖的超声波辅助提取工艺,及提取的霸王花粗多糖抗氧化活性。王琦等[15]在单因素试验的基础上,通过正交试验得出了霸王花多糖微波辅助提取的最佳提取工艺。目前尚未有对霸王花多糖进行分离纯化和结构解析的研究报道。
DOI:10.7506/spkx1002-6630-201718017
中图分类号:TS213.3
文献标志码:A
文章编号:1002-6630(2017)18-0106-07
引文格式:
何慕雪, 孟凡成, 王春明, 等. 1 种水溶性霸王花多糖的分离纯化及结构鉴定[J]. 食品科学, 2017, 38(18): 106-112.
DOI:10.7506/spkx1002-6630-201718017. http://www.spkx.net.cn
HE Muxue, MENG Fancheng, WANG Chunm ing, et al. Isolation, purif i cation and structural characterization of a water-soluble
polysaccharide from the f l ower of Hylocereus undatus (Haw.) Britton & Rose[J]. Food Science, 2017, 38(18): 106-112. (in Chinese
with English abstract) DOI:10.7506/spkx1002-6630-201718017. http://www.spkx.net.cn
仙人掌科量天尺属植物量天尺(Hylocereus undatus (Haw.) Britt. et Rose)[1],原产于墨西哥至巴西一带,现全球热
收稿日期:2016-07-18
基金项目:科技部港澳台科技合作专项(2013DFM 30080);澳门科学技术发展基金项目(042/2014/A1;013/2008/A1)
作者简介:何慕雪(1992—),女,硕士研究生,研究方向为糖化学。E-mail:mb45808@umac.mo
*通信作者:张庆文(1973—),男,副教授,博士,研究方向为天然产物。E-mail:qwzhang@umac.mo