表1 多糖提取正交试验因素与水平
Tab le 1 Factors and levels used in o rthogonal array design fo r op tim ization o f po lysaccharide extraction

刘 瑀,方志强,刘宇馨,娄亚迪
(大连海事大学环境科学与工程学院,辽宁 大连 116026)
摘 要:以青岛虾夷扇贝为原料,利用单因素试验以及正交试验,对水提、酶提醇沉法结合超声波辅助提取扇贝柱多糖工艺及多糖脱蛋白进行研究,并对三氯乙酸(trichloroacetic acid,TCA)和D-葡萄糖酸-δ-内酯(D-gluconoδ-lactone,GDL)的脱蛋白效果进行对比,其中利用GDL对多糖中的蛋白质进行脱除尚属首次。结果显示,多糖提取最佳工艺条件为液料比40∶1(m L/g)、加酶量2.5%、60 ℃提取3 h,在此条件下虾夷扇贝多糖得率可达10.90%;TCA法脱蛋白的最佳工艺条件为脱蛋白时间5 h、TCA质量分数5%、脱蛋白次数3 次;GDL法脱蛋白的最佳条件为反应时间1 h、反应温度45 ℃、GDL质量分数0.3%。在两者最佳条件下,分别进行3 次平行实验,TCA蛋白脱除率为88.654%,相对标准偏差(relative standard deviation,RSD)为0.905%;GDL蛋白脱除率为99.062%,RSD为0.679%;对比两种脱蛋白方法,GDL法脱蛋白效率更高,实验效果也更为稳定。
关键词:虾夷扇贝;多糖;三氯乙酸;D-葡萄糖酸-δ-内酯;脱蛋白
扇贝是扇贝属的双壳类软体动物的代称,又名海扇,其肉质鲜美,营养丰富,它的闭壳肌干制后即是“干贝”,被列入八珍之一。扇贝种类丰富,适合大规模养殖,是我国重要的海洋经济产品之一。扇贝含有丰富的蛋白质、脂肪、维生素、微量元素等营养成分,每100 g扇贝柱中含蛋白质63.7 g、脂肪3 g、糖类15 g、钙47 mg、磷886 mg和铁2.9 mg等[1],其中糖类含量丰富,仅次于蛋白质含量。近年来,随着水产品安全问题的出现,利用生物体内脂肪酸[2]、糖类等生物自身组成物质的含量以及生物信息等,为水产品质量安全及产地溯源提供技术支持已成为研究热点之一。而通过提取及纯化等前处理方法得到的多糖物质,其质量及纯度对后期各种分析与检测有很大的影响。因此,对扇贝多糖的提取及其纯化技术的研究具有重要意义。
目前,多糖提取的对象主要以植物为主。植物多糖提取有热水浸提、碱法浸提以及酶法浸提等[3-4]方法;辅助提取方法主要为超声波辅助提取[5-6]。超声波辅助提取主要是利用高频率超声波所产生的“空化效应”将样品细胞粉碎,使细胞内容物与提取剂充分接触,促进多糖的释放和提取,提高样品多糖的提取率和含量。对于动物性多糖,由于动物体内组成物质相对复杂,多糖常常与其他物质如蛋白多肽等相结合形成糖蛋白复合物,所以相比植物多糖的提取,动物性多糖提取主要以碱法、酶法浸提为主[7-8],辅以超声波提取[9],之后通过添加乙醇沉淀而得到粗提取的多糖物质。有研究对虾夷扇贝下脚料[10]中糖胺聚糖、脏器[11]中硫酸酯多糖以及生殖腺[12]多糖等进行了提取和纯化工作,提取纯化方法类似,效果因提取部位不同而略有差异。粗多糖的初步纯化主要是脱除其中的小分子盐类以及蛋白多肽等杂质。目前去除多糖中蛋白质的方法有:Sevag法[13]、三氯乙烷法[14]、三氯乙酸(trichloroacetic acid,TCA)法[15],以及这几种方法与酶法相结合[16]等方式。其中以Sevag法和TCA法较为普遍;Sevag法脱蛋白条件温和,但是脱蛋白效率不高,往往需要多次处理之后,蛋白脱除效果才比较明显,操作比较繁琐;TCA会使溶液体系呈现弱酸性,其中蛋白质会产生不可逆沉淀,因此会有较高的脱蛋白效果,但是在酸性环境下,多糖也容易水解,所以多糖损失率也会提高。D-葡萄糖酸-δ-内酯(D-glucono-δlactone,GDL)是葡萄糖酸的羧基与分子内的羟基之间脱水而成的酯,是一种多功能的食品添加剂,用作蛋白凝固剂来制作豆腐[17],利用其诱导牛奶蛋白[18-19]、大豆蛋白[20-21]凝结。但是目前关于GDL在多糖脱除蛋白的文献报道较少,本研究将GDL用于多糖初步纯化脱蛋白实验中,并比较了其与TCA脱蛋白效果差异。
本实验利用超声波将扇贝样品溶液进行前期处理,之后利用热水与生物酶(木瓜蛋白酶)相结合的方式对样品多糖进行粗提取,并结合单因素试验结果设计了L9(34)正交试验来研究最佳实验组合;利用TCA和GDL对粗多糖进行脱蛋白处理,并分别设计了两个L9(33)正交试验研究了其对粗多糖的脱蛋白效果,对比了两种脱蛋白方法在一定实验条件下对粗多糖脱蛋白效果的差异。
1.1 材料与试剂
选用青岛的虾夷扇贝(Patinopecten yessoensis),将其冷冻干燥研磨成粉末后备用。
无水乙醇、95%乙醇溶液、浓硫酸、氢氧化钠 天津市化学试剂一厂;葡萄糖、牛血清蛋白、苯酚、考马斯亮蓝G-250、85%磷酸、木瓜蛋白酶、GDL 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
721型分光光度计 上海元析仪器有限公司;JY92-ⅡDN超声波细胞破碎仪 宁波新芝生物科技有限公司;THZ-82型恒温水浴锅 金坛市顺华仪器有限公司;Anke TDL80-2B型离心机 上海安亭科学仪器厂;RE5298A旋转蒸发仪 上海亚荣生化仪器厂;冷冻干燥机 北京博医康实验仪器有限公司;UVF超纯水仪 上海和泰仪器有限公司;CP225D分析天平 北京赛多利斯仪器有限公司;DHG-9245A型电热鼓风干燥箱上海一恒科学仪器有限公司。
1.3 方法
1.3.1 虾夷扇贝多糖提取工艺
解剖扇贝,弃去扇贝裙边及脏器组织,只保留扇贝柱,清洗干净并冷冻,之后经冷冻干燥机干燥48 h,研磨成粉后备用。取扇贝粉末样品2 g,在单因素试验基础上,按液料比20∶1~40∶1(m L/g)用超纯水溶解,超声波细胞粉碎机在超声功率440 W条件下超声10 m in,增加扇贝粉末与水的接触面积,使细胞中的物质更好地进入水体中;之后按加酶量为1.5%~2.5%加入木瓜蛋白酶,在60~80 ℃条件下浸提3~5 h,100 ℃灭酶15 m in,冷却后得到多糖提取液。将所得多糖提取液置于离心机中以4 000 r/m in离心10 m in,取上清液于旋转蒸发仪中真空浓缩至5~10 m L,取出即得多糖浓缩液。加入体积分数为95%乙醇溶液,使其终体积分数为80%,于4 ℃中静置过夜。离心后获得多糖沉淀,用无水乙醇洗涤多次,置于通风处晾干后得到扇贝粗多糖粉末。通过L9(34)正交试验来获得提取多糖最佳的提取时间、提取温度、液料比以及加酶量,因素与水平如表1所示。
表1 多糖提取正交试验因素与水平
Tab le 1 Factors and levels used in o rthogonal array design fo r op tim ization o f po lysaccharide extraction

1.3.2 多糖含量测定
采用苯酚-硫酸法测定虾夷扇贝多糖的含量[22]。称取标准葡萄糖于105 ℃条件下干燥至质量恒定。称取干燥后的葡萄糖0.25 g,加超纯水溶解,定容于1 000.0 m L容量瓶中,摇匀,得到质量浓度为250 μg/m L的葡萄糖溶液;吸取16.0 m L葡萄糖溶液,用超纯水定容于100.0 m L 容量瓶中,摇匀,得到质量浓度为40 μg/m L的葡萄糖标准溶液。精密吸取40 μg/m L葡萄糖标准溶液0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 m L,置于不同试管中,并加水至2.0 m L,加入6%苯酚1.0 m L及浓硫酸(95.5%)5.0 m L,静置10 m in后摇匀,室温放置20 m in后于490 nm波长处测定吸光度。以2.0 m L水代替葡萄糖溶液,按同样操作进行显色反应作为空白。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,得到线性回归方程y=0.016 8x+0.006 9,相关系数R2为0.995 4。取适量粗多糖样品提取液,稀释适当倍数后精密吸取1.0 m L,然后按标准曲线制作方法测定吸光度,计算样品中的多糖含量。多糖提取率的计算公式为:
式中:R为多糖提取率/%;M1为提取物中所含多糖质量/g;M2为原料粉末质量/g。
1.3.3 蛋白质含量的测定
采用考马斯亮蓝法测定虾夷扇贝样品蛋白质的含量[22]。称取牛血清蛋白0.10 g,用超纯水溶解并定容到1 000.0 m L容量瓶中,得到质量浓度为0.1 mg/m L的标准蛋白溶液。准确吸取0、0.1、0.2、0.3、0.4、0.6、0.8 m L的标准蛋白溶液,用超纯水补充至1.0 m L;分别加入考马斯亮蓝染液4.0 m L,混匀,室温静置3 m in,以1号管为空白,波长595 nm处测定吸光度。以吸光度为纵坐标,标准蛋白液质量浓度为横坐标,得到线性回归方程y=7.314 7x+0.561 5,相关系数为R2为0.998 5。量取1.0 m L多糖溶液,加入4.0 m L考马斯亮蓝染液,摇匀,静置3 m in后,在波长595 nm处测定其吸光度,并计算样品中蛋白质的含量。
1.3.4 虾夷扇贝多糖脱蛋白
1.3.4.1 TCA脱蛋白
将1.3.1节中得到的粗多糖配成质量浓度为50 mg/m L的粗多糖溶液,加入20%的TCA溶液,使其最终质量分数达到1%~10%,之后振荡反应3~5 h,脱蛋白次数为1~3 次;反应完全后,以4 000 r/m in离心10 m in,弃去变性蛋白沉淀,上清液加入体积分数95%乙醇溶液,使其终体积分数达到80%,4 ℃静置过夜,离心后得脱蛋白后的多糖沉淀,用无水乙醇洗涤多次,置于通风处晾干后得到脱蛋白后的多糖粉末。通过L9(33)正交试验获得粗多糖TCA脱蛋白最佳的脱蛋白时间、TCA质量分数以及脱蛋白次数,因素与水平如表2所示。
表2 TCA脱蛋白正交试验因素与水平
Tab le 2 Facto rs and levels used in orthogonal array design for op tim ization o f TCA dep roteinization

1.3.4.2 GDL脱蛋白
将1.3.1节中得到的粗多糖配成质量浓度为50 mg/m L的溶液,加入质量分数2%的GDL溶液,使其终质量分数达到0.3%~0.5%,之后置于恒温水浴锅中在30~60 ℃反应1~2 h。待反应完全后,以4 000 r/m in离心10 m in,弃去下层变性蛋白沉淀,剩余上清液加入体积分数95%乙醇溶液,使其终体积分数达到80%,4 ℃静置过夜,离心后得脱蛋白后的多糖沉淀,用无水乙醇洗涤多次,干燥后得到脱蛋白后的多糖粉末。通过L9(33)正交试验获得粗多糖GDL脱蛋白最佳的反应温度、反应时间以及GDL质量分数,因素水平如表3所示。
表3 GDL脱蛋白正交试验因素与水平
Tab le 3 Facto rs and levels used in orthogonal array design for op tim ization o f GDL dep roteinization
2.1 虾夷扇贝多糖提取工艺优化结果
2.1.1 虾夷扇贝多糖提取单因素试验结果
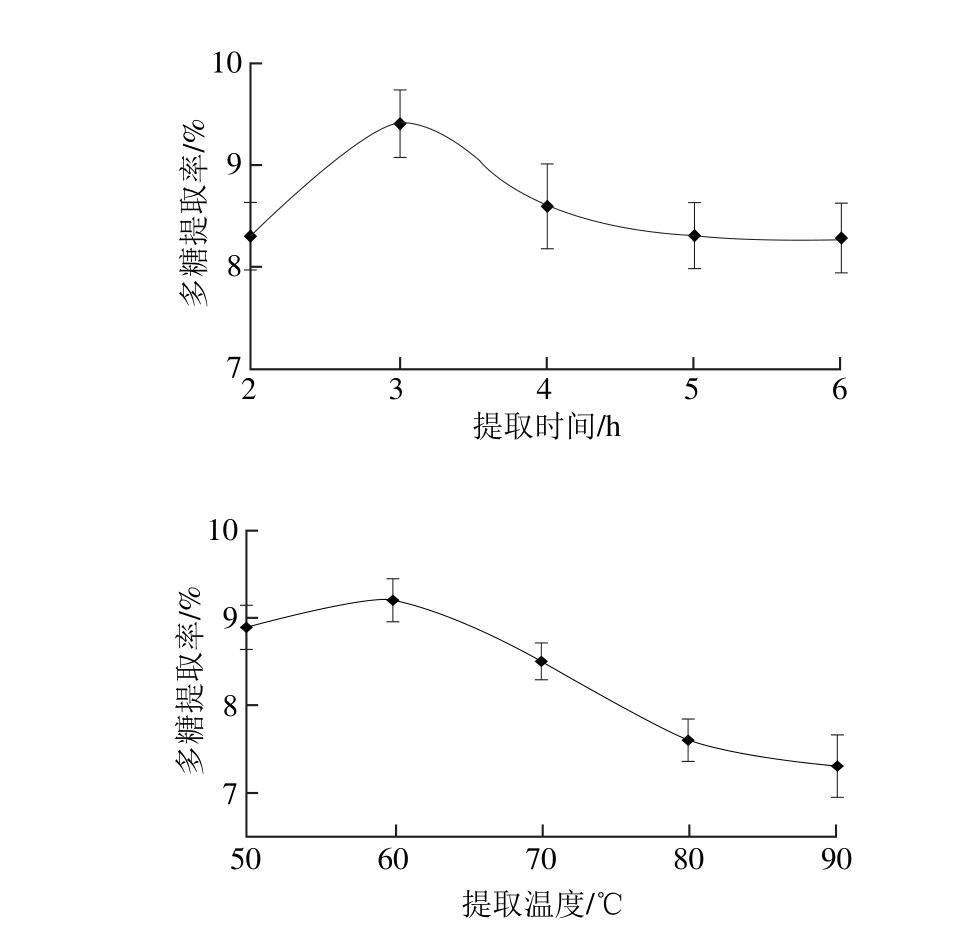
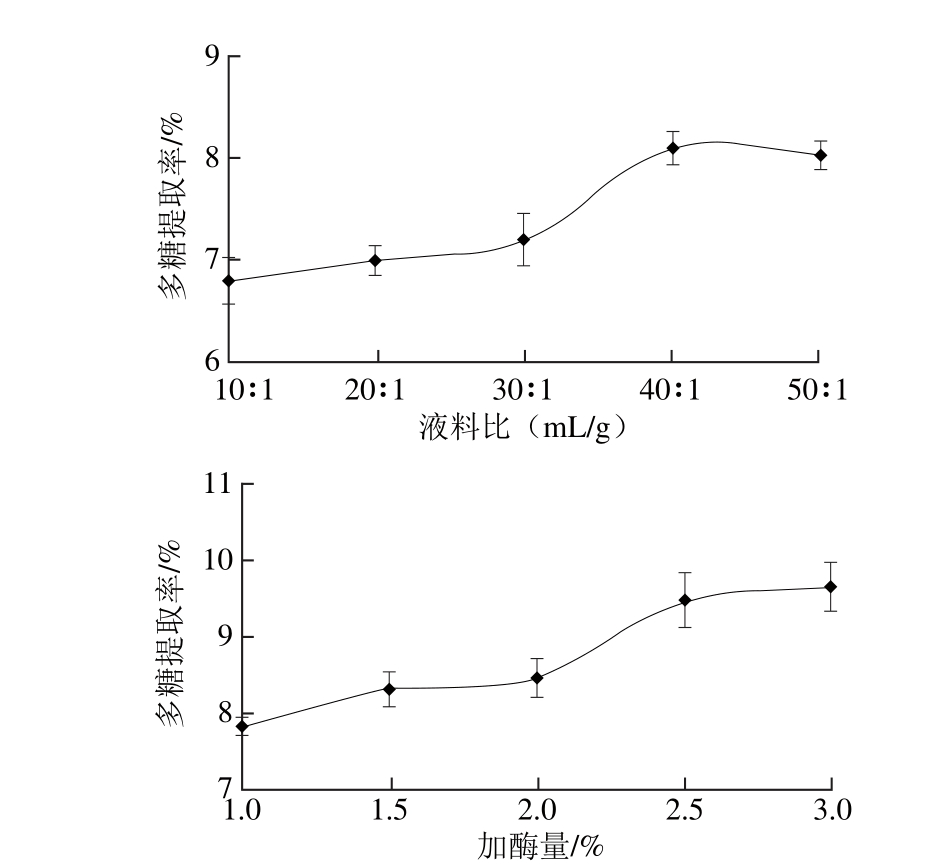
图1 不同因素对虾夷扇贝多糖提取率的影响
Fig. 1 Effects of different experim ental factors on the extraction efficiency o f po lysaccharides from scallop
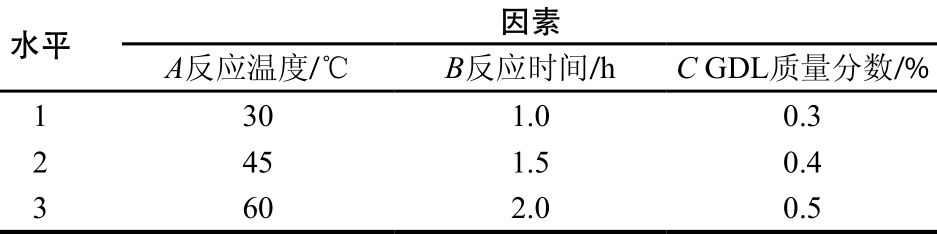
各单因素试验固定条件为提取时间4 h、提取温度60 ℃、液料比20∶1、加酶量2%,分别研究粗多糖提取过程中提取时间、提取温度、液料比以及加酶量4 个因素对多糖提取率的影响,结果见图1。
由图1可知,随着提取时间的延长,多糖提取率呈现先升高后下降的趋势,3 h时多糖提取率达到最大,表明扇贝粉末中多糖已充分溶解于水中,之后延长提取时间反而有下降的趋势。多糖提取率随着温度的升高呈现先增加后降低的趋势,在60 ℃时提取率最高,后期由于温度升高,超过木瓜蛋白酶的最适温度,酶活性降低导致提取率降低。随着液料比的增加,多糖提取率前期增加缓慢,在40∶1(m L/g)时提取率达到最大,之后趋于稳定,但是较大的液料比不仅会使多糖溶出量增多,同时杂质也会相应增多。对于加酶量来说,提取率是随加酶量增加而逐渐升高,在2.5%后提取率趋于稳定,出于经济因素的考虑,加酶量在2.5%左右最适宜。
2.1.2 虾夷扇贝多糖提取正交试验结果
由表4可知,在选定因素水平范围内,提取时间对虾夷扇贝多糖的提取具有显著影响,各试验因素影响程度的主次顺序为A(提取时间)>C(液料比)>B(提取温度)>D(加酶量)。多糖得率越高,提取效果越好,比较k值大小可得到最优组合为A1B1C3D3,即提取时间3 h、提取温度60 ℃、液料比40∶1(m L/g)、加酶量2.5%。在最优条件下,通过3 次平行实验验证可得多糖得率可达到10.90%,高于表4中所有组合。其他文献中,虾夷扇贝内脏多糖得率[23-24]为7.8%左右,鲍鱼多糖提取率[25]最高可达19.6%,海湾扇贝粗多糖[26]提取率为5.419%,其他海洋动物多糖[7]得率一般在6.5%~9%左右。本实验扇贝多糖得率高于普遍值,是一种可行的扇贝多糖提取方法。
表4 多糖粗提取正交试验设计与结果
Tab le 4 Orthogonal array design w ith experim en tal resu lts

2.2 TCA脱蛋白工艺优化结果
2.2.1 TCA脱蛋白单因素试验结果
各单因素试验固定条件为脱蛋白时间3 h、TCA质量分数5%、脱蛋白次数3 次,分别研究TCA脱蛋白过程中脱蛋白时间、TCA质量分数以及脱蛋白次数对蛋白脱除率的影响,结果见图2。
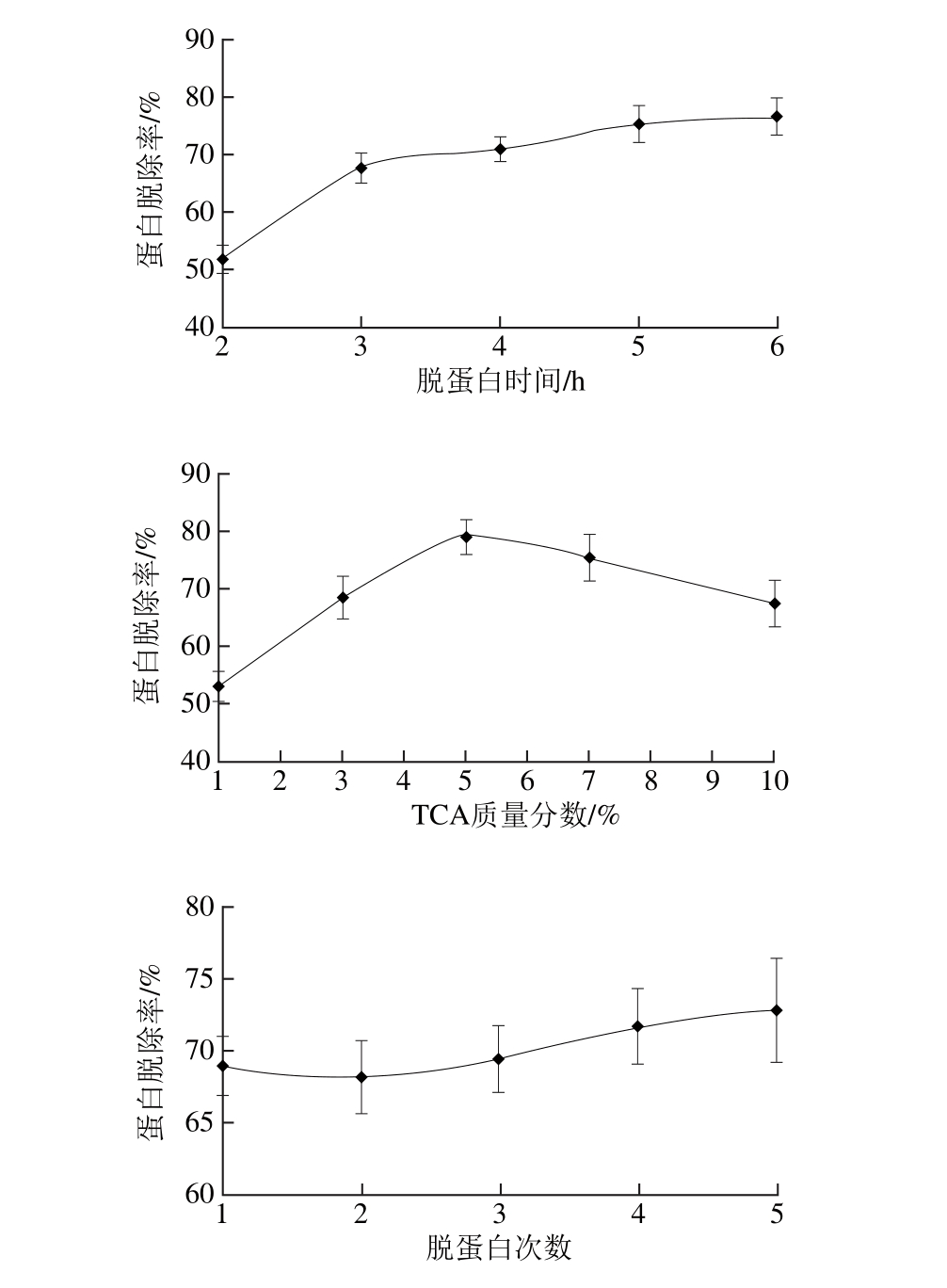
图2 不同因素对TCA脱蛋白效果的影响
Fig. 2 Effect o f different experim ental factors on TCA dep roteinization
由图2可知,随着脱蛋白时间的延长,蛋白脱除率前期提高较快,后期逐渐趋于平缓,这说明随着时间的延长,溶液中游离蛋白逐渐沉淀完全。随着TCA质量分数的增加,蛋白脱除率呈现先增加后降低的趋势,这主要是由于TCA水溶液呈弱酸性,随着其质量分数的提高,溶液pH值逐渐降低,在酸性条件下,多糖会发生一定的水解作用[27-28]。而从总体来看,脱蛋白次数对蛋白脱除率没有较为显著的影响。
2.2.2 TCA脱蛋白正交试验结果
表5 TCA脱蛋白正交试验设计与结果
Tab le 5 Orthogonal array design w ith experim en tal resu lts for op tim ization o f TCA dep ro teinization

表6 TCA脱蛋白正交试验结果方差分析
Tab le 6 Analysis o f variance o f the experim ental resu lts o f orthogonal array design fo r TCA dep ro teinization

由表5和表6可以看出,在选定因素水平范围内,脱蛋白时间对虾夷扇贝多糖的蛋白脱除率的影响大于其他两个因素。各因素影响程度的主次顺序为A(脱蛋白时间)>C(脱蛋白次数)>B(TCA质量分数)。蛋白脱除率越高,脱除效果越好,比较k值大小可得到最优组合为A3B2C3,即脱蛋白时间5 h、TCA质量分数5%、脱蛋白次数3 次,3 次平行实验得到TCA蛋白脱除率为88.654%,高于表5中各组试验结果。
2.3 GDL脱蛋白工艺优化结果
2.3.1 GDL脱蛋白单因素试验结果
单因素试验固定反应温度30 ℃、反应时间2 h、GDL质量分数0.5%,分别研究GDL脱蛋白过程中反应温度、反应时间以及GDL质量分数对蛋白脱除率的影响,结果见图3。
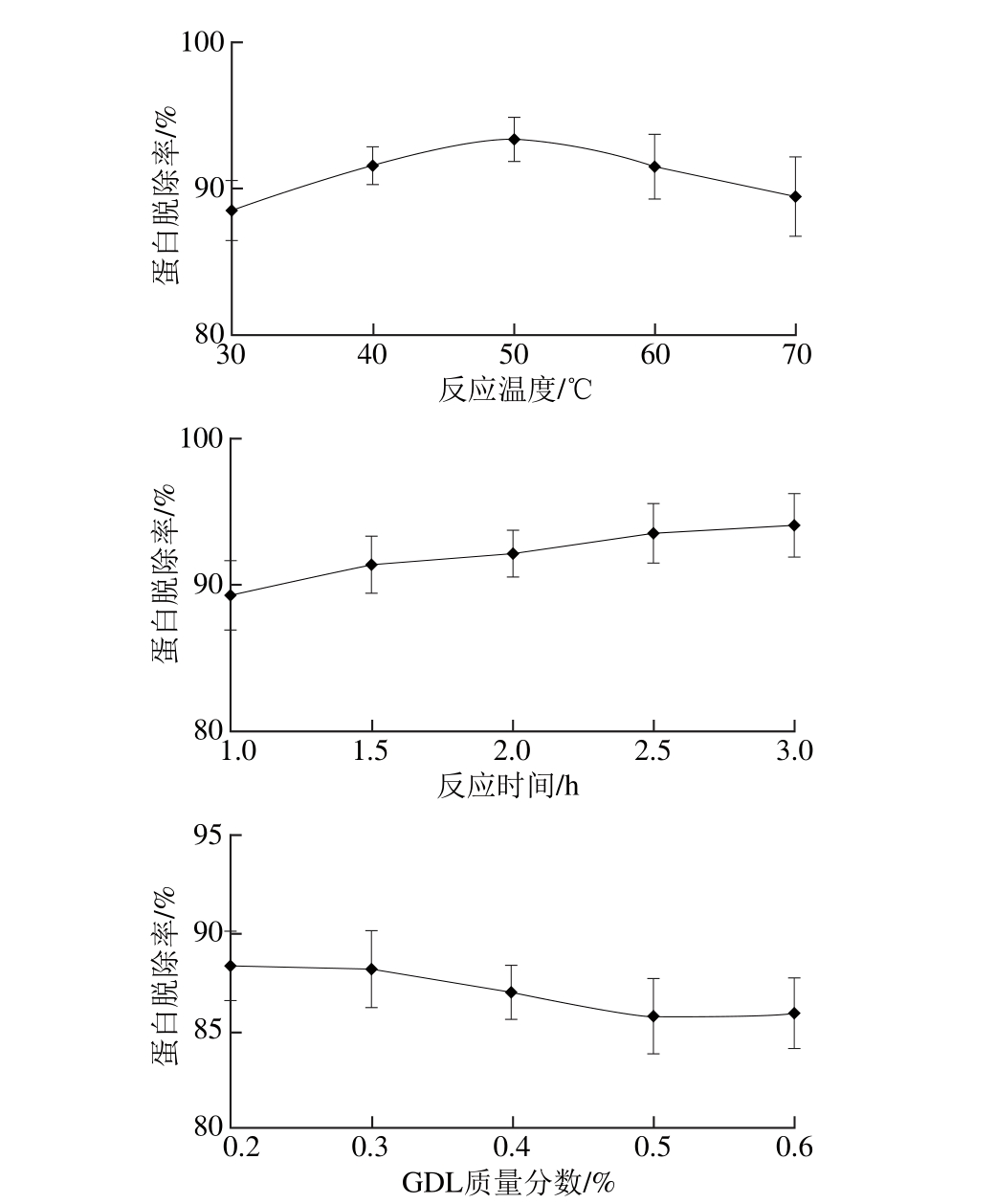
图3 不同因素对GDL脱蛋白效果的影响
Fig. 3 Effect o f different experim ental factors on GDL dep roteinization
由图3可知,随着温度的升高,蛋白脱除率有不太显著的先升后降的变化趋势,当反应温度为50 ℃时,蛋白脱除率最高。随着反应时间的延长,蛋白脱除率有较为平缓的提高,之后趋于稳定,说明游离蛋白逐渐得到充分的沉淀。而随着GDL质量分数的提高,蛋白脱除率则有稍微下降的趋势,有可能是GDL含量增加,会使蛋白质凝胶白度值下降[29-30],部分蛋白重新溶解于水中。
2.3.2 GDL脱蛋白正交试验结果
表7 GDL脱蛋白正交试验设计与结果
Tab le 7 Orthogonal array design w ith experim en tal resu lts for op tim ization o f GDL dep roteinization
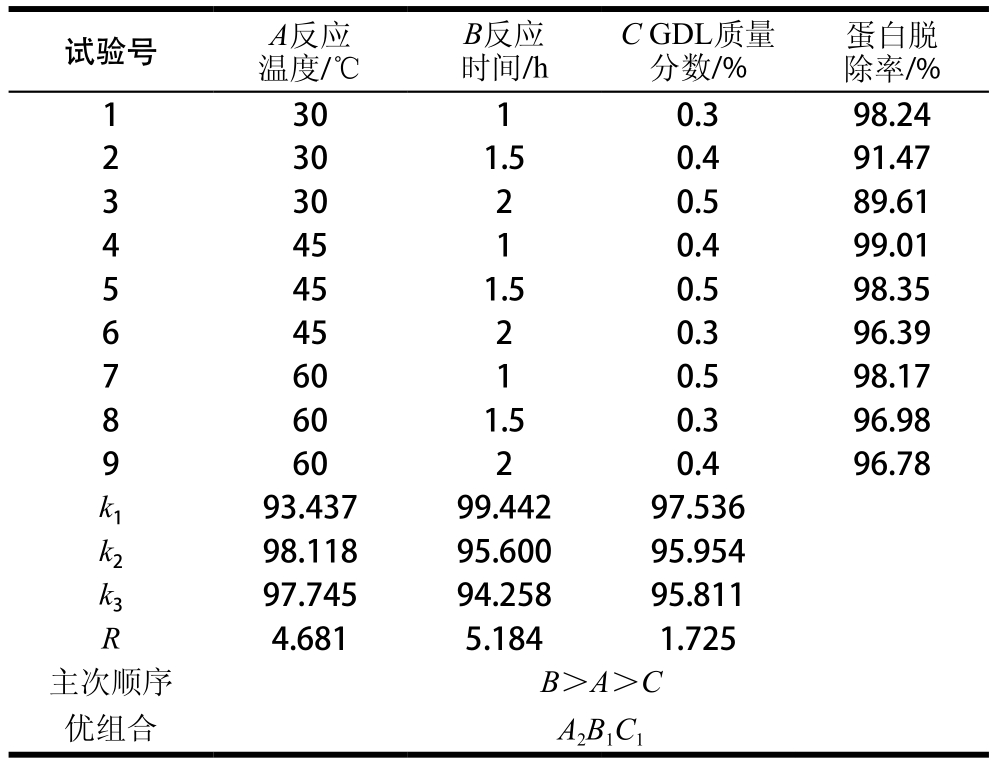
表8 葡萄酸内酯脱蛋白正交试验结果方差分析
Tab le 8 Analysis o f variance of the experim ental resu lts o f orthogonal array design fo r GDL dep ro teinization
由表7和表8可以看出,在选定因素水平范围内,反应时间对虾夷扇贝多糖的蛋白脱除率的影响大于其他两个因素。各因素影响程度的主次顺序为B(反应时间)>A(反应温度)>C(GDL质量分数)。蛋白脱除率越高,脱蛋白效果越好,比较k值大小可得到最优组合为A2B1C1,即反应温度45 ℃、反应时间1 h、GDL质量分数0.3%,3 次平行实验得到GDL蛋白脱除率为99.062%,高于表7中各组试验结果。
2.4 两种脱蛋白方法对比
两种脱蛋白方法均使用同一批粗多糖样品,粗多糖质量浓度均为50 mg/m L。从前两个脱蛋白正交试验结果中可以看出,在相应实验条件下,TCA蛋白脱除率为88.654%,RSD为0.905%;GDL蛋白脱除率为99.062%,RSD为0.679%;在一些文献中,如缢蛏[9]TCA法脱蛋白率为69.75%,海带多糖[15]酶法脱蛋白率在86.63%左右。从本实验结果看,GDL蛋白脱除率能达到99%左右,对比TCA法效率更高,脱蛋白效果也更加稳定。
通过正交试验分析可知,虾夷扇贝多糖的提取最佳条件为提取时间3 h、提取温度60 ℃、液料比40∶1(m L/g)、加酶量2.5%,此条件下,多糖得率可达10.90%;虾夷扇贝多糖脱蛋白试验中,TCA法的最佳条件为脱蛋白时间5 h、TCA质量分数5%、脱蛋白次数3 次,在此条件下,蛋白脱除率可达88.654%,RSD为0.905%;GDL法的最佳条件为反应时间1 h、反应温度45 ℃、GDL质量分数0.3%,在此条件下,蛋白脱除率可达99.062%,RSD为0.679%。本实验通过GDL对扇贝多糖中残余蛋白质进行脱除,效果显著。对比TCA多糖脱蛋白的方法,GDL法脱蛋白效率更高,实验效果也更为稳定。但是GDL作为一种仅由碳氢氧构成的化合物,可能会对多糖类物质的后期分析带来一定的影响。
参考文献:
[1] 谢宗墉. 海洋水产品营养与保健[M]. 青岛: 青岛海洋大学出版社, 1991.
[2] ZHANG X, LIU Y, LI Y, et al. Identification of the geographical origins of sea cucumber (Apostichopus japonicus) in northern China by using stable isotope ratios and fatty acid prof i les[J]. Food Chem istry, 2017, 218: 269-276. DOI:10.1016/j.foodchem.2016.08.083.
[3] 金迪, 梁英, 孙工兵, 等. 植物多糖提取技术的研究进展[J]. 黑龙江八一农垦大学学报, 2011, 23(5): 76-79. DO I:10.3969/ j.issn.1002-2090.2011.05.020.
[4] ROMDHANE M B, HADDAR A, GHAZALA I, et al. Optim ization of polysaccharides extraction from watermelon rinds: structure, functional and biological activities[J]. Food Chem istry, 2017, 216: 355-364. DOI:10.1016/j.foodchem.2016.08.056.
[5] 常秀莲, 王长海, 冯咏梅, 等. 超声波法提取库拉索芦荟花多糖[J]. 烟台大学学报(自然科学与工程版), 2005, 18(2): 137-141. DOI:10.3969/ j.issn.1004-8820.2005.02.010.
[6] KUMAR S, SIVAKUMAR M, RUCKM AN I K. M icrow aveassisted ex trac tion o f po lysaccharides from Cyphomandra betacea and its biological activities[J]. International Journal of Biological Macromolecules, 2016, 92: 682-693. DOI:10.1016/ j.ijbiomac.2016.07.062.
[7] 殷涌光, 韩玉珠, 丁宏伟, 等. 动物多糖的研究进展[J]. 食品科学, 2006, 27(3): 256-263. DOI:10.3321/j.issn:1002-6630.2006.03.062.
[8] 文松松, 赵峡, 于广利, 等. 海洋动物多糖研究进展[J]. 中国海洋药物, 2009(4): 46-51.
[9] 许静. 超声波提取缢蛏多糖及脱蛋白工艺[J]. 食品研究与开发, 2012, 33(8): 91-94. DOI:10.3969/j.issn.1005-6521.2012.08.027.
[10] 李广靖, 崔青曼, 袁春营, 等. 虾夷扇贝下脚料糖胺聚糖的化学组成与生物学功能研究[J]. 食品工业科技, 2012, 33(24): 134-136; 139.
[11] 于运海, 周大勇, 孙黎明, 等. 虾夷扇贝脏器硫酸酯多糖的制备及性质研究[J]. 食品科学, 2009, 30(6): 68-71. DOI:10.3321/ j.issn:1002-6630.2009.06.011.
[12] 曹月刚, 赵君, 陈泓宇, 等. 虾夷马粪海胆生殖腺多糖的提取、纯化及鉴定[J]. 食品科学, 2014, 35(21): 16-20. DOI:10.7506/spkx1002-6630-201421004.
[13] 张锦雀, 黄丽英, 苏聪枚, 等. 中草药多糖提取分离纯化研究进展[J]. 中药材, 2008, 31(11): 1760-1765. DOI:10.3321/ j.issn:1001-4454.2008.11.055.
[14] 张潇艳, 陈正行, 王莉, 等. 米糠多糖的脱蛋白研究[J]. 食品工业科技, 2008, 29(3): 163-165.
[15] 余华. 海带多糖中蛋白质去除方法的对比研究[J]. 成都大学学报(自然科学版), 2005, 24(4): 265-268. DOI:10.3969/ j.issn.1004-5422.2005.04.007.
[16] 周鸿立, 杨晓虹. 玉米须多糖中蛋白质脱除的Sevag与酶法联用工艺优化[J]. 食品科学, 2011, 32(8): 129-132.
[17] 岳振峰, 吴晖, 陆玲, 等. 多功能食品添加剂: D-葡萄糖酸-δ-内酯[J]. 食品工业, 1998, 19(3): 25-26.
[18] CHEN Y C, CHEN C C, CHEN S T, et al. Proteom ic profiling of the coagulation o f m ilk proteins induced by glucono-deltalactone[J]. Food Hydrocolloids, 2016, 52: 137-143. DOI:10.1016/ j.foodhyd.2015.06.005.
[19] 金嫘, 李新华, 徐亚平, 等. 葡萄糖酸-δ-内酯(GDL)对牛乳的凝固及其影响因素的研究[J]. 食品与发酵工业, 2006, 32(8): 115-118. DOI:10.3321/j.issn:0253-990X.2006.08.030.
[20] 钟芳, 王璋, 许时婴, 等. 葡萄糖酸内酯为凝固剂时大豆蛋白的胶凝特性[J]. 无锡轻工大学学报, 2003, 22(5): 1-4; 10. DOI:10.3321/ j.issn:1673-1689.2003.05.001.
[21] GRYGORCZYK A, CORREDIG M. Acid induced gelation of soym ilk, comparison between gels prepared w ith lactic acid bacteria and glucono-δ-lactone[J]. Food Chem istry, 2013, 141(3): 1716-1721. DOI:10.1016/j.foodchem.2013.03.096.
[22] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999.
[23] 闰雪, 杨静峰, 周大勇, 等. 虾夷扇贝内脏多糖SVP-12的分离纯化及性质研究[J]. 食品与发酵工业, 2009, 35(2): 172-175.
[24] 殷红玲, 马媛, 王璐, 等. 虾夷扇贝内脏多糖的提取及清除羟基自由基作用的研究[J]. 水产科学, 2007, 26(5): 255-258. DOI:10.3969/ j.issn.1003-1111.2007.05.002.
[25] 殷红玲, 杨静峰, 李冬梅, 等. 酶法提取鲍鱼多糖的研究[J]. 食品与发酵工业, 2006, 32(12): 158-160; 170. DOI:10.3321/j.issn:0253-990X.2006.12.038.
[26] 佟海菊, 张志胜, 王鸥, 等. 海湾扇贝多糖水提工艺研究[J]. 河北农业大学学报, 2011, 34(3): 85-87. DOI:10.3969/j.issn.1000-1573.2011.03.017.
[27] ARNOUS A, MEYER A S. Quantitative prediction of cell w all polysaccharide composition in grape (Vitis vinifera L.) and app le (Malus domestica) skins from acid hydrolysis monosaccharide prof i les[J]. Journal of Agricultural and Food Chem istry, 2009, 57(9): 3611-3619. DOI:10.1021/jf900780r.
[28] YANG B, YU G, ZHAO X, et al. Mechanism of mild acid hydrolysis of galantine polysaccharides w ith highly ordered disaccharide repeats leading to a complete series of exclusively odd-numbered oligosaccharides[J]. FEBS Journal, 2009, 276(7): 2125-2137. DOI:10.1111/j.1742-4658.2009.06947.x.
[29] 王宇, 孔保华, 李明清, 等. 葡萄糖酸内酯对猪肉肌原纤维蛋白功能性的影响[J]. 食品科学, 2010, 31(9): 67-70.
[30] SHARP A, OFFER G. The m echanism of form ation o f gels from m yosin m o lecules[J]. Journal of the Science of Food and Agriculture, 1992, 58(1): 63-73. DOI:10.1002/jsfa.2740580112.
Op tim ization o f Extraction and Purification o f Polysaccharides from Patinopecten yessoensis
LIU Yu, FANG Zhiqiang, LIU Yuxin, LOU Yad i
(Co llege o f Environm en tal Science and Engineering, Dalian Maritim e University, Dalian 116026, China)
Abstract:In this paper, the ultrasonic-assisted enzymatic extraction and purif i cation of polysaccharides from Patinopecten yessoensis were optim ized using one-factor and orthogonal array design methods. For the deproteinization of crude polysaccharides, D-glucono-δ-lactone (GDL) was used in this study for the fi rst time and its performance was evaluated in comparison w ith trichloroacetic acid (TCA). The results showed that the optimum conditions for extraction were as follows: solvent/solid ratio, 40:1 (m L/g); enzyme dosage, 2.5%; and 3 h extraction at 60 ℃, resulting in the highest polysaccharide yield of 10.90%. The optimum conditions for TCA deproteinization were as follows: deproteinization time, 5 h; final TCA concentration, 5%; and 3 deproteinization cycles. The optimal conditions for GDL deproteinization were as follow s: deproteinization time, 1 h; reaction temperature, 45 ℃; and fi nal concentration, 0.3%. Three parallel experiments conducted under the optim ized conditions gave an average deproteinization rate of 88.654% and 99.062% w ith relative standard derivation (RSD) of 0.905% and 0.679% for TCA and GDL, respectively. Comparison of the two deproteinization methods showed that the deproteinization eff i ciency of GDL method was higher and more stable.
Key words:Patinopecten yessoensis; polysaccharide; trichloroacetic acid; D-glucono-δ-lactone; deproteinization
DOI:10.7506/spkx1002-6630-201718033
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2017)18-0208-06引文格式:
刘瑀, 方志强, 刘宇馨, 等. 虾夷扇贝多糖提取及纯化方法的优化[J]. 食品科学, 2017, 38(18): 208-213.
DOI:10.7506/ spkx1002-6630-201718033. http://www.spkx.net.cn
LIU Yu, FANG Zhiqiang, LIU Yuxin, et al. Op tim ization of extraction and purification of polysaccharides from Patinopecten yessoensis[J]. Food Science, 2017, 38(18): 208-213. (in Chinese w ith Eng lish abstract) DOI:10.7506/spkx1002-6630-201718033. http://www.spkx.net.cn
收稿日期:2016-11-09
基金项目:“十二五”国家科技支撑计划项目(2015BAD17B05)
作者简介:刘瑀(1965—),男,教授,博士,研究方向为海洋环境化学。E-m ail:ylsibo@foxm ail.com