
王占一1,张立华1,王玉海1,戴 博2,郑丹丹1,李卓瓦1
(1.枣庄学院生命科学学院,山东 枣庄 277160;2.中国人民解放军空军总医院药学部,北京 100142)
摘 要:为获得超声波辅助纤维素酶提取石榴幼果多酚的最佳工艺,以多酚得率为考察指标,在单因素试验基础上,通过Plackett-Burman(PB)试验设计筛选提取工艺中影响多酚得率的显著性因素,Box-Behnken试验设计和响应面分析法优化得出超声波辅助纤维素酶提取石榴幼果多酚的最佳工艺条件,采用体外α-葡萄糖苷酶抑制模型研究石榴幼果多酚对α-葡萄糖苷酶的抑制作用及其动力学性质。结果表明:当超声功率318 W、加酶量23 U/m L、酶解温度46 ℃和酶解时间2.7 h时,石榴幼果多酚平均得率为11.65%,与预测值误差很小。石榴幼果多酚具有较强抑制α-葡萄糖苷酶的活性,质量浓度为1.20 mg/m L时,对α-葡萄糖苷酶抑制率达到70.3%,抑制作用的IC50为0.747 mg/m L。在质量浓度0.24~1.20 mg/m L范围内,石榴幼果多酚与对α-葡萄糖苷酶抑制效果之间呈现一定的正相关关系,其抑制机理属于可逆性抑制和非竞争性抑制。
关键词:石榴幼果;多酚;超声波;纤维素酶;抑制α-葡萄糖苷酶活性
石榴(Punica granatum L.)是石榴科(Punicaceae)石榴属(Punica)多年生木本植物,原产于伊朗及其周边地区,中国各地均有栽培[1]。石榴的多数品种结果率高,尤其在成年树上,座果经常超越了负载,严重阻碍了石榴树自身的正常生长及果实的品质。为了减少养分的消耗,减缓生长与结果的矛盾,就必须进行合理疏果而实现稳产和高产,疏果下树的“石榴幼果”经常作为废物被丢弃,造成资源浪费[2]。近年来,大量研究证明成熟的石榴果皮和石榴籽中含有多种活性成分,其中含量最高的为酚酸类成分。蒲博等[3]研究发现,石榴皮中多酚类含量较高,对脂肪酸合成酶的抑制作用效果明显。赵国建等[4]研究发现,石榴籽中多酚类成分具有较强的清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的生物活性。多酚类成分广泛存在于植物幼果中,目前,研究较多的为苹果幼果[5]、梨幼果[6]、八月瓜幼果[7]等。而未成熟的石榴幼果中是否含有多酚类成分,国内外鲜有文献报道。
近年来,随着人们生活水平的提高,糖尿病逐渐成为人类健康的杀手,因而,积极寻找糖尿病治疗药物早已成为该领域的研究热点[8-9]。在临床上,抑制α-葡萄糖苷酶活性的制剂一直作为一线药物来应用,用于降低餐后血糖。植物中多酚类成分具有显著抑制α-葡萄糖苷酶活性,国内学者在这方面的研究较多,例如费群勤等[10]对乌龙茶多酚体外抗α-葡萄糖苷酶活性进行研究,柳余莉等[11]考察了杨梅多酚类成分对α-葡萄糖苷酶体外抑制作用,均取得了较好的阳性结果。黎英等[12]研究发现,采用超声波辅助酶法提取植物药材中的活性成分,通过产生高效的空化效应,使提取过程能够在相对较短时间内完成,有效避免了活性成分被氧化而使功效丧失,提取效率高。同时,具有条件温和、环境友好、可操作性强等诸多优点[13]。但是,采用超声波辅助纤维素酶提取石榴幼果中多酚类成分的研究,国内还鲜见文献报道。因此,本研究以石榴幼果为材料,采用超声波辅助纤维素酶法提取石榴幼果中多酚类成分,并对提取产物进行抑制α-葡萄糖苷酶活性的初步研究,为石榴资源的进一步开发利用提供依据。
1.1 材料与试剂
石榴幼果采自鲁南地区峄城“万亩石榴园”核心产区,经枣庄学院李思健副教授鉴定为正品石榴科石榴(Punica granatum L.)的幼果,实验材料低温干燥后,粉碎至规定粒度,备用。
没食子酸对照品(批号:110831-201204)、阿卡波糖对照品(批号:100808-201203) 中国食品药品检定研究院;4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrobenzeneα-D-g l u c o p y r a n o s i d e,P N P G)、纤维素酶(30 000 U/g)、α-葡萄糖苷酶(25 000 U/g)(均为分析纯) 西安沃尔森生物技术有限公司;福林-酚、对硝基苯酚(p-nitrophenol,PNP)、磷酸二氢钠、磷酸氢二钠、碳酸钠、无水乙醇(均为分析纯) 天津市大茂化学试剂厂。
1.2 仪器与设备
SYNERGYH 1型全功能酶标仪 美国柏腾仪器有限公司;HN-CQY型低温超声波萃取仪 上海汗诺仪器有限公司;RW 16型电子搅拌器 上海捷沪仪器仪表有限公司;102型电热鼓风干燥箱 威瑞科教仪器有限公司;XFB型万能粉碎机 湖南中诚制药机械厂;标准检验筛 浙江上虞华美仪器纱筛厂;AL104型电子天平梅特勒-托利(上海)有限公司;RE-201D型旋转蒸发仪巩义予华仪器有限公司;HH-S2型电热恒温水浴锅金坛市大地自动化仪器厂;SHB-Ⅲ型循环水真空泵上海比朗精密仪器有限公司。
1.3 方法
1.3.1 石榴幼果多酚含量测定
多酚含量测定采用福林-酚比色法[14-15]。精密称取干燥至质量恒定的没食子酸对照品12.5 mg,用蒸馏水定容至100 m L,制备成质量浓度为0.125 mg/m L的对照品溶液。精密量取对照品溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2 m L,分别置于25 m L具塞玻璃比色管中,依次加入10%福林-酚试剂12.5 m L、7.5% Na2CO3溶液10 m L,充分摇匀并用蒸馏水定容至25 m L,于25 ℃避光放置反应2 h。在760 nm波长处测定吸光度(A),并以A值作为纵坐标,没食子酸系列质量浓度为横坐标,绘制没食子酸标准曲线。求得回归方程为:A=0.125 7C-0.006 3(r=0.999 3,n=6),线性范围为0~6 µg/m L。
1.3.2 样品处理
准确称取粉碎至规定粒度的石榴幼果粉末5.0 g,置于250 m L干燥锥形瓶中,加入不同质量的纤维素酶至设定加酶量,再加入设定pH值磷酸缓冲盐溶液(phosphate buffer saline,PBS)至设定料液比例,用保鲜膜封住瓶口。设置超声波输出功率,控制反应温度始终为酶解温度,在超声波萃取仪上超声提取到设定时间后,取出,置于设定酶解温度水浴锅中,继续在一定搅拌速率条件下,酶解反应至设定时间(酶解时间从超声波提取开始累计)。反应结束后,立即在沸水中灭酶10 m in,抽滤,将滤液适当浓缩后,定容至100 m L。取滤液适量用AB-8大孔吸附树脂静态吸附,60%乙醇溶液洗脱后,用0.45 μm微孔滤膜过滤,减压蒸干后得到石榴幼果多酚固形物,称质量,备用。
准确称取精制后的石榴幼果多酚1.0 mg,用蒸馏水定容至100 m L,作为样品溶液,用于含量测定。准确量取1 m L于25 m L具塞比色管中,按照1.3.1节方法测定A值,计算样品中多酚得率及纯度[16],如式(1)、(2)所示:

1.3.3 单因素试验设计
单因素试验中,考察原料粒径(10、24、50、65、80、100 目)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/m L))、超声功率(150、200、250、300、350、400 W)、超声时间(10、15、20、25、30、35 m in)、加酶量(6、12、18、24、30、36 U/m L)、介质pH值(2、3、4、5、6、7)、酶解温度(20、30、40、50、60、70 ℃)和酶解时间(1.0、1.5、2.0、2.5、3.0、3.5 h)共计8 个因素对石榴幼果多酚得率的影响。每个水平重复3次取平均值计算分析,试验过程中的不变水平值为:原料粒径65目、料液比1∶25、超声功率300 W、超声时间25 m in、加酶量24 U/m L、介质pH 5、酶解温度50 ℃和酶解时间2.5 h。
1.3.4 Plackett-Burman(PB)试验设计
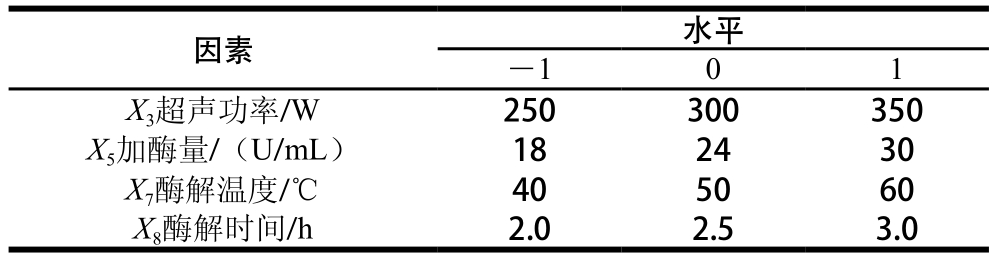
PB设计中,将1.3.3节中8 个单因素依次编码为X1、X2、X3、X4、X5、X6、X7和X8。对于每个因素,均设定高(+)、低(-)2 个水平,以石榴幼果多酚得率(Y)为响应值,X1~X8影响因素为自变量,共进行12 次试验,每个试验平行做3 次,取平均值。PB试验设计因素水平见表1。
表1 PB试验设计因素与水平
Tab le 1 Factors and levels used in the PB design

1.3.5 Box-Behnken试验设计
根据PB试验结果,选取超声功率(X3)、加酶量(X5)、酶解温度(X7)和酶解时间(X8)作为Box-Behnken试验设计的4个自变量,建立响应值与自变量之间的函数关系,进而寻求石榴幼果多酚提取工艺的最优组合。Box-Behnken试验设计因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Tab le 2 Factors and levels used in the Box-Behnken design
1.3.6 石榴幼果多酚抑制α-葡萄糖苷酶活性
1.3.6.1 PNP标准曲线的绘制
精确称取适量PNP,用PBS(pH 6.8)溶解配制成2.0 mmol/L的母液。吸取少量PNP母液依次配制成0、0.2、0.4、0.6、0.8、1.0、1.2 mmol/L浓度梯度的标准溶液。取上述标准溶液各0.5 m L,加入1 mol/L的Na2CO3溶液0.5 m L,混匀后静置1 m in,用酶标仪在405 nm波长处测定吸光度[17]。并以该吸光度作为纵坐标,PNP系列浓度为横坐标,绘制PNP标准曲线。求得回归方程为:A=0.708 6C+0.001 2(r=0.999 2,n=6),线性范围为0~0.6 mmol/L。
1.3.6.2 抑制率的测定
参考文献[18-20]方法,略有改动。在96 孔板中加样,将实验分成5 组,每组3 个平行。样品组:依次加入80 µL PBS(pH 6.8)、10 µL α-葡萄糖苷酶溶液(3 U/m L)和10 µL样品溶液,充分混匀,在37 ℃温育15 m in,加入20 µL 2.4 mmol/L PNPG溶液,在37 ℃温育30 m in;温育结束后,加入40 µL 1 mol/L Na2CO3溶液终止反应,用酶标仪在405 nm波长处测定吸光度;由于PNPG在α-葡萄糖苷酶的作用下能水解产生葡萄糖和PNP,因此,可以根据测得的吸光度,计算出产物PNP的产量。样品空白组:以PBS代替酶液,其他试剂同样品组;阴性对照组:以PBS代替样品溶液,其他试剂同样品组;空白组:以PBS代替酶液和样品溶液,其他试剂同样品组;阿卡波糖组:以阿卡波糖代替样品溶液[21],其他试剂的加入顺序同样品组。根据式(3)计算石榴幼果多酚对α-葡萄糖苷酶的抑制率。当抑制率为50%时,所得到抑制剂的质量浓度,即为该抑制剂对底物的IC50值。
式中:A1、A2、A3和A4分别为样品组、样品空白组、阴性对照组和空白组的吸光度。
1.3.6.3 酶抑制动力学分析
由前期大量实验研究得知,反应体系α-葡萄糖苷酶反应初速率维持时间不小于28 m in。固定样品溶液质量浓度(1.20 mg/m L)和底物PNPG浓度(2.4 mmol/L),α-葡萄糖苷酶含量分别为1、2、3、4、5 U/m L,在该条件下将实验分为两组,一组加入石榴幼果多酚,另一组不加入石榴幼果多酚,而以PBS代替,分别测定两组反应初速率[22]。以加入反应体系前的α-葡萄糖苷酶浓度为横坐标,初速率为纵坐标作图,确定石榴幼果多酚对α-葡萄糖苷酶的抑制是否属于可逆性抑制类型。
分别以浓度递增的PNPG(0.8、1.6、2.4、3.2、4.0 mmol/L)为底物,加入不同质量浓度(0.24、0.48、0.72、0.96、1.20 mg/m L)的石榴幼果多酚,分别测定其在20 m in时的吸光度。以反应速率的倒数(1/v)为纵坐标,加入反应体系前底物PNPG浓度的倒数(1/[S])为横坐标作图,确定石榴幼果多酚对α-葡萄糖苷酶的抑制反应的类型[23]。
1.4 数据分析
PB试验设计和Box-Behnken试验设计采用Design-Expert 8.0.5统计分析软件,图形制作采用Excel数据处理软件。
2.1 单因素试验结果
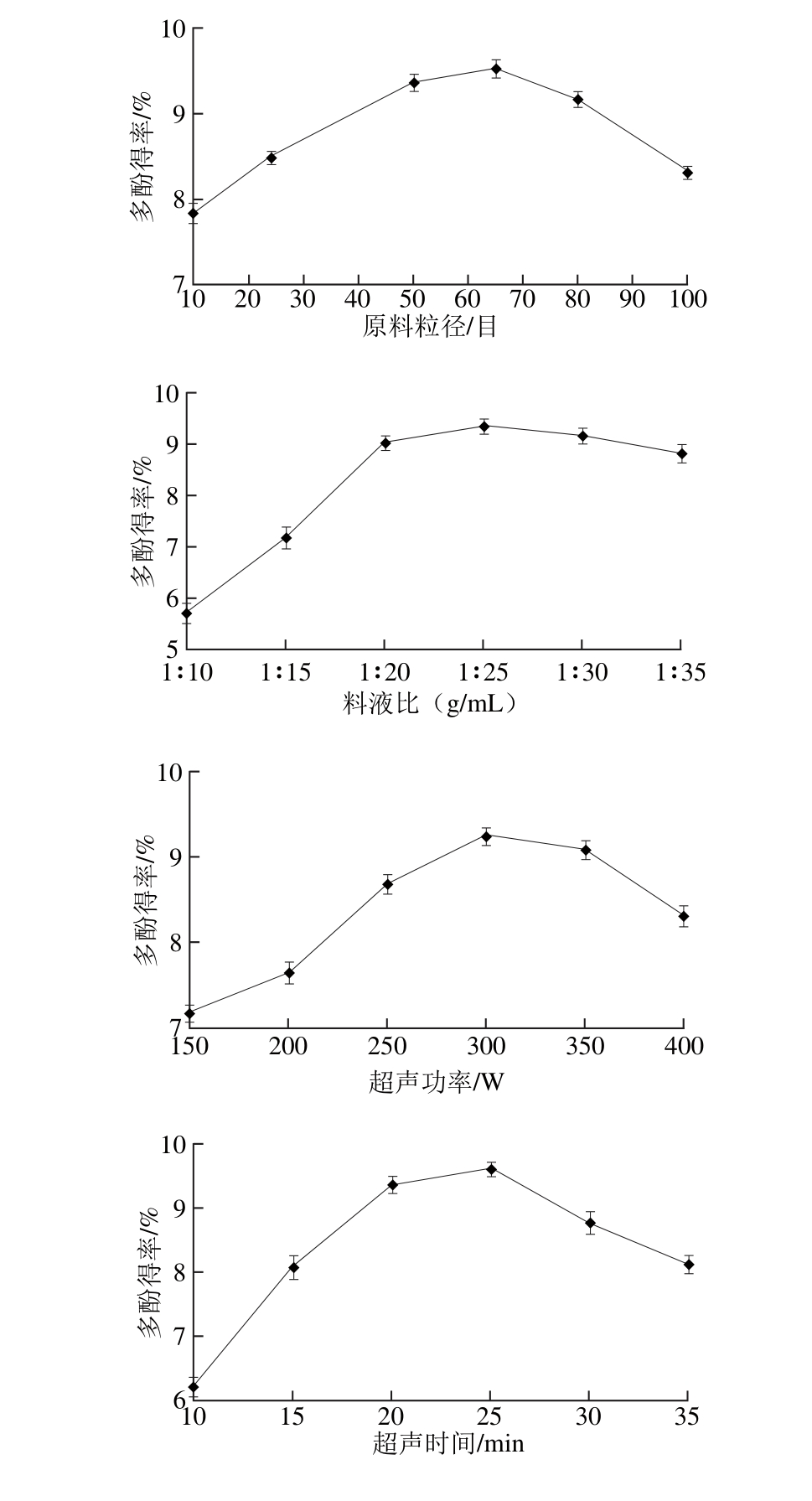
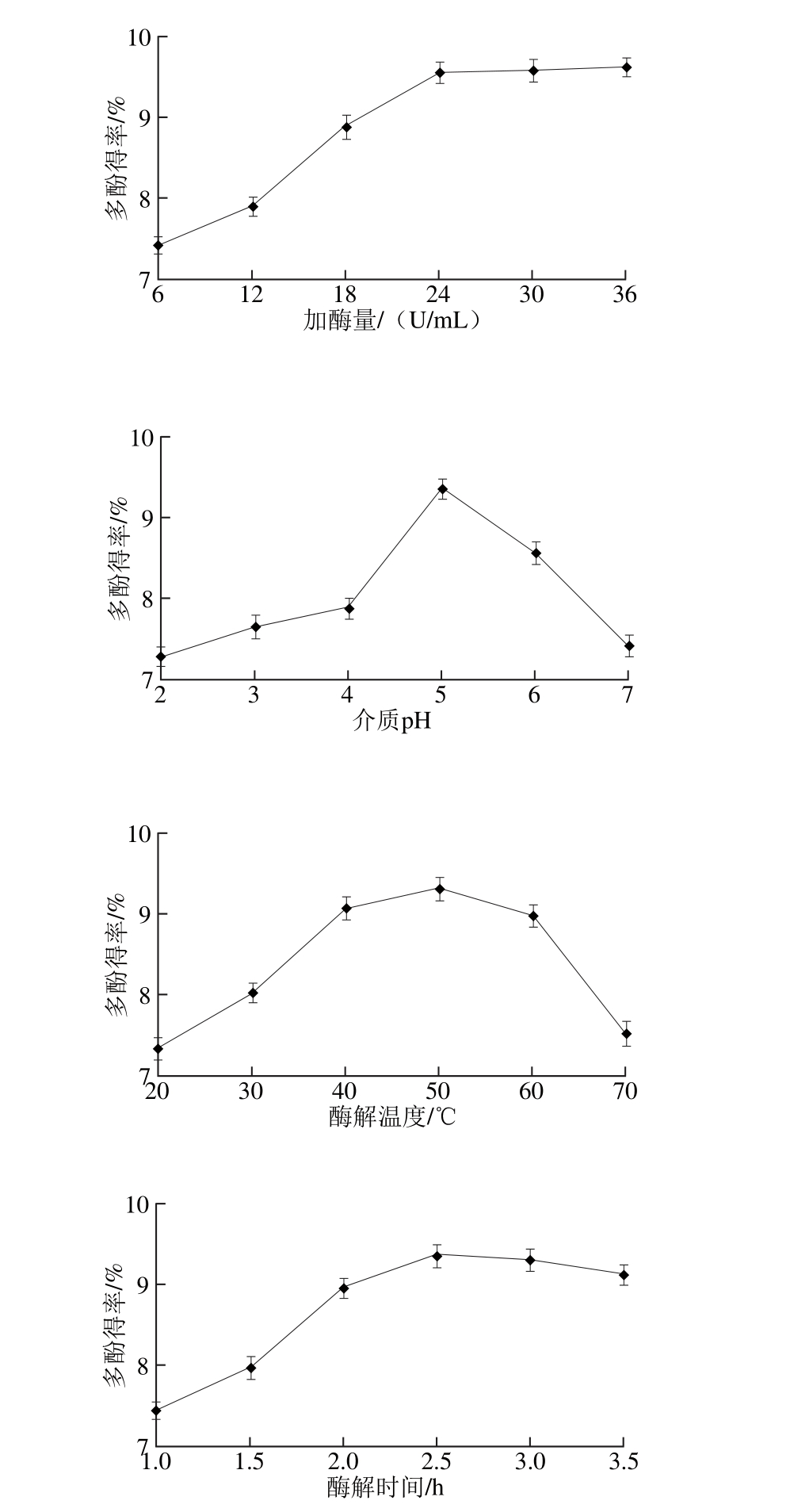
图1 各因素对石榴幼果多酚得率的影响
Fig. 1 Effects o f various factors on the yield of polypheno ls from pom egranate fruitlets
由图1可知,从提高石榴幼果多酚得率、工作效率和节约能源多方面考虑,单因素中控制原料粒径在50~80目,料液比在1∶20~1∶30,超声功率在250~350 W,超声时间在20~30 m in,加酶量在18~30 U/m L,介质pH 4~6,酶解温度在40~60 ℃,酶解时间在2.0~3.0 h范围内,石榴幼果多酚得率相对较高。
2.2 PB试验设计结果
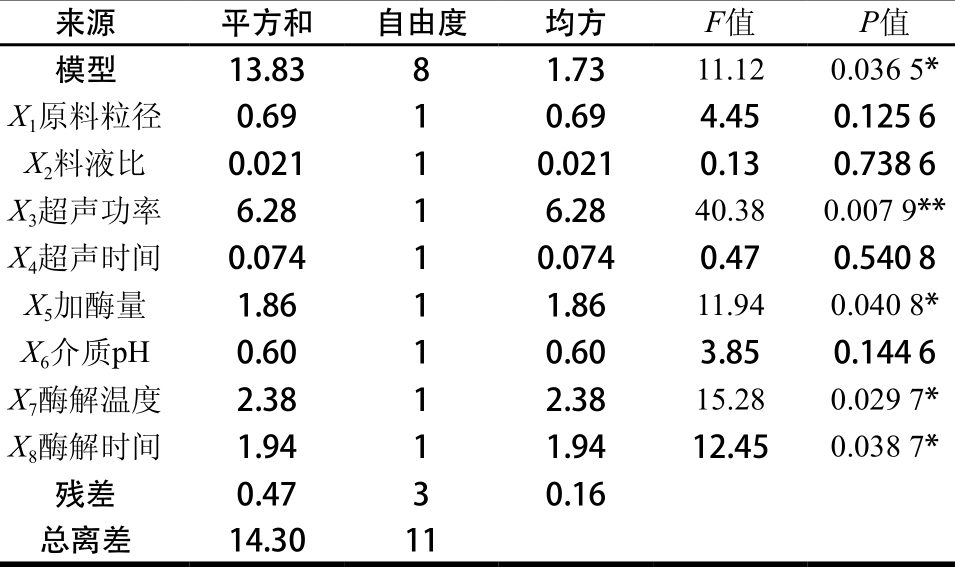
PB试验方案由Design-Expert 8.0.5统计软件提供,以石榴幼果多酚得率作为响应值,选用n=12试验设计模块,对X1~X8这8 个影响因素进行筛选,得出对试验结果影响显著的因素。试验方案及结果见表3,全因素方差分析结果见表4。
表3 PB试验设计方案及结果
Tab le 3 PB design w ith experim en tal resu lts
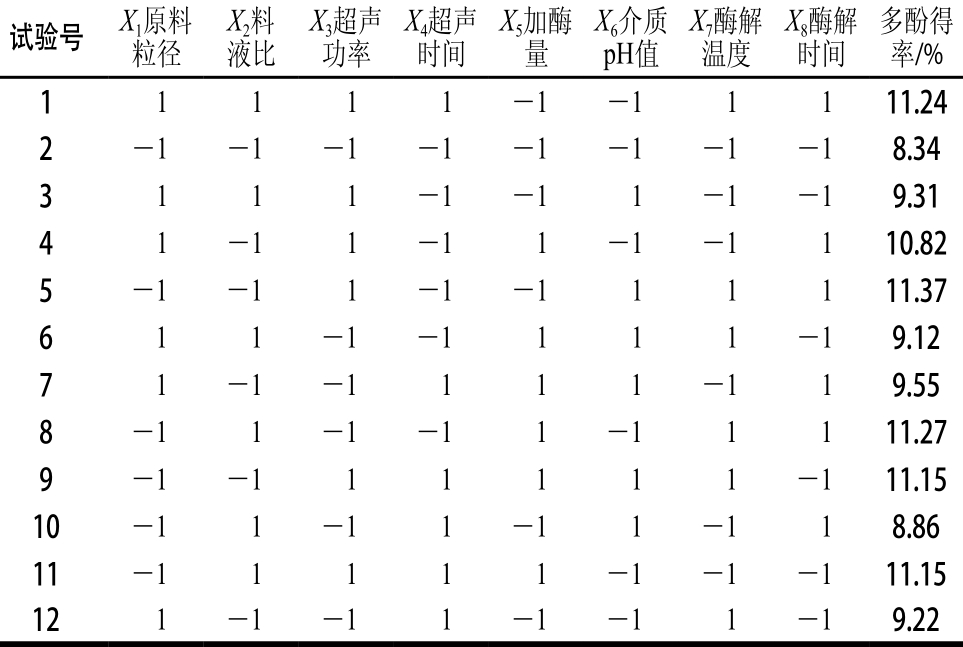
表4 PB试验方差分析
Tab le 4 Analysis o f variance o f the experim en tal resu lts o f PB design
注:**.差异极显著(P<0.01);*.差异显著(P<0.05)。表6同。
由表4可知,模型的P值为0.036 5,达到显著水平,相关系数R2为0.967 4,说明模型拟合良好,可信度较高[24]。超声功率(X3)、加酶量(X5)、酶解温度(X7)、酶解时间(X8)4 个因素影响显著,其余4个因素影响均不显著(P>0.05)。因此,在后面Box-Behnken试验设计中,应重点考察超声功率、加酶量、酶解温度和酶解时间的最优条件。考虑到效率与成本的问题,在后面优化试验中,固定原料粒径65 目、料液比1∶25、超声时间25 m in和介质pH 5。
2.3 Box-Behnken试验设计及显著性分析
Box-Behnken试验方案由Design-Expert 8.0.5统计软件提供,以石榴幼果多酚得率作为响应值,考察超声功率、加酶量、酶解温度和酶解时间4 个因素对于结果的影响,以得出最优试验条件。Box-Behnken试验方案与结果见表5,方差分析结果见表6。
对表5中的数据,采用响应面方法分析试验结果,得到石榴幼果多酚得率(Y)的二次回归方程为:
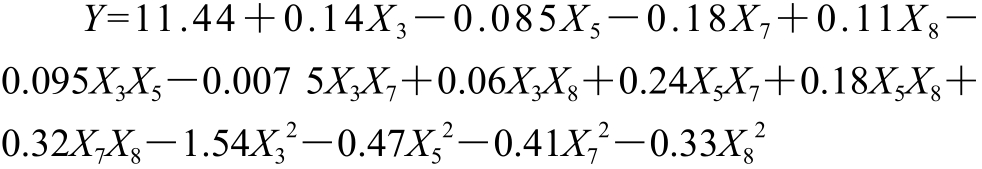
表5 Box-Behnken试验设计方案及结果
Tab le 5 Box-Behnken design w ith experim en tal resu lts
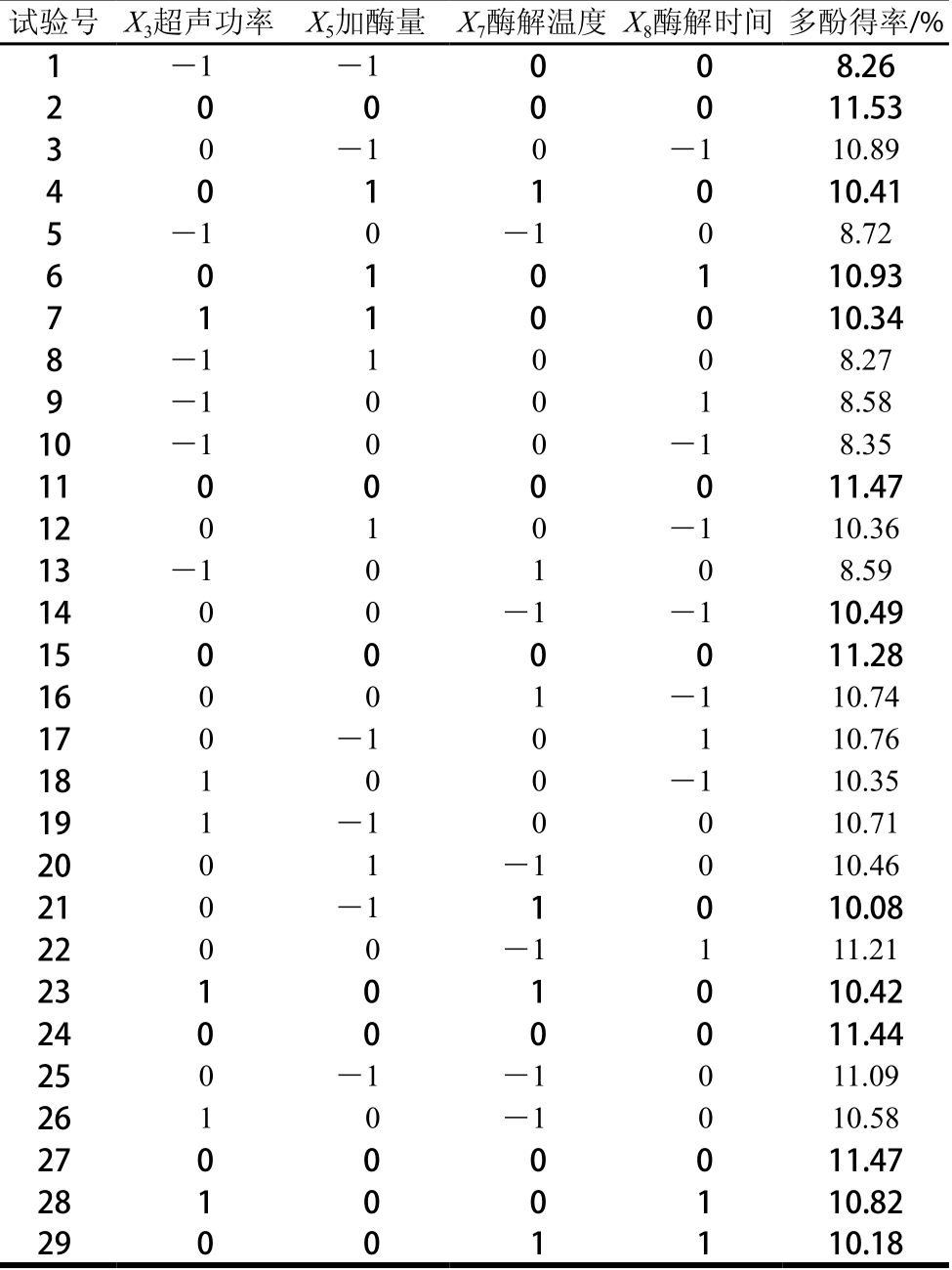
表6 Box-Behnken试验方差分析
Table 6 Analysis of variance of the regression model established using Box-Behnken design
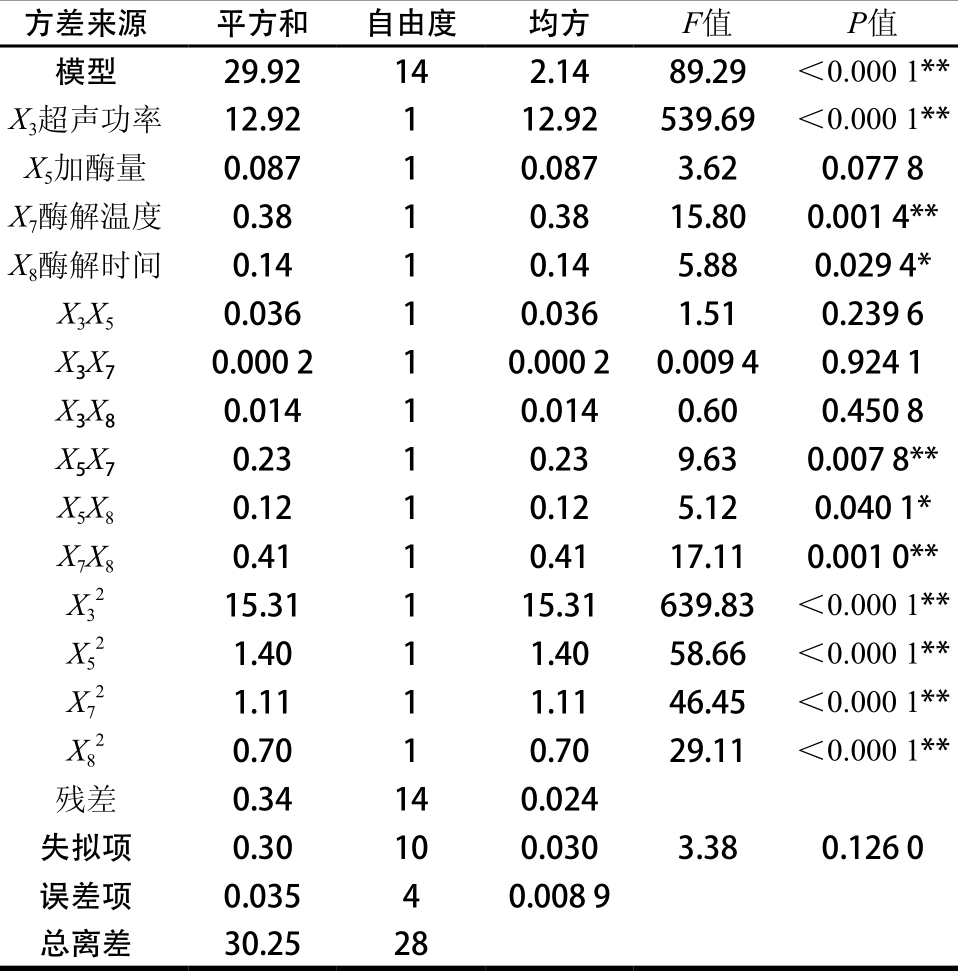
由表6可知,模型的P值小于0.000 1,达到极显著水平,决定系数R2为0.988 9,失拟项P值为0.126 0,影响不显著,说明回归方程的拟合情况良好[25-26]。一次项X3、X7,交互项X5X7、X7X8和二次项X32、X52、X72、X82影响极显著;一次项X8、交互项X5X8影响显著。4 个影响因素中,对石榴幼果多酚得率影响最大的为超声功率,其次为酶解温度和酶解时间,影响最小的为加酶量。
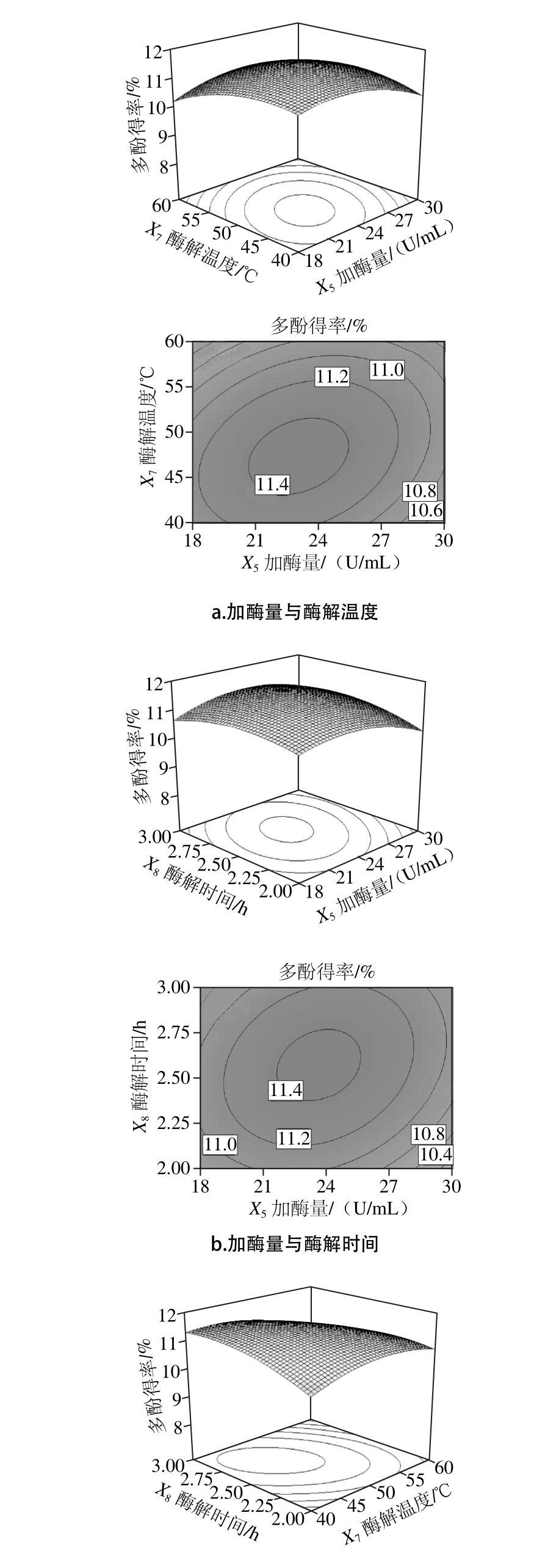
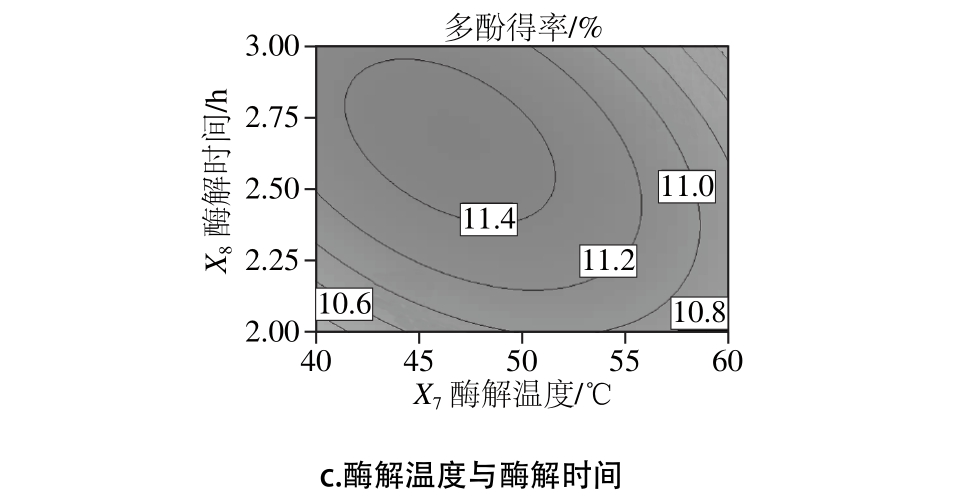
图2 各因素交互作用对石榴幼果多酚得率影响的响应面与等高线图
Fig. 2 Response su rface and con tour p lo ts show ing the in teractive effects o f extraction param eters on the yield o f po lypheno ls from pom egranate fruitlets
图2 为两两因素之间交互影响的响应面图[27],在此重点考察影响显著的两因素间的交互效应。由图2a可知,X5X7响应面曲线陡峭,等高线密集呈椭圆形,酶解温度的变化曲面比加酶量的变化曲面陡峭,说明酶解温度比加酶量的影响更显著一些。由图2b可知,X5X8响应面曲线较陡峭,等高线略呈椭圆形,酶解时间的变化曲面较陡峭,而加酶量的变化曲面相对平缓,说明酶解时间比加酶量的影响更显著一些。由图2c可知,X7X8响应面曲线陡峭,等高线密集呈椭圆形,交互作用极其显著,与方差分析结果一致。
2.4 最佳工艺条件的确定及验证
根据回归模型,可以得出超声波辅助纤维素酶提取石榴幼果多酚的最佳工艺条件为超声功率317.5 W、加酶量22.98 U/m L、酶解温度46 ℃、酶解时间2.675 h,石榴幼果多酚得率的模型预测值为11.68%。上述参数在实际操作中无法实现,因此将工艺参数修正为:超声功率318 W、加酶量23 U/m L、酶解温度46 ℃和酶解时间2.7 h。在该工艺条件下,进行3 次平行验证实验,测得石榴幼果多酚平均得率为11.65%,与预测值误差很小,说明应用Box-Behnken试验设计优化所得工艺参数是可靠的。
2.5 石榴幼果多酚抑制α-葡萄糖苷酶活性
纯化后的石榴幼果多酚固体物质,应用公式(2)计算得出纯度约为69.3%。以该纯度的石榴幼果多酚固形物,通过含量换算依次配制成质量浓度为0.24、0.48、0.72、0.96、1.20、1.44、1.68 mg/m L的石榴幼果多酚样品溶液,用于抑制α-葡萄糖苷酶活性测定。同时,将阿卡波糖依次配制成质量浓度为0.06、0.12、0.18、0.24、0.48、0.72、0.96、1.20 mg/m L的对照溶液。以加入反应体系前抑制剂的质量浓度为横坐标,对应的抑制率为纵坐标,绘制抑制曲线,见图3。
由图3可知,石榴幼果多酚对α-葡萄糖苷酶具有较强的抑制作用,当多酚质量浓度小于1.20 mg/m L时,随着质量浓度的增加,对α-葡萄糖苷酶的抑制率增加趋势明显,当质量浓度达到1.20 mg/m L时,抑制率达到70.3%。而此后,再增加多酚质量浓度,抑制率几乎不再增加,原因可能是当多酚质量浓度超过一定值时,对α-葡萄糖苷酶的抑制率达到饱和[8,28]。在0.24~1.20 mg/m L范围内,石榴幼果多酚的质量浓度与对α-葡萄糖苷酶的抑制率之间存在着正相关性,拟合方程:y=51.58x+11.46,相关系数R2为0.976。通过拟合方程算出石榴幼果多酚对α-葡萄糖苷酶抑制作用的IC50为0.747 mg/m L,同理,阿卡波糖对α-葡萄糖苷酶抑制作用的IC50为0.321 mg/m L,可见石榴幼果多酚对α-葡萄糖苷酶的抑制活性低于阿卡波糖[29]。
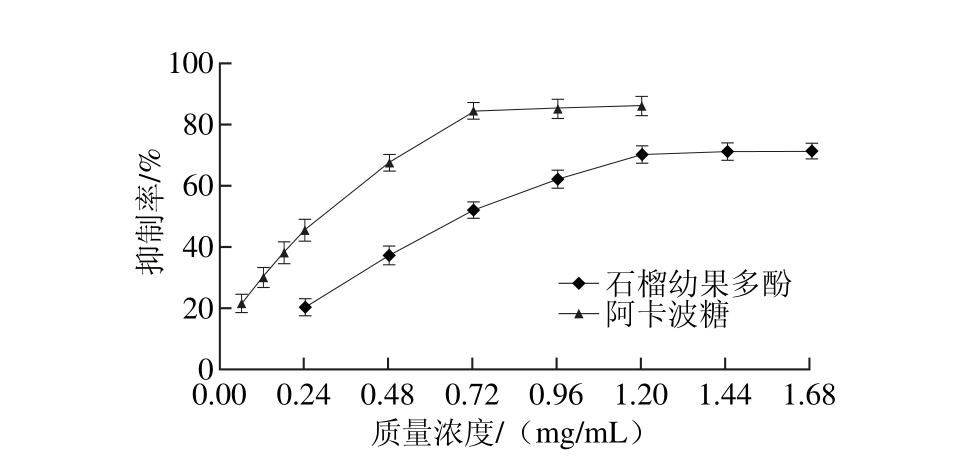
图3 石榴幼果多酚对α-葡萄糖苷酶抑制作用曲线
Fig. 3 Concentration-dependent curves of anti-α-glucosidase activity of the po lyphenols
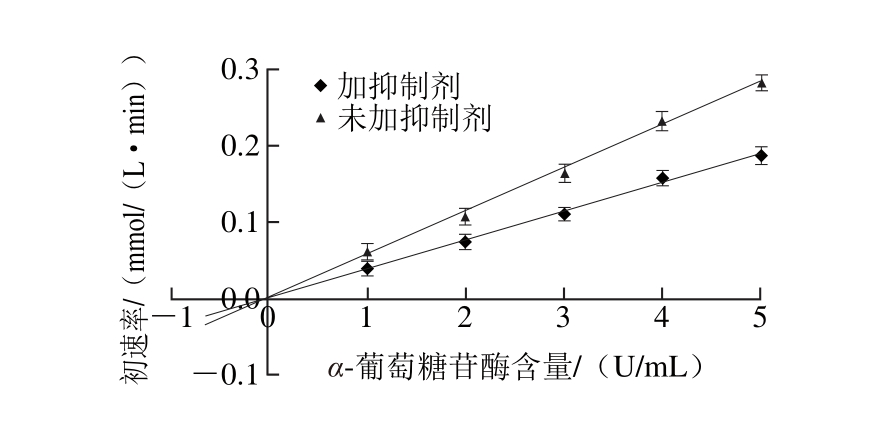
图4 酶含量-反应初速率曲线
Fig. 4 Enzym e concentrate vs initial reaction rate curve
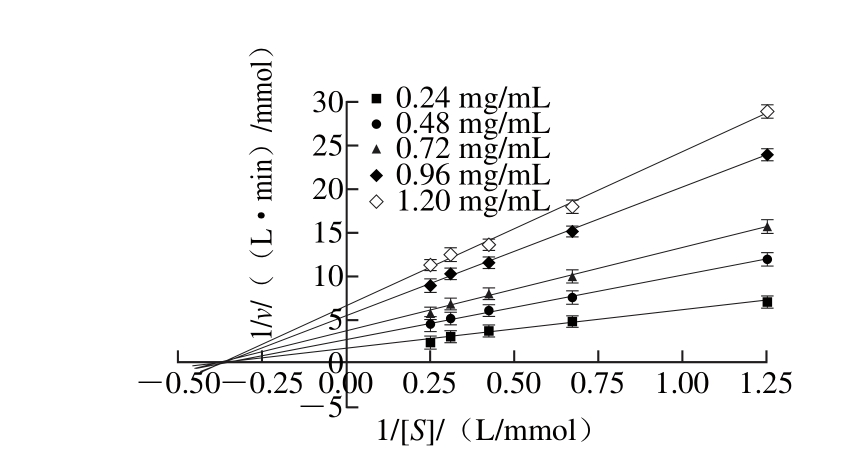
图5 石榴幼果多酚的Linew eaver-Bu rk曲线
Fig. 5 Linew eaver-Bu rk curve o f the po lypheno ls
由图4可知,反应体系中,加入石榴幼果多酚组与未加入石榴幼果多酚组,所得到的两条酶含量-反应初速率曲线均近似通过了原点。加入石榴幼果多酚组的直线斜率低于未加入组,由此可以推测石榴幼果多酚对α-葡萄糖苷酶的抑制类型属于可逆性抑制。由图5可知,随着石榴幼果多酚质量浓度的增加,反应初速率呈下降趋势。但是,5组不同质量浓度下的Lineweaver-Burk曲线在X轴负半轴的交点几乎都是一点,表明米氏常数(Km)之间不存在明显差异,具备非竞争性抑制作用特点[30],说明石榴幼果多酚对α-葡萄糖苷酶的抑制类型又属于非竞争性抑制。即使底物浓度升高也不能降低石榴幼果多酚的抑制活性,石榴幼果多酚的抑制作用与其质量浓度有关,而与底物浓度关系较小。
以石榴幼果为实验材料,在单因素试验基础上,通过PB试验设计结合Box-Behnken试验设计,优化得出超声波辅助纤维素酶提取石榴幼果多酚的最佳工艺条件为超声功率318 W、加酶量23 U/m L、酶解温度46 ℃、酶解时间2.7 h,此条件下的石榴幼果多酚得率达到11.65%。石榴幼果多酚抑制α-葡萄糖苷酶活性分析结果表明:石榴幼果多酚对α-葡萄糖苷酶活性具有较强的抑制作用,质量浓度为1.20 mg/m L时,抑制率达到70.3%,对α-葡萄糖苷酶抑制作用的IC50为0.747 mg/m L。在一定的质量浓度范围内,石榴幼果多酚与对α-葡萄糖苷酶抑制效果之间呈现一定的正相关关系。其抑制机理属于可逆性抑制和非竞争性抑制,抑制作用可以不受底物浓度影响,治疗糖尿病时,可以通过增大剂量来增强抑制效果,这使得石榴幼果多酚有望成为新一代α-葡萄糖苷酶抑制剂,也为开发利用石榴幼果资源提供理论依据。
参考文献:
[1] 汪小飞, 周耘峰, 黄埔, 等. 石榴品种数量分类研究[J]. 中国农业科学, 2010, 52(5): 1093-1098. DO I:10.3864/ j.issn.0578-1752.2010.05.026.
[2] 黄漫青, 周湘元. 桃树废弃幼果的利用[J]. 北京农学院学报, 1999, 14(3): 39-42.
[3] 蒲博, 李冰, 杨舒慧, 等. 石榴皮多酚分离纯化及对脂肪酸合成酶抑制作用的研究[J]. 食品科学, 2014, 35(17): 99-103. DOI:10.7506/ spkx1002-6630-201417020.
[4] 赵国建, 李桂峰, 董周永, 等. 石榴籽中多酚的提取及其抗氧化作用研究[J]. 西北植物学报, 2008, 28(12): 2532-2537. DOI:10.3321/ j.issn:1000-4025.2008.12.027.
[5] 陈磊, 郭玉蓉, 刘永峰, 等. 5-氨基乙酰丙酸对苹果幼果多酚含量、苯丙氨酸解氨酶活性及其基因表达的影响[J]. 食品科学, 2014, 35(11): 135-138. DOI:10.7506/spkx1002-6630-201411027.
[6] 赵梅, 张绍铃, 齐开杰, 等. 梨幼果多酚提取工艺优化及其成分分析[J].食品工业科技, 2013, 34(6): 268-271.
[7] 顾仁勇, 杨万根, 余佶. 响应面优化超临界CO2萃取八月瓜幼果多酚工艺[J]. 食品科学, 2015, 36(10): 76-80. DOI:10.7506/spkx1002-6630-201510015.
[8] 季芳, 肖国春, 董莉, 等. 药用植物来源的α-葡萄糖苷酶抑制剂研究进展[J]. 中国中药杂志, 2010, 35(12): 1633-1640.
[9] 张红城, 孙庆申, 王光新, 等. 蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用[J]. 食品科学, 2011, 32(5): 108-110.
[10] 费群勤, 秦一禾, 杨孟伽, 等. 乌龙茶多酚、EGCG和EGCG3〞M e体外抑制α-葡萄糖苷酶活性[J]. 食品科学, 2014, 35(21): 10-15. DOI:10.7506/spkx1002-6630-201421003.
[11] 柳余莉, 杨文康, 刘合生, 等. 杨梅多酚粗提物提取对α-葡萄糖苷酶体外抑制作用的研究[J]. 果树学报, 2015, 33(1): 59-65.
[12] 黎英, 陈雪梅, 严月萍, 等. 超声波辅助酶法提取红腰豆多糖工艺优化[J]. 农业工程学报, 2015, 31(15): 293-301. DOI:10.11975/ j.issn.1002-6819.2015.15.040.
[13] 刁文超, 王然, 王凤舞, 等. 超声波协同复合酶法提取南瓜多糖工艺优化[J]. 食品科学, 2012, 33(18): 14-20.
[14] 李斌, 雷月, 孟宪军, 等. 响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J]. 食品科学, 2015, 36(22): 33-39. DOI:10.7506/spkx1002-6630-201522006.
[15] SIL V A E M, ROGEZ H, LARONDELLE Y. Optim ization of extraction of phenolics from Inga edulis leaves using response surface methodology[J]. Separation and Purif i cation Technology, 2007, 55(3): 381-387. DOI:10.1016/j.seppur.2007.01.008.
[16] 黄秀香, 赖红芳, 罗丽程. 超声波协同复合酶法提取半边莲多糖工艺优化[J]. 中国实验方剂学杂志, 2012, 18(5): 44-46. DOI:10.3969/ j.issn.1005-9903.2012.05.015.
[17] 易醒, 桂菲菲, 尹红梅, 等. 泽泻对鼠源α-葡萄糖苷酶的抑制作用[J].天然产物研究与开发, 2013, 25(12): 1644-1648.
[18] 秦晶晶, 李齐激, 薛琰, 等. 刺梨总三萜提取方法及其α-葡萄糖苷酶抑制活性研究[J]. 食品工业科技, 2014, 35(10): 186-189. DOI:10.13386/j.issn1002-0306.2014.10.033.
[19] JIN Fengw ei, YUAN Yuan li, FU Deshang. An tioxidan t activities, α-g lucosidase inhibitory in vitro and effects of Lysimachia paridiformis Franch. var. stenophylla Franch. on alloxan-induced diabetic m ice in vivo[J]. Journal of Medicinal Plants Research, 2012, 6(14): 2793-2800. DOI:10.5897/JMPR11.1158.
[20] CHENG Ning, YI Wenb in, WANG Qiq in, et al. Syn thesis and α-glucosidase inhibitory activity of chrysin, diosmetin, apigenin, and luteo lin derivatives[J]. Chinese Chem ical Letters, 2014, 25(7): 1094-1098. DOI:10.1016/j.cclet.2014.05.021.
[21] 张钟, 吴文婷, 王萍, 等. 荔枝水溶性多糖作为α-葡萄糖苷酶抑制剂的活性测定[J]. 食品科学, 2013, 34(13): 175-179. DOI:10.7506/ spkx1002-6630-201313038.
[22] 刘富月, 王晓东, 李守鹏, 等. 不同品种生姜提取物对α-葡萄糖苷酶的抑制作用[J]. 食品与发酵工业, 2014, 40(12): 6-9. DOI:10.13995/ j.cnki.11-1802/ts.201412002.
[23] 康文艺, 张丽, 宋艳丽. 茜草抑制α-葡萄糖苷酶活性成分研究[J]. 中国中药杂志, 2009, 34(9): 1104-1107. DOI:10.3321/j.issn:1001-5302.2009.09.011.
[24] PRASAD K N, KONG K W, RAMANAN R N, et al. Determ ination and op tim ization o f flavonoid and extract yield from b row n m ango using response surface m ethodo logy[J]. Separation Science and Technology, 2012, 47(1): 73-80. DOI:10.1080/01496395.2011.606257.
[25] 王占一, 郑丹丹, 王京龙, 等. 响应面试验优化超声波辅助提取石榴皮中三萜类化合物工艺及动力学分析[J]. 食品科学, 2015, 36(22): 11-17. DOI:10.7506/spkx1002-6630-201522003.
[26] SUN Yi, WU Wenq ing, ZHANG Wenq in, et al. Op tim izing the extraction of pheno lic antidants from Kudingcha made from Ilex kudingcha C.J. Tseng by using response surface m ethodo logy[J]. Separation and Purification Techno logy, 2011, 78(3): 311-320. DOI:10.1016/j.seppu r.2011.01.038.
[27] LIU Qid i, QIN Kunm ing, SHEN Bao jia, et a l. Op tim ization o f the p rocessing techno logy o f Fructus Arctii by response su rface m ethodo logy[J]. Chinese Journal o f Natural Medicines, 2015, 13(3): 222-231. DOI:10.3724/SP.J.1009.2015.00222.
[28] ZHU F, ASADA T, SATO A, et al. Rosmarinic acid extract for antioxidant antiallergic, and α-glucosidase inhibitory activities, isolated by supramolecular technique and solvent extraction from Perilla leaves[J]. Journal of Agricultural and Food Chem istry, 2014, 62(4): 885-892. DOI:10.1021/jf404318j.
[29] 罗晶洁, 王尉, 曹学丽. 桑叶多糖的分离纯化及对α-葡萄糖苷酶的抑制活性[J]. 食品科学, 2011, 32(3): 112-116.
[30] 李波, 包怡红, 高峰, 等. 红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J]. 食品工业科技, 2015, 36(1): 63-65. DOI:10.13386/j.issn1002-0306.2015.01.004.
Op tim ization o f Ultrasonic-Assisted Cellu lase-Based Extraction and Anti-α-Glucosidase Activity of Po lypheno ls from Pom egranate Fruitlets
WANG Zhanyi1, ZHANG Lihua1, WANG Yuhai1, DAI Bo2, ZHENG Dandan1, LI Zhuow a1
(1. Co llege o f Life Sciences, Zaozhuang University, Zaozhuang 277160, China; 2. Departm ent o f Pharm aco logy, General Hosp ital o f Air Force, Peop le’s Liberation Arm y o f China, Beijing 100142, China)
Abstract:This study aimed to optim ize the ultrasonic-assisted cellulase-based extraction of polyphenols from pomegranate fruitlets. The factors w ith a signif i cant inf l uence on the yield of polyphenols were selected using a combination of one-factorat-a-time method and Plackett-Burman (PB) design for the optim ization experiments which were carried out using Box-Behnken design combined w ith response surface methodology. The anti-α-glucosidase activity and kinetics characteristics of the polyphenols were determ ined by using α-glucosidase inhibition model in vitro. Results showed that under the follow ing conditions: ultrasonic pow er, 318 W; enzyme dosage, 23 U/m L; hydrolysis temperature, 46 ℃; and hydrolysis time, 2.7 h, the average yield of polyphenols from pomegranate fruitlets was 11.65%, close to the predicted value. The polyphenols had a strong anti-α-glucosidase activity. The percentage inhibition of α-glucosidase by the polyphenols at a concentration of 1.20 mg/m L reached 70.3% and the half inhibitory concentration (IC50) was 0.747 mg/m L. There was a positive relationship between the anti-α-glucosidase activity and polyphenol concentration in the range of 0.24–1.20 mg/m L. The inhibition was reversible and non-competitive.
Key words:pomegranate fruitlet; polyphenol; ultrasonic-assisted extraction; cellulose; anti-α-glucosidase activity
DOI:10.7506/spkx1002-6630-201718034
中图分类号:R284.2
文献标志码:A
文章编号:1002-6630(2017)18-0214-08
引文格式:
王占一, 张立华, 王玉海, 等. 超声波辅助纤维素酶提取石榴幼果多酚及其抑制α-葡萄糖苷酶活性[J]. 食品科学, 2017, 38(18): 214-221. DOI:10.7506/spkx1002-6630-201718034. http://www.spkx.net.cn
W ANG Zhanyi, ZHANG Lihua, WANG Yuhai, et al. Optim ization of ultrasonic-assisted cellulase-based extraction and antiα-g lucosidase activity of polyphenols from pom egranate fruitlets[J]. Food Science, 2017, 38(18): 214-221. (in Chinese w ith
Eng lish abstract)
DOI:10.7506/spkx1002-6630-201718034. h ttp://www.spkx.net.cn
收稿日期:2016-10-29
基金项目:2015年度国家星火计划项目(2015GA740027);山东省自然科学基金项目(ZR2013BL018);山东省重点研发计划项目(2016GSF202010)
作者简介:王占一(1980—),男,讲师,硕士,主要从事天然药物活性成分提取与分离研究。E-m ail:zhyiw ang@126.com