
王 立1,2,邹 烨2,*,张 坤3,于 海1,*
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.南京财经大学食品科学与工程学院,江苏 南京 210023)
摘 要:以鸭肝为原料,以NaOH溶液为提取剂,采用超声辅助提取,通过响应面分析方法优化鸭肝蛋白提取工艺条件,并比较常规碱提和超声辅助碱提鸭肝蛋白的抗氧化性能。结果显示,鸭肝蛋白的最佳提取条件为超声功率256 W、超声时间43 m in、pH 11,此时鸭肝蛋白的得率达到73.1%;抗氧化实验结果表明:超声提取鸭肝蛋白清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhyd razyl,DPPH)自由基、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazo line-6-su lphonate) free radical,ABTS+·)、羟自由基IC50值分别为1.97、0.168、0.529 m g/m L,其中鸭肝蛋白对ABTS+·清除效果较强,其还原力较高;与常规碱提蛋白相比,超声辅助碱提鸭肝蛋白的抗氧化能力提高显著(P<0.05)。因此,超声辅助碱提鸭肝蛋白具有较好的抗氧化性。该研究为鸭肝的深加工提供了的一定的科学依据。
关键词:鸭肝蛋白;超声辅助碱提;响应面;抗氧化
动物肝脏是一种营养丰富的食品,富含蛋白质、脂肪、糖类、维生素和矿物质[1]。肝脏不仅是一种优质完全蛋白质源,含有多种人体必需氨基酸,且比例适当[2],同时还含大量的超氧化物歧化酶等,具有明显的抗脂质氧化作用[3],从而保护细胞和组织不受损伤,在一定程度上具有防止肿瘤发生[4]、抗衰老[5]、提高机体免疫力的作用[6],具有很高的应用价值。鸭肝属鸭科动物家鸭的肝脏,根据氨基酸营养评价[7],其中苯丙氨酸的含量最高。此外,鸭肝富含锌、铁、硒等矿物质元素[8]。根据营养质量指标[9],其中铁元素含量最高。此外锌、硒等元素含量较高,其中硒是重要的营养物质,具有预防心血管等重要功能[10]。目前蛋白质的提取方法一般多为碱提酸沉法。张耀兮[11]用碱提酸沉法提取牦牛肝蛋白的提取条件为NaOH质量分数1%、料液比1∶5、浸提时间60 m in、提取温度40 ℃、酸沉条件p H 4.0,牦牛肝蛋白得率为77.91%。本实验采用超声辅助碱法提取鸭肝蛋白,超声是一种新颖、简单、绿色、安全、快速的技术,具有提取时间短、得率高、溶剂用量少等优点,适用于食品来源的蛋白质提取[12-13]。虽然鸭肝的营养价值较高,但到目前为止,对鸭肝蛋白的深加工提取及生物活性研究鲜见报道。
本实验以新鲜鸭肝为原料,以NaOH溶液为提取剂,采用超声辅助碱提法提取鸭肝蛋白,考察不同超声功率、超声时间、超声温度、料液比、pH值对鸭肝蛋白得率的影响。在单因素试验基础上,通过响应面分析方法优化提取工艺,并进一步比较常规碱提和超声辅助碱提所得鸭肝蛋白的抗氧化性,对鸭肝蛋白的深加工提供一定的科学依据。
1.1 材料与试剂
鸭肝 南京市孝陵卫农贸市场。
1,1-二苯基-2-三硝基苯肼(1,1-d ip h en y l-2-p icrylhyd razyl,DPPH) 美国Sigm a公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 萨恩化学技术(上海)有限公司;考马斯亮兰 南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
HH-8数显恒温水浴锅 国华电器有限公司;T25DS25高速粉碎机 德国IKA公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;Uncen MR台式冷冻离心机 德国Hero Lab公司;M 124A电子天平意大利Bel公司;pH计 美国奥豪斯公司;UV-6100型分光光度计 上海美普达仪器有限公司;DGG-9023A电热恒温鼓风干燥箱 上海森信实验仪器有限公司;超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 鸭肝蛋白提取工艺流程
超声辅助提取:新鲜鸭肝(2 g)→切丁→匀浆(10 000 r /m in匀浆2 次,每次20 s,间隔10 s)→异丙醇脱脂(10%,静置12 h)→离心(5 000×g,10 m in)→干燥→超声辅助提取(超声功率:50~300 W;超声时间:10~60 m in;温度:20~70 ℃;料液比1∶30~1∶80;pH 9~13)→离心(5 000×g,15 m in)→取上清液→测吸光度(BCA试剂盒)→计算鸭肝蛋白质量浓度→其余粗提物→调至等电点(p H 4.5)→离心(13 400×g,30 m in)→得沉淀→蒸馏水洗至pH值中性→真空冷冻干燥→鸭肝蛋白粗品。
常规碱提:新鲜鸭肝(2 g)→切丁→匀浆(10 000 r /m in 匀浆2次,每次20 s,间隔10 s)→异丙醇脱脂(10%,静置12 h)→离心(5 000×g,10 m in)→干燥→常规提取(时间10~60 m in;温度:20~70 ℃;料液比1∶30~1∶80;p H 9~13)→离心(5 000×g,15 m in)→取上清液→测吸光度(BCA试剂盒)→计算鸭肝蛋白质量浓度→其余粗提物→调至等电点(pH 4.5)→离心(13 400×g,30 m in)→得沉淀→蒸馏水洗至pH值中性→真空冷冻干燥→鸭肝蛋白粗品。
1.3.2 鸭肝蛋白得率计算

1.3.3 超声辅助碱提优化试验设计
1.3.3.1 单因素试验
按工艺流程方法提取鸭肝蛋白,选取超声功率(50、100、150、200、250、300 W)、超声时间(10、20、30、40、50、60 m in)、料液比(1∶30、1∶40、1∶50、1∶60、1∶70、1∶80)、超声温度(20、30、40、50、60、70、80 ℃)以及pH值(9、10、11、12、13)几个因素进行单因素试验,探究各因素对鸭肝蛋白得率的影响。
1.3.3.2 响应面优化试验
在单因素试验的基础上,选择超声功率、超声时间、pH值3 个因素,以蛋白得率为响应值,根据Design-Expert 8.0.6软件中Box-Behnken法设计响应面试验方案,其相应的因素与水平设计见表1。
表1 Box-Behnken试验因素和水平
Tab le 1 Factors and levels used in Box-Behnken design

1.3.4 鸭肝蛋白的抗氧化性实验
1.3.4.1 还原力的测定
不同质量浓度(1~6 m g/m L)样品中分别加入1 m L磷酸盐缓冲溶液(0.2 m o l/L,pH 6.6)和2 m L 1%铁氰化钾溶液,置于50 ℃水浴中反应20 m in,然后加入2 m L 10%的三氯乙酸溶液,摇匀,室温反应10 m in,吸取上清液1.5 m L加入1 m L蒸馏水和0.2 m L 0.1%的三氯化铁溶液,混合均匀,室温反应10 m in,于波长700 nm处测定吸光度[14];VC作阳性对照。
1.3.4.2 DPPH自由基清除率的测定
蛋白水解物用去离子水溶解后配成质量浓度为1~6 m g/m L。用95%乙醇溶液现配0.1 mm o l/L的DPPH溶液,等量1 m L的样品液加入1 m L的乙醇,再加入1 m L的DPPH溶液于比色皿中。振动混匀后在37 ℃水浴中避光反应0.5 h。于波长517 nm处测吸光度A1。乙醇作为空白测定吸光度A2[15]。VC作阳性对照。DPPH自由基清除率计算如式(2)所示:
1.3.4.3 ABTS+·清除率的测定
ABTS溶液的配制:取0.1 g ABTS和0.029 g过硫酸钾溶于100 m L磷酸盐缓冲液,混合后于25 ℃避光反应16 h备用,实验时取2 m L该反应液,加入18 m L磷酸盐缓冲液,配成ABTS储备液,避光保存当日备用。ABTS储备液再用磷酸盐缓冲液稀释,于波长734 nm处测吸光度在0.85左右,即为ABTS工作液,当日现配使用。
测定方法:分别取0.1 m L样品液,加入3.9 m L ABTS工作液,混合均匀。混合液于室温静置10 m in,于波长734 nm处测定吸光度A1,以试样溶剂代替样品溶液测定空白吸光度A0,以磷酸盐缓冲液代替ABTS工作液测得吸光度A2[16],实验平行做3 次,VC作阳性对照。ABTS+·清除率计算如式(3)所示:
1.3.4.4 羟自由基清除能力的测定
试管中分别加入0.5 m L水杨酸-乙醇溶液、0.5 m L FeSO4溶液、0.5 m L样品溶液和1 m L H2O2溶液。混匀后在室温反应10 m in,于波长510 nm处测定吸光度A1。取0.5 m L蒸馏水代替FeSO4溶液,测得吸光度A2,取0.5 m L蒸馏水代替蛋白溶液,测得空白吸光度A0[17]。VC作阳性对照。羟自由基清除率计算如式(4)所示:
1.4 数据分析
采用SPSS 16.0进行显著性(P<0.05)分析,Origin 8.0、Design-Expert 8.0.6 作图。
2.1 单因素试验结果

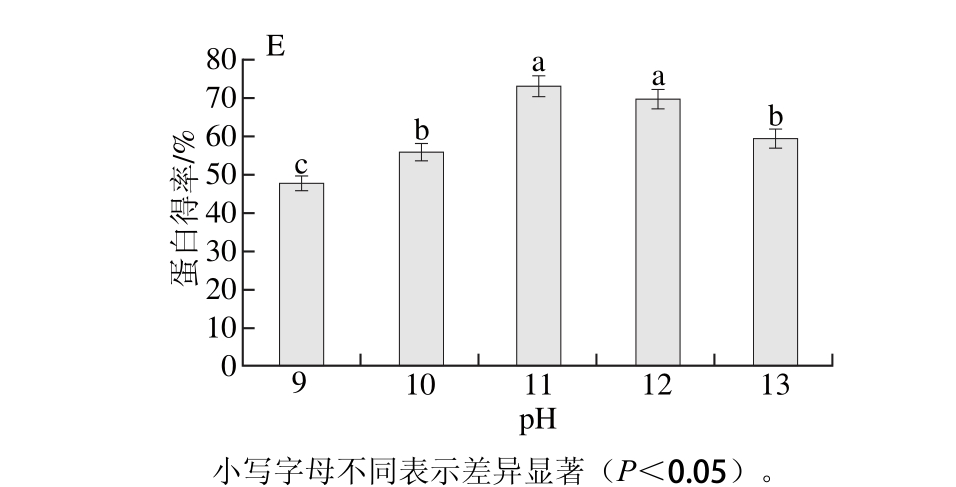
图1 超声功率(A)、超声时间(B)、料液比(C)、超声温度(D)、pH值(E)对鸭肝蛋白得率的影响
Fig. 1 Effect of ultrasonic power (A), exposure time (B), material-to-liquid ratio (C), tem perature (D), and pH (E) on the yield of duck liver protein
如图1A所示,随着超声功率的增大,蛋白得率提高显著,在250 W处出现最大值,表明超声功率越高,获得声强越大[18]。但随着功率的增大,得率反而降低,可能因为过高频率的超声波“空化作用”[19],使蛋白降解导致鸭肝蛋白得率降低,因此选择超声功率为250 W。
如图1B所示,超声时间在10~40 m in时,蛋白得率呈现逐渐上升趋势,在40 m in处出现最大值。随着超声时间的延长,得率呈下降趋势,可能是超声时间过长使鸭肝蛋白产生高温,使部分蛋白造成降解[20],因此选择超声时间为40 m in。
如图1C所示,随着溶剂用量增大,蛋白得率呈现逐渐增大后趋于平稳的趋势。当料液比达到1∶60,蛋白得率出现最大值,说明鸭肝蛋白基本提出,继续增大溶剂用量,蛋白得率趋于平衡。考虑试剂成本选择料液比为1∶60。
如图1D所示,随着超声温度的升高,蛋白得率呈上升趋势,在50 ℃出现最大值。再提高温度,得率反而下降。可能是温度过高破坏了鸭肝蛋白的结构完整性[21],造成蛋白得率下降,因此选择超声温度为50 ℃。
如图1E所示,NaOH溶液在pH 9~11时蛋白得率不断提高,而pH 12~13时,蛋白得率逐渐降低,表明碱液浓度过大,不利于蛋白的提取,主要是由于高碱条件下蛋白变性及水解[22],因此选择碱液的pH值为11。
2.2 Box-Behnken试验设计及结果
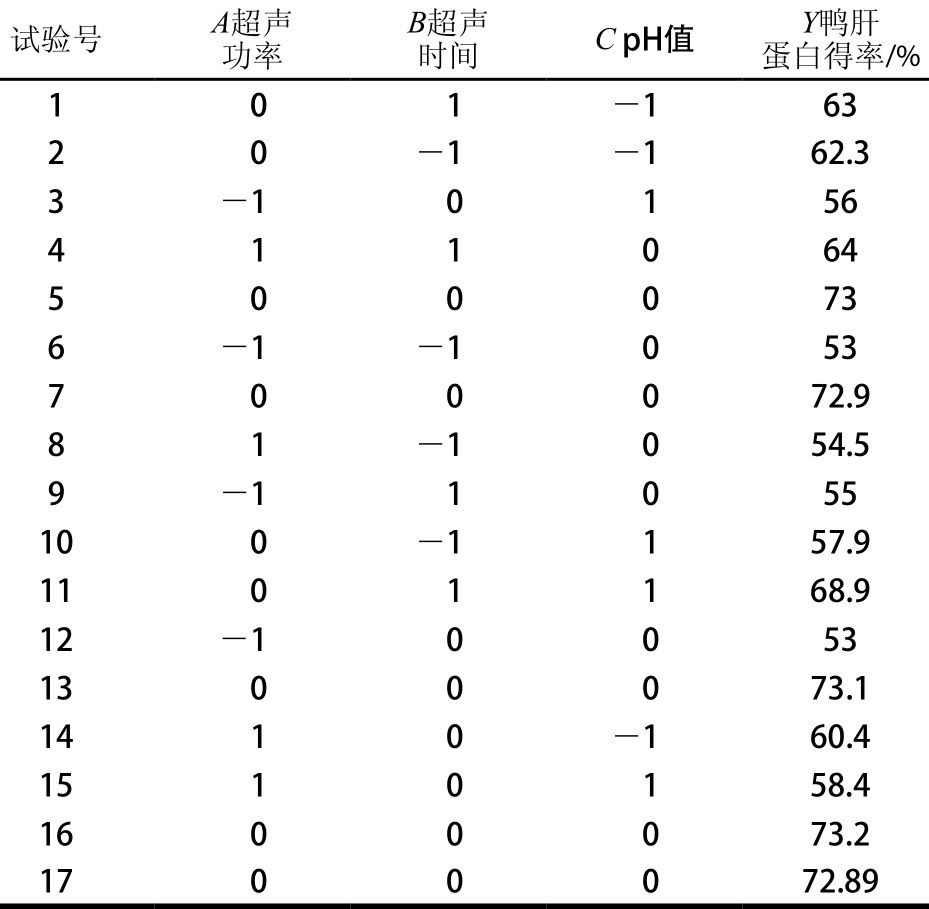
根据单因素试验结果,本研究通过响应面法中Box-Behnken试验设计对鸭肝蛋白提取工艺进行优化。超声功率、超声时间和pH值对鸭肝蛋白得率的影响较为显著,因此选取该3 个因素作为自变量,以鸭肝蛋白得率为响应值,进行三因素三水平Box-Behnken响应面优化试验,试验设计与结果如表2所示。
表2 Box-Behnken试验设计及结果
Tab le 2 Box-Behnken design w ith experim en tal resu lts
2.3 模型的建立及显著性分析
运用Design-Expert 8.0.6软件对表2数据进行二次多元回归拟合,获得响应值与自变量的逻辑关系为:Y=73.02+2.54A+2.90B+0.31C+1.87AC-1.25AC+2.58BC-11.23A2-5.16B2-4.83C2。
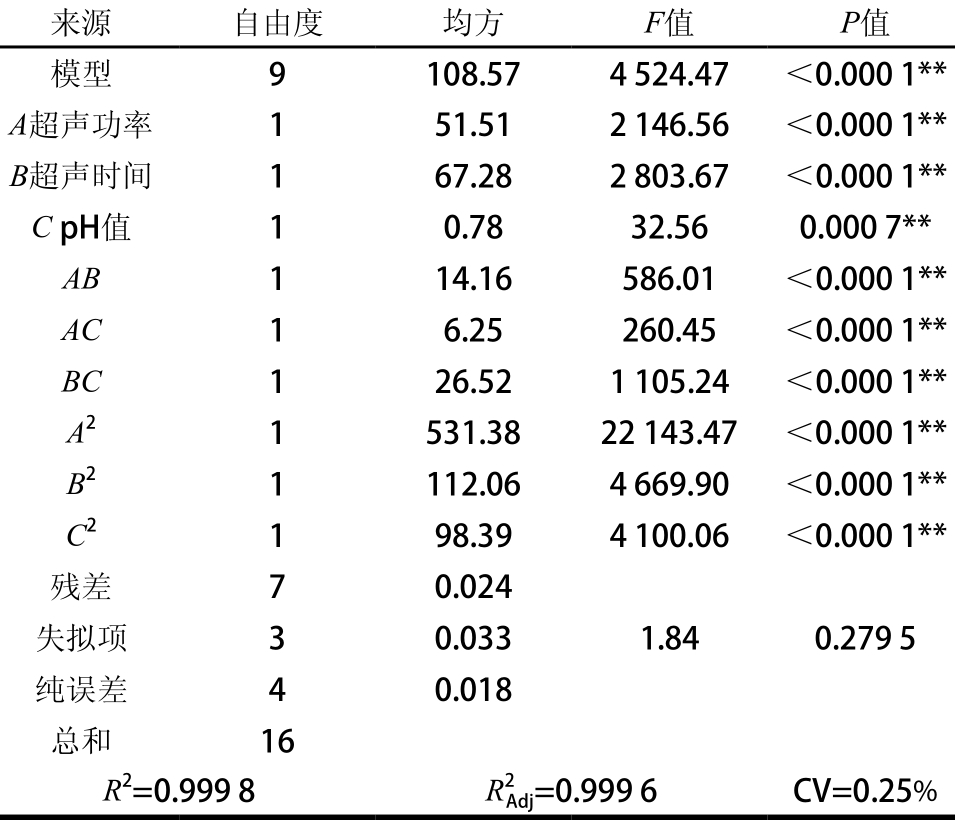
表3 多元回归模型及方差分析
Tab le 3 Analysis o f variance o f reg ression m odel
注:*. P<0.05,差异显著;**. P<0.01,差异极显著。
由表3可知,方程的一次项二次项、交互项对响应值鸭肝蛋白得率(Y)的影响均极显著。各因素之间均存在显著的交互作用。回归模型项极显著(P<0.01),响应值的相关系数R2=0.999 8,说明模型拟合良好,表明通过该模型能够较好地对鸭肝蛋白的得率作出预测。调整相关系数R2Adj达到0.999 6,说明鸭肝蛋白的得率模型能够在99.996%的程度上解释试验结果。本实验模型的失拟项不显著(P>0.05),进一步说明模型的拟合度较好。综上所述,回归模型拟合程度良好,试验误差小,能够准确分析和预测鸭肝蛋白得率。
2.4 交互作用分析
等高线的形状能够反映出交互项的强弱椭圆形表示交互显著,而圆形相反。而响应面图的陡峭程度可说明随着影响因素的变化,其响应值也随之变化[23]。图2显示了不同因素交互作用对鸭肝得率的等高线及响应面。从图2a可知,响应面图陡峭,表明超声功率和超声时间的交互作用对鸭肝蛋白的影响较大。从等高线图可知,超声时间对鸭肝蛋白得率的影响大于超声功率。从图2b可知,响应面图相对陡峭,表明超声功率和pH值的交互作用对鸭肝蛋白的影响相对交互项AB较小,从等高线图可知,超声功率对鸭肝蛋白得率的影响大于pH值。从图2c可知,BC较AB、AC图陡峭。表明超声时间与pH值的交互作用影响最大,从等高线图可知,超声时间对鸭肝蛋白得率的影响大于pH值。影响鸭肝蛋白得率的因素依次:超声时间>超声功率>pH值。
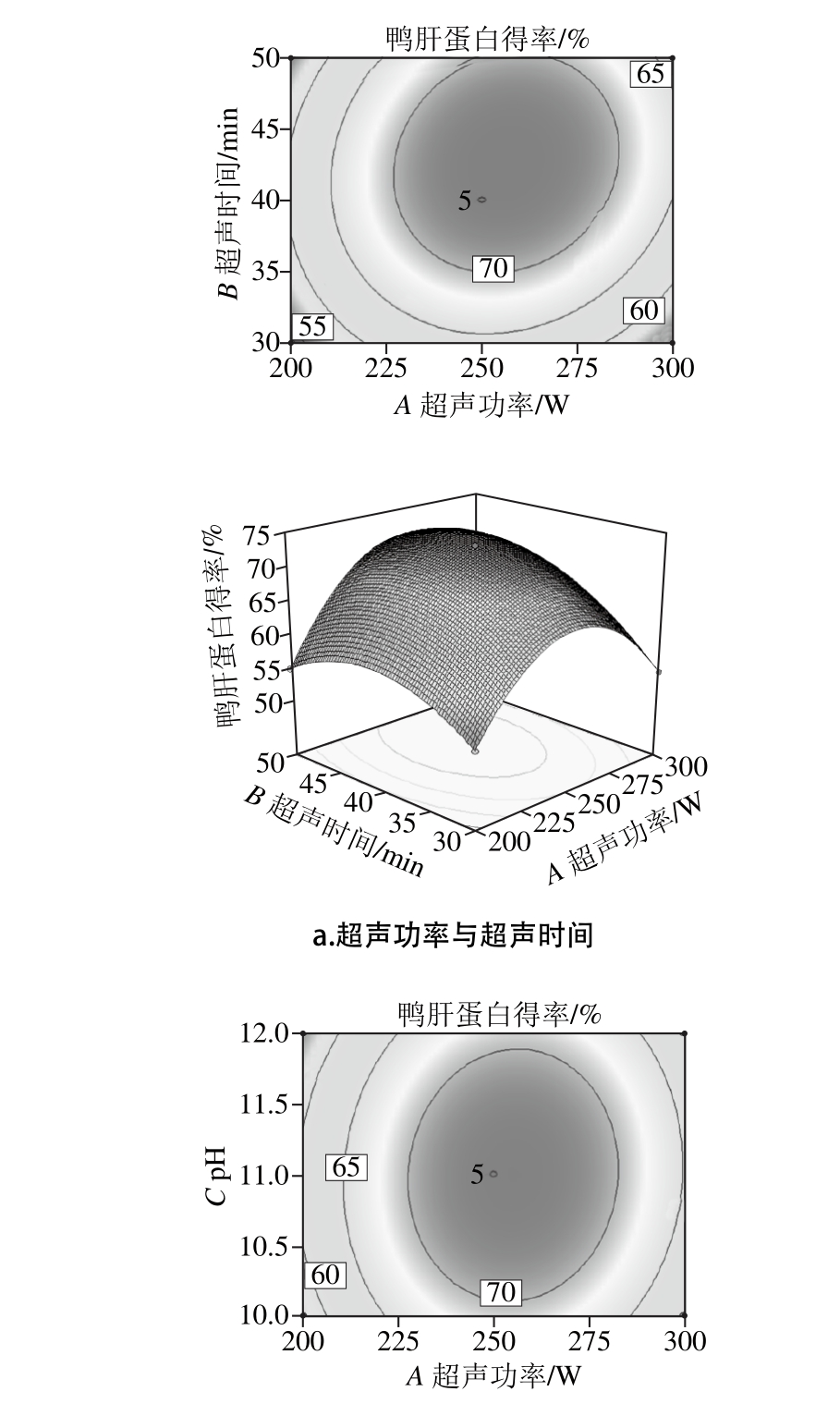
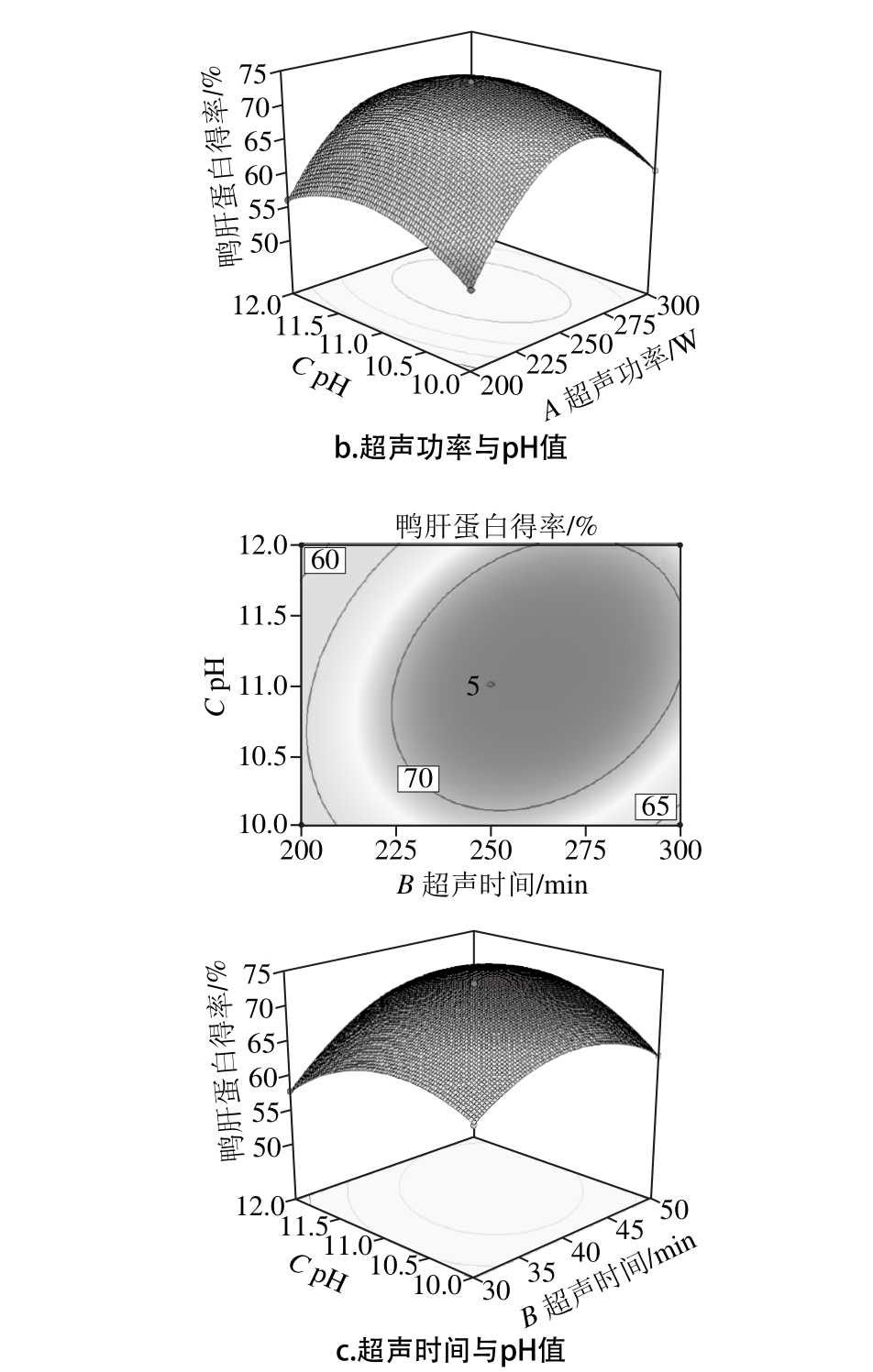
图2 各因素交互作用的等高线及响应面图
Fig. 2 Response su rface p lots show ing the in teractive effect o f th ree extraction cond itions on the yield o f duck liver p ro tein
2.5 优化提取参数和验证模型
通过响应面分析软件,超声碱提鸭肝蛋白最佳工艺为:超声功率256.72 W、超声时间43.3 m in、pH 11.10。考虑实验的可操作性,将提取工艺参数调整为超声功率256 W、超声时间43 m in、pH 11,此时鸭肝蛋白得率的预测值为73.685 6%,在上述条件下,进行3 次平行实验得到鸭肝蛋白的实际提取率为73.1%,与预测值非常接近,误差仅0.42%。常规碱提鸭肝蛋白得率为42.6%。超声碱提法所得的鸭肝蛋白得率显著高于常规碱提法(P<0.05),结果显示采用超声碱提鸭肝蛋白是可行的[24]。
2.6 鸭肝蛋白的抗氧化性结果

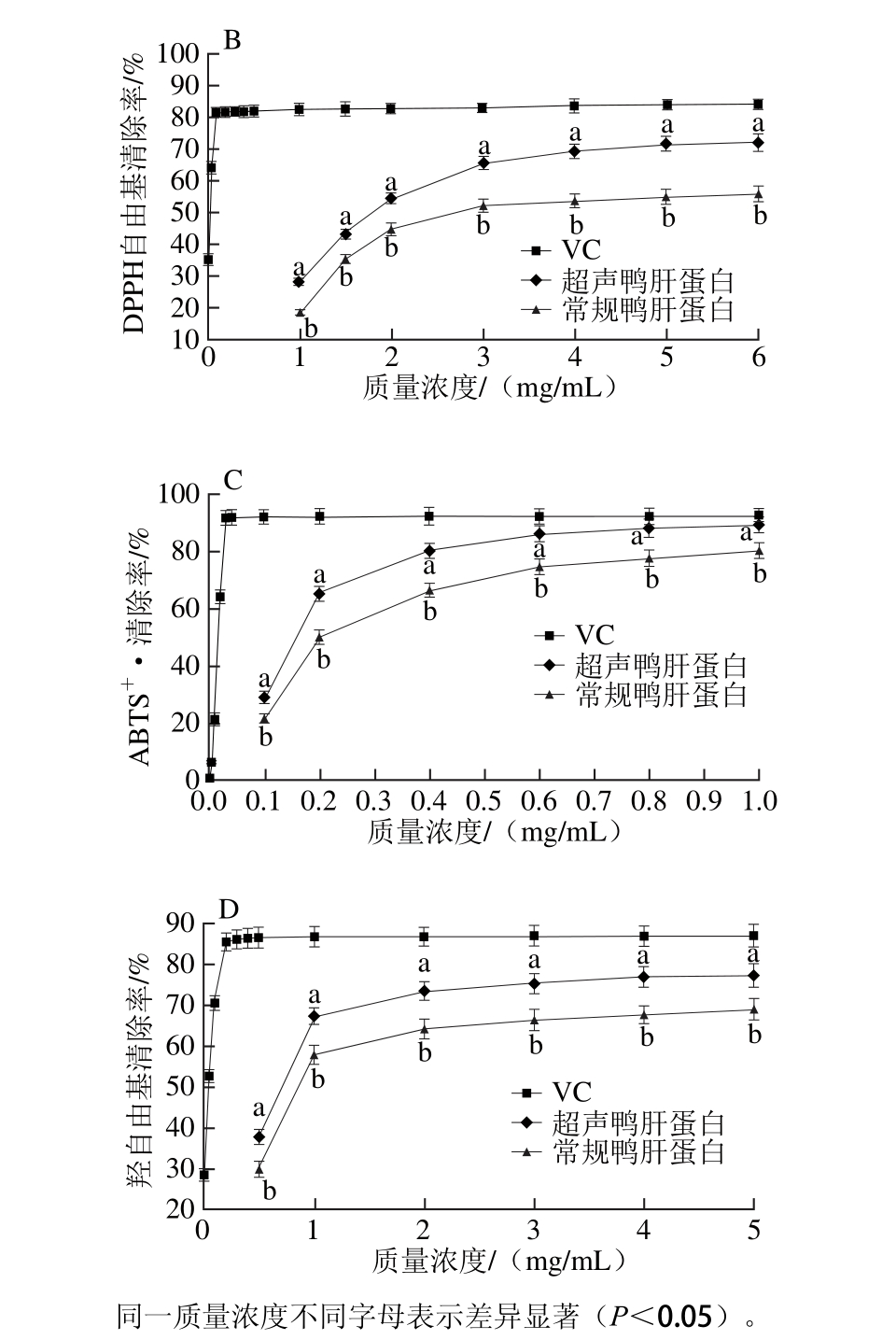
图3 鸭肝蛋白还原力(A)及DPPH自由基(B)、ABTS+·(C)、羟自由基清除活性(D)
Fig. 3 Free rad ical scavenging activity and reducing pow er o f duck liver p ro tein
两种提取方法所得的鸭肝蛋白对还原力、DPPH自由基、ABTS+·、羟自由基清除能力的作用效果如图3所示。还原力是通过物质的还原作用,给出电子清除自由基,还原力越强,表明抗氧化性越强[15,25]。由图3A可知,鸭肝蛋白的还原力随着质量浓度的增大而增大。质量浓度为6 m g/m L时,超声碱提鸭肝蛋白还原力为0.714,常规提取鸭肝蛋白的还原力为0.642,两者的还原力具有显著性差异(P<0.05)。李丹等[26]研究玉米和大豆的自由基清除活性和还原力。玉米的多肽质量浓度32 m g/m L时还原力为0.7,大豆多肽32 m g/m L时还原力不到0.6,表明超声碱提鸭肝蛋白的还原力均高于大豆和玉米多肽,具有较高的还原力。
从图3B可知,随着质量浓度增大,清除DPPH自由基能力增大。常规和超声鸭肝蛋白清除DPPH自由基的IC50值分别为3.576、1.97 m g/m L。质量浓度为6 m g/m L时,常规碱提鸭肝蛋白对DPPH自由基清除率为55.9%,超声碱提鸭肝蛋白对DPPH自由基清除率为72%,超声碱提蛋白清除DPPH自由基显著高于常规鸭肝蛋白(P<0.05)。张宇等[27]从羊肝提取羊肝蛋白清除DPPH自由基的IC50值为14.452 m g/m L,表明超声碱提鸭肝蛋白具有较高清除DPPH自由基的能力。
ABTS+·广泛用于样品的抗氧化能力,蛋白提取液与ABTS自由基反应使其褪色,吸光度越低,表明样品的抗氧化能力越强[28]。从图3C可知,常规和超声鸭肝蛋白清除ABTS+·的IC50值分别为0.241、0.168 m g/m L,表明超声碱提鸭肝蛋白清除ABTS+·的能力显著高于常规鸭肝蛋白(P<0.05)。Mem arpoor-Yazd i等[29]从鸡蛋清分离的NYDGSTDYGILQINSR抗氧化多肽清除ABTS+·的IC50值为1.35 m g/m L,表明超声碱提鸭肝蛋白具有较高清除ABTS+·的能力。
羟自由基是一种危害较大的氧自由基,在生物体内能与蛋白质等物质发生反应,破坏这些物质活性的功能[30]。由图3D可知,鸭肝蛋白清除羟自由基的能力随蛋白质量浓度增大而增大。常规和超声鸭肝蛋白清除羟自由基的IC50值分别为0.878、0.529 m g/m L,两者具有显著性差异(P<0.05)。张宇等[27]从羊肝中提取的羊肝蛋白清除羟自由基的IC50值为10.271 m g/m L,表明超声碱提鸭肝蛋白具有较高清除羟自由基的能力。以上抗氧化实验结果表明,超声辅助碱提鸭肝蛋白具有较强的还原力和DPPH自由基、ABTS+·、羟自由基的清除能力,是一种潜在的抗氧化剂。
以蛋白得率为考察指标,通过单因素以及响应面优化实验,建立了超声辅助碱提鸭肝蛋白最佳提取工艺为超声功率256 W、超声时间43 m in、pH 11,影响超声碱提鸭肝蛋白得率的因素为超声时间>超声功率>pH值。经验证,超声辅助碱提鸭肝蛋白的得率达到73.1%。与常规碱提鸭肝蛋白(得率为42.6%)相比,超声辅助碱提法显著地提高了鸭肝蛋白的得率。
抗氧化实验结果表明:超声提取鸭肝蛋白清除DPPH自由基、ABTS+·、羟自由基的IC50分别为1.97、0.168、0.529 m g/m L,其中超声提取鸭肝蛋白清除ABTS+·的能力较强。与常规碱提法的蛋白相比,超声辅助碱提鸭肝蛋白的抗氧化能力有明显提高,表现出较好的抗氧化能力,可为鸭肝蛋白的精深加工利用提供参考。
参考文献:
[1] 王健, 朱振鹏, 董飚, 等. 填饲对黑羽番鸭产肝性能、组织营养成分、肝脏组织学及脂调控基因表达水平的影响[J].南京农业大学学报, 2014, 37(6): 149-154. DOI:10.7685/ j.issn.1000-2030.2014.06.022.
[2] 陈锐, 宗志权. 略阳乌鸡肌肉及肝脏营养成分测定分析[J].湖北农业科学, 2013, 52(14): 3402-3405. DO I:10.14088/ j.issn.0439-8114.2013.14.065.
[3] 夏丽丽, 王倩倩, 杨彪, 等. 肥肝鹅恢复期血液生化指标、肝脏常规营养成分及脂代谢相关基因表达水平的变化研究[J]. 中国畜牧兽医, 2016, 43(4): 967-972. DOI:10.16431/ j.cnki.1671-7236.2016.04.017.
[4] 张小平. 川味胡萝卜鸭肝酱的开发研究[D]. 雅安: 四川农业大学, 2013: 1-37.
[5] 鞠美玲. 低温环境下烹饪鹅肥肝的营养及工艺优化研究[D]. 扬州:扬州大学, 2012: 1-56.
[6] 王来娣, 邵丹, 张宜辉, 等. 朗德鹅填饲期肝重及肝脏营养成分的变化规律研究[J]. 中国家禽, 2013, 35(5): 27-29. DOI:10.16372/ j.issn.1004-6364.2013.05.011.
[7] 谢程炜, 诸永志, 王道营, 等. 3 个品种鸭肉排酸成熟后的氨基酸组成比较及评价[J]. 西南农业学报, 2013, 26(4): 1677-1681. DOI:10.3969/j.issn.1001-4829.2013.04.077.
[8] 尹郁荪, 刘晓华, 董闽鲜, 等. 卤鸭肝旽软罐头的研制[J]. 中国家禽, 2004, 26(1): 13-14. DOI:10.3969/j.issn.1004-6364.2004.01.006.
[9] 王林静, 方少瑛, 张风雷. 棕腹刺豚肝脏Cu Zn M n的营养评价[J]. 微量元素与健康研究, 2006, 23(4): 33-34. DOI:10.3969/ j.issn.1005-5320.2006.04.014.
[10] 王伟伟, 王宝维, 耿欣, 等. 富硒鹅肥肝对大鼠高脂血症的修复研究[J]. 中国农业科学, 2011, 44(5): 1029-1039. DOI:10.3864/ j.issn.0578-1752.2011.05.021.
[11] 张耀兮. 牦牛肝蛋白的分离提取及活性研究[D]. 北京: 中国农业科学院研究生院, 2009: 23-25.
[12] GALANSKIS C M. Recovery o f high added-value com ponents from food wastes: conventional, emerging technologies and commercialized app lications[J]. Trends in Food Science & Techno logy, 2012, 26(2): 68-87. DOI:10.1016/j.tifs.2012.03.003.
[13] KADAM S U, TIWARI B K, ODONNELL C P, et al. App lication of novel extraction technologies for bioactives from marine algae[J]. Journal of Agricultural & Food Chem istry, 2013, 61(20): 4667-4675. DOI:10.1021/jf400819p.
[14] FERREIRA I C F R, BAPTISTA P, VILASBOAS M, et a l. Freerad ical scavenging capacity and reducing pow er o f w ild ed ib le m ushroom s from northeast Portugal: ind ividual cap and stipe activity[J]. Food Chem istry, 2007, 100(4): 1511-1516. DOI:10.1016/ j.foodchem.2005.11.043.
[15] LIU J, YAN J, LIN S, et al. Pu rification and iden tification o f novel antioxidant pep tides from egg w hite p rotein and their antioxidant activities[J]. Food Chem istry, 2015, 175(9): 258-266. DOI:10.1016/ j.foodchem.2014.11.142.
[16] PIHLANTO A, AKKANEN S, KORHONEN H J. ACE-inh ib ito ry and antioxidant properties of potato[J]. Food Chem istry, 2008, 109(1): 104-112. DOI:10.1016/j.foodchem.2007.12.023.
[17] TIAN Y T, ZENG H L, XU Z B, et al. Ultrasonic-assisted extraction and an tioxidant activity o f po lysaccharides recovered from w hite button m ush room (Agaricus bisporus)[J]. Carbohyd rate Po lym ers, 2012, 88(2): 522-529. DOI:10.1016/j.carbpol.2011.12.042.
[18] 薛芳, 颜瑞, 王承明. 超声辅助碱提取花生多糖的研究[J]. 食品科学, 2008, 29(8): 158-163. DOI:10.3321/j.issn.1002-6630.2008.08.030.
[19] 赵芙蓉, 康健, 陈茵茹. 响应面试验优化超声波强化复合溶剂提取葡萄籽油工艺[J]. 食品科学, 2013, 34(14): 40-44. DOI:10.7506/ spkx1002-6630-201314009.
[20] 刘振春, 刘春萌, 苏彤. 响应面优化超声辅助提取β-葡聚糖工艺[J]. 食品科学, 2013, 34(14): 113-117. DOI:10.7506/spkx1002-6630-201314023.
[21] HAMM I K M, JDEY A, ABDELLY C, e t a l. Op tim ization o f ultrasound-assisted extraction of antioxidant com pounds from Tunisian Zizyphus lotus fruits using response su rface m ethodo logy[J]. Food Chem istry, 2015, 184: 80-89. DOI:10.1016/j.foodchem.2015.03.047.
[22] SHIH F F, DAIGLE K. Use o f enzym es fo r the separation o f p rotein from rice flour[J]. Cereal Chem istry, 1997, 74(4): 437-440. DOI:10.1094/CCHEM.1997.74.4.437.
[23] 万阅, 齐计英, 曾红, 等. 响应面法优化香菇多糖的超声辅助提取工艺[J]. 生物技术通报, 2015, 31(1): 79-85. DOI:10.13560/ j.cnki.1985.2015.01.012.
[24] 王佰灵, 王淑美, 孟江, 等. 星点设计-效应面法优化鸡骨香挥发油提取工艺[J]. 中国实验方剂学杂志, 2014, 20(11): 37-40. DOI:10.13422/j.cnki.201110037.
[25] HUANG D J, CHEN H J, HOW W C, et al. Active recombinant thioredoxin h protein w ith antioxidant activities from sweet potato (Ipomoea batatas [L.] Lam Tainong 57) storage roots[J]. Journal of Agricultural and Food Chem istry, 2004, 52(15): 4720-4724. DOI:10.1021/jf0498618.
[26] 李丹, 李晓磊, 李荣和. 玉米和大豆短肽的自由基清除活性与还原力的对比研究[J]. 食品工业科技, 2008, 29(8): 71-73. DOI:10.13886/j.issn1002-0306.2008.08.081.
[27] 张宇. 羊肝蛋白提取工艺的优化及其抗氧化性研究[D]. 呼和浩特:内蒙古农业大学, 2014: 1-33.
[28] 郑善元, 陈填峰, 郑文杰, 等. 单丛茶水提物清除DPPH和ABTS自由基的光谱学研究[J]. 光谱学与光谱分析, 2010, 30(9): 2417-2423. DOI:10.3964/j.issn.1000-0593(2010)09-2417-07.
[29] MEMARPOR M, ASOODEH A, CHAMANI J, et a l. A nove l antioxidant and antim icrobial peptide from hen egg white lysozyme hyd ro lysates[J]. Journal o f Functional Foods, 2012, 4(1): 278-286. DOI:10.1016/j.jff.2011.12.004.
[30] LEE J, KOO N, M IN D B. Reactive oxygen species, ag ing, and antixidative nu traceu ticals[J]. Com p rehensive Review s in Food Science & Food Safety, 2003, 3(1): 21-33. DOI:10.1111/j.1541-4337.2004.tb00058.x.
Op tim ization o f Ultrasonic-Assisted Alkaline Extraction o f Duck Liver Pro tein Using Response Su rface Methodo logy and Its Antioxidan t Activity
WANG Li1,2, ZOU Ye2,*, ZHANG Kun3, YU Hai1,*
(1. Schoo l o f Food Science and Engineering, Yangzhou University, Yangzhou 225127, China; 2. Institute o f Agricu ltural Products Processing, Jiangsu Academ y o f Ag ricu ltu ral Sciences, Nan jing 210014, China; 3. Co llege o f Food Science and Engineering, Nan jing University o f Finance and Econom ic, Nan jing 210023, China)
Abstract:The ultrasonic-assisted alkaline extraction of duck liver protein was op tim ized by response surface methodology, and the antioxidant activity of duck liver p rotein extracted w ith and w ithout ultrasonic treatm ent w as com pared. For the u ltrasonic-assisted extraction, the op tim um conditions were determ ined as follows: u ltrasonic power, 256 W; ultrasonic exposure tim e, 43 m in; and pH value, 11, where the m axim um yield of duck liver p rotein equal to 73.1% was achieved. Antioxidant activity tests showed that IC50values for scavenging of 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate (ABTS+·) and hydroxyl free radicals were 1.97, 0.168 and 0.529 mg/m L of the ultrasonically extracted duck liver protein, respectively, suggesting stronger scavenging activity against ABTS+· than other free radicals, which also had high reducing pow er. Moreover, its antioxidant activity was significantly higher than that of the conventional alkaliextracted p rotein (P < 0.05). The current study m ay p rovide a scientific basis for intensive p rocessing of duck liver.
Key words:duck liver p rotein; ultrasonic-assisted alkaline extraction; response surface m ethodology; antioxidant activity
DOI:10.7506/spkx1002-6630-201718035
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2017)18-0200-07
引文格式:
王立, 邹烨, 张坤, 等. 响应面试验优化超声辅助碱提鸭肝蛋白工艺及其抗氧化性能[J]. 食品科学, 2017, 38(18): 222-228.
DOI:10.7506/spkx1002-6630-201718035. h ttp://www.spkx.net.cn
收稿日期:2016-10-20
基金项目:“十二五”农村领域国家科技计划课题(2014BAD04B11);江苏省农业科技自主创新资金项目(CX(14)2117);江苏省博士后科研资助计划项目(1601131C)
作者简介:王立(1990—),男,硕士研究生,主要从事农产品加工研究。E-m ail:247391269@qq.com
*通信作者:邹烨(1986—),女,助理研究员,博士,主要从事动物源食品加工与质量控制研究。E-mail:zouye_198661@126.com于海(1973—),男,教授,博士,主要从事农产品加工研究。E-m ail:haiyu0078@163.comWANG Li, ZOU Ye, ZHANG Kun, et al. Op tim ization of u ltrasonic-assisted alkaline extraction of duck liver p rotein using response surface m ethodology and its antioxidant activity[J]. Food Science, 2017, 38(18): 222-228. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201718035. h ttp://www.spkx.net.cn