孙玉林1,2,戴宏杰2,文 菁1,2,张 卫1,2,赵 娟1,2,田 丽2,陈道海1,*
(1.岭南师范学院环北部湾海洋药用动物保护与利用研究所,广东 湛江 524048;2.岭南师范学院生命科学与技术学院,广东 湛江 524048)
摘 要:以加酶量、酶解温度、pH值、酶解时间为影响因素,以蛋白脱除率和多糖损失率为评价指标,通过正交试验优化拟目乌贼肌肉多糖酶法脱蛋白工艺,并与三氯乙酸法、等电点法脱蛋白效果进行比较。同时对脱蛋白多糖的体外清除自由基能力进行研究。结果表明,拟目乌贼肌肉多糖脱蛋白最佳工艺条件为:加酶量3.0 g/100 m L、酶解温度53 ℃、pH 8.2、酶解时间1.5 h。此条件下蛋白脱除率为89.43%,多糖损失率为1.78%,优于三氯乙酸法和等电点法。清除自由基结果显示,多糖质量浓度为10 mg/m L时,酶法、三氯乙酸法和等电点法得到的脱蛋白多糖对羟自由基清除率分别为45.72%、38.72%和25.18%,相应的IC50值分别为12.44、16.37、34.64 mg/m L;对1,1-二苯基-2-三硝基苯肼自由基的清除率分别为68.00%、30.08%和23.10%,相应的IC50值分别为7.62、16.71、28.96 mg/m L。3 种脱蛋白方法所得拟目乌贼肌肉多糖清除自由基效果依次为:酶法>三氯乙酸法>等电点法。
关键词:拟目乌贼;多糖;酶法;脱蛋白;自由基
Key words: Sepia lycidas; polysaccharides; enzymatic method; deproteinization; free radicals
拟目乌贼(Sep ia ly c id as)属于软体动物门(M o l lusca),鞘亚纲(Co leo id ea),乌贼目(Sepiida),乌贼科(Sepiidae),乌贼属(Sepia),主要分布在印度洋、西太平洋海域,常栖息于水深15~100 m的地方[1]。乌贼的药用价值很高,乌贼墨有抗癌、抗辐射、止血等作用;乌贼骨(海螵蛸)有各种收敛作用,治疗胃病等;乌贼肉和乌贼血有活血化瘀、滋阴等作用[2],是一种营养价值和经济价值均较高的优良海产品品种[3]。
多糖又称多聚糖,是一种由醛糖和(或)酮糖通过脱水形成糖苷键,并由糖苷键线性或者分枝连接组成的链状聚合物,具有广泛的生物活性[4],如抗氧化、抗肿瘤、抗凝血、抗病毒、抗炎等[5-11]。天然多糖类化合物由于其来源广泛、安全低毒、提取效率高、对自由基具有清除作用等优点,有望作为新的天然抗氧化剂。近年来,除对乌贼墨多糖和性腺多糖的抗氧化活性有个别报道外[12-14],关于拟目乌贼肌肉多糖抗氧化活性研究尚鲜见报道。
本实验对拟目乌贼肌肉粗多糖的脱蛋白工艺进行优化,并对其体外清除自由基能力进行研究,考察其作为天然抗氧化剂的应用前景,以期为拟目乌贼肌肉多糖在功能性食品和医药制品方面的综合利用与开发提供理论支持。
1.1 材料与试剂
拟目乌贼购于湛江市霞山水产批发市场,随机选购成体5 头,每只体质量(1.5±0.5)kg,胴体长(26±4) cm,胴宽(12±4) cm。
胰蛋白酶(活力>250 U/mg) 美国Am resco公司;动物水解蛋白酶(活力≥500 U/g) 上海季蓝科技发展有限公司;木瓜蛋白酶(活力≥1 000 U/m g)上海金穗生物技术有限公司;胃蛋白酶(活力≥1 200 U/g)国药集团化学试剂有限公司;中性蛋白酶(活力≥6 000 U/g) 北京奥博性生物技术有限公司;福林-酚试剂盒 北京鼎国生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(1,1-d i p h e n y l-2-picrylhydrazyl,DPPH) 美国Sigma公司;牛血清蛋白、干酪素、酪蛋白、三氯乙酸(trichloroacetic acid,TCA)、磷酸氢二钠、磷酸二氢钠、柠檬酸、三羟甲基氨基甲烷(Tris)、考马斯亮蓝、苯酚、浓硫酸、葡萄糖、无水乙醇、氢氧化钠、氯化钠等均为国产分析纯。
1.2 仪器与设备
UV-3000型紫外-可见分光光度计 上海美谱达仪器有限公司;DS-1型高速组织捣碎机 上海标本模型厂;LGJ-18A型冷冻干燥机 北京四环科学仪器厂;DFY-200型手提式高速中药粉碎机 青州市三宝中药机械厂;H/T18MM型台式离心机 湖南赫西仪器装备有限公司;BCD-348WA/H型电冰箱 科龙集团有限公司;90-1型定时恒温磁力搅拌器 金坛市富华仪器有限公司;PHS-3C型pH(酸度)计 上海天达仪器有限公司。
1.3 方法
1.3.1 拟目乌贼肌肉多糖的制备
原料预处理:拟目乌贼解剖,除去表皮、内脏,得乌贼肌肉,切碎,加适量蒸馏水用组织捣碎机打成匀浆状,采用丙酮脱脂3 次,冷冻干燥、粉碎后得到拟目乌贼肌肉冻干粉。
多糖提取:参考文献[13]的方法,冻干粉在设定料液比条件下热水浸提一定时间,离心取上清液,浓缩,加入3 倍体积无水乙醇,4 ℃沉淀过夜,离心取沉淀透析48 h,冷冻干燥24 h得拟目乌贼肌肉多糖,4 ℃保存备用。
1.3.2 酶法脱蛋白工艺
1.3.2.1 酶活力的测定
采用福林-酚法[15]测酶活力。测定流程为:1)酪氨酸标准曲线制作;2)酶与底物混合保温;3)停止酶的作用;4)离心取上清液;5)显色测定;6)计算。其计算公式如式(1)所示:
式中:A为吸光度平均值;K为光密度为1时酪氨酸质量,本实验K值为172.86 μg;4为酶活力测定总量4 m L(1 m L酶液、1 m L酪蛋白、2 m L TCA),10为酶反应时间10 m in;N为酶的稀释倍数,本实验为5×103。
1.3.2.2 最优酶的选择
本实验选取胰蛋白酶、动物水解酶、木瓜蛋白酶、胃蛋白酶和中性蛋白酶作为脱蛋白的酶种,分别按其最适条件(胰蛋白酶42 ℃、pH 8.2;动物水解蛋白酶50 ℃、pH 7.0;木瓜蛋白酶60 ℃、pH 7.0;胃蛋白酶37 ℃、pH 3.0;中性蛋白酶50 ℃、pH 7.0),并设置加酶量为3 000 U/g,对拟目乌贼肌肉粗多糖溶液酶解2.0 h。酶解结束后经95 ℃水浴10 m in灭酶,4 000 r/min离心15 m in,分别用考马斯亮蓝法和苯酚-硫酸法测定上清液中蛋白和多糖的含量,以此评价酶解效果,确定最佳酶种。
1.3.2.3 单因素试验
选取酶解温度(43、48、53、58、63 ℃),酶解时间(0.5、1.0、1.5、2.0、2.5 h),pH值(7.0、7.6、8.2、8.8、9.4)和加酶量(0.5、1.0、1.5、2.0、2.5、3.0 g/100 m L) 4 个影响因素分别进行单因素试验,以拟目乌贼肌肉多糖蛋白脱除率和多糖损失率为评价指标。
1.3.2.4 正交试验设计
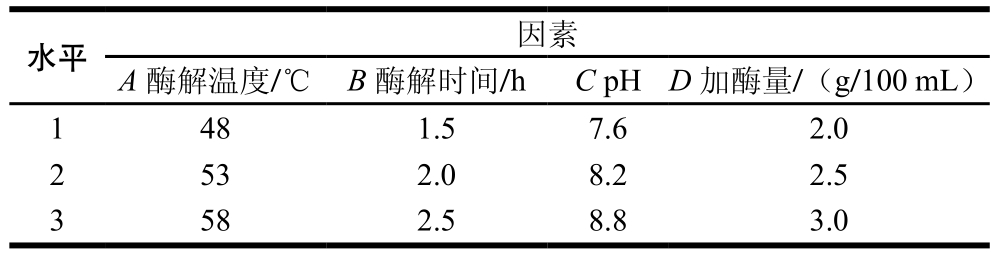
在单因素试验的基础上,选取酶解温度(A)、酶解时间(B)、pH值(C)、加酶量(D)为考察因素,采用L9(34)正交试验设计进行脱蛋白工艺的优化,确定酶法提取拟目乌贼肌肉多糖的最佳工艺。正交试验设计方案见表1。
表1 正交试验设计因素与水平
Table 1 Factors and their coded levels used in orthogonal array design
1.3.3 TCA法脱蛋白工艺
参考文献[16]的方法。分别添加20 g/100 m L TCA 溶液1%、3%、5%、7%、9%、11%(V/V)于拟目乌贼肌肉粗多糖溶液中,4 ℃静置过夜,4 000 r/m in离心20 m in,取上清液,测定蛋白和多糖含量,得TCA法脱蛋白最佳条件。
1.3.4 等电点法脱蛋白工艺
参考文献[17]的方法。取拟目乌贼粗多糖溶液,设置溶液pH值为3.5、4.0、4.5、5.0、5.5、6.0,4 ℃静置过夜,4 000 r/m in离心20 m in取上清液,测定各溶液中的蛋白和多糖含量,确定等电点法脱蛋白最佳条件。
1.3.5 拟目乌贼肌肉多糖成分测定
1.3.5.1 拟目乌贼肌肉多糖损失率的测定
采用苯酚-硫酸法[13],用葡萄糖制作标准曲线,按公式(2)计算多糖损失率:
式中:L1为多糖损失率/%;M1为脱蛋白前的多糖质量浓度/(mg/mL);N1为脱蛋白后的多糖质量浓度/(mg/mL)。
1.3.5.2 拟目乌贼肌肉多糖中蛋白脱除率的测定
采用考马斯亮蓝法[18],用牛血清蛋白作标准曲线,按公式(3)计算蛋白脱除率:
式中:L2为蛋白脱除率/%;M2为脱蛋白前的蛋白质量浓度/(mg/mL);N2为脱蛋白后的蛋白质量浓度/(mg/mL)。
1.3.6 拟目乌贼肌肉多糖体外抗氧化活性测定
1.3.6.1 对羟自由基清除能力的测定
参考文献[10]的方法。取1 m L不同质量浓度的多糖溶液,加入9 mmol/L FeSO4溶液1 m L、9 mmol/L水杨酸-乙醇溶液1 m L,最后加入8.8 mmol/L H2O2溶液1 m L,混匀后37 ℃水浴反应30 min,3 000 r/min离心10 min,取上清液测定其在波长510 nm处的吸光度。以VC为阳性对照,空白对照组以双蒸水代替多糖溶液,按式(4)计算清除率:
式中:A0为空白对照的吸光度;Ax为加入多糖溶液的吸光度;A1为以双蒸水代替H2O2溶液的吸光度。
1.3.6.2 对DPPH自由基清除能力的测定
按照文献[11]的方法,取2 m L不同质量浓度的多糖溶液,加入含0.2 mmol/L DPPH 的无水乙醇溶液2 m L后混匀,在黑暗环境中常温反应30 m in,在波长517 nm处测定吸光度。以VC为阳性对照,按式(5)计算清除率:
式中:A1为2 m L多糖溶液加2 m L DPPH溶液的吸光度;A2为2 m L多糖溶液加2 m L无水乙醇的吸光度;A0为 2 m L双蒸水加2 m L DPPH溶液的吸光度。
2.1 5 种蛋白酶活力分析
表2 5 种蛋白酶活力测定结果
Tab le 2 Activities o f 5 p roteinases
从表2可以得出,5 种蛋白酶活力大小顺序为:中性蛋白酶>胰蛋白酶>动物水解蛋白酶>胃蛋白酶>木瓜蛋白酶,其中最大的中性蛋白酶活力为(174 016.9±510.1)U/g,最小的木瓜蛋白酶活力为(35 630.2±79.1)U/g。
2.2 最佳酶种类的选择
分别在各种酶最适条件下进行酶解,加酶量为3 000 U/g,酶解时间为2 h,结果如图1所示。
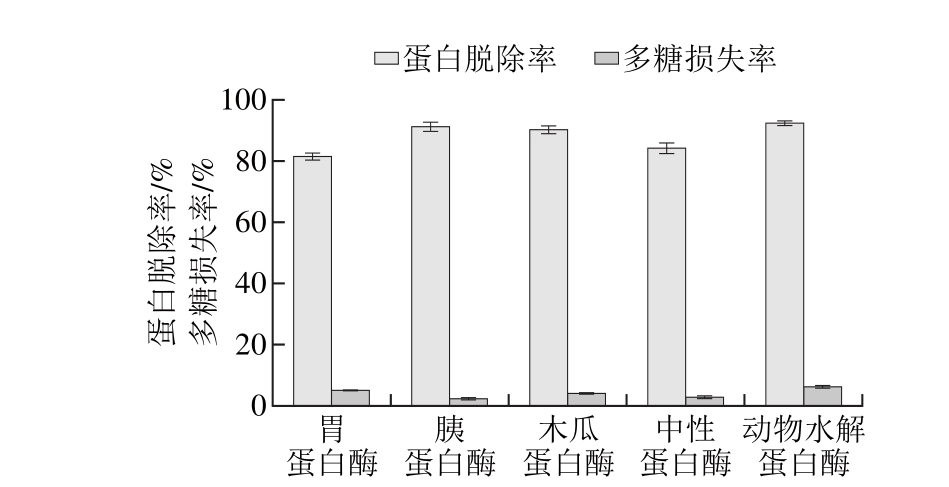
图1 5 种蛋白酶的蛋白脱除率和多糖损失率比较
Fig. 1 Com parison o f 5 p ro teinases in term s o f dep ro teinization efficiency and po lysaccharide loss
由图1可见,5种蛋白酶对拟目乌贼肌肉多糖的蛋白脱除率由高到低依次为动物水解蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶和胃蛋白酶,脱除率分别为92.05%、90.94%、90.07%、83.93%和81.17%;多糖损失率由少到多依次为胰蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶和动物水解蛋白酶,损失率分别为2.25%、2.94%、4.04%、5.06%和6.28%。综合蛋白脱除率和多糖损失率考虑选择胰蛋白酶作为后续实验酶种。
2.3 单因素试验结果
2.3.1 酶解温度对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响
固定加酶量3.0 g/100 m L、pH 8.2、酶解时间2 h,设置酶解温度分别为43、48、53、58、63 ℃,在此条件下,考察酶解温度对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响,结果见图2。
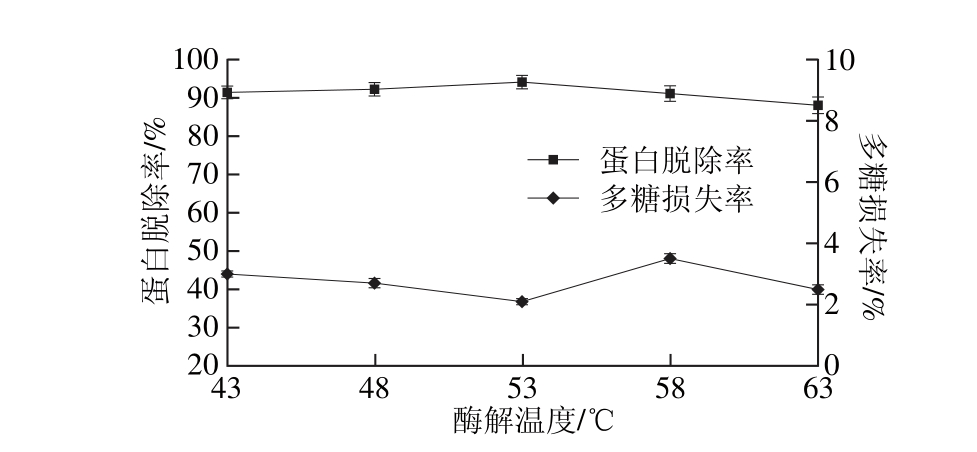
图2 酶解温度对蛋白脱除率和多糖损失率的影响
Fig. 2 Effect o f tem peratu re on dep ro teinization efficiency and po lysaccharide loss
由图2可知,在43~53 ℃温度范围内,随着温度的升高,蛋白脱除率随着温度的升高先增加后减少,多糖损失率先减少后增加,可能的原因是高温抑制了胰蛋白酶的酶解活性。综合蛋白脱除率和多糖损失率考虑,选择53 ℃最为最佳酶解温度。
2.3.2 酶解时间对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响
固定加酶量3.0 g/100 m L、pH 8.2、酶解温度53 ℃,设置酶解时间分别为0.5、1.0、1.5、2.0、2.5 h,在此条件下,考察酶解时间对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响,结果见图3。
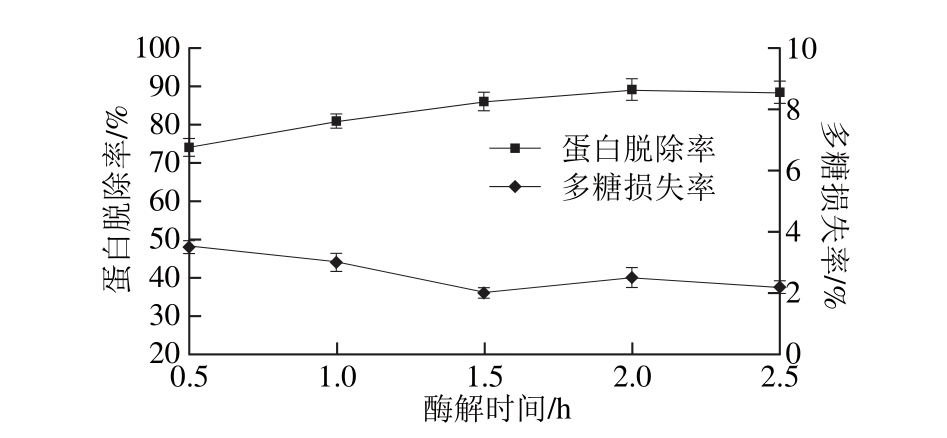
图3 酶解时间对蛋白脱除率和多糖损失率的影响
Fig. 3 Effect o f hyd ro lysis tim e on dep roteinization efficiency and po lysaccharide loss
由图3可知,随着酶解时间的延长,蛋白脱除率逐渐增加,当时间达到2.0~2.5 h时,蛋白脱除率变化不明显。多糖损失率随时间的延长先减小后增加,但当时间达到2.0~2.5 h时,变化也不明显。综合蛋白脱除率和多糖损失率考虑,选取2 h为最佳酶解时间。
2.3.3 pH值对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响
固定加酶量3.0 g/100 m L、酶解温度53 ℃、酶解时间2 h,设置粗多糖溶液的pH值为7.0、7.6、8.2、8.8、9.4,在此条件下,考察pH值对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响,结果见图4。

图4 pH值对蛋白脱除率和多糖损失率的影响
Fig. 4 Effect o f pH on deproteinization efficiency and po lysaccharide loss
由图4可知,pH值在7.0~8.2之间,蛋白脱除率逐渐增加;pH值在8.2~9.4之间,蛋白脱除率逐渐减少;而多糖损失率随着pH值的升高而逐渐增加。可能的原因是与酶的最适pH值有关,在最适pH值的条件下,酶的活性最大,脱蛋白效果最好;多糖损失率持续升高的原因是pH值升高,溶液碱性逐渐增强,可能对多糖结构造成破坏。所以综合蛋白脱除率和多糖损失率考虑,选择pH 8.2为最佳酶解pH值。
2.3.4 加酶量对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响
固定酶解温度53 ℃、酶解时间2 h、pH 8.2,设置加酶量分别为1.0、1.5、2.0、2.5、3.0 g/100 m L,在此条件下,考察加酶量对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响,结果见图5。
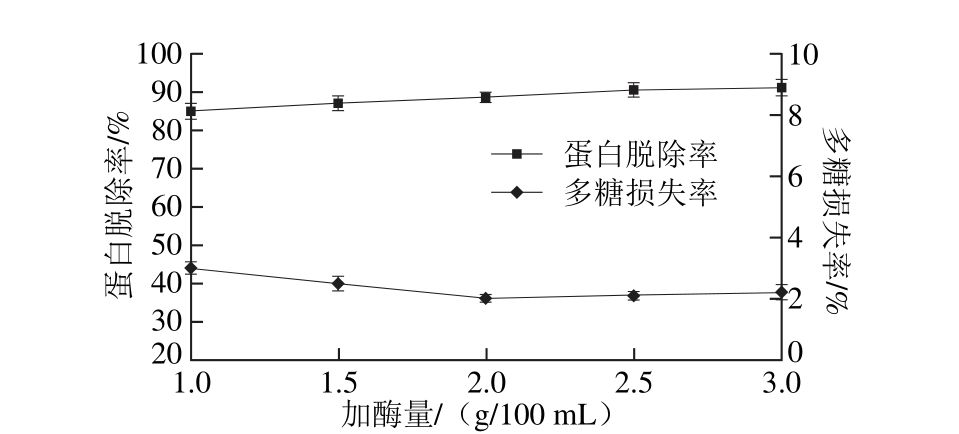
图5 加酶量对蛋白脱除率和多糖损失率的影响
Fig. 5 Effect o f enzym e dosage on dep roteinization efficiency and po lysaccharide loss
由图5可知,蛋白脱除率随着加酶量的增加而增大,在2.5~3.0 g/100 m L范围时增长缓慢。可能原因是随着酶浓度的上升,增加了酶与底物的接触机会,蛋白质脱除效果明显,但当溶液中酶浓度达到一定范围时,蛋白的脱除率已趋于最大化。此外,多糖损失率随着加酶量的增加,均处在较低的水平。综合蛋白脱除率、多糖损失率和酶的成本考虑,选择2.5 g/100 m L为最佳的加酶量。
2.3.5 酶法脱蛋白正交试验结果
在单因素试验的基础上,选取胰蛋白酶的酶解温度(A)、酶解时间(B)、pH值(C)、加酶量(D)为考察因素,进行L9(34)正交试验,结果见表3。
表3 正交试验设计及结果
Tab le 3 Orthogonal array design w ith experim ental resu lts
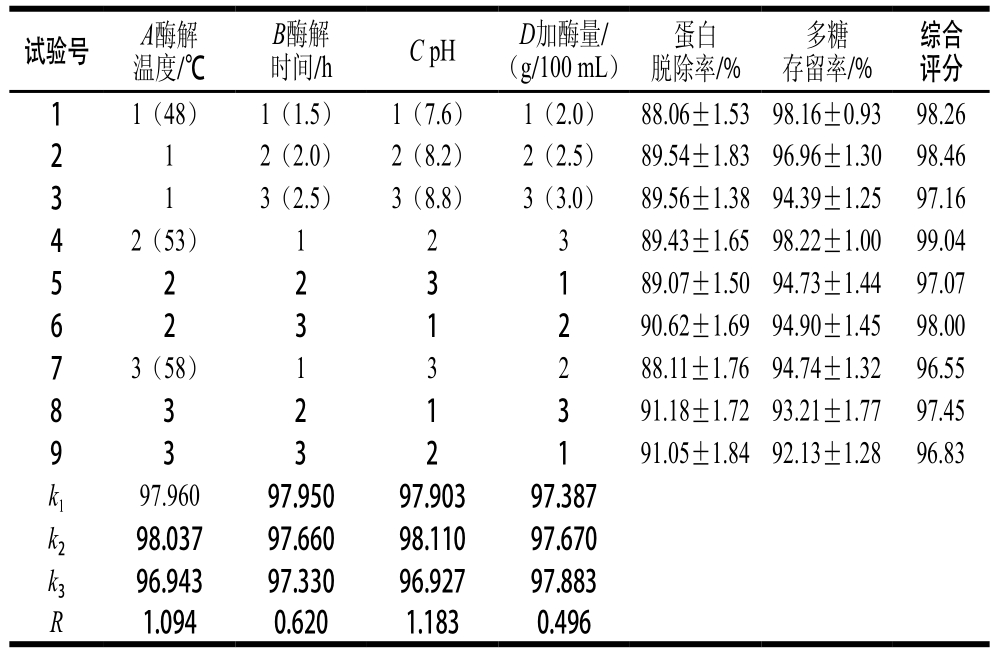
注:采用综合加权评分法[19],权重系数均为0.5,分别把2项中最大的指标定为100 分,其他各号按公式评分:综合评分=(蛋白质脱除率/ 91.18%)×100×0.5+(多糖存留率/98.22%)×100×0.5。
由表3可知,酶法脱蛋白的影响因素大小顺序为C>A>B>D,故确定最佳脱蛋白条件为A2B1C2D3,即酶解温度53 ℃、酶解时间1.5 h、pH 8.2、加酶量3.0 g/100 m L。在此条件下,蛋白脱除率为89.43%,多糖损失率为1.78%。
2.4 TCA法脱蛋白结果
设置TCA溶液体积分数分别为1%、3%、5%、7%、9%、11%,在此条件下,考察TCA对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响,结果见图6。

图6 TCA对蛋白脱除率和多糖损失率的影响
Fig. 6 Effect o f TCA concen tration on dep roteinization efficiency and po lysaccharide loss
如图6可知,随着TCA溶液体积分数的升高,拟目乌贼肌肉多糖蛋白脱除率先增加后减少,当TCA溶液体积分数为9%时,蛋白脱除率达到最大,其值为63.71%。多糖损失率随TCA溶液体积分数的升高而逐渐增加,最后在7%~11%区域趋于稳定,在TCA溶液体积分数为9%时,多糖损失率为28.38%。
2.5 等电点法脱蛋白结果
设置等电点的大小分别为3.5、4.0、4.5、5.0、5.5、6.0,在此条件下,考察等电点对拟目乌贼肌肉多糖蛋白脱除率和多糖损失率的影响,结果见图7。
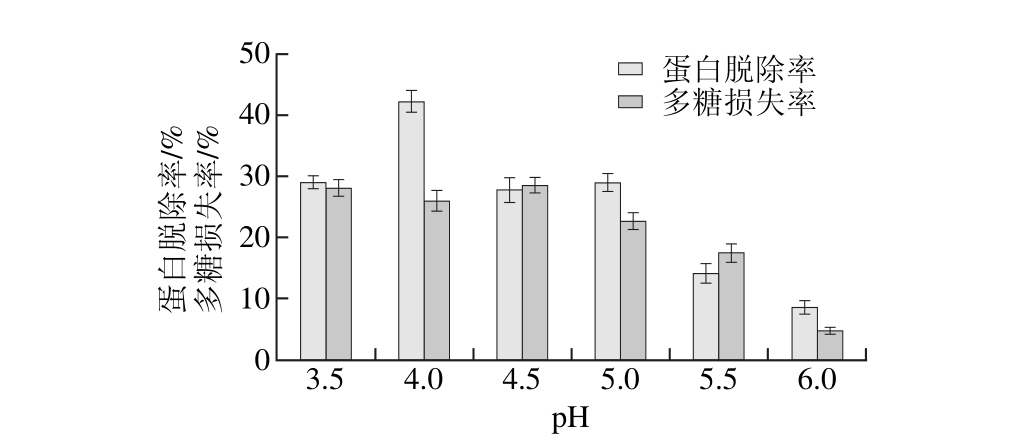
图7 等电点法对蛋白脱除率和多糖损失率的影响
Fig. 7 Effect of isoelectric point method on deproteinization efficiency and po lysaccharide loss
由图7可知,拟目乌贼肌肉粗多糖溶液经等电点法脱蛋白处理后,蛋白脱除率在pH值为4.0处明显升高,而多糖损失率在pH 3.5~5.0之间维持在相近水平,因此pH 4.0可作为等电点法脱蛋白的最佳pH值。
2.6 3 种脱蛋白方法结果比较
根据图8,经TCA法、等电点法和酶法3 种方法对拟目乌贼肌肉粗多糖蛋白脱除率和多糖损失率的结果进行比较,发现酶法脱蛋白率最高,并且多糖损失率最低,是3 种方法中较优的。
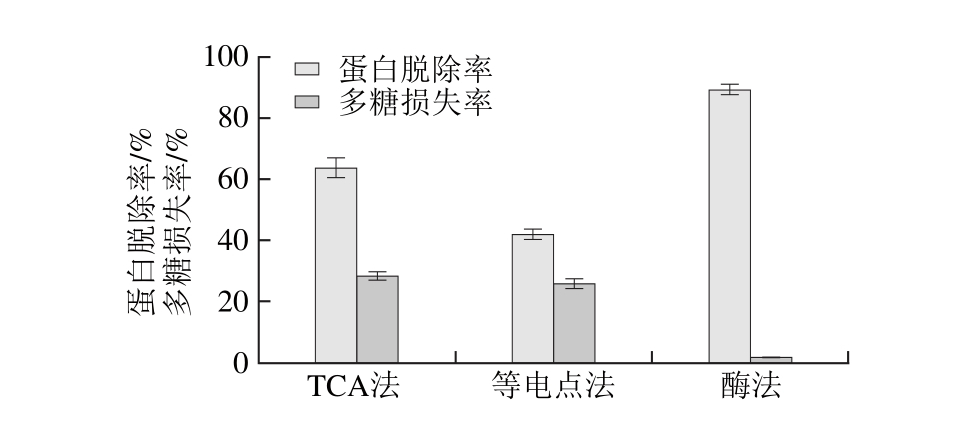
图8 3 种脱蛋白方法结果比较
Fig. 8 Com parison o f th ree dep roteinization m ethods in term s o f dep ro teinization efficiency and po lysaccharide loss
2.7 拟目乌贼肌肉多糖体外抗氧化活性分析
2.7.1 清除羟自由基能力
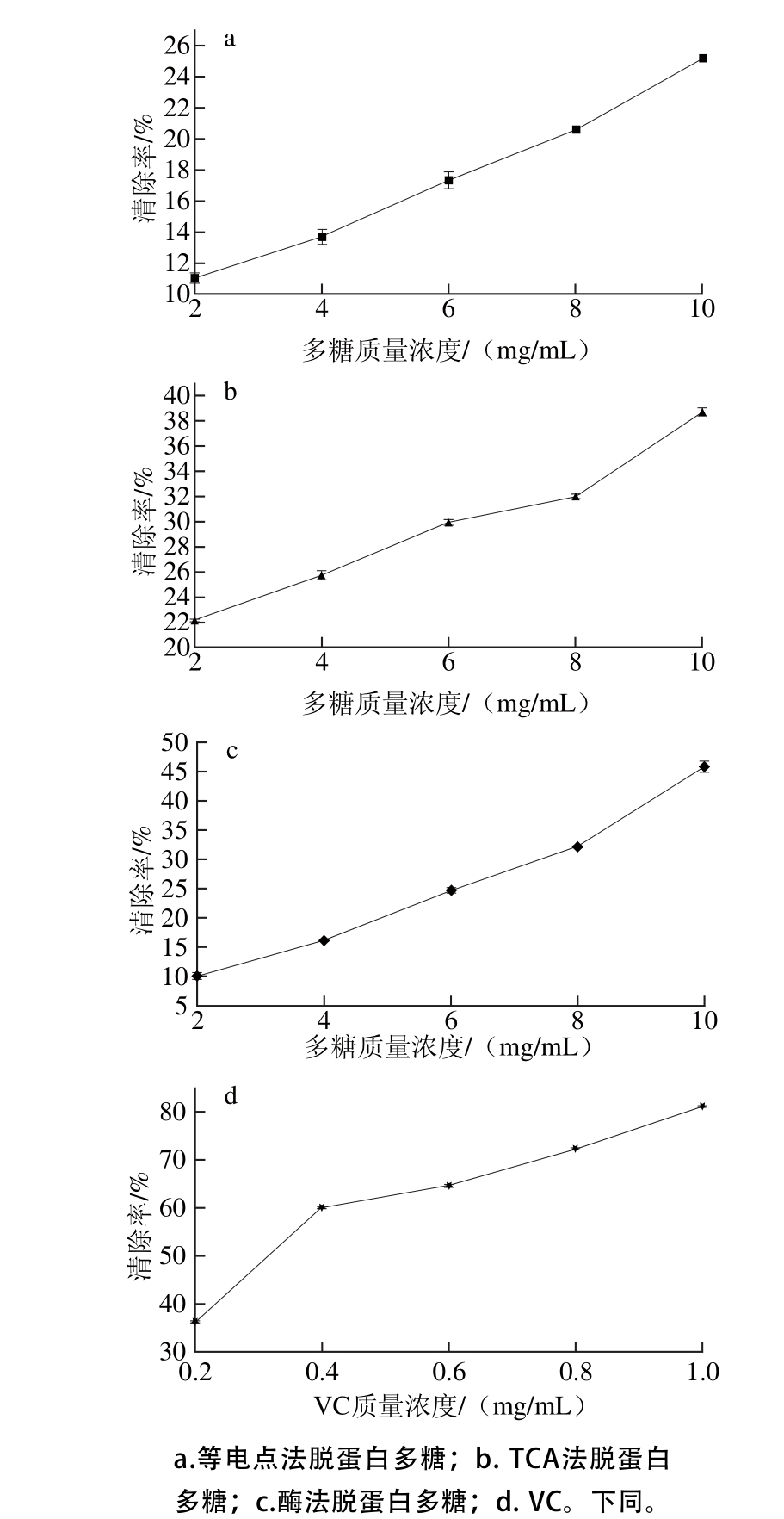
图9 拟目乌贼肌肉多糖对羟自由基的清除作用
Fig. 9 Hyd roxyl free rad ical scavenging effect o f dep roteinized po lysaccharides from cu ttlefish m uscle
如图9所示,在所选质量浓度范围内,3 种脱蛋白后的多糖对羟自由基均有一定清除能力,随着多糖质量浓度的增加,其清除羟自由基能力也相应增加,呈现良好的剂量关系;与VC相比,其清除羟自由基能力相对较弱。不同脱蛋白多糖样品对羟自由基的清除率有差异,多糖质量浓度为2 mg/m L时,酶法、等电点法脱蛋白多糖对羟自由基的清除率均只有10%左右,而TCA法脱蛋白多糖对羟自由基的清除率达到22.19%。随着多糖质量浓度的提高,酶法脱蛋白多糖对羟自由基的清除率升高,当质量浓度为10 mg/m L时,羟自由基的清除率达到45.72%,而TCA法和等电点法的清除率分别为38.72%和25.18%,酶法脱蛋白多糖对羟自由基的清除能力优于TCA法和等电点法。
2.7.2 清除DPPH自由基能力
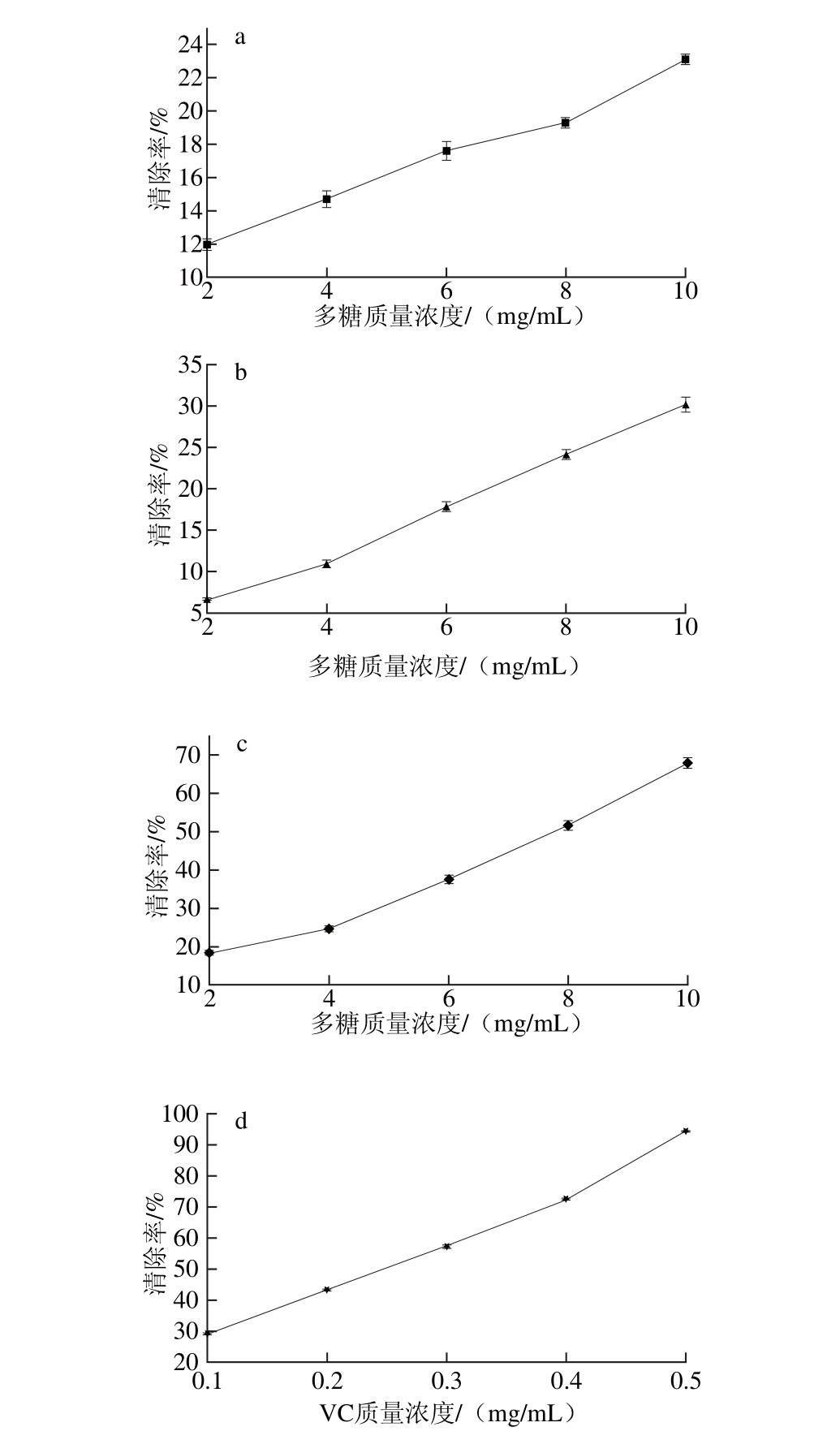
图10 拟目乌贼肌肉多糖对DPPH自由基的清除作用
Fig. 10 DPPH free rad ical scavenging effect o f dep ro teinized po lysaccharides from cu ttlefish m uscle
如图10所示,在所选质量浓度范围内,3 种脱蛋白多糖对DPPH自由基均有一定的清除作用,随着多糖质量浓度的增加,其清除率也相应增加。当多糖质量浓度为10 mg/m L,酶法、TCA法、等电点法脱蛋白多糖对DPPH自由基的清除率分别为68.00%、30.08%和23.10%,与VC相比,其清除率均较弱。不同脱蛋白方法获得的多糖对DPPH自由基的清除能力有差异:酶法脱蛋白多糖对DPPH自由基的清除能力最好,TCA法脱蛋白多糖次之,等电点法脱蛋白多糖清除效果则较差。
2.7.3 3 种脱蛋白多糖清除羟自由基和DPPH自由基IC50
表4 3 种脱蛋白多糖清除羟自由基和DPPH自由基的IC50
Tab le 4 Half m axim al effective concentrations (IC50) o f three dep roteinated polysaccharides for scavenging hyd roxyl and DPPH free rad icals
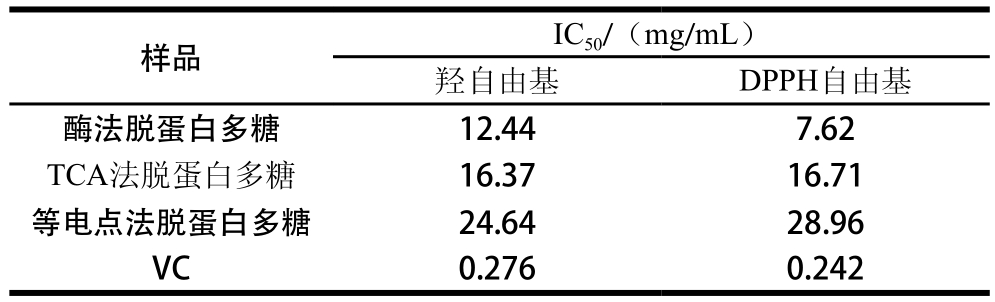
由表4可以看出, 酶法、TCA法、等电点法脱蛋白多糖对羟自由基的IC50值分别为12.44、16.37、34.64 mg/m L;对DPPH自由基的IC50值分别为7.62、16.71、28.96 mg/m L,远高于VC的IC50值(0.276 mg/m L和0.242 mg/m L)。3 种脱蛋白方法得到的多糖对羟自由基和DPPH自由基的IC50值有差异,酶法脱蛋白多糖对羟自由基和DPPH自由基的IC50最低,清除效果最好。
本实验以蛋白脱除率和多糖损失率为评价指标,采用酶法、TCA法和等电点法对拟目乌贼肌肉多糖溶液进行脱蛋白处理。酶法脱蛋白的原理是利用酶断裂大分子蛋白质的肽键,使之成为小分子肽链,本研究中选取的胰蛋白酶能够水解由赖氨酸、精氨酸的羧基所构成的肽键,拟目乌贼肌肉蛋白中可能含有大量的赖氨酸或精氨酸的羧基形成的肽键,所以蛋白脱除率较高。另外,胰蛋白酶专一性好,水解产物纯净,得到的水解产物颜色浅,反应温度低,时间短,工艺易于掌握,是较好的脱蛋白方法[20]。胰蛋白酶脱蛋白工艺为酶解温度53 ℃、酶解时间1.5 h、pH 8.2、加酶量3.0 g/100 m L,在此工艺条件下,拟目乌贼肌肉多糖蛋白质脱除率为89.43%,多糖损失率为1.78%。
TCA作为一种有机酸,可以使得样品中的蛋白质变性沉淀,从本实验结果来看,随着TCA溶液体积分数的增加,蛋白脱除率先增加后减少,可能的原因是TCA可使蛋白质变性并结合生成不溶性的盐类,同时,羧基的解离也改变溶液的pH值,影响蛋白质的稳定性[21]。多糖损失率先增加后减少,然后再增加,可能的原因是当TCA体积分数过高时可能会引起多糖结构的破坏,引起多糖的降解[22]。在本实验中,当TCA体积分数为9%时,蛋白脱除率为63.71%,多糖损失率为28.38%。
等电点法是利用等电点处蛋白质溶解度最小的原理,在低温析出大量蛋白质,本实验中,pH 4.0条件下,等电点法脱蛋白效果最佳。虽然等电点法脱蛋白工艺虽然操作简单,污染低,但脱蛋白效果并不好,而且多糖损失率较高,这可能是部分与蛋白结合在一起的多糖一并沉淀析出[23-24],本实验中蛋白脱除率仅为42.16%,多糖损失率高达25.93%。
本实验结果与其他学者的研究结果基本一致。伍善广等[25]采用Sevag法、TCA法和酶法等方法脱除蚕蛹多糖中的蛋白,结果表明Sevag法脱蛋白效率低,有机溶剂易残留;TCA法脱蛋白效率较高,但容易引起多糖的降解;酶法脱蛋白的效果明显,其蛋白脱除率为80.52%,多糖损失率为9.94%。葛炳艳等[26]采用酶法、TCA法和Sevag法对裙带菜多糖进行脱蛋白处理,结果显示,3 种方法中酶法的多糖损失率最低,为10.22%,蛋白脱除率最高,为61.10%;TCA法多糖损失率为12.13%,蛋白脱除率为57.37%;Sevag法多糖损失率为14.21%,蛋白脱除率为54.12%。酶法是裙带菜多糖脱蛋白的最佳方法。陈桂彬等[27]对比了Sevag法、TCA法、聚酰胺法和酶法等方法对茶籽多糖脱蛋白的效果,结果表明:采用碱性蛋白酶法脱蛋白效果最佳,其蛋白质脱除率为74.38%,多糖保留率为75.40%。
拟目乌贼肌肉多糖经酶法、TCA法和等电点法脱蛋白后,在质量浓度为10 m g/m L条件下,对羟自由基清除率分别为45.72%、38.72%和25.18%;其IC50值分别为12.44、16.37、34.64 mg/m L。对DPPH自由基的清除率分别为68.00%、30.08%和23.10%;其IC50值分别为7.62、16.71、28.96 mg/m L。酶法脱蛋白后的多糖对羟自由基和DPPH自由基的清除率均优于TCA法和等电点法。刘凯丽等[28]采用超声辅助提取星虫多糖,质量浓度为10 mg/m L时对羟自由基和DPPH自由基的清除率分别为56.93%和76.31%;程知庆等[29]发现瘤背石磺多糖对羟自由基和DPPH自由基的IC50值分别为2.96 mg/m L和4.14 mg/m L;这些实验结果略高于本实验的3 种脱蛋白多糖的抗氧化活性。宋荪阳等[30]从扇贝性腺中提取多糖,其质量浓度为10 mg/m L时,对DPPH自由基的清除率为51.9%。罗萍等[12]对乌贼墨多糖抗氧化活性进行研究,质量浓度为14.25 mg/m L时,对羟自由基和DPPH自由基清除率均不足30%,这些实验结果略低于本实验结果。
参考文献:
[1] 陈新军, 刘必林, 王尧耕. 世界头足类[M]. 北京: 海洋出版社, 2009: 440-441.
[2] 杨晓燕, 贾福星. 乌贼的综合药用[J]. 中国海洋药物, 1999(2): 46-47.
[3]戴宏杰, 孙玉林, 冯梓欣, 等. 雌性虎斑乌贼缠卵腺营养成分分析与评价[J]. 食品科学, 2016, 37(14): 97-103. DOI:10.7506/spkx1002-6630-201614017.
[4] 吴东儒. 糖类的生物化学[M]. 北京: 高等教育出版社, 1987: 1-17.
[5] 郑玉寅, 杨永芳, 丁国芳, 等. 乌贼墨肽聚糖的制备工艺与体外抗前列腺癌研究[J]. 时珍国医国药, 2012, 23(1): 111-113. DOI:10.3969/ j.issn.1008-0805.2012.01.048.
[6] ZONG A Z, ZHAO T, ZHANG Y, et al. Anti-metastatic and antiangiogenic actives of sulfated polysaccharide of Sepiella maindroni ink[J]. Carbohydrate Polymers, 2013, 91(1): 403-409. DOI:10.1016/ j.carbpol.2012.08.050.
[7] 文松松, 赵峡, 于广利, 等. 海洋动物多糖研究进展[J]. 中国海洋药物杂志, 2009, 29(4): 46-51.
[8] CHEN X P, WANG W X, LI S B, et al. Optim ization of ultrasoundassisted extraction of Lingzhi polysaccharides using response surface methodology and its inhibitory effect on cervical cancer cells[J]. Carbohydrate Polymers, 2010, 80(5): 944-948. DOI:10.1016/ j.carbpol.2010.01.010.
[9] YUAN J F, ZHANG Z Q, FAN Z C, et al. Antioxidant effects and cytotoxicity of three purified po lysaccharides from Ligusticum chuanxiong Hort[J]. Carbohydrate Polymers, 2008, 74(4): 822-827. DOI:10.1016/j.carbpol.2008.04.040.
[10] LIU X, SUN Z L, ZHANG M S, et al. Antioxidant and antihyperlipidem ic activities o f po lysaccharides from sea cucum ber Apostichopus aponicas[J]. Carbohyd rate Po lym ers, 2012, 90(4): 1664-1670. DOI:10.1016/j.carbpo l.2012.07.047.
[11] YEN G C, HSIEH P P. Antioxidative activity and scavenging effects on active oxygen o f xyiose-lysine Maillard reaction p roducts[J]. Journal o f the Science of Food and Agriculture, 1995, 67(3): 415-420. DOI:10.1002/jsfa.2740670320.
[12] 罗萍, 师莉莎, 刘忠华. 乌贼墨多糖的体外抗氧化作用[J]. 食品研究与开发, 2013, 34(8): 1-4.
[13] 戴宏杰, 孙玉林, 郑小林, 等. 拟目乌贼生殖腺多糖提取工艺优化及自由基清除能力研究[J]. 食品工业科技, 2015, 36(5): 198-203.
[14] 戴宏杰, 孙玉林, 杨梅语, 等. 拟目乌贼生殖腺碱提多糖的抗氧化及吸湿保湿特性[J]. 食品科学, 2016, 37(2): 31-38. DOI:10.7506/ spkx1002-6630-201602006.
[15] 李卫民. 木瓜蛋白酶活力的快速测定[J]. 检测与分析, 2009, 12(10): 30-32.
[16] 何传波, 陈玲, 李琳. 巴戟天多糖脱蛋白方法的研究[J]. 食品科技, 2005, 30(6): 25-27. DOI:10.3969/j.issn.1005-9989.2005.06.008.
[17] 董宏平, 李建宏, 范海红, 等. 水花微囊藻多糖复合物的提取[J]. 南京师范大学学报(自然科学版), 1999, 22(3): 91-94. DOI:10.3969/ j.issn.1001-4616.1999.03.024.
[18] 宁正祥. 食品成分分析手册[M]. 北京: 中国轻工业出版社, 1998: 9-10.
[19] 贾淑珍, 王成功, 于成明. 香菇多糖脱蛋白工艺的研究[J]. 中国酿造, 2008, 27(5): 24-26. DOI:10.3969/j.issn.0254-5071.2008.03.009.
[20] 李晓旭, 王利卿, 陆若欣, 等. 胰蛋白酶水解胶原蛋白[J]. 辽宁化工, 2015, 44(3): 239-241.
[21] 李强, 唐微, 郑伟, 等. 杜仲粗多糖脱蛋白方法的对比研究[J]. 食品工业科技, 2011, 32(3): 315-317.
[22] 董英, 张艳芳, 孙艳辉. 水飞蓟粗多糖脱蛋白方法的比较[J]. 食品科学, 2007, 28(12): 82-84. DOI:10.3321/j.issn:1002-6630.2007.12.014.
[23] 张民, 郭志红, 周鸿立. 多糖类物质脱蛋白方法的概况[J]. 吉林化工学院学报, 2013, 30(5): 43-46. DOI:10.3969/j.issn.1007-2853.2013.05.012.
[24] 朱劼, 董文杰, 刘佳. 超声波协同等电点沉淀法提取螺旋藻藻胆蛋白工艺的优化[J]. 食品科学, 2010, 31(10): 146-150.
[25] 伍善广, 赖泰君, 孙建华, 等. 蚕蛹多糖脱蛋白方法研究[J]. 食品科学, 2011, 32(14): 21-24.
[26] 葛炳艳, 杨波. 裙带菜多糖3 种脱蛋白质方法的比较研究[J]. 食品与药品, 2010, 12(2): 96-98. DOI:10.3969/j.issn.1672-979X.2010.02.006.
[27] 陈桂冰, 孙培冬, 季晓彤, 等. 茶籽多糖的提取及脱蛋白工艺研究[J]. 中国油脂, 2016, 41(8): 74-78. DO I:10.3969/ j.issn.1003-7969.2016.08.018.
[28] 刘凯丽, 贾瑞博, 李燕, 等. 星虫多糖提取工艺优化及其抗氧化作用研究[J]. 中国酿造, 2016, 35(8): 115-119. DOI:10.11882/ j.issn.0254-5071.2016.08.026.
[29] 程知庆, 沈和定, 姚理想, 等. 干燥方法对瘤背石磺多糖抗氧化性和还原力的影响[J]. 食品与机械, 2015, 31(6): 169-172.
[30] 宋荪阳, 孙黎明, 朱蓓薇, 等. 扇贝性腺多糖提取物的抗氧化及免疫调节活性[J]. 食品科学, 2012, 33(5): 248-251. DOI:10.7506/ spkx1002-6630-201205052.
Op tim ization of Enzym atic Dep roteinization o f Po lysaccharides from Cu ttlefish Muscle (Sepia lycidas) and Its in Vitro Free Radical Scavenging Potential
SUN Yu lin1,2, DAI Hong jie2, WEN Jing1,2, ZHANG Wei1,2, ZHAO Juan1,2, TIAN Li2, CHEN Daohai1,*
(1. Round Beibu Gu lf Institute for the Protection and Utilization o f Marine Anim als in Med icine, Lingnan Norm al University, Zhan jiang 524048, China; 2. Co llege of Life Science and Techno logy, Lingnan Norm al University, Zhanjiang 524048, China)
Abstract:The enzymatic deproteinization of polysaccharides from cuttlefish muscle (Sepia lycidas) was optim ized using an orthogonal array design. Trypsin was determined to be the optimal enzyme to hydrolyze the protein in the crude polysaccharide extract. Enzyme dosage, hydrolysis temperature, pH and hydrolysis time were selected as independent variables for optim ization, and the response variables were deproteinization efficiency and polysaccharide loss. The enzymatic method was compared w ith trichloroacetic acid (TCA) and isoelectric point (IP) methods. Meanwhile, the free radical scavenging capacity of the deproteinated polysaccharides was also studied. The results showed that the optimum deproteinization conditions were obtained as follows: trypsin dosage, 3.0 g/100 m L; hydrolysis temperature, 53 ℃; pH, 8.2; and hydrolysis time, 1.5 h, yielding a deproteinization rate as high as 89.43% and a polysaccharide loss of only 1.78%. In terms of both dependent variables, the enzymatic method was better than TCA and IP methods. The percentage scavenging of hydroxyl radical by the deproteinated polysaccharides obtained by the enzymatic, TCA and IP methods were 45.72%, 38.72% and 25.18%, w ith IC50values of 12.44, 16.37 and 34.64 mg/m L, respectively, and the percentage scavenging of 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical by these purified polysaccharides were 68.00%, 30.08% and 23.10%, w ith IC50values of 7.62, 16.71 and 28.96 mg/m L, respectively. The free radical scavenging activities of the deproteinated polysaccharides from S. lycidas muscle were ranked as follows: enzymatic method > TCA method > IP method.
收稿日期:2016-10-03
基金项目:广东省科技厅项目(2014B040404071);广东省省部产学研合作专题项目(2013B090500036);广东省自然科学基金项目(2015A030310406);广东省高等教育“创新强校工程”项目(2014KTSCX159;2016KTSCX081);湛江市财政资金科技专项竞争性分配项目(2015A06008;2015A03017;2014A03011);湛江市非资助科技攻关项目(2016B01005);岭南师范学院博士启动项目(ZL1313;ZL1504);岭南师范学院自然科学研究项目(L1102)
作者简介:孙玉林(1980—),男,讲师,博士,研究方向为海洋生物活性物质。E-m ail:sunyu lin07002@126.com
*通信作者:陈道海(1963—),男,教授,博士,研究方向为海洋药用动物的开发利用与保护。E-m ail:dhchen11@21cn.com
DOI:10.7506/spkx1002-6630-201718039
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)18-0251-08引文格式:
孙玉林, 戴宏杰, 文菁, 等. 拟目乌贼肌肉多糖酶法脱蛋白工艺优化及体外清除自由基能力[J]. 食品科学, 2017, 38(18): 251-258.
DOI:10.7506/spkx1002-6630-201718039. http://www.spkx.net.cn
SUN Yulin, DAI Hong jie, WEN Jing, et al. Op tim ization of enzym atic dep roteinization of polysaccharides from cuttlefish m uscle (Sepia lycidas) and its in vitro free radical scavenging potential[J]. Food Science, 2017, 38(18): 251-258. (in Chinese w ith Eng lish abstract) DOI:10.7506/spkx1002-6630-201718039. http://www.spkx.net.cn