
图1 叶黄素化学结构示意图
Fig. 1 Chem ical structure o f lutein
焦 岩1,2,李大婧1,*,刘春泉1,肖亚冬1
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006)
摘 要:以叶黄素晶体为原料,采用乙醇注入法制备叶黄素纳米脂质体。在单因素试验基础上采用响应面试验,优化叶黄素纳米脂质体的制备工艺,得到了叶黄素纳米脂质体的最佳制备工艺条件为:叶黄素用量0.51 m g/m L、卵磷脂与胆固醇(质量比4∶1)用量5.0%、p H 7.4、温度62.9 ℃。此条件下叶黄素纳米脂质体包封率为(91.20±0.56)%,平均粒径为(226.8±10.62)nm;透射电子显微镜分析显示,所制备的叶黄素纳米脂质体呈球形纳米结构,叶黄素在纳米脂质体内部均匀分布;1,1-二苯基-2-三硝基苯肼(1,1-d ipheny1-2-p icrylhyd razyl,DPPH)自由基清除研究结果表明,叶黄素及其纳米脂质体的DPPH自由基清除活性与其质量浓度呈正相关,叶黄素纳米脂质体可有效提高叶黄素的热稳定性和抗氧化性能。
关键词:叶黄素;纳米脂质体;制备;响应面;氧化稳定性
叶黄素又名“黄体素”,属于类胡萝卜素,广泛分布于植物的果实、枝叶和花当中,在自然界当中存在着600多种类胡萝卜素,只有20 种在人体内发挥着重要的生理功能,如β-胡萝卜素、玉米黄素、隐黄素、叶黄素和番茄红素等[1-3],结果如图1所示。叶黄素对维持健康起到重要作用,是一种重要的抗氧化剂,具有高效泯灭单线态氧和清除自由基作用,可保护人体免受氧和自由基作用而带来的损害,增强机体免疫力[4-6]。叶黄素可以通过滤过蓝光和抗氧化作用保护皮肤、视网膜和体内多个组织免受氧化损伤,具有保护视力的功能[7-11]。叶黄素还可以抑制体内组织的炎性和免疫反应,动脉壁细胞中的叶黄索还可降低低密度脂蛋白胆固醇的氧化性,对早期的动脉硬化进程有延缓作用[12-14]。多项研究表明,叶黄素对多种癌症如乳腺癌、前列腺癌、直肠癌、皮肤癌等有预防和抑制作用[15-17]。

图1 叶黄素化学结构示意图
Fig. 1 Chem ical structure o f lutein
然而,从叶黄素的分子结构可以看出,由于其分子结构中碳链较长且含有较多疏水基团,在水中溶解性差,降低了体内吸收和生物利用率;其分子中含有多个多不饱和双键,导致易受氧、光辐射、高温、pH值以及体内酶、抗体和胃酸等因素的影响而发生分解和失活,失去原有的生理活性,稳定性较差。这两个因素严重限制了叶黄素进入体内到达有效部位和被较好的吸收,难以有效地发挥其生理功能。同时也极大地影响了叶黄素作为有效功能成分在食品和医药等领域的应用[18]。通过纳米脂质体的载体作用可将叶黄素包囊形成纳米结构,改变其疏水性状态,可有效地保护叶黄素分子中的不饱和双键和功能性羟基,提高在水中的分散性、稳定性和吸收效果[19-20]。因此,本研究制备了叶黄素纳米脂质体并优化其制备工艺条件,并对其微观结构、热稳定性及抗氧化活性进行分析,为叶黄素在食品和保健品领域的广泛应用提供了科学依据。
1.1 材料与试剂
叶黄素标准品(纯度≥90%) 上海源叶生物科技有限公司;无水乙醇、石油醚、Tw een-80、胆固醇、蛋黄卵磷脂等试剂均为国产分析纯。
1.2 仪器与设备
Nano-Zs90粒径分析仪 德国新帕泰克有限公司;S-3400扫描电子显微镜 日本日立公司;RE-52旋转蒸发仪 上海亚荣生化仪器厂;PC/PLC LD-53型冷冻干燥机 美国M illrock公司;UV-2450型紫外-可见分光光度计 日本岛津公司;WXH微型旋涡混合器 上海跃进医疗器械厂。
1.3 方法
1.3.1 叶黄素纳米脂质体的制备
采用乙醇注入法制备[21-22]。将叶黄素晶体粉末溶于无水乙醇当中,加入Tw een-80超声溶解,配制成一定质量浓度的叶黄素溶液,加入5.0%的蛋黄卵磷脂和胆固醇混合溶液(质量比4∶1,下同)水浴搅拌溶解,用注射器将上述脂质乙醇溶液快速注入40 m L、pH 6.5、0.05 m o l/m L的Na2HPO4-KH2PO4缓冲液中,调节溶液p H值,在一定温度搅拌水合30 m in,得到叶黄素纳米脂质体悬浮液。将悬浮液移入150 m L圆底烧瓶内,经50 ℃减压旋转蒸发30 m in,挥去残留乙醇,即得叶黄素纳米脂质体。
1.3.2 叶黄素纳米脂质体制备单因素试验
1.3.2.1 叶黄素用量对叶黄素纳米脂质体包封率的影响
在叶黄素用量分别为0.4、0.45、0.5、0.55、0.6 mg/m L,胆固醇与卵磷脂的用量5.0%、温度50 ℃、p H 6.0条件下,制备叶黄素纳米脂质体,测定包封率,研究叶黄素用量对纳米脂质体包封率的影响。
1.3.2.2 pH值对叶黄素纳米脂质体包封率的影响
在叶黄素用量0.6 m g/m L、胆固醇与卵磷脂的用量5.0%、温度50 ℃条件下,pH值分别为4.0、5.0、6.0、7.0和8.0,制备叶黄素纳米脂质体,测定包封率,研究pH值对纳米脂质体包封率的影响。
1.3.2.3 温度对叶黄素纳米脂质体包封率的影响
在叶黄素用量0.6 m g/m L、胆固醇与卵磷脂的用量5.0%、p H 7.0条件下,调节水合温度分别为30、40、50、60、70 ℃,制备叶黄素纳米脂质体,测定包封率,研究温度对纳米脂质体包封率的影响。
1.3.3 叶黄素纳米脂质体制备响应面试验优化
在单因素试验基础上选取叶黄素用量、pH值和温度3 个主要的影响因素,以包封率为指标,采用Box-Behnken试验设计优化叶黄素纳米脂质体制备工艺参数[23]。采用Design-Expert 7.0软件进行三因素三水平的响应面分析试验,试验因素水平见表1[24]。
表1 Box-Behnken试验因素与水平
Tab le 1 Factors and levels used in Box-Behnken experimental design

1.3.4 叶黄素标准曲线的绘制
分别配制不同质量浓度的叶黄素标准液,在445 nm波长处测定吸光度,求得线性回归方程为y=0.176 3x+0.004 4,R2=0.999 1。由此可知在0~3 μg/m L质量浓度范围内,在445 nm波长处叶黄素标准溶液的质量浓度与吸光度线性关系良好[25]。
1.3.5 包封率的测定[26-27]
取1.0 m L叶黄素纳米脂质体,加入3 m L石油醚充分混匀,2 000 r/m in条件下离心5 m in,重复以上操作两次,收集的上清液在445 nm波长处测其吸光度,计算叶黄素的质量浓度,包封率的计算如式(1)所示:
式中:M为叶黄素总质量/m g;V为脂质体悬浮液的总体积/m L;C为叶黄素的质量浓度/(m g/m L)。
1.3.6 叶黄素纳米脂质体粒径的测定
取叶黄素纳米脂质体,用蒸馏水稀释,充分混匀后,取1.0 m L于粒径分析仪中进行测定,得到了叶黄素纳米脂质体的粒径大小和图谱[28]。
1.3.7 叶黄素纳米脂质体微观结构透射电子显微镜检测
采用透射电子显微镜观察叶黄素纳米脂质体微观形态。将叶黄素纳米脂质体稀释100 倍,滴加约2 μL在铜网上,自然晾干,用2%磷钨酸进行负染,15 m in后吸取多余液体上电镜观察其形貌和微观形态[29]。
1.3.8 叶黄素纳米脂质体清除1,1-二苯基-2-三硝基苯肼(1,1-d ipheny1-2-p icrylhyd razyl,DPPH)自由基性能
准确称取20 m g DPPH,用无水乙醇溶解并定容至250 m L。取不同质量浓度的叶黄素溶液和纳米脂质化的叶黄素,分别在30、50、70 ℃条件下加热12 h。然后将脂质体分别加入无水乙醇,低温离心分离提取叶黄素。将热处理后的叶黄素分别置于具塞试管中(分2 组),向其中一组加入DPPH溶液至2 m L,摇匀30 m in后,用无水乙醇做参比在517 nm波长处测吸光度,即为Ai;同时测定2 m L DPPH溶液与2 m L无水乙醇混合后的吸光度,即为Ac;向另一组中加入无水乙醇至2 m L,混合后测其吸光度,即为Aj。根据式(2)、(3)计算叶黄素及其纳米脂质体对DPPH自由基清除率(K)及清除能力降低率[30]:

2.1 叶黄素纳米脂质体制备单因素试验结果
2.1.1 叶黄素用量对纳米脂质体包封率的影响
由图2可以看出,随着叶黄素用量的增加,叶黄素纳米脂质体的包封率随之增大,当叶黄素用量为0.55 m g/m L时,对于叶黄素的包封率达到最高,之后包封率开始降低,因此叶黄素用量0.55 m g/m L为最佳。
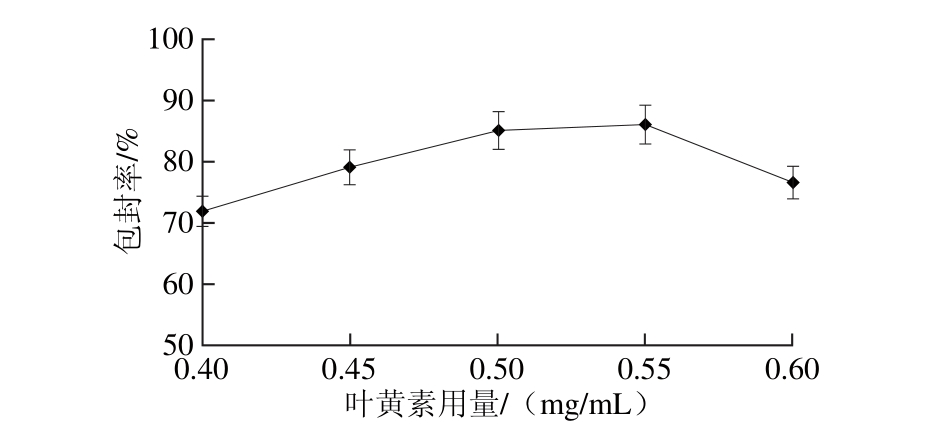
图2 叶黄素用量对包封率的影响
Fig. 2 Effects o f lu tein concen tration on entrapm en t efficiency
2.1.2 pH值对叶黄素纳米脂质体包封率的影响
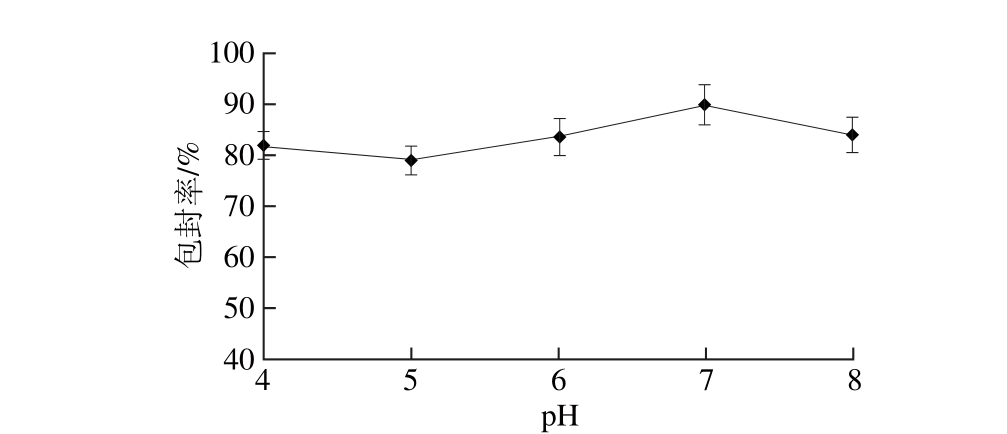
图3 pH值对叶黄素纳米脂质体包封率的影响
Fig. 3 Effect of pH on entrapm ent efficiency
由图3可知,pH 4.0~7.0范围,叶黄素纳米脂质体包封率随pH值升高而增大,在pH 7.0时达到最大,之后开始降低,这可能是由于叶黄素在中性范围时与脂质体结合较好,包封率达到最高,因此确定pH 7.0为最佳pH值。
2.1.3 温度对叶黄素纳米脂质体包封率的影响

图4 温度对包封率的影响
Fig. 4 Effects o f hyd ration tem perature on en trapm ent efficiency
由图4可知,随着制备过程中水合温度的升高,叶黄素纳米脂质体包封率增大,50 ℃时达到最大,当温度超过50 ℃时,包封率增大趋于平缓,且略有下降趋势。温度适当增大有利于脂质体内部叶黄素和磷脂等形成均一稳定的结构,但是温度过高,叶黄素脂质体的稳定性降低,从而包封率有所下降,因此确定50 ℃时为最佳温度。
2.2 响应面优化试验结果
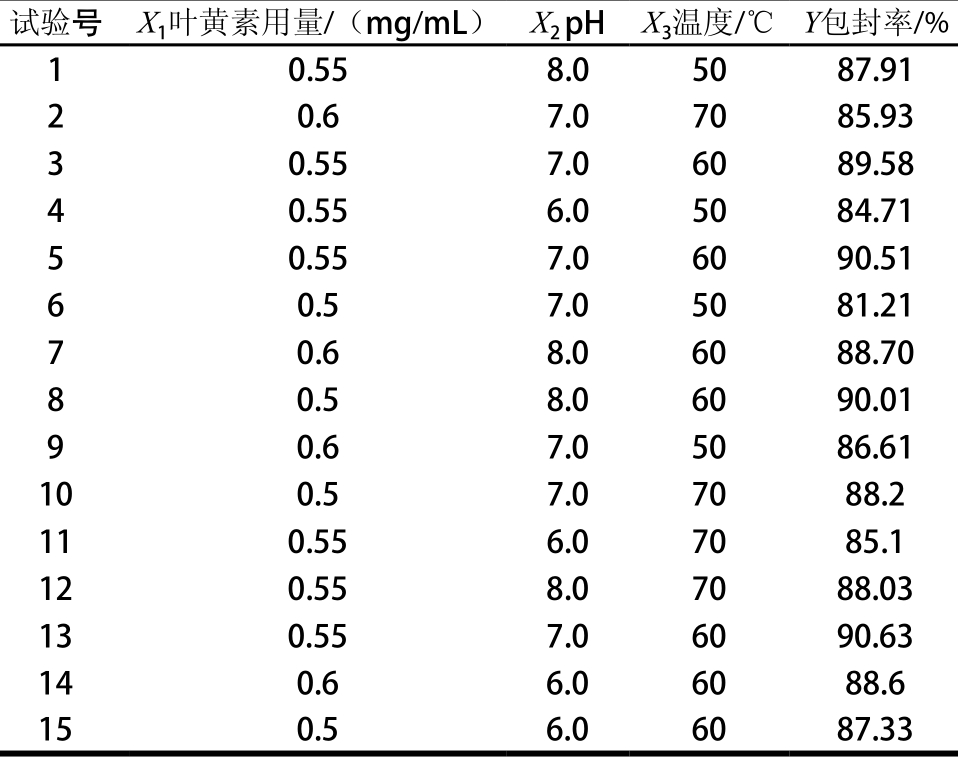
2.2.1 响应面试验设计与结果
以叶黄素用量、pH值、温度为自变量,叶黄素纳米脂质体包封率(Y)为响应值,进行响应面分析试验,得出不同试验条件下叶黄素纳米脂质体包封率(表2)。
表2 Box-Behnken试验设计及结果
Tab le 2 Box-Behnken design w ith experim ental response
2.2.2 模型的建立及分析
利用SAS 9.0对表2的试验数据进行方差及显著性分析,具体结果分析见表3,并得到如下标准形式的三元二次回归方程:

表3 二次响应面回归模型方差分析及参数估计
Tab le 3 Analysis o f variance and param eter estim ates of the quad ratic response su rface m odel

注:*.影响显著(P<0.05);**.影响极显著(P<0.01)。
从表3方差分析结果看出:X3、X32的P值小于0.01,具有极显著性;模型常量、X1、X1X3的P值在0.01~0.05间,具有显著性;其余项P值大于0.05,为不显著。各因素对响应值的影响不是简单的线性关系,因此可以利用该回归方程确定叶黄素纳米脂质体最佳制备工艺条件。而从回归分析表得出:X1、X2、X3对响应值影响的强烈程度顺序为:温度>叶黄素用量>pH值。残差项各项数据分析表明,该模型失拟P为0.128 8,不具有显著性;因此该二次方程能够较好地拟合真实的响应面。
2.2.3 响应面分析与优化
为考察三因素间的交互作用情况,采用Desig n-Expert 7.0软件对回归模型进行降维分析,并得到任意两因素响应面和等高线图,如图6所示。
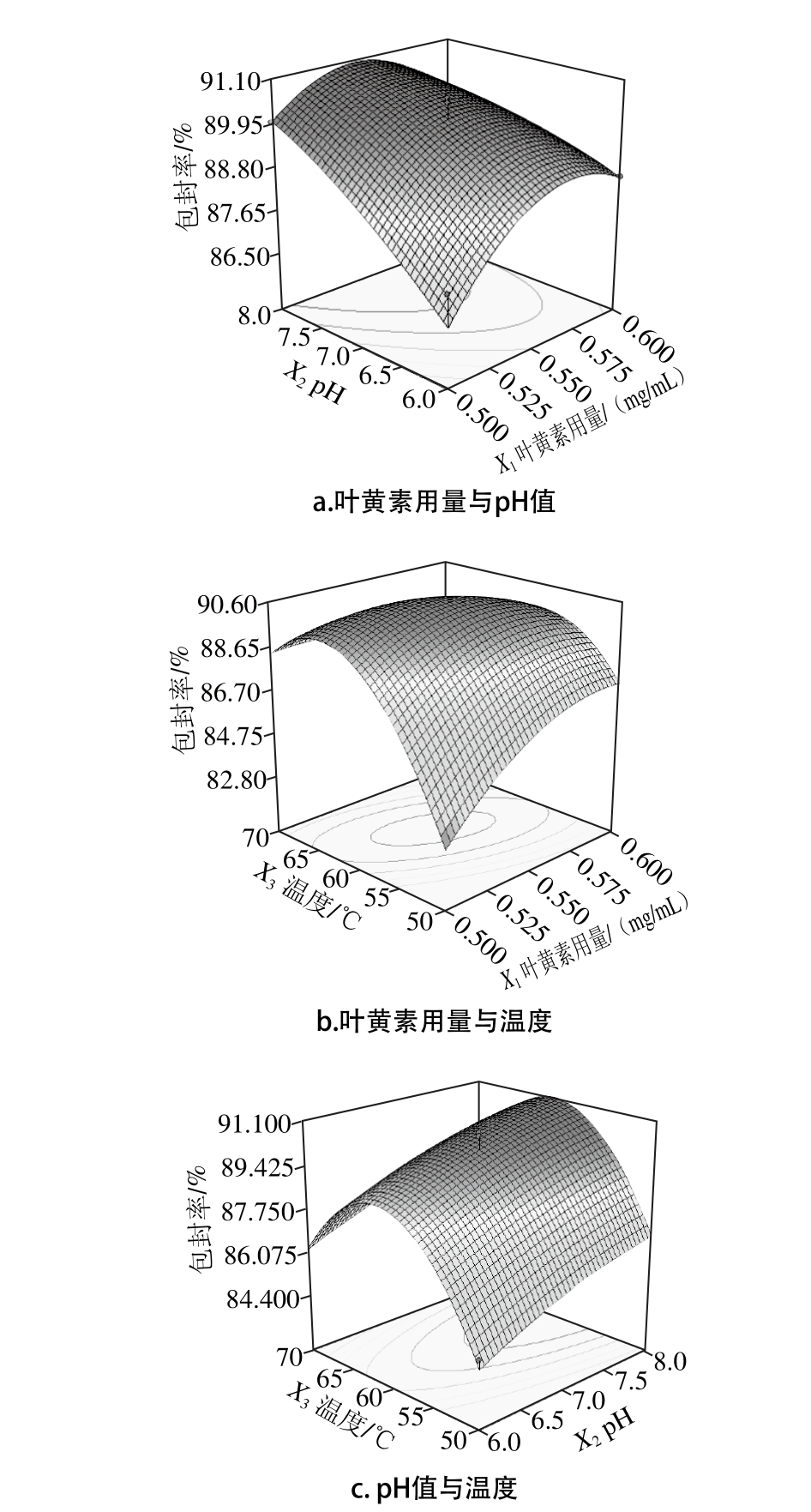
图5 各因素交互作用响应面图
Fig. 5 Response surface curves show ing the effects am ong various factors on en trapm en t efficiency
由图5可以看出,体系叶黄素用量和温度之间的交互作用显著,相比较而言,叶黄素用量和pH值之间、pH值和温度之间的交互作用较小。此外,叶黄素用量、温度对叶黄素纳米脂质体包封率的影响最大,随着叶黄素用量和温度的变化,叶黄素纳米脂质体包封率也随之趋势改变,两个因素与包封率之间的变化规律与所建立的响应面模型方程相符。
2.2.4 最佳工艺参数的确定和验证
确定叶黄素纳米脂质体的最佳制备工艺为叶黄素用量0.51 m g/m L、pH 7.44、温度62.88 ℃,此时叶黄素纳米脂质体包封率为91.59%。进一步验证模型优化分析结果,在叶黄素用量0.51 m g/m L、pH 7.4和温度62.9 ℃条件下进行重复提取工艺实验验证,实验重复3 次,得叶黄素纳米脂质体包封率为(91.20±0.56)%(n=3),与本研究中所建立的响应面模型分析结果中的预测值91.59%比较接近。按实际实验情况,可将叶黄素用量51 m g/m L、pH 7.4和温度62.9 ℃作为叶黄素纳米脂质体制备的最佳工艺参数。
2.3 叶黄素纳米脂质体粒径分析
表4 叶黄素纳米脂质体粒径大小分布
Tab le 4 Size d istribution o f lutein nano liposom es

从表4可以看出,所制备的叶黄素纳米脂质体粒径分布范围在90~700 nm左右,分布相对比较集中,在10%以上的粒径大小分布范围主要集中在190.1~342 nm之间,占整个纳米脂质体体系的60%,500 nm以上的仅占5.4%,说明本方法制备的纳米脂质体粒径较小,粒径范围分布比较集中,有利于叶黄素纳米脂质体体系的稳定性。

图6 叶黄素纳米脂质体粒径分析图
Fig. 6 Size d istribution o f lu tein nano liposom es
如图6所示,脂质体的平均粒径为(226.8±10.62)nm,在纳米级范围内粒径分布范围较窄、分布区域比较集中,与表4中脂质体粒径数据完全一致,表明所制备的叶黄素纳米脂质体是以纳米结构体的形式均匀分布。
2.4 叶黄素纳米脂质体成像分析
采用H-7650透射电子显微镜对叶黄素纳米脂质体形貌和内部结构进行微观分析,如图7a所示,叶黄素作为芯材与磷脂胆固醇等壁材形成纳米结构,纳米脂质体呈球形微粒分布,大小在1 000 nm范围内,与粒径分析仪粒径检测结果一致;从图7b对叶黄素纳米脂质体内部结构分析可以明显看出,叶黄素被脂质膜包封在脂质体内,均匀分布在纳米脂质体的内侧,和壁材结合紧密,说明叶黄素能与脂质膜材料形成比较稳定的脂质体结构,这对于提高叶黄素的水溶性,增强体内吸收利用效果和生物利用率,提高叶黄素的体内外稳定性具有重要作用。
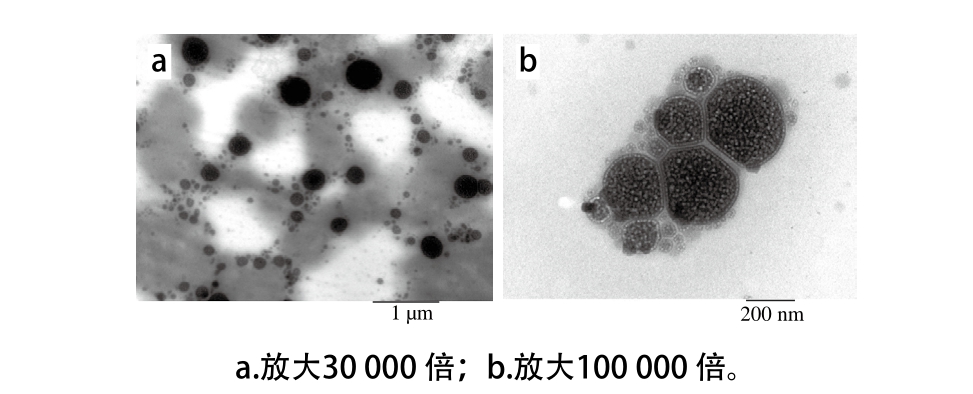
图7 叶黄素纳米脂质体微观结构透射电子显微镜图
Fig. 7 TEM o f lutein nanoliposom es
2.5 叶黄素纳米脂质体清除DPPH自由基结果
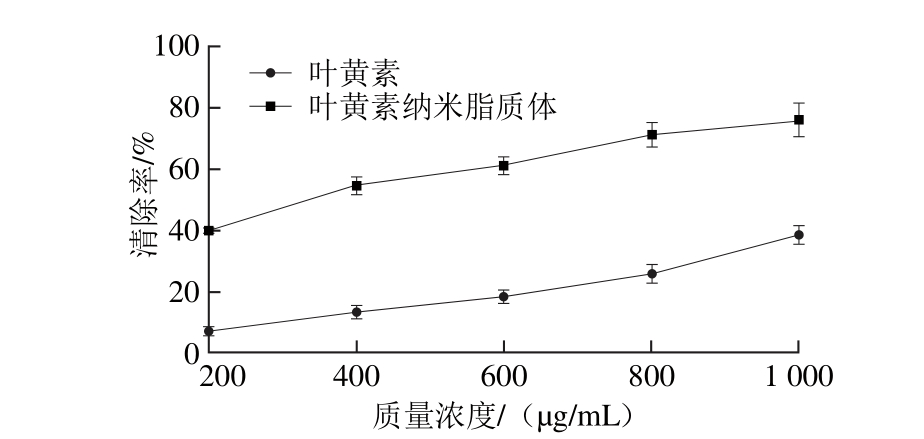
图8 叶黄素及其纳米脂质体DPPH自由基清除率
Fig. 8 DPPH rad ical scavenging activities o f LUT and LUT-NLP at d ifferen t concen trations
如图8所示,随着叶黄素及其纳米脂质体质量浓度的增加,对DPPH自由基清除能力也分别随之增加,在叶黄素质量浓度为1 000 μg/m L时,二者DPPH自由基清除率分别为(38.34±2.82)%和(75.93±4.56)%,继续增大质量浓度叶黄素溶解性降低,影响DPPH自由基清除效果。由此可见,经脂质纳米化的叶黄素抗氧化能力在相同质量浓度下对DPPH自由基的清除率明显提高,由于载体体系中有磷脂和胆固醇成分,赋予脂质体一定的抗氧化能力,也使得整个叶黄素纳米脂质体的抗氧化能力增强,这与文献[31]研究结果具有一致性。脂质体还可以增强叶黄素的水溶性和分散性,有助于叶黄素抗氧化性能的发挥和增强叶黄素体内吸收利用率。
由表5可知,经过不同温度加热12 h处理后,空白脂质体、叶黄素及其纳米脂质体在加热不同时间段对DPPH自由基清除能力均有所下降,但从不同温度条件下DPPH自由基清除能力降低率比较可以明显看出,在30、50、70 ℃热处理12 h后,叶黄素DPPH自由基清除能力分别下降了19.9%、36.39%和66.16%,而空白脂质体和叶黄素纳米脂质体的DPPH自由基清除能力降低率较小,由此可见,脂质载体材料具有一定的抗氧化和热保护能力,经过脂质纳米化后可减少温度对叶黄素的热分解作用,并通过减小脂质体中叶黄素的释放速度而增强叶黄素的稳定性,进而充分保留其抗氧化性能。
表5 不同温度作用下叶黄素及其纳米脂质体DPPH自由基清除能力的变化
Tab le 5 DPPH rad ical scavenging activities o f LUT and LUT-NLP at d ifferen t tem peratu res

对叶黄素纳米脂质体的制备方法进行研究,并采用响应面法优化其制备工艺条件,分析其微观结构。得到了叶黄素纳米脂质体的最佳制备工艺条件为叶黄素用量0.51 m g/m L、卵磷脂与胆固醇用量5.0%、pH 7.4、温度62.9 ℃,此条件下叶黄素纳米脂质体包封率为(91.20±0.56)%。所制备的叶黄素纳米脂质体微粒粒径在纳米级范围均匀分布,平均粒径为(226.8±10.62)nm,透射电子显微镜分析显示叶黄素被包封在脂质膜内部均匀分布,有效防止了叶黄素的氧化分解和水分散性差的问题,提高了叶黄素的稳定性和利用价值。DPPH自由基清除研究结果表明,叶黄素及其纳米脂质体的DPPH自由基清除活性与其质量浓度呈正相关,脂质纳米化可减小叶黄素的粒径、增大比表面积和分散性进而提高活性和利用率,并且有效地保护了叶黄素分子中的不饱和双键和功能羟基,充分减小热处理条件下的抗氧化性能损失,提高叶黄素的热稳定性和生物活性。因此本研究制备叶黄素纳米脂质体为拓宽叶黄素在食品和医药领域的应用提供了依据。
参考文献:
[1] LIN J H, LEE D J, CHANG J S. Lutein p roduction from b iom ass: marigold flowers versus m icroalgae[J]. Bioresource Technology, 2015, 184: 421-428. DOI:10.1016/j.biortech.2014.09.099.
[2] 翟艳丽, 惠伯棣, 宫平, 等. 游离态叶黄素和玉米黄素体外单线态氧淬灭率的比较研究[J]. 食品科学, 2014, 35(7): 77-80. DOI:10.7506/ spkx1002-6630-201407016.
[3] ABDEL-AAL E S M, AKHTAR H, ZAHEER K, et al. Dietary sources o f lutein and zeaxanthin carotenoids and their ro le in eye health[J]. Nu trien ts, 2013, 5(4): 1169-1185. DOI:10.3390/nu5041169.
[4] 李大婧, 刘志凌, 刘春泉. 叶黄素酯和叶黄素抗氧化作用比较[J]. 中国食品学报, 2008, 8(5): 28-32. DO I:10.3969/ j.issn.1009-7848.2008.05.005.
[5] WANG M, TSAO R, ZHANG S, e t a l. An tioxid an t ac tivity, mutagenicity/anti-mutagenicity, and clastogenicity/anti-clastogenicity of lutein from marigold flow ers[J]. Food and Chem ical Toxicology, 2006, 44(9): 1522-1529. DOI:10.1016/j.fct.2006.04.005.
[6] NWACHUKWU I D, UDENIGWE C C, ALUKO R E. Lu tein and zeaxanthin: p roduction techno logy, bioavailability, m echanism s o f action, visual function, and health claim status[J]. Trends in Food Science & Techno logy, 2016, 49: 74-84. DOI:10.1016/ j.tifs.2015.12.005.
[7] ROBERTS R L. Lu te in, zeaxan th in, an d sk in hea lth[J]. Am erican Jou rnal o f Lifesty le Med icine, 2013, 7(3): 182-185. DOI:10.1177/1559827613477827.
[8] CHEW E Y, CLEMONS T E, SANGIOVANN I J P, e t a l. Secondary analyses o f the effects of lutein/zeaxanthin on agerelated m acu lar degeneration p rogression: AREDS2 report No. 3[J]. JAMA Oph thalm o logy, 2014, 132(2): 142-149. DOI:10.1001/ jam aoph thalm o l.2013.7376.
[9] MA L, HAO Z X, LIU R R, et al. A dose-response m eta-analysis o f dietary lutein and zeaxanthin intake in relation to risk of agerelated cataract[J]. Graefe’s Archive for Clinical and Experim ental Ophthalm ology, 2014, 252(1): 63-70. DOI:10.1007/s00417-013-2492-3.
[10] 黄绯绯, 林晓明. 老年黄斑变性患者与对照人群膳食, 血清叶黄素/玉米黄素以及血脂水平的比较[J]. 北京大学学报(医学版), 2014, 46(2): 237-241. DOI:10.3969/j.issn.1671-167X.
[11] 高丹红. 叶黄素改善高脂饲料喂养大鼠动脉粥样硬化危险因素的初步研究[D]. 武汉: 华中科技大学, 2012.
[12] XU X R, ZOU Z Y, XIAO X, et al. Effects o f lu tein supp lem en t on serum in flamm atory cytokines, ApoE and lip id p ro files in early atherosclerosis population[J]. Journal of Atherosclerosis and Th rom bosis, 2013, 20(2): 170-177. DOI:10.5551/jat.14365.
[13] 付蕾, 陈晓哲, 张慧娟, 等. 叶黄素对人结肠癌HT29细胞增殖的抑制及其机制[J]. 世界华人消化杂志, 2013, 21(13): 1239-1244. DOI:10.11569/w cjd.v21.i13.1239.
[14] 叶兆伟, 吴海港, 刘柱明, 等. 万寿菊提取物叶黄素对家兔血管组织结构及某些生化指标的影响[J]. 毒理学杂志, 2016, 30(4): 282-285.
[15] 孙震, 姚惠源. 叶黄素的抗癌作用及其研究现状[J]. 生物技术通讯, 2005, 16(1): 84-86. DOI:10.3969/j.issn.1009-0002.2005.01.027.
[16] MA L, HAO Z X, LIU R R, et al. A dose-response m eta-analysis o f dietary lutein and zeaxanthin intake in relation to risk of agerelated cataract[J]. Graefe’s Archive for Clinical and Experimental Ophthalm ology, 2014, 252(1): 63-70. DOI:10.1007/s00417-013-2492-3.
[17] DESHPANDE S. Ro le o f an ti-oxidan ts in p reven tion o f agerelated m acu lar degeneration[J]. Journal o f Med ical Nutrition and Nutraceuticals, 2012, 1(2): 83-86. DOI:10.4103/2278-019X.101292.
[18] ZHANG J X, WANG K, MAO Z F, et al. App lication o f liposom es in drug development-focus on gastroenterological targets[J]. International Journal of Nanomedicine, 2013, 8: 1325-1334. DOI:10.2147/IJN.S42153.
[19] PENG C H, CHANG C H, PENG R Y, et al. Im p roved m em b rane transport of astaxanthine by liposomal encapsulation[J]. European Journal of Pharm aceutics and Biopharmaceutics, 2010, 75(2): 154-161. DOI:10.1016/j.ejpb.2010.03.004.
[20] 李秀英, 曾凡, 赵曜, 等. 脂质体药物递送系统的研究进展[J]. 中国新药杂志, 2014, 23(16): 1904-1908.
[21] MORAES M, CARVALHO J M P, SILVA C R, e t a l. Lip osom es encapsulating beta-carotene p roduced by the p roliposom es m ethod: characterisation and shelf life of powders and phospholipid vesicles[J]. In ternational Journal o f Food Science & Techno logy, 2013, 48(2): 274-282. DOI:10.1111/j.1365-2621.2012.03184.x.
[22] 丁保淼. 柠檬烯脂质体的乙醇注入法制备及其体外释放[J]. 食品科技, 2012, 37(8): 251-254.
[23] 李晓玲, 陈相艳, 王文亮, 等. 超微粉碎辅助超声-微波法提取玉米黄色素[J]. 中国食品学报, 2014, 14(8): 99-107.
[24] 马空军, 潘言亮, 张卫红, 等. 响应面试验优化万寿菊花中叶黄素酯皂化反应工艺[J]. 食品科学, 2015, 36(12): 7-11. DOI:10.7506/ spkx1002-6630-201512002.
[25] 梁敏慧, 崔亚娟, 何梅, 等. 叶黄素分析检测方法的研究进展[J]. 食品工业科技, 2015, 36(8): 390-394. DOI:10.13386/j.issn1002-0306.
[26] TAN C, XIA S, XUE J, et al. Liposom es as vehicles fo r lu tein: p reparation, stability, liposomal m em brane dynam ics, and structure[J]. Journal of Agricu ltural and Food Chem istry, 2013, 61(34): 8175-8184. DOI:10.1021/jf402085f.
[27] NALAWADE P B, GAJJAR A K. M icroencapsu lation o f lu tein extracted from m arigold flow ers (Tagetes erecta L.) using full factorial design[J]. Journal o f Drug Delivery Science and Techno logy, 2016, 33: 75-87. DOI:10.1016/j.jddst.2016.03.012.
[28] 千春录, 侯顺超, 殷健东, 等. 响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性[J]. 食品科学, 2016, 37(10): 82-87. DOI:10.7506/spkx1002-6630-201610013.
[29] LU Q, LU P M, PIAO J H, et al. Preparation and physicochem ical characteristics of an allicin nanoliposom e and its release behavior[J]. LWT-Food Science an d Techno log y, 2014, 57(2): 686-695. DOI:10.1016/j.lw t.2014.01.044.
[30] 刘香萍, 王国庆, 李国良, 等. 响应面法优化提取紫花苜蓿叶总黄酮及其抗氧化活性研究[J]. 中国食品学报, 2016, 16(4) :145-152. DOI:10.16429/j.1009-7848.2016.04.020.
[31] 戴彦韵, 邵卫樑, 杭晓敏, 等. 茶多酚磷脂复合物的制备及其抗氧化性能的研究[J]. 安徽医药, 2009, 13(7): 735-737. DOI:10.3969/ j.issn.1009-6469.2009.07.008.
Lutein Nano liposom es: Op tim ization o f Preparation Conditions and Oxidative Stability
JIAO Yan1,2, LI Dajing1,*, LIU Chunquan1, XIAO Yadong1
(1. Institu te o f Agricu ltu ral Products Processing, Jiangsu Academ y o f Ag ricu ltural Sciences, Nan jing 210014, China; 2. Co llege o f Food and Bio logical Engineering, Qiqihar University, Qiqihar 161006, China)
Abstract:This study aim ed to optim ize the p reparation conditions of lutein nanoliposom es (LUT-NLP) by ethanol injection m ethod using a com bination of one-factor-at-a-tim e m ethod and response surface m ethodology. The optim al preparation conditions were found to be as follows: lutein concentration, 0.51 mg/m L; total content of lecithin and cholesterol (4:1, m/m) in nanoliposom es, 5.0%; pH, 7.4; and hydration tem perature, 62.9 ℃. Under these conditions, the entrapm ent efficiency of lutein in nanoliposomes was (91.20 ± 0.56)% and the average size of nanoliposom es was (226.8 ± 10.62) nm. Transm ission electron m icroscope (TEM) showed that the shape of LUT-NLP was regularly spherical and lutein was evenly distributed in the nanoliposom es. The antioxidant activity studies show ed that both lutein and LUT-NLP concentration-dependently scavenged 1,1-d ipheny1-2-p icrylhyd razyl (DPPH) radical. Furtherm ore, this study dem onstrated that LUT-NLP had apparently im p roved antioxidan t activity and stability com pared w ith lu tein .
Key words:lutein; nano liposom e; p reparation; response surface m ethodo logy; oxidative stability
DOI:10.7506/spkx1002-6630-201718040
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)18-0259-07引文格式:
焦岩, 李大婧, 刘春泉, 等. 叶黄素纳米脂质体的制备工艺优化及其氧化稳定性[J]. 食品科学, 2017, 38(18): 259-265.
DOI:10.7506/spkx1002-6630-201718040. h ttp://www.spkx.net.cn
JIAO Yan, LI Dajing, LIU Chunquan, et al. Lutein nano liposom es: op tim ization of p reparation conditions and oxidative stability[J]. Food Science, 2017, 38(18): 259-265. (in Chinese w ith Eng lish abstract) DOI:10.7506/spkx1002-6630-201718040. h ttp://www.spkx.net.cn
收稿日期:2016-11-02
基金项目:江苏省博士后科研资助计划项目(1601028A)
作者简介:焦岩(1981—),男,副教授,博士,研究方向为生物活性物质与功能食品。E-m ail:jiaoyan_3000@126.com
*通信作者:李大婧(1976—),女,研究员,博士,研究方向为食品营养化学。E-m ail:lidajing@163.com