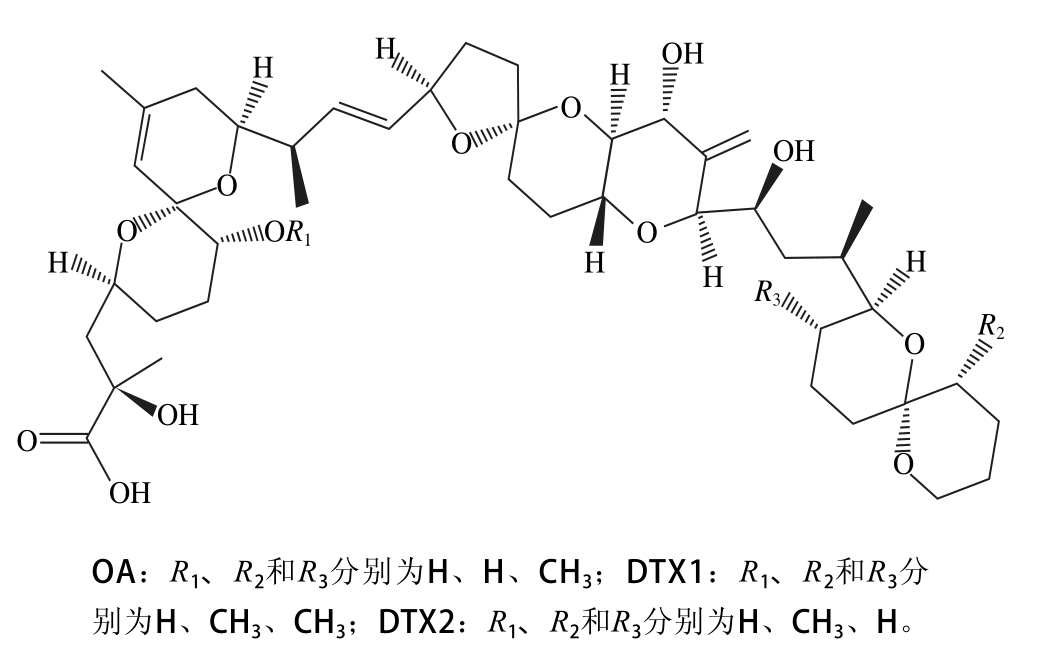
图1 OA及其衍生物DTXs结构图
Fig. 1 Chem ical structures of okadaic and dinophysistoxins
严忠雍1,2,张小军1,2,*,李奇富3,陈 思1,2,李佩佩1,2,祝 银1,2,刘文静4
(1.浙江省海洋水产研究所,浙江 舟山 316021;2.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江 舟山 316021;3.江苏美正生物科技有限公司,江苏 无锡 214135;4.浙江海洋大学食品与医药学院,浙江 舟山 316021)
摘 要:建立贝类中腹泻性贝类毒素的免疫亲和净化-液相色谱-串联质谱分析方法。样品采用80%甲醇溶液提取,选择磷酸盐缓冲液与提取液(4∶1,V/V)混合稀释后,免疫亲和选择专一净化,液相色谱-串联质谱分析。根据腹泻性免疫亲和柱的使用特性,对上样液、淋洗液、洗脱液等参数进行优化。质谱采用电喷雾负离子电离,多反应监测模式,外标法定量。3 种分析物在1.0~100 μg/L质量浓度范围内线性相关系数均大于0.996,对应的检出限和定量限均为0.3 μg/kg和1.0 μg/kg,平均回收率为82.7%~94.3%,相对标准偏差为0.70%~7.61%。本方法基质干扰小、净化效果强、灵敏度高,适合贝类中腹泻性贝类毒素的分析测定。
关键词:免疫亲和;液相色谱-串联质谱;腹泻性贝类毒素
大田软海绵酸(okadaic acid,OA)及其衍生物鳍藻毒素(d inophysistoxins,DTXs)(图1)是一类亲脂性聚醚类化合物,主要由有毒赤潮藻类鳍藻属和原甲藻属的部分藻类产生[1]。当有毒微藻被双壳贝类滤食后,OA和DTXs会在贝体内累积,导致贝类食用者中毒,出现腹泻、恶心、呕吐及下腹疼痛等症状[2-5]。OA和DTXs是腹泻性贝类毒素中分布最广、危害最大的一类组分。除能引起腹泻外,OA和DTXs还能损伤肠黏膜,是肿瘤促进因子,具有遗传毒性[6-8]。欧盟对贝类组织中腹泻性贝类毒素的安全限量为160 μg/kg,我国出境检验检疫行业标准则规定任何腹泻性贝类毒素含量不得大于160 μg/kg样品[9]。我国东海海域是赤潮多发生区域,通过对长江口及邻近海域有毒藻类和赤潮毒素调查发现,该区域常年存在能产生腹泻性贝类毒素的具尾鳍藻和倒卵形鳍藻[10-12]。考虑到该类毒素对人体健康的潜在危害,有必要加强贝类中腹泻性贝类毒素的监测。

图1 OA及其衍生物DTXs结构图
Fig. 1 Chem ical structures of okadaic and dinophysistoxins
目前,用于腹泻性贝类毒素检测的方法主要有小鼠生物法[13-15]、酶联免疫法[16-20]、高效液相色谱法[21-22]和液相色谱-质谱联用[23-26]等方法。小鼠生物法是调查检测腹泻性贝类毒素发展最早、应用最广泛的分析方法,但仅能指出毒性的大小,无法确定毒素的组成和含量,可比性较差。酶联免疫法反应迅速、成本低,但其准确度较差,易受交叉反应的影响而出现假阴性或假阳性。液相色谱法技术是有效的非生物检测法,但缺乏准确的定性能力,且需要复杂的前处理和繁琐的衍生步骤。液相色谱-质谱联用技术结合了液相色谱优越的分离能力与质谱高灵敏度的定性定量功能,但现有研究多采用固相萃取技术净化样品,回收率低,基质干扰仍较严重,导致方法应用率不高,无法有效监测腹泻性贝类毒素。免疫亲和柱是一种基于抗原抗体反应的新型层析柱,利用特异性生物大分子抗体对另一类生物大分子特异识别和可逆结合特性制作而成,具有高度的选择专一性和良好的吸附净化性能。作为新型高效的前处理净化技术,免疫亲和净化技术正在不断改进发展[27-30],但目前鲜见免疫亲和-液相色谱-质谱联用检测技术应用于贝类中腹泻性贝类毒素同时检测的相关报道。本实验利用免疫亲和柱的选择专一性,并结合液相色谱-串联质谱的高灵敏性和精确性,建立一套高效、快捷、灵敏度高的贝类中腹泻性贝类毒素检测方法。
1.1 材料与试剂
实验所用贝类样品为养殖和海捕的贻贝、毛蚶、泥蚶、花蛤、文蛤、缢蛏、牡蛎、扇贝,并按标准规范要求处理的检测样品。
OA、DTX1、DTX2标准品 加拿大海洋生物科学研究所;甲酸、乙酸铵(均为色谱纯) 美国Sigm a公司;甲醇、乙腈(均为色谱纯) 德国Merck公司;乙酸、氨水、十二水合磷酸氢二钠、氯化钠、二水合磷酸二氢钠(均为分析纯) 国药集团化学试剂有限公司;实验用水均为M illipore-Q系统制备的超纯水。
1.2 仪器与设备
ACQUITYTMUPLC-Qua ttro Prem ie r XE液相色谱-串联质谱仪(配有电喷雾离子源) 美国Wa te rs公司;SPE-24固相萃取装置 美国Su p e lco公司;N-EVAP-11634氮气吹干仪 美国Organom ation公司;MS3 Dig ital旋涡混合器 德国IKA公司;超声波清洗器上海科导超声仪器有限公司;Cen trifuge5810高速离心机德国Eppendorf公司;腹泻性贝类毒素免疫亲和柱(柱容量3 m L) 江苏美正生物技术有限公司。
1.3 方法
1.3.1 贝类毒素混合标准溶液的配制
1 μg/m L贝类毒素混合标准溶液:准确移取适量的OA、DTX1、DTX2标准品溶液,用甲醇稀释定容至50 m L,-12 ℃避光保存,保存期为3 个月;使用时逐级用甲醇稀释至100 μg/L。
1.3.2 样品前处理
准确称取已充分均质样品2.00 g于50 m L具塞离心管中,加入10 m L 80%甲醇溶液,涡旋振荡2 m in,超声提取10 m in,7 000 r/m in离心5 m in,将上清液移至另一50 m L离心管中;再向剩余残渣中加入10 m L 80%甲醇溶液,重复提取1 次,合并提取液。移取5 m L上清液至另一50 m L离心管中,加入20 m L磷酸盐缓冲溶液(phosphate bu ffer saline,PBS)溶液进行稀释,待净化。
取出免疫亲和柱,待其恢复至室温后去掉亲和柱堵头,放出柱内保存液后,上样品液。上样结束后,用6 m L 20%甲醇溶液淋洗亲和柱,挤干柱内残留液,并弃去以上全部流出液,最后用3 m L含有2%氨水的甲醇溶液洗脱,收集洗脱液于50 ℃氮气吹干,用1 m L初始流动相定容溶解,经0.22 μm滤膜过滤后分析。
1.3.3 高效液相色谱条件
ACQUITYTMUPLC BEH C18色谱柱(2.1 m m× 100 mm,1.7 ☒m);进样体积10 μL;样品室温度4 ℃;柱温30 ℃;流速0.3 m L/m in;流动相A为2 m m o l/L乙酸铵溶液,B为乙腈;梯度洗脱:0~3.0 m in,7 0%~2 5% A;3.0~3.5 m in,25%~7 0% A;3.5~5.0 m in,70% A。
1.3.4 质谱条件
电喷雾离子源,负离子扫描;多反应监测模式;毛细管电压3.2 kV;离子源温度115 ℃;脱溶剂气温度370 ℃;锥孔气流量60 L/h;脱溶剂气流量700 L/h;锥孔电压、碰撞能量、分析物母离子及子离子等质谱多反应监测条件如表1所示。
表1 分析物的质谱多反应监测实验条件
Tab le 1 Cond itions o f m u ltip le reaction m onito ring fo r analytes

注:*.定量离子。
2.1 质谱和色谱条件优化
分别在电喷雾正负离子扫描模式下采用蠕动泵5 μL/m in流动注射OA、DTX1和DTX2标准溶液,发现3 种分析物在负离子模式下的响应值高,质谱信号强。因此选择负离子模式对分析物的质谱参数进行优化。经过一级质谱扫描分析,发现3 种分析物各对应的分子离子峰[M-H]-丰度最高,故确定OA、DTX1、DTX2的母离子依次为m/z 803.3、m/z 817.3和m/z 803.3。通过二级碰撞诱导分析收集分析物子离子信息,选取丰度最强的2 个离子碎片峰作为分析物的子离子,并对参数进一步优化,各分析物的离子碎片信息如图2所示。
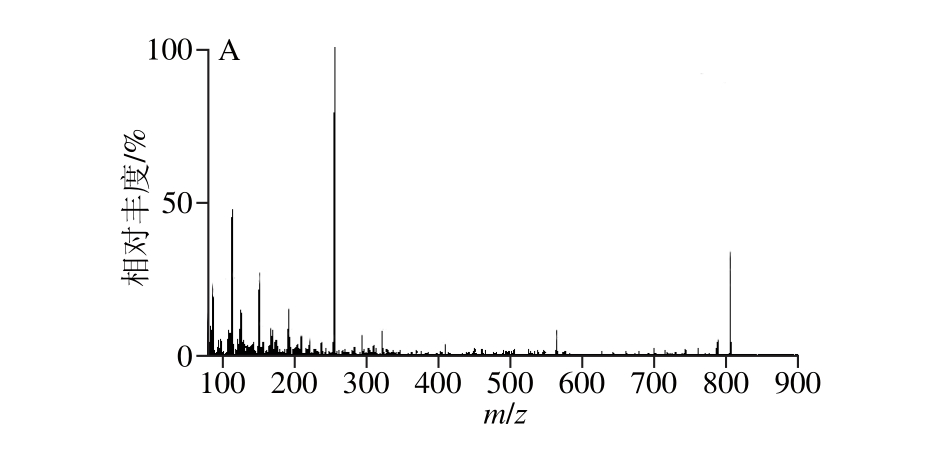

图2 分析物质谱图
Fig. 2 Mass spectra o f analytes
由于OA与DTX2是同分异构体,且在质谱上的离子特征信息相似,无法在质谱维度上精确鉴别区分,因此需选择优化合适的液相色谱条件,使这2 种分析物在色谱上实现有效分离。实验选择ACQUITYTMUPLC BEH C18系列色谱柱,考虑到同分异构体的结构相似性,需增强色谱差速迁移的效果,故选择100 mm规格的C18柱作为实验色谱柱。实验以2 mm o l/L乙酸铵溶液为水相,乙腈为有机相,通过调节有机相的体积分数(由高到低),考察不同流动相梯度条件下的色谱分离效果,比较结果如图3所示。随着有机相体积分数的减小,OA和DTX2能得到有效的分离,但保留时间会推迟,延长了分析时间;且高比例的水相增加色谱峰宽,影响色谱峰形,不利于定量分析。最终选择在0~3.0 m in时间段,乙腈体积分数由30%到75%,不仅能有效分离OA、DTX2和DTX1,又能保证色谱峰形尖锐对称。
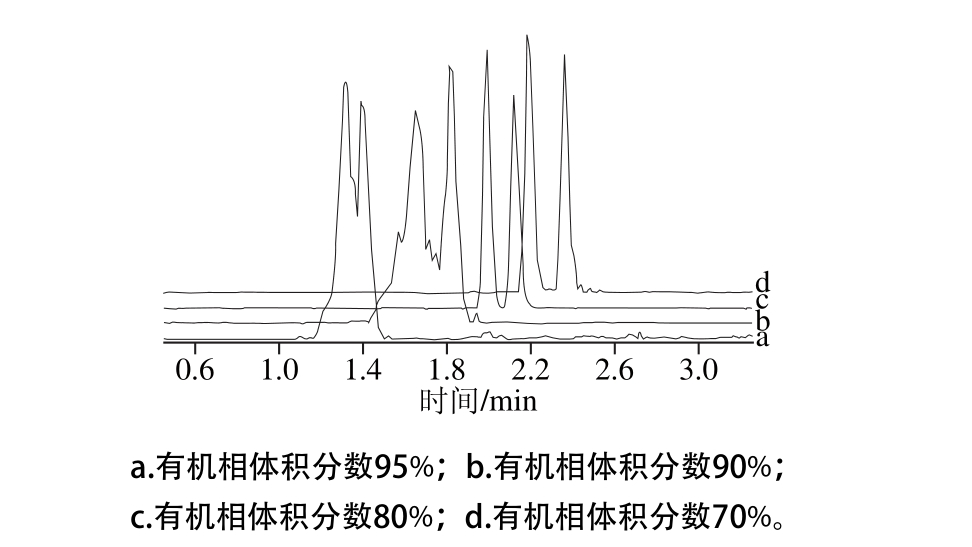
图3 不同洗脱梯度条件下的色谱图
Fig. 3 Chrom atogram s w ith different elution gradients
2.2 提取剂的选择
分别选取甲醇、80%甲醇溶液、乙腈、乙酸乙酯作为提取剂,提取添加量为20 μg/kg的贻贝样品,通过测定比较不同提取剂中分析物提取率,筛选出合适的提取剂,如图4所示。乙酸乙酯的提取效率低;乙腈对OA、DTX1提取效率较高,但对DTX2的提取效率较低;80%甲醇溶液和甲醇的提取率相近,但少量的水能使样品基质分散,提高提取效率,且能减少杂质,因此选择80%甲醇溶液作为提取剂。
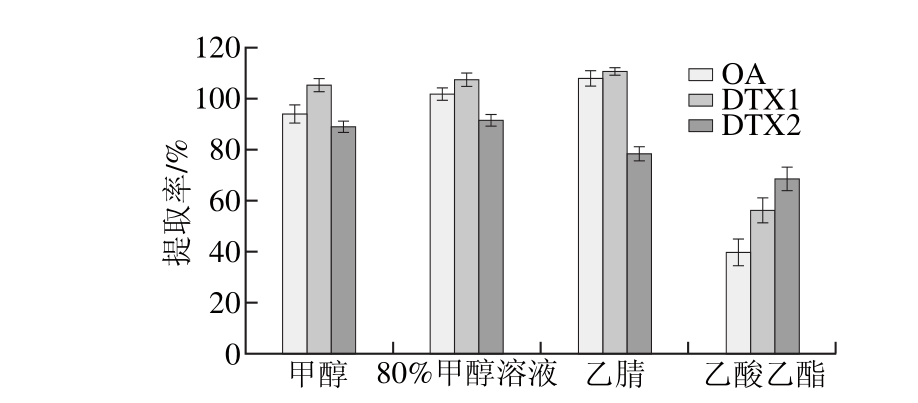
图4 不同提取剂对分析物的提取率
Fig. 4 Effects o f d ifferen t extraction so lven ts on the extraction efficiency o f analytes
2.3 免疫亲和柱优化
贝类除了含有脂肪、蛋白质、色素等杂质外,通常还含有分泌黏液,导致液液萃取过程中经常出现乳化的现象;固相萃取虽能去除杂质,但同时也吸附一部分目标物,造成回收率低的状况。本实验采用具有选择专一性的免疫亲和柱作为净化手段,由于是初次应用于贝类毒素检测领域,需对免疫亲和柱进行优化,以使其吸附净化能力最大化。
2.3.1 上样液的选择

图5 上样液中不同PBS体积分数对回收率的影响
Fig. 5 Effects o f PBS added in p ropo rtions to load ing bu ffer on the recovery o f DSP
免疫亲和作用通常受温度、pH值和溶液体系等因素影响,为保证免疫亲和柱的高效性和专一性,需筛选出合适的条件。实验在测试免疫亲和柱性能阶段,发现免疫亲和柱必须要降低到室温(通常20~25 ℃),才能性能最大化,同时降低差异性,提高平行性。PBS具有盐平衡、适宜pH值缓冲作用,能有效保证生物活性物质的物理结构和化学特性,是良好的溶解保护试剂。因此实验选择PBS稀释样品提取液,不仅能提供适宜的p H值,同时又能有效保证抗体的活性。实验设计不同体积分数的PBS与添加量为10 μg/kg样品提取液混合,通过比较不同体积分数条件下腹泻性贝类毒素的回收率,选择适合免疫亲和作用的最佳溶液体系,如图5所示。当PBS体积分数达到80%时,回收率达到峰值并趋于稳定;且考虑到过多的稀释体积增大了实验误差,因此选择PBS与提取液以4∶1的体积比稀释,作为免疫亲和柱的上样液。
2.3.2 淋洗液的选择
实验根据上样液的溶剂体系,并用纯水替代PBS,选择20%甲醇溶液作为淋洗液,不仅能去除柱床内的盐,且能淋洗一部分脂溶性杂质,降低样品基质带来的干扰,有利于分析物洗脱。由于层析柱淋洗通常需要2 个柱体积,实验最终采用6 m L 20%甲醇溶液淋洗免疫亲和柱。
2.3.3 洗脱液的选择

图6 洗脱液体积和pH值对回收率的影响
Fig. 6 Effects o f eluen t vo lum e and pH on the recovery o f DSP
分析物在柱床内免疫结合后,需要改变抗原抗体的反应平衡,通常优先选择改变洗脱液的酸碱度,达到收集抗体基质上抗原的目的。实验以甲醇为基准洗脱液,通过添加不同体积的乙酸和氨水,调节洗脱液的pH值;同时采用不同洗脱体积进行洗脱收集,并以回收率为指标,筛选出合适的pH值和洗脱体积,如图6所示。2%氨水-甲醇溶液回收率最好,且洗脱体积在2 m L时达到峰值,但出于对实际样品浓度的考虑,最终选择3 m L 2%氨水作为洗脱液。免疫亲和柱净化后,目标峰对称尖锐,且目标峰附近无杂峰,响应强度高,如图7所示。
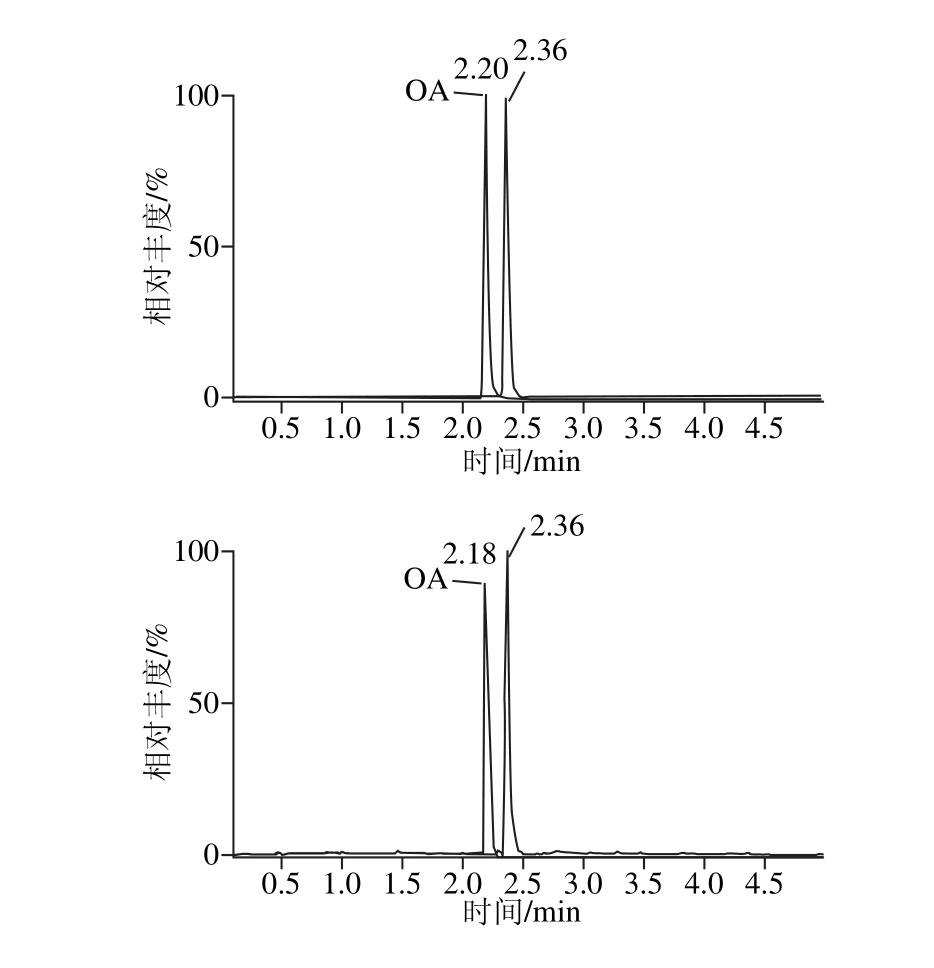
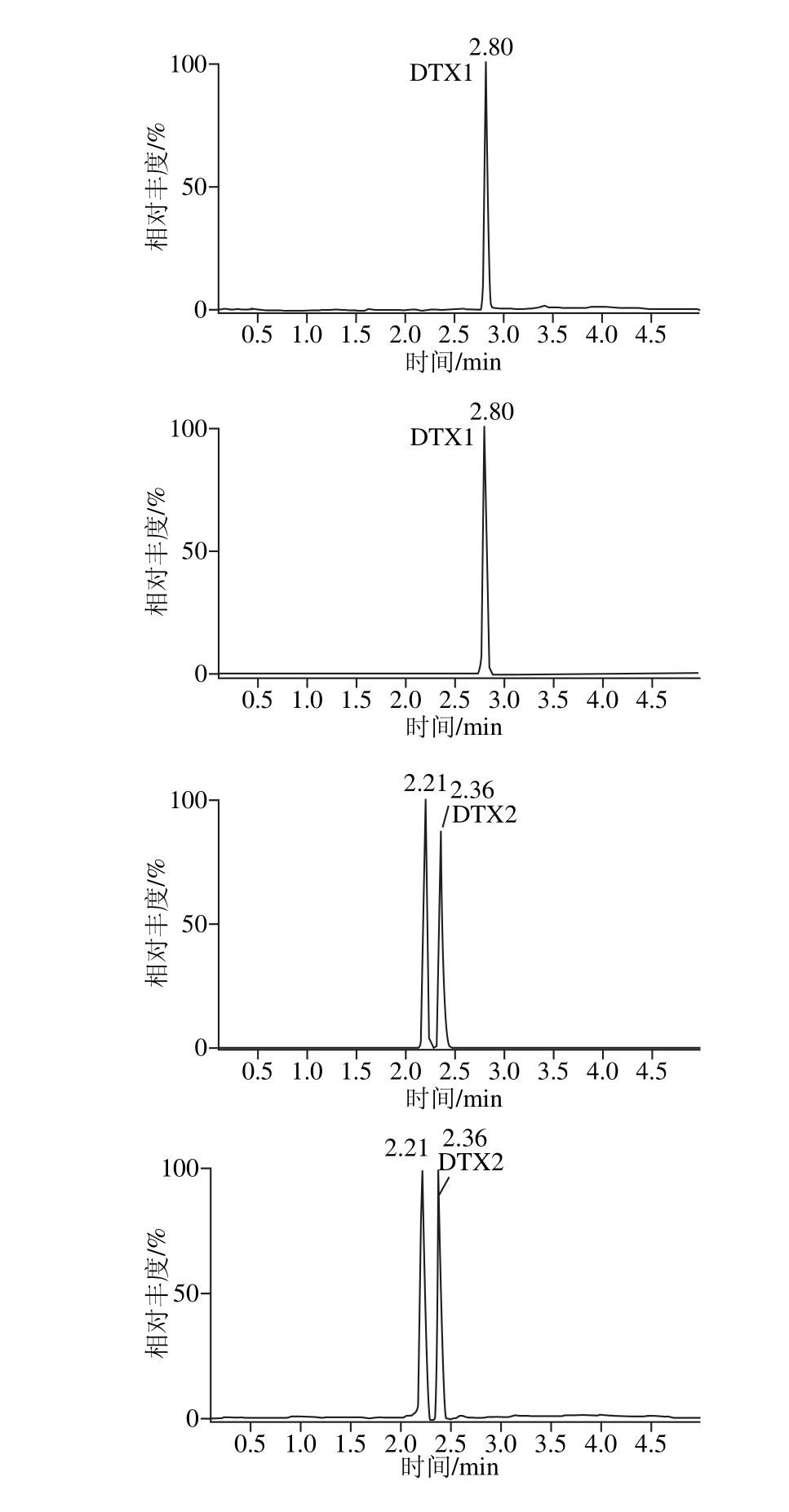
图7 5.0 μg/kg加标贻贝样品经净化后的多反应监测图谱
Fig. 7 MRM chrom atogram s of m ussel spiked at 5.0 μg/kg cleaned up by IAC
2.4 线性关系和定量限结果
在已优化的实验条件下,用初始流动相稀释腹泻性贝类毒素标准溶液配制质量浓度为1.0、5.0、10、20、50 μg/L和100 μg/L标准工作溶液,以峰面积对应的质量浓度绘制标准曲线。结果表明,3 种分析物在1.0~100 μg/L质量浓度范围内线性相关系数均大于0.996,满足仪器分析的需要;方法的理论检出限和定量限分别以3 倍信噪比和10 倍信噪比计算,最终确定3 种分析物的检出限和定量限均为0.3 μg/kg和1.0 μg/kg。
2.5 回收率及精密度结果
以2.00 g阴性的贻贝样品为空白基质,添加量为1.50、5.00、20.0 μg/kg的腹泻性贝类毒素标准溶液,每个添加实验分别测定6 次,计算各分析物对应的回收率和精密度,如表2所示。3 种分析物的平均回收率为82.7%~94.3%;相对标准偏差为0.70%~7.61%。
表2 腹泻性贝类毒素的平均回收率和相对标准偏差(n=6)
Tab le 2 Average recoveries and relative standard deviations fo r DSP (n = 6)

2.6 样品分析
为考察方法的适用性和实用性,采用本方法对养殖和海捕贻贝、毛蚶、泥蚶、花蛤、文蛤、缢蛏、牡蛎、扇贝8 个品种共计60 份贝类样品进行分析检测。其中仅有1 份赤潮期的贻贝样品有检出,其余均为未检出,验证了腹泻性贝类毒素多产生爆发于赤潮期,而常规期间的贝类相对安全。分析结果表明,本方法回收率高,精密度和灵敏度均能满足腹泻性贝类毒素的检测需要。
本研究利用免疫亲和富集解离技术,使具有反应原性的被测物与抗体特异性结合,将分析物富集到固相载体上,通过色谱差速迁移技术和抗原抗体的可逆结合特性去除非目标分析物,实现抗原抗体复合物的可逆解离,从而保证贝类样品的高效基质净化。实验同时结合液相色谱-串联质谱仪的强分离性和高灵敏度,提高了样品回收率,极大降低检出限和定量限,使之达到0.3 μg/kg和1.0 μg/kg,实现贝类中腹泻性贝类毒素的痕量分析。
参考文献:
[1] 柳俊秀, 何培民. 赤潮藻毒素种类与化学结构研究进展[J]. 中国医药生物技术, 2009, 4(2): 144-147. DOI:10.3969/j.issn.1673-713X.2009.02.013.
[2] ALEXANDER J, BENFORD D, COCKBURN A. Marine biotoxins in shellfish pectenotoxin group[J]. EFSA Journal, 2009, 1109: 1-47. DOI:10.2903/j.efsa.2009.1306.
[3] 江涛, 江天久. 贝类体内麻痹性贝类毒素的提取方法研究[J]. 分析化学, 2008, 36(11): 1460-1464. DOI:10.3321/ j.issn:0253-3820.2008.11.002.
[4] SUZUKI T T, QUILLIAM M A. LC-MS/MS analysis o f d iarrhetic shellfish poisoning (DSP) toxins, okadaic acid and dinophysistoxin analogues, and other lipophilic toxins[J]. Anaytical Sciences, 2011, 27(6): 571-584. DOI:10.2116/analsci.27.571.
[5] JUAN B, FABIOLA A, JORGE C, et a l. Effect o f the industrial steam ing on the toxicity, estim ated by LC-MS/MS, o f m ussels exposed for a long tim e to d iarrhetic shellfish poisoning (DSP) toxins[J]. Food Chem istry, 2015, 177: 240-247. DOI:10.1016/ j.foodchem.2015.01.012.
[6] LI Aifeng, MA Jinggang, CAO Jijuan, et al. Toxins in m ussels (Mytilus galloprovincialis) associated w ith d iarrhetic shellfish poisoning ep isodes in China[J]. Toxicon, 2012, 60(3): 420-425. DOI:10.1016/ j.toxicon.2012.04.339.
[7] LI Aifeng, YU Rencheng, LI Jun, et al. Protein phosphatase inhibition assay for detection of diarrhetic shellfish poison in oyster[J]. Chinese Journal o f Analytical Chenistry, 2006, 34(3): 283-287. DOI:10.1016/ S1872-2040(06)60014-5.
[8] MUNDAY R, REEVE J. Risk assessm en t o f shellfish toxins[J]. Toxins, 2013, 5(11): 2019-2037. DOI:10.3390/toxins5112109.
[9] 郭萌萌, 吴海燕, 李兆新, 等. 基于聚硫堇/亚甲基蓝和纳米金放大的免疫传感器检测贝类毒素大田软海绵酸[J]. 分析测试学报, 2014, 33(2): 161-166. DOI:10.3969/j.issn.1004-4957.2014.02.008.
[10] 刘仁沿, 刘磊, 梁玉波, 等. 我国近海有毒微藻及其毒素的分布危害和风险评估[J]. 海洋环境科学, 2016, 35(5): 787-800. DOI:10.13634/ j.cnki.m es.2016.05.025.
[11] 曾玲, 文菁, 龙超, 等. 中国沿海贝类腹泻性贝毒的特征分析[J]. 水产科学, 2015, 34(3): 188-194. DOI:10.16378/j.cnki.1003-1111.2015.03.011. [12] LIN Chao, LIU Zengshan, TAN Caiyun, et al. Con tam ination o f comm ercially availab le seafood by key diarrhetic shellfish poisons along the coast o f China[J]. Environm ental Science and Po llution Research International, 2015, 22(2): 1545-1553. DOI:10.1007/s11356-014-3494-3.
[13] 国家质量监督检验检疫总局. 进出口贝类腹泻性贝类毒素检测方法 小鼠生物法: SN/T 2131.2—2010[S]. 北京: 中国标准出版社, 2010: 4.
[14] TURRELL E A, STOBO L. A com parison o f the m ouse b ioassay w ith liquid chrom atography-m ass spectrom etry for the detection of lipophilic toxins in shellfish from Scottish w aters[J]. Toxicon, 2007, 50(3): 442-447. DOI:10.1016/j.toxicon.2007.04.002.
[15] 国家标准化管理委员会. 贝类中腹泻性贝类毒素的测定: GB/T 5009.212—2008[S]. 北京: 中国标准出版社, 2008: 5.
[16] SASSOLAS A, CATANANTE G, HAYAT A, et a l. Im p rovem en t o f the efficiency and sim p lification o f ELISA tests for rap id and u ltrasenstive detection o f okadaic acid in shellfish[J]. Food Contro l, 2013, 30(1): 144-149. DOI:10.1016/j.foodcont.2012.05.028.
[17] 国家质量监督检验检疫总局. 贝类中腹泻性贝类毒素检验方法酶联免疫吸附法: SN/T 1996—2007[S]. 北京: 中国标准出版社, 2007: 3.
[18] JOHNSON A, HARRISON K, TURNER A D. App lication o f rap id test kits for the determ ination o f diarrhetic shellfish poisoning (DSP) toxins in bivalve m o lluscs from Great Britain[J]. Toxicon, 2016, 111: 121-129. DOI:10.1016/j.toxicon.2016.06.019.
[19] HU Leq in, LIU Junxiu, WANG Qing, et al. Deve lopm en t o f an imm unochrom atographic strip test for the rapid detection of okadaic acid in shellfish sam p le[J]. Journal of App lied Phycology, 2013, 25(4): 1091-1099. DOI:10.1007/s10811-012-9949-3.
[20] DUBOIS M, DEMOULIN L, CHARLIER C, et al. Deve lopm en t o f ELISAs fo r detecting dom oic acid, okadaic acid, and saxitoxin and their app licability for the detection of m arine toxins in sam p les co llected in Belgium[J]. Food Add itives & Con tam inan ts Part A Chem istry Analysis Contro l Exposure & Risk Assessm ent, 2010, 27(6): 859-868. DOI:10.1080/19440041003662881.
[21] LOUPPIS A P, BADEKA A V, KATIKOU P, et al. Determ ination o f okadaic acid, d inophysistoxin-1 and related esters in Greek m ussels using HPLC w ith fluorom etric detection, LC-MS/MS and m ouse bioassay[J]. Toxicon, 2010, 55(4): 724-733. DOI:10.1016/ j.toxicon.2009.10.026.
[22] 张树刚, 邹清, 陈雷, 等. 浙南海域腹泻性贝毒分析[J]. 海洋科学, 2011, 35(1): 44-47.
[23] WANG Zhihong, BROADWATER M H, RAMSDELL J S. Ana lysis o f d iarrhetic shellfish poisoning toxins and pectenotoxin-2 in the bottlenose do lphin (Tursiops truncatus) by liquid ch rom atog raphytandem m ass spectrom etry[J]. Journal o f Chrom atography A, 2015, 1416: 22-30. DOI:10.1016/j.chrom a.2015.08.066.
[24] LI Xin, LI Zhaoyong, CHEN Junhui, et al. Detection, occu rrence and m onth ly variations o f typical lipophilic m arine toxins associated w ith diarrhetic shellfish poisoning in the coastal seawater of Qingdao City, China[J]. Chem osphere, 2014, 111: 560-567. DOI:10.1016/ j.chem osphere.2014.05.006.
[25] 母清林, 方杰, 万汉兴, 等. 液相色谱-串联质谱法检测贝类产品中腹泻性贝类毒素[J]. 分析化学, 2011, 39(1): 111-114.
[26] 饶涛, 张勇, 杜霞, 等. UHPLC-MS/MS分析腹泻性贝毒在文蛤体内的积累与排出[J]. 上海海洋大学学报, 2012, 31(5): 906-910.
[27] MA Fei, YANG Qingq ing, BERTRAND M, et a l. Sim u ltaneous determ ination o f capsaicin and dihyd rocapsaicin for vegetab le oil adulteration by immunoaffinity chromatography cleanup coup led w ith LC-MS/MS[J]. Journal of Chromatography B, 2016, 1021: 137-144. DOI:10.1016/j.jch rom b.2015.12.017.
[28] DUVAN E H O, DIEGO A H, GUSTAVO A P. Determ ination o f aflatoxin M1in ice cream sam p les using imm unoaffinity co lum ns and u ltra-high perform ance liquid chrom atography coup led to tandem m ass spectrom etry[J]. Food Contro l, 2015, 56: 34-40. DOI:10.1016/ j.foodcont.2015.03.011.
[29] 姚佳, 王昕, 张建新, 等. 免疫亲和柱-高效液相色谱法测定牛奶中氯霉素和玉米赤霉醇及其类似物[J]. 食品科学, 2014, 35(18): 124-127. DOI:10.7506/spkx1002-6630-201418025.
[30] 许艳丽, 鲍蕾, 吴振兴, 等. 免疫亲和柱净化-高效液相色谱法测定大米、玉米、辣椒中的橘霉素[J]. 食品科学, 2011, 32(4): 159-162.
Determ ination o f Diarrhetic Shellfish Poisons in Shellfish by Imm unoaffinity Co lum n Cleanup Coup led w ith Liquid Ch rom atog raphy-Mass Spectrom etry
YAN Zhongyong1,2, ZHANG Xiao jun1,2,*, LI Qifu3, CHEN Si1,2, LI Peipei1,2, ZHU Yin1,2, LIU Wen jing4
(1. Marine Fisheries Research Institute o f Zhejiang, Zhoushan 316021, China; 2. Key Laboratory of Sustainab le Utilization of Technology Research for Fishery Resource of Zhejiang, Zhoushan 316021, China; 3. Jiangsu Meizheng Biotechno logy Co. Ltd., Wuxi 214135, China; 4. Schoo l o f Food Science and Pharm aceutics, Zhejiang Ocean University, Zhoushan 316021, China)
Abstract:A new method using immunoaffinity chromatography (IAC) combined w ith liquid chromatography-tandem mass spectrometry (LC-MS/MS) was established for the determination of diarrhetic shellfish poisons (DSP) such as okadaic acid (OA), dinophysistoxin-1 (DTX1), pectenotoxin-1 (PTX1) in shellf i sh. Samples were extracted w ith 80% methanol, diluted w ith phosphate buffer, cleaned up by immunoaffinity chromatography, and detected by LC-MS/MS. The major parameters affecting the performance of IAC, including loading am ount, washing time and elution conditions, were investigated. Detection was carried out by electrospray ionization in the negative ion mode using multip le reaction monitoring (MRM). The linear range of the analytes was 1.0–100 μg/L w ith correlation coefficient m ore than 0.996. The lim it of detection (LOD) and lim it of quantification (LOQ) for the analytes were calculated as 0.3 and 1.0 μg/kg, respectively. The mean recoveries of the analytes were in the range of 82.7%–94.3% w ith a relative standard deviation (RSD) of less than 7.61%. Therefore, the method could be used to identify and quantify diarrhetic shellfish poisons in shellf i sh with less matrix interference and satisfactory sensitivity.
Key words:immunoaffinity chromatography (IAC); liquid chromatography-tandem mass spectrometry (LC-MS/MS); d iarrhetic shellfish poison
DOI:10.7506/spkx1002-6630-201718047
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2017)18-0304-06引文格式:
严忠雍, 张小军, 李奇富, 等. 免疫亲和净化-液相色谱-串联质谱法测定贝类中腹泻性贝类毒素[J]. 食品科学, 2017, 38(18): 304-309.
DOI:10.7506/spkx1002-6630-201718047. http://www.spkx.net.cn
YAN Zhongyong, ZHANG Xiao jun, LI Qifu, et al. Determ ination o f d iarrhetic shellfish poisons in shellfish by imm unoaffinity colum n cleanup coup led w ith liquid chrom atography-m ass spectrom etry[J]. Food Science, 2017, 38(18): 304-309. (in Chinese w ith Eng lish abstract) DOI:10.7506/spkx1002-6630-201718047. h ttp://www.spkx.net.cn
收稿日期:2016-10-21
基金项目:浙江省科研院所科技服务项目(2016F30020);浙江省分析测试科技计划项目(2016C37026)
作者简介:严忠雍(1990—),男,助理工程师,学士,主要从事渔业环境监测和水产品质量安全研究。E-mail:yzy123123123@126.com
*通信作者:张小军(1982—),男,高级工程师,博士,主要从事水产品加工与质量安全研究。E-m ail:xiaojun3627@163.com