闫鸣艳
(青岛科技大学海洋科学与生物工程学院,山东 青岛 266042)
摘 要:研究海藻酸钠、硫酸软骨素、透明质酸和壳聚糖对罗非鱼皮Ⅰ型胶原自聚集动力学和聚集后微观结构的影响。结果表明:在海藻酸钠、硫酸软骨素、透明质酸和壳聚糖存在的情况下,胶原自聚集过程仍然包含两个阶段:成核阶段和生长阶段,但是各物质对两阶段的动力学参数影响不同。海藻酸钠、透明质酸和壳聚糖均能够降低生长阶段的速率常数,然而对成核阶段的影响各有差异。海藻酸钠对成核阶段的速率常数没有显著影响,但是随着含量的增加能够延长成核时间;壳聚糖能够提高成核阶段的速率常数,同时缩短成核时间;透明质酸对成核阶段的速率常数和成核时间却没有显著影响。而硫酸软骨素对成核阶段和生长阶段均没有显著影响。扫描电子显微镜结果表明海藻酸钠、硫酸软骨素、透明质酸易使胶原纤维横向聚集形成纤维束,影响其直径大小的顺序为硫酸软骨素>海藻酸钠>透明质酸,而壳聚糖却未表现类似作用。
关键词:胶原;自聚集;罗非鱼;鱼皮
Abstract:The effects of sodium alginate (SA), chondroitin sulfate (CS), hyaluronic acid (HA) and chitosan (CTS) on the self-assembly of type I collagen from tilapia (Oreochromis niloticus) skin were investigated. It was found that collagen selfassembly showed a two-phase kinetic process (nucleation and growth) in the presence of SA, CS, HA and CTS, but their effects on the kinetic parameters were different. SA did not show any signifi cant effect on the rate constant in the nucleation phase of collagen self-assembly, but prolonged the nucleation time. CTS raised the rate constant and shorten the nucleation time. HA did not display any marked impact on the nucleation phase, nor did CS. In addition, CS had no notable effect on the growth phase. Scanning electron microscopic observations suggested that fi ber bundles were formed by the lateral aggregation of fi brils in the presence of SA, CS and HA, the diameter being in the descending order of CS > SA > HA, while CTS had no similar effect.
Key words:collagen; self-assembly; tilapia; fi sh skin
Ⅰ型胶原是动物体内分布最广的一类结构蛋白[1],广泛存在于皮肤、骨骼、软骨、肌腱等部位。它具有三股左手螺旋的多肽链缠绕形成的右手三股螺旋结构[2],这种特殊的结构赋予胶原良好的生物相容性和可降解性、低免疫原性、无毒性、利于细胞附着和生长等功能[3-4],从而使得Ⅰ型胶原在组织工程和生物材料领域具有广泛的应用。长久以来,胶原主要来源于猪、牛等哺乳动物,近年来由于疯牛病、口蹄疫的频发以及宗教和文化的差异,猪、牛来源胶原的应用受到了限制[5]。在这种情况下,水产胶原的研究和应用逐渐受到了重视。罗非鱼(Oreochromis niloticus)是我国养殖量居于第二位的鱼种,每年大量的罗非鱼被加工成鱼片出口[6]。近年来,其养殖产业发展迅速,出口量也逐年增长,由此产生大量的鱼皮、鱼骨、鱼头等副产物,其中鱼皮约占4.0%[5],而鱼皮干物质70%以上为胶原。目前这些鱼皮胶原可被加工成多肽应用于食品、化妆品等领域,而生物材料领域也是胶原应用的重要领域,若能将鱼皮胶原应用于生物材料领域将进一步提高水产品加工附加值。
自聚集性是Ⅰ型胶原的固有性质。在生理条件下胶原通过自聚集不仅能够引起胶原纤维特征性横纹结构的产生,而且能够引起具有自我限制的侧向生长,从而导致胶原纤维的形成[3,7],利用这一性质可以改善胶原基生物材料的性能以及设计新型材料。目前,对水产胶原自聚集性已经进行了一些研究,如对狭鳕鱼皮[8]、罗非鱼皮[5]、大马哈鱼[9]、草鱼皮[10]和鱼鳞[11]胶原体外自组装动力学以及草鱼和乌鳢鱼皮胶原体外自组装过程中的凝胶化行为[12]均进行了研究。然而,这些研究大多集中于单纯的胶原自聚集性的研究。一般来说,在生物材料领域,Ⅰ型胶原多与其他生物大分子复合应用[13-15],因此研究生物大分子对Ⅰ型胶原自聚集性的影响是非常必要的。海藻酸钠(sodium alginate,SA)、硫酸软骨素(chondroitin sulfate,CS)、透明质酸(hyaluronic acid,HA)和壳聚糖(chitosan,CTS)是常见的天然大分子物质,常用于生物材料的研究与开发。本研究拟探讨这4 种生物大分子对罗非鱼皮Ⅰ型胶原自聚集性的影响并探讨相互之间的差异,为水产胶原基生物材料的研究和开发提供参考和依据。
1.1 材料与试剂
罗非鱼皮由青岛厂家提供,-20 ℃保存,实验时4 ℃解冻。
胃蛋白酶 美国Sigma公司;SA 青岛明月海藻集团有限公司;CTS(300 kD,脱乙酰度>90%) 潍坊科海甲壳素有限公司;HA(1.5×106D)、CS(3.7×104D)山东益宝生物制品有限公司;氢氧化钠、冰乙酸、氯化钠、磷酸氢二钠、磷酸二氢钠、叔丁醇、浓硫酸、咔唑、茚三酮等均为国产分析纯。
1.2 仪器与设备
CT14RD冷冻离心机 天美(中国)科学仪器有限公司;LGJ0-5冷冻干燥机 北京四环科技仪器厂;UV-2102 PC紫外-可见分光光度计 日本尤尼柯仪器有限公司;PHS-3C精密酸度计 上海佑科仪器仪表有限公司;HHS-Ni电热恒温水浴锅 北京长安科学仪器厂;S-4800扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 Ⅰ型胶原的制备
参照Huang Yuru等[16]的Ⅰ型胶原制备方法,得到酶促溶性胶原(pepsin-solubilised collagen,PSC)。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析其为Ⅰ型胶原。
1.3.2 胶原自聚集条件
参照Yan Mingyan等[8,17]的方法。以浓度为0.5 mol/L的醋酸溶液为溶剂配制质量浓度为2 mg/mL的PSC溶液,20 000×g离心后取上清液。将该溶液与等体积的40 mmol/L磷酸盐缓冲液(含有260 mmol/L的NaCl,pH 7.4)在冰浴中混合,使NaCl终浓度为130 mmol/L,磷酸盐缓冲液终浓度为20 mmol/L,PSC终质量浓度为1 mg/mL,混合均匀后确定溶液pH 7.4,即为自聚集PSC溶液,立即将该溶液放在30 ℃水浴中进行自聚集。
以40 mmol/L磷酸盐缓冲液(含有260 mmol/L的NaCl,pH 7.4)为溶剂配制质量浓度为2 mg/mL的SA溶液,10 000×g离心后取上清液。将SA与PSC溶液在冰浴中混合,使m(SA)∶m(PSC)分别为1∶4、1∶2和1∶1,磷酸盐缓冲液、NaCl和PSC的终浓度和终质量浓度分别为20、130 mmol/L和1 mg/mL,混合均匀后确定溶液pH 7.4,立即在30 ℃水浴中进行聚集。
将4 mg/mL的HA(或CS)水溶液与等体积80 mmol/L磷酸缓冲液(含有520 mmol/L NaCl,pH 7.4)在冰浴中混合,调pH 7.4后,取一定体积的混合液与2 mg/mL PSC溶液在冰浴中混合,使m(HA或CS)∶m(PSC)分别为1∶4、1∶2和1∶1。CTS用1%醋酸溶液溶解后与磷酸缓冲液和PSC溶液混合,使m(CTS)∶m(PSC)分别为1∶4、1∶2和1∶1。PSC自聚集条件同上。
1.3.3 胶原自聚集动力学测定
溶液中PSC的自聚集过程可通过紫外-可见分光光度法来表征[18]。每1 h测定一次溶液在400 nm波长处的吸光度以表征溶液中PSC的自聚集。以0 h时的自聚集PSC溶液为空白。
所得胶原自聚集动力学曲线应用Boltzmann函数进行拟合,依据Yan Mingyan等[5,8]的方法,胶原自聚集速率常数k计算如式(1)所示。
式中:At为自聚集PSC溶液在时间t时400 nm波长处的吸光度;Ae为自聚集PSC溶液在平衡阶段400 nm波长处的吸光度;A0为自聚集PSC溶液在时间为0 h时400 nm波长处的吸光度。
1.3.4 自聚集比率测定
胶原自聚集30 h后,20 000×g离心30 min,收集上清液。采用双缩脲法测定上清液中蛋白质含量;上清液中SA、CS和HA含量测定采用硫酸咔唑法[19],CTS含量测定采用茚三酮分光光度法[20]。自聚集比率根据式(2)计算,为上清液中某成分(PSC、SA、CS、HA、CTS)的降低比率。
1.3.5 扫描电子显微镜观察
参照王响英等[21]的方法。胶原自聚集30 h后,取50 μL溶液滴到干净的玻璃片上,室温干燥24 h后放入蒸馏水中浸泡脱盐36 h(每12 h更换1 次蒸馏水)。用2%甲醛溶液固定12 h,依次用30%、50%、70%、80%和90%叔丁醇-乙醇溶液脱水15 min,最后置于纯叔丁醇脱水3 次,每次15 min。末次叔丁醇脱水时置于4 ℃条件下固化,真空干燥后固定在样品台上,真空喷金处理,加速电压为10 kV,以扫描电子显微镜观察样品的微观结构。
1.4 数据统计分析
数据统计采用Origin 7.5软件进行单因素方差分析。P<0.05表示差异显著。
2.1 SA对罗非鱼皮Ⅰ型胶原自聚集性的影响

图1 SA对罗非鱼皮Ⅰ型胶原自聚集动力学曲线(aa)及线性拟合关系(bb)的影响
Fig. 1 Effect of sodium alginate on the kinetic self-assembly curves (a)and linear fi tting relationships (b) of type I collagen from tilapia skin
SA是一种线性阴离子多糖[22],其对罗非鱼皮Ⅰ型胶原自聚集动力学的影响如图1a和表1所示。可以看出在不同的SA含量下,胶原的自聚集动力学曲线均为S型曲线[23-24],能够很好地拟合Boltzmann函数(R2>0.9),说明在SA存在的条件下,罗非鱼皮Ⅰ型胶原仍然表现较好的自聚集能力。采用Yan Mingyan等[5,8]的自聚集动力学理论对罗非鱼皮Ⅰ型胶原自聚集动力学曲线进行分析(图1b和表1),发现在SA存在的情况下,胶原的自聚集过程仍然包含两个阶段:成核阶段和生长阶段;随着SA含量的增加,第一阶段的速率常数并未表现明显变化,但是成核时间延长,而第二阶段的速率常数显著降低,说明SA能够使更多的胶原分子参与成核阶段,但是对胶原纤维的生长表现一定的延缓作用,这与Tsai[13]和Sang Lin[19]等的研究结果类似。自聚集比率的测定结果表明SA能够促使更多的胶原参与自聚集,这可能与胶原成核时间的延长有关,然而随着SA含量的增加,胶原自聚集比率并未表现明显地增加。图2表示SA对胶原自聚集后微观结构的影响,可以看出在SA存在的条件下,胶原仍然能够自聚集形成纤维,且随着SA含量的增加,胶原纤维易横向聚集形成纤维束[25],Tsai[13]和Sang Lin[19]等也发现类似结果,这可能与SA中羟基和羧基等活性基团的存在有关。
表1 SA对罗非鱼皮Ⅰ型胶原自聚集速率常数和比率的影响
Table 1 Effect of sodium alginate on the rate constant and reconstruction rate of type I collagen from tilapia skin

注:同列小写字母不同表示差异显著(P<0.05)。下同。

图2 SA对罗非鱼皮Ⅰ型胶原自聚集后微观结构的影响
Fig. 2 Effect of sodium alginate on the microstructure of type I collagen from tilapia skin after self-assembly
2.2 CS对罗非鱼皮Ⅰ型胶原自聚集性的影响
CS在中性条件下也是一种阴离子型多糖,图3a表明在CS存在的条件下,PSC表现较好的自聚集能力,但是其对罗非鱼皮Ⅰ型胶原自聚集动力学的影响与SA明显不同。CS对胶原自聚集动力学影响的分析结果如图3b和表2所示,发现CS对胶原自聚集过程的成核阶段和生长阶段的速率常数以及成核时间并未表现显著影响,并且PSC的自聚集比率也未发生明显变化。然而CS对胶原自聚集后微观结构影响显著。图4表明CS对胶原自聚集后微观结构的影响与SA类似,均易横向聚集形成纤维束,这与在牛皮胶原上观察到的结果是一致的[26],并且CS参与形成的胶原纤维束直径更大,说明CS在纤维形成过程中发挥重要作用。由图3a还发现随着CS含量的增加,胶原自聚集溶液的终吸光度是逐渐增大的,前人研究结果表明这种吸光度的增大主要与纤维数量的增加或直径的增大有关[27],由于表2表明胶原的自聚集比率并未发生显著变化,因此认为本实验中溶液终吸光度的增大主要是由纤维束直径的增大引起的。
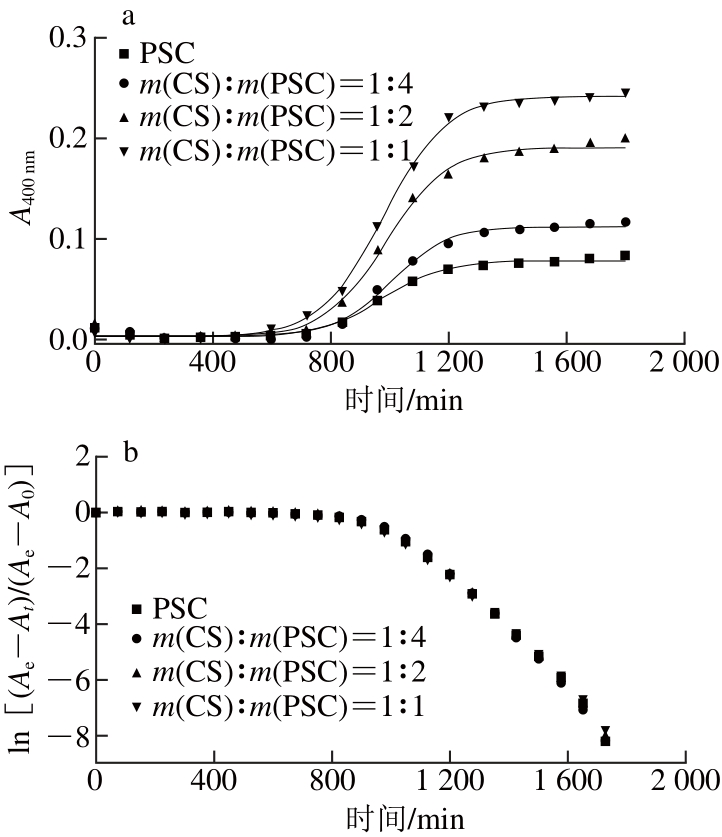
图3 CS对罗非鱼皮Ⅰ型胶原自聚集动力学曲线(aa)及线性拟合关系(bb)的影响
Fig. 3 Effect of chondroitin sulfate on the kinetic self-assembly curves (a)and linear fi tting relationships (b) of type I collagen from tilapia skin
表2 CS对罗非鱼皮Ⅰ型胶原自聚集速率常数和比率的影响
Table 2 Effect of chondroitin sulfate on the rate constant and reconstruction rate of type I collagen from tilapia skin



图4 CS对罗非鱼皮Ⅰ型胶原自聚集后微观结构的影响
Fig. 4 Effect of chondroitin sulfate on the microstructure of type I collagen from tilapia skin after self-assembly
2.3 HA对罗非鱼皮Ⅰ型胶原自聚集性的影响
HA与SA和CS类似,也是一种阴离子型多糖,并与胶原类似存在于细胞外基质[28],其对罗非鱼皮Ⅰ型胶原自聚集动力学的影响如图5和表3所示。Boltzmann函数拟合结果表明在HA存在的条件下,胶原也表现S型的自聚集动力学曲线,对其进一步分析发现随着HA含量的增加,胶原的自聚集过程均包含成核阶段和生长阶段;HA含量对成核阶段的速率常数和成核时间没有显著影响,但是其对生长阶段的速率常数具有一定的影响,在m(HA)∶m(PSC)≤1∶2时,生长阶段的速率常数没有显著差异(P>0.05),然而当m(HA)∶m(PSC)=1∶1时,生长阶段的速率常数显著降低(P<0.05)。因此可以认为HA对罗非鱼皮Ⅰ型胶原的晶核形成没有显著影响,但是对胶原纤维的生长具有延缓作用。自聚集比率测定结果表明PSC的自聚集比率总体随着HA含量的增加而升高;同时发现HA的自聚集比率均高于90%,这可能是HA的C=O、N—H和C—OH易与胶原酰胺Ⅰ和Ⅱ带形成氢键导致的[29],然而随着HA含量的增加未表现显著差异(P>0.05)。图6表明HA对胶原自聚集后微观结构的影响与SA和CS类似,胶原纤维均易横向聚集形成纤维束,但是HA参与形成的纤维束直径小于其他二者。

图5 HA对罗非鱼皮Ⅰ型胶原自聚集动力学曲线(aa)及线性拟合关系(bb)的影响
Fig. 5 Effect of hyaluronic acid on the kinetic self-assembly curves (a)and linear fi tting relationships (b) of type I collagen from tilapia skin
表3 HA对罗非鱼皮Ⅰ型胶原自聚集速率常数和比率的影响
Table 3 Effect of hyaluronic acid on the rate constant and reconstruction rate of type I collagen from tilapia skin


图6 HA对罗非鱼皮Ⅰ型胶原自聚集后微观结构的影响
Fig. 6 Effect of hyaluronic acid on the microstructure of type I collagen from tilapia skin after self-assembly
2.4 CTS对罗非鱼皮Ⅰ型胶原自聚集性的影响
CTS是一种线性阳离子型多糖[30],与SA、CS和HA是不同的,其对罗非鱼皮Ⅰ型胶原自聚集动力学的影响如图7和表4所示,可以看出CTS对胶原自聚集动力学具有显著影响,并且与上述三者不同。图7a为CTS对胶原自聚集动力学曲线的影响,结果表明在CTS存在的条件下,胶原仍然表现较好的自聚集能力。对其进一步分析结果如图7b和表4所示,随着CTS含量的增加,胶原成核阶段的速率常数显著升高(P<0.05),并且成核时间逐渐缩短,这可能与CTS分子中含有活泼的氨基有关,然而生长阶段的速率常数总体显著降低(P<0.05),因此可以认为CTS能够加快胶原晶核的形成,但是对胶原纤维的生长表现延缓作用。自聚集比率测定结果表明随着CTS含量的增加,PSC自聚集比率是先升高后降低的,而CTS的自聚集比率是逐渐升高的。CTS对胶原自聚集后微观结构的影响如图8所示,可以看出在CTS存在的情况下,胶原仍可形成丝状纤维结构,但与单独PSC形成的纤维直径没有显著差异,这与SA、CS和HA是不同的。
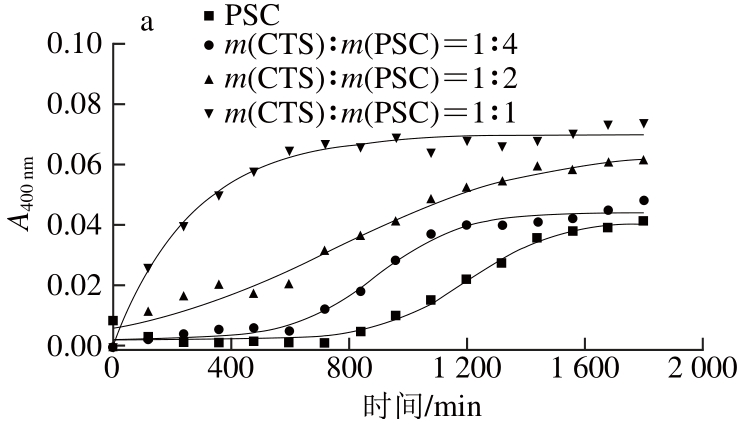
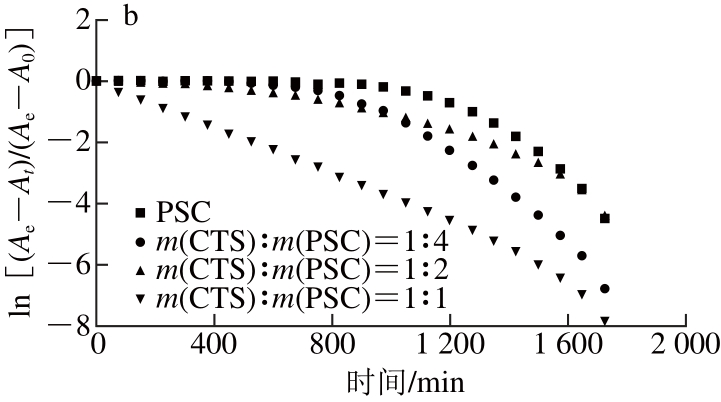
图7 CTS对罗非鱼皮Ⅰ型胶原自聚集动力学曲线(a)及线性拟合关系(bb)的影响
Fig. 7 Effect of chitosan on the kinetic self-assembly curves (a) and linear fi tting relationships (b) of type I collagen from tilapia skin
表4 CTS对罗非鱼皮Ⅰ型胶原自聚集速率常数和比率的影响
Table 4 Effect of chitosan on the rate constant and reconstruction rate of type I collagen from tilapia skin

注:—.未表现第一阶段。

图8 CTS对罗非鱼皮Ⅰ型胶原自聚集后微观结构的影响
Fig. 8 Effect of chitosan on the microstructure of type I collagen from tilapia skin after self-assembly
综上所述,SA、CS、HA和CTS对罗非鱼皮Ⅰ型胶原自聚集动力学和自聚集后微观结构均有显著的影响,但是影响结果是各不相同的。SA能够促使更多的胶原分子参与自聚集的成核阶段,但是对胶原纤维的生长具有延缓作用,随着SA含量的增加,胶原纤维易横向聚集形成纤维束;CS对胶原自聚集动力学没有显著影响,但是对胶原自聚集后微观结构影响显著,随着其含量的增加,纤维也易聚集形成纤维束,并且在相同含量的条件下,CS参与形成的纤维束直径要大于SA;HA对胶原自聚集的成核阶段没有显著影响,但是对纤维的生长表现延缓作用,随着其含量的增加,胶原纤维也易形成纤维束,但是纤维束直径要小于SA和CS参与形成的;CTS能够加快胶原晶核的形成,但对胶原纤维的生长却具有延缓作用,随着其含量的增加,其参与形成的胶原纤维直径并未表现显著增大,这与SA、CS和HA是不同的。上述研究成果可为海洋胶原生物材料和食品包装材料的研究和开发提供参考。下一步工作将着重探讨SA、CS、HA和CTS对罗非鱼皮Ⅰ型胶原自聚集后性能的影响,并探讨其影响机制。
参考文献:
[1] PAL G K, SURESH P V. Comparative assessment of physicochemical characteristics and fi bril formation capacity of thermostable carp scales collagen[J]. Materials Science and Engineering: C, 2017,70: 32-40. DOI:10.1016/j.msec.2016.08.047.
[2] LI Y P, ASADI A, MONROE M R, et al. pH effects on collagen fibrillogenesisin vitro: electrostatic interactions and phosphate binding[J]. Materials Science and Engineering: C, 2009, 29: 1643-1649.DOI:10.1016/j.msec.2009.01.001.
[3] 宿广昊. 取向胶原基材料的制备及影响因素的考察[D]. 北京: 北京协和医学院, 2012: 5.
[4] 闫婷婷, 郑学晶, 刘捷, 等. 胶原大分子自组装研究进展[J]. 高分子通报, 2016(8): 18-28. DOI:10.14028/j.cnki.1003-3726.2016.08.003.
[5] 闫鸣艳, 秦松. 聚集条件对罗非鱼皮Ⅰ型胶原自聚集动力学的影响[J]. 食品工业科技, 2016, 37(2): 93-97; 102. DOI:10.13386/j.issn1002-0306.2016.02.010.
[6] ZENG S K, ZHANG C H, LIN H, et al. Isolation and characterization of acid-solubilised collagen from the skin of Nile tilapia (Oreochromis niloticus)[J]. Food Chemistry, 2009, 116: 879-883. DOI:10.1016/j.foodchem.2009.03.038.
[7] LI J H, LIU W T, LI G Y. The effect of glycerol and 2-propanol on the molecular aggregation of collagen in solution[J]. International Journal of Biological Macromolecules, 2015, 72: 1097-1103. DOI:10.1016/j.ijbiomac.2014.10.032.
[8] YAN Mingyan, LI Bafang, ZHAO Xue, et al. Effect of concentration,pH and ionic strength on the kinetic self-assembly of acidsoluble collagen from walleye pollock (Theragra chalcogramma)skin[J]. Food Hydrocolloids, 2012, 29: 199-204. DOI:10.1016/j.foodhyd.2012.02.014.
[9] YUNOKI S, NAGAI N, SUZUKI T, et al. Novel biochemical from reinforced salmon collagen gel prepared by fi bril formation and crosslinking[J]. Journal of Bioscience and Bioengineering, 2004, 98: 40-47.DOI:10.1016/S1389-1723(04)70240-6.
[10] 赵燕, 鲁亮, 杨玲, 等. 草鱼皮胶原的体外自组装动力学研究[J]. 食品科学, 2014, 35(11): 21-26. DOI:10.7506/spkx1002-6630-201411005.
[11] 梁艳萍, 王艳, 汪海波, 等. 草鱼鱼鳞胶原蛋白体外自组装行为的研究[J]. 食品科学, 2011, 32(23): 15-20.
[12] 赵燕, 鲁亮, 杨玲, 等. 草鱼和乌鳢鱼皮胶原体外自组装过程中的凝胶化行为比较研究[J]. 食品科学, 2014, 35(19): 34-38. DOI:10.7506/spkx1002-6630-201419007.
[13] TSAI S W, LIU R L, HSU F Y, et al. A study of the influence of polysaccharides on collagen self-assembly: nanostructure and kinetics[J]. Biopolymers, 2006, 83: 381-388. DOI:10.1002/bip.20568.
[14] YANG Y L, SUN C, WILHELM M E, et al. Infl uence of chondroitin sulfate and hyaluronic acid on structure, mechanical properties, and glioma invasion of collagen Ⅰ gels[J]. Biomaterials, 2011, 32: 7932-7940.DOI:10.1016/j.biomaterials.2011.07.018.
[15] CHANDIKA P, KO S C, OH G, et al. Fish collagen/alginate/chitooligosaccharides integrated scaffold for skin tissue regeneration application[J]. International Journal of Biological Macromolecules,2015, 81: 504-513. DOI:10.1016/j.ijbiomac.2015.08.038.
[16] HUANG Yuru, SHIAU C Y, CHEN Huihuang, et al. Isolation and characterization of acid and pepsin-solubilized collagens from the skin of balloon fish (Diodon holocanthus)[J]. Food Hydrocolloids, 2011,25: 1507-1513. DOI:10.1016/j.foodhyd.2011.02.011.
[17] YAN Mingyan, QIN Song, LI Jie. Study on the self-assembly property of type Ⅰ collagen prepared from tilapia (Oreochromis niloticus)skin by different extraction methods[J]. International Journal of Food Science and Technology, 2015, 50: 2088-2096. DOI:10.1111/ijfs.12870.
[18] LI Y, DOUGLAS E P. Effects of various salts on structural polymorphism of reconstituted type Ⅰ collagen fibrils[J]. Colloids and Surfaces B: Biointerfaces, 2013, 112: 42-50. DOI:10.1016/j.colsurfb.2013.07.037.
[19] SANG Lin, WANG Xiaoli, CHEN Zhenhua, et al. Assembly of collagen fi brillar network in the presence of alginate[J]. Carbohydrate Polymers, 2010, 82: 1264-1270. DOI:10.1016/j.carbpol.2010.07.005.
[20] 张雪娇, 齐暑华, 刘春叶, 等. 茚三酮显色法测定壳聚糖含量[J]. 化学研究与应用, 2015, 27(3): 407-411. DOI:10.3969/j.issn.1004-1656.2015.03.032.
[21] 王响英, 吴淑燕, 李苏安, 等. 叔丁醇脱水干燥法在游离细胞扫描电镜样品制备中的应用[J]. 苏州大学学报(医学版), 2005, 25(5): 834-835.DOI:10.3969/j.issn.1673-0399.2005.05.028.
[22] PUSTLAUK W, PAUL B, GELINSKY M, et al. Jellyfish collagen and alginate: combined marine materials for superior chondrogenesis of hMSC[J]. Materials Science and Engineering C, 2016, 64: 190-198.DOI:10.1016/j.msec.2016.03.081.
[23] 赵颖, 陆金婷, 邓超, 等. 纤维化胶原蛋白海绵的制备及其自组装工艺[J]. 中国组织工程研究, 2015, 19(30): 4820-4826. DOI:10.3969/j.issn.2095-4344.2015.30.013.
[24] HOYER B, BERNHARDT A, LODE A, et al. Jellyfish collagen scaffolds for cartilage tissue engineering[J]. Acta Biomaterialia, 2014,10: 883-892. DOI:10.1016/j.actbio.2013.10.022.
[25] REESE S P, UNDERWOOD C J, WEISS J A. Effects of decorin proteoglycan on fi brillogenesis, ultrastructure, and mechanics of typeⅠ collagen gels[J]. Matrix Biology, 2013, 32: 414-423. DOI:10.1016/j.matbio.2013.04.004.
[26] TIAN H, LI C, LIU W, et al. The infl uence of chondroitin 4-sulfate on the reconstitution of collagen fibrilsin vitro[J]. Colloids and Surfaces B: Biointerfaces, 2013, 105: 259-266. DOI:10.1016/j.colsurfb.2013.01.005.
[27] ZHU J L, KAUFMAN L J. Collagen Ⅰ self-assembly: revealing the developing structures that generate turbidity[J]. Biophysical Journal,2014, 106(8): 1822-1831. DOI:10.1016/j.bpj.2014.03.011.
[28] CHUNG E J, JAKUS A E, SHAH R N.In situforming collagenhyaluronic acid membrane structures: mechanism of self-assembly and applications in regenerative medicine[J]. Acta Biomaterialia, 2013, 9:5153-5161. DOI:10.1016/j.actbio.2012.09.021.
[29] 陈旭, 李国英. 胶原/透明质酸共混体系的相容性及相互作用研究[J]. 功能材料, 2013, 44(8): 1136-1140. DOI:10.3969/j.issn.1001-973.2013.08.018.
[30] 李晓静, 王新木, 董研, 等. 基于壳聚糖的纳米材料在骨组织工程与再生医学中的研究进展[J]. 中国生物医学工程学报, 2013, 32(5):620-625. DOI:10.3969/j.issn.0258-8021.2013.05.016.
Effects of Several Biological Macromolecules on the Self-Assembly of Type I Collagen from Tilapia (Oreochromis niloticus) Skin
YAN Mingyan
(College of Marine Science and Biological Engineering, Qingdao University of Science and Technology, Qingdao 266042, China)
DOI:10.7506/spkx1002-6630-201719005
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2017)19-0024-06
引文格式:
闫鸣艳. 几种生物大分子对罗非鱼皮Ⅰ型胶原自聚集性的影响[J]. 食品科学, 2017, 38(19): 24-29. DOI:10.7506/spkx1002-6630-201719005. http://www.spkx.net.cn
YAN Mingyan. Effects of several biological macromolecules on the self-assembly of type I collagen from tilapia(Oreochromis niloticus) skin[J]. Food Science, 2017, 38(19): 24-29. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719005. http://www.spkx.net.cn
收稿日期:2016-09-05
基金项目:国家自然科学基金青年科学基金项目(31201455);国家自然科学基金面上项目(41576155);
青岛科技大学引进人才科研启动基金项目(010022778)
作者简介:闫鸣艳(1980—),女,讲师,博士,研究方向为海洋生物资源高值化利用。E-mail:yanmingyan@qust.edu.cn