赵雅娟1,尹丽卿1,苏 琳1,刘树军2,李 云2,王小斌2,靳 烨1,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.乌拉特中旗农区畜牧业专项推进办公室,内蒙古 乌拉特中旗 015300)
摘 要:以12月龄不同饲养条件下(放牧和圈养)苏尼特羊背最长肌作为实验材料,用ATP酶染色法和实时定量聚合酶链式反应技术研究不同饲养方式下肌纤维类型组成。结果表明:放牧苏尼特羊背最长肌Ⅰ型和ⅡB型肌纤维直径和横截面积均显著小于圈养(P<0.05);同时,放牧苏尼特羊背最长肌Ⅰ型和ⅡA型肌纤维数量比例和面积比例、MyHCⅠ和MyHCⅡa基因的mRNA表达量均显著大于圈养(P<0.05),ⅡB型肌纤维数量比例和MyHCⅡb型基因mRNA表达量则呈现相反趋势。
关键词:苏尼特羊;饲养方式;肌纤维类型;MyHC基因
Abstract:The aim of this study was to investigate the infl uence of different feeding systems (stall feeding and grazing) on muscle fi ber types oflongissimus dorisfrom Sunit sheep by ATPase histochemical staining and real-time polymerase chain reaction. The results showed that the diameters and cross-sectional areas of type Ⅰ and ⅡB muscle fi bers inlongissimus dorisfrom grazing sheep were signifi cantly lower than those from stall-fed sheep (P< 0.05). The number and area percentages of type Ⅰ and type ⅡA, andMyHCⅠandMyHCⅡagene expression in grazing sheep were signifi cantly higher than those in stall-fed sheep (P< 0.05), but the expression of type ⅡB andMyHCⅡbgenes present the opposite trend.
Key words:Sunit sheep; feeding systems; muscle fi ber types;MyHCgene
苏尼特羊作为内蒙古肉羊品种中具有代表性的优良种群[1],以其肉质细嫩、味道鲜美、低脂肪、低膻味、高蛋白、易消化等优点而受到广大消费者的青睐[2]。然而由于受草原面积和生态环境的限制,苏尼特羊的饲养模式由放牧饲养逐步变为舍饲圈养,而圈养造成羊肉品质劣化引起了很多研究者的关注和重视,通过改变饲养方式来提高肉品质成为研究热点。肌纤维是组成肌肉组织的基本单位,其类型差异是影响肉品质的重要因素[3]。尽管肌纤维的类型主要是由先天遗传决定的,但是肌纤维类型组成并不是固定的,肌纤维类型之间可以相互转化[4]。肌纤维类型受多种因素的影响,品种、年龄、性别、营养以及饲养方式等都会影响肌纤维类型[5]。其中饲养方式是连接肌纤维类型改变与肉品质的重要桥梁,有很多研究者已经对其进行研究。有研究表明,散养猪肌肉组织中ⅡA型肌纤维含量比舍饲喂养猪的肌纤维含量高,而ⅡB型和ⅡX型含量少[6]。Gentry等[7]研究了环境因素对猪肌肉性状的影响,结果显示,散养猪背最长肌中Ⅰ型肌纤维的含量显著高于舍饲喂养猪。可见不同饲养方式会对肌纤维类型分布和组成有很大影响,而肌纤维类型又会影响肉的品质,因此研究饲养方式对肌纤维类型分布的影响十分必要。
本实验以12月龄不同饲养方式下(放牧和圈养)苏尼特羊背最长肌作为实验材料。用ATP酶染色法及肌球蛋白重链(MyHC)基因mRNA表达量对肌纤维进行分型,分析在不同饲养方式下肌纤维类型的组成差异,旨在通过改变饲养方式来改变肌纤维类型的分布从而改善羊肉品质,同时对提高苏尼特羊这一内蒙古特色肉羊品种的保护和利用具有实际意义。
1.1 材料与试剂
选择内蒙古巴彦淖尔海流图镇放牧和圈养条件下的12月龄苏尼特羊共20 只(断奶后10 只放牧饲喂,10 只舍饲喂养,集中育肥),每种饲养条件下公、母各半。在放牧条件下,牧草种类主要以乌拉特中旗荒漠化草原典型牧草为主(芨芨草、蒙古葱、中间锦鸡儿、沙生冰草、碱韭等十余种);圈养条件下苏尼特羊以吃农区饲草料为主(玉米秸秆、葵盘粉、葵花籽皮等,同时补充玉米精料及育肥饲料)。屠宰后1 h内取背最长肌为实验材料。
巴比妥钠、氯化钴 国药集团化学试剂有限公司;硫化铵 上海振兴化工二厂有限公司;无水氯化钙、醋酸钠、冰醋酸 天津永大化学试剂厂;异戊烷 庄信万丰公司;三磷酸腺苷二钠盐 美国Sigma公司;SYBR Premix ExTaqTMⅡ试剂盒、RNAiso Plus、PrimeScriptTMRT Reagent Kit with gDNA Eraser RNAiso Plus、PrimeScript TMRT Reagent Kit with gDNA Eraser 大连宝生物工程有限公司;异丙醇 上海振兴化工二厂有限公司;三氯甲烷 北京化工厂。
1.2 仪器与设备
MEV冰冻切片机 德国Slee公司;DM 4000B显微镜德国Leica公司;5417R低温台式冷冻离心机 德国Eppendorf生物公司;CFX96TM实时定量聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像分析系统 美国Bio-Rad公司;BG-power 3500型稳压稳流电泳仪、水平电泳槽 北京百晶生物技术有限公司;PCR扩增仪 德国Biometra公司。
1.3 方法
1.3.1 肌纤维组织学特性测定
1.3.1.1 样品的采集和制片
在羊屠宰后1 h内,将背最长肌沿着肌纤维的方向切成近似0.5 cm×0.5 cm×1 cm大小的肉块,放入预冷的异戊烷中进行干燥(约30 s),再经液氮速冻。装入冻存管中,置于-80 ℃的冰箱中保存。将处理好的样品置于恒温冰冻切片机(-25 ℃)内,切成厚度约为10~12 μm的片,然后将切好的片放在冰箱(-80 ℃)中保存,用于后续实验[8]。
1.3.1.2 染色
用pH值为4.6的酸性前孵育液mATPase组织化学染色法进行染色[9-10]。
1.3.1.3 肌纤维各项指标的测定
将染好的片子用Qwin V3显微图像分析软件分析肌纤维的各项指标。每只羊分别取2 个样品制片,用显微镜对每个片子随机选取3~4 个清晰视野进行拍照,使肌纤维总数不少于1 500 根[11]。测量每根肌纤维横截面上最长两点和最短两点距离,计算二者的平均值作为肌纤维直径,测多根求平均值即为肌纤维直径;圈出视野内各型肌纤维的横截面积,测多根求其平均值即为肌纤维横截面积;对每种类型肌纤维的数量计数,用每种类型肌纤维数量除以肌纤维总量即为肌纤维数量比例;通过测量视野内各型肌纤维的横截面积,求得每种类型肌纤维面积总和,用每种肌纤维总面积除以总肌纤维面积即为肌纤维面积比例,见公式(1)[12]。
1.3.2MyHC基因表达量测定
1.3.2.1 样品的采集
在羊屠宰后1 h内取背最长肌约100 mg装入无酶无菌冻存管中,迅速投入液氮中冷冻,置于-80 ℃的冰箱中保存,用于总RNA的提取。
1.3.2.2 RNA的提取
参考文献[13],依据RNAiso Plus的实验指导使用说明书对肌肉中总RNA进行提取。
1.3.2.3 RNA浓度和质量的测定
将提取的总RNA用1%的琼脂糖凝胶电泳检测其完整性,凝胶成像仪拍照。用微量分光光度计测定提取的总RNA的浓度和纯度(A260nm/A280nm)。
1.3.2.4 反转录
参考文献[14],按照PrimeScritTMRT reagent Kit with gDNA Eraser(Perfect Real Time)指导说明书进行反转录,进而合成cDNA。
1.3.2.5 引物序列及合成
MyHCⅠ、MyHCⅡa、MyHCⅡb、MyHCⅡx以及管家基因18S rRNA引物引用参考文献[15]所列。引物由上海生工生物工程有限公司合成。引物信息如表1所示。
表1 实时定量PCR扩增所用引物
Table 1 Primers of real-time PCR

1.3.2.6 实时定量PCR扩增
按照SYBR®Premix ExTaqTMⅡ(TLi RNaseH Plus)说明书进行,以前面获得的cDNA为模板,配制PCR反应液CFX96TMReal-Time PCR Detection System 二步法进行操作。
1.3.2.7 实时定量PCR产物检测
用1%的琼脂糖凝胶电泳检测实时定量PCR产物,凝胶成像仪拍照。
1.4 数据统计分析
实时定量PCR数据分析方法:本实验采用2-ΔΔCt法,计算公式[16]如下。
式中:Ct1为处理组的目的基因循环值;Ct2为处理组的内参基因循环值;Ct3为未处理组的目的基因循环值;Ct4为未处理组的内参基因循环值。
用DPSv 6.55和SPSS 20.0软件对实验数据进行统计分析,所有数值用 ±s表示。
2.1 苏尼特羊肌纤维ATP染色结果
2.1.1 不同饲养方式下背最长肌肌纤维ATP染色结果
采用ATPase组织染色法对放牧和圈养苏尼特羊的背最长肌进行染色,在10×10 倍的显微镜下观察,标尺为200 μm,结果如图1所示。经ATP酶染色后肌纤维主要分为3 种类型,颜色最深(黑色)的均是Ⅰ型肌纤维,颜色最浅(白色)均是ⅡB型肌纤维,介于二者颜色之间(棕褐色)均是ⅡA型肌纤维。

图1 放牧(a)和圈养(b)条件下苏尼特羊背最长肌ATP染色结果
Fig. 1 ATPase staining oflongissimus dorisin grazing (a) and stall-fed (b) Sunit sheep
2.1.2 不同饲养方式对背最长肌肌纤维直径和横截面积的影响
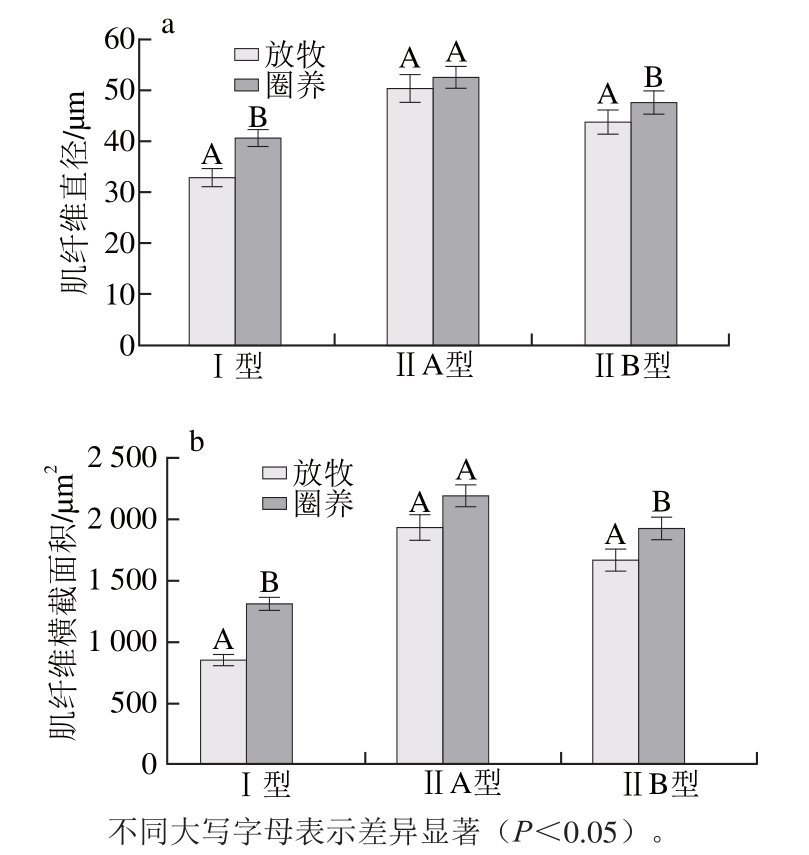
图2 不同饲养方式下苏尼特羊背最长肌肌纤维的直径(aa)和横截面积(bb)
Fig. 2 Muscle fi ber diameters (a) and cross-sectional areas (b) oflongissimus dorismuscle from Sunit sheep reared in different feeding systems
由图2可知,放牧苏尼特羊背最长肌Ⅰ型和ⅡB型肌纤维直径和横截面积均显著小于圈养(P<0.05),ⅡA型肌纤维也呈现出放牧小于圈养条件,但差异不显著(P>0.05)。在两种饲养方式下,背最长肌肌纤维直径和横截面积总体都呈现为Ⅰ型<ⅡB型<ⅡA型的规律。杨烨等[17]的研究结果显示,户外散养鸡的胸肌和腿肌肌纤维直径显著大于笼养鸡,与本实验研究结果不一致,可能是因为肌纤维直径和横截面积受肌肉部位的影响所导致的。
2.1.3 不同饲养方式对背最长肌肌纤维数量比例的影响
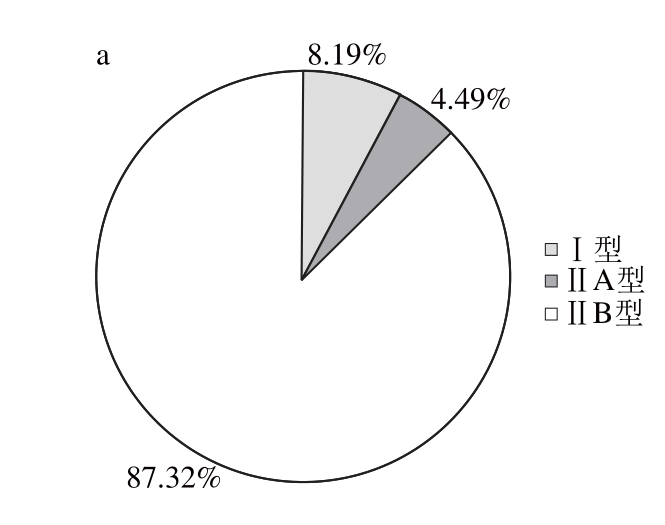

图3 放牧(a)和圈养(b)饲养方式下苏尼特羊背最长肌肌纤维的数量比例
Fig. 3 Muscle fi ber number proportions oflongissimus dorismuscle from Sunit sheep reared in different feeding systems
由图3可知,苏尼特羊背最长肌Ⅰ型和ⅡA型肌纤维数量比例均为放牧条件大于圈养条件,其中Ⅰ型肌纤维的数量比例存在显著差异(P<0.05)。而ⅡB型肌纤维的数量比例则呈现出放牧条件小于圈养条件,但差异不显著(P>0.05)。放牧条件下苏尼特羊背最长肌中氧化型肌纤维(Ⅰ型和ⅡA型)的数量比例为12.68%,圈养苏尼特羊背最长肌中氧化型肌纤维的数量比例为10.09%,这说明肌纤维的数量比例受到饲养方式的影响。放牧条件下使得苏尼特羊背最长肌氧化型肌纤维数量比例增加,酵解型肌纤维的数量比例减少。Klitgward等[18]也采用ATP酶染色法比较了健美选手和普通青年人的肌纤维组成,研究得出运动量较多的健美选手的肱二头肌中含有较多的ⅡA型肌纤维,而含有较少的ⅡA/ⅡB共存型肌纤维。
2.1.4 不同饲养方式对背最长肌肌纤维面积比例的影响
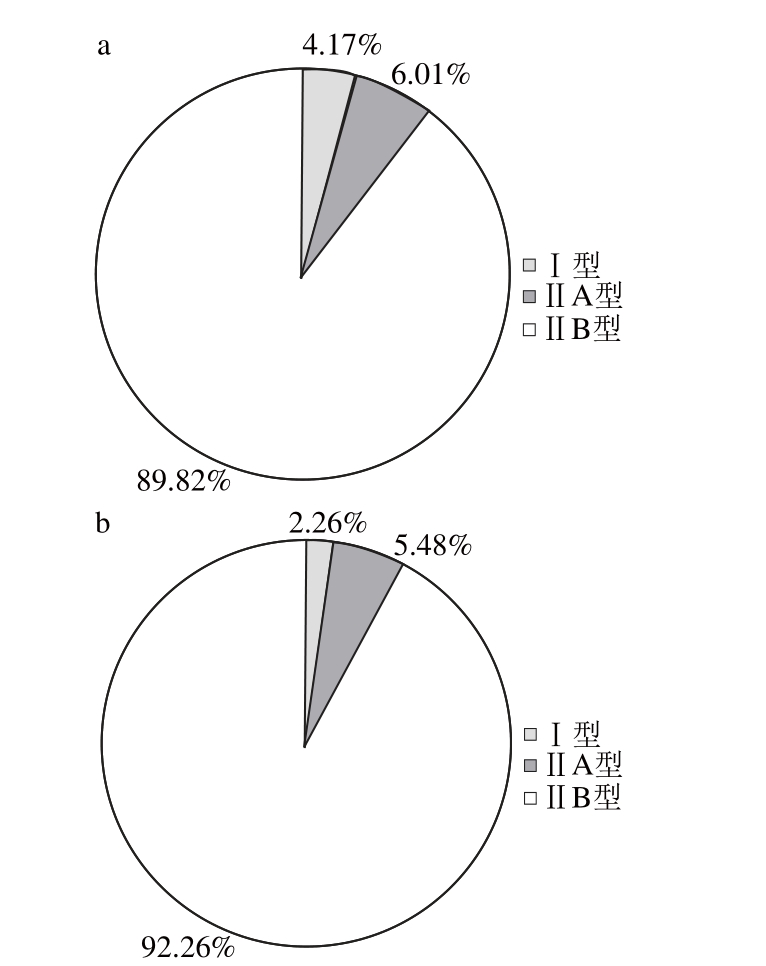
图4 放牧(a)和圈养(b)饲养方式下苏尼特羊背最长肌肌纤维的面积比例
Fig. 4 Muscle fi ber area proportions oflongissimus dorismuscle from Sunit sheep in different feeding conditions
由图4可知,放牧条件下苏尼特羊背最长肌Ⅰ型和ⅡA肌纤维的面积比例大于圈养条件下,其中Ⅰ型肌纤维的面积比例差异显著(P<0.05)。两种饲养条件下都以ⅡB型肌纤维为主,放牧条件下ⅡB型肌纤维的面积比例为89.82%,圈养条件下ⅡB型肌纤维的面积比例为92.26%,这说明放牧条件下苏尼特羊背最长肌酵解型肌纤维的面积比例较圈养条件下减少。
对比不同饲养方式下苏尼特羊背最长肌的肌纤维特性后发现,放牧苏尼特羊与圈养苏尼特羊相比,具有较高的氧化型肌纤维的数量比例和面积比例,较少的酵解型肌纤维的数量比例和面积比例。产生此结果可能是由于放牧条件下羊的运动量大,提高了肌肉的氧化能力,从而导致肌纤维类型发生了转变,使得酵解型肌纤维向氧化型肌纤维转变[19-20]。这说明不同饲养方式会对肌纤维类型的转化产生一定影响。
2.2 不同饲养方式下苏尼特羊背最长肌MyHC基因表达规律
不同饲养方式下苏尼特羊背最长肌MyHCⅠ、MyHCⅡa、MyHCⅡb和MyHCⅡx基因的表达量结果如图5所示。
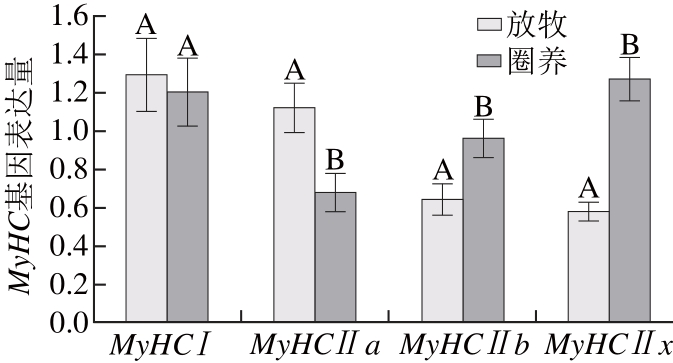
图5 苏尼特羊MMyyHHCC基因的表达量(n=1100)
Fig. 5 Relative expression levels ofMyHCgenes in Sunit sheep (n= 10)
由图5可知,放牧条件下MyHCⅠ基因和MyHCⅡa基因的mRNA表达量均大于圈养条件下,且MyHCⅡa基因表达量在两种饲养方式下差异显著(P<0.05)。MyHCⅡb基因和MyHCⅡx基因mRNA表达量均为圈养条件下显著大于放牧条件(P<0.05)。因此,苏尼特羊MyHC基因表达量受饲养方式的影响较大。文献[21-22]研究表明,通过给小鼠耐力运动训练后发现,小鼠比目鱼肌中MyHCⅡb基因表达量明显降低,而MyHCⅠ基因表达量升高,这说明运动可以诱导不同肌肉中MyHC异形体之间发生转化[23],导致肌纤维类型由酵解型转化为氧化型,即本实验也得出放牧苏尼特羊背最长肌中MyHCⅡb和MyHCⅡx向MyHCⅠ和MyHCⅡa发生了转化。
2.3 肌纤维比例与MyHC基因表达量的相关性
通过表2肌纤维数量比例与MyHC基因表达量的相关性分析可知,MyHCⅠ、MyHCⅡa基因表达量分别与Ⅰ型和ⅡA型肌纤维的数量比例呈正相关关系,MyHCⅡx和MyHCⅡb表达量均与ⅡB型肌纤维的数量比例呈正相关关系,其中MyHCⅡb基因表达量与ⅡB型肌纤维数量比例呈显著正相关(P<0.05)。说明MyHC基因表达量与ATP酶组织化学染色法对肌纤维的分型结果基本一致。
表2 肌纤维比例与MyHC基因表达量的相关性
Table 2 Correlation coeffi cients between relative expression levels ofMMyyHHCCgenes and proportion of cross sectional area of muscle fi bers
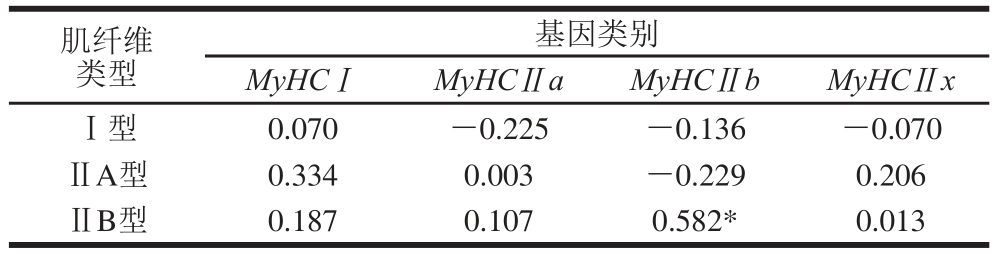
注:*.在0.05水平显著相关。
本实验通过ATP酶染色法和MyHCmRNA表达量对肌纤维分型,得到放牧条件使得苏尼特羊背最长肌肌纤维类型由酵解型纤维(MyHCⅡb和MyHCⅡx)向氧化型纤维(MyHCⅠ和MyHCⅡa)转化。肌纤维类型组成是决定肌肉品质的重要因素。研究发现,ⅡB型肌纤维数量比例与最终pH值呈负相关关系[19],即ⅡB型肌纤维的数量比例越高,糖酵解能力越强,宰后24 h后pH值也就越低,肉质就越差[24]。苏琳[25]、Renand[26]等研究表明ⅡB型肌纤维比例越高剪切力越大,肉的嫩度越差。肌纤维类型组成不同直接影响肉的颜色,氧化型肌纤维比例越高,肌红蛋白含量越高,肌肉颜色越红,肉色评分也越高[27]。Offer[28]研究发现酵解型肌纤维含量高会导致肉的保水性下降。酵解型肌纤维比例升高会加快宰后pH值降低的程度和速度,并最终导致肌肉滴水损失增加和颜色下降[29]。以上研究都证明酵解型纤维比例高不利于肉质,而本实验得出放牧条件可以降低酵解型纤维的比例,由此可知饲养方式会影响肌纤维类型变化,从而影响肉质,目前为适应生态与畜牧业发展双赢的目标,羊养殖方式由传统放牧散养到集中圈养是大势所趋[30],如何在圈养条件下控制羊的运动量、改变饲料营养水平,从而改善舍饲羊的肉用品质是接下来的研究核心。
参考文献:
[1] 郭月英, 程海星, 王乐, 等. 苏尼特羊钙蛋白酶抑制蛋白基因表达规律及其与肉质的相关性研究[J]. 食品工业科技, 2015, 36(7):122-126; 131. DOI:10.13386/j.issn1002-0306.2015.07.017.
[2] 莎丽娜. 自然放牧苏尼特羊肉品质特性的研究[D]. 呼和浩特: 内蒙古农业大学, 2009: 1-2.
[3] CHOI Y M, KIO B C. Muscle fiber characteristics,myofibrillar protein isoforms,and m eat quality[J]. Livestock Science, 2009, 122(2/3): 105-118.
[4] VADASZOVA A, ZACHAROVA G, MACHACOVA K, et al.Infl uence of thyroid status on the differentiation of slow and fast muscle phenotypes[J]. Physiological Research, 2004, 53(Suppl 1): 57-61.
[5] RYU Y C, CHOI Y M, LEE S H, et al. Comparing the histochemical characteristics and meat quality traits of different pig breeds[J]. Meat Science, 2008, 80(2): 363-369. DOI:10.1016/j.meatsci.2007.12.020.
[6] PETERSEN J S, HENCKEL P, OKSBJERG N, et al. Adaptations in muscle fibre characteristics induced by physical activity in pigs[J]. Animal Science, 1998, 66(3): 733- 740. DOI:10.1017/S1357729800009310.
[7] GENTRY J G, MCGLONE J J, MILLER M F, et al. Environmental effects on pig performance, meat quality, and muscle characteristics[J]. Jou rnal of Animal Science, 2004, 82(1): 209-217.DOI:10.2527/2004.821209x.
[8] HWANG Y H, KIM G D, JEONG J Y, et al. The relationship between muscle fi ber characteristics and meat quality traits of highly marbled Hanwoo (Korean native cattle) steers[J]. Meat Science, 2010, 86(2):456-461. DOI:10.1016/j.meatsci.2010.05.034.
[9] 王晓冬, 汤乐民. 生物光镜标本技术[M]. 北京: 科学出版社, 2007:129-131.
[10] 华晓青, 刘树军, 史晓燕, 等. 巴美肉羊和小尾寒羊肌纤维特性的研究[J]. 食品工业, 2012, 33(10): 105-108.
[11] DREILING C E, BROWN D E, CASALE L, et al. Muscle glycogen:comparison of iodinebinding and enzyme digestion assays and application to meat samples[J]. Meat Science, 1987, 20(3): 167-177.DOI:10.1016/0309-1740(87)90009-X.
[12] 苏琳, 辛雪, 刘树军, 等. 苏尼特羊肉肌纤维特性与肉质相关性研究[J]. 食品科学, 2014, 35(7): 7-11. DOI:10.7506/spkx1002-6630-201407002.
[13] 辛雪, 苏琳, 赵雅娟. 巴美肉羊肌球蛋白重链基因表达规律研究[J]. 食品科技, 2014, 39(10): 134-138. DOI:10.13684/j.cnki.spkj.2014.10.028.
[14] BROCKS L, KLONT R E, BUIST W, et al. The effects of selection of pigs on growth rate vs leanness on histochemical characteristics of different muscles[J]. Journal of Animal Science, 2000, 78(5): 1247-1254.
[15] 张静. 巴美肉羊和苏尼特羊Fox01、MyHC基因表达规律及对肉质的影响[D]. 呼和浩特: 内蒙古农业大学, 2015: 13.
[16] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt[J]. Methods, 2001,25(4): 402-408. DOI:10.1006/meth.2001.1262.
[17] 杨烨, 方桂友, 李忠荣, 等. 不同饲养方式对肉鸡肌纤维组织学特性及肌肉嫩度影响的研究[J]. 安徽农业科学, 2009, 37(27): 13101-13102.DOI:10.13989/j.cnki.0517-6611.2009.27.137.
[18] KLITGWARD H, ZHOU M, RICHTER E A. Myosin heavy chain composition of single fibres from m.biceps brachii of male body builders[J]. Acta Physiologica Scandinavica, 1990, 140(2): 175-180.DOI:10.1111/j.1748-1716.1990.tb08989.x.
[19] 熊萍, 朱文, 李范玲, 等.不同强度运动对大鼠骨骼肌纤维MHC亚型转化的影响[C]//2013年度学术年会论文摘要汇编. 长沙: 湖南省生理科学会, 2013: 12.
[20] PETERSEN J S, HENCKEL P, OKSBJERG N, et al. Adaptations in muscle fibre characteristics induced by physical activity in pigs[J].Animal Science, 1998, 66(3): 733-740.
[21] GENG Tuoyu, LI Ping, YIN X, et al. PGC-1α plays a funcitional role in exercise-induced mitochondrial biogenesis and angiogenesis but not fi ber-type transformation in mouse skeletal muscle[J]. American Journal of Physlology, 2010, 298(3): 572-579. DOI:10.1152/ajpcell.00481.2009.
[22] CAIOZZO V J, HADDAD F, BAKER M J, et al. Influence of mechanical loading on myosin heavy chain protein and mRNA isoform expression[J]. Journal of Applied Physiology, 1996, 80(5): 1503-1512.
[23] TIDYMAN W E, MOORE L A, BANDMAN E. Expression of fast myosin heavy chain transcripts in developing and dystrophic chicken skeletal muscle[J]. Developmental Dynamics, 1997, 208(4): 491-504.
[24] IMMONEN K, RUUSUNEN M, HISSA K, et al. Bovine muscle glycogen concentration in relation to finishing diet, slaughter and ultimate pH[J]. Meat Science, 2000, 55(1): 25-31. DOI:10.1016/S0309-1740(99)00121-7.
[25] 苏琳. 巴美肉羊肌纤维特性、糖酵解潜力对羊肉品质的影响和MyHC表达量分析[D]. 呼和浩特: 内蒙古农业大学, 2015: 63-68.
[26] RENAND G, PICA RD B, TOURAILLE C, et al. Relationships between muscle characteristics and meat quality traits of youngCharolais bulls[J]. Meat Science, 2001, 59(1): 49-60. DOI:10.1016/S0309-1740(01)00051-1.
[27] 尹靖东. 动物肌肉生物学与肉品科学[M]. 北京: 中国农业大学出版社, 2011: 22-23.
[28] OFFER G. Modelling of the formation of pale soft and exudative meat: effect of chilling regime and rat and extent of glycolysis[J]. Meat Science, 1991, 30(2): 157-184. DOI:10.1016/0309-1740(91)90005-B.
[29] MAKIN C A, WARKUP C C, MATHEWS K R, et al. Pig muscle fi bre characteristics as a source of variation in eating quality[J]. Meat Science,1997, 47(3/4): 237-248. DOI:10.1016/S0309-1740(97)00055-7.
[30] 孙国伟. 山羊的放牧和圈养[J]. 当代畜禽养殖业, 2014(4): 11.
Effect of Different Feeding Systems on Muscle Fiber Types of Longissimus dorsi from Sunit Sheep
ZHAO Yajuan1, YIN Liqing1, SU Lin1, LIU Shujun2, LI Yun2, WANG Xiaobin2, JIN Ye1,*
(1. College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China;2. Wulate Middle Banner Animal Husbandry Special-Purpose Facilitation Offi ce, Wulate Middle Banner 015300, China)
DOI:10.7506/spkx1002-6630-201719006
中图分类号:TS251.5
文献标志码:A
文章编号:1002-6630(2017)19-0030-05
引文格式:
赵雅娟, 尹丽卿, 苏琳, 等. 不同饲养方式对苏尼特羊背最长肌肌纤维类型组成的影响[J]. 食品科学, 2017, 38(19):30-34. DOI:10.7506/spkx1002-6630-201719006. http://www.spkx.net.cn
ZHAO Yajuan, YIN Liqing, SU Lin, et al. Effect of different feeding systems on muscle fi ber types oflongissimus dorsifrom Sunit sheep[J]. Food Science, 2017, 38(19): 30-34. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201719006. http://www.spkx.net.cn
收稿日期:2016-07-01
基金项目:国家自然科学基金面上项目(31360393)
作者简介:赵雅娟(1992—),女,硕士研究生,研究方向为食品质量与安全。E-mail:15049121395@163.com
*通信作者:靳烨(1964—),男,教授,博士,研究方向为畜产品安全生产。E-mail:jinyeyc@sohu.com